Методические указания по санитарно-микробиологическому контролю производства рыбы горячего и холодного копчения
Купить бумажный документ с голограммой и синими печатями. подробнее
Цена на этот документ пока неизвестна. Нажмите кнопку "Купить" и сделайте заказ, и мы пришлем вам цену.
Распространяем нормативную документацию с 1999 года. Пробиваем чеки, платим налоги, принимаем к оплате все законные формы платежей без дополнительных процентов. Наши клиенты защищены Законом. ООО "ЦНТИ Нормоконтроль"
Наши цены ниже, чем в других местах, потому что мы работаем напрямую с поставщиками документов.
Способы доставки
- Срочная курьерская доставка (1-3 дня)
- Курьерская доставка (7 дней)
- Самовывоз из московского офиса
- Почта РФ
В Методических указаниях приведены периодичность контроля и показатели бактериальной обсемененности по этапам технологического процесса производства рыбы горячего и холодного копчения, дана оценка результатов контроля и рекомендации по устранению причин повышенной бактериальной обсемененности, а также рецепты применяемых питательных сред, методы отбора проб и микробиологических исследований.
Методические указания предназначены для работников производственных лабораторий и СЭС, осуществляющих микробиологический контроль производства рыбы горячего и холодного копчения, в том числе балычных изделий
Оглавление
1. Введение
2. Профилактический микробиологический контроль готовой продукции горячего и холодного копчения
2.1. Отбор проб готовой рыбопродукции и подготовка их к анализу
2.2. Микробиологические исследования
2.2.1. Определение общей бактериальной обсемененности
2.2.2. Определение бактерий группы кишечной палочки
2.3. Оценка результатов контроля и рекомендации
3. Профилактический санитарно-микробиологический контроль производства
3.1. Контроль санитарного состояния инвентаря и тары
3.2. Взятие и анализ смывов с рук и санодежды
3.3. Микробиологический контроль воды и воздуха
3.4. Оценка результатов контроля и рекомендации
4. Дополнительный микробиологический контроль
4.1. Отбор проб и проведение исследований
4.2. Оценка результатов контроля и рекомендации
5. Питательные среды и реактивы
5.1. Растворы для приготовления разведений (физиологический раствор и пептонная вода)
5.2. Среда для определения общей бактериальной обсемененности
5.3. Среды для выявления бактерий группы кишечной палочки
5.4. Среды для выявления грибов
5.5. Растворы для окраски препаратов по Граму
Приложение 1. Микробиологический контроль продуктов (форма журнала)
Приложение 2. Микробиологический контроль санитарного состояния производства (форма журнала)
Рекомендуемая литература
| Дата введения | 01.01.2021 |
|---|---|
| Добавлен в базу | 01.02.2020 |
| Актуализация | 01.01.2021 |
Этот документ находится в:
- Раздел Экология
Организации:
| 19.02.1982 | Утвержден | Зам. Министра рыбного хозяйства СССР |
|---|---|---|
| 03.03.1982 | Утвержден | Зам. Главного Государственного санитарного врача СССР |
| Разработан | Гипрорыбфлот | |
| Разработан | ЦПКТБ Запрыба | |
| Принят | Минрыбхоз СССР | |
| Принят | Центральная санитарная инспекция |
Чтобы бесплатно скачать этот документ в формате PDF, поддержите наш сайт и нажмите кнопку:

стр. 1

стр. 2

стр. 3

стр. 4

стр. 5

стр. 6

стр. 7

стр. 8

стр. 9
стр. 10
стр. 11

стр. 12

стр. 13

стр. 14

стр. 15

стр. 16

стр. 17

стр. 18
стр. 19
стр. 20

стр. 21

стр. 22

стр. 23
МИНИСТЕРСТВО РЫНЮГО ХОЗЯЙСТВА СССР Гооударотвеюшй проектно-конструкторский ннотжтут рыбопромыслового флота (ШПРОРЫБФЛОТ)
МЕТОДИЧЕСКИЕ УКАЗАНИЯ ПО САНИТАРНО-ШКРОШОЛОШЧЕСКОМУ КОНТРОЛ) ПРОИЗВОДСТВА РЫБЫ ГОРЯЧЕГО И ХОЛОДНОГО КОПЧЕНИЯ
Ленинград
1982
МИНИСТЕРСТВО РЫШОГО ХОЗЯЙСТВА СССР Государственный проектно-конструкторский институт рыбопромыслового флота (1ИПРОРЫБФЛОТ)
УТВЕРЖДЕНЫ
Заместителем министра рыбного хозяйства СССР А.Н.1Ульченно 19 февраля 1982 г.
УТВЕРЖДЕНЫ
Заместителем Главного государственного санитарного врача СССР В.Е.Ковшило 3 марта 1982 г.
МЕТОДИЧЕСКИЕ УКАЗАНИЯ ПО САНИТАРН0-ГЛ1КР0НЮЛ0ПГ1ЕСК0МУ КОНТРОЛЮ ПРОИЗВОДСТВА РЫБЫ ГОРЯЧЕГО И ХОЛОДНОГО КОПЧЕНИЯ
Ленинград
1982
|
Продолжение табл.2 | ||||||||||||||||||||
| ||||||||||||||||||||
|
^Оборотная тара. | ||||||||||||||||||||
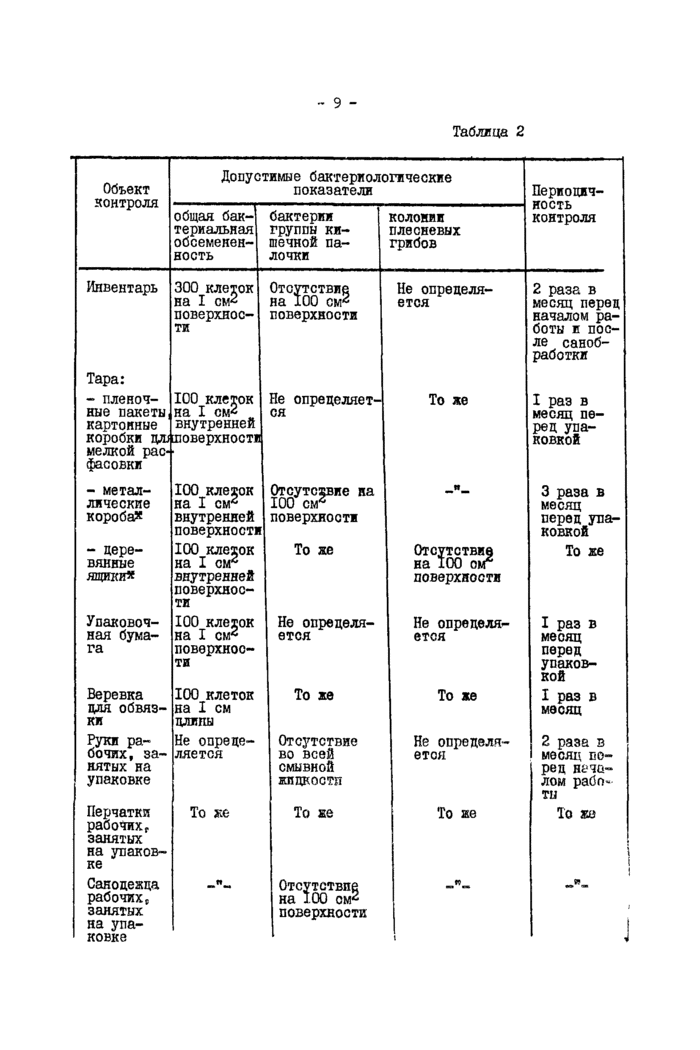
3.1. Контроль санитарного состояния инвентаря и тары
Санитарному контролю подвергаются весы, столы, тара, упаковочная бумага, т.е. предметы, с которыми соприкасается продукт после его приготовления в процессе затаривания, а также веревка для обвязки (см. табл.2). Контроль качества мойки и дезинфекции весов, столов и многократно используемой тары осуществляется перед началом работы путем исследования смывов на общую бактериальную об-семенекнооть и наличке бактерий группы кишечной палочки. Смывы берут следующим образом:
площадь исследуемого предмета около '100 см^ протирают смочен-иым в отержльном физиологическом растворе или водопроводной вод* ватным тампоном или марлевой салфеткой.
После взятия смыва стержень с тампоном вставляют в пробирку
с 5 см° физиологического раствора или водопроводной воды, встряхивают ж дают отстояться 2-3 мин. Из полученного материала отбирают 1 см'* для определения общей бактериальной обсемененности. Количество микроорганизмов вычисляют по формуле:
X - число микроорганизмов на I слг поверхности;
а - число колоний, выросших на питательной среде в чашке Петри;
в - разведение;
d - площадь смывной поверхности, 100 см2.
В пробирки со смывной жидкостью и тампонами наливают по 5-7 см2 одной из сред Кесслер или КОДА для определения бактерий группы кишечной палочки и термостатируют при 43°С. Дальнейший ход анализа описан в подразделе 2.2.2.
В смывах с бумаги, потребительской тары разового пользования и веревки определяют только общую бактериальную обсемененяость.
Для определения чистоты бумаги исследуемый рулон разворачивают и берут смыв с внутренней поверхности. С веревки для обвязки смывы берут следуэдим образом. Отрезок веревки, равный 25 см, стерильным пинцетом опускают в колбу с 50 см** отерильной водопроводной воды и затем встряхивают в течение 2-3 мин. Жидкость для посева используют без разведения. Для подсчета количества микроорганизмов на 1 см веревки число колоний, выросших на питательном агаре в чашке Петри, умножают на 2.
Для определения плесневых грибов на деревянной таре смывы берут увлажненным тампоном с 300 см2 поверхности. Стержень с тампоном затем вставляют в пробирку с 3 см2 физиологического раствора или водопроводной воды, встряхивают и дают отстояться 2-3 мин. Из полученного материала отбирают по i см'* в 2 параллельны? чашки Петри. Посевы в чашках заливают расплавленным и остуженным до 45°С сусловым агаром или агаризованной средой Сабуро. Посевы термостатируют при 30°С в течение 5 сут. Развитие грибов сопровождается появлением пушистого паутинообразного или ватообразного роста на поверхности среды. Плесневые грибы на чашках должны отсутствовать.
3.2. Взятие и анализ смывов с рук и санодежцы
Чистоту рук и санодежцы работников, находящихся на упаковке, определяют посредством исследования смывов, взятых перец началом работы, на присутствие бактерий группы кишечной палочки. Наличие послед в смывах не попускается,.
При взятии смывов с руя влажные тампоноь или марлевой салфетк-
обтирают сначала всю ладонь вдоль, а затем обратной стороной тампона поперек, захватывая межпальцевые и подногтевые пространства. С перчаток берут смывы только со стороны ладоней.
Смывы с санодежцы берут тампоном с 4-х площадок по 25 см3: обследуют нижнюю часть каждого рукава и две площадки с верхней передней части санодежцы.
Затем для обнаружения бактерий группы кишечной палочки в пробирку с тампоном наливают по 5-7 см3 одну из питательных сред (Кесслер,КОДА) или тампоны вносят в пробирки с питательной средой и термостатируют при 43°С 24 ч.
3.3. Микробиологический контроль воды и воздуха
Не реже 1 раза в месяц (при пользовании городским водопроводом) и одного раза в декаду (при наличии собственного источника водоснабжения) в воде определяют общее количество бактерий и бактерий группы кишечной палочки по ГОСТ 18963-73. "Вода питьевая. Методы санитарно-бактериологического анализа". Вода должна соответствовать ГОСТ 2874-73 (в I см3 воды не должно содержаться более 100 бактерий). Титр бактерий группы кишечной палочки должен быть не менее 300.
В воздухе помещений, где производится охлаждение и упаковка готового продукта, определяют общее количество бактерий и количество спор плесневых грибов, так как загрязненный воздух может способствовать увеличению микробиальной обсемененности продукта.
Воздух на предприятиях обследуется седиментационным или аспирационным методами.
При седиментационном методе анализа воздуха чашки Петри с питательным агаром (для определения общего количества бактерий) и о суоловым агаром или со средой Сабуро (для определения количества колоний плесневых грибов) оставляют открытыми в течение 20 мин в 3-х местах обследуемого помещения, затем закрывают и инкубируют 48 ч при температуре 30°С или 24 ч при комнатной температуре (20-22°С) и 24 ч при температуре 37°С. Воздух считается чистым, если на чашках с питательным агаром вырастает до 200 колоний, на сусловом агаре - 20 колоний плесневых гриб^ч..
При обследовании воздуха аспирационным методом используется прибор Кротова (инструкция do эксплуатации прилагается к прибору).
Воздух считается чистым, если при просасывалии 100 л воздуха на чашках о питательным агаром вырастает не более 150 колоний и на сусловом агаре - 15 колоний проросших спор плесневых грибов.
3.4. Сценка результатов контроля н рекомендации
Если результаты санитарно-микробиологического контроля не соот-
ветствуют показателям, приведенным в табл.2, принимаются меры для устранения причин повышенной бактериальной обсемененности. При повышенной обсемененности смывов с весов, тары и шомполов для накалывания рыбы необходимо ировести повторную тщательную санитарную обработку горячей водой и дезинфицирующими средствами. При повышенной обсемененности воздуха нужно проверить работу вентиляции. При повторном обнаружении повышенной обсемененности следует обработать помещение ультрафиолетовыми лампами (Б7В-15, ЕУВ-30 и ЕУВ-60) после окончания или за 2 ч до начала работы. Облучение помещений может снизить микробное загрязнение воздуха на 80-90$.
4. ДОПОЛНИТЕЯЫШЙ ШКРОШШОШЕСКИЙ KOHTPOJEb
Для выяснения источников и причин стойкой повышенной обсеменен-ности готового продукта повторно контролируется готовая продукция, а также проводится микробиологический контроль сырья и полуфабрикатов (табл.З).
4.1. Отбор проб и проведение исследований
Мелкую рыбу и мелкие нерыбные объекты морского промыола в количестве от 3 до 10 шт. отбирают из разных мест обследуемой партии во взвешенную стерильную колбу или банку. Посуду с образцами взвешивают и по разности весов устанавливают массу отобранной пробы. Затем в посуду наливают стерильной водопроводной или пептонной воды столько, чтобы весь продукт был полностью покрыт жидкостью. Расход смывной жидкости учитывают. При небольшой навеске жидкость удобно наливать в количестве, превышающем вес рыбы в 9 раз, чтобы получить сразу разведение 1СГ*. Колбу тщательно встряхивают в течение 5 глин, дают отстояться 3 мин и приступают к анализам.
Крупную рыбу или крупные куски разделанной рыбы отбирают для анализа в количество не менее 3 шт. Из разных мест каждого образца стерильным скальпелем вырезают по 2-3 кусочка площадью около 4 сьг, толщиной 4-5 мм и переносят во взвешенную стерильную колбу на 250 см^. В дальнейшем поступают, как и при исследовании мелкой рыбы.
Пробу соли, хранящейся в мешках, составляют из отдельных выемок, взятых стерильным щупом, на глубине до 2/3 высоты мешка от 5$ мешков данной партии, но не менее, чем из 5-ти мешков.
Пробу соли, хранящейся навалом, без упаковки, составляют из отдельных выемок, взятых щупом в 6-ти различных местах. Пробу соли отбирают общей массой около 400-500 г в стерильные банки.
|
Объект контроля |
Допустимые бактериологические показатели | |
|
общая бактериальная обсемененность, 1 г |
бактерии группы кишечной палочки | |
|
Сырье (рыба охлажденная, после дефростацнн) |
5 х I04 |
Не определяется |
|
Рыба после разделки и мойки |
5 х I04 |
•тПт. |
|
Соль |
1 х Ю3 |
и11в |
|
Горячее копчение | ||
|
Тузлук (через 2 ч работы) |
5 х Ю4 |
О Отсутствие в 0,1 см |
|
Полуфабрикат после нанизки |
5 х I04 |
Не определяется |
|
Холодное копчение | ||
|
Вода для отмочки (через 5 ч работы |
I х I05 | |
|
Полуфабрикат после нанизки |
5 х I05 | |
Отобранную пробу соли тщательно перемешивают, затем отвешивают 10 г, заливают 90 свг стерильной воды (разведение 1СГ^). Колбу встряхивают в течение 5 мин, дают отстояться 3 мин, готовят следующее раз-ведение 1СГ^ ж приступают к анализам.
Отбор проб тузлука из посолочной ванны проводят после 1,5-2 ч работы.
Методика проведения микробиологических исследований приведена в подразделе 2.2.
4.2. Оценка результатов контроля и рекомендации
При повышенной обсемененности рыбы после нанизки, направляемой на горячее копчение, проводят дополнительную мойку рыбы на вешалках. При повышенной обсемененности рыбы после отмочки, направляемой на холодное копчение, проводят дополнительный анализ воды для отмочки и корректируют режим ее сменности. Если устанавливают повышенную обсе-мененность тузлука, то проводят повторную санитарную обработку по-оольной емкости и микробиологический анализ соли.
5. ПИТАТЕЛЬНЫЕ СРЕДЫ И РЕАКТИВЫ
5.1. Растворы для приготовления разведений (<|я8иологический раствор и пептонная вода)
Для приготовления физиологического раствора в I л водопроводной воды растворяют 8,5 г хлористого натрия, а пептонной воды - в 1 л водопроводной воды растворяют I г пептона. Физиологический раствор, водопроводную или пептонную воду наливают в пробирки по 10 см3 или в колбы по 100 см3 и стерилизуют при 120°С (1,02 кгс/см2) в течение 20 мин.
о
После стерилизации в пробирках остается обычно по 9 см воды, а в колбах - по 90 см3, т.е. такое количество, которое необходимо для приготовления разведений из посевного материала.
5.2. Среда для определения общей бактериальной обсеыененностн
Для определения общей бактериальной обсемененности готовится среда из сухого питательного агара (Дагестанский НИИ по производству питательных средств). Способ приготовления дается на этикетке.
5.3. Среды для выявления бактерий группы кишечной палату
5.3.1. Среда Кесслер
К 1 л водопроводной воды добавляют 10 г пептона и 50 см3 стерильной бычьей желчи. Смесь кипятят на водяной бане при помешивании 20-30 мин, фильтруют через вату, добавляют 2;5 г глюкозы, доводят объем до 1 л, устанавливают pH 7,4-7,6, добавляют 2 см3 1^-ного водного раствора генцианвиолета и разливают в пробирки по 8-10 см3 или колбы по 50 см3 и стерилизуют ири 120°С в течение 10-15 мин. Готовая среда должна иметь темно-фиолетовый цвет.
&чья желчь
Свежую желчь прогревают текучим паром в течение часа, дают отстояться и еще горячую фильтруют через ватко-марлевый фильтр. Стерилизуют при 120°С 30 мин. Перед употреблением желчь декантируют с осадка. Желчь, готовую к употреблению, можно приобрести в аптеке.
5.3.2. Среда КОДА
Готовят из сухой питательной среды (Дагестанский НИИ по производству питательных средств). Способ приготовления дается на этикетка.
5.3.3. Среда Эндо
Готовят из сухой питательной среды (Дагестанский НИИ по производству питательных средств).Способ приготовления дается на этикетка.
5.3.4. Глюкозо-пептоняая среда
К I л водопроводной воды добавляют 5 г глюкозы, 100 г пептона и 5 г хлористого натрия. Разливают в пробирки с поплавками или комочками ваты и стерилизуют при 120°С 10 мин pH 7,0-7,2.
5.4. Среды для выявления грибов
5.4.1. Сусловый агар
Неохмеленное пивное сусло разбавляют водопроводной водой в соотношении 1:1. К I л разбавленного пивного сусла (плотностью в среднем 8° по Баллингу) добавляют 15-20 г агара и расплавляют на электрической плитке или в автоклаве без давления, затем фильтруют через вату, устанавливают pH 4,5, разливают по колбам и стерилизуют при Н2°С 20 мин.
5.4.2. Среда Сабуро
К I л стерилизованной дрожжевой воды добавляют <10 г пептона,
40 г глюкозы или мальтозы, устанавливают pH 5,0-6,6, затем добавляют 15-20 г агара. Среду стерилизуют при П2°С 20 мин.
Приготовление дрожжевой воды
К 100 см** водопроводной воды добавляют 80 г прессованных или 10 г сухих дрожжей и кипятят 15 мин. Фильтруют через бумажный фильтр, разливают по колбам, стерилизуют при Н2°С 20 мин.
5.5. Растворы для окраски препаратов по Граму
5.5.1. Раствор Люголя
2 г йодистого калия растворяют в 10 см3 дистиллированной воды, прибавляют 1 г кристаллического йода и оставляют на несколько часов до полного растворения йода. Затем приливают 290 см3 дистиллированной воды. Хранить раствор нужно во флаконе из темного стекла.
5.5.2. Водно-спиртовый раствор фуксина
Сначала готовят насыщенный раствор краски (фуксин Циля). Для этого I г основного фуксина, 10 см3 этилового ректификованного спирта и 5 г фенола растирают в ступке, добавляя постепенно 100 см3 дистиллированной воды.
После 2 сут отстаивания данный раствор фильтруют. Для окраски препаратов к I см3 насыщенного раствора прибавляют 9 см3 дистиллированной воды (фуксин Пфяйфера).
5.5.3. Приготовление красящих фильтровальных бумажек
Краску генциан-виолета (I г краски в 10 см3 этилового ректи-
фикованного спирта, 5 г фенола растирали? в ступке, добавляя 100 см'* дистиллированной води) наливают в лоток или глубокую тарелку. Бумагу нарезают в виде полосок шириной 2-2,5 см и длиной 30-50 см. Полоску погружают на несколько секунд в краску так, чтобы смачивались обе ее поверхности. Окрашенные полосы вынимают пинцетом, дают краске стечь и подвешивают для высушивания. Бумагу сушат на воздухе при комнатной температуре. Высушенные полоски бумаги разрезают на кусочки размером 2 см х 2 см или 2 см х 4,5 см, хранят в темной склянке.
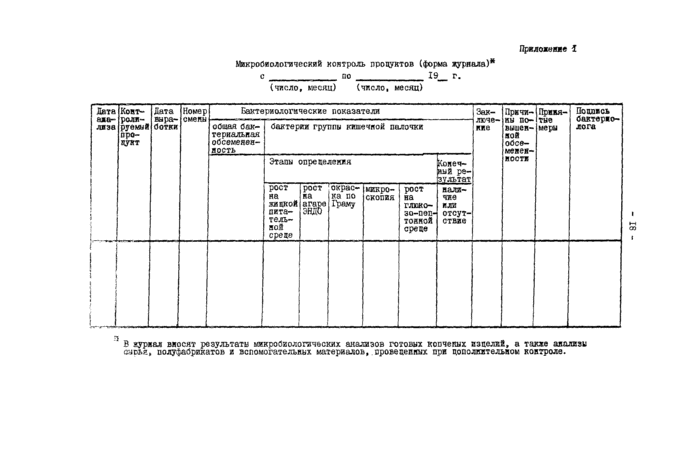
Шкробиологический контроль продуктов (форма ж}'риала)*
с_ ао 19_ г.
(число, пески) (число, месяц)
|
Дата |
Ковт- ПЛЦ- |
Дата |
Номер |
Бактериологические показатели |
Зек- |
Лрачн- |
Правя- Помесь шшлт AaVVMnifW | |||||||
|
«за |
РУвп.* |
бОТКИ |
оомая вахте риалькая обсемеяеа-яость |
С актере* группы к* веткой полочкк |
яве |
ВЫ DO— выиев-ВОЙ ооса- меяев- |
мерм |
йога | ||||||
|
Этапы определения |
(ояеч-и.в результат |
воете | ||||||||||||
|
рост яа жидкой оита- тель- аой среде |
рост яа агаре эндб |
окраска по 1>аму |
ыжкро- скопвя |
рост ва глюао- ЗО-ПОЕ- тояной среде |
вали- чве RJCB отсут- ствае | |||||||||
В кураал вяосят результате ыякробвологзчосхих анализов готовых косчеяых взвелхй, а такие анализы <ис*я, полуфабрикатов в вспомогательных материалов, вровессшолс ара допслиительвоы ковтрохе.
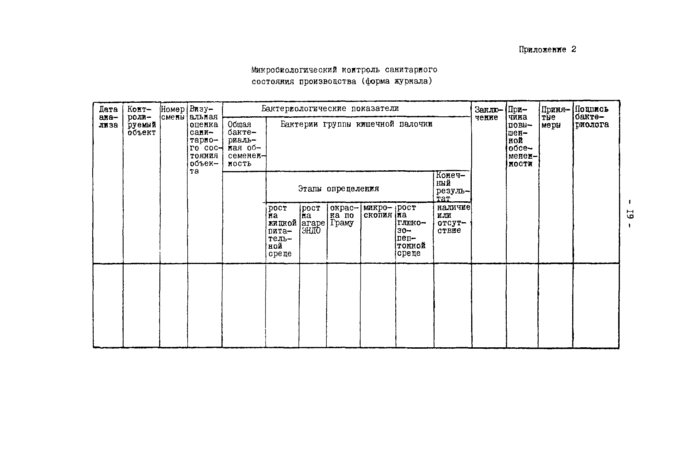
«иуроС*ологт.чссхкй контроль спкитариого состояния производства ($орма журчала)
|
Дата |
Коит- роли- pynioil обгект |
Номер |
Эйзу- |
Бактериологические показатели |
Зал.тг- |
При- |
Преи*- |
Поилась | ||||||
|
пял— Л1)В |
СргПН |
ли оценка санитар* о-ГО СОСТОЯНИЯ обьек- |
ОСюая бактериальная Об-ссмеиеи-яость |
Бактерии группы килечной палочки |
IPHUf |
чина повы- эси- ио> обсе- иенси- кости |
TV6 М*РУ |
УН* IP" рнодога | ||||||
|
Кояеч- | ||||||||||||||
|
Этапы опрспелспня |
ныв розуль— | |||||||||||||
|
рост на ни иной пита тель но! cpese |
рост на агаре WO |
окраска ПО Грану |
микро скопия |
рост иа глгко- 30- пеп- TOIWO* cpese |
наличие к.ту отсут- ствае | |||||||||
Методические указания предназначены идя работников производственных лабораторий и СЭС, осуществляющих микробиологический контроль производства рыбы горячего и холодного копчения, в том чиоле балычных изделий.
Указания разработаны в Птрорыбфлоте и ЦПКТБ Запрыба при участии членов Метоцсовета бактериологов рыбной промышленности, согласованы с Центральной санитарной инспекцией, Управлением производства рыбной продукции и новой технологии Минрыбхоза СССР.
Разработчики: отарший научный сотрудник, какд.биолог.наук Курдина Р.М., зав.лабораторией Иривреноьа И.И., ведущий бактериолог ЦПКТБ Зал рыба Волкова А.П., зам. начальника Центральной санитарной инспекции Минрыбхоза СССР Харченко П.С.
РЕКОМЕНДУЕМАЯ ЛИТЕРАТУРА
1. ГОСТ 7631-73. Рыба, продукты из рыбы, морские млекопитающие и беспозвоночные. Правила приемки. Методы органолептической оценки качества. Методы отбора проб для лабораторных испытаний.
2. ГОСТ 18963-73. Вода питьевая. Методы санитарно-бактериологического анализа.
3. Дутова Е.Н., Гофгарш М.М., Призренова И.И., Сазонова А.С. Техническая микробиология рыбных продуктов. М., Пищевая промышленность, 1976.
4. Инструкция о порядке санитарно-технического контроля консервов на производственных предприятиях, оптовых базах, в розничной торговле и на предприятиях общественного питания II2I-73. Утверждена Минздравом СССР в 1974 г. М., Пищевая промышленность, 1974.
5. Дутова Е.Н., Курдина Р.М., Школьникова С.С.
Методическая инструкция по санитарно-микробиологическому контролю производства кулинарных изделий из рыбы и нерыбных объектов морского промысла. Утверждена Минздравом СССР и Минрыбхозом СССР в 1978 г.,
Л., 1978.
6. Костенко Ю.Г., Нецепляев С.В. Основы микробиологии, гигиены
и санитарии на предприятиях мясной и птицеперерабатывающей промышленности. М., Пищевая промышленность, 1978.
7. Лабинокая А.С. Микробиология с техникой микробиологических исследований. М., Медицина, 1972.
8. Найденова Л.П., Дашевская Т.В., Мочалова Н.Н. Новые дезинфицирующие препараты для предприятий консервной промышленности. М., ЦНИИТЭИпищепром, 1972.
Основной задачей микробиологического контроля является обеспечение выпуска доброкачественной готовой продукции безопаоной в эпидемиологическом отношении.
Микробиологическая обсемененность и доброкачественность готового продукта зависят от того, насколько сырье и вспомогательные материалы отвечают требованиям соответствующих стандартов, включая микробиологические показатели, и в какой степени обеспечено соблюдение всех технологических и санитарных режимов обработки, начиная от приемки и хранения сырья и материалов и кончая выпуском готовой продукции, а также от санитарно-технического состояния предприятия.
При микробиологическом контроле производства рыбы горячего и холодного копчения контролируется готовая продукция (при необходимости сырье, полуфабрикаты по этапам технологического процеоса), а также оборудование, воздух производственных помещений, вода,руки и саноцежца работников предприятия.
Микробиологический контроль целится на профилактический, который проводится систематически с определенной периодичностью (табл.1,2) и включает анализ готовой продукции и проверку санитарного состояния предприятия, и дополнительный (табл.З), который проводится по решению зав.лабораторией, старшего бактериолога или ведомственных санитарных врачей учреждений санэпицслужбы в случае стойкой повышенной бактериальной обсемененности готового продукта и включает анализы соли, сырья полуфабрикатов по технологическому процессу для выявления источников и установления причин повышенной бактериальной обсемененности готовой продукции.
В Методических указаниях приведены периодичность контроля и показатели бактериальной обсемененности по этапам технологического
процесса производства рыбы горячего и холодного копчения, дана оценка результатов контроля и рекомендации по устранению причин повышенной бактериальной обсемененности, а также рецепты применяемых питательных сред, методы отбора проб и микробиологических исследований.
В /Агтоцические указания включены формы журналов и список рекомендуемой литературы.
Данные указания составлены с учетом основных положений, изложенных в Методической инструкции по санитарно-микробиологическому контролю производства кулинарных изделий из рыбы и нерыбных объектов морского промысла, на основании данных производственных лабораторий ВРИО, лаооратории технической микробиологии Ллпрорыбфлота и лаборатории ЦШСТБ Запрыбы.
2. ПРОФИШТИЧЕСКИЙ ЬЖРОШОЛОГИЧЕСКИЙ КОНТРОЛЬ ГОТОВОЙ ПРОДУКЦИИ ГОРЯЧЕГО И Х0Л0;СН01Х) КОПЧЕНИЯ
В основе профилактического санитарно-микробиологического контроля (табл.1) лежит определение обпей бактериальной обсемененности и санитарно-показательных микроорганизмов-бактерий группы кишечной палочки.
Профилактический микробиологический контроль готовой продукции проводится систематически бактериологическими лабораториями предприятий (периодичность см. в табл.1), учреждений салэпмдслужби согласно их плану и лабораториями ЦПКТБ всесоюзных рыбопромышленных объединений при выборочных проверках предприятий, а где нет лабораторий, на договорных началах лабораториями СЭС.
|
Таблица 1 | ||||||||||||||||
|
хСальмонеллы должны отсутствовать в 25 г готовой продукции. Исследование на сальмонеллы проводят в лабораториях санэиицслужоь.
2.1. Отбор проб готовой рыбопродукции и подготовка их к анализу
Отбор проб и подготовка их к анализу проводятся с соблюдением условий асептики, исключающих возможность попадания микроорганизмов из внешней среды. Интервал во времени между отбором проб и исследованием должен быть максимально сокращен.
В случае необходимости образцы сохраняют до начала исследования не более 4-х ч при температуре 2 ♦ 4°С ( в холодильнике).
Проба готовой продукции для микробиологических исследований отбирается после упаковки от одной партии в стерильные банки общей массой не менее 300 г из 3-х единиц транспортных упаковок (картонные или деревянные ящики). Под однородной партией следует понимать продукцию одного товарного качества, способа обработки и наименования, выпущенную одной сменой.
Если в ящиках находится рыба в потребительской таре - полиэтиленовых мешках или картонных коробочках, то для анализа отбнраетоя полностью единица упаковки без нарушения ее целостности.
Из рулетов и крупной рыбы из приголовной и прихвостовой ее части асептически вырезают поперечные куски. Мелкая рыба используется целиком.
Отобранную среднюю пробу снабжают этикеткой, в которой указывают наикзноваяие продукта, номер партии, номер образца и цату отбора проб.
Идя анализа среднюю пробу измельчают стерильным ножом или скальпелем, затем 150 - 200 г исследуемого материала растирают в стерильной ступке. Образцы можно также измельчать в электрических гомогенизаторах (размельчителях тканей) PT-I. Инструкция по эксплуатации прилагается к прибору. 10 г измельченного материала стерильно помещают в колбу (банку) с 90 ск? жидкости для разведения (0,1/&-ная пептонная вода, физиологический раствор, водопроводная вода), получая разведение 10“*. Взвесь встряхивают в течение 5 мин, дают отстояться 3 мин и после оседания крупных частиц приступают к анализу.
Массу пробы можно определять и объемным методом. Для этого берут специально подготовленные стаканы, на стенки которых наносится нарезка-черта на уровне 100 см'*. В стакан наливают 90 см'* стерильной жидкости для разведения. Среднюю пробу размельченного продукта вносят в стаканы в количестве, обеспечивающим подъем налитой жидкости до уровня нанесенной черты (по нижнему мениску), получая разведение 10“ .
2.2. Микробиологические исследования
Микробиологические исследования, проводимые при осуществлении п; филактического контроля готовой продукции, включают определение общей бактериальной обсемененности и бактерий группы кишечной палочки, а
также выборочно сальмонелл. Анализ на сальмонеллы провопят лаборатории СЭС.
2.2.1. Определение общей бактериальной обеемененности
Из подготовленного Для анализа материала (разведение 10“*) делают дальнейшие разведения. Для этого I см3 гомогената переносят в пробирку с 9 см3 стерильной воды, физиологического раствора или пептон-ной воды, получая разведение 1СГ^. Для приготовления каждого разведения используется отдельная пипетка. Разведения подбирают с таким расчетом, чтобы после посева па чашках Петри выросло не более 300 колоний.
Для анализа рыбы как горячего, так и холодного копчения рекомендуется высевать разведения ИГ* и 10Г*\
Для определения общего количества бактерий в исследуемом материале по 1 см'* соответствующего разведения вносят в 2 чашки Петри и заливают расплавленным и остуженным до 45°С питательным агаром. Сразу после заливки агаром содержимое чашки следует тщательно перемешать легким вращательным движением для равномерного распределения посевного материала. После застывания агара чашки переворачивают крышками вниз и ставят в термостат с температурой 30°С на 48 ч или оставляют на 24 ч при комнатной температуре, а потом на 24 ч в термостате при температуре 37°С. Затем подсчитывают количество выросших колоний в каждой чашке. Для подсчета берут те чашки, количество колоний в которых не менее 30 и не более ЗСО.
В отдельных случаях при большем числе колоний дно чашки Петри делят на 4-6 одинаковых сектора, подсчитывают число колоний в 2-3-х противолежащих секторах, находят среднее арифметическое число колоний для одного сектора, которое умножают на общее количество секторов всей чашки. Таким образом находят общее количество колоний, выросших на одной чашке. Количество микроорганизмов рассчитывают на 1 г продукта путем умножения числа колоний в чашке на 10, 100 и так далее, в зависимости от разведения.
2.2.2. Определение бактерий группы кишечной палочки
Бактерии группы кишечной палочки в рыбе горячего и холодного копчения определяют в 1 г продукта. Для этого 10 см** исходного гомогената вносят в колбы с 50 см3 среды Кесслор и инкубируют при температуре 43°С. Через 24 ч из забродивших колб производят посев на среду Эндо с таким расчетом, чтобы получить отдельные колонии, цдя чего берут минимальное количество посевного материала и производят посев частым штрихом. Перед посевом дно чашки со средой Эндо целят на 4 сектора. Посев из каждой колбы производят на отдельный сектор. Чашки с посева-
мв помещают (крышками вниз) в термостат с температурой 37°С на 18-24 ч. При наличии на среде Эндо красных (часто с металлическим блеском), розовых, бледно-розовых или бесцветных колоний из них готовят препараты и окрашивают по Граму. Для этого из суточной культуры микроорганизмов со среды Эндо готовят мазок на обезжиренном предметном стекле. Мазок сушат на воздухе и фиксируют, проводя 3 раза над пламенем горелки. На препарат помещают красящую фильтровальную бумажку (п.5.5.3) и наносят на нее 2-3 капли воды. Окрашивание продолжается 1-2 мин. Затем бумажки снимают ж, не промывая препарата водой, наливают раствор Люголя на 1-2 мин до почернения препарата, после чего раствор Люголя сливают, а предметное стекло для обесцвечивания мазка погружают несколько раз в стаканчик со спиртом или выдерживают в нем около 30 сек. Процесс обесцвечивания считается завершенным, когда от мазка перестают отделяться окрашенные в фиолетовый цвет струйки жидкости. Затем препарат тщательно промывают водопроводной водой и докрашивают спирто-водным раствором фуксина 1-2 мин. После промывки и просушивания мазок микроскопируют. Микробы, красящиеся по Граму генциан-виолетом, имеют темно-фиолетовый цвет и называются грам-положительными, а микробы, красящиеся по Граму фуксином в красный цвет - грам-отрицателышми.
К бактериям группы кишечной палочки относятся грам-отрицатель-ные, не образующие спор короткие палочки.
В случае обнаружения граи-отрицательных палочек делают посевы в глюкозо-пептонную среду с поплавками или рыхлыми небольшими комочками ваты. Посевы выдерживают в термостате 18-24 ч при температуре 43°С. Газообразование в пробирках указывает на присутствие бактерий группы кишечной палочки.
Наряду с приведенным выше методом для определения кишечной палочки можно применять экспресс-метод с использованием специфической элективной среды КОДА.
Для этого в колбы с 50 см^ среды вносят I г продукта или *0 см^ исходного гомогената. Посевы термостатируют при 43°С.
Среда КОДА при росте бактерий группы кишечной палочки приобретает ярко-зеленый, зеленый или желтый цвет. Исходный цвет среды КОДА -сине-фиолетовый. Результаты посева на среде КОДА можно учитывать через 18 ч после посева.
Влбор метода для определения бактерий группы кишечной палочки определяется возможностями лаборатории, наличием питательных сред.
2.3. Оценка результатов контроля и рекомендации
Готовый продукт рассматривается как доброкачественный в микрс биологическом отношении, если общая бактериальная обсеменеиность
в -I г пыбы горячего копчения не превышает 5 х dO2, холодного -5 х ICr клеток и бактерий группы кишечной палочки в d г отсутствуют. Сальмонеллы долины отсутствовать в 25 г готового продукта.
Если в готовом продукте обнаружена повышенная бактериальная обсемененность, необходимо для выявления источника обсеменения и срочного устранения его визуально оценить санитарное состояние технологической линии, проверить правильность проведения режима технологического процесса, провести дополнительные санитарно-микробиологические исследования, обращая внимание на обсемененность воздуха помещений, где охлаждается готовый продукт.
Вопрос о реализации партии готовой рыбопродукции с повышенной обсемененностью решают предприятие-изготовитель в лице технохимичес-кого контроля, ведомственная инспекция по качеству и санитарная инспекция в установленном порядке на основании лабораторных анализов, органолептических показателей и санитарного состояния цеха.
3. ПРОФИЛАКТИЧЕСКИЙ САНИТАРН0-И1КР0БИ0Л0гаЧЕСКИЙ КОНТРОЛЬ ПРОИЗВОДСТВА
Требуемый уровень санитарно-гигиенического оостояш!я производства поддерживается путем проведения комплекса саньтарно-тех-нических и профилактических мероприятий. Эффективность проводимых мероприятий оценивается путем микробиологического контроля санитарного состояния инвентаря, тары, воды, воздуха, рук ы санодежцы рабочих, проводимого с определенной периодичностью (табл.2). Сотрудниками лаборатории осуществляется также ежедневный визуальный контроль санитарного состояния производства.
При контроле могут быть выявлены источники бактериального загрязнения. Нарушение санитарного режима может привести к выпуску готового продукта с повышенной бактериальной обсемененностью, а также к вторичному обсеменению продукта.
По результатам микробиологического обследования оценивается санитарное состояние производства.
|
Таблица 2 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||