Методические указания по бактериологической диагностике брюшного тифа, паратифа А, В и других заболеваний салмонеллезной этиологии
Купить бумажный документ с голограммой и синими печатями. подробнее
Цена на этот документ пока неизвестна. Нажмите кнопку "Купить" и сделайте заказ, и мы пришлем вам цену.
Распространяем нормативную документацию с 1999 года. Пробиваем чеки, платим налоги, принимаем к оплате все законные формы платежей без дополнительных процентов. Наши клиенты защищены Законом. ООО "ЦНТИ Нормоконтроль"
Наши цены ниже, чем в других местах, потому что мы работаем напрямую с поставщиками документов.
Способы доставки
- Срочная курьерская доставка (1-3 дня)
- Курьерская доставка (7 дней)
- Самовывоз из московского офиса
- Почта РФ
Оглавление
I Материал для исследования и сбор его
II Посев исходного материала и ход бактериологического исследования
Приложение. Рецептура рекомендуемых питательных сред
| Дата введения | 01.01.2021 |
|---|---|
| Добавлен в базу | 01.02.2020 |
| Актуализация | 01.01.2021 |
Этот документ находится в:
Организации:
| Разработан | ИЭМГ | |
| Утвержден | Министерство здравоохранения РСФСР |
Чтобы бесплатно скачать этот документ в формате PDF, поддержите наш сайт и нажмите кнопку:

стр. 1

стр. 2

стр. 3

стр. 4

стр. 5

стр. 6

стр. 7

стр. 8

стр. 9

стр. 10

стр. 11

стр. 12

стр. 13

стр. 14

стр. 15

стр. 16
стр. 17

стр. 18
стр. 19
МЕТОДИЧЕСКИЕ УКАЗАНИЯ ПО БАКТЕРИОЛОГИЧЕСКОЙ ДИАГНОСТИКЕ БРЮШНОГО ТИФА, ПАРАТИФА А, В И ДРУГИХ ЗАБОЛЕВАНИЙ САЛМОНЕЛЛЕЗНОЙ ЭТИОЛОГИИ
«УТВЕРЖДАЮ>
Зам. министра Здравоохранения РСФСР
Г. НИКОЛАЕВА
МЕТОДИЧЕСКИЕ УКАЗАНИЯ ПО БАКТЕРИОЛОГИЧЕСКОЙ
ДИАГНОСТИКЕ БРЮШНОГО ТИФА, ПАРАТИФА А, В И ДРУГИХ ЗАБОЛЕВАНИЙ САЛМОНЕЛЛЕЗНОЙ ЭТИОЛОГИИ
Исследования на обнаружение брюшнотифозных, паратифозных А и В, а также прочих салмонеллезных микробов производят с целью:
1) Подтверждения диагноза заболевания;
2) выявления бактерионосительства у реконвалесцентов перед выпиской из стационара;
3) выявления источника заболевания при вспышках;
4) выявления бактерионосительства среди работников пищевых предприятий, водоснабжения, детских и лечебных учреждений, а также у лиц приравненных к ним;
5) выявления путей распространения инфекции через объекты внешней среды.
1. Материал для исследования и сбор его
Выбор материала для бактериологического исследования определяется локализацией и путями выделения возбудителя из организма больного в свете патогенеза тифозных, паратифозных и прочих салмонеллезных заболезаний.
Учитывая развитие инфекционного процесса выделить микроб легче всего: из крови — на 1—2 неделе заболевания (бактериэмия); из желчи (дуоденального содержимого) — в течение Есего заболевания, вплоть до реконвалесценции, а также у бактерионосителей; из розеол — во время их существования; из испражнений у брюшнотифозных и паратифозных больных с конца второй недели заболевания, при других клинических формах — с первого дня заболевания, а также у бактерионосителей; из мочи — с конца второй недели заболевания, а также у бактериовыделителей; из костного мозга — в особых случаях, по указанию клинициста; из трупа—в материале добытом из желчного пузыря и селезенки, содержимого тонких кишек, мезентериальных желез, костного мозга.
В связи с периодичностью выделения микробов рекомендуется производить повторные исследования испражнений и мочи, с промежутками приблизительно в 5—7 дней.
з
представляют штаммы, потерявшие агглютинабильность. При соответствии морфологических и биохимических признаков какому-нибудь из видов салмонелл, эти штаммы не должны быть отброшены. Агглютинабильность иногда восстанавливается после нескольких (3—5) ежедневных пересевов на свежий, влажный, скошенный агар или при чередовании пересевов на агар с посевом на желчный бульон. Рекомендуется одновременно рассеять неагглютинирующуюся культуру на чашку и выбрать из выросших колоний такие, которые дают на стекле агглютинацию с соответствующей сывороткой. Для выявления соматического антигена следует поставить реакцию агглютинации с культурой, прогретой 30 минут при температуре 100°.
При выделении культуры, хорошо агглютинирующейся какой-нибудь из сывороток, но атипичной по другим свойствам, прежде всего убеждаются в чистоте штамма. Для этого рассевают жидкую взвесь изучаемой культуры на дифференциальные среды, что сразу позволяет убедиться в чистоте культуры и выделить типичную колонию. Вновь выделенный штамм проверяют по всей схеме.
Если биохимические свойства культуры остаются атипичными, следует провести ряд пассажей на 10й/о желчном бульоне, бульоне Хоттингера и скошенном агаре. Можно рекомендовать, в качестве Дополнительного метода, испытание фаголизабельности культуры.
В случае, если после всех вышеописанных приемов дополнительного исследования не удается определить природу выделенной культуры, дается отрицательный ответ с требованием трехкратного повторения исследования. Изучаемую же культуру следует направить в научно-исследовательский институт для изучения.
При необходимости ускорения хода бактериологического исследования должны быть использованы комбинированные питательные среды, сокращение интервалов между пересевами и между отдельными этапами исследования, одновременное выполнение различных приемов, выполнявшихся раньше в разные дни.
Так, подозрительные колонии с чашки снимают сразу на три пробирки— одну — скошенный столбик с лактозой, глюкозой и мочевиной и вторую — среду типа Ресселя с маннитом и с сахарозой, а также пробирку с бульоном для определения сероводорода и индола. Можно подозрительную колонию эмульгировать в небольшом объеме бульона или физиологического раствора и внести в пробирки развернутого пестрого ряда. Рекомендуется питательные среды предварительно подогреть до 37°С. С момента появления роста культуры (6—8 час.) возможно постановка реакции агглютинации.
Ускорение исследования не должно достигаться путем упрощения или опущения установленных необходимых и важных признаков в характеристике выделенных микробов.
Метод ускоренной бактериологической диагностики в модификаци Московского института им. Мечникова
Сущность этого метода заключается в использовании элективных питательных сред, короткого пестрого ряда и адсорбированных сывороток с учетом подвижности и морфологии культуры. Такой метод 12
сокращает продолжительность анализа на одни сутки, по сравнений с обычным.
Подозрительные на салмонеллезных микробов колонии со среды Плоскирева, бактоагара Ж или среды висмут-сульфит агар отсевают на короткий пестрый ряд (среда Ресселя или лактоза, глюкоза и скошенный агар) и в столбик с полужидким (0,4%) слабощелочным агаром для определения подвижности.
Типичные для салмонелл по биохимическим и морфологическим свойствам культуры испытывают в ориентировочной агглютинации на стекле со смесью салмонеллезных сывороток. Эта смесь состоит из обычных агглютинирующих сывороток паратифа А, паратифа В, Бреслау, Суипестифер и Гертнер (по 1 мл каждой +20 мл физиологического раствора). К смеси, в качестве консерванта, следует добавить 1% дважды перекристаллизованной борной кислоты. Кроме того, для пробной агглютинации можно пользоваться смесью № 3 института им. Пастера (см. приложение).
Культуры, дающие положительную реакцию агглютинации со смесью паратифозных сывороток, испытывают сначала адсорбированными О-сыворотками для определения серологической группы А, В, С, Д, Е), а затем с Н-сы.воротками для установления вида бактерий.
Если подвижная культура, типичная по биохимическим и морфологическим свойствам, хорошо агглютинируется на стекле адсорбированными О-сыворотками, устанавливающими серологическую группу и Н-сыворотками определенного вида, то дается положительный ответ.
В случае какой-либо неясности при работе ускоренным методом исследование продолжают обычным способом, как описано выше.
Настоящий метод рекомендуется применять только при исследовании материала от больных и при массовой работе во время вспышек. Не рекомендуется использование его при исследовании материала из внешней среды, так как в этих случаях чаще встречаются атипичные культуры, требующие более углубленного изучения.
Рецептура рекомендуемых питательных сред
I. СРЕДЫ ОБОГАЩЕНИЯ
1. Желчный бульон — К 800 мл бульона добавляют 200 мл нативной желчи PH—7,6. Стерилизация в автоклаве при 120°С 30 минут.
2. Среда Рапопорт — К 1 литру 10% желчного бульона добавляют 2% глюкозы и в качестве индикатора либо 13/о раствора Андре-да или 0,1 спиртового раствора бромкрезолпурпурного. Разливают по 50 мл во флаконы, куда вкладывают поплавок. Стерилизуют текучим парам три дня по 30 минут.
3. Среда Мюллера — В стерильные флаконы отвешивают по 4.5 гр мела, стерилизуют сухим жаром. Наливают в каждый флакон по 90 мл бульона. Стерилизуют при 1 атмосфере давления 30 минут. К каждому флакону, в асептических условиях, добавляют 2 мл раствора Люголя и 10 мл раствора серноватисто-кислого натрия.
Раствор Люголя: 100 мл дестиллированной воды, 20,0 йодистого калия и 25,0 иода.
Раствор серноватисто-кислого натрия: насыпают в измерительный цилиндр 50,0 серноватистокислого натрия и добавляют дестилли-рованной ьоды до 100 мл. Переливают в бутыль. Стерилизуют текучим паром.
4. Среда Кауфмана — К 500 мл стерильной среды Мюллера добавляют 25 мл стерильной желчи и 5 мл 0,1% водного раствора бриллиантовой зелени. Разливают в пробирки, с соблюдением правил асептики.
II. КОНСЕРВИРУЮЩАЯ ГЛИЦЕРИНОВАЯ СМЕСЬ
К 1 литру физиологического раствора добавляют 0,5 л химически чистого нейтрального глицерина и устанавливают pH средьг=8, добавляя 20% фосфорно-кислый натрий (Na2HPC>4). Стерилизация при 112° в течение 15 минут. После стерилизации pH =7,6—7,8.
Ill ДИФФЕРЕНЦИАЛЬНЫЕ ПИТАТЕЛЬНЫЕ СРЕДЫ
Каждая новая серия сухой элективной питательной среды (бак-гоагар Ж, среда Плоскирева, среда Вильсон- и Блер) должна проверяться при помощи посевов инфицированных фекалий или салмонел-лезных культур. При полном отсутствии роста кишечнои палочки (стерильные чашки) следует снизить количество порошка в растворе; при обильном росте кишечной палочки — наоборот (согласно указания на этикетке). При задержке роста салмонеллезных микробов следует снижать количество порошка в растворе, заменяя его сухим питательным агаром.
1. Среда Ресселя из сухих питательных сред — На 950 мл дестиллированной воды берут 40 г «сухого питательного агара с индикатором ВР и лактозой» и 5 г сухого питательного агара. Смесь растворяют при нагревании до кипения. Затем в 50 мл дестиллированной воды растворяют 1 г глюкозы и добавляют к вышеуказанной смеси. Разливают в стерильные пробирки по 5—6 мл и стерилизуют теку-14
чим паром два раза по 30 минут. Среду скашивают так, чтобы остался небольшой столбик.
Среду Ресселя с маннитом и сахарозой готовят по вышеуказанному принципу: на 950 мл дестиллированной воды берут 40,0 «Сухого питательного агара с индикатором ВР и сахарозой» и прибавляют 1,0 маннита, растворенного в 50 мл дестиллированной воды.
Цвет среды сероваторозовый, при кислотообразовании цвет среды меняется на синий.
2. Среда <гскошенный столбик» из сухих питательных сред — В 100 мл горячей стерильной дестиллированной воды растворяют
4 г сухой среды Гисса с лактозой и индикатором ВР, 0,1 г глюкозы и 1 г мочевины; полученный раствор разливают в пробирки и стерилизуют текучим паром 15 минут. Среду скашивают как среду Ресселя. Цвет среды — сероваторозовый. При кислой реакции цвет среды меняется на синий, при щелочной — на оранжевый.
3. Среда Биттера с рамнозой. — В 1 литре дестиллированной воды растворяют 0,5 гр одноосновного фосфорнокислого натрия, 1 г серно-кислого аммония, 2 г трехосновного лимоннокислого натрия,
5 г хлористого натрия, 0,5 г пептона, 5 г рамнозы — кипятит, фильтруют, разливают, стерилизуют три дня текучим паром по 30 минут.
IV. ПРИГОТОВЛЕНИЕ ИНДИКАТОРНЫХ БУМАЖЕК
а) На индол
Парадиметил-амидобензальдегид ..... 3—5 гр
Спирт 96»/о.................. 50 мл
Фосфорная кислота (очищен, концентр.) . . 10 мл
Смешать, дать раствориться порошку. Полученной тепловатой жидкостью смочить полоски фильтровальной бумаги, высушить и нарезать узкими полосками. Цвет бумажек — желтый. При наличии в бульоне индола цвет бумажки изменяется на сиренево-розовый до интенсивно малинового. Появление других цветов на индикаторной бумажке не учитывается.
б) На сероводород — Лист фильтровальной бумаги смачивают в следующем растворе:
Дестиллированной воды...........100 мл
Уксусно-кислого свинца ........... 20 г
Двууглекислой соды.............. 1 г
Бумагу высушивают, нарезают полосками. После обработки бумага бесцветная, при наличии сероводорода чернеет.
V. МЕТОДИКА ОПРЕДЕЛЕНИЯ ФАГОТИПОВ КУЛЬТУР ТИФОЗНЫХ БАКТЕРИИ
Для определения фаго-типов брюшнотифозных культур надо иметь набор типовых брюшно-тифозных фагов 2-го серологического типа 1. В настоящее время имеется свыше 30 фагов и различных
типов Ви II бактериофагов и соответствующее им фаготилов культур. Они обозначаются заглавными буквами латинского алфавита— А, В, С, Д, Е и т. д. Кроме того, надо иметь фаг «Ви» первого серологического типа, который используется для контроля состояния культуры. Бактериофаг 1-го серологического типа лизирует тифозные культуры всех типов, если они находятся в «V» форме.
Определение фаготипов культур проводят с брюшнотифозными микробами. Тифозные палочки должны быть в «V» ферме т. е. содержать Ви антиген и агглютинироваться Ви-антисывороткой. Для опыта применяют молодые 3—4 часовые бульонные культуры, которые засевают на чашки с агаром. Употребляют 1,1°/»-ный прозрачный агар рН=7,2—7,4.
Чашки с агаром хорошо подсушивают и на поверхность их наносят каплю культуры платиновой петлей, всегда одного диаметра, после чего чашку ставят снова в термостат на 20—30 минут для подсушивания.
На высохшие капли испытуемой культуры наносят одинаковые объемы типовых фагов в критическом тест-разведении 2 (обозначено на этикетках ампул с фагом).
Засеянные чашки помещают в термостат на 2—3 часа, а затем на ночь в холодильник при +2 +6°. На следующий день чашки помещают вновь на 4—б часов в термостат, лишь после этого учитывают результаты опыта. Тип культуры определяют по фагу, который полностью лизирует культуру. Если культура полилизабильная, то опыт повторяют с прибавлением двух последующих разведений фага после тест-разведения.
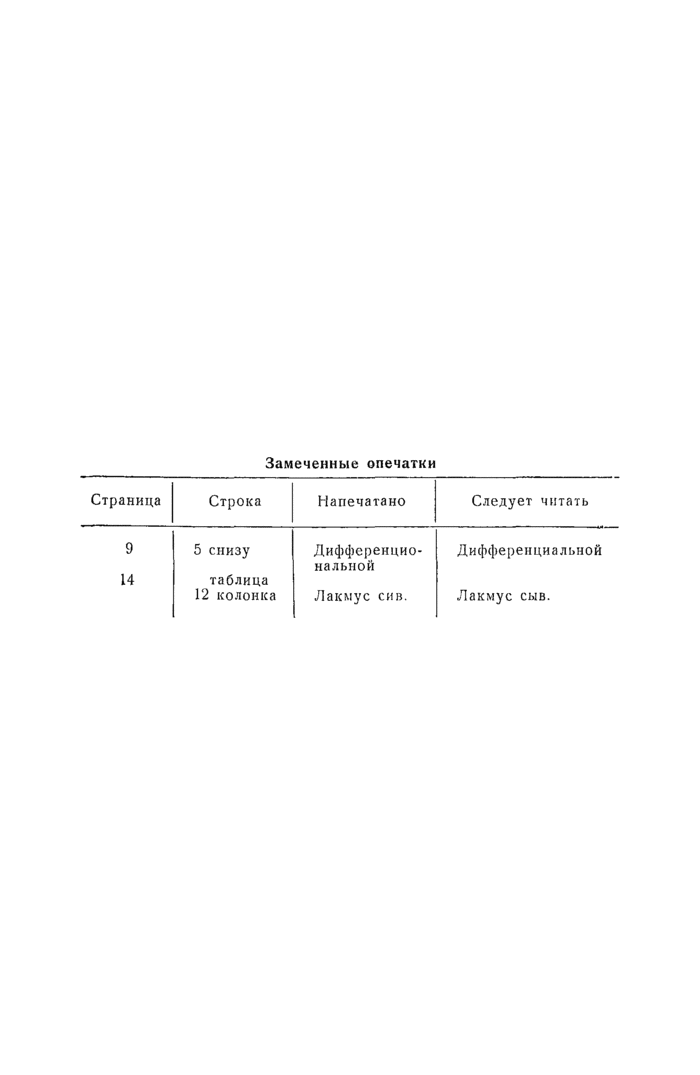
VI. НОМЕНКЛАТУРА САЛМОНЕЛЛЕЗНЫХ ДИАГНОСТИЧЕСКИХ АГГЛЮТИНИРУЮЩИХ СЫВОРОТОК
(Приказ министерства здразоохоанения СССР № 175 от 16.IV— 1955 г.).
Видовые неадсорбированные:
Брюшнотифозная Паратифозная Тифимурим (Бреслау)
Паратифозная А Паратифозная Холересуис (Суипестифер) Паратифозная В
Паратифозная Энтеритидис (Гертнера)
Брюшнотифозная Н Брюшнотифозная О Паратифозная А Паратифозная В
Видовые адсорбированные:
Паратифозная тифимуриум (Бреслау) Паратифозная Энтеритидис (Гертнер) Паратифозная Гайдельберг Паратифозная холересуис (Суипестифер)
Паратифозная смесь №3* (А, В, С, Д — Герти ер) и адсорбированные — монорецепторные:
I. Монорецепторные антисыворотки к О-антигенам представителей рсда Салмонелла, встречающиеся у человека (по общепринятой классификации — I, II, III, IV, V, VI, VII, VIII, IX) и брюшнотифозная Ви-антисыворотка, а также комплексные О-антигены группы В (IV, V) и группы С (VI, VII, VIII) 3 4.
II. Монорецепторные антисыворотки к видо-специфическим Н-ан-тигенам представителей рода Салмонелла, встречающихся у человека по общепринятой классификации: а, в, с, i, г, f, g, m, d, eh, Iv,
gm, gt.*.
III. Монорецепторные антисыворотки к неспецифическим Н-антн-генам представителей Салмонелл, встречающихся у человека (по общепринятой классификации — 1,2; 1,5).
Прецилитирующие сыворотки5
Брюшнотифозная Паратифозная энтеритидис (Гертнер)
Паратифозная А Паратифозная тифимуриум (Бреслау)
Паратифозная В Паратифозная холересуис (Суипестифер)
ПРИМЕЧАНИЕ: I. Агглютинирующие и преципитирующие сыворотки используют согласно сроков годности, указанных на этикетках. По истечении срока годности они могут быть использованы только после пе-ретитрования.
2. При применении сывороток следует строго придерживаться настав лений, приложенных к сывороткам
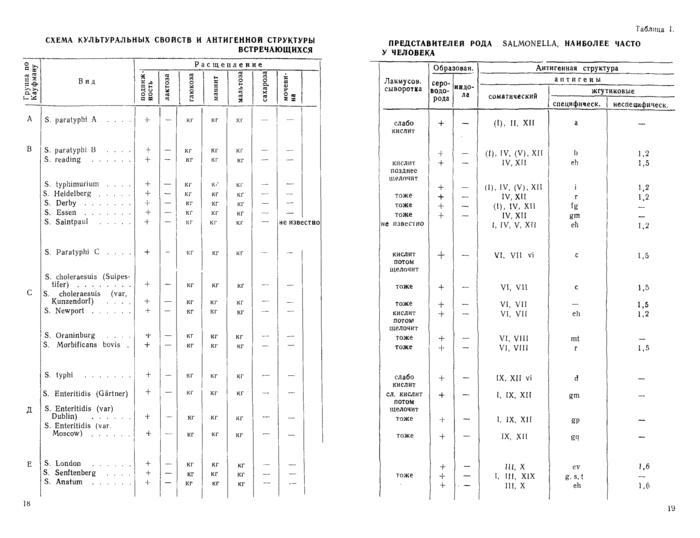
СХЕМА КУЛЬТУРАЛЬНЫХ СВОЙСТВ И АНТИГЕННОЙ СТРУКТУРЫ
ВСТРЕЧАЮЩИХСЯ
|
“ « Ц | |||||||||
|
Вид |
* Л |
3 |
1 |
Я |
1 |
1 |
t • | ||
|
ss- и 'Л |
• ► a |
1 n |
2 |
- a |
i |
3 5 |
i S3 | ||
|
А |
$ p»r»typbi А .... |
*■ |
M |
Rf |
Rf | ||||
|
в |
S pttrtypht В .... |
♦ |
КГ |
Hr |
Rf | ||||
|
S rctding ...... |
+ |
ur |
Rf |
*r |
— | ||||
|
S typhimufluir .... |
♦ |
__ |
КГ |
. |
_ |
— | |||
|
S ТММЬсгк..... |
♦ |
— |
КГ |
« |
Rr |
— |
— | ||
|
S Derby....... |
+ |
— |
Hr |
Rr |
RT |
— |
-- | ||
|
$ Eutn....... |
♦ |
— |
КГ |
Rf |
Rf |
— |
— | ||
|
$ Silntpiul ..... |
+ |
Rf |
Rr |
Rf |
” |
« WWIIO | |||
|
S P»f»lypbi c .... |
4 |
КГ |
RT |
Rf |
- |
- | |||
|
S ihol«»e*uU (Sulpcv | |||||||||
|
tlfrtt....... |
4 |
— |
Rf |
Rr |
HI |
— |
— | ||
|
с |
s chotoMMi* (»ir. | ||||||||
|
Kunrendorll .... |
4 |
— |
КГ |
RT |
Rr |
— |
— | ||
|
S Newport...... |
+ |
— |
Rr |
Rf |
nr |
— |
— | ||
|
S ОгдшпЬигк .... |
4 |
_ |
Rr |
Rr |
Rr | ||||
|
S Morbtllc»n» fcovl» . |
+ |
‘ |
Rf |
Rr |
Rr |
— |
— | ||
|
s t»pw ....... |
4 |
- |
Rf |
*r |
— |
— | |||
|
S Enlwltldi* (Girtnrr) |
4 |
Rf |
nr |
.r |
- |
- | |||
|
д |
S Entcritldii (v»r) Dublin) ...... S Entrrilldii (v»r |
4 |
Rr |
Rr |
Rf |
- |
- | ||
|
Moscow)..... |
4 |
ШТ |
Rr |
Rr |
— | ||||
|
Е |
S London ...... |
4 |
Rf |
Rr |
Rf | ||||
|
S Scnftenbcrg .... |
♦ |
— |
«Г |
Rf |
Rf |
_ |
— | ||
|
S Anitum...... |
Rf |
МГ |
КГ |
— |
— | ||||
представителей рода salmonella, наиболее часто
У ЧЕЛОВЕКА
|
Обрамми. |
Аи1иг«ииаа структура | ||||
|
Лашусо» |
саро- *050- | ||||
|
CUlOpOtl» |
НЮ- Л| |
Htryiimoauc | |||
|
рола |
соме«иксекии |
спецяфинеск. |
моииафичсо. | ||
|
<■.1*60 |
4 |
_ |
(1). It. XII |
ft | |
|
кислят | |||||
|
4 |
_ |
(1). IV. (V|. XII |
b |
1.3 | |
|
кислит лошкс |
4 |
— |
IV. XII |
eh |
1.5 |
|
ЩСЛОЧИТ | |||||
|
+ |
— |
III. IV. (V). XII |
• |
1.2 | |
|
тоже |
4 |
— |
IV. XII |
Г |
1.2 |
|
тоже |
+ |
— |
(1). IV. XII |
<2 |
- |
|
тоже И« ИЗИССГИО |
4 |
IV. XII 1. IV. V. XII |
И“ ch |
- 1.2 | |
|
КИСЛЯТ |
+ |
VI. VII ri |
c |
1.5 | |
|
ПОТОУ щелочит | |||||
|
тоже |
4 |
- |
VI. VII |
c |
1.5 |
|
тоже |
4 |
— |
VI. VII |
— |
I.S |
|
кислит |
4 |
— |
VI. VII |
eli |
1.2 |
|
ПОТОУ щелочит | |||||
|
тоже |
4 |
— |
VI. VIII |
ml |
— |
|
тоже |
+ |
— |
VI. VIII |
r |
1.5 |
|
слабо |
4 |
_ |
IX. XII vi |
d | |
|
КИСЛИТ | |||||
|
«Л. КМСЛЛГ |
4 |
— |
1. IX. XII |
*m | |
|
ГОТОМ щелочит | |||||
|
тоже |
4 |
— |
1. IX. XII |
HP |
— |
|
тоже |
4 |
— |
IX. XII |
2П |
- |
|
4 |
__ |
III. X |
cv |
1.5 | |
|
тоже |
4 |
— |
1. III. XIX |
— | |
|
4 |
III. X |
ck |
1.5 | ||
Составлена в Московском ИЭМГ
|
Утверждена комиссией в составе: |
БЕНДЕРСКАЯ Е. А. — Минздрав РСФСР РАВИЧ-БИРГЕР Е. Д. — Моек. ИЭМГ (председатель) ЭПШТЕИН-ЛИТВДК р. в. Моек. ИЭМГ АНДРЕЕВА 3. М. — (секретарь). Моек. ИЭМГ НОВГОРОДСКАЯ Э. М. — Ленингр. ИЭМГ им. Пастера /МАРГОЛИНА Л . М. — ин-т Микроб. АМН им. Гамалея ТИМЕН Я. Е. — Моек. ИВС им. Мечникова ХОМЕНКО Н. А. — Моек. ИВС им. Мечникова ГОЛУБЕВА И В. — Моек. ИВС им. Мечникова ОСТРОВСКАЯ Д И. — Москов. ГорСЭС |
| ||
|
Типография Хлебоиздата, Москва, Шелепиха, 4-я ул., д. 1а |
|
Страница |
Строка |
Напечатано |
Следует читать |
|
9 |
5 снизу |
Диффсренцио- нальной |
Дифференциальной |
|
14 |
таблица 12 колонка |
Лакмус сив. |
Лакмус сыв. |
а) Взятие крови
Хотя легче всего выделить культуру из крови в течение 1—2 недели заболевания, однако, ее можно выделить на протяжении всего лихорадочного периода и во время рецидивов, увеличивая количество засеваемой крови до 15—20 мл.
Для бактериологического исследования кровь берут в количестве 5—10 мл стерильным шприцем из локтевой вены и засевают на одну из приведенных ниже сред, в соотношении 1 : 10.
Посев крови производят в колбу или флакон емкостью в 100 мл со средами обогащения: 1) желчной средой Рапопорт, 2) бульоном с 10—20°/о желчи (см. приложение).
Среду Рапопорт разливают по 50 мл в колбы или флаконы с поплавками. При отсутствии желчи кровь можно засевать по способу Клодницкого и Самсонова на 80—100 мл стерильной дестиллирован-ной или водопроводной воды.
При получении для исследования уже свернувшейся крови, сыворотка отсасывается и используется для реакции Видаля, а сгусток после измельчения может быть засеян на желчные среды.
б) Взятие желчи (дуоденального содержимого)
Зондирование производят в лечебном учреждении или на бацил-лоносительском пункте. Вопрос о возможности применения этого метода исследования должен каждый раз индивидуально решаться клиницистом.
Взятие проб содержимого двенадцатиперстной кишки производят при помощи дуоденального зонда. Зонд вводят больному или носителю натощак. Через 15 минут после того как из зонда выделится первая порция дуоденального сока, вводят через зонд в двенадцатиперстную кишку 50 мл 30% стерильного раствора сернокислой магнезии. Этот раздражитель вызывает опорожнение желчного пузыря.
Необходимо собрать в отдельные стерильные пробирки порцию А из двенадцатиперстной кишки, порцию В из желчного пузыря и порцию С из желчных притоков.
В лабораторию доставляют пробирки с двумя или тремя порциями (А и В или А, В, С) желчи. Каждую из порций можно посеять отдельно, но можно посеять смесь их.
Дуоденальное содержимое имеет характерное зелено-желтое окрашивание и характеризуется щелочной реакцией, поэтому до посева в пробах проверяют реакцию лакмусовой бумажкой. Если обнаружена кислая реакция и материал исследования представляет собой белую жидкость с хлопьевидным осадком, что характерно для желудочного сока, то материал исследованию не подлежит.
в) Сбор испражнений
Пробы испражнений от больных можно брать из подкладного судна. Судно следует дезинфицировать осветленным раствором хлорной извести (но не лизолом или карболовой кислотой), а затем, перед отбором испражнений для исследований, его многократно и тщательно промывают горячей водой до уничтожения следов дезинфицирующих веществ
Всем здоровым лицам, обследуемым на бактерионосительство, необходимо давать предварительно (за 2—3 часа) 25—30 гр смеси сернокислой магнезии и сернокислого натрия, которая является желчегонной *; сбор испражнений для исследования на носительство производят на стерильные эмалированные тарелки, можно тазы, лотки, картонные тарелки или стаканчики (при массовых обследованиях). Тарелки должны быть снабжены индивидуальными номерами. Производить сбор испражнений ректальными трубками не рекомендуется.
У больных материал для исследования собирают, по возможности, вне периода применения антибиотиков.
Для обнаружения салмонеллезных микробов надлежит брать 10—20 гр жидкой части испражнений, происходящих из верхних отделов кишечника (последнюю порцию). Пробы испражнений собирают стерильными стеклянными лопаточками, палочками, трубочками или деревянными шпаделями в широкие стерильные пробирки со средой обогащения.
При наличии в испражнениях патологических примесей, последние также переносят в среду обогащения. Наиболее употребительными из них являются — 20°/о желчный бульон, среда Мюллера, комбинированная среда Кауфмана (см. приложение).
Если материал не может быть сразу посеян на среды обогащения, то его можно хранить в наливном виде, либо в консервирующей глицериновой смеси (см. приложение) при +2 +6°С в холодильнике, желательно не более 12—24 часов. В консервант помещают не менее 1—2 гр испражнений.
г) С бор мочи
Сбор мочи производят в стерильные флаконы. Для исследования достаточно собрать 20—30 мл мочи. Перед сбором мочи наружные половые органы должны быть тщательно обмыты кипяченой водой и обтерты стерильной ватой или стерильной марлевой салфеткой. Перед посевом мочу центрифугируют и осадок засевают на среды обогащения и плотные диференциальные среды.
д) Посев костного мозга
В отдельных случаях, по особым клиническим показаниям, в условиях больницы, при наличии соответствующего специалиста, можно применить, с диагностической целью, посев костного мозга путем проведения пункции грудины. Полученный материал засевают на среды обогащения.
е) Взятие посевного материла из розеол
Участок кожи с несколькими хорошо выраженными розеолами протирают спиртом, а затем сухой стерильной марлей или ватой. Делают несколько поверхностных царапин на розеолах так, чтобы на них выступили капли лимфы. Капли лимфы стерильной пипеткой засевают в пробирки с желчным бульоном.
) Больным слабительное давать не следует.
II. Посев исходного материала и ход бактериологического исследования
а) Бактериологическое исследование крови
Кровь, засеянную в среду Рапопорт, в желчную среду или дистиллированную воду, помещают в термостат при 37°. При росте сал-монеллезиых микробов в первоначально желтоватой прозрачной среде появляется помутнение. В среде Рапопорт цвет жидкости, при наличии индикатора Андреде, постепенно меняется на красный, что особенно заметно в поплавке. При росте газообразующих микробов в поплавке, кроме изменения дзета, появляется пузырек газа.
Через 10—20 часов необходимо сделать пересев из желчного бульона или другой среды обогащения, на чашки с плотной дифференциальной средой Эндо или Левина.
Со среды Рапопорт можно в конце первых суток сделать нативный препарат для определения подвижности и препарат окрашенный по Граму. При наличии чистой культуры грамотрицательных палочек можно получить ориентировочные данные о тифозной или паратифозной природе их, учитывая изменения цвета среды и образование пузырька газа в поплавке.
Через 18—20 часов просматривают чашки. Если имеется обильный рост чистой культуры, то 2—3 колонии отсевают на косой агар, затем готовят взвесь из нескольких типичных колоний в физиологическом растворе. Взвесь вносят в пробирки со средами Гисса (пестрый ряд) и используют для постановки пробирочной агглютинации. Ориентировочная реакция на стекле ставится с видовыми адсорбированными или неадсорбированными сыворотками 6. Можно рекомендовать вести испытание культур в опыте реакции агглютинации на стекле сначала со смесью салмонеллезных сывороток, а при наличии агглютинации со смесью, испытать культуру отдельно с каждой из сывороток, входящих в данную смесь.
Для постановки реакции агглютинации на стекле с видовой не-адсорбированной сывороткой, последнюю разводят стерильным физиологическим раствором в 25—50 раз. Видовые адсорбированные сыворотки уже разведены и дальнейшему разведению не подлежат. В каплю той или другой сыворотки на стекле вносят петлей небольшое количество культуры. Культуру растирают до равномерной взвеси. Наблюдения ведут в течение 5 минут.
В случае обнаружения чистой культуры грамотрицательных подвижных палочек, агглютинирующихся какой-либо из салмонеллезных сывороток, выдают предварительный положительный ответ.
Для постановки пробирочной агглютинации могут быть использованы только видовые неадсорбировакные сыворотки, так как они обладают высокими титрами. Видовую неадсорбированную сыворотку разводят в агглютинационных пробирках стерильным физиологическим раствором до титра, указанного на этикетке.
Окончательный положительный ответ дается через 54—72 часа мосле учета результатов посева на углеводные среды Гисса и развернутой агглютинации.
При выделении культуры, по морфологическим и биохимическим свойствам подозрительной на палочку брюшного тифа, но не агглютинирующейся брюшнотифозной видовой неадсорбированной сывороткой, следует испытать культуру в реакции на стекле с брюшнотифозной монорецепторной Ви-ангисывороткой. Если выделенная культура содержит Ви-антиген, она может не реагировать с 0 антисывороткой и реагирует только с Ви-антисывороткой. В этом случае дается положительный ответ, который должен быть подтвержден реакцией агглютинации с гретой (1 час при 56°) культурой.
Культуру брюшнотифозной палочки, содержащую Ви-антиген, отсевают на простой бульон для определения фаго-типа (методика типирования фагом дана в приложении).
Если первый высез из сред обогащения отрицательный, то последующие высевы на плотные питательные среды делают через 48 и 72 часа от начала исследования.
Отрицательный ответ выдают после 3 высева (на 6 сутки) с указанием, что посевы в течение 6 суток прошли с отрицательным результатом, а исследование продолжается.
Несмотря на выдачу отрицательного ответа, периодические высевы продолжают до 14 дня, с интервалом в 3—4 дня.
б) Бактериологическое исследование желчи, посевного материала из розеол, испражнений, мочи, трупного материала
Первый день исследования. Производят посев материала на чашки с плотной дифференциальной питательной средой, за исключением материала из костного мозга и розеол, которые первично засевают только в среду обогащения.
Испражнения для посева размешивают в физиологическом растворе (в отношении 1 : 10) и оставляют на полчаса на столе до оседания крупных частиц. Каплю посевного материала следует брать с поверхности жидкости.
При исследовании на бактерионосительство рекомендуется производить одновременный высев мочи и испражнений. При этом свежесобранную мочу в стерильную посуду можно использовать как жидкость для эмульгирования испражнений того же лица. При получении положительного результата в дальнейшем исследование кала и мочи производят раздельно.
Кусочки паренхиматозных органов, полученные от трупа, растирают в стерильной фарфоровой ступке с 1 мл физиологического раствора. Из верхнего слоя жидкости делают посев на плотные дифференциальные среды и на среды обогащения.
При посеве любого исследуемого материала на несколько чашек следует на каждую чашку брать новую порцию.
Наибольшее распространение имеют элективные среды с прибавлением желчных солей — бактоагар Ж, среда Плоскирева, а также высоко элективная для тифозных и паратифозных микробов висмут-
сульфитная среда (Вильсон и Блер). Применяют также среду с эозином и метиленовой синькой в модификации Левина, среду Эндо.
Элективные среды создают благоприятные условия для роста сал-монеллезных микробов, подавляют рост нормальной кишечной флоры, что позволяет значительно увеличить количество посевного материала.
Рекомендуется посев делать на три чашки с различными дифференциальными средами, например: одну с бактоагаром Ж или средой Плоскирева, другую со средой Вильсона и Блера, а третью со средой типа Эндо или Левина.
Если на месте сбора материала не было произведено посева в среду обогащения, то параллельно с высевом на плотные дифференциальные среды нужно немного исследуемого материала поместить в среду обогащения (кроме дуоденального содержимого).
Дуоденальное содержимое помещают в термостат при 37° и параллельно засевают во флакон с 50 мл бульона..
В дальнейшем, в течение 5 дней, производят не менее трех высевов на плотные дифференциальные среды.
В том случае, если средой обогащения служит желчный бульон рекомендуется производить высев на чашки с дифференциальной средой в тот-же день, после 4—6 часов инкубации при 37°С; имеются наблюдения, что содержание желчного бульона при комнатной температуре даже более благоприятно.
Второй день исследования (первые сутки).
Рост прямого посева материала на чашках рассматривают простым глазом или при помощи лупы. Салмонеллезные микробы растут на среде Плоскирева, бактоагаре Ж, среде с эозином и метиленовой синькой в модификации Левина, среде Эндо в виде прозрачных или полупрозрачных бесцветных, иногда слегка голубоватых колоний. На висмут-сульфит агаре (Вильсон и Блер) тифозные и паратифозные А микробы растут в виде мелких серовато-зеленых колоний с черным центром. Колонии паратифозных В микробов и других сал-монелл значительно крупнее, коричневого цвета с металлическим блеском. Все салмонеллезные культуры изменяют цвет среды Вильсон и Блер на черный. Если на среде Вильсон и Блер через 24 часа не имеется характерного роста, чашки оставляют в термостате на 48—72 часа.
3—5 подозрительных колоний отсевают на среду «скошенный столбик с мочевиной» (ом. приложение) или среду Рееселя, или на короткий пестрый ряд (косой агар, среды Гисса с глюкозой и лактозой)7. На ореду Рееселя и скошенный столбик с мочевиной посев делают сначала штрихом по скошенной поверхности, а затем уколом в глубину столбика. Посевы помещают в термостат при 37° до следующего дня.
Производят высев со сред обогащения на чашки с элективными и дифференциальными средами, как описано выше. Засеянные чашки помещают в термостат при 37° на 18—24 часа.
Третий день исследования (вторые сутки). Если на дифференциальных средах в «прямом» посеве и высеве со сред обогащения отсутствуют подозрительные колонии, то дается отрицательный ответ.
Изучение выделенных культур начинают с учета их ферментативной характеристики. Культуры, ферментирующие лактозу и глюкозу при наличии газообразования, отбрасывают (кишечная палочка и ее разновидности). Отбрасывают культуры разложившие в скошенном столбике мочевину, т. е. изменившие цвет среды на коричневато-фиолетовый (при индикаторе тимоловый синий + индикатор Андреде) или до оранжевого (при индикаторе ВР) — протеи, пал. Моргана.
При отсутствии культур подозрительных на микробов рода сал-монелла или дизентерийных, дается отрицательный ответ.
Культуры, ферментирующие только глюкозу с образованием кислоты и газа, т. е. изменяющие цвет среды в красный (при индикаторе Андреде) или синий (при индикаторе ВР) и образующие в среде пузырьки газа, подозрительные как салмонеллезные микробы, испытывают в ориентировочной агглютинации на стекле с набором сал-монеллезных сывороток. Культуры, расщепляющие глюкозу с образованием кислоты без газа, подозрительны как микробы брюшного тифа или дизентерии, их испытывают с брюшнотифозной сывороткой и набором дизентерийных сывороток.
Дальнейшему изучению подвергают .не все выделенные подозрительные культуры, а 2—3, остальные сохраняют до конца исследования. В случае, если культуры изученные в первую очередь приходится отбросить, продолжают исследование сохраненных штаммов. Проверяют морфологию (окраска по Граму) и подвижность в висячей или раздавленной капле. При выявлении грамотрицательных подвижных палочек, культуры пересевают на пробирки со скошенным агаром, а так же на среды Гисса с маннитом, мальтозой8, сахарозой и на простой бульон или на 1% пептонную воду. Можно заменить пробирки с маннитом и сахарозой одной пробиркой со средой по типу среды Ресселя (см. приложение). Для исследования на наличие сероводорода и индолообразование под пробку пробирки с бульоном или с 1% пептоиной водой вкладывают специальные индикаторные бумажки (см. способ приготовления в приложении). Все посевы помещают в термостат вместе с пробирками с лактозой и глюкозой от предыдущего дня.
Агглютинацию на стекле проводят при помощи видовых адсорбированных или неадсорбированных (цельных) сывороток. Применяют сыворотки против представителей наиболее часто встречающихся пяти серологических групп рода салмонелл (А, В, С, Д, Ё), либо можно рекомендовать вести испытание культур в опыте .реакции агглютинации на стекле сначала со смесью салмонеллезных сывороток, как было указано в исследовании крови. В случае положи-
тельной реакции агглютинации с видовыми салмонеллезными сыворотками производят рецепторный анализ выделенной культуры, сначала с соответствующими монорецепторными О-сыворотками, а затем с монорецепторными Н-сыворотками (к специфической фазе). При работе с монорецепторными сыворотками испытуемую культуру тщательно смешивают с каждой сывороткой путем растирания платиновой петлей. После каждой сыворотки петлю прожигают на огне. Положительная реакция агглютинации наступает в течение первой минуты. Для агглютинации с О-сыворотками культуру следует брать с верхней части скошенного агара, для агглютинации с Н-сыворотками из конденсационной воды (наиболее подвижные особи).
Отсутствие или наличие агглютинации на стекле не решает окончательно вопроса о принадлежности культур к тому или иному виду. Свежевыделенные культуры в первых генерациях часто плохо агглютинируются, особенно со среды Плоскирева. С другой стороны, культура, находящаяся в переходной или шероховатой форме, может легко и до высоких титров агглютинироваться гетерологичными сыворотками. Результаты ориентировочной агглютинации дают право только на предварительное заключение. При работе с видовыми неадсорбированными сыворотками, соответственно данным агглютинации на стекле, ставят линейную реакцию агглютинации со смывом культуры со среды Ресселя или скошенного агара. Видовую неадсор-бировакную сыворотку для этой цели разводят в агглютинационных пробирках стерильным физиологическим раствором, начиная от разведения 1 : 100 до титра сыворотки, указанного на этикетке. Агглю-тинационные пробирки выдерживают два часа в термостате, а затем оставляют при комнатной температуре до следующего дня.
Через 48 часов (на вторые сутки), на основании данных о морфологии выделенного микроба, его ферментативной характеристики на коротком пестром ряду и результатов реакции агглютинации на стекле может быть выдан ориентировочный ответ.
ПРИМЕЧАНИЕ: 1. Среди салмонелл иногда встречаются неподвижные варианты, поэтому культуры грамотрицательных, неподвижных, газообраэующих палочек надо испытывать с набором салмонеллезных сывороток.
2. Необходимо также учесть, что среди салмонелл группы «В» встречаются варианты не образующие газ при ферментации углеводов.
3. Если подвижная, беэгазовая, биохимически сходная с брюшнотифозной палочкой культура не агглютинируется брюшнотифозной сывороткой, следует испытать ее с монорецепторной Ви-антисывороткой (см. исследование крови).
Четвертый день (третьи сутки) исследования. Отмечают изменения углеводных сред Гисса, образование сероводорода и индола (см. приложение — таблицу ферментативных свойств). Если культура расщепляет сахарозу, образует индол (покраснение индикаторной бумажки), то она отбрасывается как непатогенная и дается отрицательный ответ.
Учитывают линейную реакцию агглютинации при помощи агглю-тиноскопа или лупы. При работе с видовыми адсорбированными сывороткам по возможности ставят реакцию агглютинации на стекле повторно.
Четвертый день (72 часа) является днем выдачи окончательно то ответа.
Основанием для выдачи положительного ответа служат данные морфологии микроба, ферментативной характеристики и отчетливые результаты агглютинации на стекле с адсорбированными сыворотками, позволяющими определить вид культуры.
При работе с видовыми неадсорбированными сыворотками положительный ответ выдается при наличии типичной биохимической характеристики и положительной реакции линейной агглютинации не ниже Va титра сыворотки. При агглютинации ниже Va титра положительный ответ может быть дан лишь при наличии положительной агглютинации о монорецепторными О и Н сыворотками.
При фаготипировании культуры брюшного тифа в ответе указывается также фаготип.
Исследование со сред обогащения ведется аналогично вышеописанному, но на один день позже.
Для установления вида салмонеллезных микробов группы «В» иногда бывает недостаточно провести биохимическое изучение и обычный серологический анализ. Для дополнительной дифференциации, например, микробов S. paratyphi В, S. typhimurium, S. Heidel-oerg хорошими дифференциальными признаками являются феномен валообразования, феномен врастания в агар и поведение на среде Биттера с рамнозой.
Культуры засевают на чашки с простым агаром (pH 7,4—7,6) так чтобы рост был в виде отдельных колоний. Посевы выдерживают в термостате 24 часа, а затем 1—2 суток при комнатной температуре. Чашки просматривают с помощью лупы. Вокруг отдельных колоний S. paratyphi В появляются возвышающиеся над поверхностью колоний слизистые валики, сильно преломляющие свет—положительный феномен валообразования. У S. typhimurium иБ. Heidelberg образование таких валиков вокруг колоний не наблюдается.
При отсутствии валообразования колонии на чашках смывают физиологическим раствором. Наличие углублений в агаре на месте смытой колонии характерно для микробов S. typhimurium, положительный феномен врастания колоний. Колонии микробов S. paratyphi В. S. Heidelberg не врастают в агар.
Культуру засевают на среду Биттера с рамнозой (см. приложение). К суточной культуре добавляют несколько капель 1,5% спиртового раствора метилрота. S. typhimurium и S. Heidelberg дают красное окрашивание. S. paratyphi В — желтое.
Идентификация выделенных культур не представляет затруднений, если их биохимические и серологические свойства совпадают с характеристикой одного из видов рода салмонелл. Однако, нередко возникают затруднения при определении культур невполне типичных.
В случаях отклонений от указанных положений культуры подлежат дальнейшему изучению, о чем выдается ответ по следующей форме: «Выделена культура, подозрительная по принадлежности к роду салмонелл. Исследование продолжается».
Наиболее частый случай отклонения от типичной характеристики
1
Набор типовых фагов выпускает Тбилисский институт вакцин и сыво роток.
2
Тест-разведение типового фага определяется титрованием каждого фага с соответствующей культурой и является последним разведением, вызывающие полный лизис культуры на плотной среде
3
*)' Выпускает Ленинградский Институт эпидемиологии, микробиологии нм. Пастера.
4
Выпускает Московский институт вакцин и сывороток им. Мечникова.
5
Выпускает Московский институт эпидемиологии, микробиологии и гигиены Министерства здравоохранения РСФСР.
6
Номенклатура агглютинирующих сывороток, принятая-Мииздравом СССР в 1955 г., дана в приложении.
7
Подозрительные колонии со среды Вильсон и Блер снимаются на среды не содержащие мочевину.
R
8
При массовых исследоиамимэсидовпмми среды с мальтозой не обязательно.