Временное наставление по лабораторной диагностике гриппа лошадей
Купить бумажный документ с голограммой и синими печатями. подробнее
Цена на этот документ пока неизвестна. Нажмите кнопку "Купить" и сделайте заказ, и мы пришлем вам цену.
Распространяем нормативную документацию с 1999 года. Пробиваем чеки, платим налоги, принимаем к оплате все законные формы платежей без дополнительных процентов. Наши клиенты защищены Законом. ООО "ЦНТИ Нормоконтроль"
Наши цены ниже, чем в других местах, потому что мы работаем напрямую с поставщиками документов.
Способы доставки
- Срочная курьерская доставка (1-3 дня)
- Курьерская доставка (7 дней)
- Самовывоз из московского офиса
- Почта РФ
Оглавление
Предисловие
I. Выделение вируса на развивающихся куриных эмбрионах
А. Взятие, пересылка и подготовка материала
Б. Заражение куриных эмбрионов
II. Идентификация вируса в реакции торможения гемагглютинации (РТГА)
А. Приготовление сыворотки к работе
Б. Приготовление 1 %-ной суспензии эритроцитов кур
В. Постановка реакции гемагглютинации
Г. Идентификация вируса с РТГ
III. Установление специфических антител (антигемагглютининов) в сыворотке переболевших животных к вирусу гриппа лошадей
А. Получение и приготовление сывороток
Б. Установление специфических антител в сыворотках животных-рекопвалесцентов в реакции торможения гемагглютинации с помощью типоспецифических гриппозных антигенов
| Дата введения | 01.01.2021 |
|---|---|
| Добавлен в базу | 01.02.2020 |
| Актуализация | 01.01.2021 |
Этот документ находится в:
- Раздел Экология
- Раздел 11 ЗДРАВООХРАНЕНИЕ
- Раздел 11.220 Ветеринария
- Раздел 11 ЗДРАВООХРАНЕНИЕ
Организации:
| Издан | Агропромиздат | 1987 г. |
Чтобы бесплатно скачать этот документ в формате PDF, поддержите наш сайт и нажмите кнопку:

стр. 1

стр. 2

стр. 3

стр. 4

стр. 5

стр. 6

стр. 7

стр. 8

стр. 9
стр. 10

стр. 11

стр. 12

стр. 13

стр. 14

стр. 15

стр. 16

стр. 17

стр. 18

стр. 19
СПР/ТО
Ш
АБОРАТОРНЫЕ ИССЛЕДОВАНИЯ В ВЕТЕРИНАР ИИ
ВИРУСНЫЕ, РИККЕТСИОЗНЫЕ И ПАРАЗИТАРНЫЕ БОЛЕЗНИ
СПРАВОЧНИКЛАБОРАТОРНЫЕ ИССЛЕДОВАНИЯ В ВЕТЕРИНАРИИ
ВИРУСНЫЕ, РИККЕТСИОЗНЫЕ И ПАРАЗИТАРНЫЕ БОЛЕЗНИ
Под редакцией Б. И. АНТОНОВА
т
эии эритроцитов, доски легко встряхивают и оставляют на 30 мин при комнатной температуре. При правильном выборе рабочей дозы (4 АЕ) в !-й, 2-й, 3-й лунках должна быть полная агглютинация эритроцитов (зонтик); в 4-й лунке агглютинация может быть частичной или отсутствовать, а в 5-й лунке агглютинация не должна быть. Если в 4-й лунке оказывается полная агглютинация, а в 5-й частичная или отсутствует — это означает, что выбранная доза вируса содержит не 4 АЕ, а больше (8 АЕ). В этом случае и доза должна быть соответственно уменьшена вдвое, т. е. следует взять 0,2 мл следующего разведения и повторно проверить рабочую дозу, Особенно важно, чтобы в 3-й лунке, где должна быть 1 АЕ вируса, была бы полная агглютинация. Если в ней агглютинация не полная, то выбранная рабочая доза вируса содержит меньше 4 АЕ в 0,2 мл и должна быть увеличена и повторно проверена.
Г. Идентификация вируса с РТГ.
27. Схема постановки РТГА сводится к следующему (рис. 3): в ряд лунок, начиная со второй, наливают по 0,2 мл физиологического раствора; затем в первую и вторую лунки добавляют по 0,2 мл заведомо известной приготовленной сыворотки в разведении 1 : 10; во второй лунке пипетируют и переносят 0,2 мл смеси в третью н т. д. до разведения 1 : 2560; из последней лунки удаляют 0,2 мл в дезинфицирующий раствор. После этого во все лунки вносят но 0,2 мл рабочего разведения (4 АЕ) испытуемого вируса. Доски с лунками встряхивают и оставляют при комнатной температуре на 30 мин. После тридцатиминутного контакта сыворотки с вирусом в каждую лунку добавляют по 0,4 мл 1 %-ной суспензии эритроцитов.
28. Для точности учета РТГ ставят контроль:
|
noO.Znn по О,1* мп |
|
Учет реакции (титр антисыворотки (:1280( |
1) контроль сыворотки для исключения присутствия гсмагглю-тннинов к куриным эритроцитам (0,2 мл сыворотки в разведении
Физраствор бнтисыбо-рН7,2'7/> ---
|
Контроль эритроцитоб на спонтанную агглютинацию | |||||
| |||||
|
Физраствор по 0,2мп Зритроцитоб по 0,2ма |
шш то,5щж
ПО № ЬНО т Физраствор поО,2мп Антисыворотки поО,2мп Зритроцитов no Ofirtn
Рис. 3. Схема постановки реакции торможения гемагглютинации.
1 : 10, 0,2 мл физиологического раствора и 0,4 мл 1 %-ной суспензии эритроцитов);
2) контроль избранной дозы вируса (0,2 мл рабочей дозы вируса (4 АЕ), 0,2 мл физиологического раствора и 0,2 мл 1 %-ной суспензии куриных эритроцитов);
3) контроль стандартных диагностикумоз (антигена 0,2 мл + +0,2 мл гомологичной сыворотки+0,4 мл 1 %-ной суспензии эритроцитов) ;
4) контроль эритроцитов на спонтанную агглютинацию (0,2 мл физиологического раствора и 0,2 мл I %-ной суспензии эритроцитов).
29. Титром сыворотки считается последнее разведение ее, давшее полную задержку гемагглютинации. Идентификацию возбудителя считают завершенной, если заведомо активная диагностическая сыворотка набора тормозит гемагглютинируюшую активность испытуемого полевого штамма вируса в пределах целого или ‘/а—'/в титра.
30. На выделение и идентификацию вируса необходимо 3—10 дн.
III. Установление специфических антител (анти-гемагглютининов) в сыворотке переболевших животных к вирусу гриппа лошадей
31. Изучение парных сывороток в реакции торможения гемагглютинации является ценным и чувствительным методом диагностики, дающим возможность ретроспективно установить этиологию перенесенного заболевания.
32. Парные сыворотки исследуют на 10—14-й день после проявления первых клинических признаков заболевания и на 21-й день после первого взятия сыворотки.
33. Для исследования парных сывороток в реакции торможения гемагглютинации необходимо иметь: типоспецифические антигены гриппа лошадей; исследуемые парные сыворотки; физиологический раствор поваренной соли, pH 7,2—7,4; 1 %-ную суспензию эритроцитов петуха; доски из плексигласа или бактериологические пробирки; пипетки 2,0 и 10,0 мл; 30 %-ную соляную кислоту; мел; аппарат Киппа (рис. 4).
Типоспецифические сухие гриппозные антигены имеются в диагностическом наборе.
|
Рис. 4. Типы капельных воронок, заменяющих аппарат Киппа для получения СО* |
А. Получение и приготовление сывороток.
34. Кровь от лошадей берут стерильно в области верхней трети шеи (яремной вены) в пробирки, увлажненные физиологическим раствором. Полученную кровь выдерживают 2—3 ч при комнатной температуре, осторожно по стенке пробирки обводят иглой и ставят в прохладное помещение с температурой не выше 10°С. Через 12— 24 ч сыворотку отсасывают в стерильную пробирку, добавляют мер-тиолят в количестве 1 : 20 ООО.
35. Перед использованием сыворотки в РТГА ее разводят дистиллированной водой 1:10 (т. е. 0,5 мл сыворотки+4,5 мл диет, воды). Разведенную сыворотку прогревают при температуре 56°С в течение 30 мин, обрабатывают углекислым газом, как описано в разделе II, А.
36. Приготовление однопроцентной суспензии эритроцитов кур аналогично описанному в разделе II, Б.
37. Постановка реакции гемагглютинации (описана в разделе II, В), поставленная с антигеном из ампул, разведенным 1,0 мл физиологического раствора,
Б. Установление специфических антител в сыворотках жнвотпых-рекопвалесцентов в реакции торможения гемагглютинации с помощью типоспецифических гриппозных антигенов.
38. Схема постановки реакции торможения гемагглютинации описана в разделе II, Г,
39. Титром сыворотки считается последнее разведение ее, давшее полную задержку гемагглютинации с одним из заведомо известным антигеном.
40. Штаммовая принадлежность определена, если испытуемая сыворотка тормозит гемагглютиннрующую активность диагностического антигена в пределах целого или V*—7в его титра с гомологичной диагностической сывороткой, при отсутствии реакции с другим антигеном или же в реакции не выше 1 :20. Ретроспективно диагноз на грипп может быть поставлен, если частное от деления гемагглютинирующего титра испытуемой сыворотки, взятой на 30-и день после заболевания, на титр сыворотки, взятой в начале заболевания, будет соответствовать 4-кратному увеличению титра сыворотки.
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
|
Агар мясо-пептонный 83, 92 Альбумин бычий 63, 64 Аппарат Киппа 35, 39 Бульон мясо-пептонный 92 — триптозно-фосфатный 113 Гемолизин 105 Гемолитическая система (гем- система) 56, 105 Жидкость Барбагалло 170, 188 — Руге 127 Иммуноасцитическая жидкость (ИАЖ) 13 Йодный реактив Мелена 79 Комплемент 16, 24, 105 Метод гельминтоскопии 164, 176 — биопсии 176 — биохимический 179, 187 — Вишняускаса 160 — Гнединой 175 — Ковоана 175 — комбинированный 177 — микроагглютинации с помощью аппарата Такачи 85, 105 — раздавленной капли 198, 204, 210, 213, 215, 226 — световой микроскопии (три-хинеллоскопии) 179 — седиментации с целлофановыми пленками 160 — Щербовича 185 — Фюллеборна 183 Методика Бермана 171, 183 — Кивако 176 — комбинированная в модификации Котельникова и Хренова 173 Методика культивирования личинок стронгилят и лавроско-пии 168 — седиментации с центрифугированием по Котельникову, Корчагину и Хренову 172 — упрощенная модификация методики Бермана 171 — флотации 160, 164, 166, 176 |
Окраска гистопрепаратов по Ленцу 1! ---Туревичу 11 — мазков по Борману —Гайнуллиной 7 ---Бурри 227 ---Лейшману 225, 228 --— Михину 6 ---Морозову 127 ---Муромцеву 6 ---Нохту 70 ---Паппенгейму 70 ---Пашену 127 ---Романовскому 191, 199, 211, 215, 216, 225, 228 ---Романовскому — Гим- эе 21 --- Селлерсу 6 — --Стемну 21 ■---Щуренковой 191 Перевиваемая линия почки свиньи (СПЭВ) 92 Первично-трипсинизированная культура клеток почки свиньи (ПЭС) 41, 92 --эмбриона коров (ПЭК) 58 --тестикулов бычка (ТБ) 58 Раствор азотнокислого натрия 185 — азотнокислого свинца 159, 160, 173 — азотнокислого серебра 127 — Альсевера 96 Раствор аммиачной селитры 164, 166, 173, 176 — борной кислоты 184 — буферный борантный 157 — веронал-мединаловый 12, 13, 149 — гексаметафосфата 56, 61 — гипосульфита натрия 185 — забуференного глицерина 181 — забуференный физиологический (ЗФР) 82 — лимоннокислого натрия 97 — мертиолята 40, 98, 156 — сернокислого цинка 160, 171, 172 — соляной кислоты 179 |
|
— уксусной кислоты 177 — фосфатно-буферный 9, 66, 96 — Хенке 63, 81 —- хлорида цинка 177 — электролита 68 — Эрла 100 Реакция гемагглюгннацин (РГА) 36, 60 — гемадсорбции (РГАд) 42, 59 Среда 199, 81, 92 — 0,5 %-ного гидролизата лак-тальбумина 81, 92, 113 — Игла 97, 100 — диффузионной преципитации (РДП) 55, 61, 141, 155 — длительного связывания комплемента (РДСК) 16, 23, 9ft — ЙАТ 151 — иммунофлуоресценции (ИФ) 54, 79, 80, 91, 111 — иммуноэлектроосмиофореза (РИЭОФ) 147 —кольцепреципитации в капилляре 182 — нейтрализации (PH) 42, 81, 91, 94, 115, 117 — нейтрализации вирусных гемагглютинииов (РНВГ) 63 — непрямой гемагглютинации (РИГА) 64, 65, 66, 82, 84 — непрямой иммунофлуоресценции 180 — подавления иммунофлуоресценции 54, 91 — радиальной иммунодиффу-вии (РРИД) 71, 76, 78 диагиостикум — связывания комплемента (РСК) 23, 24, 56, 57, 192, 199, 219 |
--конглютинирующего комплекса 207 — торможения гемагглютинации (Р'ГГА, или РЗГА) 43, 60 --гемадсорбции (РТГАд) 42, 60 --непрямой гемагглютииа- ции (РТНГА) 62, 63, 142 — формалиновая 205, 226 ■— Игла (МЕМ) 113 — Кнтта — Тароцци 83, 92 — пептонно-агаровая 211 — Петровского 211 — поддерживающая 87, 92 — ростовая 92 — Сабуро 134 Тельца Бабеща — Нсгри 5, 6 Тканевая цитопатическая доза (ТЦД) 64, 103 Термолабильные ингибиторы 35, 95 Термостабильные ингибиторы 35, 95 Цитопатическое действие (ЦПД) 58, 81, 87, 93 Эритроцитарный |
СОДЕРЖАНИЕ
Предисловие........ 3
МЕТОДЫ ДИАГНОСТИКИ ВИРУСНЫХ И РИККЕТСИОЗНЫХ ИНФЕКЦИИ
Болезни, общие для всех видов животных...... 5
Бешенство......... 5
Методические указания по лабораторной диагностике бешенства . 5
Болезнь Ауески .............12
Методические указания по лабораторной диагностике болезни Ауески животных.........12
Лихорадка Ку........... . 16
Методические указания по серологической диагностике лихорадки Ку животных....... 16
Хламидийные инфекции ...........20
Методические указания по лабораторным исследованиям на хламидийные инфекции сельскохозяйственных животных 20
Болезни лошадей............33
Грипп .......... 33
Временное наставление по лабораторной диагностике гриппа лошадей . 33
Ринопневмония.............40
Методические указания по лабораторной диагностике ри-
нопневмонии лошадей..........40
Инфекционная анемия ........... 44
Временные методические указания по лабораторной диагностике инфекционной анемии лошадей.....44
Методика постановки реакции диффузионной преципитации (РДП) для серологической диагностики инфекционной
анемии лошадей........ 43
Болезни крупного и мелкого рогатого скота.....51
Респираторно-кишечные инфекции крупного рогатого скота . 61
Методические указания по лабораторной диагностике вирусных респираторно-кишечных инфекций крупного рогатого скота .............51
Методические указания по серодиагностике инфекционного ринотрахеита крупного рогатого скота в реакции непрямой гемагглютинации (РИГА) ... ..... 65
Лейкоз крупного рогатого скота....... 67
Методические указания по диагностике лейкоза крупного рогатого скота............67
Аденоматоз овец и коз...........76
Временные методические указания по лабораторной диагностике аденоматоза овец и коз.......76
Временная методика постановки реакции по определению
гиперпротеинемии у овец и коз.......79
Болезни свиней ............. 79
Вирусный (трансмиссивный) гастроэнтерит.....79
Методические указания по лабораторной диагностике вирусного (трансмиссивного) гастроэнтерита свиней . , 79
Временное наставление по применению набора для серо-диагностики трансмиссивного гастроэнтерита свиней . . 84
Энтеровирусный гастроэнтерит . . . 86
Методические указания по лабораторной диагностике энте-
ровирусного гастроэнтерита свиней ...... 86
Грипп...............89
Наставление по применению набора антигенов и сывороток
для диагностики гриппа свиней.......89
Энзоотический энцефаломиелит (болезнь Тешена) ... 91
Методические указания по лабораторной диагностике энзоотического энцефаломиелита (болезни Тешена) свиней 91
Парвовирусная болезнь...........95
Методические указания по диагностике парвовирусной болезни свиней............95
Болезни птиц.............97
Болезнь Марека (нейролимфоматоз птиц).....97
Методические указания по лабораторной диагностике болезни Марека (нейролимфоматоза) птиц.....97
Вирусный энтерит гусят ...........102
Методические указания по лабораторной диагностике вирусного энтерита гусят..........102
Лейкоз птиц..............104
Временное наставление по лабораторной диагностике лейкоза птиц............. 104
Оспа птиц..............125
Методические указания по лабораторной диагностике оспы птиц..............125
Инфекционный ларннготрахеит кур....... 128
Временное наставление по лабораторной диагностике инфекционного ларинготрахеита кур ....... 128
Временные методические указания по определению биологической активности вирусвакцины из штамма ВНИИБТ против инфекционного ларинготрахеита птиц .... 132
Инфекционный бронхит кур.........138
Наставление по лабораторной диагностике инфекционного
бронхита кур............138
Болезни пушных зверей и пчел........ 145
Миксоматоз кроликов...........145
Временные методические указания по лабораторной диагностике мнксоматоза кроликов........145
Алеутская болезнь норок (плазмоцитоз)......147
Наставление по применению набора антигена и контрольных сывороток в реакции иммуноэлектроосмофореза для серологической диагностики алеутской болезни норок . 147
Наставление по прижизненной диагностике алеутской болезни норок при помощи йодно-агглютинационного теста 151
Трансмиссивная энцефалопатия норок.......152
Временные методические указания по лабораторной диагностике трансмиссивной энцефалопатии норок . . 152
Вирусный энтерит норок..........154
Временные методические указания по гистологическому исследованию на вирусный энтерит норок.....154
Гепатит песцов, лисиц и собак.........155
Временное наставление по постановке реакции диффузионной преципитации (РДП) в агаровом геле для диагностики вирусного гепатита песцов, лисиц и собак ... 155
Острый паралич пчел и заболевание, вызываемое нитевидным
вирусом пчел.............157
Методические указания по постановке реакции диффузионной преципитации (РДП) в агаровом геле для диагностики острого паралича пчел и заболевания, вызываемого нитевидным вирусом пчел..........157
ПАРАЗИТАРНЫЕ БОЛЕЗНИ
Гельминтозы........... 159
Методические указания по диагностике гельминтозов животных ..............159
Методические указания по лабораторным исследованиям
на гельминтозы плотоядных........176
Трихинеллез..............179
Методические указания по лабораторной диагностике трихинеллеза животных..........179
Временное наставление по применению реакции непрямой иммунофлуоресцепции для прижизненной диагностики
трихинеллеза свиней .......... 180
Трихинеллез клеточных пушных зверей и его диагностика 182 Приложение к «Инструкции по профилактике ликвидации трихинеллеза в звероводческих хозяйствах (фермах)» . 182
Стронгилоидоэ.............183
Методические указания по лабораторным исследованиям
на стронгилоидоэ животных........ 183
Телязноз...... 184
Методические указания по лабораторным исследованиям
на телязиоз крупного рогатого скота......184
Акантоцефалезы ............185
Методические указания по лабораторным исследованиям на акантоцефалезы животных (макроканторинхоз свиней, полиморфоз, филиколлез водоплавающих птиц) ... 185
Промежуточные (дополнительные) хозяева.....186
Методические указания по лабораторным исследованиям промежуточных (дополнительных) хозяев на личинки гельминтов ....... 186
Лротозоозы..............190
Пироплазмидозы..... 190
Извлечение из временной инструкции о мероприятиях по
борьбе с пироплазмидозами животных.....190
Анаплазмоз крупного и мелкого рогатого скота .... 191
(Приложение № I к «Инструкции по борьбе с анаплазмозом крупного и мелкого рогатого скота»).....191
Методика постановки РСК для диагностики анаплазмоза крупного и мелкого рогатого скота......192
Эперитрозооноз ............. 194
Методические указания по лабораторным исследованиям
на эперитрозооноз овец.........194
Трипанозомозы.............198
Методические указания по лабораторным исследованиям на случную болезнь лошадей, ослов, мулов .... 198
Извлечение из инструкции по борьбе с трипанозомозом верблюдов, лошадей, ослов, их гибридов и собак . . . 204
Временные Методические указания по постановке и учету реакции связывания конглютинирующего комплекса (РСКК) для диагностики су-ауру у верблюдов . . . 207
Трихомоноз..............209
Методические указания по лабораторной диагностике трихомоноза крупного рогатого скота.......209
Балантидиоз .............212
Извлечение из временной инструкции о мероприятиях по борьбе с заболеванием свиней балантидиозом . . . 212
Гистомоноз..............213
Методические указания по лабораторным исследованиям на гистомоноз (тифлогепатит) птиц . . . . . . 213
Токсоплазмоз.............216
Методические указания по лабораторным исследованиям
на токсоплазмоз животных........216
Временное наставление по применению токсоплазменного антигена КазНИВИ и ИЗ АН КазССР в реакции связывания комплемента (РСК, РДСК) для серологической диагностики токсоплазмоза и токсоплазмоносительства у
животных.............219
Лейшманиоз...... 224
Методические указания по лабораторным исследованиям
на лейшманиоз собак..........224
Боррелиоз (спирохетоз) птиц ......... 226
Методические указания по лабораторным исследованиям
на боррелиоз (спирохетоз) птиц....... 226
Безноитиоз крупного рогатого скота ....... 227
Методические указания по лабораторным исследованиям
на безноитиоз крупного рогатого скота.....227
Акариозы ..............228
Саркоптоидозы.............228
Извлечение из инструкции о мероприятиях по борьбе с cap.
коптоидозами (чесоткой) овец и коз...... 228
Извлечение из инструкции о мероприятиях по борьбе с саркоптоидозами (чесоткой) пушных зверей и кроликов . 229
Извлечение нз инструкции о мероприятиях по предупреждению и ликвидации саркоптоза свиней.....230
Извлечение из инструкции по профилактике и ликвидации заболевания северных оленей чесоткой (саркоптозом) , 231
Инвазионные болезни пчел ....... 232
Нозематоз.............. 232
Методические указания по лабораторным исследованиям
на нозематоз медоносных пчел.......232
Предметный указатель ...........235
ББК 48.73 Л12
УДК 619: 616.98/.99 (031)
Составители: Б. И. Антонов, В. В. Борисова, Л. П. Каменева, Л. И. Ковалерчук, Г. А. Михальский, В, Д. Пев• нева, Л. И. Прянишникова.
Лабораторные исследования в ветеринарии: Ви« Л12 русные, риккетсиозные и паразитарные болезни: Справочник/Под ред. Б. И. Антонова. — М.: Агро-промиздат, 1987.—-240 с.: ил.
В книге даны методы лабораторного исследования патологического ма!ермала с целью определения возбудителей вирусных, риккетсиозных и паразитарных болезней животных. Они изложены по единой схеме. Методы унифицированы и стандартизированы.
3805020000—166 035(01)—87
332-87
ББК 48.73
Для ветврачей и фельдшеров, лаборантов ветеринарных лабораторий.
ЛАБОРАТОРНЫЕ ИССЛЕДОВАНИЯ В ВЕТЕРИНАРИИ: ВИРУСНЫЕ, РИККЕТСИОЗНЫЕ И ПАРАЗИТАРНЫЕ БОЛЕЗНИ
Справочник
Составители; Борис Иванович Антонов, Валерия Валентиновна Борисова, «Людмила Петровна Каменева и др.
Зав. редакцией В. Г. Федотов. Редактор В. //. Сайтаниди. Художественный редактор Н. А. Никонова. Технический редактор И. А. Зубкова. Корректор И. В. Карпова
И Б № 5093
Сдано в набор 02.10.86. Подписано к печати 22.01.87. Т-00912. Формат
84X108711. Бумага тип. JV* 2. Гарнитура Литературная. Печать высокая. Уел. псч. л. 12,6. Уел. кр.-отт. 12,6. Уч.-иэд. л. 18,25. Изд. № 226. Тираж 33 000 экз. Заказ .Ns 668. Цена 1 р. 10 к.
Ордена Трудового Красного Знамени ВО «Агропромнздат», 107807, ГСП, Москва, Б-53, ул. Садовая-Спасская, 18
Владимирская типография Союэполиграфпрома при Государственном комитете СССР по делам издательств, полиграфии и книжной торговли 600000, г. Владимир, Октябрьский проспект, д. 7
© ВО «Агропромнздат», 1987
ПРЕДИСЛОВИЕ
Успешное выполнение намеченной XXVII съездом КПСС широкой программы развития в нашей стране агропромышленного комплекса в немалой степени зависит от хорошей организации ветеринарного обслуживания животноводства, четко налаженной работы ветеринарных диагностических лабораторий. Проводимые в лабораториях исследования позволяют правильно организовать мероприятия по предупреждению инфекционных и инвазионных болезней, а в случаях возникновения заболевания своевременно поставить диагноз и принять целенаправленные меры по его быстрейшей ликвидации.
В работе ветеринарных лабораторий все большее применение находят современные методы исследований, одновременно идет совершенствование диагностики многих заболеваний, предлагаются новые более чувствительные и достоверные методы, позволяющие полнее и на ранних стадиях выявлять заболевших животных и тем самым способствовать быстрейшему оздоровлению хозяйств.
Специалисты лабораторий постоянно расширяют перечень показателей и болезней, на которые проводятся исследования.
За последнее время утверждено значительное количество инструктивных документов по проведению лабораторных исследований, что позволило более четко организовать работу специалистов, улучшить качество исследований, получать сопоставимые результаты.
Оснащение лабораторий современным оборудованием позволяет внедрять в работу более точные инструментальные методы.
В своей работе ветеринарные лаборатории не могут использовать всего многообразия предлагаемых методов исследования из-за того, что они или недостаточно апробированы, или из-за сложности используемого оборудования. Имеют место случаи, когда предлагаемые различными авторами методы при определении одних и тех же показателей дают несовпадающие результаты. Поэтому в настоящий справочник включены методы лабораторных исследований патологического материала, полученного от больных, убитых или павших сельскохозяйственных животных, апробированные Центральной ветеринарной лабораторией и утвержденные в разные годы бывшим Министерством сельского хозяйства СССР.
Книга содержит методические указания по диагностике вирусных, риккетсиозных, хламидиозиых болезней, а также методические указания по лабораторной диагностике паразитарных болезней животных и пчел.
Методики излагаются по единой схеме: взятие и пересылка патологического материала, методы его обработки, микроскопические исследования, включая световую и люминесцентную микроскопию, выделение возбудителей на куриных эмбрионах и культурах клеток, заражение лабораторных животных, гистологические исследования, идентификация и дифференциация возбудителей с использованием различных методов, определение биологической активности вакцин и исследования на напряженность иммунитета.
Методы лабораторных исследований, представленные и справочнике, унифицированы и стандартизированы, что создает возможность для стандартизации аппаратов, приборов, инструментов, посуды, реактивов, биопрепаратов и другого специального имущества, определения объема подготовки специалистов и степень оснащения ветеринарных диагностических лабораторий. Таким образом, стандартизация методов исследования является способом наведения строгого порядка в ветеринарной лабораторной работе.
БОЛЕЗНИ ЛОШАДЕЙ
ГРИПП
Временное наставление по лабораторной диагностике гриппа лошадей
(Рекомендовано 15 января 1973 г.)
Грипп лошадей — высококонтагиозное инфекционное вирусное заболевание, характеризующееся коротким инкубационным периодом, кратковременной высокой лихорадкой, общим угнетением, сильным сухим кашлем и конъюнктивитом.
Клинически грипп лошадей трудно диагностировать, поскольку он имеет сходство с другими респираторными заболеваниями лошадей как вирусной, так и невирусной этиологии.
Лабораторная диагностика гриппа лошадей основана на:
1) выделении вируса на развивающихся куриных эмбрионах;
2) идентификации вновь выделенного вируса в реакции торможения гемагглютинации с типоспецифическими гриппозными сыворотками;
3) установлении специфических антител в парных сыворотках животных.
Для лабораторной диагностики используют специальный диагностический набор, который состоит из антигенов и позитивных сывороток.
Антигены представляют собой инактивированную лиофилизиро-ванную внруссодержащую аллантоисную жидкость. Антигены готовит из штаммов A Equi-2/Miami/63 и A Equi-l/Cambridge/63, соответствующих двум антигенным разновидностям.
Антигемагглютинирующие — лиофилнзированные гипериммун-иые сыворотки кроликов, полученные на два указанных штамма: A Equi-2/Miami/63 и A Equi-l/Cambridge/63,
I. Выделение вируса на развивающихся куриных
эмбрионах
А. Взятие, пересылка и подготовка материала.
1. С целью выделения вируса используют носовые смывы от больных лошадей в первые 2—3 дня от начала заболевания. Материал из носовых полостей берут стерильными тампонами, смоченными физиологическим раствором поваренной соли. Такими тампонами тщательно протирают носовые ходы и опускают их в пробирки.
2. Если транспортировка материала продолжается более 4 ч, тампоны следует поместить в термос со льдом и в таком виде доставить в лабораторию для исследования.
3. В лаборатории тампоны тщательно отжимают. Полученную жидкость, содержащую слизь, обрывки ткани и другие аморфные частицы, центрифугируют при 4 тыс. об/мин в течение 15 мин. Над-осадочную жидкость отсасывают в стерильные пробирки, добавляют антибиотики (пенициллин и стрептомицин) по 500 ЕД/мл и выдерживают при 4°С в течение одного часа, после чего используют для заражения куриных эмбрионов.
Б. Заражение куриных эмбрионов.
4. Для заражения используют эмбрионы 9—10-дневного срока инкубации. Для исследования одной пробы материала заражают не менее 6 эмбрионов.
5. Перед заражением эмбрионы предварительно овоскопирукл карандашом на скорлупе отмечают границу воздушного пространства (пути). Сбоку яйца между кровеносными сосудами отмечают участок для прокола скорлупы и инокуляции испытуемого материала. Отобранные для заражения эмбрионы переносят в бокс. Скорлупу со стороны пуги и участок, где намечено производить прокол и введение материала, тщательно протирают спиртом и обжигают. В центре воздушного пространства и в месте введения материала сбоку пробойником делают отверстия, затем через боковое отверстие на глубину 2—3 мм вводят испытуемый материал в объеме 0,2 мл.
7. Перед вскрытием скорлупу над воздушным пространством дезинфицируют. Затем на границе с пугой стерильными ножницами срезают скорлупу, осторожно пинцетом снимают подскорлупную оболочку, разрывают хорионаллантоис, отгибая в стороны на края скорлупы разорванные участки мембраны. Из одного куриного эмбриона можно собрать 6—9 мл эмбриональной жидкости.
6. После заражения эмбрионов отверстия в скорлупе заливают парафином и переносят их в термостат, где инкубируют в течение 72 ч при температуре 37,5 °С. В процессе инкубации их овоскопиру-юг один раз в сутки, погибшие эмбрионы до вскрытия сохраняют в холодильнике при 4°С. На третий день инкубации все погибшие и выжившие эмбрионы вскрывают после предварительного их охлаждения при 4°С в течение 8 ч.
8. Контроль на стерильность взятых образцов эмбриональной жидкости производят путем посева 0,2 мл ее на МПА и МПБ. Посевы выдерживают в термостате в течение 5 дн. Помимо того, взятые из каждого эмбриона образцы эмбриональной жидкости проверяют на гемагглютинирующую активность. При наличии гемагглю-тинации и отсутствии бактериального загрязнения образец взятой жидкости титруют в реакции гемагглютинации. Если титры ГА выделяемого вируса низки, проводят еще 2—3 дополнительно слепых пассажа его на куриных эмбрионах. При отсутствии ГА активности выделяемого вируса после 2—3 пассажей дальнейшее выделение вируса из данного образца исследуемого материала прекращают.
Идентификацию выделенного вируса проводят в реакции торможения гемагглютинации с заведомо известными типоспецифическими сыворотками вируса гриппа лошадей.
II. Идентификация вируса в реакции торможения гемагглютинации (РТГА)
9. Реакция торможения гемагглютинации применяется для идентификации вновь выделенного вируса, обладающего гемагглютини-рующей активностью с заведомо известными специфическими гриппозными сыворотками, и для определения специфических антител ь сыворотках реконвалесцентов.
J0. Для постановки реакции торможения гемагглютинации необходимо иметь: типоспецифические сыворотки к вирусу гриппа лошадей; исследуемый гемагглютинирующий вирус; физиологический раствор поваренной соли pH 7,2—7,4; однопроцентную суспензию эритроцитов петуха; доски из плексигласа или бактериологические пробирки; пипетки на 2,0 и 10,0 мл; 30 %-ную соляную кислоту; мел; аппарат Киппа.
Типоспецифические сыворотки имеются в диагностическом наборе.
А. Приготовление сыворотки к работе.
11. В ампулу, содержащую сухую диагностическую сыворотку, добавляют дистиллированной воды в количестве 9 мл, т. е. делают разведение ее 1:10 и пипетируют до полного растворения содержимого.
12. Наличие в иммунных сыворотках ингибиторов к различным серотипам вируса гриппа затрудняет идентификацию вновь выделенных штаммов в реакции торможения гемагглютинации.
13. Для удаления термолабильных ингибиторов разведенную сыворотку прогревают в водяиой бане при 60 °С в течение 30 мин.
14. Для осаждения термостабильных ингибиторов через разведенную и прогретую сыворотку пропускают углекислый газ (С02) из аппарата Киппа (схема 4) в течение 2—3 мин или опускают в нее кусочки твердой углекислоты. После обработки углекислотой сыворотку центрифугируют в течение 5 мин при 2 гыс. об/мин. После чего сыворотку используют в реакции торможения гемагглютинации для идентификации вируса.
Б. Приготовление I %-ной суспензии эритроцитов кур.
15. Для получения I %-ной суспензии эритроцитов используют петухов старше 6 мес.
16. Взятие крови у петухов производят из подкрыльцовой вены,
набирают пипеткой необходимое количество крови в стеклянную баночку с физиологическим раствором и 2,5*%-ным раствором лимоннокислого натрия.
17. Полученную кровь трижды отмывают физиологическим раствором, осаждая на центрифуге в течение 10 мин при 1500 об/мин.
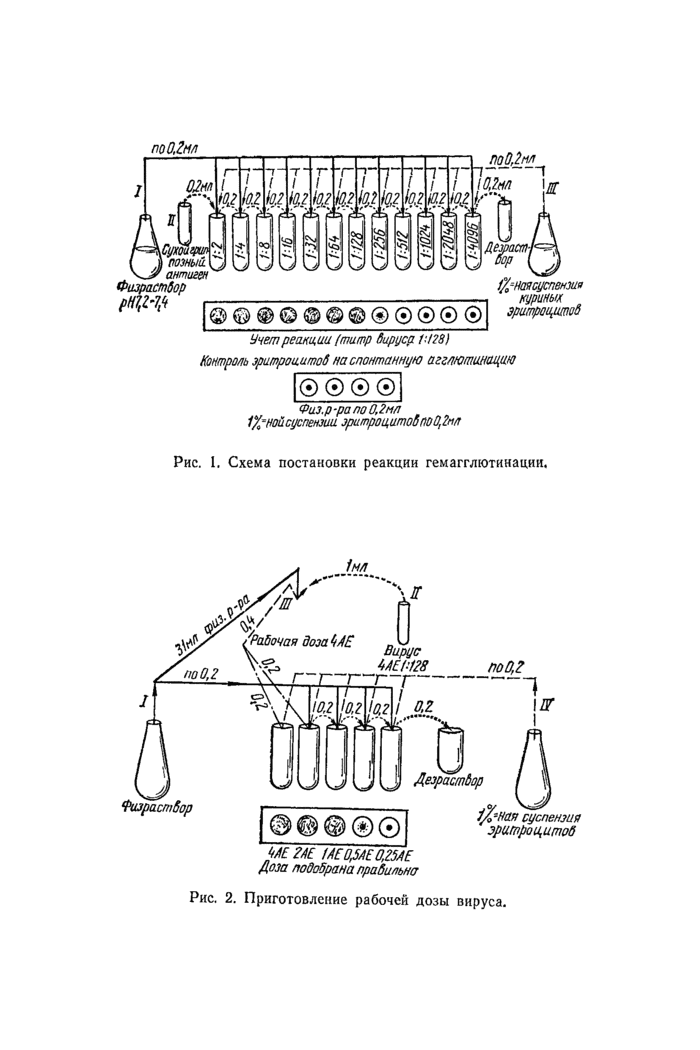
18. Из осадка отмытых эритроцитов готовят 1 %-ную суспензию, которую хранят при 4 °С не более 4 сут.
В. Постановка реакции гемагглютинации.
19. Реакция гемагглютинации является подготовительным этапом в постановке реакции торможения гемагглютинации.
20. Вначале готовят двукратные разведения вируссодержащего материала от 1 :2 до 1 : 1024. Для этого в ряд лунок или пробирок (рис. 1) наливают физиологический раствор в объеме 0,2 мл. Затем в первую лунку вносят по 0,2 мл вируса, трехкратно пипетируют и переносят 0,2 смеси во вторую и т. д. до требуемого разведения. Из последней лунки 0,2 мл смеси удаляют в дезинфицирующий раствор.
21. В каждую лунку добавляют по 0,2 мл 1 %-ной суспензии эритроцитов. Необходимо ставить контроль на спонтанную агглютинацию эритроцитов (к 0,2 мл физиологического раствора добавляют 0,2 мл 1 %-ной суспензии эритроцитов).
22. Доски с лунками встряхивают и оставляют при комнатной температуре, учет реакции проводят через 30 мин,
23. Положительная реакция гемагглютинации оценивается по форме осадка эритроцитов, которые осаждаются не только на дне, но и на стенках, образуя «зонтик». В случае отрицательной реакции так же, как и в контроле, эритроциты оседают под действием тяжести, образуя на дне лунки диск с ровными краями.
24. Титром вируса считается то наибольшее разведение его, при котором наблюдается еще агглютинация эритроцитов, что и соответствует 1 АЕ.
25. После того как определен титр гемагглютинации вновь выделенного вируса, переходят к постановке реакции торможения гемагглютинации. Последняя основана на способности специфических антител нейтрализовать гемагглютинирующую активность вируса.
26. Для постановки реакции торможения гемагглютинации готовят рабочую дозу вновь выделенного вируса, в 0,2 мл которого содержится 4 АЕ вируса. С этой целью исходный вирус разводят физиологическим раствором во столько раз, сколько получают от деления на 4 цифры, указывающей гемагглютинирующий титр. Например, если титр гемагглютинации 1 : 128, рабочее разведение будет 128:4=32, т. е. в 0,2 мл разведенного 1 :32 вируса будет содержаться 4 АЕ. Для его приготовления необходимо взять 31 мл физиологического раствора и добавить 1 мл исходного вируса. Перед постановкой основного опыта проверяют правильность выбора 4 АЕ. Для этого (рис. 2) берут 5 лунок, в первую и вторую наливают 4 АЕ по 0,2 мл, т. е. выбранное разведение вируса, после чего во вторую, третью, четвертую, пятую лунки наливают по 0,2 мл физиологического раствора. После пипетирования из второй лунки переносят 0,2 мл в третью, из третьей после смешивания 0,2 мл переносят в четвертую, а затем в пятую, из пятой лунки удаляют 0,2 мл смеси в дезинфицирующий раствор. Таким образом, во 2-й лунке остается 2 АЕ вируса, в 3-й — 1 АЕ, в 4-й — 0,5 АЕ, в 5-й — 0,25 АЕ. После этого в каждую лунку добавляют по 0,2 мл 1 %-ной суслен-
noO.lun
|
not),2мл |
I позный _' антиген Физрастбор MW
©©®©©©©®©®®®
Дета МР ул
фнаясуепензив
куриные
эритрацитоб
Учет реакции /титр бируса 1:128)
Контроль зритроиитоб на спонтанную агглютинацию
© © © ©
Физ.р ■ра по 0.2мл 1%‘ной суспензии зри/прои,итоВпоО,2м/т
Рис. 1. Схема постановки реакции гемагглютинации.
|
Ш т /АС OJAE 0.25АЕ Доза подобрана прабипьна Рис. 2. Приготовление рабочей дозы вируса. |