Временное наставление по лабораторной диагностике лейкоза птиц
Купить бумажный документ с голограммой и синими печатями. подробнее
Цена на этот документ пока неизвестна. Нажмите кнопку "Купить" и сделайте заказ, и мы пришлем вам цену.
Распространяем нормативную документацию с 1999 года. Пробиваем чеки, платим налоги, принимаем к оплате все законные формы платежей без дополнительных процентов. Наши клиенты защищены Законом. ООО "ЦНТИ Нормоконтроль"
Наши цены ниже, чем в других местах, потому что мы работаем напрямую с поставщиками документов.
Способы доставки
- Срочная курьерская доставка (1-3 дня)
- Курьерская доставка (7 дней)
- Самовывоз из московского офиса
- Почта РФ
Оглавление
3. Методика постановки РСК при лейкозе птиц
4. Методика постановки кофал-теста
5. Реакция непрямой гемагглютинации
6. Метод иммунофлуоресценции
7. РИФ-тест
8. Реакция нейтрализации (РН)
9. Методика выделения вирусов лейкоз-саркомной группы
| Дата введения | 01.01.2021 |
|---|---|
| Добавлен в базу | 01.02.2020 |
| Актуализация | 01.01.2021 |
Этот документ находится в:
- Раздел Экология
- Раздел 11 ЗДРАВООХРАНЕНИЕ
- Раздел 11.220 Ветеринария
- Раздел 11 ЗДРАВООХРАНЕНИЕ
Организации:
| Издан | Агропромиздат | 1987 г. |
Чтобы бесплатно скачать этот документ в формате PDF, поддержите наш сайт и нажмите кнопку:

стр. 1

стр. 2

стр. 3

стр. 4

стр. 5

стр. 6

стр. 7

стр. 8

стр. 9

стр. 10
стр. 11

стр. 12

стр. 13

стр. 14

стр. 15
стр. 16

стр. 17

стр. 18

стр. 19

стр. 20

стр. 21

стр. 22

стр. 23
стр. 24

стр. 25

стр. 26

стр. 27

стр. 28

стр. 29

стр. 30
СПР/ТО
Ш
АБОРАТОРНЫЕ ИССЛЕДОВАНИЯ В ВЕТЕРИНАР ИИ
ВИРУСНЫЕ, РИККЕТСИОЗНЫЕ И ПАРАЗИТАРНЫЕ БОЛЕЗНИ
СПРАВОЧНИК
ЛАБОРАТОРНЫЕ ИССЛЕДОВАНИЯ В ВЕТЕРИНАРИИ
ВИРУСНЫЕ, РИККЕТСИОЗНЫЕ И ПАРАЗИТАРНЫЕ БОЛЕЗНИ
Под редакцией Б. И. АНТОНОВА
т
|
Ряды лунок пластин |
Контроля сывороток на гемотоксачность н амтнкомплемектаркость в ряд*х лунок |
Контроль компле мента | ||||||||||||
|
1 |
2 |
3 |
4 |
6 |
6 |
7 |
1 |
2 |
3 |
1 |
2 |
3 |
1.6 дозы |
2.0 дозы |
0,025 0,025 0,025 0,025 0,025 0,025 0,025
Исследуемый антиген я разведении 1:2
Специфическая сыворотка хомяка, голубя или унифицированный диагностики в рабочем титре Сыворотка здорового голубя, хомяка или кролика Физиологический раствор
Комплемент 1,5 дозы
Комплемент 2 дозы
- - 0,025 0,025 — — — 0,025 0,025 0,025 - — -
— — — — 0,025 0.025 — — — — 0,025 0.С25 0.025
0,025 0,025 — — — — 0,05 0,025 0,025 0,05 0.025 0,025 0,05 0,05 0,05
0,025 — 0,025 — 0,025 — - 0,025 — — 0,025 — - 0,025
— 0,025 - 0,025 — 0,025 - - 0,025 - - 0,025 —
Температурный режим 4—6°С в течение 16—18 ч Гемолитическая 0,05 0,05 0,05 0.05 0,06 0,05 0,05 0,05 0,06 0,05 0,05 0,05 0,05 0.05 0.С5 система
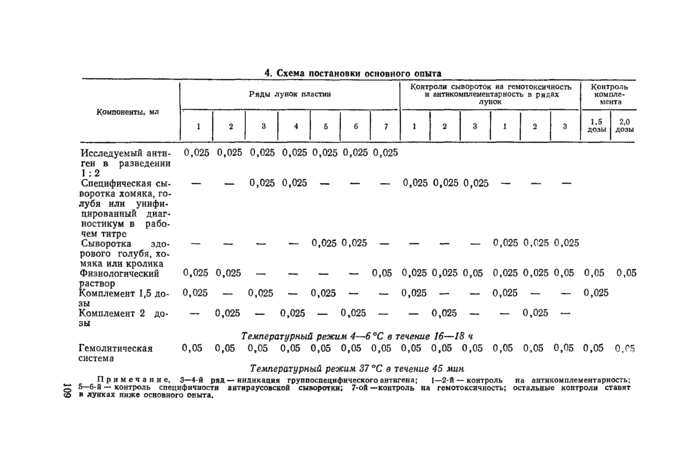
Температурный режим 37 "С в течение 45 мин Примечание. 3— 4-й рад — имдикааи1 грунпоспецнфнческото антигена; I—2Й — контроль на антякомплемемтариость:
6—6-в — контроль специфичности аитяраусовской сыворотки: 7-ой —контроль яа гемотоксячиость: остальные контроля ставят в лунках ниже основного опыта.
каждые 15 мин пластины встряхивают во избежание преждевременного оседания эритроцитов. Окончательный учет результатов производят после 2-часовой выдержки пластин при комнатной температуре по осадку негемолизированных эритроцитов по четырехплюсовой системе: ( + + + +) и (+ + + )—положительный результат, (+ + )—сомнительный, (+) и (—)— отрицательный.
Результаты считаются достоверными при условии: а) отсутствия антикомплементарных и гемотоксических свойств у исследуемых н контрольных антигенов и сывороток; б) наличия задержки гемолиза в реакции сыворотки к ВСР или унифицированного диагностикума с положительными контрольными антигенами и наличия полного гемолиза в реакциях с отрицательными антигенами; в) наличия полного гемолиза контрольной отрицательной сыворотки с положительным и отрицательным антигенами.
4. Методика постановки кофал-теста.
4.1. Кофал-тест ставится в тех случаях, когда в исследуемом материале вирус лейкоз-саркомной группы находится в невысоких титрах и не улавливается методом РСК.
4.2. Для постановки кофал-теста необходимо вначале произвести накопление вирусов путем пассирования исследуемого материала в 1
|
5. Протокол основного опыта | |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||
|
Обозначения: ССГ — специфическая сыворотка голубя; ССХ — специфическая сыворотка хомяка; УД — унифицированный диагкостикум; СЗГ — сыворотка здорового голубя; СЗХ — сыворотка здорового хомяка; СЗК — сыворотка здорового кролика. | ||||||||||||||||||||||||||||||||||||||||||
культуре клеток фибробластов эмбрионов кур (ФЭК), желательно фенотипа С/О1, свободных от контаминации вирусами лейкоз-сарком-ной группы. Зараженные культуры клеток ФЭК трехкратно субкуль-тивируют в термостате в течение 4 дн. каждую субкультуру. Из клеток третьей генерации готовят антиген, который исследуют в FCK (табл. б).
Для накопления вируса и приготовления культурального антигена исследуемым материалом (экстракты внутренних органов, аллантоисная жидкость, сыворотка крови и т. д.) инокулируют по
2 матраца первичной культуры ФЭК.
2 матраца с культурой клеток той же партии заражают штаммом RSV (RAV-1) вируса саркомы Рауса (положительный контроль), 2 матраца с культурой ФЭК оставляют незаряженными (отрицательный контроль). Культуры ФЭК поддерживают в виде мо-нослойиой культуры клеток 12—14 дн. методом 3-кратного субкультивирования. В день окончания культивирования из матрацев сливают культуральную жидкость и добавляют в каждый матрац по
4—5 мл физиологического раствора (pH 7,2). Клетки разрушают 3—5-кратным замораживанием и оттаиванием. Содержимое трех групп матрацев сливают в 3 флакона и центрифугируют при 4 тыс. об/мин 30 мин. Полученные культуральные антигены (над-осадочные жидкости) сохраняют при — 20 °С до проверки в РСК.
4.3. Кофал-тест ставится в объеме 0,125 мл микрометодом по Такачи с использованием 1,5—2,0 гемолитических ед. комплемента,
3 ед. гемолизина, 4 ед. специфической сыворотки и 2 ед. антигена.
5. Реакция непрямой гемагглютинации.
5.1. Компоненты реакции: препарат для диагностики лейкоза птиц (ПДЛП); исследуемые сыворотки, которые хранят в холодильнике при 4°С не более 7 дн.; физиологический раствор.
5.2. Реакцию ставят капельным методом на предметном стекле при температуре не ниже 18—20 °С. На чистое, обезжиренное предметное стекло наносят каплю испытуемой сыворотки и добавляют каплю растворенного в дистиллированной воде ПДЛП. Пипетку после каждой сыворотки промывают физиологическим раствором не менее 5—6 раз. Предметное стекло легко покачивают и не позднее 2 мин производят учет реакции макроскопически на белом фоне. Реакцию оценивают по четырехплюсовой системе: (+ + + -F) и (+++)-“ положительная реакция, эритроциты все или почти все агглютинированы; ( ++) — сомнительная реакция, имеется взвесь неагглютннированных эритроцитов; ( + ) и (—)—отрицательная реакция, большинство или все эритроциты не агглютинированы. Результаты учитываются при отрицательном контроле ПДЛП с физиологическим раствором.
6. Метод иммунофлуоресценции.
6.1. Для иммунофлуоресцентного исследования необходимо иметь люминесцентный микроскоп МЛ-2А, МЛ-2Б или другой; объектив 90, окуляры 4 или 5, светофильтры СЗС-7 или СЗС-14, ФС-1, БС-8, ЖС-18, ЖС-19 и другие в соответствии с наставлением по использованию люминесцентного микроскопа.
6.2. Для лабораторной диагностики ГС-антигена вирусов лейкоз-саркомной группы используют прямой вариант метода флуоресцирующих антител. Сущность этого метода заключается в соединении меченых ФИТЦ антител с ГС-антигенов вирусов лейкоз-саркомной группы.
6.3 Методом иммунофлуоресценции исследуют мазки крови кур, мазки-отпечатки из патологического материала и культур клеток фибробластов эмбрионов кур. В качестве контроля берут мазки крови или мазки-отпечатки от здоровых кур-доноров или культуру ФЭК, свободную от контаминации вирусами лейкоза-саркомы, для проведения исследования используют люминесцирующую сыворотку к ГС-антигену вирусов лейкоза-саркомы; контрольную меченую сыворотку от интактных кроликов или голубей; фосфатно-буферный раствор с pH 7,4, который разводится физиологическим раствором 1 ; 50; ацетон безводный для фиксации мазков; глицерин с фосфатным буфером, pH 8,0 (9 частей глицерина нейтрального и 1 часть фосфатного буфера); нефлуоресцирующее иммерсионное масло или его ааменитель.
6.4. Приготовление исследуемого материала. Каплю крови из подкрыльцовой вены наносят на предметное стекло и, сделав тонкий мазок, высушивают его при комнатной температуре. Для приготовления мазков-отпечатков в стерильную чашку Петри наливают 0,5 мл инактивированной сыворотки крови кур-доноров, разведенной 1 : 1 дистиллированной водой. Исследуемую ткань или органы измельчают и вносят в сыворотку, суспендируют до помутнения сыворотки. Из полученной суспензии готовят мазки на предметных стеклах, которые подсушивают на воздухе. Для приготовления ФЭК, свободных от контаминации вирусами лейкоза-саркомы, культуру клеток последних выращивают на покровных стеклах в прооир-ках (см. п. 7.4).
Исследуемым материалом в дозе 0,2 мл заражают ФЭК (не ме-цее 8 пробирок на одну исследуемую пробу) с хорошим монослоем. В каждую пробирку вносят 1,8 мл поддерживающей среды с антибиотиками. После 4—5-суточного инкубирования зараженных ФЭК при 37,6 °С покровные стекла извлекают из пробирок и не менее 3 раз отмывают фосфатно-буферным раствором (pH 7,4), а затем подсушивают на воздухе.
6.5. Контрольные препараты: мазки от здоровых кур-доноров или культура ФЭК из эмбрионов, неконтаминированных вирусами лейкоз-саркомной группы+специфическая к ГС-антигену меченая сыворотка кролика; исследуемые мазки или культура ФЭК+ Ч-контрольная меченая сыворотка интактного кролика. Результат отрицательный.
6.6. Интенсивность свечения приготовленных препаратов оценивают по 4-плюсовой системе. Положительным результатом считается зеленоватая люминесценция морфологически типичных клеток с более интенсивным свечением их по периферии на (+ + + + ) и (+ + + ), сомнительным на (+ + ) и отрицательным на (-f) и (—).
Примечание. При использовании люминесцирующей сыворотки, приготовленной к ГС-антигену на голубях, ставят следующие контроля: а) культура ФЭК, свободная от контаминации вирусами лейкоза-саркомы +специфическая к ГС-антигену меченая сыворотка голубя; б) исследуемая культура ФЭК-Ъ +контрольная меченая сыворотка интактного голубя.
7. РИФ-тест.
7.1. РИФ-тест основан на интерференции между вирусом лейкоза птиц и вирусом саркомы Рауса в культуре ФЭК. Тест использу-
ют для выделения и изучения вирусов лейкоза. С помощью РИФ-теста исследуют на содержание лейкозных вирусов куриные эмбрионы, сыворотку крови и надосадочную жидкость из гомогенатов органов птицы, подозреваемой в заболевании лейкозом. Из куриных эмбрионов, исследуемых на наличие вируса лейкоза, готовят ФЭК. Другой исследуемый материал (сыворотку крови, надосадочную жидкость) вносят в культуру ФЭК, приготовленную из эмбрионов от «безлейкозных» несушек. В качестве контроля используют культуры ФЭК, приготовленные из эмбрионов от «безлейкозных» несушек. Реакция является строго типоспецифичной.
7.2. Компоненты реакции: эмбрионы «безлейкозных»кур 10—12-дневные; исследуемый материал — индивидуальные эмбрионы, сыворотка или плазма крови, аллантоисная жидкость, надосадоч-ная жидкость из 20 % гомогенатов внутренних органов; вирус саркомы Рауса (ВСР) подгрупп А, В, С, D; набор питательных сред:
а) среда роста для получения первичных ФЭК, %: 0,5 %-ный гидролизат лактальбумина на растворе Хэнкса — 90; сыворотка теленка — 10;
б) поддерживающая среда, %: среда Игла — 47,5; среда 199 — 47,5; сыворотка теленка — 5;
в) поддерживающая среда для субкультур первого пересева, %: среда Игла —60; среда 199 — 30; триптозо-фосфатный бульон «Диф-ко» — 5; сыворотка теленка — 5;
г) поддерживающая среда для субкультур второго пересева, %: среда Игла — 90; триптозо-фосфатный бульон «Дифко» — 5; сыворотка теленка — 5.
Для приготовления рабочего раствора триптозно-фосфатного бульона берут 29,5 г порошка этого препарата, растворяют в 1 л бидистнллированной воды и стерилизуют при 121 °С в течение 15 мин.
Антибиотики добавляют во все среды из расчета 100 ЕД/мл; pH всех сред не должна превышать 7,2—7,4. Для подавления грибковой микрофлоры в поддерживающую и питательную среды добавляют нистатин или натриевую соль нистатина. Данный антибиотик используют в виде спиртового или водного раствора в дозе 30— 40 ЕД/мл.
7.3. Бактериологическому контролю подвергают все растворы, питательные среды, клеточную взвесь, сыворотку крови теленка.
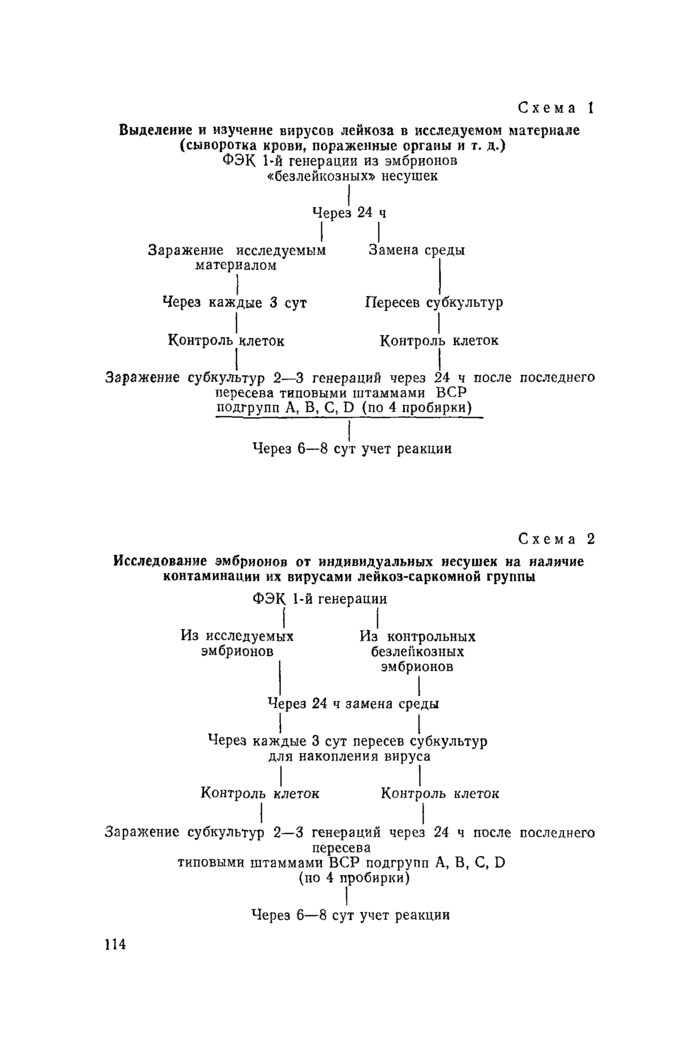
7.4. Первичные культуры ФЭК готовят из 10—12-дневных куриных эмбрионов по общепринятой методике. Для отделения клеток ФЭК ткань промывают средой «а», пипетируют 2—3 мин, фильтруют через 4 слоя марли, к остатку добавляют новую порцию питательной среды и так повторяют 3 раза. Выращенную культуру ФЭК из «безлейкозных» и исследуемых эмбрионов используют для определения наличия вируса в исследуемом материале (схема 1) и для установления факта контаминации исследуемых эмбрионов кур (схема 2). В первом случае проводят заражение ФЭК фенотипа С/О, свободных от контаминации вирусами лейкоз-саркомной группы, исследуемым материалом из расчета 3—5 мл на матрац. В контрольных матрацах производят только замену среды роста на поддерживающую среду. Во втором случае производят замену среды роста на поддерживающую как в исследуемой, так и в контрольной культурах.
Схема 1
Выделение и изучение вирусов лейкоза в исследуемом материале (сыворотка крови, пораженные органы и т. д.)
ФЭК 1-й генерации из эмбрионов «безлейкозных* несушек
Через 24 ч
I I
Заражение исследуемым Замена среды
материалом |
Через каждые 3 сут Пересев субкультур
Контроль клеток Контроль клеток
I I
Заражение субкультур 2—3 генераций через 24 ч после последнего пересева типовыми штаммами ВСР подгрупп А, В, С, D (по 4 пробирки)
Через 6—8 сут учет реакции
Схема 2
Исследование эмбрионов от индивидуальных несушек на наличие контаминации их вирусами лейкоз-саркомной группы
ФЭК 1-й генерации
I I
Из исследуемых Из контрольных
эмбрионов безлейкозиых
эмбрионов
Через 24 ч замена среды
Через каждые 3 сут пересев субкультур для накопления вируса
Контроль клеток Контроль клеток
Заражение субкультур 2—3 генераций через 24 ч после последнего
пересева
типовыми штаммами ВСР подгрупп А, В, С, D (по 4 пробирки)
Через 6—8 сут учет реакции
7.5. Для получения субкультуры второго пересева на 4—5-е сутки роста первичной культуры проводят ее первый пересев. Из матрацев со сплошным монослоем жизнеспособных клеток первичной культуры ФЭК сливают и отсасывают питательную среду, наливают 0,25 %'Ный раствор трипсина и оставляют на 1—3 мин при комнатной температуре. Затем трипсин сливают, монослой промывают раствором Хэнкса с сывороткой теленка и антибиотиками, сливают его и вносят среду «в>. Тщательно смывают клетки со стенок матрацев, объединяют однотипные взвеси из разных матрацев в один флакон и пипетируют. Полученную гомогенную взвесь после подсчета числа клеток разводят средой «в» до посевной дозы (200—300 тыс. в 1 мл), разливают в стерильные матрацы и ставят в термостат нрп 36,6*0. Через 3 сут делают второй пересев субкультур (третья генерация), используя среду «г». Культуру разливают в стерильные пробирки или пенициллиновые флаконы по 1 мл.
7.6. Заражение субкультур второго пересева проводят через 24 ч. Заражают соответствующими штаммами ВОР подгрупп А, В, С, D в дозе 0,2 мл в разведениях от 10-2 до 10-5, что устанавливают путем предварительной титрации вируса. На каждое разведение одного штамма берут нс менее 4 пробирок. Для разведения ВСР используют среду «г».
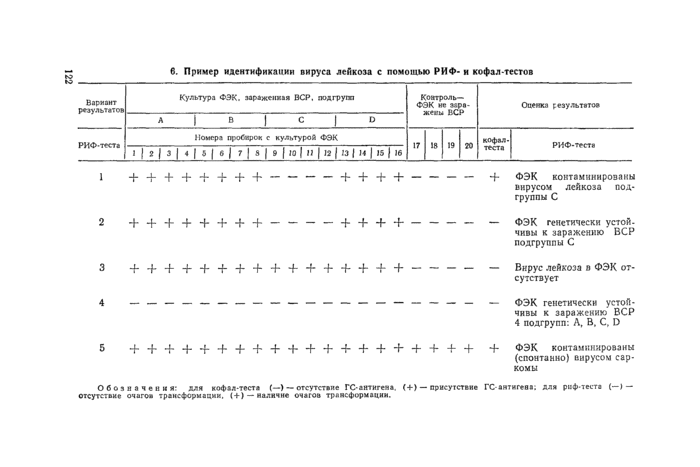
7.7. Учет результатов постановки РИФ-теста. Подсчет фокусов трансформации проводят на 8-й день после заражения субкультур второго пересева. В случае наличия в исследуемых эмбрионах вирусов лейкоза, суперинфицирование ВСР клеток ФЭК, приготовленных из эмбрионов, не ведет к образованию очагов трансформации. 1о же самое наблюдают при наличии вируса в исследуемом материале (плазме и сыворотке крови, надосадочной жидкости), которым заражали ФЭК первой генерации (результат РИФ-теста положителен).
В контрольных и исследуемых культурах, не содержащих вирусов лейкоза, после заражения их ВСР образуются очаги трансформации (РИФ-тест отрицателен) — своеобразные морфологические изменения, устанавливаемые микроскопически. Это белые пятна, состоящие из скопления круглых, возвышающихся, монослойно растущих трансформированных клеток. Количество образовавшихся фокусов указывает на степень чувствительности ФЭК к заражению ВСР. О степени чувствительности ФЭК к заражению ВСР судят по относительной чувствительности культур ФЭК. Относительная чувствительность культур ФЭК к ВСР определяется частным от деления среднего количества очагов трансформации в каждой пробирке индивидуальной культуры на среднее количество очагов трансформации контрольной или наиболее чувствительной культуры данного опыта.
Для исключения факта генетической резистентности культур ФЭК исследуют надосадочную жидкость из резистентных культур п кофал-тесте на наличие в ней ГС-антигена вирусов лейкоза-саркомы. При отсутствии ГС-антигена культура ФЭК и соответственно эмбрионы и курица относятся к генетически усюйчивым к заражению вирусами лейкоза-саркомы определенной серологической подгруппы.
8. Реакция нейтрализации (PH).
8.1. Основана на выявлении нейтрализации ВСР определенной серологической подгруппы специфическими антителами исследуемой сыворотки крови кур. Реакцию применяют для обнаружения специ-
фических антител в сыворотках крови кур, определения активности гипериммунных сывороток к вирусам лейкоза-саркомы и идентификации указанных вирусов со специфическими типовыми сывороткамп.
8.2. Реакцию нейтрализации можно ставить на разных моделях: в культуре ФЭК, на ХАО куриных эмбрионов или на цыплятах. В зависимости от метода постановки реакции необходимы: первичная культура ФЭК, 11-дневные эмбрионы кур или цыплят 2-недельного возраста; исследуемые сыворотки крови, инактивированные при температуре 56 °С в течение 30 мин; типовые гипериммунные сыворотки (ТС) к ВСР 4 серологических подгрупп (А, В, С, D); типовые штаммы ВСР 4 серологических подгрупп:
ВН — RSV (RAV-1) —серологическая подгруппа А;
ВН — RSV (RAV-2) —серологическая подгруппа В;
ВН — RSV (RAV-49) — серологическая подгруппа С;
ВН — RSV (RAV-50) — серологическая подгруппа D.
8.3. Для поддержания типовых штаммов ВСР в состоянии высокой онкогенной активности последний пассируют на 10-дневных цыплятах. Вируссодержащим материалом для заражения цыплят служит 30 %-ная суспензия опухолевой массы в среде 199 или физиологическом растворе с добавлением гиалуронидазы 100 ЕД/мл и антибиотиков, освобожденная от клеток центрифугированием при 3 об/мин в течение 30—40 мин. Вируссодержащую суспензию вводят в перепонку крыла в дозе 0,2 мл. Через 8—10 дн. после заражения развивается опухоль, которую вылущивают с соблюдением стерильности. Внруссодержащую опухолевую массу разрезают на небольшие кусочки и хранят при температуре минус 20 °С в герметично закрывающихся инсулиновых флаконах или капсулах, применяемых для сохранения спермы.
8.4. Перед использованием штаммы ВСР титруют на цыплятах или эмбрионах. В первом случае используют 10—12-дневных цыплят, которым вводят 10-кратные разведения ВСР в 4 точки крыловых перепонок по 0,1 мл на каждую точку (рис. 1).
Через 8—10 дн. после заражения осматривают у цыплят места инъекции с целью контроля появления опухоли. Подсчет титра вируса проводят по методу Рида и Менча и выражают в ОД50/МЛ (50 %-ная онкогенная доза). В PH используют штаммы ВСР с онкогенной активностью не ниже Ю“**5ОДбо в 1 мл.
8.5. При титровании штаммов ВСР иа 11-дневных куриных эмбрионах 10-кратные разведения ВСР инокулируют в дозе 0,1 мл на ХАО. Каждым разведением заражают по 10 эмбрионов. Зараженные эмбрионы без изменения их положения помещают в термостат и инкубируют до 18—19 дн. По истечении срока инкубации эмбрионы
|
Рис. 1» Схема титрования ВСР на цыплятах, |
вскрывают, освобождают ХАО и расправляют ее на чашке Петри, несколько раз промывают физиологическим раствором. Подсчет образовавшихся бляшек проводят на темном фоне при косом освещении. Титр вируса —lg ср. арифметического количества бляшек на XAO + lg разведения вируса (наибольшего, давшего положительный эффект)-нобъем введенного вируса. Выражают титр в БОЕ/мл (бляшкообразующие единицы в 1 мл).
Пример расчета титра вируса: заражено десять 11-дневных эмбрионов вирусом в разведении 10~4 по 0,1 мл на ХАО. После 8-дневной инкубации со дня заражения на ХАО образовались бляшки:
1 -й эмбрион — 25 бляшек — 1,2 lg*
2- й эмбрион — 50 бляшек— 1,6 lg
3- й эмбрион— 4 бляшки—0,6 lg
4- й эмбрион— 0 бляшек
5- й эмбрион — 30 бляшек — 1,5 lg
6- й эмбрион — 60 бляшек — 1,7 lg
7- й эмбрион — 50 бляшек — 1,6 lg
8- й эмбрион — 0 бляшек
0-й эмбрион — 25 бляшек —1,2 lg 10-й эмбрион — 30 бляшек —1,5 lg
10,9:8=1,36 lg**
• Бляшки, образовавшиеся на ХАО (в численном выражении), переводят по таблице Брадиса в логарифмы.
Сумму логарифмов делят на общее количество ХАО с бляшками и определяют среднее арифметическое число бляшек в логарифмах.
8.6. Вируссодержащим материалом для PH служит 20 %-иая суспензия опухоли цыпленка, индуцированная одним из типовых штаммов ВСР. Суспензию опухоли готовят в среде 199 или в физиологическом растворе с добавлением стерильного мелко растертого стекла, 100 ЕД/мл гиалуронидазы и антибиотиков (смесь пенициллина и стрептомицина по 100 ЕД/мл). Суспензию освобождают от клеток центрифугированием при 3 тыс. об/мин в течение 30—40 мни. После центрифугирования из надосадочной жидкости готовят десятикратные разведения ВСР от !0-1 до 10*"4 в среде 199 или физиологическом растворе в объеме 10 мл.
8.7. П ост а н о в к а PH в культуре ФЭК. Для реакции используют первично трипсинизированную культуру ФЭК, свободных от вирусов лейкоза-саркомы. Через 24—48 ч отбирают матрацы с хорошим монослоем и готовят субкультуру с концентрацией клеток 200—300 тыс. на 1 мл питательной среды. Субкультуру разливают по 1,3 мл в пенициллиновые флаконы или пробирки. Готовят разведения исследуемых и гипериммунных типоспецифических сывороток на среде Игла от 1 :2 до 1 : 128 в объеме 0,5 мл. К каждому разведению сыворотки добавляют равный объем разведения суспензии ВСР на среде Игла с антибиотиками, содержащей в 0,1 мл 100 ОДзд. Смесь тщательно перемешивают и оставляют для контакта при комнатной температуре. Через 2 ч 0,2 мл смеси вносят в пенициллиновые флаконы или пробирки с субкультурой ФЭК. На каждое разведение сыворотки берут не менее 4 флаконов или пробирок, которые выдерживают в термостате при температуре 37,6 °С в течение 4—6 сут.
Контроля к PH: контроль клеток незараженной субкультуры (трансформация клеточного монослоя отсутствует); контроль вируса—каждым разведением вируса заражают по 4 флакона с суо-культурой ФЭК (наличие очагов трансформации); контроль на стерильность ингредиентов, питательных сред и смеси вируса и сыворотки (полное отсутствие бактериальной и грибковой микрофлоры в посевах).
Учет результатов PH проводят микроскопически на 5—6-й день после постановки реакции при наступлении выраженной трансформации клеточного монослоя. По наибольшему разведению исследуемой сыворотки, нейтрализующей 100 ОДи ВСР, устанавливают ви-руснейтрализующую активность сыворотки, которую выражают в ЕД$о (эффективных доз).
8.8. Постановка PH на эмбрионах кур. В четыре пробирки вносят равные объемы исследуемой сыворотки в разведении 1 :2 в среде 199 или на стерильном физиологическом растворе и четыре десятикратных разведения антигена от 10'-* до 10~5 4 типовых штаммов ВСР.
Порядок внесения компонентов в пробирки следующий: исследуемая сыворотка крови —0,3 мл; среда 199 или физиологический раствор —0,3 мл; антиген (ВСР) в 4 разведениях — 0,6 мл. Смесь сыворотки и вируса оставляют для контакта при комнатной температуре на 2 ч. По истечении этого срока данную смесь инъецируют в дозе 0,1 мл на ХАО эмбрионов. Каждым разведением смеси заражают по 10 эмбрионов. Эмбрионы инкубируют в условиях термостата при 37,6 °С в течение 8 сут.
Контроль реакции: смесь, состоящую из равных объемов вируссодержащей суспензии типовых штаммов ВСР соответствующих раз-ведений и физиологического раствора, инъецируют в дозе 0,1 мл на ХАО эмбриона кур. Учет результатов реакции проводят через 8 дн. инкубации. Опытные и контрольные эмбрионы вскрывают и подсчитывают бляшки на ХАО. Индекс нейтрализации равен титру ВСР в контроле минус титр ВСР в опыте. Положительно реагирующими считают сыворотки с индексом нейтрализации, равным или больше 0,5 lg.
8.9. Постановка PH на цыплятах. Реакцию ставят в два этапа: первый этап — в пробирках, где контактируют смесь вируса с сывороткой при комнатной температуре 2 ч; второй этап — заражение цыплят полученной смесью для учета нейтрализации вируса. Для первого этапа готовят 10-кратные разведения вируса в пределах его титра, а затем в стерильные пробирки вносят равные объемы исследуемой сыворотки в разведении 1 :2 и ВСР в разведении 10~*; 10“3; 10"4; Ю-5. После 2-часового контакта при комнатной температуре по 0,1 мл смеси вводят в 4-е точки крыловых перепонок 2-недельных цыплят. Одной смесью сыворотки с ВСР заражают по 4 цыпленка. В контроле равные объемы указанных разведений ВСР смешивают с равным количеством физиологического раствора. Контрольные смеси инокулируют 8—10 цыплятам в тех же дозах и в те же точки, что и испытуемые (рис. 2). Все подопытные и контрольные цыплята находятся под наблюдением в течение 3 нед.
Первый учет реакции у цыплят проводят на 8-й день после начала опыта, затем в течение последующих 2 нед цыплят осматривают каждые 3 дня. Появление опухоли на месте инъекции оценивают знаком плюс, а отсутствие опухоли — знаком минус.
Реакция нейтрализации считается положительной, если ВСР в
ББК 48.73 Л12
УДК 619: 616.98/.99 (031)
Составители: Б. И. Антонов, В. В. Борисова, Л. П. Каменева, Л. И. Ковалерчук, Г. А. Михальский, В, Д. Пев• нева, Л. И. Прянишникова.
Лабораторные исследования в ветеринарии: Ви« Л12 русные, риккетсиозные и паразитарные болезни: Справочник/Под ред. Б. И. Антонова. — М.: Агро-промиздат, 1987.—-240 с.: ил.
В книге даны методы лабораторного исследования патологического ма!ермала с целью определения возбудителей вирусных, риккетсиозных и паразитарных болезней животных. Они изложены по единой схеме. Методы унифицированы и стандартизированы.
3805020000—166 035(01)—87
332-87
ББК 48.73
Для ветврачей и фельдшеров, лаборантов ветеринарных лабораторий.
ЛАБОРАТОРНЫЕ ИССЛЕДОВАНИЯ В ВЕТЕРИНАРИИ: ВИРУСНЫЕ, РИККЕТСИОЗНЫЕ И ПАРАЗИТАРНЫЕ БОЛЕЗНИ
Справочник
Составители; Борис Иванович Антонов, Валерия Валентиновна Борисова, «Людмила Петровна Каменева и др.
Зав. редакцией В. Г. Федотов. Редактор В. //. Сайтаниди. Художественный редактор Н. А. Никонова. Технический редактор И. А. Зубкова. Корректор И. В. Карпова
И Б № 5093
Сдано в набор 02.10.86. Подписано к печати 22.01.87. Т-00912. Формат
84X108711. Бумага тип. JV* 2. Гарнитура Литературная. Печать высокая. Уел. псч. л. 12,6. Уел. кр.-отт. 12,6. Уч.-иэд. л. 18,25. Изд. № 226. Тираж 33 000 экз. Заказ .Ns 668. Цена 1 р. 10 к.
Ордена Трудового Красного Знамени ВО «Агропромнздат», 107807, ГСП, Москва, Б-53, ул. Садовая-Спасская, 18
Владимирская типография Союэполиграфпрома при Государственном комитете СССР по делам издательств, полиграфии и книжной торговли 600000, г. Владимир, Октябрьский проспект, д. 7
© ВО «Агропромнздат», 1987
(исследуемая сыворотка + ВСР)
(Физраствор «■ ВСР)
|
Рис. 2. Схема введения смесей. |
Титр вируса в контроле и титр вируса в опыте подсчитывают по методу Рида и Меича и выражают в ОДзо. Индекс нейтрализации (ИН) равен разности титра вируса в контроле и в опыте. Положительно реагирующей считают сыворотку с HH=l,5lg и выше.
смеси с исследуемой сывороткой не проявил биологической активности (не вызвал образования опухоли у подопытных цыплят).
9. Методика выделения вирусов лейкоз-саркомной группы.
9.1. Исходный вируссодержащий материал для выделения вирусов: а) лейкоза — внутренние органы птиц с характерными для этого заболевания изменениями и эмбрионы кур-вирусоносителей; б) саркомы-опухоли во внутренних opiaHax, на серозных оболочках, под кожей и в мышцах. Диагноз на лейкоз и саркому при этом подтверждают гистологическим исследованием отобранных и фиксированных в 10 %-ном растворе формалина кусочков опухолей, нервов и внутренних органов: печени, селезенки, почек, поджелудочной железы, яичника. Исключают болезнь Марека. Патматериал для вирусологических исследований берут с соблюдением правил асептики тотчас после вскрытия павшей или убитой птицы. Материал от больной лейкозом птицы хранят при температуре минус 70 °С или в жидком азоте; от кур, больных саркомой, — при минус 20 °С. При необходимости траспортировки материал доставляется в консерванте. Консервант готовят следующим образом: в 250 мл стерильной Сиди-стиллированной воды, подогретой до 80 °С, растворяют 13,75 г глюкозы. Раствор охлаждают до 40 °С и добавляют к нему антибиотики. Затем 250 мл х. ч. глицерина нагревают до 100 °С и после охлаждения до 40 °С смешивают с раствором глюкозы.
Подготовка патматериала к исследованию. Кусочки органов или опухоли тщательно отмывают от консерванта и крови фосфатно-буферным раствором или раствором Хенкса с pH 7,4—7,6. Из отмытого патматериала готовят 30—70 %-ный гомогенат на среде 199 с антибиотиками. Гомогенат центрифугируют при 3 тыс. об/мин в течение 20 мин. Супернатант сливают в стерильные флаконы и фильтруют через фильтр Зейтца (фильтровальные пластины БК с величиной пор 0,1 нм), pH фильтрата должен быть в пределах 7,4—
7,6. Бесклеточный фильтрат исследуют в РСК на наличие ГС-анти-гена. Для вирусологических исследований используют только РСК* положительный фильтрат, так называемый «тканевой* вирус (схема 3). Бесклеточный фильтрат контролируют на отсутствие посторонней
ПРЕДИСЛОВИЕ
Успешное выполнение намеченной XXVII съездом КПСС широкой программы развития в нашей стране агропромышленного комплекса в немалой степени зависит от хорошей организации ветеринарного обслуживания животноводства, четко налаженной работы ветеринарных диагностических лабораторий. Проводимые в лабораториях исследования позволяют правильно организовать мероприятия по предупреждению инфекционных и инвазионных болезней, а в случаях возникновения заболевания своевременно поставить диагноз и принять целенаправленные меры по его быстрейшей ликвидации.
В работе ветеринарных лабораторий все большее применение находят современные методы исследований, одновременно идет совершенствование диагностики многих заболеваний, предлагаются новые более чувствительные и достоверные методы, позволяющие полнее и на ранних стадиях выявлять заболевших животных и тем самым способствовать быстрейшему оздоровлению хозяйств.
Специалисты лабораторий постоянно расширяют перечень показателей и болезней, на которые проводятся исследования.
За последнее время утверждено значительное количество инструктивных документов по проведению лабораторных исследований, что позволило более четко организовать работу специалистов, улучшить качество исследований, получать сопоставимые результаты.
Оснащение лабораторий современным оборудованием позволяет внедрять в работу более точные инструментальные методы.
В своей работе ветеринарные лаборатории не могут использовать всего многообразия предлагаемых методов исследования из-за того, что они или недостаточно апробированы, или из-за сложности используемого оборудования. Имеют место случаи, когда предлагаемые различными авторами методы при определении одних и тех же показателей дают несовпадающие результаты. Поэтому в настоящий справочник включены методы лабораторных исследований патологического материала, полученного от больных, убитых или павших сельскохозяйственных животных, апробированные Центральной ветеринарной лабораторией и утвержденные в разные годы бывшим Министерством сельского хозяйства СССР.
Книга содержит методические указания по диагностике вирусных, риккетсиозных, хламидиозиых болезней, а также методические указания по лабораторной диагностике паразитарных болезней животных и пчел.
Методики излагаются по единой схеме: взятие и пересылка патологического материала, методы его обработки, микроскопические исследования, включая световую и люминесцентную микроскопию, выделение возбудителей на куриных эмбрионах и культурах клеток, заражение лабораторных животных, гистологические исследования, идентификация и дифференциация возбудителей с использованием различных методов, определение биологической активности вакцин и исследования на напряженность иммунитета.
Методы лабораторных исследований, представленные и справочнике, унифицированы и стандартизированы, что создает возможность для стандартизации аппаратов, приборов, инструментов, посуды, реактивов, биопрепаратов и другого специального имущества, определения объема подготовки специалистов и степень оснащения ветеринарных диагностических лабораторий. Таким образом, стандартизация методов исследования является способом наведения строгого порядка в ветеринарной лабораторной работе.
ЛЕЙКОЗ ПТИЦ
Временное наставление по лабораторной диагностике лейкоза птиц
(Рекомендовано 16 февраля 1975 г.)
1. Лабораторная диагностика лейкоза птиц основана на выявлении группоспецифического (ГС) антигена вирусов лейкоз-сарком-ной группы в серологических реакциях: реакции связывания комплемента (РСК), кофал-тесте, реакции непрямой гемагглютинации (РИГА), нммунофлуоресценции (ИФ).
В случае необходимости выявления типоспецифических (ТС) антигенов РИФ-тестом, типоспецифических (ТС) антител реакцией нейтрализации и выделения вирусов лейкоз-саркомной группы материалы направляют в соответствующие научно-исследовательские институты.
2. Лабораторная диагностика лейкоза птиц применяется для изучения эпизоотического состояния птицы по лейкозу и оздоровления птицеводческих хозяйств от этой болезни в комплексе с общими
ветеринарно-санитарными мероприятиями, для выведения линий кур, генетически устойчивых к лейкозу, а также для контроля эмбрионов, используемых биопромышленностыо.
3. Методика постановки РСК при лейкозе птиц.
3.1. РСК применяется для индикации в исследуемом материале (сыворотках крови, культурах фибробластов и аллантоисной жидкости эмбрионов, экстрактах органов кур) ГС-антигена вирусов лейкоз-саркомиой группы.
3.2. Реакция ставится микрометодом с использованием микро-титратора Такачи в объеме 0,125 мл всех компонентов. Реакцию мож* но ставить и макрометодом в объеме 0,5 мл. Первую фазу реакции — связывание — проводят при температуре 4°С в холодильнике в течение 16—18 ч. Вторую фазу — индикаторную — во влажной камере термостата при температуре 37—38 °С в течение 1 ч.
3.3. Компоненты реакции: фосфатно-буферный или физиологический раствор с pH 7,2; гемолитическая сыворотка биофабричного производства (гемолизин) с рабочим титром не меиее 1 : 1200; свежая или консервированная сыворотка морской свинки (комплемент); 3 %-ная взвесь эритроцитов барана; специфическая сыворотка, полученная на вирус саркомы Рауса штаммов Ьриан стандартный или Шмидта — Руппина методом иммунизации голубей или хомяков; унифицированный диагностикум, полученный на вирус эритробластоза штамма Р путем иммунизации кроликов; нормальная (контрольная) сыворотка здорового голубя, хомяка или кролика; специфический (положительный) антиген — осветленный центрифу-гат 10 %-ного экстракта опухолевой ткани саркомы Рауса или 10 %-ный экстракт культуры клеток фибробластов, зараженных вирусом саркомы Рауса; отрицательный (контрольный) антиген — осветленный центрифугат 10 %-ного экстракта мышц и органов от здоровых кур или культуры фибробластов из эмбриона курицы, свободной от контаминации вирусами лейкоз-саркомной группы; исследуемый материал — сыворотки крови кур, 10—20 %-ные экстракты пораженных органов кур, культуры фибробластов эмбрионов кур 3-го пассажа и т. д. в разведениях 1 :2—1 :4. После разведения для освобождения ГС-антигена вирусов лейкоз-саркомной группы и ликвидации антикомплементарных свойств материал подвергают 3—5-кратному замораживанию и размораживанию, инактивированию при температуре 56 °С в течение 30 мин в водяной бане и центрифугиро* ванию при 3 тыс. об/мин в течение 20 мин.
3.4. Т и т р о в а н и е компонентов реакции. Предварительно титруют гемолизин, комплемент и специфическую сыворотку или унифицированный диагностикум.
Титрование гемолизина и комплемента в гемолитической системе проводят по квадратной схеме. Во вспомогательных рядах пробирок готовят раздельно разведения гемолизина от 1 ; 1000 до 1 : 4000 и комплемента от 1 : 10 до 1 :80 по общепринятым методикам, затем соответственно соединяют их в лунках пластины, разливая каждое разведение гемолизина по вертикальным рядам, а разведения комплемента по горизонтальным с помощью капельницы по 0,025 мл. Добавляют по 0,025 мл 3 %-ной взвеси бараньих эритроцитов и по 0,05 мл буферного или физиологического раствора во все лунки пластины.
Контрол и: гемолизина (гемолизин 1 : 100 +эритроциты по 0,025 мл+буферный или физиологический раствор до объема
0,125 мл); комплемента (комплемент I : 10 +эритроциты по 0,025 мл+ + буферный или физиологический раствор до объема 0,125 мл); эритроцитов (эритроциты 0,025 мл + буферный или физиологический раствор до объема 0,125 мл).
После разлива всех компонентов пластины встряхивают и ставят во влажную камеру термостата при температуре 37—38 °С на 1 ч. Затем определяют титр гемолизина и комплемента при отсутствии гемолиза эритроцитов во всех контрольных луночках. Титром гемолизина считают то его наибольшее разведение, при котором наступает полный гемолиз эритроцитов в присутствии комплемента, разведенного 1 : 10.
Гемолитическая система для опыта готовится по общепринятой методике с использованием гемолизина в 3-кратном титре.
Титр комплемента — его наивысшее разведение, при котором произошел полный гемолиз эритроцитов при соответствующем максимальном разведении гемолизина. За рабочее разведение комплемента принимают разведение через ряд выше титра комплемента.
Определение одной гемолитической единицы комплемента проводят перед каждым опытом. С этой целью испытывают дробные дозы комплемента в пределах рабочего разведения от 0,005 до 0,022. Ввиду невозможности отмерить столь малые объемы готовят во вспомогательном ряду пробирок 50-кратные дозы комплемента.
Пример. Если рабочее разведение комплемента равно 1 :20, то во вспомогательном ряду пробирок готовят из этого разведения следующие дробные дозы комплемента (табл. 1).
1. Разведение комплемента
|
Компоненты, мл |
Номер пробирок | |||||
|
1 |
2 | 3 | 4 |
б |
6 |
7 |
8 | |
|
Комплемент 1 :20 |
0,25 0,35 |
0,5 |
0,6 0,75 |
0,85 1,0 1,1 |
|
Буферный или физраствор |
1,0 0,9 |
0,75 |
0,65 0,5 |
0,4 0,25 0,15 |
|
Искомая доза комплемента |
0,005 0,007 |
0,01 |
0,012 0,015 |
0,017 0,02 0,022 |
Отдельной капельницей из каждой пробирки вспомогательного ряда комплемента по 0,025 мл переносят в ряды лунок пластины, соответствующие: исследуемым антигенам или сывороткам, взятым выборочно от партии; контрольным положительному и отрицательному антигенам; специфической сыворотке или унифицированному диагностикуму, которые предварительно разливают в разведении 1 : 2 или 1 :4 по 0,025 мл.
Во все лунки вносят буферный или физиологический раствор по 0,025 мл, а в лунки контроля на гемотоксичность — по 0,05 мл. Пластины встряхивают и выдерживают при температуре 4°С в холодильнике в течение 16—18 ч. После этого в лунки добавляют гемолитическую систему в объеме 0,05 мл. Пластины встряхивают и помещают во влажную камеру термостата при температуре 37—38 °С на 1 ч. Через 15 мин пластины повторно встряхивают. Реакцию учитывают после 2—3-часовой выдержки смеси компонентов при комнатной температуре.
Контрол и: испытуемые и контрольные антигены и сыворотки на гемотоксичность (антигены и сыворотки по 0,025 мл г гемсистс-ма 0,05 мл + буферный или физиологический раствор до объема 0,125 мл); комплемента (отдельно каждая доза комплемента 0,025 мл + гемсистема 0,05 мл + буферный или физиологический раствор до объема 0,125 мл); гемсистемы (гемсистема 0,05 мл + буферный или физиологический раствор до объема 0,125 мл).
Одной гемолитической единицей комплемента считают минимальное его количество, необходимое для полного гемолиза взвеси эритроцитов в рядах лунок с основными разведениями испытуемых и контрольных антигенов и сывороток (табл. 2).
2. Результаты титрования комплемента в присутствии испытуемых и контрольных антигенов и сывороток
|
Доза комплемента, мл | ||
|
Компоненты |
0,005 0,007 0,01 0,012 | 0,015 0,017 |
0,02|о,022 |
Исследуемый антиген или 44 *44- 4+ +4- +4 4 0 0 сыворотка 4-4 Н—f—Н- 44
Специфический антиген 44* 44—М—Ь4 44—(-4 0 0
44 44 44 44 44 Отрицательный антиген 44 4 0 0 0 0 0
Специфическая сыворотка 44* 44 4Н—Ь4 44 0 0 0
к ВСР или унифицирован- 44 44—Ь4 44 ный диагностикум
В данном примере активность комплемента соответствует дозе 0,02 мл в присутствии антигенов, а в присутствии сыворотки — 0,017 мл.
За гемолитическую единицу комплемента принимается доза 0,02 мл. Для основного опыта берут 2—3 восходящих дозы или 1,5—2 ед.
Пример расчета комплемента для опыта на 2 ед.: в опыте необходимо заполнить 200 лунок. Чистого комплемента для опыта потребуется:
0,02-2-200
Общий объем разведенного комплемента для опыта равен: 0,025-200=5 мл. Следует брать 0,4 мл чистого комплемента на 4,0 мл буферного или физиологического раствора. Аналогично проводят расчет и 1,5-кратной дозы комплемента.
Титрование специфической сыворотки к ВСР или унифицированного диагностикума. Титрование проводят в качестве контроля для полученной серии диагностикума. Сыворотку титруют по квадратной схеме с положительным и отрицательным антигенами. Готовят разведения сыворотки и положительного антигена от 1:2 до 1:128, которые вносят в лунки пластины по вертикальным и горизонтальным рядам. Отрицательный антиген используют в разведении 1 :2 или 1 :4. Затем в лунки добавляют комплемент, концентрация которого должна соответствовать 50 % избытку, т. е. составлять 1,5 ед. Пластины с компонентами тщательно встряхивают и выдерживают 16—18 ч при температуре 3—4°С.
Для контроля разливают нормальную сыворотку в разведениях 1:4 и 1:8 для каждого разведения положительного и отрицательного антигенов. Добавляют гемолитическую систему, выдерживают 45 мин при температуре 37 °С, после чего учитывают результаты реакции (табл. 3).
3. Примерная схема учета результатов
|
Разведение антигена |
Разведение специфической сыворотки |
КонтрОЛИ нормальной сыворотки | |||||||
|
112 |
114 |
1(8 |
1(16 |
1:32 |
1J64 | |
(128 |
1:4 | |
1:8 | |
|
Положительного 1 :2 |
++ |
4-4- |
4-4- |
4-4- |
4-4- |
4- |
0 |
0 |
0 |
|
1 :4 |
++ 4-4- |
4-4- 4-4- |
4-4- 4-4- |
4- 4-4- |
4-4- |
4- |
0 |
0 |
0 |
|
1:8 |
4-4- +4- |
4-4- -н- |
4-4- ++ |
4-4- 4.4- |
4- |
0 |
0 |
0 |
0 |
|
1 : 16 |
4-4- 4-4- |
4-4- 4-4- |
4-4- 4-4- |
4- |
0 |
0 |
0 |
0 |
0 |
|
1 :32 |
4-4- 4-4- |
4-4- 4-4- |
4- 4- |
0 |
0 |
0 |
0 |
0 |
0 |
|
1 :64 |
4-4- тт |
4-4- 4- |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
|
1:128 |
т+ |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
|
Отрицатель ного 1 : 2 |
4- |
0 |
0 |
0 |
0 |
0 |
0 |
0 | |
|
1 :4 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 | |
Титром специфической сыворотки считают то наибольшее разведение ее, которое вызывает задержку гемолиза на 3 и 4 плюса при максимальном разведении положительного антигена. Титр специфической сыворотки должен быть не ниже 1 : 8.
3.5. Постановка основного опыта. Схема постановки основного опыта представлена в таблице 4. В ряды из 7 лунок по горизонтали вносят исследуемые и контрольные антигены в разведении, установленном при титровании комплемента в присутствии испытуемых антигенов. Затем по вертикали вносят: буферный или физиологический раствор (в 1-й и 2-й ряды по 0,025 мл — контроль на антикомплементарность; в 7-й ряд по 0,05 мл — контроль на ге-мотоксичиость); специфическую сыворотку в ее титре (в ряды 3-й и 4-й); отрицательную сыворотку в разведении, равном разведению специфической сыворотки (контроль специфичности антираусовской сыворотки в 5-й и 6-й ряды). Затем во все нечетные ряды, кроме 7, вносят комплемент в 1,5-кратной дозе, в четные —в 2-кратной дозе. Дополнительно контролируют комплемент в 1,5- и 2-кратной дозе и гемолитическую систему. Пластины встряхивают и ставят на 16— 18 ч при температуре 4°С в холодильник, затем добавляют во все лунки гемолитическую систему. Пластины встряхивают и ставят во влажную камеру термостата при температуре 37 °С на 1 ч. Через
1
Фенотип особи представляет частный случай проявления генотипа в конкретных условиях среды. Фенотип устанавливают на основании данных РИФ-теста. Фибробласты эмбрионов кур РИФ-отрицательные (не содержащие вирусов лейкоз-саркомы подгрупп А, В, С, D) и чувствительные к заражению этими вирусами обозначают С/О.