Временные методические указания по определению биологической активности вирусвакцины из штамма ВНИИБТ против инфекционного ларинготрахеита птиц
Купить бумажный документ с голограммой и синими печатями. подробнее
Цена на этот документ пока неизвестна. Нажмите кнопку "Купить" и сделайте заказ, и мы пришлем вам цену.
Распространяем нормативную документацию с 1999 года. Пробиваем чеки, платим налоги, принимаем к оплате все законные формы платежей без дополнительных процентов. Наши клиенты защищены Законом. ООО "ЦНТИ Нормоконтроль"
Наши цены ниже, чем в других местах, потому что мы работаем напрямую с поставщиками документов.
Способы доставки
- Срочная курьерская доставка (1-3 дня)
- Курьерская доставка (7 дней)
- Самовывоз из московского офиса
- Почта РФ
Оглавление
1. Общие положения
2. Материалы и методы
3. Титрование вирусвакцины
Приложение. Антилогарифмы
| Дата введения | 01.01.2021 |
|---|---|
| Добавлен в базу | 01.02.2020 |
| Актуализация | 01.01.2021 |
Этот документ находится в:
- Раздел Экология
- Раздел 11 ЗДРАВООХРАНЕНИЕ
- Раздел 11.220 Ветеринария
- Раздел 11 ЗДРАВООХРАНЕНИЕ
Организации:
| Издан | Агропромиздат | 1987 г. |
Чтобы бесплатно скачать этот документ в формате PDF, поддержите наш сайт и нажмите кнопку:

стр. 1

стр. 2

стр. 3

стр. 4

стр. 5

стр. 6

стр. 7

стр. 8
стр. 9

стр. 10
стр. 11

стр. 12

стр. 13

стр. 14

стр. 15

стр. 16

стр. 17

стр. 18
СПР/ТО
Ш
АБОРАТОРНЫЕ ИССЛЕДОВАНИЯ В ВЕТЕРИНАР ИИ
ВИРУСНЫЕ, РИККЕТСИОЗНЫЕ И ПАРАЗИТАРНЫЕ БОЛЕЗНИ
СПРАВОЧНИКЛАБОРАТОРНЫЕ ИССЛЕДОВАНИЯ В ВЕТЕРИНАРИИ
ВИРУСНЫЕ, РИККЕТСИОЗНЫЕ И ПАРАЗИТАРНЫЕ БОЛЕЗНИ
Под редакцией Б. И. АНТОНОВА
т
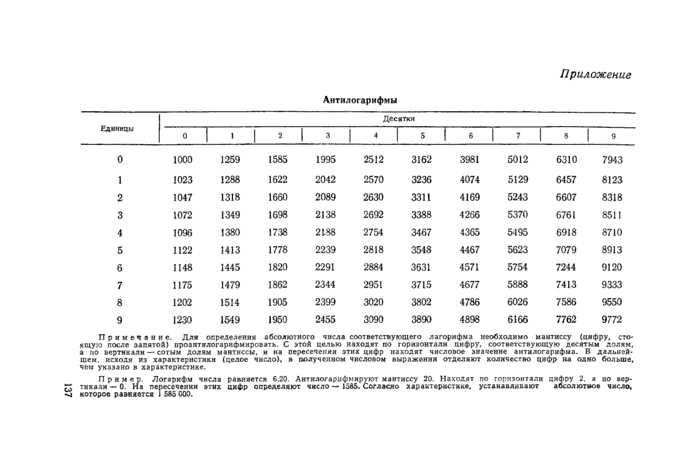
ПриложениеАнтилогарифмы
|
Десятки | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Примечание. Для определения абсолютного числа соответствующего дагорифма необходимо мантиссу (цифру, стоящую после запятой) проаятидогаркфмировать. С >тоА целью находят по горизонтали цифру, соответствующую десятым долям, а по вертикали — сотым долям мантиссы, и на пересечении этих цифр находят числовое лхасские антилогарифма. В дальнейшем. исходя из характеристики (целое число), я полученном числовом выражения отделяют количество цифр на одно больше, чем указано в характеристике.
Пример Логарифм числа равняется 6.20 Антилогарифмируют мантиссу 20 Находят по горизонтали цифру 2. а по аер-г: тикали — 0. На пересечении этих цифр определяют число — 1565. Согласно характеристике, устанавливают абсолютное число, -si которое равняется I ИЗ ООО.
учреждения, ее изготовившего, номер серии и дату изготовления, дату поступления иа исследование и наименование хозяйства, откуда поступила вакцина, и результат исследования.
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
|
Агар мясо-пептонный 83, 92 Альбумин бычий 63, 64 Аппарат Киппа 35, 39 Бульон мясо-пептонный 92 — триптозно-фосфатный 113 Гемолизин 105 Гемолитическая система (гем- система) 56, 105 Жидкость Барбагалло 170, 188 — Руге 127 Иммуноасцитическая жидкость (ИАЖ) 13 Йодный реактив Мелена 79 Комплемент 16, 24, 105 Метод гельминтоскопии 164, 176 — биопсии 176 — биохимический 179, 187 — Вишняускаса 160 — Гнединой 175 — Ковоана 175 — комбинированный 177 — микроагглютинации с помощью аппарата Такачи 85, 105 — раздавленной капли 198, 204, 210, 213, 215, 226 — световой микроскопии (три-хинеллоскопии) 179 — седиментации с целлофановыми пленками 160 — Щербовича 185 — Фюллеборна 183 Методика Бермана 171, 183 — Кивако 176 — комбинированная в модификации Котельникова и Хренова 173 Методика культивирования личинок стронгилят и лавроско-пии 168 — седиментации с центрифугированием по Котельникову, Корчагину и Хренову 172 — упрощенная модификация методики Бермана 171 — флотации 160, 164, 166, 176 |
Окраска гистопрепаратов по Ленцу 1! ---Туревичу 11 — мазков по Борману —Гайнуллиной 7 ---Бурри 227 ---Лейшману 225, 228 --— Михину 6 ---Морозову 127 ---Муромцеву 6 ---Нохту 70 ---Паппенгейму 70 ---Пашену 127 ---Романовскому 191, 199, 211, 215, 216, 225, 228 ---Романовскому — Гим- эе 21 --- Селлерсу 6 — --Стемну 21 ■---Щуренковой 191Перевиваемая линия почки свиньи (СПЭВ) 92 Первично-трипсинизированная культура клеток почки свиньи (ПЭС) 41, 92 --эмбриона коров (ПЭК) 58 --тестикулов бычка (ТБ) 58 Раствор азотнокислого натрия 185 — азотнокислого свинца 159, 160, 173 — азотнокислого серебра 127 — Альсевера 96 Раствор аммиачной селитры 164, 166, 173, 176 — борной кислоты 184 — буферный борантный 157 — веронал-мединаловый 12, 13, 149 — гексаметафосфата 56, 61 — гипосульфита натрия 185 — забуференного глицерина 181 — забуференный физиологический (ЗФР) 82 — лимоннокислого натрия 97 — мертиолята 40, 98, 156 — сернокислого цинка 160, 171, 172 — соляной кислоты 179 |
|
— уксусной кислоты 177 — фосфатно-буферный 9, 66, 96 — Хенке 63, 81 —- хлорида цинка 177 — электролита 68 — Эрла 100 Реакция гемагглюгннацин (РГА) 36, 60 — гемадсорбции (РГАд) 42, 59 Среда 199, 81, 92 — 0,5 %-ного гидролизата лак-тальбумина 81, 92, 113 — Игла 97, 100 — диффузионной преципитации (РДП) 55, 61, 141, 155 — длительного связывания комплемента (РДСК) 16, 23, 9ft — ЙАТ 151 — иммунофлуоресценции (ИФ) 54, 79, 80, 91, 111 — иммуноэлектроосмиофореза (РИЭОФ) 147 —кольцепреципитации в капилляре 182 — нейтрализации (PH) 42, 81, 91, 94, 115, 117 — нейтрализации вирусных гемагглютинииов (РНВГ) 63 — непрямой гемагглютинации (РИГА) 64, 65, 66, 82, 84 — непрямой иммунофлуоресценции 180 — подавления иммунофлуоресценции 54, 91 — радиальной иммунодиффу-вии (РРИД) 71, 76, 78 диагиостикум — связывания комплемента (РСК) 23, 24, 56, 57, 192, 199, 219 |
--конглютинирующего комплекса 207 — торможения гемагглютинации (Р'ГГА, или РЗГА) 43, 60 --гемадсорбции (РТГАд) 42, 60 --непрямой гемагглютииа- ции (РТНГА) 62, 63, 142 — формалиновая 205, 226 ■— Игла (МЕМ) 113 — Кнтта — Тароцци 83, 92 — пептонно-агаровая 211 — Петровского 211 — поддерживающая 87, 92 — ростовая 92 — Сабуро 134 Тельца Бабеща — Нсгри 5, 6 Тканевая цитопатическая доза (ТЦД) 64, 103 Термолабильные ингибиторы 35, 95 Термостабильные ингибиторы 35, 95 Цитопатическое действие (ЦПД) 58, 81, 87, 93 Эритроцитарный |
СОДЕРЖАНИЕ
Предисловие........ 3
МЕТОДЫ ДИАГНОСТИКИ ВИРУСНЫХ И РИККЕТСИОЗНЫХ ИНФЕКЦИИ
Болезни, общие для всех видов животных...... 5
Бешенство......... 5
Методические указания по лабораторной диагностике бешенства . 5
Болезнь Ауески .............12
Методические указания по лабораторной диагностике болезни Ауески животных.........12
Лихорадка Ку........... . 16
Методические указания по серологической диагностике лихорадки Ку животных....... 16
Хламидийные инфекции ...........20
Методические указания по лабораторным исследованиям на хламидийные инфекции сельскохозяйственных животных 20
Болезни лошадей............33
Грипп .......... 33
Временное наставление по лабораторной диагностике гриппа лошадей . 33
Ринопневмония.............40
Методические указания по лабораторной диагностике ри-
нопневмонии лошадей..........40
Инфекционная анемия ........... 44
Временные методические указания по лабораторной диагностике инфекционной анемии лошадей.....44
Методика постановки реакции диффузионной преципитации (РДП) для серологической диагностики инфекционной
анемии лошадей........ 43
Болезни крупного и мелкого рогатого скота.....51
Респираторно-кишечные инфекции крупного рогатого скота . 61
Методические указания по лабораторной диагностике вирусных респираторно-кишечных инфекций крупного рогатого скота .............51
Методические указания по серодиагностике инфекционного ринотрахеита крупного рогатого скота в реакции непрямой гемагглютинации (РИГА) ... ..... 65
Лейкоз крупного рогатого скота....... 67
Методические указания по диагностике лейкоза крупного рогатого скота............67
Аденоматоз овец и коз...........76
Временные методические указания по лабораторной диагностике аденоматоза овец и коз.......76
Временная методика постановки реакции по определению
гиперпротеинемии у овец и коз.......79
Болезни свиней ............. 79
Вирусный (трансмиссивный) гастроэнтерит.....79
Методические указания по лабораторной диагностике вирусного (трансмиссивного) гастроэнтерита свиней . , 79
Временное наставление по применению набора для серо-диагностики трансмиссивного гастроэнтерита свиней . . 84
Энтеровирусный гастроэнтерит . . . 86
Методические указания по лабораторной диагностике энте-
ровирусного гастроэнтерита свиней ...... 86
Грипп...............89
Наставление по применению набора антигенов и сывороток
для диагностики гриппа свиней.......89
Энзоотический энцефаломиелит (болезнь Тешена) ... 91
Методические указания по лабораторной диагностике энзоотического энцефаломиелита (болезни Тешена) свиней 91
Парвовирусная болезнь...........95
Методические указания по диагностике парвовирусной болезни свиней............95
Болезни птиц.............97
Болезнь Марека (нейролимфоматоз птиц).....97
Методические указания по лабораторной диагностике болезни Марека (нейролимфоматоза) птиц.....97
Вирусный энтерит гусят ...........102
Методические указания по лабораторной диагностике вирусного энтерита гусят..........102
Лейкоз птиц..............104
Временное наставление по лабораторной диагностике лейкоза птиц............. 104
Оспа птиц..............125
Методические указания по лабораторной диагностике оспы птиц..............125
Инфекционный ларннготрахеит кур....... 128
Временное наставление по лабораторной диагностике инфекционного ларинготрахеита кур ....... 128
Временные методические указания по определению биологической активности вирусвакцины из штамма ВНИИБТ против инфекционного ларинготрахеита птиц .... 132
Инфекционный бронхит кур.........138
Наставление по лабораторной диагностике инфекционного
бронхита кур............138
Болезни пушных зверей и пчел........ 145
Миксоматоз кроликов...........145
Временные методические указания по лабораторной диагностике мнксоматоза кроликов........145
Алеутская болезнь норок (плазмоцитоз)......147
Наставление по применению набора антигена и контрольных сывороток в реакции иммуноэлектроосмофореза для серологической диагностики алеутской болезни норок . 147
Наставление по прижизненной диагностике алеутской болезни норок при помощи йодно-агглютинационного теста 151
Трансмиссивная энцефалопатия норок.......152
Временные методические указания по лабораторной диагностике трансмиссивной энцефалопатии норок . . 152
Вирусный энтерит норок..........154
Временные методические указания по гистологическому исследованию на вирусный энтерит норок.....154
Гепатит песцов, лисиц и собак.........155
Временное наставление по постановке реакции диффузионной преципитации (РДП) в агаровом геле для диагностики вирусного гепатита песцов, лисиц и собак ... 155
Острый паралич пчел и заболевание, вызываемое нитевидным
вирусом пчел.............157
Методические указания по постановке реакции диффузионной преципитации (РДП) в агаровом геле для диагностики острого паралича пчел и заболевания, вызываемого нитевидным вирусом пчел..........157
ПАРАЗИТАРНЫЕ БОЛЕЗНИ
Гельминтозы........... 159
Методические указания по диагностике гельминтозов животных ..............159
Методические указания по лабораторным исследованиям
на гельминтозы плотоядных........176
Трихинеллез..............179
Методические указания по лабораторной диагностике трихинеллеза животных..........179
Временное наставление по применению реакции непрямой иммунофлуоресцепции для прижизненной диагностики
трихинеллеза свиней .......... 180
Трихинеллез клеточных пушных зверей и его диагностика 182 Приложение к «Инструкции по профилактике ликвидации трихинеллеза в звероводческих хозяйствах (фермах)» . 182
Стронгилоидоэ.............183
Методические указания по лабораторным исследованиям
на стронгилоидоэ животных........ 183
Телязноз...... 184
Методические указания по лабораторным исследованиям
на телязиоз крупного рогатого скота......184
Акантоцефалезы ............185
Методические указания по лабораторным исследованиям на акантоцефалезы животных (макроканторинхоз свиней, полиморфоз, филиколлез водоплавающих птиц) ... 185
Промежуточные (дополнительные) хозяева.....186
Методические указания по лабораторным исследованиям промежуточных (дополнительных) хозяев на личинки гельминтов ....... 186
Лротозоозы..............190
Пироплазмидозы..... 190
Извлечение из временной инструкции о мероприятиях по
борьбе с пироплазмидозами животных.....190
Анаплазмоз крупного и мелкого рогатого скота .... 191
(Приложение № I к «Инструкции по борьбе с анаплазмозом крупного и мелкого рогатого скота»).....191
Методика постановки РСК для диагностики анаплазмоза крупного и мелкого рогатого скота......192
Эперитрозооноз ............. 194
Методические указания по лабораторным исследованиям
на эперитрозооноз овец.........194
Трипанозомозы.............198
Методические указания по лабораторным исследованиям на случную болезнь лошадей, ослов, мулов .... 198
Извлечение из инструкции по борьбе с трипанозомозом верблюдов, лошадей, ослов, их гибридов и собак . . . 204
Временные Методические указания по постановке и учету реакции связывания конглютинирующего комплекса (РСКК) для диагностики су-ауру у верблюдов . . . 207
Трихомоноз..............209
Методические указания по лабораторной диагностике трихомоноза крупного рогатого скота.......209
Балантидиоз .............212
Извлечение из временной инструкции о мероприятиях по борьбе с заболеванием свиней балантидиозом . . . 212
Гистомоноз..............213
Методические указания по лабораторным исследованиям на гистомоноз (тифлогепатит) птиц . . . . . . 213
Токсоплазмоз.............216
Методические указания по лабораторным исследованиям
на токсоплазмоз животных........216
Временное наставление по применению токсоплазменного антигена КазНИВИ и ИЗ АН КазССР в реакции связывания комплемента (РСК, РДСК) для серологической диагностики токсоплазмоза и токсоплазмоносительства у
животных.............219
Лейшманиоз...... 224
Методические указания по лабораторным исследованиям
на лейшманиоз собак..........224
Боррелиоз (спирохетоз) птиц ......... 226
Методические указания по лабораторным исследованиям
на боррелиоз (спирохетоз) птиц....... 226
Безноитиоз крупного рогатого скота ....... 227
Методические указания по лабораторным исследованиям
на безноитиоз крупного рогатого скота.....227
Акариозы ..............228
Саркоптоидозы.............228
Извлечение из инструкции о мероприятиях по борьбе с cap.
коптоидозами (чесоткой) овец и коз...... 228
Извлечение из инструкции о мероприятиях по борьбе с саркоптоидозами (чесоткой) пушных зверей и кроликов . 229
Извлечение нз инструкции о мероприятиях по предупреждению и ликвидации саркоптоза свиней.....230
Извлечение из инструкции по профилактике и ликвидации заболевания северных оленей чесоткой (саркоптозом) , 231
Инвазионные болезни пчел ....... 232
Нозематоз.............. 232
Методические указания по лабораторным исследованиям
на нозематоз медоносных пчел.......232
Предметный указатель ...........235
ББК 48.73 Л12
УДК 619: 616.98/.99 (031)
Составители: Б. И. Антонов, В. В. Борисова, Л. П. Каменева, Л. И. Ковалерчук, Г. А. Михальский, В, Д. Пев• нева, Л. И. Прянишникова.
Лабораторные исследования в ветеринарии: Ви« Л12 русные, риккетсиозные и паразитарные болезни: Справочник/Под ред. Б. И. Антонова. — М.: Агро-промиздат, 1987.—-240 с.: ил.
В книге даны методы лабораторного исследования патологического ма!ермала с целью определения возбудителей вирусных, риккетсиозных и паразитарных болезней животных. Они изложены по единой схеме. Методы унифицированы и стандартизированы.
3805020000—166 035(01)—87
332-87
ББК 48.73
Для ветврачей и фельдшеров, лаборантов ветеринарных лабораторий.
ЛАБОРАТОРНЫЕ ИССЛЕДОВАНИЯ В ВЕТЕРИНАРИИ: ВИРУСНЫЕ, РИККЕТСИОЗНЫЕ И ПАРАЗИТАРНЫЕ БОЛЕЗНИ
СправочникСоставители; Борис Иванович Антонов, Валерия Валентиновна Борисова, «Людмила Петровна Каменева и др.Зав. редакцией В. Г. Федотов. Редактор В. //. Сайтаниди. Художественный редактор Н. А. Никонова. Технический редактор И. А. Зубкова. Корректор И. В. КарповаИ Б № 5093
Зав. редакцией В. Г. Федотов. Редактор В. //. Сайтаниди. Художественный редактор Н. А. Никонова. Технический редактор И. А. Зубкова. Корректор И. В. КарповаИ Б № 5093
Сдано в набор 02.10.86. Подписано к печати 22.01.87. Т-00912. Формат
84X108711. Бумага тип. JV* 2. Гарнитура Литературная. Печать высокая. Уел. псч. л. 12,6. Уел. кр.-отт. 12,6. Уч.-иэд. л. 18,25. Изд. № 226. Тираж 33 000 экз. Заказ .Ns 668. Цена 1 р. 10 к.
Ордена Трудового Красного Знамени ВО «Агропромнздат», 107807, ГСП, Москва, Б-53, ул. Садовая-Спасская, 18
Владимирская типография Союэполиграфпрома при Государственном комитете СССР по делам издательств, полиграфии и книжной торговли 600000, г. Владимир, Октябрьский проспект, д. 7
© ВО «Агропромнздат», 1987ПРЕДИСЛОВИЕ
Успешное выполнение намеченной XXVII съездом КПСС широкой программы развития в нашей стране агропромышленного комплекса в немалой степени зависит от хорошей организации ветеринарного обслуживания животноводства, четко налаженной работы ветеринарных диагностических лабораторий. Проводимые в лабораториях исследования позволяют правильно организовать мероприятия по предупреждению инфекционных и инвазионных болезней, а в случаях возникновения заболевания своевременно поставить диагноз и принять целенаправленные меры по его быстрейшей ликвидации.
В работе ветеринарных лабораторий все большее применение находят современные методы исследований, одновременно идет совершенствование диагностики многих заболеваний, предлагаются новые более чувствительные и достоверные методы, позволяющие полнее и на ранних стадиях выявлять заболевших животных и тем самым способствовать быстрейшему оздоровлению хозяйств.
Специалисты лабораторий постоянно расширяют перечень показателей и болезней, на которые проводятся исследования.
За последнее время утверждено значительное количество инструктивных документов по проведению лабораторных исследований, что позволило более четко организовать работу специалистов, улучшить качество исследований, получать сопоставимые результаты.
Оснащение лабораторий современным оборудованием позволяет внедрять в работу более точные инструментальные методы.
В своей работе ветеринарные лаборатории не могут использовать всего многообразия предлагаемых методов исследования из-за того, что они или недостаточно апробированы, или из-за сложности используемого оборудования. Имеют место случаи, когда предлагаемые различными авторами методы при определении одних и тех же показателей дают несовпадающие результаты. Поэтому в настоящий справочник включены методы лабораторных исследований патологического материала, полученного от больных, убитых или павших сельскохозяйственных животных, апробированные Центральной ветеринарной лабораторией и утвержденные в разные годы бывшим Министерством сельского хозяйства СССР.
Книга содержит методические указания по диагностике вирусных, риккетсиозных, хламидиозиых болезней, а также методические указания по лабораторной диагностике паразитарных болезней животных и пчел.
Методики излагаются по единой схеме: взятие и пересылка патологического материала, методы его обработки, микроскопические исследования, включая световую и люминесцентную микроскопию, выделение возбудителей на куриных эмбрионах и культурах клеток, заражение лабораторных животных, гистологические исследования, идентификация и дифференциация возбудителей с использованием различных методов, определение биологической активности вакцин и исследования на напряженность иммунитета.
Методы лабораторных исследований, представленные и справочнике, унифицированы и стандартизированы, что создает возможность для стандартизации аппаратов, приборов, инструментов, посуды, реактивов, биопрепаратов и другого специального имущества, определения объема подготовки специалистов и степень оснащения ветеринарных диагностических лабораторий. Таким образом, стандартизация методов исследования является способом наведения строгого порядка в ветеринарной лабораторной работе.
Временные методические указания по определению биологической активности вирусвакцины из штамма ВНИИБТ против инфекционного ларинготрахеита птиц
(Утверждены 17 июля 1985 г.)
1. Общие положения.
*
1.1. В связи с возможным снижением биологической активности (титра) сухой вирусвакцины против инфекционного ларинготрахеита птиц из штамма ВНИИБТ* при хранении или транспортировке, пе-
Именуемой ниже — вакцина.
ред ее применением аэрозольным методом необходимо определять биологическую активность препарата с целью обеспечения точности дозировки при иммунизации.
1.2. На коробке с вакциной указаны количество клоачных доз в ампуле и биологическая активность (титр) вакцины данной серии. Титр вакцины должен быть не ниже 105 ЭИДм/мл (эмбриональных инфекционных доз). В каждой ампуле содержится 2 мл вируса и
2 мл наполнителя.
1.3. Работу по определению биологической активности вакцины выполняют вирусологические отделы республиканских, краевых, областных ветеринарных лабораторий, а также зональные специализированные ветеринарные лаборатории (по болезням птиц).
1.4. Биологическую активность вакцины определяют методом титрования на куриных эмбрионах с последующей статистической обработкой полученных данных.
2. Материалы и методы.
2.1. Для проведения работы по титрованию вирусвакцины ИЛТ необходимо иметь: бокс с предбоксииком, оборудование для вирусологических исследований; стерильные бактериологические пробирки, закрытые ватно-марлевыми или резиновыми пробками; стерильные флаконы на 100 мл; стерильные пипетки на 1, 2, 5 и 10 мл; пипетки Мора на 25 и 50 мл; фарфоровую кружку или стеклянную банку с дезинфицирующим раствором (для отработанных пипеток и других материалов); спиртовку или газовую горелку; ножницы изогнутые глазные остроконечные; пинцеты глазные; шприцы «Рекорд» на 1 мл с инъекционными иглами № 16; подставку с гнездами (ячейками) для куриных эмбрионов; картонные или металлические лотки; пробойники; лейкопластырь или парафин; этиловый спирт;
3 %-ный спиртовой раствор йода; раствор дезинфицирующего вещества (1—2 %-ный раствор едкого натра или 5 %-ный раствор монохлорамина); охлажденный стерильный физиологический раствор, приведенный фосфатным буфером к pH 7,2—7,4; антибиотики (пенициллин, стрептомицин).
2.2. Для определения биологической активности вакцины используют 9-дневные куриные эмбрионы с белой скорлупой из хозяйств, благополучных по инфекционному ларинготрахеиту птиц, где не проводится вакцинация против этой болезни.
2.3. Куриные эмбрионы заражают соответствующими разведениями вирусвакцины (то есть вирусом ИЛТ) в аллантоисную полость (см. п. 3.1 и 3.2).
2.4. Инструменты, используемые при заражении эмбрионов (пинцет, шприц на 1 мл, иглы, пробойники), стерилизуют кипячением в дистиллированной воде. В процессе работы пинцеты и пробойники обрабатывают 96°-ным спиртом и фламбируют.
2.5. Непосредственно перед заражением эмбрионы овосколиру-юг, отбирают эмбрионы с хорошей подвижностью и развитой хорионаллантоисной оболочкой (ХАО) и отмечают границу дуги (естественная воздушная полость).
3. Титрование вирусвакцины.
3.1. Разведение вирусвакцины для титрования. Исходное разведение лиофилизированного вируса ИЛТ (вирусвакцины) готовят начиная с разведения 10_| (без учета наполнителя). Берут 9 ампул вакцины (по 2 мл вируса в ампуле), из которых
составляют 3 пробы (по 3 ампулы в каждой пробе), и параллельно их титруют.
Содержимое трех ампул (6 мл вируса) растворяют в 60 мл стерильного физиологического раствора (разведение I : 10), содержащего 400 ЕД/мл пенициллина и 400 мкг/мл стрептомицина, затем вируссодержащую суспензию центрифугируют 10 мин при 1 тыс. об/мин. Из надосадочной жидкости готовят возрастающие 10-кратные разведения до 10 7.
В ряд соответственно обозначенных стерильных пробирок (по количеству разведений вируса) разливают стерильный физиологический раствор по 9 мл.
Из исходного разведения вируса (1:10) отмеряют 1 мл и переносят в следующую пробирку с 9 мл физиологического раствора, при этом пипетка не должна касаться жидкости. Таким образом получают разведение 1 : 100 (10-2). Использованную пипетку погружают в дезинфицирующий раствор. Другой чистой пипеткой перемешивают вируссодержащую суспензию разведения 10~2 и 1 мл ее переносят в следующую пробирку, получают разведение 10~3, и так до 7-й пробирки (т. е. до разведения 10~7).
3.2. Заражение эмбрионов. Каждым разведением вируса, начиная с 10~7 до 10”1, одним стерильным шприцем заражают в аллантоисную полость по 4 эмбриона 9-днсвного возраста в дозе 0,2 мл (всего 28 эмбрионов). Для этого яйцо помещают вертикально тупым концом вверх. Поверхность скорлупы в области естественной пуги протирают 96°-ным спиртом и фламбируют. Легким ударом пробойника над центром воздушного мешка делают прокол скорлупы. Через отверстие в вертикальном направлении вводят иглу в аллантоисную полость на глубину 2—3 мм ниже границы воздушного мешка. Отверстие в скорлупе после инъекции заклеивают расплавленным парафином или лейкопластырем. Кроме того, 6 эмбрионов оставляют незаряженными для контроля.
Зараженные и контрольные эмбрионы укладывают в лоток вертикально пугой и помещают в термостат, где инкубируют 144 ч при температуре 37±0,5°С и относительной влажности 60—70 %. В термостат ставят кювет (объемом 0,5 л) с водой.
3.3. Эмбрионы овоскопируют 2 раза в день. Эмбрионы, павшие в течение 24 ч после заражения, во внимание не принимают, их собирают и уничтожают, так как в этот период они могут погибнуть не только от действия вируса. Гибель эмбрионов в последующие дни относят за счет действия вакцинного вируса инфекционного ларин-готрахента (при условии, что посевы из каждого эмбриона на питательные среды МПБ, МПА, МППБ и среду Сабуро останутся стерильными). Через 6 дней все эмбрионы вскрывают. При этом учитывают изменения, характерные для вируса ИЛТ (мелкие серо-белые узелки некроза, рассеянные по всей хорионаллантоисной оболочке или слившиеся в бляшки). В контрольных (незаряженных) куриных эмбрионах изменений на ХАО не должно быть.
Титр вируса высчитывают по методу Рида и Менча по каждой пробе отдельно. Примерный расчет по этому методу приводится в таблицах 1 и 2.
Знаком ( + ) обозначены эмбрионы, погибшие после 24 ч инкубации или выжившие, но имеющие характерные для вируса ИЛТ изменения при вскрытии их через 6 дн. после заражения; знаком «0» — эмбрионы, не имеющие изменений, свойственных вирусу ИЛТ.
Из таблицы 1 видно, что при разных разведениях вируса пора-
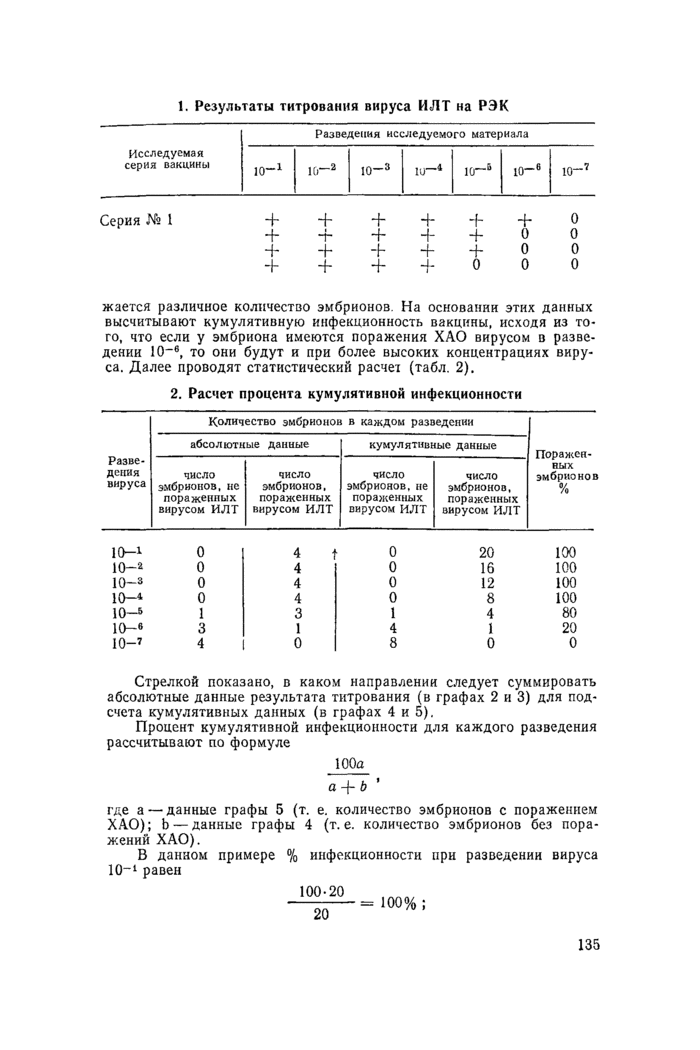
1. Результаты титрования вируса ИЛТ на РЭК
|
Разведения исследуемого материала | |||||||||||||||||||||||||||||||||||||||
|
жается различное количество эмбрионов. На основании этих данных высчитывают кумулятивную инфекционность вакцины, исходя из того, что если у эмбриона имеются поражения ХАО вирусом в разведении 10”®, то они будут и при более высоких концентрациях вируса. Далее проводят статистический расчет (табл. 2).
2. Расчет процента кумулятивной инфекционности
|
Количество эмбрионов в каждом разведении | ||||||||||
|
Разве дения вируса |
|
Поражен ных эмбрионов % | ||||||||
|
10-1 |
0 |
4 f 0 |
20 |
100 | |
|
10-* |
0 |
4 |
0 |
16 |
100 |
|
10-3 |
0 |
4 |
0 |
12 |
100 |
|
10—4 |
0 |
4 |
0 |
8 |
100 |
|
10-ь |
1 |
3 |
1 |
4 |
80 |
|
10-* |
3 |
1 |
4 |
1 |
20 |
|
Ю-7 |
4 |
0 |
8 |
0 |
0 |
Стрелкой показано, в каком направлении следует суммировать абсолютные данные результата титрования (в графах 2 и 3) для подсчета кумулятивных данных (в графах 4 и 5).
Процент кумулятивной инфекционности для каждого разведения рассчитывают по формуле
100а а + Ь *
где a — данные графы 5 (т. е. количество эмбрионов с поражением ХАО); b — данные графы 4 (т. е. количество эмбрионов без поражений ХАО).
В данном примере % инфекционности при разведении вируса 10~1 равен
100-20
% инфекционное™ при разведении вируса 10~5 равен
100*4 400
4+1 " 5
80 % ит. д.
Одна ЭИД50 равна тому количеству вируса, которое вызывает поражение ХАО у 50 % эмбрионов.
Из таблицы 2 видно, что ни при одном разведении вируса ин-фекционность не составляет 50 %, следовательно, ЭИД50 находится между разведениями 10~5 и 10~с.
Разведение вируса, при котором процент инфекционное™ приближается к 50, но выше этой цифры, называется высшей критической дозой, а если он ниже 50 — низшей критической дозой.
В данном примере высшей критической дозой является разведение вируса 10"5 (80 % инфекциоиности), а низшей критической дозой — 10-° (20% инфекционное™).
Для расчета коэффициента пропорциональности (X) предложена формула
_£-50_
с-д 5
где X — коэффициент пропорциональности; С—процент инфекционное™ высшей критической дозы; Д — процент инфекциоиности низшей критической дозы.
Ставим цифровые значения в формулу
J0-5O =Л = 05 80— 20 60
Установлено, что ЭИ Дао равна логарифму высшей критической дозы плюс коэффициент пропорциональности. В данном случае логарифм высшей критической дозы равен 5 (10~5), коэффициент пропорциональности — 0,5. Следовательно, при окончательном подсчете ЭИД$о=5 + 0,5“5,5 (т. е. 105,6 ЭИД5о/0,2 мл). Для определения биологической активности внрусвакцины в 1 мл к полученному числовому выражению логарифма прибавляют постоянную величину 0,7, т. е. в данном случае ЭИД5о=5,5 lg+0,7 lg«6,2 lg. Значит, титр вируса в I мл будет равен 6,2 lg.
3.4. Для перевода титра вируса в абсолютные числа находят антилогарифм числа 6,2, пользуясь приложением к настоящим методическим указаниям (т. е. искомое число антилогарифма в данном примере 6,20, где 6 — характеристика, 20—мантисса, которая определяется на месте пересечения десятых и сотых цифровых значений в таблице, а характеристика указывает на количество знаков в цифровом выражении). В приведенном примере в 1 мл вакцины содержится 1 585 000 ЭИД50 (это и есть абсолютное число).
3.5. Для более точного расчета необходимо провести не менее трех параллельных титрований, так как за биологическую активность вакцины принимается среднеарифметическая величина трех параллельных титрований.
Для аэрозольной вакцинации применяют вакцину с титром не ниже 105 ЭИ Дм/мл.
3.6. Результаты титрования записывают в соответствующей книге (журнале) учета. При этом указывают наименование вакцины и