Решение 159
О классификаторе видов документов регистрационного досье лекарственного препарата и справочнике структурных элементов регистрационного досье лекарственного препарата
Купить Решение 159 — бумажный документ с голограммой и синими печатями. подробнее
Цена на этот документ пока неизвестна. Нажмите кнопку "Купить" и сделайте заказ, и мы пришлем вам цену.
Распространяем нормативную документацию с 1999 года. Пробиваем чеки, платим налоги, принимаем к оплате все законные формы платежей без дополнительных процентов. Наши клиенты защищены Законом. ООО "ЦНТИ Нормоконтроль"
Наши цены ниже, чем в других местах, потому что мы работаем напрямую с поставщиками документов.
Способы доставки
- Срочная курьерская доставка (1-3 дня)
- Курьерская доставка (7 дней)
- Самовывоз из московского офиса
- Почта РФ
Оглавление
Классификатор видов документов регистрационного досье лекарственного препарата
I. Детализированные сведения из классификатора видов документов регистрационного досье лекарственного препарата
II. Паспорт классификатора видов документов регистрационного досье лекарственного препарата
III. Описание структуры классификатора видов документов регистрационного досье лекарственного препарата
Справочник структурных элементов регистрационного досье лекарственного препарата
I. Детализированные сведения справочника структурных элементов регистрационного досье лекарственного препарата
II. Паспорт справочника структурных элементов регистрационного досье лекарственного препарата
III. Описание структуры справочника структурных элементов регистрационного досье лекарственного препарата
| Дата введения | 19.10.2019 |
|---|---|
| Добавлен в базу | 01.02.2020 |
| Актуализация | 01.01.2021 |
Этот документ находится в:
- Раздел Экология
- Раздел 11 ЗДРАВООХРАНЕНИЕ
- Раздел 11.120 Фармацевтика
- Раздел 11 ЗДРАВООХРАНЕНИЕ
- Раздел Строительство
Организации:
| 17.09.2019 | Утвержден | Коллегия Евразийской экономической комиссии | 159 |
|---|---|---|---|
| Издан | Сайт Евразийского экономического союза () | от 19.09.2019 |
Чтобы бесплатно скачать этот документ в формате PDF, поддержите наш сайт и нажмите кнопку:

стр. 1

стр. 2
стр. 3

стр. 4

стр. 5
стр. 6

стр. 7

стр. 8

стр. 9

стр. 10

стр. 11

стр. 12

стр. 13

стр. 14

стр. 15

стр. 16

стр. 17

стр. 18

стр. 19
стр. 20

стр. 21
стр. 22

стр. 23
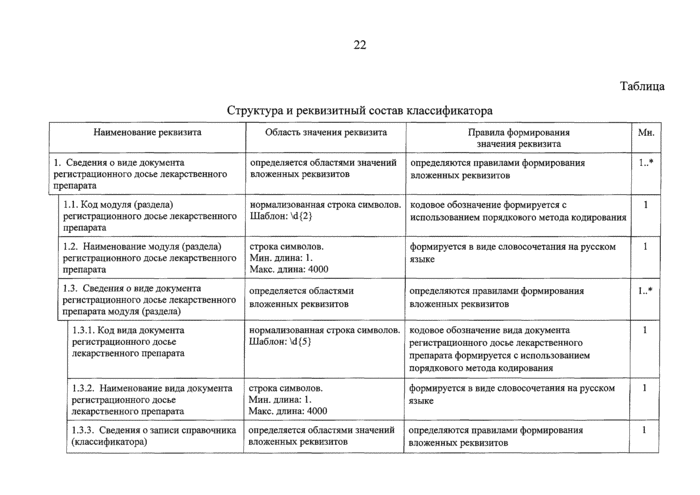
стр. 24

стр. 25
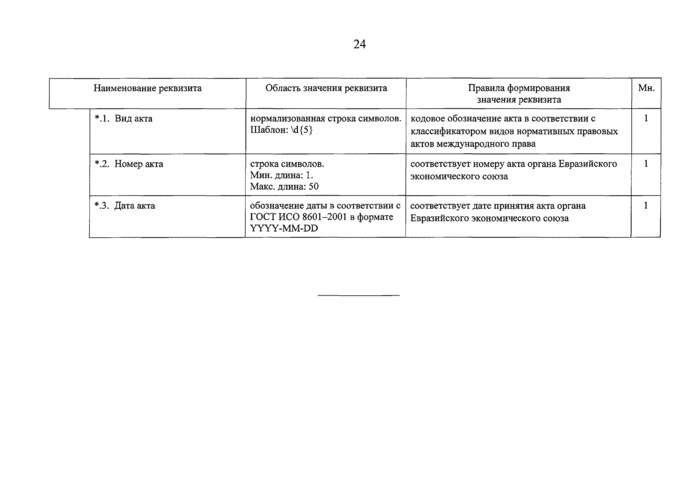
стр. 26
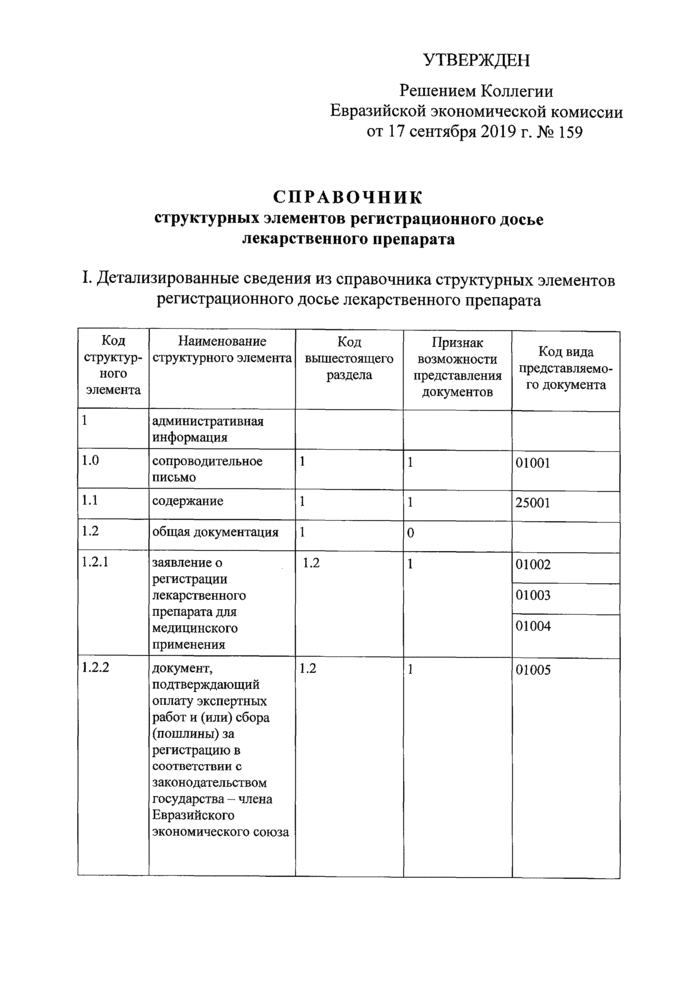
стр. 27
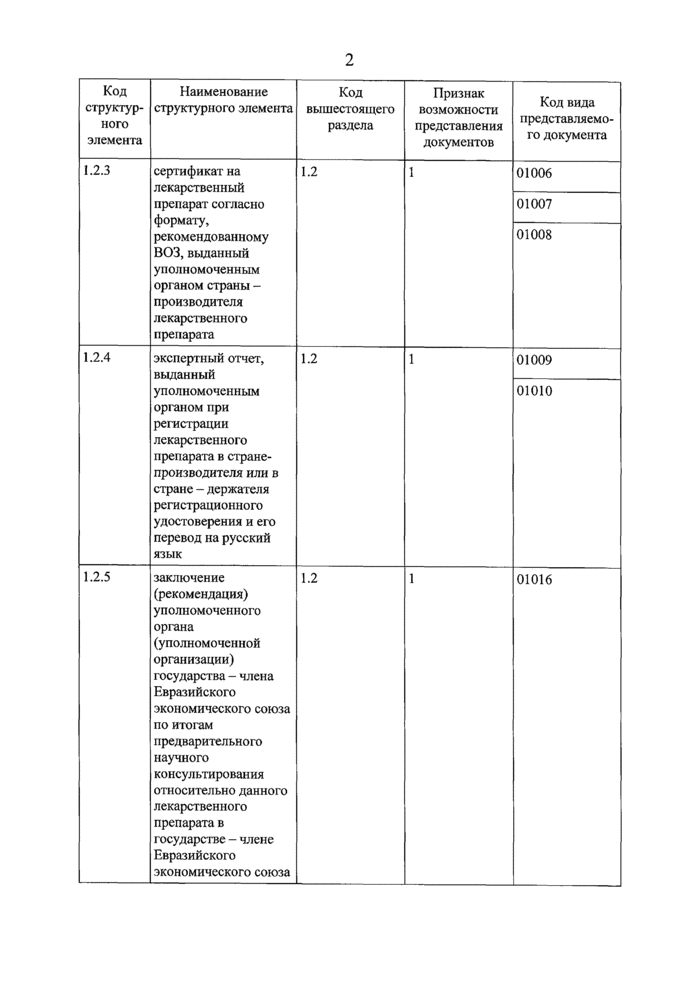
стр. 28
стр. 29
стр. 30
Лк|^
ЕВРАЗИЙСКАЯ ЭКОНОМИЧЕСКАЯ КОМИССИЯ
КОЛЛЕГИЯ
РЕШЕНИЕ
«17» сентября 2019 г. № 159 г. Москва
О классификаторе видов документов регистрационного досье лекарственного препарата и справочнике структурных элементов регистрационного досье лекарственного препарата
В соответствии со статьей 30 Договора о Евразийском экономическом союзе от 29 мая 2014 года, пунктами 4 и 7 Протокола об информационно-коммуникационных технологиях и информационном взаимодействии в рамках Евразийского экономического союза (приложение № 3 к указанному Договору) и руководствуясь Положением о единой системе нормативно-справочной информации Евразийского экономического союза, утвержденным Решением Коллегии Евразийской экономической комиссии от 17 ноября 2015 г. № 155, Коллегия Евразийской экономической комиссии решила:
1. Утвердить прилагаемые:
классификатор видов документов регистрационного досье лекарственного препарата (далее - классификатор);
справочник структурных элементов регистрационного досье лекарственного препарата (далее - справочник).
2. Включить классификатор и справочник в состав ресурсов единой системы нормативно-справочной информации Евразийского экономического союза.
3. Установить, что:
классификатор и справочник применяются с даты вступления настоящего Решения в силу;
использование кодовых обозначений классификатора и справочника является обязательным при реализации общих процессов в рамках Евразийского экономического союза в сфере обращения лекарственных средств.
4. Настоящее Решение вступает в силу гю .истечении 30 календарных дней с даты его официального опублшт№ия.^^ч
((of Для п!
||(Докуа4ЕН7.0 о]
у\М °/ill
Председатель Коллегии hJJ
Евразийской экономической комиссии ^^^Рг-^мтсян
|
Код раздела |
Код вида документа |
Наименование |
|
11004 |
резюме по клинической эффективности | |
|
11005 |
резюме по клинической безопасности | |
|
11006 |
использованный при подготовке резюме литературный источник | |
|
11007 |
краткий обзор индивидуальных исследований | |
|
12 |
документы по качеству, относящиеся к активной фармацевтической субстанции | |
|
12001 |
сведения о наименовании активной фармацевтической субстанции | |
|
12002 |
сведения о структуре активной фармацевтической субстанции | |
|
12003 |
сведения об общих свойствах активной фармацевтической субстанции | |
|
12004 |
сведения о производителе активной фармацевтической субстанции | |
|
12005 |
описание производственного процесса активной фармацевтической субстанции и его контроля | |
|
12006 |
сведения о контроле исходных материалов активной фармацевтической субстанции | |
|
12007 |
сведения о контроле критических стадий и промежуточной продукции при производстве фармацевтической субстанции | |
|
12008 |
сведения о валидации производственного процесса активной фармацевтической субстанции и (или) его оценка | |
|
12009 |
сведения об оценке производственного процесса активной фармацевтической субстанции | |
|
12010 |
описание разработки производственного процесса активной фармацевтической субстанции | |
|
12011 |
сведения о подтверждении структуры и других характеристик активной фармацевтической субстанции | |
|
12012 |
сведения о примесях активной фармацевтической субстанции | |
|
12013 |
спецификация активной фармацевтической субстанции | |
|
12014 |
аналитическая методика для контроля качества активной фармацевтической субстанции | |
|
12015 |
протокол валидации аналитической методики для активной фармацевтической субстанции | |
|
12016 |
результаты анализа серий активной фармацевтической субстанции |
|
Код раздела |
Код вида документа |
Наименование |
|
12017 |
обоснование спецификации активной фармацевтической субстанции | |
|
12018 |
описание стандартных образцов или материалов активной фармацевтической субстанции | |
|
12019 |
описание системы упаковки (укупорки) активной фармацевтической субстанции | |
|
12020 |
резюме испытаний стабильности активной фармацевтической субстанции | |
|
12021 |
заключение о стабильности активной фармацевтической субстанции | |
|
12022 |
профамма пострегистрационных испытаний стабильности активной фармацевтической субстанции | |
|
12023 |
обязательства относительно стабильности активной фармацевтической субстанции | |
|
12024 |
данные испытаний стабильности активной фармацевтической субстанции | |
|
13 |
документы по качеству, относящиеся к лекарственному препарату | |
|
13001 |
описание и состав лекарственного препарата | |
|
13002 |
описание фармацевтической разработки лекарственного препарата | |
|
13003 |
описание компонентов лекарственного препарата | |
|
13004 |
описание активной фармацевтической субстанции в составе лекарственного препарата | |
|
13005 |
описание вспомогательных веществ в составе лекарственного препарата | |
|
13006 |
сведения о лекарственном препарате | |
|
13007 |
сведения о разработке лекарственной формы | |
|
13008 |
сведения о производственных избытках лекарственного препарата | |
|
13009 |
сведения о физико-химических и биологических свойствах лекарственного препарата | |
|
13010 |
сведения о разработке производственного процесса для лекарственного препарата | |
|
13011 |
описание системы упаковки (укупорки) | |
|
13012 |
микробиологические характеристики лекарственного препарата |
|
Код раздела |
Код вида документа |
Наименование |
|
13013 |
сведения о совместимости лекарственного препарата | |
|
13014 |
сведения о производителях лекарственного препарата | |
|
13015 |
состав на серию (производственная рецептура) лекарственного препарата | |
|
13016 |
описание производственного процесса лекарственного препарата и его контроля | |
|
13017 |
сведения о контроле критических стадий и промежуточной продукции при производстве лекарственного препарата | |
|
13018 |
отчет о валидации производственного процесса лекарственного препарата | |
|
13019 |
оценка производственного процесса лекарственного препарата | |
|
13020 |
спецификация вспомогательных веществ лекарственного препарата | |
|
13021 |
аналитическая методика, относящаяся к исследованию вспомогательных веществ | |
|
13022 |
протокол валидации аналитической методики, относящейся к исследованию вспомогательных веществ | |
|
13023 |
обоснование спецификации вспомогательных веществ лекарственного препарата | |
|
13024 |
сведения о вспомогательных веществах человеческого и животного происхождения в составе лекарственного препарата | |
|
13025 |
сведения о новых вспомогательных веществах в составе лекарственного препарата | |
|
13026 |
спецификация лекарственного препарата | |
|
13027 |
аналитическая методика контроля качества лекарственного препарата | |
|
13028 |
проект нормативного документа по качеству для лекарственного препарата, подготовленный в соответствии с рекомендациями Евразийской экономической комиссии | |
|
13029 |
протокол валидации аналитической методики контроля качества лекарственного препарата | |
|
13030 |
сведения о результатах анализа серий лекарственного препарата | |
|
13031 |
характеристика примесей лекарственного препарата | |
|
13032 |
обоснование спецификации лекарственного препарата | |
|
13033 |
описание стандартных образцов и материалов |
|
Код раздела |
Код вида документа |
Наименование |
|
13034 |
описание системы упаковки (укупорки) лекарственного препарата | |
|
13035 |
резюме испытаний стабильности лекарственного препарата | |
|
13036 |
заключение о стабильности лекарственного препарата | |
|
13037 |
программа пострегистрационных испытаний стабильности лекарственного препарата и обязательства относительно изучения стабильности | |
|
13038 |
данные испытаний стабильности лекарственного препарата | |
|
13039 |
документ, содержащий региональную информацию | |
|
13040 |
описание производственных помещений и оборудования | |
|
13041 |
сведения об оценке безопасности относительно посторонних агентов | |
|
13042 |
сведения о новых вспомогательных веществах | |
|
13043 |
последний обзор по качеству лекарственного препарата | |
|
13044 |
сведения о восстановителях, растворителях, разбавителях, носителях | |
|
13045 |
описание и состав восстановителя, растворителя, разбавителя, носителя | |
|
13046 |
описание фармацевтической разработки восстановителя, растворителя, разбавителя, носителя | |
|
13047 |
описание компонентов восстановителя, растворителя, разбавителя, носителя | |
|
13048 |
сведения о производстве восстановителя, растворителя, разбавителя, носителя | |
|
13049 |
сведения о производственных избытках восстановителя, растворителя, разбавителя, носителя | |
|
13050 |
сведения о физико-химических и биологических свойствах восстановителя, растворителя, разбавителя, носителя | |
|
13051 |
сведения о разработке производственного процесса восстановителя, растворителя, разбавителя, носителя | |
|
13053 |
сведения о производителях восстановителя, растворителя, разбавителя, носителя | |
|
13052 |
микробиологические характеристики восстановителя, растворителя, разбавителя, носителя | |
|
13054 |
описание производственного процесса и его контроля восстановителя, растворителя, разбавителя, носителя |
|
Код раздела |
Код вида документа |
Наименование |
|
13055 |
сведения о контроле критических стадий и промежуточной продукции при производстве восстановителя, растворителя, разбавителя, носителя | |
|
13056 |
отчет о валидации производственного процесса восстановителя, растворителя, разбавителя, носителя | |
|
13057 |
документ об оценке производственного процесса восстановителя, растворителя, разбавителя, носителя | |
|
13058 |
спецификация восстановителя, растворителя, разбавителя, носителя | |
|
13059 |
аналитическая методика контроля качества восстановителя, растворителя, разбавителя, носителя | |
|
13060 |
протокол валидации аналитической методики контроля качества восстановителя, растворителя, разбавителя, носителя | |
|
13061 |
сведения о результатах анатиза серий восстановителя, растворителя, разбавителя, носителя | |
|
13062 |
характеристика примесей восстановителя, растворителя, разбавителя, носителя | |
|
13063 |
обоснование спецификации восстановителя, растворителя, разбавителя, носителя | |
|
13064 |
описание стандартных образцов и материалов восстановителя, растворителя, разбавителя, носителя | |
|
13065 |
описание системы упаковки (укупорки) восстановителя, растворителя, разбавителя, носителя | |
|
13066 |
сведения о совместимости восстановителя, растворителя, разбавителя, носителя | |
|
13067 |
состав на серию (производственная рецептура) восстановителя, растворителя, разбавителя, носителя | |
|
13068 |
резюме испытаний стабильности восстановителя, растворителя, разбавителя, носителя | |
|
13069 |
заключение о стабильности восстановителя, растворителя, разбавителя, носителя | |
|
13070 |
программа пострегистрационных испытаний стабильности восстановителя, растворителя, разбавителя, носителя и обязательства относительно изучения стабильности | |
|
13071 |
данные испытаний стабильности восстановителя, растворителя, разбавителя, носителя | |
|
14 |
отчеты об исследованиях фармакологии |
|
Код раздела |
Код вида документа |
Наименование |
|
14001 |
отчет об исследовании первичной фармако динамики | |
|
14002 |
отчет об исследовании вторичной фармакодинамики | |
|
14003 |
отчет об исследовании фармакологической безопасности | |
|
14004 |
отчет об исследовании фармакодинамических лекарственных взаимодействий | |
|
15 |
отчеты об исследованиях фармакокинетики | |
|
15001 |
аналитическая методика исследования фармакокинетики | |
|
15002 |
отчет по валидации аналитической методики исследования фармакокинетики | |
|
15003 |
отчет об исследовании абсорбции | |
|
15004 |
отчет об исследовании распределения | |
|
15005 |
отчет об исследовании метаболизма | |
|
15006 |
отчет об исследовании экскреции (выведения) | |
|
15007 |
отчет об исследовании фармакокинегических лекарственных взаимодействий | |
|
15008 |
отчет о фармакокинетических исследованиях | |
|
16 |
отчеты об исследованиях токсикологии | |
|
16001 |
отчет об исследовании токсичности при однократном введении | |
|
16002 |
отчет об исследовании токсичности при многократном введении | |
|
16003 |
отчет об исследовании генотоксичносги in vitro | |
|
16004 |
отчет об исследовании канцерогенности in vivo | |
|
16005 |
отчет об исследовании репродуктивной и онтогенетической токсичности | |
|
16006 |
отчет об исследовании фертильности и раннего эмбрионального развития | |
|
16007 |
отчет об исследовании эмбриофетального, пренатального и постнатального развития | |
|
16008 |
отчет об исследовании на неполовозрелом потомстве с последующим наблюдением | |
|
16009 |
отчет об исследовании местной переносимости | |
|
16010 |
отчет о токсикологических исследованиях |
|
Код раздела |
Код вида документа |
Наименование |
|
16011 |
отчет об исследованиях антигенности | |
|
16012 |
отчет об исследованиях иммунотоксичности | |
|
16013 |
отчет об исследованиях механизма действия | |
|
16014 |
отчет об исследованиях лекарственной зависимости | |
|
16015 |
отчет о токсикологических исследованиях метаболитов | |
|
16016 |
отчет о токсикологических исследованиях примесей | |
|
16017 |
отчет о долговременных исследованиях токсичности при повторном (многократном) введении, которые нс были включены в отчеты по токсичности при повторном (многократном) введении | |
|
16018 |
отчет о кратковременных исследованиях токсичности при повторном (многократном) введении, которые нс были включены в отчеты по токсичности при повторном (многократном) введении | |
|
16019 |
отчет о других исследованиях канцсрогенности | |
|
17 |
отчеты и документы о клинических исследованиях (испытаниях) (общие) | |
|
17001 |
перечень всех клинических исследований (испытаний) | |
|
17002 |
отчет об исследовании биодоступности | |
|
17003 |
отчет об исследовании сравнительной биодоступности | |
|
17004 |
отчет об исследовании биоэквивалентности | |
|
17005 |
отчет об исследовании корреляции in vitro - in vivo | |
|
17006 |
описание биоаналитичсской методики | |
|
17007 |
описание аналитической методики для клинических исследований | |
|
18 |
отчеты о фармакокинетических исследованиях с использованием биоматериалов человека | |
|
18001 |
отчет об исследовании связывания активного вещества с белками плазмы | |
|
18002 |
отчет об исследовании метаболизма в печени и взаимодействия активного вещества | |
|
18003 |
отчет об исследовании с использованием других биоматериалов, полученных от человека | |
|
19 |
отчеты о фармакокинетических исследованиях у человека |
|
Код раздела |
Код вида документа |
Наименование |
|
19001 |
отчет об исследовании фармакокинетики у здоровых добровольцев и первичной переносимости | |
|
19002 |
отчет об исследовании фармакокинетики у пациентов и первичной переносимости | |
|
19003 |
отчет о влиянии внутренних факторов организма на фармакокинетику | |
|
19004 |
отчет о влиянии внешних факторов организма на фармакокинетику | |
|
19005 |
отчет об исследовании популяционной фармакокинетики | |
|
19006 |
отчет об изучении фармакокинетического взаимодействия активного вещества с другими лекарственными препаратами или веществами | |
|
20 |
отчеты о фармакодинамичсских исследованиях у человека | |
|
20001 |
подтверждение корреляции фармакодинамического действия и эффективности у здоровых добровольцев | |
|
20002 |
описание фармакодинамического действия, не связанного с эффективностью у здоровых добровольцев | |
|
20003 |
описание исследования одновременного применения решетрируемого лекарственного препарата вместе с другими лекарственными препаратами, определяющего возможное изменение фармакологического действия у здоровых добровольцев | |
|
20004 |
отчетов изучении фармакодинамического взаимодействия активного вещества с другими лекарственными препаратами или веществам у здоровых добровольцев | |
|
20005 |
подтверждение корреляции фармакодинамического действия и эффективности у пациентов | |
|
20006 |
описание фармакодинамического действия, нс связанного с эффективностью у пациентов | |
|
20007 |
описание исследования одновременного применения регистрируемого лекарственного препарата вместе с другими лекарственными препаратами, определяющего возможное изменение фармакологического действия у пациентов | |
|
20008 |
отчет об изучении фармакодинамического взаимодействия активного вещества с другими лекарственными препаратами или веществами у пациентов | |
|
21 |
отчеты об исследовании эффективности и безопасности, контролируемых клинических исследованиях относительно подтверждения заявленных показаний к применению |
|
Код раздела |
Код вида документа |
Наименование |
|
21001 |
отчет (исследование) о контролируемых клинических исследованиях относительно подтверждения заявленных показаний к применению | |
|
21002 |
протокол исследования относительно подтверждения заявленных показаний к применению | |
|
21003 |
описание итоговой оценки безопасности в отношении возможных областей применения лекарственного препарата | |
|
22 |
отчеты об исследовании эффективности и безопасности, отчеты о неконтролируемых клинических исследованиях, анализах данных, других клинических исследованиях | |
|
22001 |
отчет о неконтролируемых клинических исследованиях | |
|
22002 |
отчет об анализах данных по нескольким исследованиям | |
|
22003 |
отчет о других клинических исследованиях | |
|
23 |
отчеты о пострегистрационном опыте применения | |
|
23001 |
отчет о пострегистрационном опыте применения | |
|
24 |
индивидуальные регистрационные карты и перечни пациентов | |
|
24001 |
индивидуальная регистрационная карта пациента | |
|
24002 |
перечень пациентов, принимавших участие в клиническом исследовании | |
|
25 |
справочные материалы (содержания, ссылки) | |
|
25001 |
полное содержание регистрационного досье | |
|
25002 |
содержание модулей 2-5 регистрационного досье | |
|
25003 |
содержание модуля 3 | |
|
25004 |
ссылка на литературный источник, использованный при подготовке документов по качеству | |
|
25005 |
содержание модуля 4 | |
|
25006 |
ссылка на литературный источник, использованный при проведении доклинических исследований | |
|
25007 |
содержание модуля 5 | |
|
25008 |
ссылка на литературный источник, использованный при проведении клинических исследований | |
|
99 |
иные виды документов | |
|
99999 |
другой документ |
|
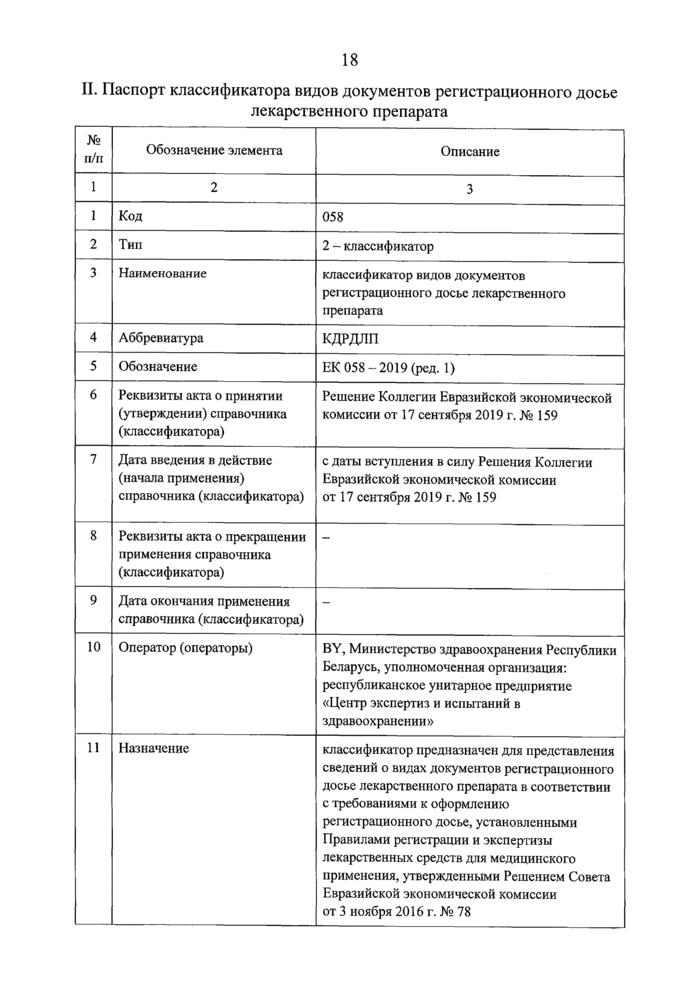
II. Паспорт классификатора видов документов регистрационного досье лекарственного препарата | |||||||||||||||||||||||||||||||||||||||
|
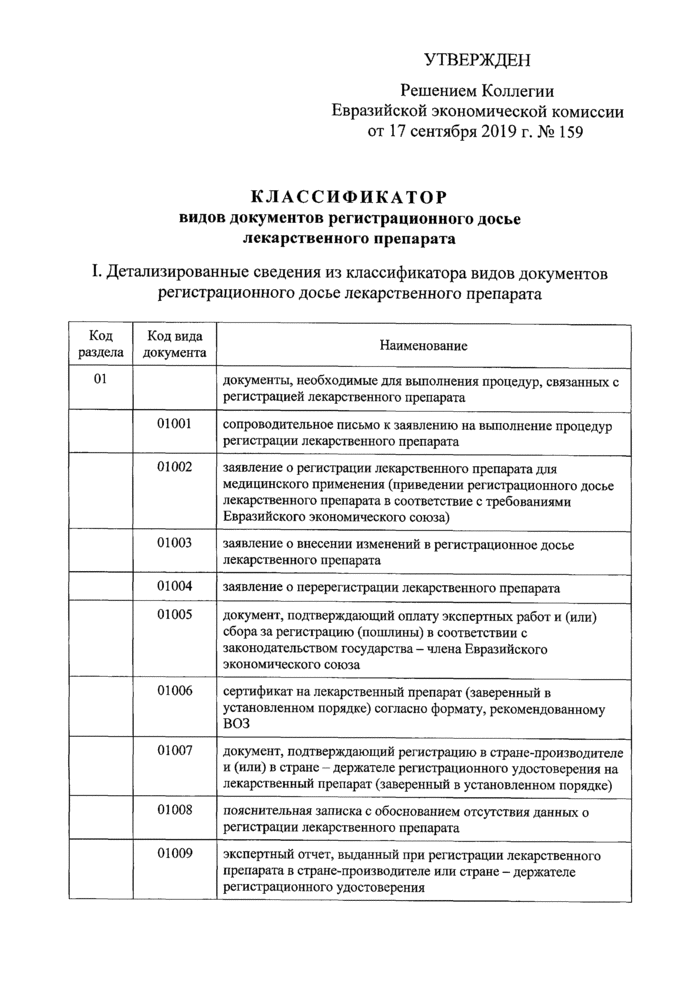
УТВЕРЖДЕН
Решением Коллегии Евразийской экономической комиссии от 17 сентября 2019 г. № 159
КЛАССИФИКАТОР видов документов регистрационного досье лекарственного препарата
I. Детализированные сведения из классификатора видов документов регистрационного досье лекарственного препарата
|
Код раздела |
Код вида документа |
Наименование |
|
01 |
документы, необходимые для выполнения процедур, связанных с регистрацией лекарственного препарата | |
|
01001 |
сопроводительное письмо к заявлению на выполнение процедур регистрации лекарственного препарата | |
|
01002 |
заявление о регистрации лекарственного препарата для медицинского применения (приведении регистрационного досье лекарственного препарата в соответствие с требованиями Евразийского экономического союза) | |
|
01003 |
заявление о внесении изменений в регистрационное досье лекарственного препарата | |
|
01004 |
заявление о перерегистрации лекарственного препарата | |
|
01005 |
документ, подтверждающий оплату экспертных работ и (или) сбора за регистрацию (пошлины) в соответствии с законодательством государства - члена Евразийского экономического союза | |
|
01006 |
сертификат на лекарственный препарат (заверенный в установленном порядке) согласно формату, рекомендованному ВОЗ | |
|
01007 |
документ, подтверждающий регистрацию в стране-производителе и (или) в стране держателе регистрационного удостоверения на лекарственный препарат (заверенный в установленном порядке) | |
|
01008 |
пояснительная записка с обоснованием отсутствия данных о регистрации лекарственного препарата | |
|
01009 |
экспертный отчет, выданный при регистрации лекарственного препарата в стране-производителе или стране - держателе регистрационного удостоверения |
|
№ п/п |
Обозначение элемента |
Описание |
|
1 |
2 |
3 |
|
12 |
Аннотация (область применения) |
используется для обеспечения информационного взаимодействия при реализации общих процессов в рамках Евразийского экономического союза и функционирования информационной системы в сфере обращения лекарственных средств |
|
13 |
Ключевые слова |
документ регистрационного досье лекарственного препарата, регистрационное досье, лекарственный препарат, общий технический документ |
|
14 |
Сфера, в которой реализуются полномочия органов Евразийского экономического союза |
техническое регулирование |
|
15 |
Использование международной (межгосударственной, региональной) классификации |
2 - при разработке классификатора международные (межгосударственные, региональные) классификаторы и (или) стандарты не применялись |
|
16 |
Наличие государственных справочников (классификаторов) государств - членов Евразийского экономического союза |
2 - классификатор не имеет аналогов в 1т>сударствах - членах Евразийского экономического союза |
|
17 |
Метод систематизации (классификации) |
2 - иерархический метод классификации (число ступеней классификации - 2) |
|
18 |
Методика ведения |
1 - централизованная методика ведения. Добавление, изменение или исключение значений классификатора выполняется оператором в соответствии с актом Евразийской экономической комиссии. В случае исключения значения запись классификатора отмечается как недействующая с даты исключения с указанием сведений об акте Евразийской экономической комиссии, регламентирующем окончание действия записи классификатора. Коды классификатора являются уникальными, повторное использование кодов |
|
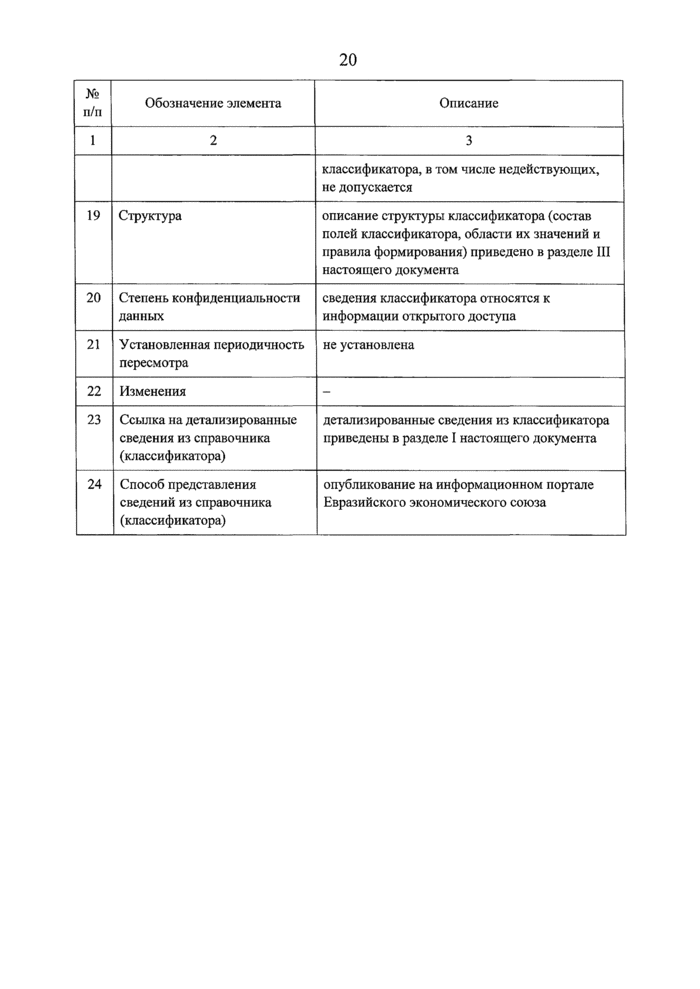
Код раздела |
Код вида документа |
Наименование |
|
01010 |
перевод на русский язык экспертного отчета, выданного при регистрации лекарственного препарата в стране-производителс или стране - держателе регистрационного удостоверения | |
|
01011 |
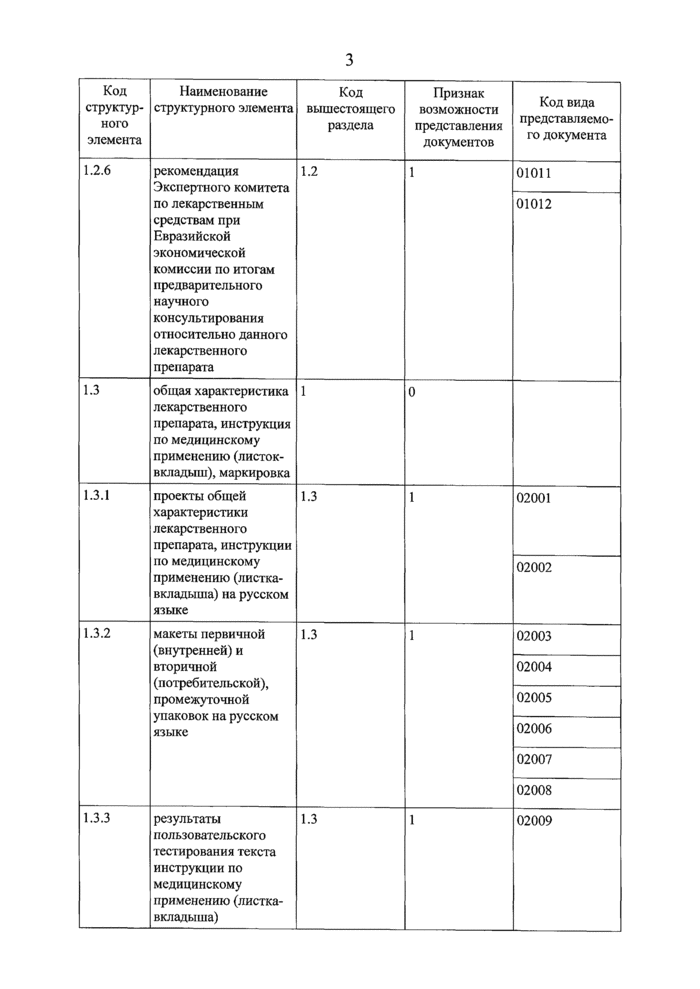
заключение Экспертного комитета но лекарственным средствам при Пвразийской экономической комиссии по итогам предварительного научного консультирования относительно данного лекарственного препарата | |
|
01012 |
рекомендация Экспертного комитета по лекарственным средствам при Евразийской экономической комиссии по итогам предварительного научного консультирования относительно данного лекарственного препарата | |
|
01013 |
перечень стран, в которых лекарственный препарат подан на регистрацию, зарегистрирован, получил отказ в регистрации или его обращение на рынке было приостановлено | |
|
01014 |
письмо держателя регистрационного удостоверения о соответствии клинических исследований заявленного на регистрацию лекарственного препарата требованиям Правил надлежащей клинической практики Евразийского экономического союза, утвержденных Решением Совета Евразийской экономической комиссии от 3 ноября 2016 г. № 79 (далее - Правила надлежащей клинической практики Евразийского экономического союза) | |
|
01015 |
письмо держателя регистрационного удостоверения о дополнительном торговом наименовании лекарственного препарата | |
|
01016 |
заключение (рекомендация) уполномоченного органа (уполномоченной организации) государства - члена Евразийского экономического союза по итогам предварительного научного консультирования относительно данного лекарственного препарата | |
|
02 |
документы, описывающие общую характеристику лекарственного препарата, инструкцию по его медицинскому применению, маркировку | |
|
02001 |
проект общей характеристики лекарственного препарата на русском языке | |
|
02002 |
проект инструкции по медицинскому применению лекарственного препарата (листок-вкладыш) | |
|
02003 |
проект маркировки лекарственного препарата | |
|
02004 |
макет вторичной (потребительской) упаковки лекарственного препарата |
|
Код раздела |
Код вида документа |
Наименование |
|
02005 |
макет первичной (внутренней) упаковки лекарственного препарата | |
|
02006 |
макет промежуточной упаковки лекарственного препарата | |
|
02007 |
макет этикетки лекарственного препарата | |
|
02008 |
макет стикера лекарственного препарата | |
|
02009 |
описание результатов пользовательского тестирования текста инструкции по медицинскому применению | |
|
02010 |
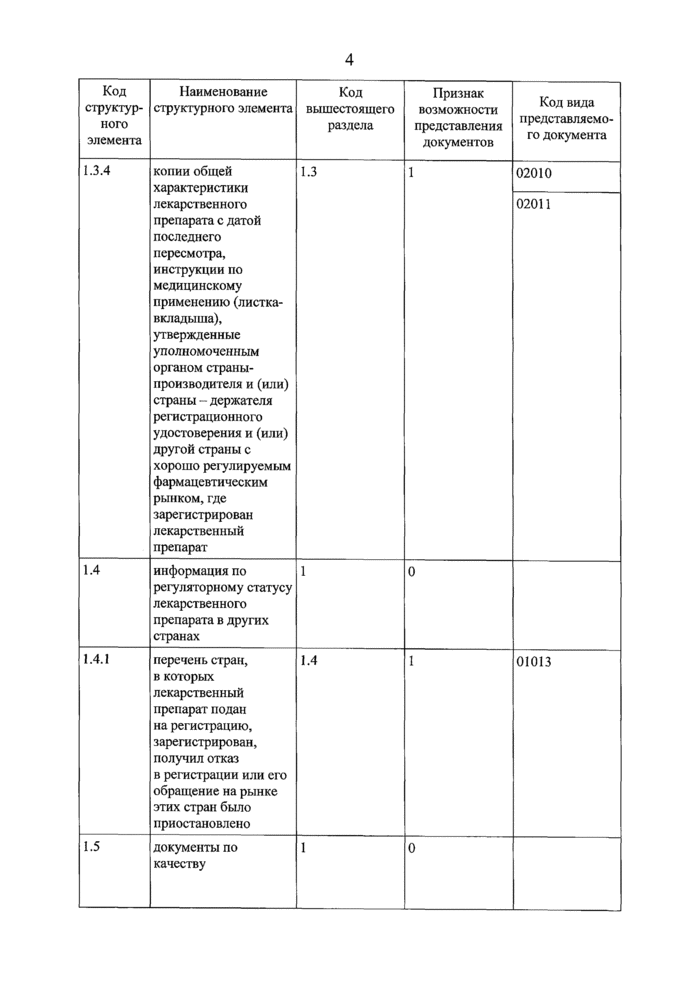
общая характеристика лекарственного препарата, утвержденная уполномоченным органом страны-производителя или страны - держателя регистрационного удостоверения | |
|
02011 |
инструкция по медицинскому применению лекарственного препарата, одобренная уполномоченным органом страны-производителя | |
|
03 |
документы, подтверждающие качество лекарственного препарата и его компонентов | |
|
03001 |
сертификат соответствия статье Фармакопеи Евразийского экономического союза | |
|
03002 |
сертификат соответствия статье Европейской фармакопеи по губчатой энцефалопатии | |
|
03003 |
документ, выданный уполномоченными органами ветеринарного надзора страны происхождения сырья | |
|
03004 |
письмо держателя мастер-файла активной фармацевтической субстанции с обязательством по предварительному оповещению об изменениях в мастер-файле активной фармацевтической субстанции | |
|
03005 |
письмо, подтверждающее согласие держателя мастер-файла фармацевтической субстанции на представление документов закрытой части мастер-файла на фармацевтическую субстанцию по запросу уполномоченного органа | |
|
03006 |
сертификат соответствия фармацевтической субстанции требованиям Европейской фармакопеи | |
|
03007 |
сертификат на мастер-файл плазмы, выданный уполномоченным органом страны-производителя | |
|
03008 |
сертификат на мастер-файл вакцинного антигена, выданный уполномоченным органом страны-производителя |
|
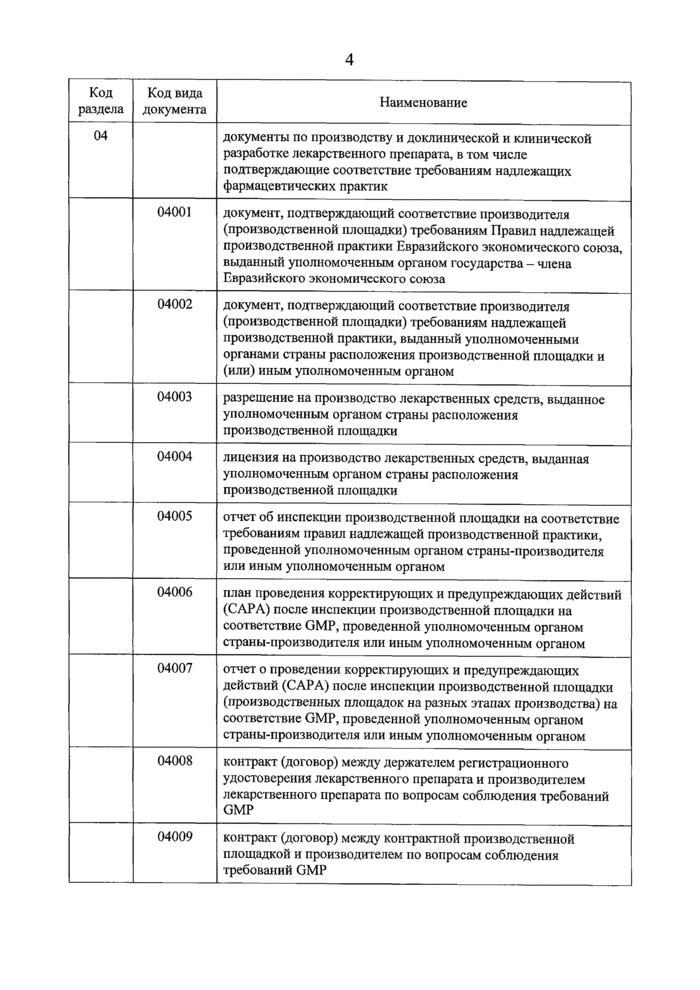
Код раздела |
Код вида документа |
Наименование |
|
04 |
документы по производству и доклинической и клинической разработке лекарственного препарата, в том числе подтверждающие соответствие требованиям надлежащих фармацевтических практик | |
|
04001 |
документ, подтверждающий соответствие производителя (производственной площадки) требованиям Правил надлежащей производственной практики Евразийского экономического союза, выданный уполномоченным органом государства - члена Евразийского экономического союза | |
|
04002 |
документ, подтверждающий соответствие производителя (производственной площадки) требованиям надлежащей производственной практики, выданный уполномоченными органами страны расположения производственной площадки и (или) иным уполномоченным органом | |
|
04003 |
разрешение на производство лекарственных средств, выданное уполномоченным органом страны расположения производственной площадки | |
|
04004 |
лицензия на производство лекарственных средств, выданная уполномоченным органом страны расположения производственной площадки | |
|
04005 |
отчет об инспекции производственной площадки на соответствие требованиям правил надлежащей производственной практики, проведенной уполномоченным органом страны-производителя или иным уполномоченным органом | |
|
04006 |
план проведения корректирующих и предупреждающих действий (САРА) после инспекции производственной площадки на соответствие GMP, проведенной уполномоченным органом страны-производителя или иным уполномоченным органом | |
|
04007 |
отчет о проведении корректирующих и предупреждающих действий (САРА) после инспекции производственной площадки (производственных площадок на разных этапах производства) на соответствие GMP, проведенной уполномоченным органом страны-производителя или иным уполномоченным органом | |
|
04008 |
контракт (договор) между держателем регистрационного удостоверения лекарственного препарата и производителем лекарственного препарата по вопросам соблюдения требований GMP | |
|
04009 |
контракт (договор) между контрактной производственной площадкой и производителем по вопросам соблюдения требований GMP |
|
Код раздела |
Код вида документа |
Наименование |
|
04010 |
сведения о регуляторных мерах, принятых уполномоченным органом по результатам инспекций в отношении производственной площадки | |
|
04011 |
письмо уполномоченного лица по качеству о соответствии условий производства заявленного на регистрацию лекарственного препарата требованиям Правил надлежащей производственной практики Евразийского экономического союза | |
|
04012 |
сведения о рекламациях в отношении качества лекарственного препарата | |
|
04013 |
подтверждение отсутствия рекламаций в отношении качества лекарственных препаратов | |
|
04014 |
согласие на проведение фармацевтической инспекции на соответствие требованиям международных договоров и актов, составляющих право Евразийского экономического союза | |
|
04015 |
основное досье (мастер-файл) производственной площадки/участка (производственных площадок) | |
|
04016 |
схема этапов производства лекарственного препарата | |
|
04017 |
разрешение уполномоченного органа на проведение клинического исследования | |
|
04018 |
перечень проведенных инспекций на соответствие надлежащей клинической практики (GCP) | |
|
04019 |
отчет о проведении инспекции исследовательского центра, принимавшего участие в клинических исследованиях лекарственного препарата | |
|
04020 |
отчет о проведении инспекции спонсора | |
|
04021 |
отчет о проведении инспекции контрактной исследовательской организации по клиническим исследованиям лекарственного препарата | |
|
04022 |
отчет о проведении инспекции иных организаций, имеющих отношение к исследованию лекарственного препарата | |
|
04023 |
отчет о проведении прочих инспекций с целью определения соответствия надлежащей клинической практики (GCP) | |
|
04024 |
договор между спонсором клинического исследования и исследовательским центром | |
|
04025 |
таблица с перечнем клинических исследований | |
|
04026 |
валидациоиный мастер-план |
|
Код раздела |
Код вида документа |
Наименование |
|
04027 |
руководство по качеству (лабораторное руководство) лаборатории контроля качества производителя | |
|
04028 |
список аналитических методик, которые выполняет лаборатория контроля качества производителя | |
|
05 |
информация о специалистах, принимавших участие в исследованиях | |
|
05001 |
информация о специалисте, под1-отовившем резюме по качеству | |
|
05002 |
информация о специалисте, подготовившем резюме доклинических исследований | |
|
05003 |
информация о специалисте, подготовившем резюме клинических исследований | |
|
06 |
документы об оценке потенциальной опасности для окружающей среды | |
|
06001 |
документ заявителя об оценке потенциальной опасности для окружающей среды | |
|
06002 |
письмо заявителя о том, что лекарственные препараты содержат генетически модифицированные организмы или получены из них | |
|
07 |
документы по фармаконадзору в государстве - члене Евразийского экономического союза | |
|
07001 |
мастер-файл системы фармаконадзора держателя регистрационного удостоверения в соответствии с требованиями Правил надлежащей практики фармаконадзора Евразийского экономического союза, утвержденных Решением Совета Евразийской экономической комиссии от 3 ноября 2016 г. № 87 | |
|
07002 |
краткая характеристика системы фармаконадзора держателя регистрационного удостоверения | |
|
07003 |
письменное подтверждение держателем регистрационного удостоверения факта наличия уполномоченного лица, ответственного за фармаконадзор на территории государства -члена Евразийского экономического союза | |
|
07004 |
план управления рисками на лекарственный препарат | |
|
07005 |
документ, подтверждающий наличие взаимодействия, обеспечивающего надлежащее выполнение несколькими юридическими лицами всех обязанностей держателя регистрационного удостоверения | |
|
08 |
документы об охране интеллектуальной собственности | |
|
08001 |
документ, подтверждающий регистрацию товарного знака |
|
Код раздела |
Код вида документа |
Наименование |
|
09 |
введение в общий технический документ и общие обзоры | |
|
09001 |
введение в общий технический документ | |
|
09002 |
общее резюме по качеству | |
|
09003 |
общее описание активной фармацевтической субстанции | |
|
09004 |
резюме общей информации относительно исходных материалов и сырья | |
|
09005 |
общее описание процесса производства АФС | |
|
09006 |
общее описание характеристик АФС | |
|
09007 |
общее описание контроля качества АФС | |
|
09008 |
общее описание стандартных образцов или материалов | |
|
09009 |
общее описание системы упаковки (укупорки) АФС | |
|
09010 |
общее описание стабильности | |
|
09011 |
общее описание лекарственного препарата | |
|
09012 |
общее описание и состав лекарственного препарата | |
|
09013 |
общее описание фармацевтической разработки | |
|
09014 |
общее описание процесса производства лекарственного препарата | |
|
09015 |
общее описание контроля качества вспомогательных веществ | |
|
09016 |
общее описание контроля качества лекарственного препарата | |
|
09017 |
общее описание стандартных образцов или материалов лекарственного препарата | |
|
09018 |
общее описание системы упаковки (укупорки) лекарственного препарата | |
|
09019 |
общее описание стабильности лекарственного препарата | |
|
09020 |
обзор дополнительной информации | |
|
09021 |
общее описание производственных помещений и оборудования | |
|
09022 |
резюме оценки безопасности относительно посторонних агентов | |
|
09023 |
общее описание новых вспомогательных веществ | |
|
09024 |
резюме региональной информации | |
|
09025 |
краткие сведения о восстановителях, растворителях, разбавителях, носителях |
|
Код раздела |
Код вида документа |
Наименование |
|
09026 |
краткое описание и состав восстановителя, растворителя, разбавителя, носителя | |
|
09027 |
краткое описание фармацевтической разработки восстановителя, растворителя, разбавителя, носителя | |
|
09028 |
краткое описание процесса производства восстановителя, растворителя, разбавителя, носителя | |
|
09029 |
краткое описание контроля качества восстановителя, растворителя, разбавителя, носителя | |
|
09030 |
краткое описание системы упаковки (укупорки) для восстановителя, растворителя, разбавителя, носителя | |
|
09031 |
краткое описание стабильности восстановителя, растворителя, разбавителя, носителя | |
|
09032 |
краткое описание состава на серию (производственная рецептура) восстановителя, растворителя, разбавителя, носителя | |
|
09033 |
краткое описание микробиологических характеристик восстановителя, растворителя, разбавителя, носителя | |
|
09034 |
краткое описание совместимости восстановителя, растворителя, разбавителя, носителя | |
|
10 |
резюме доклинических исследований и обзоры доклинических данных | |
|
10001 |
обзор доклинических данных | |
|
10002 |
резюме фармакологических исследований в текстовом формате | |
|
10003 |
резюме фармакологических исследований в виде таблиц | |
|
10004 |
резюме фармакокинетических исследований в текстовом формате | |
|
10005 |
резюме фармакокинетических исследований в виде таблиц | |
|
10006 |
резюме токсикологических исследований в текстовом формате | |
|
10007 |
резюме токсикологических исследований в виде таблиц | |
|
10008 |
введение | |
|
11 |
резюме клинических исследований и обзоры клинических данных | |
|
11001 |
обзор клинических данных | |
|
11002 |
резюме биофармацсвтических исследований и связанных с ними аналитических методов | |
|
11003 |
резюме исследований по клинической фармакологии |