Методы бактериологического исследования условно патогенных микроорганизмов в клинической микробиологии. Методические рекомендации
Купить бумажный документ с голограммой и синими печатями. подробнее
Цена на этот документ пока неизвестна. Нажмите кнопку "Купить" и сделайте заказ, и мы пришлем вам цену.
Распространяем нормативную документацию с 1999 года. Пробиваем чеки, платим налоги, принимаем к оплате все законные формы платежей без дополнительных процентов. Наши клиенты защищены Законом. ООО "ЦНТИ Нормоконтроль"
Наши цены ниже, чем в других местах, потому что мы работаем напрямую с поставщиками документов.
Способы доставки
- Срочная курьерская доставка (1-3 дня)
- Курьерская доставка (7 дней)
- Самовывоз из московского офиса
- Почта РФ
Методические рекомендации предлагают методики посева, идентификации, определения лекарственной чувствительности условно патогенных микроорганизмов при диагностике смешанной инфекции у больных туберкулезом. Приведены качественные и количественные методы исследования диагностического материала, схемы идентификации основных групп микроорганизмов, выделяемых от больных туберкулезом (стрептококки, стафилококки, грамотрицательные бактерии, неферментирующие грамотрицательные палочки). Методические рекомендации предназначены для лабораторий противотуберкулезных учреждений.
Оглавление
Аннотация
Бактериологические исследования на условно-патогенные микроорганизмы
Исследование микрофлоры верхних дыхательных путей
Исследование микрофлоры нижних дыхательных путей
Качественный метод
Количественный метод
Посев промывных вод бронхов, лаважной жидкости
Исследование микрофлоры глаз
Исследование мазков из уха
Исследование мочи
Исследование микрофлоры ран, пунктатов, экссудатов, резецированных тканей
Исследование микрофлоры женских половых органов
Исследование желчи
Исследование крови
Исследование на дисбактериоз кишечника
Идентификация микроорганизмов
Грамположительные кокки
Грамотрицательные кокки
Гемофильные палочки
Грамотрицательные палочки
Неферментирующие грамотрицательные бактерии (НГОБ)
Определение чувствительности микроорганизмов к антибиотикам
Метод диффузии
Метод разведений
Санитарно-бактериологическое исследование воздуха
Питательные среды
| Дата введения | 01.01.2021 |
|---|---|
| Добавлен в базу | 01.02.2020 |
| Актуализация | 01.01.2021 |
Этот документ находится в:
Организации:
| 16.12.1991 | Принят | Главное научное управление |
|---|---|---|
| 19.12.1991 | Утвержден | Министерство здравоохранения РСФСР |
| Разработан | Московский научно-исследовательский институт туберкулеза Минздрава РСФСР |
Чтобы бесплатно скачать этот документ в формате PDF, поддержите наш сайт и нажмите кнопку:

стр. 1

стр. 2

стр. 3

стр. 4

стр. 5

стр. 6

стр. 7
стр. 8

стр. 9

стр. 10

стр. 11

стр. 12

стр. 13

стр. 14

стр. 15

стр. 16

стр. 17

стр. 18

стр. 19

стр. 20

стр. 21

стр. 22

стр. 23

стр. 24

стр. 25

стр. 26
стр. 27

стр. 28

стр. 29

стр. 30
МЕТОДЫ БАКТЕРИОЛОГИЧЕСКОГО ИССЛЕДОВАНИЯ УСЛОВНО ПАТОГЕННЫХ МИКРООРГАНИЗМОВ В КЛИНИЧЕСКОЙ МИКРОБИОЛОГИИ
1991
Методические рекомендации
Москва
|
^лаинистра •:В'..И. Стародубов 1/v У * декабря..1991г- | |
|
Заместитель Ж 74*:'\ | |
МЕТОДЫ ЕАКТЕРИ0Л01ИЧЕСК0Г0 ИССЛЕДОВАНИЯ УСЛОВНО ПАТОГЕННЫХ МИКРООРГАНИЗМОВ В КЛИНИЧЕСКОЙ МИКРОШОЛОГИИ
Методические рекомендации
Москва - 1991
ю
которой фекалии разведены до 1СГ3, вносят по 0,1 мл на поверхность среды Сабуро и ЖСА. Из разведения 10"® производят пооевы на чашки с 0,32 кровянш агаром и среду Эндо по 0,1 мл. Для получения роста изолированных колоний применяют стеклянные бусы иля шпатели. Стеклянные круглые буоы 13-14 штук (заранее проста рилизоваиные) опускают в чашку о посевным материалом. При легком покачивании чашки о бусами в течение I мин материал равномерно распределяется по питательной среде. Посев буоами начинают со ореды, на которой пооеяло наибольшее разведение (1(ГЪ, перенося буоы на меньшее разведение. Для выделания анаэробных бифидобактерий производят выоев из разведений 1СГ^, 10“® и ДО"** в 2 пробирки (по 0,1 и 1 мл) регенерированной в течение 1 ч среды Блаурокка. После посева пробирки энергично вращают между ладонями для равномерного распределения взвеси. Среды для выращивания аэробов помещают в термостат при З1/* (Сабуро - при 2(Р) на 18-24 ч. R)ct анаэробов на среде Блаурокка учитывают через 48-72 ч. На следующий пень после посева определяют количество кишечной палочки и других микробов в I г фекалий по числу колоний, выросших на соответствующей питательной среде с пересчетом на количество посеянного материала и степени его разведения.
Так, если на среде Эндо выросло 30 лактозонегативных колоний при посеве 0,1 мд фекалий из разве пеняя КГ® (1:100.000), при расчете следует 30 умножить на 10 и на 100.000, т.е. в I гр будет 30.000.000 лактозонегативных энтеробактерий. Учитывают число лактозонегативных и гемолитических колоний кишечной палочки, наличие стафилококка, протея и других микроорганизмов. Определяются ферментативные свойства и лекарственная чувствительность микроорганизмов. Из пробирок со оредой Блаурокка приготавливаются мазки. Под микроскопом бифидобактерии имеют вид характерных грамположительных палочек утолщенных или разветвленных на концах, расположенных в виде римской цифры У, часто в виде
н
скоплений. В ответе бактериолога указываются процент или абсолютное количество каллой группы микроорганизмов.
Идентификация микроорганизмов. Методы идентификации микроорганизмов основаны на изучении морфологических, культуральных и биохимических, антигенных я др. овойств культур.
Морфологические свойства изучаются путем бактериоскопии диагностического материала и мазков из колоний, выросших на плотных и жидких питательных средах культур. Мазки на предметных стеклах фиксируют на пламени горелки или в жидких фиксаторах (96° спирт, смесь Никифорова) и окрашивают по Граму. При просмотре мазков из мокроты оценивают всю имеющуюся микрофлору: наличие скоплений грамподожительных кокков (стафилококки, микрококки), цепочек грамподожительных кокков (стрептококки), мелких ланцетовидных диплококков, окруженных зоной не окрасившейся кал-оуды (пневмококк), грамотрицательных кокков (нейссерии); грам-отрицательных палочек (кишечная, синегнойная, протей); грамотрицательных палочек с закругленными концами, окруженных капсулой в виде светлого ореола (клебоиелла), мелких грамотрицательных палочек в виде скоплении (гемофмдьные бактерии) и др. Бак-териоскопическое исследование является ориентировочным.Дальнейшее исследование включает посев материала на питательные среды, выделение чистых культур, их идентификацию и определение лекарственной чувствительности. Культуральные свойства изучают при просмотре выросших культур на плотных и жидких питательных средах. На плотных средах учитывают размер колонии, цвет, прозрачность, форму, наличие пигмента, гемолиз вокруг колонии и его характер и т.д. На жидких ор«пдх отмечают их прозрачность, наличие осанка (придонный рост) или пленки на поверхности среды. Исследование биохимических свойств основывается на определении ферментативной сахародитической активности, способности утилизировать питательные вещества в аэробных и анаэробных условиях
культивирования. Антигенные овойства культур изучаются при взаимодействии бактерий и их антигенов с соответствующими антисыворотками (реакции агглютинации, иммунофлюорооценции и др.) • Itoc-ле изучения морфологических и культуральных свойств осуществляют постановку дифференциальных тестов о чистыми культурами микроорганизмов.
Ррамположительнне кокки. Грамполодительные кокки относятся к семейству , включающем род и
’семи и семейством
Семействоt/fttUfecem&ae. . Для медицинской микробиологии необходимо дифференцировать стафилококки от микрококков. Изучают морфологические свойства, гемолиз, способность расти на среде с солью, пигментобраэование, ферментацию глюкозы до кислоты в анаэробных условиях, ферментацию глицерина. Микрококки имеют в 3-3 больший размер клеток (0,5-3,5 мкм), не ферментируют глюкозу в анаэробных условиях и глицерин, имеют пигмент от желтого по розового. Дифференциация различных видов стафилококка осуществляется по комплексу тестов: плаэмокоагулирующей способности, лецитинаэной активности, ферментации маннита в анаэробных условиях, пшыентообразованию, чувствительности к новобиоцину
кокка исследуемый материал засевают на дифференциально-диагностическую среду: яелточно-солевой агар. При окраске по Граму стафилококк окрашивается грамполсскительно и располагается одиночно, попарно или образует скопления в виде неправильных кучек* Стафилококк устойчив к повышенным концентрациям в среде хлористого натрия (7-1(#), что используется для его выделения из патологического материала. При росте на мясо-пептонном бульоне вызывает его равномерное помутнение и дает хлопьевидный осадок.
На плотных питательных средах стафилококк растет в виде круглых блестящих колоний о ровными краями (0,5-1,5 мм в диаметре). На 2-й лень исследования оценивают количественный рост выросших колоний, учитывают лецитиназную активность, выделяют чистую культуру микроба (пересев на пробирки с молочным или простым скошенным агаром). На Э-й день - ставят тесты для дифференциации и на лекарственную чувствительность.
При определении коагулаэной активности пользуются лиофили-зироваяной плазмой крови кролика, разведенной стерильным физиологическим раствором 1:5 и разлитой в стерильные пробирки по 0,5 мл в каждую. В пробирку засевают I петлю суточной агаровой культуры иоследуемого штамма и помещают в термостат при З^С.
Учет результатов производят через 30 мин, 1ч, 2ч, Зчи24ч. Положительными считаются все отепени свертывания плазмы от небольшого сгуотка, остающегося неподвижным при перевертывании пробирки.
Лецитиназная активность определяется на желточно-солевом агаре. Учет реакции производят через 24-48 ч макроскопически по наличию мутной зоны и радужного венчика вокруг колоний стафилококка, что свидетельствует о наличии у них фермента лецити-назы.
При ИЗУЧвЩЗД ДйШЙНМНИ МЙШШа пооев суточной агаровой культуры испытуемого штамма производят уколом в столбик 1% агара с маннитом и вазелиновым маслом. При ферментации маннита столбик агара синеет. Положительной считается реакция при ферментации 2/3 столбика агара.
Лля определения лшмектообрааовакия культуры стафилококка засевают на 1($ молочный агар. Учет через I&-20 ч.
Определение гемолитической _одособпо_сти культуры стайилокок-ка осуществляется на 5# кровяном агаре (донорская кровь без до-
бавления антисептиков) по наличию просветления вокруг выросших колоний, которые четко выявляются в проходящем свете. Положительный гемолитический тест на агаре с кровью человека, как правило, обусловлен гемотоксинами, тогда как основную роль в патогенезе стафилококковых инфекций играет Л -токсин, который можно выявить на агаре с кровью кролика.
Семействоо<£^^^^^г^^гг. Стрептококки представля
ют собой большую и довольно гетерогенную группу микроорганизмов. Наиболее изученными являются аэробные представите ли
сферическую форл!у, грамполокителен, в мазках с плотных питательных сред располагается в виде коротких цепочек из 2-3 кокков, на жидких питательных средах дает более длинные цепочки. При выращивании стрептококков следует учитывать их повышенную потребность в питательных веществах. Поэтому для культивирования стрептококка применяют питательные среды, содержащие глпсозу ($), кровь (5-10555), сыворотку (10-2($).
|
тические стрептококки |
На кровяном агаре стрептококк растет в виде мелких, прозрачных с гладким краем колоний. Отношение к кровяному агару является одним из важнейших свойств стрептококков, в значительной мере определяющих их патогенность. Качество гемолиза определяется через 24 ч по зоне просветления вокруг колоний. В-гемоли-
) через 24 ч после посе-
оС-зеленящие стрептококки
ва дают вокруг колоний зону полного просветления за счет полного лизиса эритроцитов. При последующем хранении чашечек при температуре -ь4°с в течение 24 ч зона гемолиза не увеличивается.
кую зону лизиса иногда с зеленым пигментом (явление гемометаморфоза - стрептококки способствуют перекрашиванию пигмента крови в зеленый цвет), У- негемолитические стрептококки не вызывают
iS
изменений кровяного агара. На сахарном бульоне стрептококки растут придонно игристеночно, оставляя бульон прозрачна. Образуют хлопьевидной, иногда гомогенный осадок. По Ленсфилд, дифференциация стрептококка осуществляется с помощью реакции преципитации по наличию полисахаридного антигена. Стрептококки группы А дают гемолиз на кровяном агаре, нередуцируют метиленовую синь в молоке, чувствительны к пенициллину. Энтерококк является обитателем кишечника человека, однако может вызывать энтероколиты, циститы и пр. В отличив от стрептококков группы А он редуцирует метиленовую синь в молоке, не чувствителен к пенициллину, растет на средах с повышенным содержанием поваренной соли (6,5$, в 40^ желчном бульоне и бульоне pH 9,6). В отношении углеводов стрептококки не активны. Стрептококк нередко погибает во время пересевов. Поэтому целесообразно использовать все данные, полученные при посеве на первичную чашку Петри с 5# кровяным агаром; характер гемолиза, лекарственную чувствительность. При необходимости чистую культуру стрептококка можно выделить путем пересева типичной колонии секторами на чашку Петри с кровяным агаром. Пневмококк, как и другие стрептококки, может быть причиной гнойных процеосов в любом органе (гнойный отит, гайморит, ангина и т.д.); он является специфическим возбудителем крупозной пневмонии. Из диагностического материала (кроме крови) обязательно приготавливаются мазки, окрашенные по Граму. Обнаружение в них грамположи-телыщх калоульных диплококков свидетельствует о наличии пневмококка. Для его выделения материал засевают на чашки Петри о £$ кровяным агаром или в сахарный бульон. Для приготовления кровяного агара лучше попользовать ^ибринированную кровь кролика (2,Е$), барана или лошади. При работе с кровью человека в ореду добавляют дрожжевой экстракт. Питательные о репы хранятся не более 2-х недель. Посевы просматривают после инкубации при 37°С в
течение 16-18 ч. На кровяном агаре колонии пневмококков нежные, мелкие, зеленовато-серые, окружены ореолом, напоминающим гемолиз. Характерно вдавление в центре колонии. На сахарном бульоне пневмококк дает тонкое равномерное помутнение, иногда небольшой осадок. ферментация инулина имеет дифференциально-диагностическое значение для определения этого вида стрептококка. Жизнеспособность пневмококков непродолжительна, они быотро погибают при воздействии обычных дезинфицирующих средств, особенно чувствительны к желчи и ее солям. Стрептококк, колонии которого сходны с пневмококком, не лизирувтся желчью. Для идентификации микроба в пробирку о 1$ желчным бульоном засевают 2-3 мл суточной культуры исследуемого штамма. Пробирку помешают на I&-24 ч в термостат при 37°С. Просветление содержимого пробирки (лизис микроба) позволяет отнести исследуемую культуру к пневмококкам.
Ррамотрицатедьные кокки. Гремотрицательные кокки и кокка бациллы продотавлены родами ,
t&Ol0JceMo,.
К роду tЖ&ббе&сО' относятся патогенные виды -iZ''/п&ссл. — и Л'.рямЬъАеас и несколько сапрофитных видов: s/f J' Ja^/бпкг J'/pucce#?, ot'jSeca* и пр.
Менингококк является возбудителем эпидемического цереброспинального менингита, но может также вызывать сепоне, ринофа-рингиты и пр. Отмечено носительотво микроба в носоглотке здоровых людей. Для выделения микроорганизма спинномозговая жидкость центрифугируется и осадок засевается на 5^ кровяной агар, 20{f сывороточный агар, сахарный бульон. Отрицательный результат исследования не говорит против инфекции, tjc. применение антибиотиков я сульфаниламидных препаратов значительно снизило высевае-мость менингококка. В связи с этим большое значение имеет приготовление и микроскопия мазка из осадка, полученного при центри-
фугировании спинномозговой жидкости. Менингококк - это граиотрицательный диплококк, имеющий форму кофейного зерна, клетки обращены друг к другу вогнутыми сторонами, полиморфны. Наличие в мазках грамотрицательных диплококков бобовидной формы, расположенных внутриклеточно, свидетельствует о присутствии менингококка. На плотных питательных средах менингококк растет в виде мелких, слегка выпуклых, голубоватых колоний, с ровными краями. Через 2-3 суток выращивания при 37°С колонии увеличиваются в размерах и их край становится неровным. При обнаружении грамотрицательных диплококков в мокроте, мазких из зева и пр. необходимо провести дифференциацию менингококка от неотличимых от него бактериоскопически грамотрицательных микрококков. Для етого выделенные чистые культуры микроорганизма изучают в отношении биохимических свойств (табл 2).
Табл 2.
Ферментация углеводов представителями рода
|
Микроорганизм; ! 1&псула! Гшсоэа! Сахароза! Мальтона! Пигмент | ||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||
|
Примечание: К - образование кислоты |
Микроорганизмы родов и
являются возбудителями конъюнктивитов человека. 3.
в мазках располагается в виде диплококков, образует капсулу, углеводы не ферментирует, М. алеет вариабельную морфо
логию - от мелких кокков по толстых коротких палочек, расположенных парами или короткими цепочками, капсулы не образуют, углеводы не ферментируют. На кровяном агаре растут в виде мелких колоний, образующих вокруг большие темные зоны,
Гемо&ильные палочки. Гемофильные палочки относятся к роду
, включающих патогенные и непатогенные для че-века виды, ши выделяются при исследовании диагностического материала верхних дыхательных путей:
Усапрофит) и пр.
Бактерии инфлюэнцы - очень мелкие, чрезвычайно полиморфны от кокковидных по длинных нитевидных форм, неподвижны, грамотри-цательны, хорошо окрашиваются слабыми растворами фуксина. В мазках палочки чаще располагаются в виде скоплений. Микробы неустойчивы к влешним воздействиям и быстро погибают вне живого организма, Для культивирования требуют присутствия в средах факторов роста (X и У), Х-фактор связан с гематином и находится в крови, не разрушается при нагревании по 12(Рс. У-фактор содержится в животных и растительных тканях, вырабатывается некоторыми бактериями, термолабилен. Оптимальными средами для выращивания являются 10# кровяной агар или агар Ловинталя. На кровяном агаре вырастают мелкие, плоские, с выпуклым центром прозрачные колонии, иногда сливающиеся между собой, гемолиза не дают. При культивировании на среде Левинталя колонии больших размеров имеют куполообразную форму. В жидких кровяных средах микроб дает гомогенный рост о небольшой порошковидным осадком на пне. Ферментативные свойства не постоянны. ГЬлочки инфлюэнцы сбраживают глюкозу, декстрозу, левулезу, галактозу, мальтозу и сахарозу с образованием кислоты. Они никогда не сбраживают лактозу и маннит, патогенны для лаборатор-
ных животных.
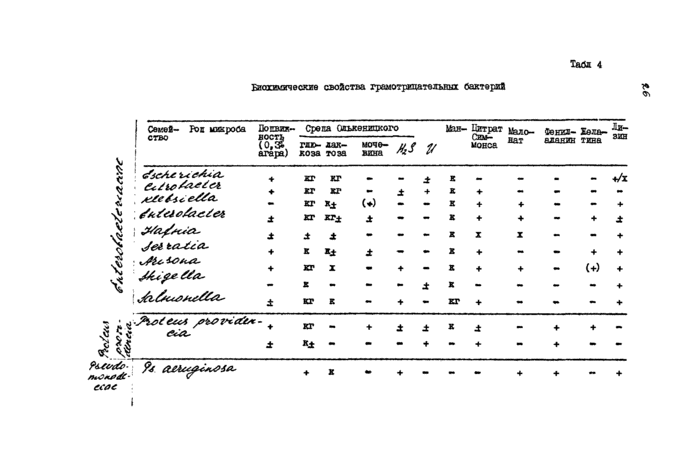
Грамот штате льные палочки. К семейству относятся грамнегативные палочки, хорошо растущие на обычных питательных средах, подвижные или неподвижные, расщепляющие глюкозу путем ферментации, не имеющие цитохромоксиаазы, редуцирующие нитраты в нитриты. После установления принадлежности штамма к
определяют внутри семейства другие таксономические свойства. При этом основное значение имеет изучение ферментативной характеристики культур. Вюхнмические признаки кишечных бактерий в пределах рода непостоянны. Поэтому при идентификации используют ряд биохимических тестов, а также изучают аминокислотный метаболизм. Дифференциация проводится до определения рода микроорганизма. Принадлежность микроба к одному из ролов семвйства^^^/^?/^^^<5йй^^СТШ|авливается по ряду биохимических те&тов?* Изучают подвижность, ферментацию глюкозы, лактозы, маннита, разложение мочевины, усвоение цитрата, разжижение желатины, образование индола и сероводорода, утилизацию малопата, дезаминирование фенилаланина, декарбоксилирование лизина. Схема дифференциации гремотрицагельных бактерии представлена в табл 4.
Посев материала производится на среды: Эндо, простой питательный агар, 5# кровяной агар. На 2-й день выделяют чистые культуры микроорганизмов и приготавливают мазки. На 3-й день изучают биохимические свойства и лекарственную чувствительность. Производят посев на среду Олькеницкого (3-х сахарный агар с мочевиной) для изучения ферментации глюкозы, лактозы, разложения мочевины и образования сероводорода; в пробирку со средой Симмонса, полужидким агаром, в среды о фенилаланином, малонатом натрия, лизином, в бульон Хоттингера для определения лекарственной чувствительности опускают полоску рентгеновской пленки. При необходи-
Методические рекомендации предлагают методики посева, идентификации, определения лекарственной чувствительности условно патогенных микроорганизмов при диагностике смепанной инфекции у (Зольных туберкулезом. Приведены качественные и количественные методы исследования диагностического материала, схемы идентификации основных групп микроорганизмов, выделяемых от больных туберкулезом (стрептококки, отафялококки, грамотрицателыше бактерии, нефермеытирующие грамотрицателыше палочки)* Методические рекомендации предназначены для лабораторий противотуберкулезных учреждений.
Методические рекомендации составлены сотрудником Московского НИИ туберкулеза Минздрава РСФСР к.м.н. А.Н. Мадш.
(с) - Московский научно-исследовательский институт туберкулёза Минздрава РОФСР
мости более полной идентификации набор тестов может быть увеличен, В настоящее время для идентификации грамотрицательных бактерий выпускаются системы индикаторные бумажные (СИБ). Системы имеют набор для межродовой шфференциации по 9 основным биохимическим свойствам: утилизация цитрата и малоната натрия, ферментация лактозы; наличие р -галактозидазы, фенилаланиндезаминазы, уреазы, декарбоксилазы лизина; образование индола и сероводорода. Полная идентификация дфода включает 25 биохимических тестов.
палочка о закругленными концами, грамотрицательна, подвижна, В отношении питательных сред непритязательна. На поверхности плотных питательных сред кишечная палочка растет в виде круглых, серовато-голубоватых (малиново-красных на среде Эндо) колоний с металлическим блеском, некоторые штаммы дают гемолиз на кровяном агаре. В бульоне - равномерное помутнение, к концу первых оуток образуют индол. Первичное распознавание кишечной палочки основывается на ее способности разлагать с образованием кислоты и газа глюкозу* лактозу, маннит. Способность кишечной палочки сбраживать лактозу с образованием кислоты и газа отличает ее от других представителей кишечной группы. Чистую культуру микроба выделяют на скошенный мясо-пептонный агар. Для определения сахаролитических свойств культуру с агара пересевают в среду Олькеницкого, в пробирку с маннитом. Посинение ореды и пузырьки газа свидетельствуют о ферментации глюкозы, лактозы и маннита. Кишечная палочка не растет на среде Сишонса, не образует сероводорода.
Капсулыгые бактешии^^У#2& _ капоуль-
ные бактерии pona^^’^V являются возбудителями пневмонии, ржносклеромы, оэены. Бактерии рода
Идентификация осуществляется по общей схеме. В отличие от микробов раотут на среде Симмонса, образуют сероводород.
вызывают
Бактериологические исследования на условно-пато-
шааа ншшатша
Комплексное лабораторное изучение микрофлоры включает бак-териоскопическое и бактериологическое исследование материала, проводимые в динамике при поступлении на стационарное лечение, в процессе лечения, а также по показаниям у больных, лечащихся амбулаторно, Пооевы диагностического материала целесообразно производить на плотные питательные среды, что исключает подавление роста одного микроорганизма другим и позволяет дать количественную оценку числа выросших колоний. Интенсивность роста микроорганизмов может выражаться в крестах и соответствовать содержанию определенного количества микробных клеток в I мл диагностического материала:
•Н++ обильный рост вливающихся колоний (ю® м/кл)
+++ массивный рост изолированных колоний (I07 м/кл)
++ умеренный рост множества сосчитываемых колоний (не менее 50) (Ю5-Ю6 м/кл)
♦ скудный рост единичных колоний (30-50) (I04 м/кл).
Цри дозированном посеве определяют абсолютное содержание микроорганивмов в I мл или I гр исследуемого материала. Этиологически влачимым содержанием бактерий в I мл (I гр) материала признается I07 и выше. Количественное преобладание определенного вида микроорганизма является одним из показателей его участия в гнойно-воопалатальном процессе. (Леончатадьная интерпретация результатов бактериологического исследования производится после изучения анамнестических данных, клинической симптоматики, результатов антибактериальной терапии. При направлении материала на пооев необходимо соблюдать определенные правила. Материал должен быть последовав до начала антибактериальной терапии или через такой период после введения антибактериальных препаратов, который необходим идя их элиминации из
У
организма больного (2-3 пня при анализах мокроты, 4-7 иней -мочи). Применение антибиотиков в $-4 раза снижает частоту выделения микроорганизмов. Посевы диагностического материала проводятся в динамике (3-5 раз), что уточняет этиологию заболевания, дает возможность проследить длительность персистен-ции возбудителя, контролировать эффективность провопимой терапии. Мтервал между сбором и посевом материала не должен превышать 1-2 ч.
Исследование нихроДшорн верхних дыхательных путай (глот-ка, ноо, ротовая полость). Материалом для исследования служат: слизь, гнойное отделяемое, корочки, пленка, кусочки инфильтратов при биопсии. Материал для микробиологического исследования из ротовой полости забираА/г натощак стерильным ватным тампоном со слизистой оболочки у выхода протоков слюнных желез, поверхности языка, из язвочек (соскоб ложечкой), с наиболее пораженных мест. При наличии пленки последнюю снимают пинцетом. Материал из носовой полости забирают сухим стерильным ватным тампоном. Материал засевают на чашки Петри с кровяная, желточно-солевым агарами, среду Сабуро. При посеве тампоном материал втирают в среду со всей поверхности тампона на небольшом участке 1-2 см^, а затем штрихами по всей поверхности. Одновременно о посевом приготавливают мазки и окрашивают по Граму.
Исследование микрофлоры нижних дыхательных путей. Основная материалом для исследования является мокрота, которая собирается в день исследования, утром, после чистки зубов и полоскания полости рта свежекипяченой водой. При обильном выделении мокроты, первые порции следует откашлять в плевку, а последующие собираются в стерильную посулу и доставляются в лабораторию. Дня изучения микрофлоры мокроты применяют как посев неразведенной мокроты (качественный метод), так и метод раз-
ведения, который получил название количественного. При качественном методе для посева используются гнойные комочки мокроты, отмытые в физиологическом растворе от микрофлоры ротовой полости. Цри количественных методах гомогенизируется I мд мокроты. Затем производятся разведения, позволяющие уменьшить в ней количество микроорганизмов ротовой полости. При обоих методах одновременно с посевом приготавливается мазок, который окрашивается по Граму. Исследованию подлежит гнойная и слизисто-гнойная мокрота, в которой присутствуют лейкоциты и клетки альвеолярного эпителия, клетки, вкрапленные в муцин, присутствие которых характерно для экскрета нижних отделов дыхательных путей. Обращают внимание на преобладающую в мазке нативной мокроты микрофлору, особенно капсульные диплококки (пневмококки), мелкие грам-отрицатедькые палочки (палочка Щюйффера) и др.
Качественный метод. В лаборатории мокроту выливают в чашу Петри, выбирают 3-3 гнойных комочка, которые однократно отмывают в физиологическом растворе, после чего засевают на кровяной и желточно-солевой агары, среды Эндо и Сабуро. Посев производят стерильным стеклянным шпателем, равномерно растирая материал на поверхности питательной среды. На чашку с кровяным агаром сразу же пооле пооева накладывают диски о антибиотиками (стрептомицином, пенициллином, тетрациклином, эритромицином и девомицети-ном), что поэволяет подучить акопресо-информацию о лекарственной чувствительности преобладающей в посеве микрофлоры. На второй день учитывают количество выросших колоний (этиологически значимым считается рост более 50 колоний), однородность популяции и лекарственную чувотвительнооть при росте их в монокультуре,
Количественный метод. Из доставленной в лабораторию мокроты берут I мл, добавляют 9 мл мясо-пептонного бульона и гомогенизируют в балке о бусами в течение 20 мин. Из полученной эмуль-
оии готовят десятикратные последовательные разведения. Посев осуществляют в обратном порядке с меньшего разведения, засевается по 0,1 мд из разведенной мокроты КГ4 и КГ® на чашку с кровяным агаром. Посев на желточно-солевой агар, среду Эндо и Сабуро делают из ииконного разведения I;10. Посевы инкубируют в течение суток при 37°. На 2-ые сутки чашки просматривают и учитывают численность каждого из видов микроорганизмов в миллионах. Диагностически значимым признается содержание бактерий I04 м/кл и выше в I мд мокроты.
Дзсев промывных, вод бронхов^ лдвэдноД жидкости. Из последуем ого материала отбирают комочки слизи, которые без предварительного отмывания в физиологическом растворе засевают на плотные питательные среды (см. пооев мокроты) и в пробирку с сахарным бульоном. При отсутствии комочков слизи производят посев материала, набранного в пастеровскую пипетку. Инкубация в течение суток при З^С.
Исследование микрофлоры глаз. Пробы на исследование отбирает врач стерольнш ватным тампоном иди стеклянной палочкой. Материал забирается с пораженных мест и засевается в 0,5£ сахарный бульон. В случае отсутствия роста через 48 ч выдается отрицательный ответ.
Исследование таков из уха. Материал забирают стерильным ватным тампоном из слухового канала и производят посев на кровяной и желточно-солевой агары, среду Сабуро, втирая материал на участке среды, после чего растирают по всей чашке.
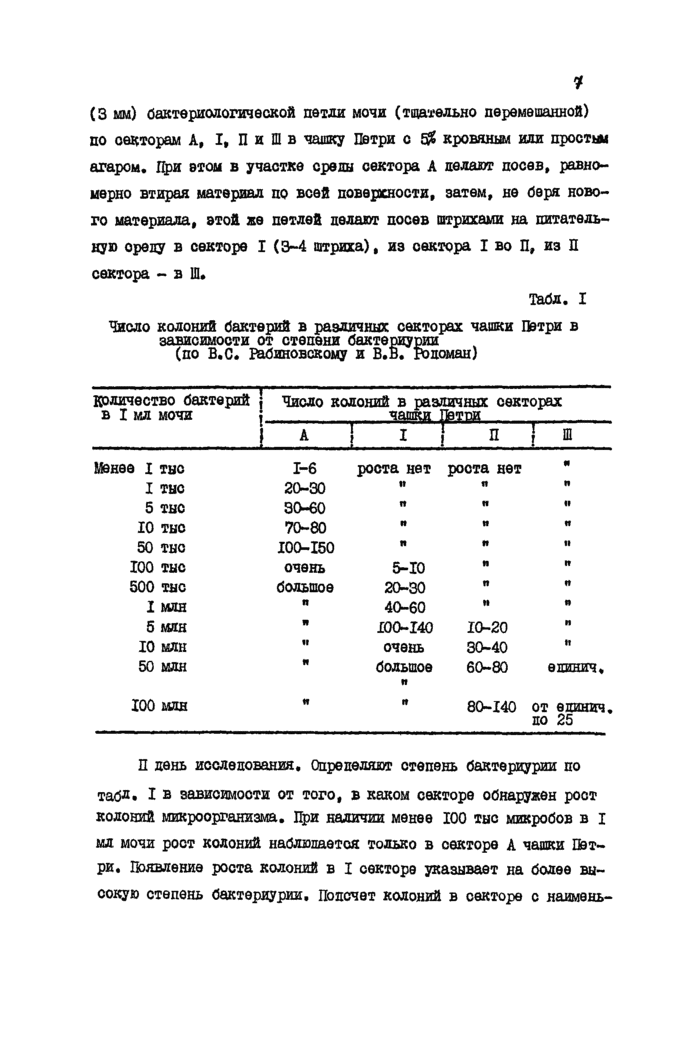
Исследование мочи. Исследованию подлежит орепняя порция утренней мочи, подученная при нормальном мочеиспускании иля взятая катетером. Показателем бактериурии, имеющим клиническое значение, считается наличие 100 ООО и более микробой в I мл мочи.
I день исследования. Производят посев одной стандартной
(3 мм) бактериологической петли мочи (тщательно перемешанной) по векторам А, I, П и Ш в чашку Петри с S& кровяным или просты* агаром. При этом в участке среды сектора А делают посев, равномерно втирая материал по всей поверхности, затем, не беря нового материала, этой же петлей делают посев штрихами на питательную ореду в секторе I (3-4 штриха), из сектора I во П, из П сектора - в Ш.
Табл. I
Число колоний бактерий в различных секторах чашки Петри в зависимости от степени бактериурии (по В. С. Раб Яновскому и В. В. родомац)
|
Количество бактерий ; Число колоний в различных секторах в I мл мочи j чашки Пвтпи | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
по 25 |
П день исследования. Определяют степень бактериурии по
табл* I в зависимости от того, в каком секторе обнаружен рост колоний микроорганизма. При наличии менее 100 тыс микробов в I мл мочи рост колоний наблюдается только в секторе А чашки Петри. Появление роста колоний в I секторе указывает на более высокую степень бактериурии. Попечет колоний в секторе с наймень-
шим ростом не представляет труда. Метод секторных посевов в большинстве случаев позволяет уже на второй день исследования выделить возбудителя заболевания в чистой культуре.
Исследовшше микчойяоры ран, пуяктатов. экссудатов, резв-ццрованных тканей. Экссудаты и пунктаты засевают пастеровской пипеткой в пробирки с кровяным и простым мясо-пептонным агаром, сахарным бульоном. Тампон с диагностическим материалом заоева-ют на чашки Петри о $ кровяным и 1$ желточно-солевым агарами. Материал втирается по краю среды, а затем рассеивается по чашке при помощи этого же тампона или бактериологической петли.
Исследование микройлорн женские половых останов. Выделе-кия собирают с помощью стерильного ватного тампона и засевают на чашки Петри о $ кровяным агаром, желточно-солевым агаром и в пробирку с сахарным бульоном, а также на среду Эндо.
Исследование недчп. 2елчь собирают при зондировании иди во время операции в стерильные пробирки и доставляют в лабораторию не позднее 2 ч от момента забора. 0,1 мл желчи высевают на чашку с кровяным агаром и на среду Эндо. Посевы и оставшийся исходный материал помещают в термостат при З^С. Через 24 ч учитывают результаты первичных посевов с подсчетом количества колоний каждого вида на плотных питательных средах.
Исследование крови. Кровь сеют у постели больного пооле тщательной обработки кожи (спирт, эфир). Из локтевой вены берут 10 мд крови, которую выливают в две колбы: первую со 150-200 ил сахарного бульона и вторую о тиогликолевой средой (по 5 мл). Посевы выдерживают в термостате в течение 10 дней. На 2, 3, 5 и 10-й дни производят контрольные высевы на чашки Натри с St кровяным агаром. Посев 5 ил крови можно произвести во флакон о питательной средой в двух фазах: плотной и жидкой (скоо St кровяного агара с jjt глюкозы и 50 мл 0,5£ сахарного бульона), такая
методика исключает необходимость многократных пересевов, устраняет возможность загрязнения посева микрофлорой окружающей среды, позволяет учесть количество выросших колоний (т.е. оценить напряженность бактериемии). Посев помещают в термостат при 370 на 10 аут. Ежедневно содержимое флаконов взбалтывают и наклоном флакона омачивают поверхность скоса плотной питательной среды. При появлении роста колоний на скосе кровяного агара с них приготавливают мазки и далее идентифицируют по общепринятым в бактериологии правилам. При отсутствии роста микроорганизмов на 10-ые сутки дается окончательный ответ - посев крови стерилен.
Исследование на диобактегаоз кишечника. На предварительно подготовленные и взвешенные (подпергаменг или вощанку) стерильные бумажки размером 3x2 берут произвольное количество фекалий и взвешивают на торзионных весах. Бумажку вмеоте о материалом помещают в стерильную пробирку. Вес навески фекалий, за вычетом веса бумажки, умножают на 9. Полученная после умножения сумма равна количеству физиологического раствора, которое необходимо добавить в пробирку. Вазведеяие 1:10 (I).
Например: вес бумажки 20 мг
вес фекалий с бумажкой 420 мг
420 - 20 400 мг х 9 = З.вОО (3,5 мл).
Пооле эмульгирования стеклянной палочкой или стерильной пипеткой взвеои дают ототояться при комнатной температуре 10-15 мин и 0,1 мл переносят в следующую пробирку с 9,9 мл физиологического раствора (разведение 10”*). Затем производят разведение фэкалий до титра 10“^. Из основного разведения (10”*) производят посев на плотные питательные ореяы для выделения патогенных микробов семейства кишечных (среду Плоскирева, Левина). Одновременно делают массивный (0,&-1,0) посев на жидкие среды обогащения (Мюллера, селенитовую, магниевую). Из пробирки, в