Приказ 300н
Об утверждении требований к медицинским организациям, проводящим клинические испытания медицинских изделий, и порядка установления соответствия медицинских организаций этим требованиям
Купить Приказ 300н — бумажный документ с голограммой и синими печатями. подробнее
Цена на этот документ пока неизвестна. Нажмите кнопку "Купить" и сделайте заказ, и мы пришлем вам цену.
Распространяем нормативную документацию с 1999 года. Пробиваем чеки, платим налоги, принимаем к оплате все законные формы платежей без дополнительных процентов. Наши клиенты защищены Законом. ООО "ЦНТИ Нормоконтроль"
Наши цены ниже, чем в других местах, потому что мы работаем напрямую с поставщиками документов.
Способы доставки
- Срочная курьерская доставка (1-3 дня)
- Курьерская доставка (7 дней)
- Самовывоз из московского офиса
- Почта РФ
Порядок определяет правила установления соответствия медицинских организаций требованиям, предъявляемым к медицинским организациям, проводящим клинические испытания медицинских изделий
Зарегистрировано в Минюсте РФ 4 февраля 2014 г. Регистрационный № 31216
Оглавление
Приложение № 1. Требования к медицинским организациям, проводящим клинические испытания медицинских изделий
Приложение № 2. Порядок установления соответствия медицинских организаций требованиям, предъявляемым к медицинским организациям, проводящим клинические испытания медицинских изделий
Приложение № 1. Заявление о намерении осуществлять клинические испытания медицинских изделий
Приложение № 2. Перечень медицинских организаций, проводящих клинические испытания медицинских изделий
| Дата введения | 25.02.2014 |
|---|---|
| Добавлен в базу | 01.02.2020 |
| Актуализация | 01.01.2021 |
Этот документ находится в:
Организации:
| 16.05.2013 | Утвержден | Министерство здравоохранения Российской Федерации | 300н |
|---|---|---|---|
| Издан | Российская газета | от 14.02.2014 № 34 |
Чтобы бесплатно скачать этот документ в формате PDF, поддержите наш сайт и нажмите кнопку:

стр. 1

стр. 2

стр. 3

стр. 4

стр. 5

стр. 6

стр. 7
стр. 8
Приложение № 1 к приказу Министерства здравоохранения Российской Федерации
от /£ МОЯ■ '0/3i № 300 к-
Требования к медицинским организациям, проводящим клинические испытания медицинских изделий
1. К медицинским организациям, проводящим клинические испытания медицинских изделий, предъявляются следующие требования:
а) наличие лицензии на осуществление медицинской деятельности с указанием перечня работ (услуг), составляющих медицинскую деятельность, исходя из назначения и области применения медицинских изделий, в отношении которых проводятся испытания;
б) наличие в уставе медицинской организации сведений:
об осуществлении научной (научно-исследовательской) деятельности;
о проведении клинических испытаний медицинских изделий;
в) наличие отделения (палаты) интенсивной терапии и реанимации, в случае проведения клинических испытаний медицинских изделий с участием человека в качестве субъекта, относящихся к классам 26 и 3 в зависимости от потенциального риска применения1;
г) обеспечение защиты конфиденциальной информации.
2. К медицинским организациям, проводящим клинические испытания медицинских изделий для диагностики in vitro (далее - клинико-лабораторные испытания), предъявляются следующие требования:
а) наличие лицензии на осуществление медицинской деятельности в области лабораторной диагностики (клиническая лабораторная диагностика);
б) наличие в уставе медицинской организации сведений:
об осуществлении научной (научно-исследовательской) деятельности;
о проведении клинических испытаний (исследований) медицинских изделий;
в) обеспечение защиты конфиденциальной информации. 2
Jjta.о Ю/*>ч.
Министр
|
МИНИСТЕРСТВО ЗДРАВООХРАНЕНИЯ!!! ,ШЬИ«1Ш.М |
|
ПРИКАЗ |
|
от |
^ Ъ00ц_
Москва
В.И. Скворцова
Приложение № 2 к приказу Министерства здравоохранения Российской Федерации
от
Порядок установления соответствия медицинских организаций требованиям, предъявляемым к медицинским организациям, проводящим клинические испытания медицинских изделий
1. Настоящий порядок определяет правила установления соответствия (далее - Порядок) медицинских организаций требованиям, предъявляемым к медицинским организациям, проводящим клинические испытания медицинских изделий (далее - установление соответствия).
2. Установление соответствия осуществляется Федеральной службой по надзору в сфере здравоохранения (далее - Росздравнадзор) в целях признания компетентности медицинской организации в проведении клинических испытаний медицинских изделий по соответствующему профилю медицинской помощи, оказываемой медицинской организацией.
3. Росздравнадзор осуществляет ведение перечня медицинских организаций, проводящих клинические испытания, и размещает его на своем официальном сайте в информационно-телекоммуникационной сети Интернет.2
4. Медицинская организация, планирующая проводить клинические испытания медицинских изделий (далее - заявитель), представляет непосредственно либо направляет по почте или в форме электронного документа в Росздравнадзор заявление о намерении проводить клинические испытания медицинских изделий, которое оформляется по образцу согласно приложению № 1 к настоящему Порядку, и документы, указанные в пункте 6 настоящего Порядка;
5. В заявлении о намерении осуществлять клинические испытания медицинских изделий указываются следующие сведения:
а) полное и сокращенное наименование (в случае если имеется), в том числе фирменное наименование, организационно-правовая форма медицинской организации, адрес (место нахождения), а также номера телефонов и адреса электронной почты медицинской организации (в случае если имеется);
б) основной государственный регистрационный номер записи
0 государственной регистрации медицинской организации;
в) идентификационный номер налогоплательщика;
г) перечень работ (услуг) в соответствии с лицензией на осуществление медицинской деятельности.
6. Для установления соответствия медицинских организаций требованиям, предъявляемым к медицинским организациям, проводящим 3
клинические испытания медицинских изделий, представляются следующие документы, заверенные медицинской организацией в установленном порядке:
а) копии учредительных документов;
б) копии документов, подтверждающих наличие отделения (палаты) интенсивной терапии и реанимации, в случае проведения клинических испытаний медицинских изделий с участием человека в качестве субъекта, относящихся к классам 26 и 3 в зависимости от потенциального риска применения:
копию утвержденного руководителем медицинской организации документа, устанавливающего коечный фонд, структуру и штатное расписание медицинской организации;
сведения о санитарно-эпидемиологическом заключении (с указанием номера и даты) о соответствии санитарным правилам помещений, необходимых для выполнения работ (услуг) при осуществлении медицинской деятельности по анестезиологии и реаниматологии;
в) копии документов, подтверждающих наличие клинико-диагностической (диагностической) лаборатории с указанием ее профиля (для медицинских изделий для диагностики in vitro):
сведения о санитарно-эпидемиологическом заключении (с указанием номера и даты) о соответствии санитарным правилам помещений, необходимых для выполнения работ (услуг) при осуществлении медицинской деятельности по лабораторной диагностике, клинической лабораторной диагностике;
сведения о санитарно-эпидемиологическом заключении (с указанием номера и даты) о возможности проведения определенного вида работ с конкретными видами микроорганизмов на каждое структурное подразделение, проводящее работу с возбудителями I -II фуппы патогенности (при необходимости)4;
г) копию утвержденного руководителем медицинской организации документа, устанавливающего порядок работы с конфиденциальной информацией;
7. Заявление и документы, указанные в пункте 6 настоящего Порядка, представляются заявителем в Росздравнадзор на бумажном носителе непосредственно или направляются заказным почтовым отправлением с уведомлением о вручении и описью вложения, или в форме электронного документа, подписанного электронной подписью.
Росздравнадзор не вправе требовать представления документов и информации, которые находятся в распоряжении органов, предоставляющих государственные услуги, органов, предоставляющих муниципальные услуги, иных государственных органов, органов местного самоуправления либо подведомственных государственным органам или органам местного самоуправления организаций, участвующих в предоставлении государственных и муниципальных услуг.
8. Заявление о намерении проводить клинические испытания медицинских изделий подписывается руководителем заявителя или уполномоченным им лицом и заверяется печатью медицинской организации.
9. Росздравнадзор не вправе требовать от заявителя представления документов, не предусмотренных настоящим Порядком.
10. Заявление и документы, представленные заявителем в соответствии с пунктом 6 настоящего Порядка, принимаются по описи и регистрируются Росздравнадзором в день их поступления.
11. Росздравнадзор в срок, не превышающий 20 рабочих дней с даты поступления представленных в соответствии с пунктом 7 настоящего Порядка документов, рассматривает их, проводит проверку полноты и достоверности содержащихся в них сведений, проверку соответствия заявителя требованиям к медицинским организациям, проводящим клинические испытания медицинских изделий, установленным приложением № 1 к приказу Министерства здравоохранения Российской Федерации от /6 Js&Jl <&&• № ZWfrc •
Проверка наличия у заявителя лицензии на осуществление медицинской деятельности в соответствии с областью медицинского применения медицинских изделий осуществляется Росздравнадзором с использованием единой системы межведомственного электронного взаимодействия и подключаемых к ней региональных систем межведомственного электронного взаимодействия по межведомственному запросу Росздравнадзора.
12. Росздравнадзор в срок, предусмотренный пунктом 11 настоящего
Порядка, принимает решение о соответствии или несоответствии заявителя требованиям к медицинским организациям, проводящим клинические испытания медицинских изделий, установленным приложением № 1 к приказу Министерства здравоохранения Российской Федерации от f/PJ/ftsJ&Zr № , которое оформляется соответствующим решением.
13. В случае принятия решения о соответствии медицинской организации требованиям, установленным приложением № 1 к приказу Министерства здравоохранения Российской Федерации от <ЯЖ >№
Росздравнадзор в течение 3 рабочих дней с даты принятия указанного решения вносит сведения о медицинской организации в перечень медицинских организаций, проводящих клинические испытания медицинских изделий, по образцу согласно приложению № 2 к настоящему Порядку и направляет (вручает) заявителю разрешение на проведение клинических испытаний медицинских изделий5.
14. В случае принятия решения о несоответствии медицинской организации требованиям, установленным приложением № 1 к приказу Министерства здравоохранения Российской Федерации от /6 № &РР /t> , Росздравнадзор в течение 3 рабочих дней с даты принятия указанного решения направляет (вручает) заявителю письмо с мотивированным обоснованием причин несоответствия.
15. Исключение из перечня медицинских организаций, проводящих клинические испытания медицинских изделий, осуществляется
Росздравнадзором в следующих случаях:
а) подача заявления, подписанного руководителем медицинской организации, об исключении из перечня медицинских организаций, проводящих клинические испытания медицинских изделий;
б) выявление Росздравнадзором нарушений обязательных требований
при проведении медицинской организацией клинических испытаний медицинских изделий по результатам осуществления государственного контроля за обращением медицинских изделий в соответствии
с постановлением Правительства Российской Федерации от 25 сентября 2012 г. № 970 «Об утверждении Положения о государственном контроле за обращением медицинских изделий» (Собрание законодательства Российской Федерации, 2012, № 40, ст. 5452).
№_от
Приложение № 1 к Порядку установления соответствия медицинских организаций требованиям, предъявляемым к медицинским организациям, проводящим клинические испытания медицинских изделий
Образец
В ФЕДЕРАЛЬНУЮ СЛУЖБУ ПО НАДЗОРУ В СФЕРЕ ЗДРАВООХРАНЕНИЯ
Заявление о намерении осуществлять клинические испытания медицинских изделий
|
Заявитель | |||||||||||||||||||||||||||
| |||||||||||||||||||||||||||
|
* в случае если имеется в лице Фамилия, имя. отчество (если имеется), должность руководителя медицинской организации действующего на основании_ |
(документ, подтверждающий полномочия)
просит включить в перечень медицинских организаций, проводящих клинические испытания медицинских изделий, и подтверждает соответствие медицинской организации требованиям к медицинским организациям, осуществляющим клинические испытания медицинских изделий.
Заявитель
'ФИО. подпись
«
»
20 г.
м. п.
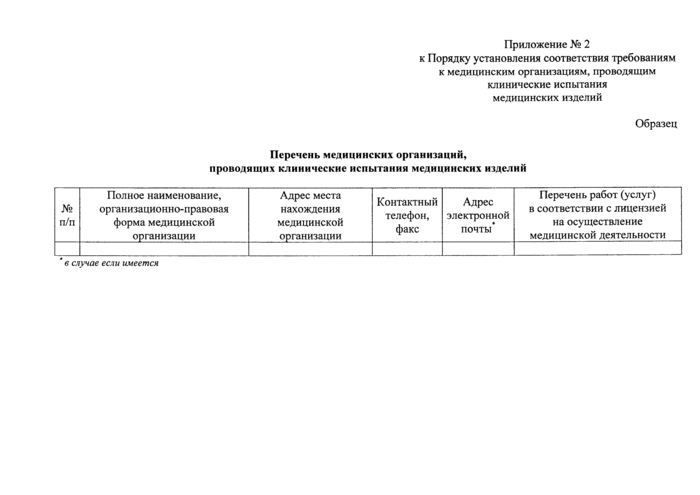
Приложение № 2 к Порядку установления соответствия требованиям к медицинским организациям, проводящим клинические испытания медицинских изделий
Образец
Перечень медицинских ор1янизацнй, проводящих клинические испытания медицинских изделий
| ||||||||||||
|
в случае если имеется |
1
Требования к медицинским организациям, проводящим клинические испытания медицинских изделий, согласно приложению № 1;
2. Порядок установления соответствия медицинских организаций требованиям, предъявляемым к медицинским организациям, проводящим клинические испытания медицинских изделий, согласно приложению № 2.
2
Приказ Министерства здравоохранения Российской Федерации от 6 июня 2012 г. № 4н «Об утверждении номенклатурной классификации» (зарегистрирован Министерством юстиции Российской Федерации от 9 июля 2012 г., регистрационный № 24852).
3
Пункт 27 постановления Правительства Российской Федерации от 27 декабря 2012 г. № 1416 «Об утверждении Правил государственной регистрации медицинских изделий» (Собрание законодательства Российской Федерации. 2013, № I. ст. 14).
4
Постановление Главного государственного санитарного врача Российской Федерации от 15 апреля 2003 г. №42 «О введении в действие Санитарно-эпидемиологических правил СП 1.3.1285-03» (зарегистрировано Министерством юстиции Российской Федерации от 15 мая 2003 г., регистрационный № 4545).
5
Пункт 24 постановления Правительства Российской Федерации от 27 декабря 2012 г. № 1416 «Об утверждении Правил государственной регистрации медицинских изделий» (Собрание законодательства Российской Федерации, 2013, № 1,ст. 14).