Административный регламент Федерального медико-биологического агентства по исполнению государственной функции по контролю и надзору в сфере донорства крови и ее компонентов
Купить бумажный документ с голограммой и синими печатями. подробнее
Цена на этот документ пока неизвестна. Нажмите кнопку "Купить" и сделайте заказ, и мы пришлем вам цену.
Распространяем нормативную документацию с 1999 года. Пробиваем чеки, платим налоги, принимаем к оплате все законные формы платежей без дополнительных процентов. Наши клиенты защищены Законом. ООО "ЦНТИ Нормоконтроль"
Наши цены ниже, чем в других местах, потому что мы работаем напрямую с поставщиками документов.
Способы доставки
- Срочная курьерская доставка (1-3 дня)
- Курьерская доставка (7 дней)
- Самовывоз из московского офиса
- Почта РФ
Регламент устанавливает сроки и последовательность административных процедур при осуществлении государственного контроля и надзора за соблюдением законодательства Российской Федерации в сфере донорства крови и ее компонентов
Зарегистрировано в Минюсте РФ 28 ноября 2011 г. Регистрационный № 22412
Оглавление
I. Общие положения
II. Требования к порядку исполнения государственной функции
III. Административные процедуры
IV. Порядок и формы контроля за исполнением государственной функции
V. Досудебный (внесудебный) порядок обжалования решений и действий (бездействия) органа, исполняющего государственную функцию, а также их должностных лиц
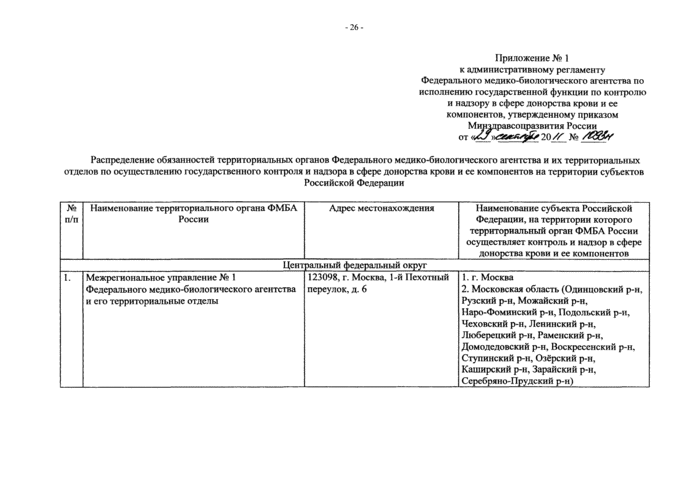
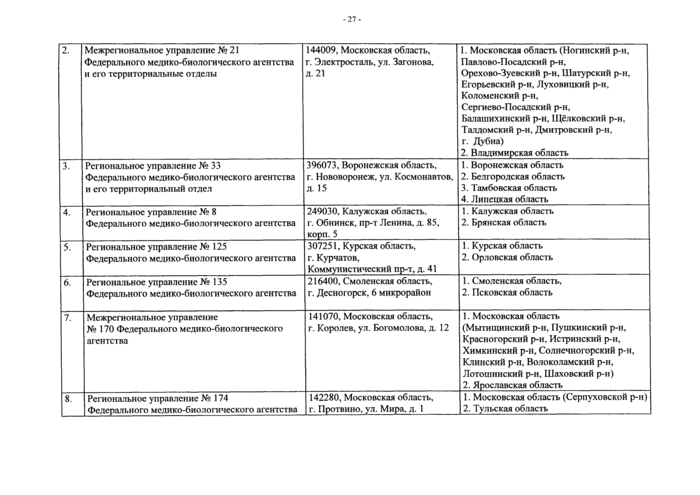
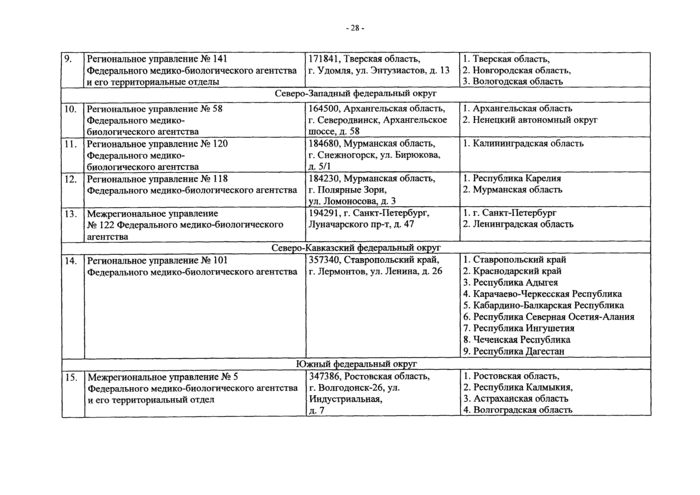
Приложение № 1. Распределение обязанностей территориальных органов Федерального медико-биологического агентства и их территориальных отделов по осуществлению государственного контроля и надзора в сфере донорства крови и ее компонентов на территории субъектов РФ
Приложение № 2. Блок-схема "Структура и взаимосвязи административных процедур, выполняемых при осуществлении контроля и надзора в сфере донорства крови и её компонентов"
Приложение № 3. Схема исполнения административной процедуры "Получение и анализ сведений о соблюдении организациями здравоохранения, науки и образования, а также их структурными подразделениями, осуществляющими заготовку, переработку, хранение, транспортировку, применение и обеспечение безопасности донорской крови и ее компонентов обязательных требований в сфере донорства крови и её компонентов"
Приложение № 4. Схема исполнения административной процедуры "Проведение проверок осуществления организациями здравоохранения, науки и образования, а также их структурными подразделениями, осуществляющими заготовку, переработку, хранение, транспортировку, применение и обеспечение безопасности донорской крови и ее компонентов деятельности в сфере донорства крови и ее компонентов"
| Дата введения | 27.12.2011 |
|---|---|
| Добавлен в базу | 01.02.2020 |
| Завершение срока действия | 27.09.2020 |
| Актуализация | 01.01.2021 |
Этот документ находится в:
- Раздел Экология
Организации:
| 29.09.2011 | Утвержден | Министерство здравоохранения и социального развития РФ | 1093н |
|---|---|---|---|
| Издан | Российская газета | от 16.12.2011 № 284 |
- Федеральный закон 294-ФЗ О защите прав юридических лиц и индивидуальных предпринимателей при осуществлении государственного контроля (надзора) и муниципального контроля
- Федеральный закон 59-ФЗ О порядке рассмотрения обращений граждан Российской Федерации
- Технический регламент Технический регламент о требованиях безопасности крови, ее продуктов, кровезамещающих растворов и технических средств, используемых в трансфузионно-инфузионной терапии
- Постановление 373 О разработке и утверждении административных регламентов осуществления государственного контроля (надзора) и административных регламентов предоставления государственных услуг
- Федеральный закон 8-ФЗ Об обеспечении доступа к информации о деятельности государственных органов и органов местного самоуправления
- Постановление 953 Об обеспечении доступа к информации о деятельности Правительства Российской Федерации и федеральных органов исполнительной власти
- Показать все
Чтобы бесплатно скачать этот документ в формате PDF, поддержите наш сайт и нажмите кнопку:

стр. 1

стр. 2

стр. 3

стр. 4

стр. 5

стр. 6

стр. 7

стр. 8

стр. 9

стр. 10

стр. 11

стр. 12

стр. 13

стр. 14

стр. 15

стр. 16

стр. 17

стр. 18

стр. 19

стр. 20

стр. 21

стр. 22

стр. 23

стр. 24

стр. 25

стр. 26

стр. 27
стр. 28
стр. 29
стр. 30
МИНИСТЕРСТВО ЗДРАВООХРАНЕНИЯ И СС ЦИАЛЬНОГО’ЙЧЗВИТИЯ
РОССИЙСКОЙ ФЕДЕРА датЕКШ) юстиции российской ШЕмиии
(Минздравсоцразвития Ро< сщХРЕГИСТРИРОВЛИО
ПРИКАЗ
Регистрационный .V»
от
№ /%%///
Москва
Об утверждении ад1иинистративного регламента Федерального медико-биологического агентства по исполнению государственной функции по контролю и надзору в сфере донорства крови и её компонентов
Во исполнение Федерального закона от 26 декабря 2008 г. № 294-ФЗ «О защите прав юридических лиц и индивидуальных предпринимателей при осуществлении государственного контроля (надзора) и муниципального контроля» (Собрание законодательства Российской Федерации, 2008, №52, ст. 6249; 2009, № 18, ст. 2140; № 29, ст. 3601; №48, ст. 5711, № 52, ст. 6441; 2010, № 17, ст. 1988, № 18, ст. 2142, № 31, ст. 4160, ст. 4193, ст. 4196; № 32, ст. 4298; 2011, № 1, ст. 20, № 17, ст. 2310; № 27, ст. 3880, № 30, ст. 4590) и в соответствии с постановлениями Правительства Российской Федерации от 30 июня 2004 г. № 321 «Об утверждении Положения о Министерстве здравоохранения и социального развития Российской Федерации» (Собрание законодательства Российской Федерации, 2004, № 28, ст. 2898; 2005, № 2, ст. 162; 2006, № 19, ст. 2080; 2008, № 11, ст. 1036; № 15, ст. 1555; № 23, ст. 2713; № 42, ст. 4825; № 46, ст. 5337; № 48, ст. 5618; 2009, № 2, ст. 244; № 3, ст. 378; № 6, ст. 738; № 12, ст. 1427, ст. 1434; № 33, ст. 4083, ст. 4088; № 43, ст. 5064; № 45, ст. 5350;
2010, № 4, ст. 394; №11, ст. 1225; № 25, ст. 3167; № 26, ст. 3350; № 31, ст. 4251; № 35, ст. 4574; № 52, ст. 7104; 2011, № 2, ст. 339; № 14, ст. 1935, ст. 1944; № 16, ст. 2294, №24, ст. 3494; № 34, ст. 4985), от 11 апреля 2005 г. № 206 «О Федеральном медико-биологическом агентстве» (Собрание законодательства Российской Федерации, 2005, № 16, ст. 1456; 2006, № 49, ст. 5222; 2008, № 23, ст. 2713; № 46, ст. 5337; 2009, № 6, ст. 738, № 12, ст. 1427; № 30, ст. 3823; № 43, ст. 5064; 2010, № 26, ст. 3350;
2011, № 14, ст. 1935), от 16 мая 2011г. № 373 «О разработке и
утверждении административных регламентов исполнения государственных функций и административных регламентов предоставления государственных услуг» (Собрание законодательства Российской Федерации, 2011, № 22, ст. 3169; 2011, № 35, ст. 5092),
приказываю:
1. Утвердить прилагаемый административный регламент Федерального медико-биологического агентства по исполнению государственной функции по контролю и надзору в сфере донорства крови и её компонентов.
2. Признать утратившими силу:
приказ Министерства здравоохранения и социального развития
Российской Федерации от 22 февраля 2008 г. № 91 н «О порядке осуществления контроля за качеством донорской крови и ее компонентов» (зарегистрирован Министерством юстиции Российской Федерации 17 марта 2008 г. № 11352);
приказ Министерства здравоохранения и социального развития
|
Т.А. Голикова |
Российской Федерации от 15 апреля 2009 г. № 190н «О внесении изменений в приказ Министерства здравоохранения и социального развития Российской Федерации от 22 февраля 2008 г. № 91 н «О порядке осуществления контроля за качеством донорской крови и ее компонентов» (зарегистрирован Министерством юстиции Российской Федерации 12 мая 2009 г. № 13913).
Министр
I КОПИЯ БЕРНА L
государственной информационной системе «Единый портал государственных и муниципальных услуг (функций)».
17. Место нахождения, график работы, номера телефонов и электронной почты размещаются непосредственно в помещениях Федерального медико-биологического агентства и территориальных органов ФМБА России на стендах, а также посредством публикации сведений на официальном Интернет-сайте ФМБА России www.fmbaros.ru, и в федеральной государственной информационной системе «Единый портал государственных и муниципальных услуг (функций)».
18. Текст административного регламента размещается на официальном Интернет-сайте Федерального медико-биологического агентства www.fmbaros.ru, а также в федеральной государственной информационной системе «Единый портал государственных и муниципальных услуг (функций)» в течение 5 рабочих дней со дня регистрации.
19. Обобщенный план проведения плановых проверок организаций здравоохранения Федерального медико-биологического агентства и территориальных органов ФМБА России на очередной год размещается путем публикации на официальном Интернет-сайте ФМБА России www.fmbaros.ru до 31 декабря года, предшествующего году проведения плановых проверок.
20. Плата за исполнение государственной функции не взимается.
21. Срок проведения каждой из проверок не может превышать двадцати рабочих дней.
22. В отношении одного субъекта малого предпринимательства общий срок проведения плановых выездных проверок не может превышать пятьдесят часов для малого предприятия и пятнадцать часов для микропредприятия в год.
23. В исключительных случаях, связанных с необходимостью проведения сложных и (или) длительных исследований, испытаний, специальных экспертиз и расследований на основании мотивированных предложений должностных лиц Федерального медико-биологического агентства или территориальных органов ФМБА России, проводящих выездную плановую проверку, срок проведения проверки может быть продлен руководителем Федерального медико-биологического агентства или руководителем территориального органа ФМБА России, но не более, чем на двадцать рабочих дней, а в отношении малых предприятий, микропредприятий - не более чем на пятнадцать часов.
24. Срок проведения проверки в отношении организации здравоохранения, которая осуществляет свою деятельность на территориях нескольких субъектов Российской Федерации, устанавливается отдельно по каждому филиалу, представительству, обособленному структурному
подразделению юридического лица. При этом общий срок проведения проверки не может превышать шестьдесят рабочих дней.
III. Административные процедуры
25. В рамках исполнения государственной функции устанавливаются следующие административные процедуры:
1) «Получение и анализ сведений о соблюдении организациями
здравоохранения, науки и образования, а также их структурными
подразделениями, осуществляющими заготовку, переработку, хранение, транспортировку, применение и обеспечение безопасности донорской крови и ее компонентов обязательных требований в сфере донорства крови и её компонентов»;
2) «Проведение проверок осуществления организациями
здравоохранения, науки и образования, а также их структурными
подразделениями, осуществляющими заготовку, переработку, хранение, транспортировку, применение и обеспечение безопасности донорской крови и ее компонентов деятельности в сфере донорства крови и ее компонентов».
26. Структура и взаимосвязи административных процедур, осуществляемых в рамках исполнения государственной функции, приведены на блок-схеме (приложение № 2 к административному регламенту).
27. Административная процедура «Получение и анализ сведений о соблюдении организациями здравоохранения, науки и образования, а также их структурными подразделениями, осуществляющими заготовку, переработку, хранение, транспортировку, применение и обеспечение безопасности донорской крови и ее компонентов обязательных требований в сфере донорства крови и её компонентов» осуществляется постоянно в соответствии с нижеследующим порядком (схема осуществления административной процедуры приведена в приложении № 3 к административному регламенту):
28. Федеральное медико-биологическое агентство и территориальные органы ФМБА России осуществляют сбор и анализ:
1) идентификационных данных об организациях здравоохранения, включая идентификационный номер налогоплательщика, основной государственный регистрационный номер, дата государственной регистрации юридического лица, наименование структурных подразделений, осуществляющих заготовку, переработку, хранение, транспортировку, применение и обеспечение безопасности донорской крови и ее компонентов, номер и дата выдачи лицензии на осуществление медицинской деятельности по забору, заготовке, хранению донорской
крови и ее компонентов, транспортировке донорской крови и ее компонентов, трансфузиологии;
2) рекламаций и жалоб на несоблюдение обязательных требований организациями здравоохранения;
3) сведений о посттрансфузионных осложнениях, возникших вследствие деятельности организаций здравоохранения.
29. Федеральное медико-биологическое агентство получает сведения, необходимые для планирования исполнения государственной функции территориальными органами ФМБА России:
1) от органов управления здравоохранением субъектов Российской Федерации о деятельности организаций здравоохранения на территории субъекта;
2) от федеральных органов исполнительной власти, имеющих подведомственные организации здравоохранения;
3) от организаций здравоохранения;
4) от Федеральной службы по надзору в сфере здравоохранения и социального развития;
5) от территориальных органов ФМБА России;
Свод и анализ сведений, необходимых для планирования исполнения государственной функции территориальными органами ФМБА России, производится Управлением организации службы крови Федерального медико-биологического агентства ежегодно до первого сентября каждого года. Результаты анализа, полученные до первого сентября каждого года, используются для формирования плана проведения проверок на следующий год.
30. Административная процедура «Проведение проверок осуществления организациями здравоохранения, науки и образования, а также их структурными подразделениями, осуществляющими заготовку, переработку, хранение, транспортировку, применение и обеспечение безопасности донорской крови и ее компонентов деятельности в сфере донорства крови и ее компонентов» осуществляется в ходе плановых и внеплановых, выездных и документарных проверок соблюдения обязательных требований организациями здравоохранения в соответствии с нижеследующим порядком (схема административной процедуры приведена в приложении № 4 к административному регламенту).
Обязательными требованиями являются:
1) требования, предъявляемые к зданиям и помещениям;
2) требования, предъявляемые к ведению учетно-отчетной документации по установленным формам;
3) требования, предъявляемые к уровню профессионального образования персонала, занятого в процессах заготовки, переработки, хранения, транспортировки, применения и обеспечения безопасности донорской крови и ее компонентов;
4) требования, предъявляемые к производственной среде;
5) требования, предъявляемые к оборудованию и используемым в работе изделиям медицинского назначения;
6) требования, предъявляемые к процессу организации донорства (привлечение доноров, меры социальной поддержки доноров, страхование доноров, управление донорами, отбор доноров);
7) требования, предъявляемые к заготовке донорской крови и её компонентов (взятие донорской крови и её компонентов, образцы для лабораторного обследования, переработка крови, получение компонентов донорской крови);
8) требования, предъявляемые к лабораторному обследованию доноров, донорской крови и объектов внешней среды;
9) требования, предъявляемые к биологической полноценности донорской крови и ее компонентов;
10) требования, предъявляемые к показателям качества крови и её компонентов требованиям, установленным законодательством Российской Федерации в сфере донорства крови и ее компонентов;
11) требования, предъявляемые к осуществлению хранения донорской крови и её компонентов;
12) требования, предъявляемые к маркировке и системе отбора забракованных компонентов донорской крови;
13) требования, предъявляемые к прослеживаемости;
14) требования, предъявляемые к осуществлению карантинизации плазмы;
15) требования, предъявляемые к выпуску и реализации готовой продукции;
16) требования, предъявляемые к поставщикам компонентов
донорской крови;
17) требования, предъявляемые к потребителям компонентов
донорской крови;
18) оценка состояния клинической трансфузиологии;
19) учет посттрансфузионных осложнений.
31. Предметом плановой проверки организации здравоохранения
является соблюдение организацией здравоохранения в процессе
осуществления деятельности по заготовке, переработке, хранению, транспортировке, применению и обеспечению безопасности донорской крови и ее компонентов обязательных требований.
В отношении одной организации здравоохранения плановая проверка может проводиться не чаще, чем один раз в три года.
32. Плановые проверки проводятся в соответствии:
1) с ежегодным планом проведения проверок, разрабатываемым Управлением организации службы крови Федерального медикобиологического агентства, утвержденным руководителем Федерального
медико-биологического агентства и согласованным с органами прокуратуры по месту осуществления деятельности организации здравоохранения в установленном порядке;
2) с ежегодными планами проведения проверок, разрабатываемыми в каждом территориальном органе ФМБА России, утвержденными руководителями территориальных органов ФМБА России, согласованными с Управлением организации службы крови Федерального медико-биологического агентства и органами прокуратуры по месту осуществления деятельности организации здравоохранения в установленном порядке.
33. При составлении ежегодного плана проведения плановых проверок Федеральным медико-биологическим агентством или территориальными органами ФМБА России указываются следующие сведения:
1) наименования организаций здравоохранения (их филиалов, представительств, обособленных структурных подразделений);
2) адреса фактического осуществления деятельности организаций здравоохранения (их филиалов, представительств, обособленных структурных подразделений);
3) основной государственный регистрационный номер (ОГРН);
4) идентификационный номер налогоплательщика (ИНН);
5) цель проведения плановой проверки;
6) основание проведения плановой проверки;
7) дата начала проведения плановой проверки;
8) срок проведения проверки;
9) форма проведения проверки (документарная, выездная, документарная и выездная);
10) наименование подразделения Федерального медикобиологического агентства (территориального органа ФМБА России), осуществляющего конкретную плановую проверку;
11) наименование органа государственного контроля (надзора), с которым проверка проводится совместно.
34. Основанием для включения организации здравоохранения в ежегодный план проведения плановых проверок является истечение трёх лет со дня:
1) государственной регистрации организации здравоохранения;
2) окончания проведения последней плановой проверки организации здравоохранения.
35. Плановая проверка проводится в форме документарной проверки и (или) выездной проверки в порядке, установленном административным регламентом.
36. О проведении плановой проверки организация здравоохранения уведомляется Федеральным медико-биологическим агентством или
территориальным органом ФМБА России не позднее, чем в течение трех рабочих дней до начала ее проведения посредством направления копии приказа (распоряжения) руководителя (заместителя руководителя) Федерального медико-биологического агентства или копии распоряжения руководителя территориального органа ФМБА России о начале проведения плановой проверки заказным почтовым отправлением с уведомлением о вручении или иным доступным способом.
37. Предметом внеплановой проверки организации здравоохранения является соблюдение организацией здравоохранения обязательных требований в процессе осуществления деятельности по заготовке, переработке, хранению, транспортировке, применению и обеспечению безопасности донорской крови и ее компонентов, выполнение предписаний Федерального медико-биологического агентства или территориального органа ФМБА России, проведение организацией здравоохранения мероприятий по предотвращению причинения вреда жизни, здоровью граждан, вреда животным, растениям, окружающей среде, по обеспечению безопасности государства, по предупреждению возникновения чрезвычайных ситуаций природного и техногенного характера, по ликвидации последствий причинения такого вреда.
38. Основанием для проведения внеплановой проверки является:
1) истечение срока исполнения организацией здравоохранения ранее выданного предписания об устранении выявленного нарушения обязательных требований;
2) поступление в Федеральное медико-биологическое агентство или территориальные органы ФМБА России обращений и заявлений граждан, юридических лиц, индивидуальных предпринимателей, информации от органов государственной власти, органов местного самоуправления, из средств массовой информации о следующих фактах:
возникновения угрозы причинения вреда жизни, здоровью граждан, вреда животным, растениям, окружающей среде, безопасности государства, а также угрозы чрезвычайных ситуаций природного и техногенного характера;
причинения вреда жизни, здоровью граждан, вреда животным, растениям, окружающей среде, безопасности государства, а также возникновения чрезвычайных ситуаций природного и техногенного характера;
нарушения прав потребителей (в случае обращения граждан, права которых нарушены);
3) приказ (распоряжение) руководителя (заместителя руководителя) Федерального медико-биологического агентства, изданного в соответствии с поручениями Президента Российской Федерации, Правительства Российской Федерации.
39. Обращения и заявления, не позволяющие установить лицо, обратившееся в Федеральное медико-биологическое агентство или территориальный орган ФМБА России, а также обращения и заявления, не содержащие сведений о фактах, указанных в подпункте 2 пункта 38 административного регламента, не могут служить основанием для проведения внеплановой проверки.
40. Внеплановая проверка проводится в форме документарной проверки и (или) выездной проверки в порядке, установленном административным регламентом.
41. Внеплановая выездная проверка организаций здравоохранения может быть проведена по основаниям, указанным в абзацах втором и третьем подпункта 2 пункта 38 административного регламента, Федеральным медико-биологическим агентством и территориальными органами ФМБА России после согласования с органом прокуратуры по месту осуществления деятельности организаций здравоохранения.
42. Если основанием для проведения внеплановой выездной проверки является причинение организацией здравоохранения вреда жизни, здоровью граждан, животным, растениям, окружающей среде, безопасности государства, а также возникновение чрезвычайных ситуаций природного и техногенного характера, в момент совершения таких нарушений в связи с необходимостью принятия неотложных мер Федеральное медико-биологическое агентство вправе приступить к проведению внеплановой выездной проверки незамедлительно с извещением органов прокуратуры о проведении мероприятий по контролю посредством направления в течение двадцати четырех часов в органы прокуратуры документов, необходимых для согласования внеплановой выездной проверки.
43. О проведении внеплановой выездной проверки, за исключением внеплановой выездной проверки, основания проведения которой указаны в абзаце втором и третьем подпункта 2 пункта 38 административного регламента, организация здравоохранения уведомляется Федеральным медико-биологическим агентством не менее, чем за двадцать четыре часа до начала ее проведения любым доступным способом.
В случае, если в результате деятельности организации здравоохранения причинен или причиняется вред жизни, здоровью граждан, вред животным, растениям, окружающей среде, безопасности государства, а также возникли или могут возникнуть чрезвычайные ситуации природного и техногенного характера, предварительное уведомление организации здравоохранения о начале проведения внеплановой выездной проверки не осуществляется.
44. Предметом документарной проверки являются сведения, содержащиеся в документах организации здравоохранения,
устанавливающих ее организационно-правовую форму, права и обязанности, а также используемых при осуществлении ею деятельности по заготовке, переработке, хранению, транспортировке, применению и обеспечению безопасности донорской крови и ее компонентов и связанных с исполнением ею обязательных требований, выполнением предписаний Федерального медико-биологического агентства и территориальных органов ФМБА России.
45. Организация документарной проверки (как плановой, так и внеплановой) осуществляется в порядке, установленном административным регламентом, и проводится по месту нахождения Федерального медико-биологического агентства или территориального органа ФМБА России.
46. В процессе проведения документарной проверки должностными лицами Федерального медико-биологического агентства или территориального органа ФМБА России в первую очередь рассматриваются:
1) документы организации здравоохранения, имеющиеся в распоряжении Федерального медико-биологического агентства или территориального органа ФМБА России;
2) акты предыдущих проверок;
3) материалы рассмотрения дел об административных правонарушениях и иные документы о результатах исполнения в отношении этих организаций здравоохранения государственной функции.
47. В случае, если достоверность сведений, содержащихся в документах, имеющихся в распоряжении Федерального медикобиологического агентства или территориального органа ФМБА России, вызывает обоснованные сомнения либо эти сведения не позволяют оценить соблюдение организацией здравоохранения обязательных требований, Федеральное медико-биологическое агентство или территориальный орган ФМБА России направляет в адрес организации здравоохранения мотивированный запрос с требованием представить иные необходимые для рассмотрения в ходе проведения документарной проверки документы. К запросу прилагается заверенная печатью копия приказа руководителя или копия распоряжения руководителя территориального органа ФМБА России о проведении документарной проверки.
48. В течение десяти рабочих дней со дня получения мотивированного запроса организация здравоохранения направляет в Федеральное медико-биологическое агентство или территориальный орган ФМБА России указанные в запросе документы.
Указанные в запросе документы представляются в виде копий, заверенных печатью (при ее наличии) и подписью руководителя, иного
должностного лица или уполномоченного представителя организации здравоохранения.
49. Не допускается требовать нотариального удостоверения копий документов, представляемых в Федеральное медико-биологическое агентство или территориальный орган ФМБА России, если иное не предусмотрено законодательством Российской Федерации.
50. В случае, если в ходе документарной проверки выявлены ошибки и (или) противоречия в представленных организацией здравоохранения документах либо несоответствие сведений, содержащихся в этих документах, сведениям, содержащимся в имеющихся у Федерального медико-биологического агентства или территориального органа ФМБА России документах и (или) полученным в ходе исполнения государственной функции, информация об этом направляется организации здравоохранения с требованием представить в течение десяти рабочих дней необходимые пояснения в письменной форме.
При проведении документарной проверки Федеральное медикобиологическое агентство и территориальные органы ФМБА России не вправе требовать у организации здравоохранения сведения и документы, не относящиеся к предмету документарной проверки.
51. Организация здравоохранения, представляющая в Федеральное медико-биологическое агентство или территориальный орган ФМБА России пояснения относительно выявленных ошибок и (или) противоречий в представленных документах либо относительно имеющихся в распоряжении Федерального медико-биологического агентства или территориального органа ФМБА России сведений, вправе представить дополнительно в Федеральное медико-биологическое агентство или территориальный орган ФМБА России документы, подтверждающие достоверность ранее представленных документов.
52. Должностное лицо, которое проводит документарную проверку, рассматривает представленные руководителем, иным должностным лицом или уполномоченным представителем организации здравоохранения пояснения и документы, подтверждающие достоверность ранее представленных документов.
53. Предметом выездной проверки являются содержащиеся в документах организации здравоохранения сведения, а также соответствие обязательным требованиям ее работников, состояния используемых указанными лицами при осуществлении деятельности по заготовке, переработке, хранению, транспортировке, применению и обеспечению безопасности донорской крови и ее компонентов территорий, зданий, строений, сооружений, помещений, оборудования, транспортных средств.
54. Выездная проверка (как плановая, так и внеплановая) проводится по месту нахождения организации здравоохранения и (или) по месту фактического осуществления ею деятельности по заготовке, переработке,
хранению, транспортировке, применению и обеспечению безопасности донорской крови и ее компонентов, в случае если при документарной проверке не представляется возможным оценить ее соответствие обязательным требованиям без проведения выездной проверки.
55. Выездная проверка начинается с предъявления служебного удостоверения должностными лицами Федерального медикобиологического агентства и территориальных органов ФМБА России, обязательного ознакомления руководителя, иного должностного лица или уполномоченного представителя организации здравоохранения с полномочиями проводящих выездную проверку лиц, а также с целями, задачами, основаниями проведения выездной проверки, видами и объемом мероприятий по контролю, составом экспертов, представителями экспертных организаций, привлекаемых к выездной проверке, со сроками и условиями ее проведения.
По просьбе руководителя, иного должностного лица или уполномоченного представителя проверяемой организации здравоохранения должностные лица Федерального медико-биологического агентства или территориальных органов ФМБА России знакомят сотрудников организации здравоохранения с положениями административного регламента и порядком проведения проверки на объектах, используемых организацией здравоохранения.
56. Выездная проверка проводится в соответствии с режимом работы проверяемой организации здравоохранения.
57. Заверенная печатью Федерального медико-биологического агентства копия приказа (распоряжения) руководителя (заместителя руководителя) Федерального медико-биологического агентства или распоряжения руководителя территориального органа ФМБА России вручается под роспись должностными лицами Федерального медикобиологического агентства или территориальных органов ФМБА России, проводящими проверку, руководителю, иному должностному лицу или уполномоченному представителю организации здравоохранения.
58. По требованию организации здравоохранения должностные лица Федерального медико-биологического агентства или территориальных органов ФМБА России представляют информацию о Федеральном медикобиологическом агентстве в целях подтверждения своих полномочий.
59. Руководитель, иное должностное лицо или уполномоченный представитель организации здравоохранения представляют должностным лицам Федерального медико-биологического агентства и территориальных органов ФМБА России, проводящим выездную проверку, возможность ознакомиться с документами, связанными с целями, задачами и предметом выездной проверки, в случае, если выездной проверке не предшествовало проведение документарной проверки, а также обеспечить доступ проводящих выездную проверку должностных лиц и участвующих в
Утвержден приказом Министерства здравоохранения и социального развития Российской Федерации
Административный регламент Федерального медико-биологического агентства по исполнению государственной функции по контролю и надзору в сфере донорства крови и её компонентов
I. Общие положения
1. Административный регламент Федерального медикобиологического агентства по исполнению государственной функции по контролю и надзору в сфере донорства крови и её компонентов (далее -административный регламент) устанавливает сроки и последовательность административных процедур при осуществлении государственного контроля и надзора за соблюдением законодательства Российской Федерации в сфере донорства крови и её компонентов.
2. Государственная функция по контролю и надзору в сфере донорства крови и её компонентов (далее - государственная функция) представляет собой деятельность Федерального медико-биологического агентства, направленную на предупреждение, выявление и пресечение нарушений организациями здравоохранения, науки и образования, а также их структурными подразделениями, осуществляющими заготовку, переработку, хранение, транспортировку, применение и обеспечение безопасности донорской крови и ее компонентов (далее - организации здравоохранения) требований, установленных нормативными правовыми актами Российской Федерации в сфере донорства крови и ее компонентов к заготовке, переработке, хранению, транспортировке, применению и обеспечению безопасности донорской крови и ее компонентов (далее -обязательные требования), посредством:
1) организации и проведения проверок организаций здравоохранения;
выездной проверке экспертов, представителей экспертных организаций на территорию, в используемые организацией здравоохранения при осуществлении деятельности здания, строения, сооружения, помещения, к используемым организацией здравоохранения оборудованию, подобным объектам, транспортным средствам и перевозимым ими грузам.
60. Федеральное медико-биологическое агентство и территориальные органы ФМБА России привлекают к проведению выездной проверки организации здравоохранения экспертов, экспертные организации, не состоящие в гражданско-правовых и трудовых отношениях с организацией здравоохранения, в отношении которой проводится проверка, и не являющиеся ее аффилированными лицами.
61. Проверка соблюдение организацией здравоохранения обязательных требований независимо от формы ее проведения проводится на основании приказа (распоряжения) руководителя (заместителя руководителя) Федерального медико-биологического агентства или распоряжения руководителя территориального органа ФМБА России.
62. Проверка может проводиться только должностным лицом или должностными лицами, которые указаны в приказе (распоряжении) руководителя (заместителя руководителя) Федерального медикобиологического агентства или распоряжении руководителя территориального органа ФМБА России.
63. В приказе (распоряжении) руководителя (заместителя руководителя) Федерального медико-биологического агентства или распоряжении руководителя территориального органа ФМБА России указываются:
1) номер и дата приказа (распоряжения) о проведении проверки;
2) фамилии, имена, отчества, должность должностного лица или должностных лиц, уполномоченных на проведение проверки, а также привлекаемых к проведению проверки экспертов, представителей экспертных организаций;
3) наименование организации здравоохранения, в отношении которой проводится проверка;
4) цели, задачи, предмет проверки и срок ее проведения;
5) правовые основания проведения проверки, в том числе подлежащие проверке обязательные требования;
6) сроки проведения и перечень мероприятий по контролю, необходимых для достижения целей и задач проверки;
7) перечень нормативных правовых актов для проведения мероприятий по контролю;
8) перечень документов, представление которых организацией здравоохранения необходимо для достижения целей и задач проведения проверки;
9) даты начала и окончания проведения проверки.
2) принятия предусмотренных законодательством Российской Федерации мер по пресечению и (или) устранению последствий выявленных нарушений обязательных требований;
3) систематического наблюдению за исполнением обязательных требований, анализом и прогнозированием состояния их исполнения организациями здравоохранения.
3. Федеральное медико-биологическое агентство планирует исполнение государственной функции территориальными органами -региональными и межрегиональными управлениями Федерального медико-биологического агентства (далее - территориальные органы ФМБА России) и непосредственно осуществляет деятельность, указанную в пункте 2 административного регламента.
Планирование исполнения государственной функции территориальными органами ФМБА России осуществляется в соответствии с распределением обязанностей территориальных органов ФМБА России и их территориальных отделов по осуществлению государственного контроля и надзора в сфере донорства крови и ее компонентов на территории субъектов Российской Федерации (приложение № 1 к административному регламенту) посредством
согласования Федеральным медико-биологическим агентством ежегодных планов проведения плановых проверок организаций здравоохранения, составляемых территориальными органами ФМБА России.
4. Исполнение государственной функции осуществляется в соответствии с:
1) Основами законодательства Российской Федерации об охране здоровья граждан от 22 июля 1993 г. № 5487-1 (Ведомости Съезда народных депутатов и Верховного Совета Российской Федерации, 1993, №33, ст. 1318; Собрание законодательства Российской Федерации, 1998, № 10, ст. 1143; 1999, № 51, ст. 6289; 2000, № 49, ст. 4740; 2003, № 2, ст. 167; № 9, ст. 805; № 27, ст. 2700; 2004, № 27, ст. 2711; № 35, ст. 3607; № 49, ст. 4850; 2005, № 10, ст. 763; № 52, ст. 5583; 2006, № 1, ст. 10; № 6, ст. 640; 2007, № 1, ст. 21; № 31, ст. 4011; № 43, ст. 5084; 2008, № 30, ст. 3616; № 45, ст. 5149; № 52, ст. 6236; 2009, № 1, ст. 17; № 30, ст. 3739; № 48, ст. 5717; № 52, 6441; 2010, № 31, ст. 4161; № 40, ст. 4969; № 30, ст. 4590);
2) Законом Российской Федерации «О донорстве крови и её компонентов» от 9 июня 1993 г. № 5142-1 (Ведомости Съезда народных депутатов и Верховного Совета Российской Федерации, 1993, № 28, ст. 1064; Собрание законодательства Российской Федерации, 2000, № 19, ст. 2024; 2001, № 17, ст. 1638; 2004, № 35, ст. 3607; 2007, № 1, ст. 21; № 43, ст. 5084; 2008, № 29, ст. 3410; № 30, ст. 3616; 2009, № 30, ст. 3739);
3) Федеральным законом от 26 декабря 2008 г. № 294-ФЗ «О защите прав юридических лиц и индивидуальных предпринимателей при
осуществлении государственного контроля (надзора) и муниципального контроля» (Собрание законодательства Российской Федерации, 2008, № 52, ст. 6249; 2009, № 18, ст. 2140; № 29, ст. 3601; № 48, ст. 5711, № 52, ст. 6441; 2010, № 17, ст. 1988, № 18, ст.2142, № 31, ст. 4160, ст. 4193, ст. 4196; № 32, ст. 4298; 2011, № 1, ст. 20, № 17, ст. 2310; № 27, ст. 3880, № 30, ст. 4590);
4) Федеральным законом от 2 мая 2006 г. № 59-ФЗ «О порядке рассмотрения обращений граждан Российской Федерации» (Собрание законодательства Российской Федерации, 2006, № 19, ст. 2060; 2010, № 27, ст. 3410, № 31, ст. 4196);
5) Федеральным законом от 9 февраля 2009 г. № 8-ФЗ «Об обеспечении доступа к информации о деятельности государственных органов и органов местного самоуправления» (Собрание законодательства Российской Федерации, 2009, № 7, ст. 776; 2011, № 29, ст. 4291);
6) постановлением Правительства Российской Федерации от 26 января 2010 г. № 29 «Об утверждении технического регламента о требованиях безопасности крови, ее продуктов, кровезамещающих растворов и технических средств, используемых в трансфузионно-инфузионной терапии» (Собрание законодательства Российской Федерации, 2010, № 5, ст. 536, № 42, ст. 5380);
7) постановлением Правительства Российской Федерации от 30 июня 2010 г. № 489 «Об утверждении Правил подготовки органами государственного контроля (надзора) и органами муниципального контроля ежегодных планов проведения плановых проверок юридических лиц и индивидуальных предпринимателей» (Собрание законодательства Российской Федерации, 2010, № 28, ст. 3706);
8) постановлением Правительства Российской Федерации от 24 ноября 2009 г. № 953 «Об обеспечении доступа к информации о деятельности Правительства Российской Федерации и федеральных органов исполнительной власти» (Собрание законодательства Российской Федерации, 2009, № 48, ст. 5832);
9) приказом Министерства экономического развития Российской Федерации от 30 апреля 2009 г. № 141 «О реализации положений Федерального закона «О защите прав юридических лиц и индивидуальных предпринимателей при осуществлении государственного контроля (надзора) и муниципального контроля» (зарегистрирован Министерством юстиции Российской Федерации 13 мая 2009 г. № 13915) с изменениями, внесенными приказом Министерства экономического развития Российской Федерации от 24 мая 2010 г. № 199 (зарегистрирован Министерством юстиции Российской Федерации 6 июля 2010 г. № 17702);
10) приказом Министерства здравоохранения Российской Федерации от 14 сентября 2001 г. №364 «Об утверждении Порядка медицинского обследования донора крови и ее компонентов» (зарегистрирован
Министерством юстиции Российской Федерации 31 октября 2001 г. № 3009) с изменениями, внесенными приказами Министерства здравоохранения и социального развития Российской Федерации от 16 апреля 2008 г. № 175н (зарегистрирован Министерством юстиции Российской Федерации 13 мая 2008 г. № 11679), от 6 июня 2008 г. № 261 н (зарегистрирован Министерством юстиции Российской Федерации 25 июня 2008 г. № 11876);
11) приказом Министерства здравоохранения и социального
развития Российской Федерации от 31 марта 2005 г. № 246 «Об утверждении форм представления гражданина Российской Федерации к награждению нагрудным знаком «Почетный донор России» и перечня документов, подтверждающих сдачу крови или плазмы крови» (зарегистрирован Министерством юстиции Российской Федерации 3 мая 2005 г. № 6566), с изменениями, внесенными приказами
Минздравсоцразвития России от 28 июня 2005 г. № 433 (зарегистрирован Министерством юстиции Российской Федерации 15 июля 2005 г. № 6805), от 8 ноября 2007 г. № 688 (зарегистрирован Министерством юстиции Российской Федерации 3 декабря 2007г. № 10602);
12) приказом Министерства здравоохранения Российской Федерации от 25 ноября 2002 г. № 363 «Об утверждении Инструкции по применению компонентов крови» (зарегистрирован Министерством юстиции Российской Федерации 20 декабря 2002 г. № 4062);
13) приказом Министерства здравоохранения Российской Федерации от 16 февраля 2004 г. № 82 «О совершенствовании работы по профилактике посттрансфузионных осложнений» (в соответствии с письмом Министерства юстиции Российской Федерации от 18 марта 2004 г. № 07/2965-ЮД данный документ в государственной регистрации не нуждается);
14) приказом Федерального медико-биологического агентства от 21 апреля 2009 г. № 280 «Об утверждении Регламента Федерального медико-биологического агентства» (зарегистрирован Министерством юстиции Российской Федерации от 6 июля 2009 г. № 14213), с изменениями, внесенными приказом ФМБА России от 7 сентября 2009 г. №617 (зарегистрирован Министерством юстиции Российской Федерации от 21 октября 2009 г. № 15075).
5. Предметом государственного контроля (надзора) в сфере донорства крови и ее компонентов является соблюдение организациями здравоохранения обязательных требований.
6. Должностные лица ФМБА России и территориальных органов ФМБА России при осуществлении государственного контроля (надзора) в сфере донорства крови имеют право:
1) включать проверки организаций здравоохранения в ежегодный план проведения проверок при наличии оснований, установленных административным регламентом;
2) требовать представления документов, информации, образцов продукции, проб обследования объектов окружающей среды и объектов производственной среды, если они являются объектами проверки или относятся к предмету проверки;
3) отбирать образцы продукции, пробы обследования объектов окружающей среды и объектов производственной среды для проведения их исследований, испытаний, измерений;
4) выдавать предписание руководителю, иному должностному лицу, уполномоченному представителю организации здравоохранения об устранении выявленных нарушений;
5) принимать меры в отношении фактов нарушений, выявленных при проведении проверки в порядке, установленном Кодексом Российской Федерации об административных правонарушениях.
7. Должностные лица ФМБА России и территориальных органов ФМБА России при осуществлении государственного контроля (надзора) в сфере донорства крови обязаны:
1) своевременно и в полной мере исполнять предоставленные в соответствии с законодательством Российской Федерации полномочия по предупреждению, выявлению и пресечению нарушений обязательных требований;
2) соблюдать законодательство Российской Федерации, права и законные интересы организации здравоохранения, в отношении которой проводится проверка;
3) проводить проверку на основании приказа (распоряжения) руководителя (заместителя руководителя) Федерального медикобиологического агентства или распоряжения руководителя территориального органа ФМБА России о проведении соответствующей проверки в соответствии с ее назначением;
4) проводить проверку только во время исполнения служебных обязанностей, выездную проверку только при предъявлении служебных удостоверений, копии приказа (распоряжения) руководителя (заместителя руководителя) Федерального медико-биологического агентства или копии распоряжения руководителя территориального органа ФМБА России;
5) не препятствовать руководителю, иному должностному лицу или уполномоченному представителю организации здравоохранения присутствовать при проведении проверки и давать разъяснения по вопросам, относящимся к предмету проверки;
6) предоставлять руководителю, иному должностному лицу или уполномоченному представителю организации здравоохранения.
присутствующим при проведении проверки, информацию и документы, относящиеся к предмету проверки;
7) знакомить руководителя, иное должностное лицо или уполномоченного представителя организации здравоохранения, с результатами проверки;
8) учитывать при определении мер, принимаемых по фактам выявленных нарушений, соответствие указанных мер тяжести нарушений, их потенциальной опасности для жизни, здоровья людей, окружающей среды, безопасности государства, а также не допускать необоснованное ограничение прав и законных интересов граждан, юридических лиц;
9) доказывать обоснованность своих действий при их обжаловании юридическими лицами в порядке, установленном законодательством Российской Федерации;
10) соблюдать сроки проведения проверки, установленные законодательством Российской Федерации;
11) не требовать от организации здравоохранения документы и иные сведения, представление которых не предусмотрено законодательством Российской Федерации;
12) перед началом проведения выездной проверки по просьбе руководителя, иного должностного лица или уполномоченного представителя организации здравоохранения ознакомить их с положениями административного регламента;
13) осуществлять запись о проведенной проверке в журнале учета проверок.
8. Руководитель, иное должностное лицо или уполномоченный представитель организации здравоохранения, в отношении которой осуществляются мероприятия по контролю и надзору, имеют право:
1) непосредственно присутствовать при проведении проверки, давать объяснения по вопросам, относящимся к предмету проверки;
2) получать от Федерального медико-биологического агентства и территориальных органов ФМБА России, их должностных лиц информацию, которая относится к предмету проверки и предоставление которой предусмотрено административным регламентом;
3) знакомиться с результатами проверки и указывать в акте проверки о своем ознакомлении с результатами проверки, согласии или несогласии с ними, а также с отдельными действиями должностных лиц Федерального медико-биологического агентства и территориальных органов ФМБА России;
4) обжаловать действия (бездействие) должностных лиц Федерального медико-биологического агентства и территориальных органов ФМБА России, повлекшие за собой нарушение прав организации здравоохранения при проведении проверки, в административном и (или) судебном порядке в соответствии с законодательством Российской Федерации.
9. Руководитель, иное должностное лицо или уполномоченный представитель организации здравоохранения, в отношении которой осуществляются мероприятия по контролю и надзору, обязаны:
1) представлять документы, необходимые для рассмотрения в ходе проведения документарной проверки и указанные в мотивированном запросе Федерального медико-биологического агентства и территориальных органов ФМБА России, поступившем в организацию здравоохранения в порядке, установленном административным регламентом;
2) предоставлять должностным лицам Федерального медикобиологического агентства и территориальных органов ФМБА России при проведении ими выездной проверки возможность ознакомления с документами, связанными с целями, задачами и предметом выездной проверки, в случае если ей не предшествовало проведение документарной проверки;
3) обеспечить доступ проводящих выездную проверку должностных лиц Федерального медико-биологического агентства, территориальных органов ФМБА России, участвующих в выездной проверке экспертов, представителей экспертных организаций на территорию, в используемые организацией здравоохранения при осуществлении деятельности по заготовке, переработке, хранению, транспортировке, применению и обеспечению безопасности донорской крови и ее компонентов здания, строения, сооружения, помещения, к используемым организацией здравоохранения оборудованию, подобным объектам, транспортным средствам и перевозимым ими грузам.
10. Результатом исполнения государственной функции является обеспечение выполнения организациями здравоохранения, обязательных требований, установленных законодательством Российской Федерации.
11. Юридическими фактами, которыми заканчивается исполнение государственной функции, являются:
1) вручение (направление) акта проверки соблюдения обязательных требований руководителю, иному должностному лицу или уполномоченному представителю организации здравоохранения;
2) выдача предписания об устранении нарушений обязательных требований, установленных в ходе проверки, руководителю, иному должностному лицу или уполномоченному представителю организации здравоохранен ия;
3) направление в установленном порядке информации:
а) в органы, осуществляющие лицензирование медицинской деятельности, органы государственной власти и местного самоуправления, в ведении которых находятся проверяемые организации здравоохранения -о нарушениях обязательных требований;
б) в органы государственного контроля в соответствии с их
компетенцией - о нарушениях установленных законодательством требований, не относящихся к предмету государственного контроля (надзора) в сфере донорства крови и ее компонентов;
в) в органы прокуратуры - о нарушениях обязательных требований, содержащих признаки преступлений в соответствии с законодательством Российской Федерации.
II. Требования к порядку исполнения государственной функции
12. Информирование об исполнении государственной функции осуществляется по месту нахождения Федерального медикобиологического агентства (123182, г. Москва, Волоколамское шоссе, д. 30, стр. 1) и его территориальных органов ФМБА России.
Информация о месте нахождения территориальных органов ФМБА России представлена в приложении 1 к административному регламенту.
13. График (режим) работы Федерального медико-биологического агентства территориальных органов ФМБА России:
День недели Режим работы
Понедельник 9.00-18.00
Вторник 9.00-18.00
Среда 9.00-18.00
Четверг 9.00 - 18.00
Пятница 9.00-16.45
Суббота, воскресенье Выходной день
14. Информация о месте нахождения и графике работы Федерального медико-биологического агентства и территориальных органов ФМБА России предоставляется:
1) непосредственно в помещениях Федерального медикобиологического агентства и территориальных органов ФМБА России;
2) с использованием средств телефонной связи, электронного информирования и электронно-вычислительной техники;
3) посредством публикации сведений на официальном Интернет-сайте Федерального медико-биологического агентства www.fmbaros.ru.
4) по телефону для справок: 8(499) 190-33-25.
5) по номеру факса: 8(499) 190-07-25.
6) по адресу электронной почты: fmba@fmbaros.ru
15. Информация о ходе исполнения государственной функции предоставляется при личном или письменном обращении заинтересованных лиц, включая обращение по электронной почте, факсу, по номерам телефонов для справок.
16. Общие сведения об исполнении государственной функции размещаются на официальном Интернет-сайте Федерального медикобиологического агентства www.fmbaros.ru, а также в федеральной