Выделение и идентификация бактерий желудочно-кишечного тракта животных
Купить бумажный документ с голограммой и синими печатями. подробнее
Цена на этот документ пока неизвестна. Нажмите кнопку "Купить" и сделайте заказ, и мы пришлем вам цену.
Распространяем нормативную документацию с 1999 года. Пробиваем чеки, платим налоги, принимаем к оплате все законные формы платежей без дополнительных процентов. Наши клиенты защищены Законом. ООО "ЦНТИ Нормоконтроль"
Наши цены ниже, чем в других местах, потому что мы работаем напрямую с поставщиками документов.
Способы доставки
- Срочная курьерская доставка (1-3 дня)
- Курьерская доставка (7 дней)
- Самовывоз из московского офиса
- Почта РФ
Методические рекомендации разработаны для научно-исследовательских и учебных ветеринарных учреждений, ветеринарных лабораторий и других организаций и предназначены для выделения, количественного учета, идентификации и изучения биологических свойств условно-патогенных, патогенных и полезных бактерий желудочно-кишечного тракта животных, а также определения потенциальной этиологической значимости выделенных микроорганизмов при желудочно-кишечных болезнях животных. В методических рекомендациях изложены количественные и качественные методы исследований микрофлоры кишечника животных, позволяющие рационализировать и упростить бактериологический анализ с целью прижизненной постановки диагноза на желудочно-кишечные болезни и дисбактериоз, экономить материальные средства и сократить затраты труда, что позволит проводить обследование большого поголовья животных в короткие сроки и охарактеризовать этиологическую структуру острых кишечных болезней в хозяйстве, а также дать оценку степени защищенности животных полезной микрофлорой и определять лечебно-профилактическую эффективность различных препаратов.
Оглавление
Введение
1 Бактериологические исследования
1.1 Микрофлора кишечника здоровых животных
1.2 Необходимые материалы, реактивы и питательные среды
1.3 Забор материала и подготовка к работе
1.4 Схема бактериологических исследований
1.5 Посев материала и выделение чистой культуры
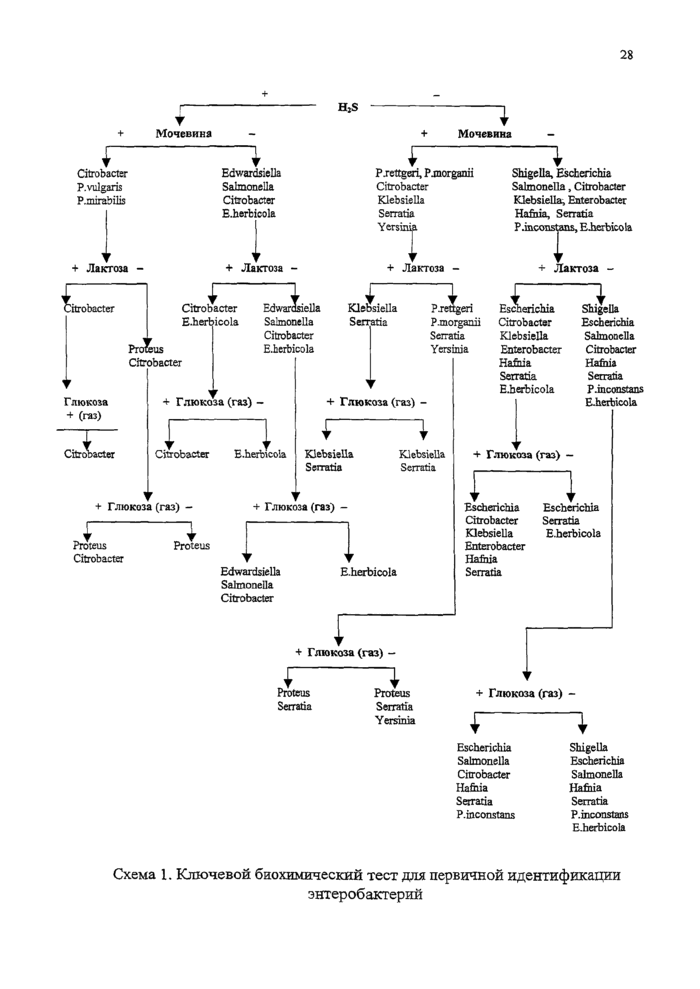
2 Идентификация выделенных культур
2.1 Выделение чистой культуры и ее первичная идентификация
2.2 Первичная идентификация микроорганизмов
2.3 Дифференциация родов и видов
2.4 Характеристика микроорганизмов, вызывающих желудочно-кишечные болезни молодняка животных
2.5 Определение чувствительности к специфическим бактериофагам
2.6 Серологическая идентификация
2.7 Индикация лактобактерий и бифидобактерий
2.8 Оценка результатов исследований
3 Определение чувствительности к антибактериальным препаратам
3.1 Устойчивость микроорганизмов к антибиотикам
3.2 Техника определения чувствительности микроорганизмов к антибиотикам
Приложение 1. Консерванты
Приложение 2. Среды обогащения и накопления
Приложение 3. Среды для первичной идентификации
Приложение 4. Селективные среды
Приложение 5. Дифференциально-диагностические среды
Приложение 6. Среда Блаурокка (модифицированная, печеночная)
Приложение 7. Инструкция по применению пластины биохимической дифференцирующей энтеробактерии (ПБДЭ)
Приложение 8. Инструкция по применению систем индикаторных бумажных для идентификации микроорганизмов семейства Enterobacteriaceae (СИБ)
Список использованной литературы
| Дата введения | 01.01.2021 |
|---|---|
| Добавлен в базу | 01.01.2021 |
| Актуализация | 01.01.2021 |
Этот документ находится в:
- Раздел Экология
- Раздел 11 ЗДРАВООХРАНЕНИЕ
- Раздел 11.220 Ветеринария
- Раздел 11 ЗДРАВООХРАНЕНИЕ
Организации:
| 11.05.2004 | Утвержден | Минсельхоз России | 13-5-02/1043 |
|---|---|---|---|
| Разработан | МГАВМиБ |
- ГОСТ 6709-72 Вода дистиллированная. Технические условия
- ГОСТ 13805-76 Пептон сухой ферментативный для бактериологических целей. Технические условия
- ГОСТ 171-81 Дрожжи хлебопекарные прессованные. Технические условия
- ГОСТ 24363-80 Реактивы. Калия гидроокись. Технические условия
- ГОСТ 2493-75 Реактивы. Калий фосфорнокислый двузамещенный 3-водный. Технические условия
- ГОСТ 25336-82 Посуда и оборудование лабораторные стеклянные. Типы, основные параметры и размеры
- ГОСТ 4147-74 Реактивы. Железо (III) хлорид 6-водный. Технические условия
- ГОСТ 4328-77 Реактивы. Натрия гидроокись. Технические условия
- ГОСТ 435-77 Реактивы. Марганец (II) сернокислый 5-водный. Технические условия
- ГОСТ 4523-77 Реактивы. Магний сернокислый 7-водный. Технические условия
- ГОСТ 61-75 Реактивы. Кислота уксусная. Технические условия
- ГОСТ 13277-79 Молоко коровье пастеризованное. Технические условия
- ГОСТ 20292-74 Приборы мерные лабораторные стеклянные. Бюретки, пипетки. Технические условия
- Показать все
Чтобы бесплатно скачать этот документ в формате PDF, поддержите наш сайт и нажмите кнопку:

стр. 1

стр. 2

стр. 3

стр. 4

стр. 5

стр. 6

стр. 7

стр. 8
стр. 9

стр. 10

стр. 11
стр. 12
стр. 13

стр. 14

стр. 15

стр. 16

стр. 17

стр. 18

стр. 19

стр. 20

стр. 21

стр. 22

стр. 23

стр. 24
стр. 25

стр. 26

стр. 27

стр. 28

стр. 29
стр. 30
«УТВЕРЖДАЮ»
Руководитель Департамента ветеринарии Минсельхоза России
_Е.А. Непоклонов
« // » 2004 г
v*' /З-5 -oz
МИНИСТЕРСТВО СЕЛЬСКОГО ХОЗЯЙСТВА РОССИЙСКОЙ ФЕДЕРАЦИИ (Минсельхоз России) ДЕПАРТАМЕНТ ВЕТЕРИНАРИИ 107139, Москва, Орликов пер., 1/11 Для телеграмм: Москва, 84 Минроссельхоз Факс: (095) 975 58 50, тел: (095) 207 80 00 E-mail:chief@devetmcx.ru http ;//www.mcx.ni
flop. ps/i № 4$ - 5 02 ,
на №_
Методические рекомендации
«Выделение и идентификация бактерий
желудочно-кишечного тракта животных»
ОБЩИЕ ПОЛОЖЕНИЯ
Методические рекомендации «Выделение и идентификация бактерий желу-дочно-хишечного тракта животных» разработаны для научно-исследовательских и учебных ветеринарных учреждений, ветеринарных лабораторий и других организаций и предназначены для выделения, количественного учета, идентификации и изучения биологических свойств условно-патогенных, патогенных и полезных бактерий желудочно-кишечного тракта животных, а также определения потенциальной этиологической значимости зыделенных микроорганизмов при желудочно-кишечных болезнях животных.
В методических рекомендациях изложены количественные и качественные методы исследований микрофлоры кишечника животных, позволяющие рационализировать и упростить бактериологический анализ с целью прижизненной постановки диагноза на желудочно-кишечные болезни и дисбактериоз, экономить материальные средства и сократить затраты труда, что позволит проводить обследование большого поголовья животных в короткие сроки и охарактеризовать этиологическую структуру острых кишечных болезней в хозяйстве, а также дать оценку степени защищенности животных полезной микрофлорой и определять лечебно-профилактическую эффективность различных препаратов.
Введение......................................................................2
1. Бактериологические исследования...................................3
1.1. Микрофлора кишечника здоровых животных...................3
1.2. Необходимые материалы, реактивы и питательные среды.. .5
1.3. Забор материала и подготовка к работе...........................6
1.4. Схема бактериологических исследований........................6
1.5. Посев материала и выделение чистой культуры.................8
2. Идентификация выделенных культур...............................11
2.1. Выделение чистой культуры и ее первичная
идентификация...................................................................11
2.2. Первичная идентификации микроорганизмов...................25
2.3. Дифференциация родов и видов.....................................29
2.4. Характеристика микроорганизмов, вызывающих
желудочно-кишечные болезни молодняка животных.....................34
2.5. Определение чувствительности к специфическим
бактериофагам.....................................................................50
2.6. Серологическая идентификация....................................52
2.7. Индикация лактобактерий и бифидобактерий...................53
2.8. Оценка результатов исследований.................................53
3. Определение чувствительности к антибактериальным
препаратам.........................................................................54
3.1. Устойчивость микроорганизмов к антибиотикам...............54
3.2. Техника определения чувствительности
микроорганизмов к антибиотикам............................................56
Приложения..................................................................57
Список использованной литературы....................................81
низмов (проводят посев суспензий чистых культур микроорганизмов и посев из разведений 10'5; 10*6, пипеткой в объеме 0,05 мл с последующим растиранием шпателем).
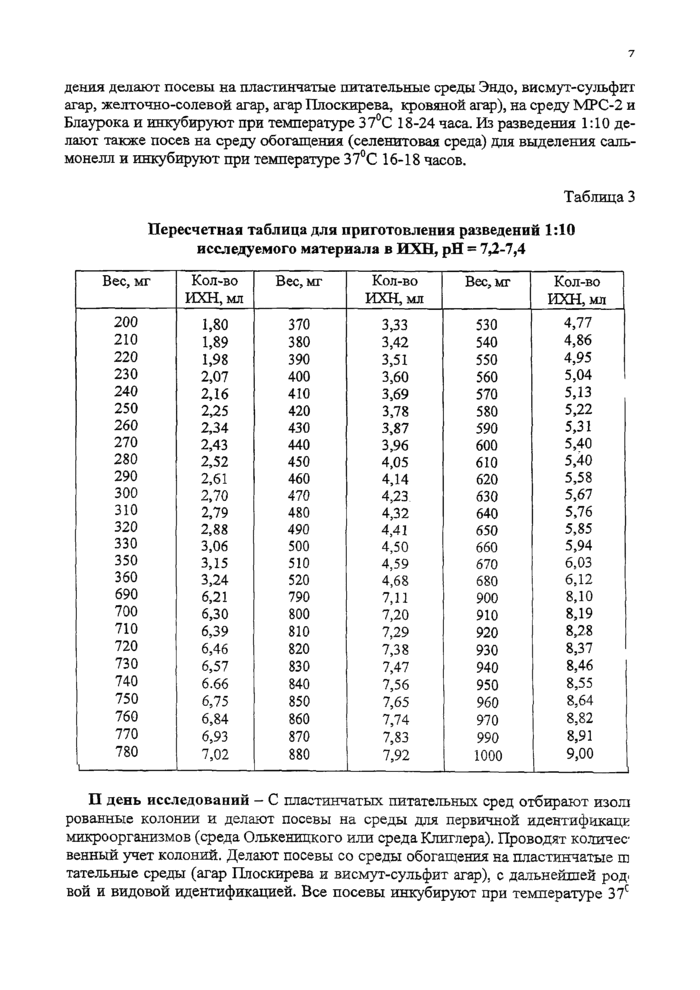
Для выделения сальмонелл используют жидкие среды обогащения: хлор-магниевую, Мюллера, селенитовый бульон. Посев проводят пипеткой в объеме 1 мл из исходного (10'1) разведения в 5 мл среды обогащения с последующим высевом петлей через 16—18 ч на дифференциально - диагностические среды.
Для выявления лакто- и бифидобактерий используют жидкие среды:
— Блаурокка - для обнаружения бифидобактерий (посев делают го разведения 10*8 в объеме 1 мл);
— МРС-2 - для выявления лактобактерий (посев проводят из разведения 10*8 в объеме 0,05 мл). Следует обратить внимание на необходимость создания анаэробных условий культивирования бактерий на среде Блаурокка и МРС-2, так как бифидо- и лактобактерии являются факультативными анаэробами. При посеве пипетку с микробной взвесью опускают на дно пробирки и осторожно выливают содержимое, стараясь не допускать появления пузырьков воздуха в пробирке.
Все посевы инкубируют в термостате при 37 ±1 °С:
— среды Плоскирева, Эндо, селенитовый бульон, магниевую среду -18-24
ч;
— 5%-ный кровяной агар - 48 ч;
— среды МРС-2 и Блаурокка - 3-4 суток;
— висмут-сульфит агар - 48 ч.
При пересеве клеток микроорганизмов с одной среды на другую все манипуляции всегда проводят вблизи пламени горелки (но не в пламени!), по возможности быстро, чтобы не загрязнять культуру посторонними микроорганизмами. При взятии материала, пробирки (колбы) необходимо удерживать в наклонном положении, чтобы гарантировать стерильность культуры. Если держать их вертикально, то возможно попадание в культуру посторонней микрофлоры.
Если микроорганизмы высевают на плотную скошенную питательную среду, то бактериологической петлёй или иглой с культурой, по поверхности среды -проводят прямую или волнообразную черту (лёгким движением, не разрезая среды). Такой способ называется «посев штрихом». Зигзагообразный штрих проводят в тех случаях, когда необходимо получить больше посевного материала (для смывов и т.д.). Если культуру высевают в столбик питательной среды, то иглу или петлю вводят в центральную часть, в толщу среды до дна пробирки. Такой способ называется «посев уколом».
Культуру помещают в термостат, проводят наблюдения за её развитием и описывают характер роста микроорганизмов.
Если посев делают в жидкую среду (или из жидкой среды), лучше пользоваться пипеткой или петлёй. Пробирки держат слегка наклонив, чтобы не замочить их края и пробки. Перед тем как закрыть пробирки, пробки и края пробирок обжигают в пламени.
Подсчет микроорганизмов, пересев на среду Оль-кеницкого или Юиглера
Родовая и видовая идентификация по биохимическим признакам. Серологическая идентификация.
Рис. 1. Схема сокращенного метода исследований микрофлоры кишечника животных
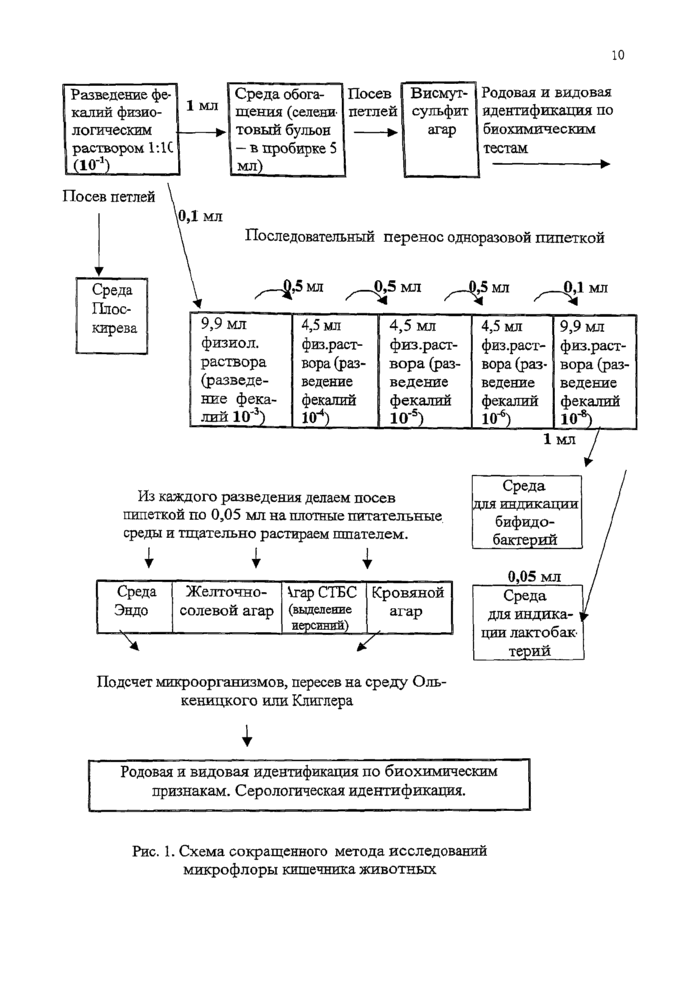
2. ИДЕНТИФИКАЦИЯ ВЫДЕЛЕННЫХ КУЛЬТУР
2.1. Выделение чистой культуры и ее первичная идентификация
При посеве материала на плотные питательные среды необходимо получить рост изолированных колоний, в противном случае идентификация бактерий невозможна. Чашки с посевом просматривают невооруженным глазом.
|
Форма колоний |
|
а б в г д |
|
Профиль колоний |
|
а б в г Край колоний |
0 0 0 Cg
а б в г
|
Структура колоний |
|
а б в г д Рис. 2. Характеристика колоний: |
Форма колоний: а - округлая, б - неправильной формы, в - амебовидная, г - ризоидная, д - мицслиальная;
Профиль колоний: а - плоский, б - выпуклый, в - кратерообразный, г - конусовидный;
Край колоний: а - ровный, б - волнистый, в - лопастной, г - бахромчатый;
Структура колоний: а - однородная, б - мелкозернистая, в - крупнозернистая, г - струйчатая, д - волокнистая.
В числе характеристик колоний учитывают их размер (диаметр в мм), форму, возвышение над поверхностью (плоская, выпуклая), особенности края (ровный — S-форма, волнистый — R-форма) и поверхности (блестящая, матовая), цвет, плотность (прозрачная, мутная) и консистенцию (вязкая, пленчатая и др.)-
Для определения качественного состава бактерий, колонии на чашке группируют по культуральным признакам (характер колонии), которые являются наиболее существенной особенностью роста микроорганизмов на плотной питательной среде.
Различают: 1) поверхностные; 2) глубинные; 3) донные колонии, з зависимости от того, где они развивались - на поверхности плотной питательной среды, в толще ее или на дне сосуда. Обычно изучают и описывают только колонии, выросшие на поверхности среды, так как именно эти колонии отличаются большим разнообразием. Глубинные колонии, напротив, довольно однообразны. Чаще всего они имеют вид более или менее сплющенных чечевичек, принимающих в проекции форму овалов с заостренными концами. Лишь у немногих микроорганизмов глубинные колонии напоминают пучки ваты с нитевидными выростами в питательную среду. Образование глубинных колоний часто сопровождается разрывом агаризованной среды вследствие выделения углекислоты или других газов развивающимися микроорганизмами. Донные колонии самых разнообразных микроорганизмов растут в виде тонких прозрачных пленок, стелющихся по дну.
При описании колонии необходимо указывать возраст культуры, состав среды и температуру культивирования.
Решающее значение при оценке энтеробактерий на пластинчатых средах имеет дифференциация по окраске изолированных колоний, зависящая от отношений бактерий к дифференцирующим компонентам питательной среды, например, лактозе (табл 4).
Характеристика колоний энтеробактерий различных родов
|
Таблица 4 | ||||||
|
|
13 | |
|
1 |
2 |
|
Escherichia |
Более крупные, чем колонки сальмонелл; многообразны по окраске, плотности и форме; могут быть плоские, выпуклые или со слегка волнистым слоем; влажные, сухие, иногда слизистые; прозрачные или полупрозрачные; напоминают колонии клебсиелл. На МПБ - растут диффузно, образуя интенсивную равномерную муть и легко разбивающийся осадок; иногда образуют поверхностную пленку и кольцо на стенке пробирки. На МПА - гладкие, выпуклые, блестящие, с ровными краями колонии, хорошо суспендируемые в растворе хлорида натрия (S-форма) и более плоские, сухие, с неровными краями, плохо суспендируемые в растворе хлорида натрия колонии (R-форма). На среде Эндо - у лактозоположительных штаммов - темно-красные, с металлическим блеском или без него, розовые или с бесцветным ободком и интенсивно красным или розовым центром; у лактозоотрицательных штаммов - под цвет среды или с розоватым оттенком. На среде Плоскирева - рост значительно подавляется, колонии с желтоватым оттенком. На среде Левина - темно-синие, с металлическим блеском или розовые. На висмут-сульбит агаре — бледно-зеленые, прозрачные, бле-стящие, иногда бурые, без металлического блеска, легко снимаются со среды. Под колониями среда не прокрашивается. |
|
Enterobacter |
Хорошо растут на обычных питательных средах. По размеру, форме и окраске сходны с колониями эшерихий и клебсиелл. На среде Эндо - от малинового до розового цвета или бежевого оттенка. На среде Плоскирева - колонии с желтоватым оттенком. В косо проходящем свете имеют зеленовато-желтоватый оттенок. На висмут-сульбит агаре - блелно-зеленые. бурые, прозрачные, блестящие, легко снимаются со среды. Под колониями среда не прокрашивается. |
|
Erwinia |
Хорошо растут при 25-27°С, при 37иС могут не расти или давать скудный, замедленный рост. Образуют желтый пигмент. На среде Эндо - розоватые, без металлического блеска. На среде Плоскирева - выпуклые, желтоватого оттенка. На висмуг-сульбит агаре - зеленоватые или коричневого цвета, без металлического блеска. |
|
1 |
2 |
|
Edwardsiella |
Растут на обычных питательных средах, но более медленно, чем другие виды энтеробактерий, образуя мелкие (до 1 мм в диаметре), полупрозрачные колонии. На среде Эндо — бесцветные или розоватые, полупоозрачные. сходные с колониями сальмонелл. На bhgmvt-сульфит агаре - темные, без металлического блеска и почернения среды иод ними. На среде Плоскирева - бесцветные, полупрозрачные, с гладкой блестящей поверхностью. Не имеют специфического запаха. |
|
Citrobacter |
Гладкие, слегка выпуклые, влажные, сероватые колонии с блестящей поверхностью. Могут встречаться слизистые и шероховатые формы. На среде Эндо - у лактозоположительных штаммов - интенсив-но-розовые или красные с темным центром, но не дающие характерного для эшерихий металлического блеска; у лактозоотрицательных штаммов - слегка опалесцируют, в тон среды или с розоватым оттенком. На среде Плоскирева - лактозоположительные штаммы имеют интенсивную розово-красную окраску с темным центром. Лактозоотрицательные штаммы образуют слегка опалесцирующие, выпуклые колонии, окрашенные в тон среды. На висмут-сулыЬит агаое - через 48 ч инкубации колонии свет-ло-зеленые, коричневые или черные. Черные колонии, образуемые штаммами, продуцирующими сероводород, в отличие от черных колоний, образуемых сальмонеллами, не окрашивают в черный цвет среду под колонией. Рост колоний сопровождается резким неприятным запахом. |
|
Klebsiella |
Крупные (в диаметре 3 мм), выпуклые, влажные, слизистые, нередко сливаются друг с другом. На МПБ - равномерное помутнение, образование осадка и по-верхи остная пленка. На МПА - крупные, выпуклые, слизистые колонии. На соепе Эндо - лактозоположительные штаммы сходны с ко-лониями эшерихий, с металлическим блеском или без него. Могут быть красные, розовые, белые, прозрачные, бесцветные с белым ободком, с темным или розовым центром. На среде Плоскирева - красные, розовые, бесцветные, бежевые или желтые (в зависимости от степени ферментации лактозы). |
|
15 | |
|
1 |
2 |
|
Proteus |
На МПБ - вызывают равномерное помутнение и осалок. На среде Эндо - P.vulearis и Pjnirabilis проявляют способность к роению и дают сливной рост. Другие виды образуют колонии, сходные с колониями сальмонелл. На среде Плоскиоева - 2-7 мм в диаметре, прозрачные и полу-прозрачные, выпуклые, с желтовато-розовым оттенком (перламутровые). Вокруг колоний желтоватый ореол. На висмут-сулыЬит агаре - через 48 часов культивирования ко-лонни влажные, грязно-коричневого цвета, без металлического блеска. После их снятия на среде остается темно-коричневая редукционная зона. Рост колоний сопровождается резким гнилостным запахом. |
|
Serratia |
Бесцветные, по размеру и форме сходны с колониями сальмонелл. Хорошо растут при 15-30°С. На кровяном агаре пои 37°С образуют серовато-белые прозрач-ные колонии, гладкие или мелкозернистые, 1-2 мм в диаметре. При комнатной температуре через 24-48 ч колонии становятся красными, т.к. бактерии образуют розово-красный или малиновый водонерастворимый пигмент продигиозин. На скошенном МПА образуют гладкий белый налет. На среде Эндо - прозрачные, бледно-розовые, без металляческо-го блеска. На среде Плоскиоева - бесцветные. На висмут-сульфит агаре - коричневые, черные. Пол колониями среда не прокрашивается. Культура издает ароматный запах, напоминающий залах карамели. |
|
Morganella |
Хорошо растут на обычных питательных средах. На кровяном агаре некоторые штаммы дают гемолиз. На среде, содержащей 5 % триптофана, штаммы моргайелл продуцируют красно-коричневый пигмент. Сходны по культуральным свойствам с Proteus. На среде Эндо - сливной рост. На среде Плоскирева - прозрачные и полупрозрачные, вьпгук-лые, с желтовато-розовым оттенком. На висмут-сульАит агаре ~ влажные, коричневого цвета, без ме-таллического блеска. |
|
1 |
2 |
|
Hafhia |
Полупрозрачные, бесцветные, розоватые, сероватые или имеют оттенок среды. На МПА - гладкие, влажные, полупрозрачные. мутноватые, се-роватые колонии диаметром 2-4 мм. На соеле Энло - полупрозрачные. бесцветные или бледно-розовые, без металлического блеска. На среде Плоскирева - дают скудный рост, сероватые или жел-товатые или розоватые. |
|
Yersinia |
Хорошо растут на простых питательных средах при температуре 28-29° С и pH - 7,2-7,4. Культивируются в температурном диапазоне 14-42° С и pH 4-10. Колонии мелкие (до 1 мм в диаметре). При 37° С может отмечаться полиморфизм колоний, проявляющийся появлением R-форм с выпуклым, коричневого цвета центром и волнистыми истонченными краями. На МПБ - могут вызывать равномерное помутнение (Y.enterocolitica), равномерное помутнение с последующим выпадением хлопьевидного или вязкого осадка (Y. pseudotuberculusis) или в виде взвешенных хлопьев в прозрачном бульоне с образованием рыхлого осадка (Y. pestis). На МПА - образуют мелкие (диаметром 0.1-0.5 мм\ выпуклые, прозрачные, с голубоватым оттенком блестящие колонии. Y. pseudotuberculusis на скошенном агаре растут в виде сплошного налета серовато-желтоватого цвета с блестящей волнистой поверхностью. На среде Эндо и Левина - в течение первых суток роста при 22° С колонии мелкие (росинки), обычно выпуклые, блестящие, бесцветные или с розовым оттенком, с ровным краем. В течение вторых суток роста становятся крупными. При этом, колонии Y.enterocolitica (на среде Левина) фиолетовые с металлическим блеском, могут приобретать розовый оттенок, а Y.pseudotuberculosus - остаются неокрашенными. На среде Плоскиоева - не растут. Пси обильном посеве образу-ют очень мелкие колонии, часто не видимые невооруженным глазом. На солевом агаре - в первые сутки (при 220О колонии Y.enterocolitica небольшие, блестящие, прозрачные, голубоватые, мягкие. Y.pseudotuberculosus - полупрозрачные. На среде СТБС - иерсинии синего цвета, другие энтеробактерии - желтоватого цвета. |
|
1 |
2 |
|
Providencia |
Хорошо растут на обычных питательных средах. По размеру и форме сходны с колониями Proteus, но отсутствует способность к «роению». На среде Энло - розовые, без металлического блеска. На соеде Плоскирева - выпуклые, желтовато-розовые На висмут-сульфит агаре - коричневого цвета, без металличе-ского блеска. |
|
Shigella |
На плотных средах образуют небольшие гладкие S-колонии правильной формы и крупные шероховатые R- колонии с неровными краями, напоминающими виноградный лист. Колонии могут быть слегка выпуклыми, бесцветные, блестящие, полупрозрачные, мягкой консистенции, легко снимающиеся петлей с поверхности ага-ра. На МПБ - S-боомы лают равномерное помутнение. R-формы образуют придонный осадок и среда остается прозрачной. На среде Энло и Плоскирева - S-Формы колоний круглые, куп о-лообразные, гладкие, полупрозрачные или голубовато-розового цвета в проходящем свете. R-формы колоний неправильной формы, плоские, тусклые, с шероховатой поверхностью и неровными краями, с розоватым или желтоватым оттенком. |
Необходимо учитывать, что после культивирования бактерий при 37°С и учета выросших колоний, чашки Петри необходимо выдержать еще сутки при комнатной температуре (для подращивания и выделения Erwinia, Serratia и Yersinia).
Дальнейшую работу проводят с колониями, имеющими ровный край. С чашек, на которые проводили мерно посев (с определенного разведения), подсчитывают выросшие колонии, определяя биологическую концентрацию микроо^ ганизмов в 1 г фекалий (табл 5).
При наличии на чашках Петри нескольких типов колоний для дальнейшей работы отбирают не менее трех из них каждого типа.
С чашек со средой Плоскирева, прежде всего, отбирают колонии, сходные по культуральным свойствам с сальмонеллами (бесцветные, полупрозрачные, плоские); с клебсиеллами и энтеробактерами (розовые, с желтым центром, выпуклые, бежевые или желтые); с протеями (прозрачные или полупрозрачные, слегка выпуклые, с желтовато-розовым перламутровым оттенком); с цитро-бактерами и гафниями (выпуклые, полупрозрачные, окрашенные в тон среды, а также розовые или красные).
Р. vulgaris и Р. mirabilis проявляют способность к «роению», в результате высокой степени подвижности этих микроорганизмов. Для получения изолированных колоний рекомендуют использовать среду Эндо с желчью (способ при-
готовления см. в приложении 4).
Со среды Эндо отбирают, в первую очередь, лактозонегативные (бледно-розовые или розовые) колонии, подозрительные на сальмонеллы, лактозонегативные эшерихии, клебсиеллы, энтеробактеры, цитробактеры, и засевают на среду Клиглера или Олькеницкого. Для выявления ЕРЕС (энтеропатогенные эшерихии) колонии малинового цвета с металлическим блеском или без него или малиновые с розовым ободком отсевают одновременно на среду Клиглера или Олькеницкого и косой агар для дальнейшей серологической диагностики.
На 5 %-ном кровяном агаре по наличию зоны просветления (гемолиза) вокруг колонии выявляют гемолитические формы энтеробактерий. Результаты учитывают через 24 ч, окончательно - через 48 ч.
На висмут-сульфитном агаре отбирают колонии, подозрительные на сальмонеллы (черные, с характерным металлическим блеском и почернением среды вокруг колонии). Исключение составляют Salmonella choleraesuis, V. Kunzen-dorf, S. typhisuis.
Для количественной характеристики условно-патогенных энтеробактерий (табл. 5) подсчитывают колонии каждого типа на пластинчатых дифференциально-селективных средах (Эндо, 5 %-ный кровяной агар, среда Плоскирева Ю"4).
|
Таблица 5 Пример определения концентрации микроорганизмов (метод БК) | ||||||||||||||||||||||||||||||||||||||||
|
На последующих этапах количество выросших колоний умножают на соответствующее разведение (из которого проводили высев на чашку) и на 20, если высевали 0,05 мл, или на 10, если высевали 0,1 мл.
Например, высев из разведения 10-6 привел к развитию на чашке со средой Эндо трех колоний, однородных по характеристикам и отнесенных к роду Citrobacter. Для определения содержания их в 1 г фекатий 3 умножают на 10би
1. Блохина И.Н., Воронин Е.С., Брусникина Н.Ф. и др. Методические рекомендации по выделению и идентификации условно-патогенных энтеробактерий и сальмонелл при острых кишечных заболеваниях молодняка сельскохозяйственных животных.- М.: MBA, 1990.
2. Воронин Е.С., Грязвева Т.Н., Тихонов И.В., Девришов Д.А., Джамбулатов З.М., Ахмедов М.М. Выделение и идентификация условно-патогенных микроорганизмов и сальмонелл при острых кишечных заболеваниях молодняка животных (переработанное и дополненное) /Учебно-методическое пособие.- М.: МГАВМиБ им. К.И. Скрябина, 2003.
3. Голубева В.А., Килессо В.А., Киселева Б.С. и др. Энтеробактерии /Руководство для врачей // Под редакцией В.И. Покровского.- М.: Медшдана.-1985,- 321 с.
5. Грязнева Т.Н., Соболь М.А., Троицкая И.В. Применение систем индикаторных бумажных (СИБ № 6) в лабораторной практике птицеводства /Межвуз. сборник научных трудов «Ветеринарная и биологическая наука - ветеринарному производству».- Н.Новгород, 1997 г.
6. Интизаров М.М. Микрофлора тела животных /Лекция для слушателей ФПК, преподавателей и научных сотрудников,- М.: MBA, 1989.
7. Петровская ВТ., Марко О.П. Микрофлора человека в норме и патологии.-М.: Медицина, 1976.
8. Сидоров М.А., Скородумов ДЛ, Федотов В.Б. Определитель зоопатоген-ных микроорганизмов /Справочник.- М.: Колос.- 1995.
9. Ставцева Л.Я., Грязнева Т.Н. Антагонистическая активность бифидо- и лактобактерий в отношении патогенных и условно-патогенных энтеробактерий //Ветеринария,- N° 6.-1991.
10. Ставцева ЛЯ., Грязнева Т.Н. Роль условно-патогенных энтеробактерий в возникновении диареи у новорожднЕЫХ телят - гипотрофиков /Межвуз. сб. науч. трудов «Новое в диагностике, лечении и профилактике болезней молодняка с/х животных».- Москва, 1991 г.
11. Трещанина Н.А. Техника микробиологических исследований /Лабораторный практикум по микробиологии.- Часть I,- Самара, 1997.
12. Трещанина Н.А. Выделение чистой культуры бактерий /Лабораторный практикум по микробиологии.- Часть П,- Самара, 1997.
13. Трещанина Н.А. Изучение свойств выделенного штамма /Лабораторный практикум по микробиологии.- Часть Ш.- Самара, 1997.
на 20 (3-10б*20=6-107). Таким образом, устанавливают, что в 1 г материала содержалось 6 ТО7 бактерий рода Citrobacter.
Для выявления некоторых морфологических особенностей, количественного учета микроорганизмов, проверки чистоты культуры и ряда других целей готовят фиксированные окрашенные препараты, которые могут храниться длительное время.
Приготовление фиксированных окрашенных препаратов включает следующие этапы: приготовление мазка, высушивание, фиксацию, окраску и определение размера клеток бактерий.
Приготовление мазка. На обезжиренное предметное стекло наносят маленькую каплю водопроводной воды и переносят в нее петлей небольшое количество исследуемого материала. Получившуюся суспензию равномерно размазывают петлей или краем покровного стекла на площади 1-2 см* как можно более тонким слоем. Мазок должен быть настолько тонок, чтобы высыхал почти тотчас же после приготовления.
Высушивание мазка. Лучше всего сушить препарат при комнатной температуре на воздухе. Хорошо приготовленный тонкий мазок высыхает очень быст} (не более 1 мин). Если высушивание мазка замедленно, то препарат можно слегка нагреть в струе теплого воздуха высоко над пламенем горелки, держа стекло мазком вверх.
Эту операцию следует проводить крайне осторожно, не перегревая мазок, иначе клетки микроорганизмов деформируются.
Фиксация. Фиксация препарата преследует несколько целей: убить микроорганизмы, т.е. сделать безопасным дальнейшее обращение с ними, обеспечить лучшее прилипание клеток к стеклу и сделать мазок более восприимчивым к окраске (мертвые клетки окрашиваются лучше, чем живые).
Самым распространенным способом фиксации является термическая обработка. Для этого препарат трижды проводят через наиболее горячую часть пламени горелки, держа предметное стекло мазком вверх. Не следует перегревать мазок, так как при этом могут произойти грубые изменения клеточных структур, а иногда и внешнего вида клеток, например их сморщивание.
Для исследования тонкого строения клетки прибегают к фиксации различными химическими веществами. Чаще всего пользуются этиловым спиртом (время фиксации 15-20 мин), метиловым спиртом (время фиксации 3-5 мин), смесью равных объемов этилового спирта и эфира (препарат погружают на 15-20 мин в смесь или заливают мазок и дают смеси испариться). По окончании фиксации препарат отмывают от фиксатора водопроводной водой и окрашивают.
Окраска. Для окрашивания клеток микроорганизмов чаще всего пользуются анилиновыми красителями, среди которых различают кислые и основные.
К кислым красителям относятся те, у которых ион, придающий окраску (хромофор), является анионом, у основных красителей хромофором является катион. Примером кислых красителей служат эозин, эритрозин, нигрозин, кислый фуксин - все эти красители интенсивно связываются с цитоплазматическими (основными) компонентами клетками.
г
ВВЕДЕНИЕ
В последние годы с несомненностью установлена полиэтиологичносп острых кишечных заболеваний человека и животных с существенным удельные весом возбудителей, относящихся к условно-патогенным бактериям. Между тем причины желудочно-кишечных болезней животных часто остаются нерасшифрованными, что затрудняет анализ, учет заболеваемости и проведение лечебно-профилактических мероприятий. В результате, невозможно целенаправленнс конструировать специфические биологические препараты и объективно оценивать их эффективность.
Выделение, количественный учет и точная идентификация условно-патогенных, патогенных и полезных бактерий желудочно-кишечного тракта животных вызывают определенные затруднения. Существующие на сегодняшний день методики определения микробного состава содержимого кишечника предусматривают, как правило, проведение качественного анализа с использованием, для биохимической идентификации бактерий, наборз жидких дифференциальнодиагностических сред. Это не позволяет полноценно характеризовать микробный биоценоз и не всегда обеспечивает стандартность получаемых результатов. Описанный ранее метод количественного анализа микрофлоры кишечника (Р. В. Эпштейн-Литвак, Ф. К. Вилыпаяская, 1969, модифицированный К. Я. Соколовой, 1972) дает исчерпывающий ответ. Однако трудоемкость этого метода ограничивает его практическое применение, особенно в условиях крупных животноводческих хозяйств. Метод можно использовать при углубленных исследованиях или при динамическом наблюдении за приживляемостью в кишечнике лакто- и бифидобактерий, при лечебно-профилактическом применении соответствующих препаратов.
Представленные в данных методических рекомендациях методы исследований фекалий животных, а также выделения и идентификации бактерий, позволяют рационализировать и упростить бактериологический анализ, с целью прижизненной постановки диагноза на желудочно-кишечные болезни и дисбактериоз.
Нами предложен сокращенный метод количественной оценки состава микрофлоры желудочно-кишечного тракта животных для проведения широкого обследования поголовья и характеристики этиологической структуры острых кишечных болезней в хозяйстве, а также для оценки степени защищенности животных полезной микрофлорой по количеству лакто- и бифидобактерий. За счет обоснованного выбора критериев оценки микробного состава, число разведений материала для количественного бактериологического анализа сокращено вдвое, что уменьшает затраты труда, количество лабораторной посуды и питательных сред.
На этапе идентификации выделяемых бактерий мы рекомендуем использовать коммерческие тест-системы ПБДЭ (пластины биохимические дифференцирующие энтеробактерии) или СИБ (системы индикаторные бумажные). Использование стабильных тест-систем обеспечивает унификацию исследований, экономию материальных средств и сокращение затрат времени. Гест-системь
удобны для транспортировки, хранения, особенно незаменимы при работе в экспедиционных условиях.
Для определения потенциальной этиологической значимости при желудочно-кишечных болезнях выделенных бактерий, наряду с установлением юс видовой принадлежности, количественной характеристикой и серотшшрованием, мы рекомендуем использовать выявление одного из существенных признаков патогенности некоторых микроорганизмов — адгезивной активности.
1. БАКТЕРИОЛОГТ1ЧЕСКИЕ ИССЛЕДОВАНИЯ Ы.Микрофлора кишечника здоровых животных
С организмом животного ассоциированы, как правило, десятки и сотни видов различных микроорганизмов. Многие микроорганизмы обнаруживаются в разных областях тела, изменяясь лишь количественно, в зависимости от вида млекопитающих. Однако большинству животных свойственны общие усредненные показатели микрофлоры.
В таблице 1 представлены группы микроорганизмов, выявляемые в содержимом кишечника нижних отделов желудочно-кишечного тракта животных.
Микрофлора нижних отделов желудочно-кишечного тракта животных
|
Таблица 1 | ||||||||||||||||||||||||||||||
|
В настоящее время установлено, что на долю анаэробных и факультативнс анаэробных видов микроорганизмов в кишечнике приходится 95-99 %. а вс* аэробные бактерии составляют 1-5 %.
При анализе количественного и качественного состава микрофлоры фекалий животных разных видов необходимо учитывать, что вся микрофлора желудочно-кишечного тракта условно подразделяется на нормальную (полезную), условно-патогенную и патогенную (табл. 2).
|
Таблица 2 Количество микроорганизмов в 1 г фекалии здоровых телят | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Нормальные бактерии, представленные, в основном, непатогенной Е. coli Lactobacillus, Bifidobacillus и споровыми анаэробами, у здоровых животны> должны содержаться в концентрациях 106- 107и вышем.кл. в 1 г фекалий. Пр* размножении, данные бактерии вырабатывают биологически активные вещестза защищающие организм животных от других микроорганизмов и их токсинов, г также занимают экологическую нишу патогенных бактерий. При уменьшение концентрации полезных бактерий в желудочно-кишечном содержимом животных развивается дисбактериоз, на фоне которого может возникнуть то или иное
заболевание.
Условно-патогенные бактерии, такие как Е. coli со слабо выраженными ферментативными свойствами, Enterococcus, Proteus, Klebsiella и др., могут постоянно находиться в желудочно-кишечном тракте животных и не вызывать нарушений пищеварения. Однако на фоне дисбактериоза, дефицита полезной микрофлоры, низкой резистентности организма и других причин, условно-патогенные бактерии приобретают вирулентные свойства и вызывают желуочно-кишечные болезни, проявляющиеся диареей, интоксикацией, обезвоживанием организма и ДР-
Как следует из таблицы 2, допустимая концентрация условно-патогенных бактерий в 1 г фекалий телят не должна превышать 102 -103 м. кл, а патогенные микроорганизмы не должны обнаруживаться в кишечнике животных.
Патогенные бактерии, как правило, обладают вирулентными свойствами и при попадании в организм животных могут вызвать заболевание. При выделении из фекалий животных таких бактерий как Е. coli энтеропато генная (вызывающая гемолиз эритроцитов, обладающая адгезивными свойствами и др.), Salmonella, Yersinia и др. эти микроорганизмы можно рассматривать как этиологи с кий фактор возникновения и развития болезни у животного.
У разных видов животных и птиц соотношение полезной, условно-патогенной и патогенной микрофлоры в желудочно-кишечном тракте может быть различным. Даже у одного и того же вида животных в норме микробный пейзаж может отличаться, в зависимости от содержания и кормления, качества кормов, индивидуальных особенностей организма и др.
1.2. Необходимые материалы, реактивы, питательные среды
При проведении бактериологических исследований фекалий животных для прижизненной постановке диагноза при желудочно-кишечных болезнях необходимы:
- бактериологические пробирки или пенициллиновые флаконы, стерильные с резиновой пробкой и лопаточками дли забора материала. Вес пробирки (флакона) указан на этикетке из лейкопластыря;
- чашки Петри, ГОСТ — 25336— 82;
- пипетки градуированные, ГОСТ — 20292— 74 на 1 мл, 10 мл;
- бактериологическая петля из проволоки никелевого сплава, диаметром 0,5—0,5 м;
- груша резиновая малая;
- предметные стекла;
- пробирки агтлютинационные, ГОСТ — 25336 — 82;
- спирт этиловый для горения спиртовок, обжига шпателя;
- раствор хлорида натрия изотонический, pH = 7,2 — 7,4 (ИХН);
- агары: Эндо, Плоскирева, 5%-ный кровяной, висмут-сульфит агар, солевой агар; СТБС (специальная среда для выделения иерсиний);
- среда обогащения (селенитовый бульон или хлормагниевая среда, или сред? Мюллера);
- среда Блаурокка жидкая;
- среда МРС-2 полужидкая;
- мясопептонный 2 %-ный агар в пробирках по 5 мл;
- стерильное вазелиновое масло;
- растворы консервантов (см. приложение № 1);
- комбинированные среды типа Олькеницкого, Ресселя, Клиглера;
- наборы стабильных тест-систем для идентификации микроорганизмов по биохимическим свойствам (ПБДЭ или СИБ );
- наборы диагностических сывороток для серологической диагностики эше-рихий, сальмонелл и других энтеробактерий.
Рецептура питательных сред, консервантов, характеристика ПБДЭ и СИБ дана в приложении.
13. Забор материала и подготовка к работе
При заборе материала необходимо исключить возможность загрязнения его микроорганизмами из окружающей среды. Для бактериологического исследования целесообразно брать пробы до начала фаго- и антибиотикотерапии.
Исследуемый материал (фекалий около 1 г) забирают в стерильные, предварительно взвешенные бактериологические пробирки или пенициллиновые флаконы. В сопроводительном документе необходимо указать вид и номер животного, его возраст, клиническое состояние, когда и какие виды бактериофагов, антибиотиков или других антибактериальных препаратов применяли, дату и время взятия пробы, первичность или повторность анализа. Исследуемый материал суспендируют в изотоническом растворе хлорида натрия (ИХН) pH - 7Д-7,4 в отношении 1:10 (из расчета 1 г материала и 9 мл ИХН) и высевают на питательные среды не позднее двух часов с момента взятия пробы.
При использовании консервантов материал пригоден для исследования в течение 12-24 ч. В качестве консервантов используют глицеринозую смесь (рН-7,8), буферный глицериново-солевой раствор, фосфатно-буферный раствор (pH-8,0), ИХН (pH - 7,2-7,4) (см. приложение № 1).
Вес взятого для анализа материала определяют по разнице весов флакона с материалом (или флакона с материалом и консервантом) и веса пустого флакона (или флакона с консерзантом).
Для приготовления материала в разведении 1:10 требуемое количество ГОСН определяют по пересчетной таблице № з. при использовании консерванта от установленного по таблице № 3 объема ИХН следует вычесть объем консерванта. Хранят материал при температуре 4 ±1 °С.
1.4. Схема бактериологического исследования
I день исследований - Исследуемый материал (содержимое кишечника, фекалии) разводят физиологическим раствором 1:10, согласно пересчетной таблице № 3.
Готовят разведения исследуемого материала от 10'1 до 1 О*8. Из каждого разве-
дения делают посевы на пластинчатые питательные среды Эндо, висмут-сульфит агар, желточно-солевой агар, агар Плоскирева, кровяной агар), на среду МРС-2 и Блаурока и инкубируют при температуре 37°С 18-24 часа. Из разведения 1:10 делают также посев на среду обогащения (селенитовая среда) для выделения сальмонелл и инкубируют при температуре 37°С 16-18 часов.
Пересчетная таблица для приготовления разведений 1:10 исследуемого материала в ИХН, pH = 7,2-7,4
|
Таблица 3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
П день исследований - С пластинчатых питательных сред отбирают изош рованные колонии и делают посевы на среды для первичной идентификаци микроорганизмов (среда Олькеницкого или среда Клиглера). Проводят количес венный учет колоний. Делают посевы со среды обогащения на пластинчатые щ тате льны е среды (агар Плоскирева и висмут-сульфит агар), с дальнейшей род-вой и видовой идентификацией. Все посевы инкубируют при температуре 37е
18-20 часов.
Ш день исследований - Проводят учет результатов первичной идентификации бактерий. Делают посевы на среды минимального дифференцирующего ряда для определения рода. Проводят серологическую идентификацию с агглютинирующими и адгезивными сыворотками к сальмонеллам и энтеропатогенным E.coli (ЕРЕС). Используют диагностические бактериофаги.
IV день исследований - Делают заключение о родовой и видовой принадлежности микроорганизмов. Проводят постановку дополнительных тестов для идентификации некоторых видов энтеробактерий. Готовят мазки со сред Блауро-ка и МРС-2 и просматривают их под микроскопом. Проводят серологическую идентификацию выделенных микроорганизмов в реакции агглютинации на стекле с использованием диагностических сывороток.
V день исследований - Окончательное определение видов, биоваров, количественная характеристика выделенных микроорганизмов.
1.5. Посев материала и выделение чистой культуры
При посеве материала для выделения чистой культуры используют пластинчатые селективно-дифференциальные среды, дтя выделения сальмонелл - среды обогащения.
Для количественной характеристики аэробной микрофлоры проводят дозированный посев на пластинчатые среды из четырех диагности-чески значимых разведений исходного материала (КГ4, 10'5, КГ*, 10‘8). Разведения готовят в пяти бактериологических пробирках. В две пробирки наливают по 9,9 мл изотонического раствора хлорида натрия (для разведений 10‘3, 10‘8), в три пробирки -4,5 мл (для разведений 10"4, 1 О*3) и последовательно переносят взвесь из предыдущего разведения в последующее в объемах, указанных на рис. 1.
Всю работу проводят с соблюдением стерильности, со сменой пипеток при переходе от предыдущего разведения к последующему. Каждую взвесь хорошо перемешивают.
Перед работой пластинчатые среды подсушивают в сушильном шкафу при температуре 60±1 °С в течение 20 мин, при 40=1 °С в течение 45 мин. На поверхности агара не должно оставаться конденсационной влаги.
Целесообразно использовать следующий набор сред, обеспечивающих выделение патогенных и условно-патогенных энтеробактерий:
—селективная среда Плоскирева, для выделения сальмонелл (посев проводят петлей из разведения 10'1 и 10*4);
—дифференциально-диагностическая среда Эндо, для выделения клебси-елл, протеев, энтеробактеров, гафний (посев проводят пипеткой в объеме 0,05 мл из разведения 10‘8);
— дифференциально-диагностическую среду Эндо для выделения энтеробактерий (посев проводят пипеткой, мерно, из разведений 10'5 и 10*6 в объеме 0,05 мл с последующим растиранием шпателем);
— 5 %-ный кровяной агар для выделения гемолитических форм микроорга-