Методические рекомендации по Порядку и условиям применения метода трансплантации эмбрионов крупного рогатого скота
Купить бумажный документ с голограммой и синими печатями. подробнее
Цена на этот документ пока неизвестна. Нажмите кнопку "Купить" и сделайте заказ, и мы пришлем вам цену.
Распространяем нормативную документацию с 1999 года. Пробиваем чеки, платим налоги, принимаем к оплате все законные формы платежей без дополнительных процентов. Наши клиенты защищены Законом. ООО "ЦНТИ Нормоконтроль"
Наши цены ниже, чем в других местах, потому что мы работаем напрямую с поставщиками документов.
Способы доставки
- Срочная курьерская доставка (1-3 дня)
- Курьерская доставка (7 дней)
- Самовывоз из московского офиса
- Почта РФ
Методические рекомендации определяют терминологию, перечень ключевых операций и подходов для эффективного получения, хранения, пересадки и подсадки эмбрионов крупного рогатого скота.
Оглавление
Введение
1 Общие положения
2 Отбор доноров и семени быков
3 Технологии производства и трансплантации эмбрионов крупного рогатого скота
4 Получение эмбрионов крупного рогатого скота методом in vivo
4.1. Отбор животных в доноры эмбрионов
4.2. Методы стимуляции доноров для получения эмбрионов
4.3. Использование готовых сред, их приготовление
4.4. Извлечение эмбрионов
5 Получение эмбрионов крупного рогатого скота методом in vitro
5.1 Отбор животных в доноры яйцеклеток (ооцитов)
5.2 Проведение трансвагинальной аспирации ооцитов (ТАО)
5.3 Транспортировка ОКК
5.4 Транспортировка яичников
5.5 Выделение ооцитов из яичников
5.6 Отбор ооцитов
5.7 Дозревание отобранных ооцитов
5.8 Оплодотворение дозревших in vitro ооцитов и культивирование эмбрионов
5.9 Требования к работе с биологическим материалом и инструментами
6 Требования к эмбрионам
7 Криоконсервация эмбрионов
8 Перенос эмбрионов в организм самки-реципиента
9 Криохранение эмбрионов
9.1 Техника безопасности при работе с сосудами Дьюара и стационарными биохранилищами
10 Учет и отчетность
Приложение 1. Карточка донора (корова/телка)
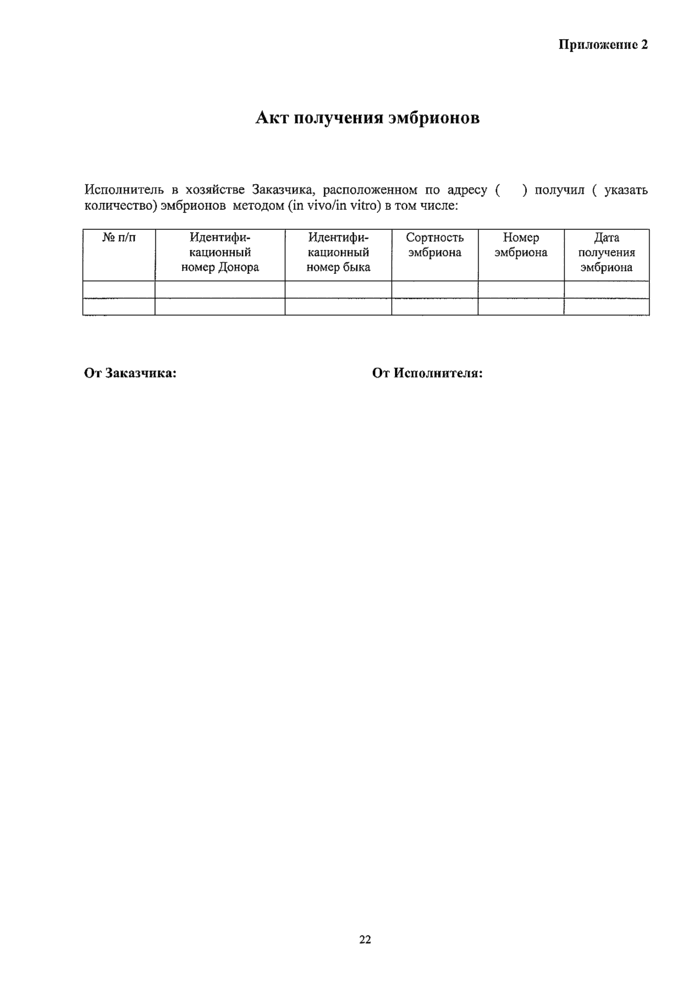
Приложение 2. Акт получения эмбрионов
Приложение 3. Акт на отбор телок-реципиентов
Приложение 4. Акт на пересадку эмбрионов
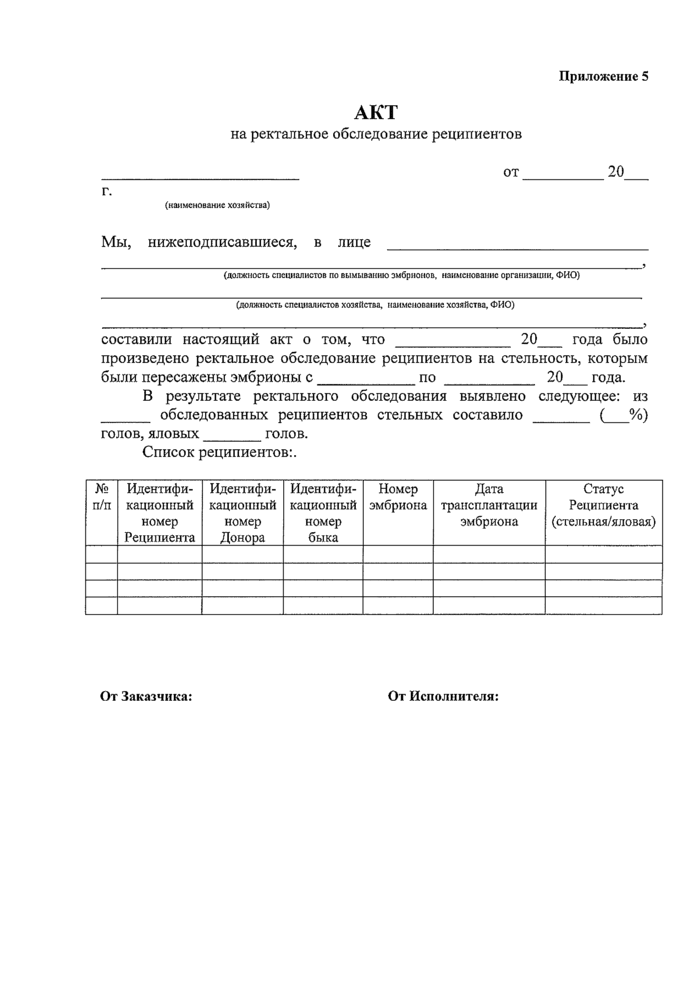
Приложение 5. Акт на ректальное обследование реципиентов
Приложение 6. Отчет по трансплантации эмбрионов по хозяйству
| Дата введения | 01.01.2021 |
|---|---|
| Добавлен в базу | 01.01.2021 |
| Актуализация | 01.01.2021 |
Этот документ находится в:
- Раздел Экология
- Раздел 11 ЗДРАВООХРАНЕНИЕ
- Раздел 11.220 Ветеринария
- Раздел 11 ЗДРАВООХРАНЕНИЕ
Организации:
| Принят | Департамент животноводства и племенного дела Минсельхоза России | |
| Утвержден | ФГБНУ Всероссийский научно-исследовательский институт племенного дела |
Чтобы бесплатно скачать этот документ в формате PDF, поддержите наш сайт и нажмите кнопку:

стр. 1

стр. 2

стр. 3

стр. 4

стр. 5

стр. 6

стр. 7

стр. 8

стр. 9

стр. 10

стр. 11

стр. 12

стр. 13

стр. 14

стр. 15

стр. 16

стр. 17

стр. 18

стр. 19
стр. 20

стр. 21

стр. 22
стр. 23

стр. 24

стр. 25
стр. 26
стр. 27
|
УТВЕРЖДАЮ: Директор ФГБНУ |
СОГЛАСОВАНО: И.о. директора |
|
Всероссийский научно-исследовательский Департамента животноводства и |
МЕТОДИЧЕСКИЕ РЕКОМЕНДАЦИИ
по Порядку и условиям применения метода трансплантации эмбрионов крупного рогатого скота
Настоящие Методические рекомендации определяют терминологию, перечень ключевых операций и подходов для эффективного получения, хранения, пересадки и подсадки эмбрионов крупного рогатого скота.
Рекомендации подготовлены в соответствии с Федеральным законом от 03.08.1995 г. № 123-ФЗ "О племенном животноводстве" и предназначены для организаций по трансплантации эмбрионов, подразделений по получению и трансплантации эмбрионов в составе организаций, хозяйств - собственников скота, племенных и ветеринарных служб.
ОГЛАВЛЕНИЕ
ВВЕДЕНИЕ.........................................................................................................................................4
1. ОБЩИЕ ПОЛОЖЕНИЯ..............................................................................................................5
2. ОТБОР ДОНОРОВ И СЕМЕНИ БЫКОВ.................................................................................7
3. ТЕХНОЛОГИИ ПРОИЗВОДСТВА И ТРАНСПЛАНТАЦИИ ЭМБРИОНОВ КРУПНОГО
РОГАТОГО СКОТА..........................................................................................................................8
4. ПОЛУЧЕНИЕ ЭМБРИОНОВ КРУПНОГО РОГАТОГО СКОТА МЕТОДОМ IN VIV0....9
4.1. ОТБОР ЖИВОТНЫХ В ДОНОРЫ ЭМБРИОНОВ..................................................................9
4.2. МЕТОДЫ СТИМУЛЯЦИИ ДОНОРОВ ДЛЯ ПОЛУЧЕНИЯ ЭМБРИОНОВ.......................9
4.3. ИСПОЛЬЗОВАНИЕ ГОТОВЫХ СРЕД, ИХ ПРИГОТОВЛЕНИЕ......................................10
4.4. ИЗВЛЕЧЕНИЕ ЭМБРИОНОВ.................................................................................................10
5. ПОЛУЧЕНИЕ ЭМБРИОНОВ КРУПНОГО РОГАТОГО СКОТА МЕТОДОМ IN VITRO 12
5.1. ОТБОР ЖИВОТНЫХ В ДОНОРЫ ЯЙЦЕКЛЕТОК (ООЦИТОВ).......................................12
5.2. ПРОВЕДЕНИЕ ТРАНСВАГИНАЛЬНОЙ АСПИРАЦИИ (ТАО)........................................12
5.3. ТРАНСПОРТИРОВКА ОКК....................................................................................................12
5.4. ТРАНСПОРТИРОВКА ЯИЧНИКОВ......................................................................................13
5.5. ВЫДЕЛЕНИЕ ООЦИТОВ ИЗ ЯИЧНИКОВ...........................................................................13
5.6. ОТБОР ООЦИТОВ....................................................................................................................13
5.7. ДОЗРЕВАНИЕ ОТОБРАННЫХ ООЦИТОВ..........................................................................13
5.8. ОПЛОДОТВОРЕНИЕ ДОЗРЕВШИХ IN VITRO ООЦИТОВ И КУЛЬТИВИРОВАНИЕ
ЭМБРИОНОВ...................................................................................................................................13
5.9. ТРЕБОВАНИЯ К РАБОТЕ С БИОЛОГИЧЕСКИМ МАТЕРИАЛОМ И
ИНСТРУМЕНТАМИ.......................................................................................................................14
6. ТРЕБОВАНИЯ К ЭМБРИОНАМ............................................................................................15
7. КРИОКОНСЕРВАЦИЯ ЭМБРИОНОВ...................................................................................16
8. ПЕРЕНОС ЭМБРИОНОВ В ОРГАНИЗМ САМКИ-РЕЦИПИЕНТА..................................17
9. КРИОХРАНЕНИЕ ЭМБРИОНОВ...........................................................................................19
9.1. ТЕХНИКА БЕЗОПАСНОСТИ ПРИ РАБОТЕ С СОСУДАМИ ДЬЮАРА И СТАЦИОНАРНЫМИ БИОХРАНИЛИЩАМИ.............................................................................19
10. УЧЕТ И ОТЧЕТНОСТЬ............................................................................................................21
ПРИЛОЖЕНИЯ.........................................................................................................................23
Поиск эмбрионов
Вымывную жидкость собирают в стерильную емкость или фильтруют через эмбриональный фильтр и поиск эмбрионов проводят непосредственно в фильтре. Фокусировку микроскопа проводят по нижнему слою жидкости или по образовавшемуся осадку на дне фильтра, так как именно в этом слое должны находиться извлеченные эмбрионы. Поиск проводят при 10' или 15' кратном увеличении стереомикроскопа, последовательно и тщательно просматривая каждое поле зрения. При этом передвигают эмбриональный фильтр относительно окуляра стереомикроскопа слева направо или наоборот. Обнаруженные в поле зрения эмбрионы с помощью одноразового шприца (емкостью 1мл), соединенного с венозным катетером или пластиковым капилляром, переносят в маленькую чашку Петри (0-35-40 мм) со средой для культивирования.
Оценка эмбрионов
Оценивают качество эмбрионов под микроскопом в проходящем свете при 100-160 кратном увеличении. Пригодными для трансплантации являются эмбрионы, полученные на 7-8 день после первого осеменения. К этому времени нормально развитые эмбрионы находятся на стадии развития поздней морулы, ранней бластоцисты и поздней бластоцисты.
Замороженно-оттаянные эмбрионы оценивают по тем же морфологическим показателям, что и свежеполученные. Эмбрионы, имеющие значительные повреждения прозрачной оболочки, разрушение бластомеров, сжатие бластополости, подвергаются дополнительной оценке методом культивирования или выбраковываются.
Оценку эмбрионов осуществляют согласно нормам Госта 28424-2014. Санитарная обработка эмбрионов
Для устранения инфекционной контаминации перед пересадкой или замораживанием необходимо применять санитарную обработку эмбрионов. Для обработки трипсином можно подвергать только эмбрионы с не повреждённой прозрачной оболочкой. Эмбрионы отмывают в 5-ти стерильных каплях среды культивирования, затем 2-2,5 мин в 2 3-х каплях раствора трипсина с концентрацией 0,25%. После обработки трипсином эмбрионы вновь промывают в 5-ти в 5-ти сменяющихся каплях 20%-ного раствора фетальной сыворотки на основе среды Дюлбекко.
Подготовка эмбрионов к замораживанию
Для замораживания используют только свежеполученные эмбрионы отличного и хорошего качества. Продолжительность времени подготовки эмбрионов к замораживанию должна быть минимальной. Для защиты эмбрионов от разрушения при замораживании и оттаивании применяют специальные криозащитные вещества, в основном: легко
и
проникающий в клетку криопротекторы глицерин в концентрации 1,0 М, 1,4 М. или этилен гликоль в концентрации 1,5 М. Для нысыщения эмбрионов криопротектором их группами помещают в криозащитный раствор и выдерживают определённое время. После чего при помощи специального устройства заправляют в пайеты
Подготовку к криоконсервации, криоконсервацию и отгаивание эмбрионов осуществляют по принятому протоколу.
Глубокое замораживание эмбрионов и хранение их в жидком азоте при температуре -196°С обеспечивает длительное сохранение их жизнеспособности и проведение трансплантации в любое удобное время. Для криоконсервирования выделяют хорошо вентилируемое помещение, граничащие территориально с комнатой, где проводится оценка жизнеспособности эмбрионов. Одно помещение служит для замораживания эмбрионов, другое - для хранения хладоагента и замороженных эмбрионов (эмбриобанк). Замораживание эмбрионов проводят с помощью автоматических приборов, обеспечивающих регулирование скорости охлаждения в заданных режимах.
После проведения криоконсервации эмбрионов заполняют соответствующую документацию, в которой отражены характеристики доноров, эмбрионов и проведенных процедур.
При работе с эмбрионами соблюдают все предписания и правила, отраженные в Госте 28424-2014, в кодексе здоровья наземных животных МЭБ и ветеринарном законодательстве РФ.
5. ПОЛУЧЕНИЕ ЭМБРИОНОВ КРУПНОГО РОГАТОГО СКОТА МЕТОДОМ IN VITRO
5.1. Отбор животных в доноры яйцеклеток (ооцитов)
Отбор животных для получения ооцитов проводится также, как и в технологии трансплантации in vivo.
В технологии in vitro используют два способа получения женских гамет. Первый - ооциты аспирируют из поверхностных антральных фолликулов яичников животных прижизненно, методом ovum pick-up (OPU). Процедура выполняется с минимальным хирургическим вмешательством, при этом предварительная гормональная обработка животного не является обязательным условием, а выделенные ооциты дозревают in vitro. Получение ооцитов у одного животного может проводиться с интервалом в 1-2 недели. Второй способ — это выделение ооцитов из яичников животных при убое.
5.2. Проведение трансвагинальной аспирации ооцитов (ТАО)
Использование технологии in vitro для получения доимплантационных эмбрионов может способствовать ускоренному получению потомства ценных в
генетическом отношении животных, у которых имеются нарушения в воспроизводстве, не связанные с функцией яичников, или не проявляется адекватная реакция суперовуляции в ответ на гормональную обработку. Также этот метод позволяет получать полноценные эмбрионы для трансплантации при выделении ооцитов из яичников здоровых животных, в том числе и находящихся на разных сроках стельности.
Другим источником женских гамет являются яичники, получаемые при убое животных. В этом случае также могут быть разово получены эмбрионы от ценных особей, выбраковка которых по ряду причин необходима. В широком масштабе этот источник используется для увеличения поголовья и повышения генетического потенциала в мясном скотоводстве.
Для проведения прижизненной трансвагинальной аспирации ооцитов из фолликулов яичника используют устройства OPU. Прибор OPU состоит из ультразвукового сканера, вакуумной помпы, пункционной насадки, иглы диметром 18G. В качестве среды для кратковременной локализации ОКК используется фосфатно-солевой буфер Дюльбекко с добавлением 100 ед./мл гентамицина, геперина и 2% BSA либо фетальной сыворотки. Извлекаемые из фолликулов ооциты по трубке попадают в подогреваемый приемник.
5.3. Транспортировка ооцит-кумулюсных комплексов (ОКК)
Допустимо осуществлять транспортировку ОКК в транспортном
инкубаторе в среде для дозревания с соблюдением температурного режима и концентрации СОг
5.4. Транспортировка яичников
После овариоэктомии морфологически нормальные яичники доставляют в лабораторию. Если транспортировка яичников до лаборатории занимает непродолжительное время (2-3 час.), температура раствора, в котором находятся яичники, должна быть в пределах 30-35°С. Если транспортировка требует более продолжительного времени (более 6 час.), температура раствора должна находиться в пределах 20-25°С.
5.5. Выделение ооцитов из яичников
Выделение ооцитов проводится в стерильных условиях с использованием нагревательных поверхностей.
В чашку Петри или конический фильтр помещается небольшое количество предварительно подготовленного и подогретого до температуры +37°С раствора среды Дюльбекко с добавлением фетальной сыворотки и антибиотиков. Яичник в этой среде фиксируется пинцетом. Затем при помощи стерильного лезвия рассекают ткани яичника, после чего места разрезов тщательно промывают подготовленным раствором среды.
5.6. Отбор ооцитов
В технологии получения эмбрионов крупного рогатого скота in vitro требуются ооциты, способные возобновлять мейоз, дозревать и
оплодотворяться in vitro с получением жизнеспособных эмбрионов, пригодных для дальнейшей трансплантации.
При отборе ооцит-кумулюсных комплексов обращают внимание на такие морфологические параметры как: наличие кумулюса и его качество, размер ооцита, гомогенность и цвет ооплазмы, ширина и равномерность зоны пеллюцида, тургор. Локализацию ооцит-кумулюсных комплексов проводят с помощью сетчатого фильтра, визуализацию и оценку качества ооцитов осуществляют с использованием стереоскопического микроскопа.
5.7. Дозреванис отобранных ооцитов
После получения и отбора ооциты помещают в среду дозревания и выдерживают течение 22-24 часов в газовых инкубаторах, при влажности 98% и температуре +38,5 °С.
Все технологические процедуры с ооцитами для получения эмбрионов методом in vitro должны проводиться согласно принятым протоколам с соблюдением правил асептики.
5.8. Оплодотворение дозревших in vitro ооцитов и культивирование эмбрионов
Для оплодотворения используют, как правило, криоконссрвированное семя быков. Выделяют фракцию подвижных сперматозоидов, свободных от семенной плазмы и компонентов среды. Оплодотворяющая способность сперматозоидов может существенно варьировать у разных особей. Концентрация подвижных сперматозоидов при оплодотворении дозревших in vitro ооцитов крупного рогатого скота должна составлять 0,5-1,0 х 106 сперматозоидов/мл.
Ооциты со сперматозоидами инкубируют в средах для оплодотворения в течение 18-20 часов. День оплодотворения считают нулевым.
После завершения процедуры инкубирования зиготы помещают в среду культивирования, в состав которой, в зависимости от протокола, могут входить пируват натрия, лактат натрия, глутамин, глюкоза, растворы заменимых и незаменимых аминокислот, фетальная сыворотка крупного рогатого скота, бычий сывороточный альбумин, витамины. Стадии развития, пригодной для нехирургической трансплантации (бластоцисты, экспандированной бластоцисты и полностью экспандированной бластоцисты), полученные in vitro эмбрионы достигают на 6-7 и 8 сутки культивирования.
5.9. Требования к работе с биологическим материалом и инструментами
Биологические продукты животного происхождения, в том числе культуральные клетки и составляющие жидкостей, используемые для отбора, дозревания, оплодотворения, культивирования ооцитов, вымывания и хранения эмбрионов, не должны содержать живых патогенных возбудителей. Среды должны подвергаться предварительной стерилизации по утвержденным
методикам, описанным в Руководстве IETS, а при манипуляциях оставаться стерильными. Антибиотики должны добавляться в жидкости и среды согласно рекомендациям Руководства IETS.
Инвентарь, используемый для отбора, манипуляций, культивирования, вымывания, замораживания и хранения ооцитов/эмбриоиов, должен быть стерильным и тестированным на эмбриотоксичность.
6. ТРЕБОВАНИЯ К ЭМБРИОНАМ
Характеристика состояния эмбрионов необходима для выявления среди них способных к развитию и пригодных для пересадки реципиенту или криоконсервации. При оценке учитывают стадию развития эмбриона, соответствие ее возрасту, определяют морфологическое состояние эмбриона и, исходя из этих критериев, устанавливают его качество и пригодность для дальнейшего использования. Морфологическую оценку качества эмбрионов проводят под бинокулярной лупой или стереомикроскопом. Характеризуют и классифицируют эмбрионы согласно Госту 28424-2014.
При работе с эмбрионами соблюдают все предписания и правила, отраженные в Госте 28424-2014, в кодексе здоровья наземных животных МЭБ и ветеринарном законодательстве РФ.
7. КРИОКОНСЕРВАЦИЯ ЭМБРИОНОВ
Эмбрионы крупного рогатого скота, полученные методом in vitro, по ряду морфофизиологических характеристик отличаются от полученных in vivo, и являются более чувствительными к воздействию факторов, связанных с криоконсервацией. В результате криоконсервации с использованием технологии медленного замораживания жизнеспособность эмбрионов, полученных методом in vitro, существенно снижается.
В этой связи криоконсервацию эмбрионов, полученных методом in vitro рекомендуется проводить методом витрификации. Особенность метода заключается в помещении эмбриона в концентрированный раствор криопротектора, перенос эмбриона на носитель - «криотек» и мгновенное погружение в жидкий азот. Для достижения максимальных скоростей охлаждения и нагревания объем капли криопротектора, в которой содержится эмбрион, должен быть минимальным (от 1 до 4 мкл). При криоконсервации по методу витрификации полученных in vitro эмбрионов используется широкий ряд носителей открытого и закрытого типов.
Требования к консервации и транспортировке эмбрионов согласно кодексу здоровья наземных животных МЭБ:
• в одну группу при криоконсервации должны входить эмбрионы,
полученные от одной самки-донора или происходящие из одной партии.
• эмбрионы должны криоконсервироваться в очищенных и стерильных контейнерах с жидким азотом, а затем храниться с соблюдением строгих условий гигиены в специально предназначенном для этой цели месте.
• носители с криоконсервированными эмбрионами маркируются, как указано в Руководстве IETS.
• после проведения процедуры криоконсервации эмбрионов заполняют соответствующую документацию, в которой отражены характеристики доноров, эмбрионов и проведенных процедур.
8. ПЕРЕНОС ЭМБРИОНОВ В ОРГАНИЗМ САМКИ-РЕЦИПИЕНТА
Пересадки эмбрионов проводят в хозяйствах, благополучных по инфекционным и инвазионным заболеваниям, с хорошей организацией производства, обеспечивающей сбалансированное кормление и оптимальный уровень воспроизводства стада.
Для пересадок используют как коров, так и телок. Коров в качестве реципиентов используют не ранее, чем через 50-60 дней после отела, не старше 7-ми лет, клинически здоровых, с регулярными половыми циклами нормальной продолжительности. Телки должны быть случного возраста, средней упитанности, с живой массой, соответствующей стандарту породы, ни разу не осеменявшиеся. При отборе реципиентов проводят тщательное ректогенитальное обследование с целью исключения особей с неразвитыми половыми органами или наличием патологии.
• реципиенты должны быть клинически здоровыми;
• проходить обязательное обследование на инфекционные заболевания (бруцеллез, туберкулез, вирусные респираторные заболевания, лейкоз, трихомоноз, вибриоз, ящур и др.);
• обязательна дегельминтизация предоставляемого поголовья для отбора в качестве реципиентов за 1,5 месяца до пересадки эмбрионов;
• реципиенты должны быть с нормальной физиологией половой системы без патологии родовых путей;
• в качестве реципиентов рекомендуется использовать наименее ценных в племенном отношении животных;
• нельзя использовать в качестве реципиентов животных мелких пород для трансплантации эмбрионов от пород более крупных по массе.
После проведения мероприятий по отбору и комплектованию группы реципиентов составляется акт (см. приложение).
Для управления половым циклом и синхронизации половой охоты у доноров и реципиентов применяют препараты, разрешённые к использованию на территории РФ и содержащие такие гормоны как прогестерон, синтетические аналоги простагландина F2a, различные рилизинг-гормоны.
После проведения мероприятий по синхронизации половых циклов у доноров и реципиентов составляют акт, где указывают использованные схемы введения гормонов (см. приложение).
Трансплантация эмбрионов реципиентам нехирургическим методом представляет собой процедуру переноса эмбриона из пайеты (соломинки) в рог матки реципиента. Такая процедура проводится при помощи специальных катетеров под ректальным контролем. Этот метод требует хороших навыков, позволяющих избежать травмирования слизистой оболочки половых путей, и его проводят в строгом соответствии со всеми требованиями и правилами по контролю и профилактике инфекционных заболеваний.
После пересадки эмбриона кормление и содержание реципиентов осуществляют в обычных условиях, как для стельных животных, не допуская травмирования и стрессовых ситуаций.
В группах реципиентов ведут постоянное наблюдение за возможным проявлением повторной охоты. На 30-90 дни после пересадки животных-реципиентов ректально исследуют на наличие стельности. По результатам исследования составляют акт (см. приложение).
9. ХРАНЕНИЕ ЭМБРИОНОВ
9.1 .Техника безопасности при работе с сосудами Дьюара и стационарными биохранилищами
Персонал, работающий с сосудами Дьюара (заправка жидким азотом, загрузка и выгрузка канистр со спермой, опорожнение сосуда и т. д.), обязан надевать защитные очки (лучше щитки из органического стекла) и рукавицы кожаные, асбестовые или брезентовые. Одежда не должна оставлять открытым кожный покров. Нужно помнить, что попадание жидкого азота на кожу может вызвать обморожение. Необходимо избегать соприкосновения открытых участков тела с металлическими предметами, извлеченными из жидкого азота, которые также могут вызвать обморожение. Брюки должны быть без манжет и закрывать верх обуви. Рукавицы должны надеваться на руки свободно, чтобы при необходимости их можно было легко сбросить.
Заливать жидкий азот в теплый сосуд Дьюара (имеющий температуру внутри сосуда, равную температуре окружающего воздуха) надо медленно. Азот заливают в сосуд Дьюара через широкую металлическую воронку. Быстрое заполнение теплого сосуда Дьюара азотом приводит к выбросам
жидкости из сосуда вследствие чрезмерно большого количества образующихся паров (особенно у сосудов с узкой горловиной).
Категорически запрещается оставлять на отогрев после испытаний сосуды Дьюара, потерявшие вакуум (покрывшиеся слоем инея) в помещении, где могут находиться (или проходить) люди. При отогреве таких сосудов может произойти быстрая десорбция больших количеств воздуха, поглощенного адсорбентом при заливании в сосуд жидкого азота. При этом резко увеличивается давление в межстенном пространстве сосуда, что может привести к взрыву. Отогревать (не менее 3 суток) такие сосуды следует в изолированных помещениях, в которые на это время должен быть запрещен доступ людям.
При транспортировке сосудов Дыоара с жидким азотом на автомобилях и других видах транспорта необходимо надежно закреплять их во избежание падений. Сосуды Дьюара, подготавливаемые к перевозке на самолетах, надо заливать жидким азотом только на половину гидравлической емкости.
В сосуды Дьюара, изготавливаемые для сельского хозяйства, не допускается заливка жидкого азота с примесью воздуха и жидкого кислорода, поскольку в качестве адсорбента применен активированный уголь. Использование в сосудах Дьюара загрязненного кислородом жидкого азота требует соблюдения правил безопасности.
При получении на предприятии-поставщике каждой партии жидкого азота шофер автомобиля с транспортным резервуаром организации или сопровождающее лицо обязаны взять от представителя ОТК этого предприятия сертификат на жидкий азот с указанием его чистоты в процентах. В организации работник, ответственный за эксплуатацию криогенного оборудования, должен постоянно следить по сертификатам за чистотой получаемого азота. Сертификаты должны храниться отдельно от других документов.
10 . УЧЕТ И ОТЧЕТНОСТЬ
Метод трансплантации эмбрионов требует четкой организации и последовательности работ, пунктуального и добросовестного оформления документации. Правильный учет на всех этапах технологии трансплантации эмбрионов необходим для постоянного контроля и анализа результатов, применения отдельных схем, режимов и методов в работе.
На каждого поступающего животного донора и реципиента, заполняется соответственно оформленная карточка племенной коровы, телки. К карточке прилагают пояснительную записку или зоотехническо-гинекологическую карточку с характеристикой воспроизводительной способности животного и других показателей, перечисленных в требованиях при отборе коров-доноров.
На выбракованных из молочного стада коров указывают причину выбраковки.
18
На быков-производителей, семя которых используется для осеменения доноров, заполняется карточка, племенного быка или племсвидетельство.
На каждого теленка, полученного методом трансплантации эмбрионов, в день его рождения составляют акт на оприходование приплода, ведется журнал регистрации приплода и выращивания молодняка крупного рогатого скота.
На каждого племенного бычка и телочку заполняется карточка теленка.
Оперативный учет работ, непосредственно связанный с технологией трансплантации эмбрионов, осуществляется с помощью специальных карточек для животных: доноров, реципиентов и телят. Лицевая сторона карточки донора и реципиента заполняется при отборе животных в хозяйстве, на основании данных первичного зоотехнического племенного учета, клинической и гинекологической диспансеризации, а также непосредственного осмотра и ректального контроля родополовых органов. Обратная сторона карточки предназначена для учета и контроля исполнения каждого элемента технологии трансплантации эмбрионов.
Одновременно ведется учет и регистрация работ в следующих рекомендуемых журналах:
- учета поступления и использования доноров;
- гормональной индукции суперовуляции доноров;
- извлечения, оценки качества и использования эмбрионов;
- криоконсервирования и использования эмбрионов;
- учета результатов пересадки эмбрионов.
Вся информация в процессе работы сразу заносится в карточку или журнал с указанием даты и непосредственного исполнителя работ.
По результатам работы за каждый месяц заведующий составляет отчет, в который включает:
• итоговые показатели работы по трансплантации эмбрионов;
• опись и карточки на каждого используемого в работе донора, реципиента
и полученного методом пересадки эмбрионов теленка;
• копию акта результатов ректального исследования реципиентов на
стельность.
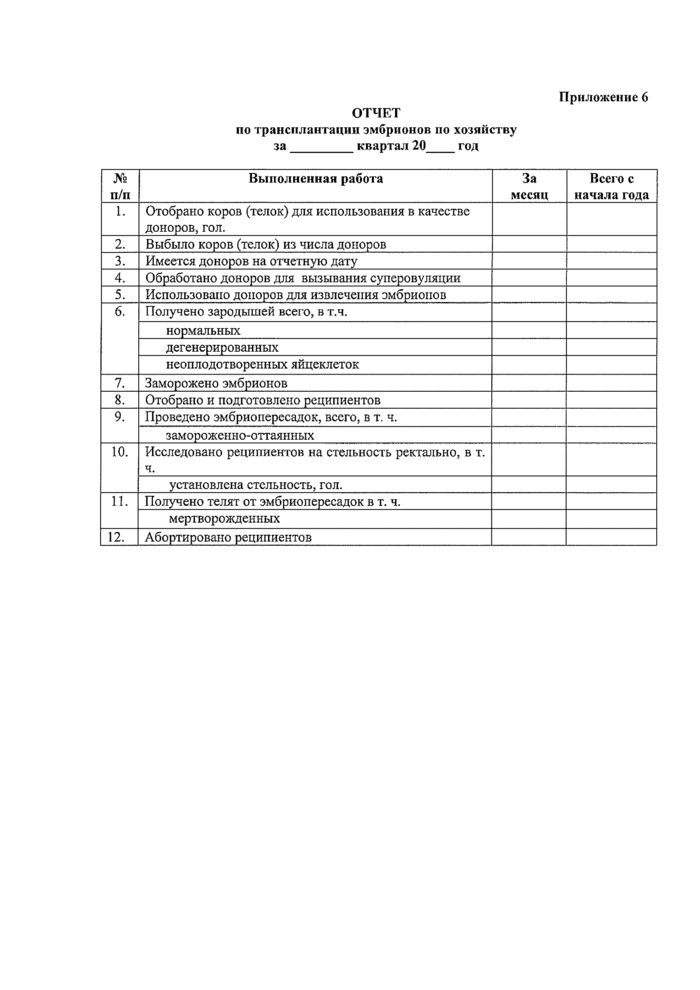
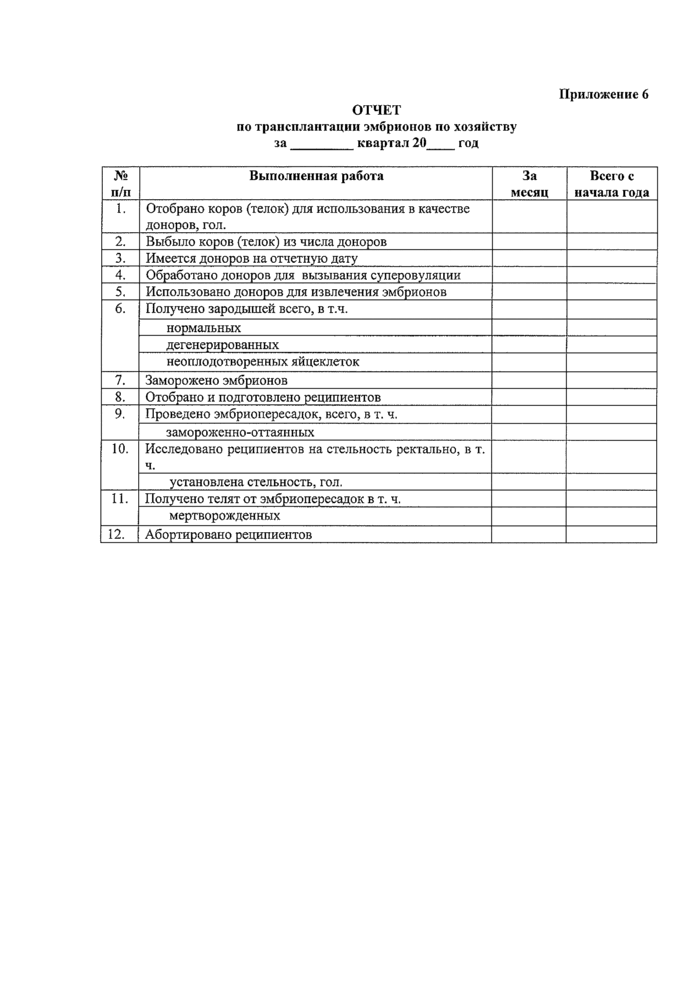
ОТЧЕТ
Приложение 6
по трансплантации эмбрионов по хозяйству за_квартал 20_гол
|
№ п/п |
Выполненная работа |
За месяц |
Всего с начала года |
|
1. |
Отобрано коров (телок) для использования в качестве доноров, гол. | ||
|
2. |
Выбыло коров (телок) из числа доноров | ||
|
3. |
Имеется доноров на отчетную дату | ||
|
4. |
Обработано доноров для вызывания суперовуляции | ||
|
5. |
Использовано доноров для извлечения эмбрионов | ||
|
6. |
Получено зародышей всего, в т.ч. | ||
|
нормальных | |||
|
дегенерированных | |||
|
неоплодотворенных яйцеклеток | |||
|
7. |
Заморожено эмбрионов | ||
|
8. |
Отобрано и подготовлено реципиентов | ||
|
9. |
Проведено эмбриоперссадок, всего, в т. ч. | ||
|
замороженно-оттаянных | |||
|
10. |
Исследовано реципиентов на стельность ректально, в т. ч. | ||
|
установлена стельность, гол. | |||
|
И. |
Получено телят от эмбриопересадок в т. ч. | ||
|
мертворожденных | |||
|
12. |
Абортировано реципиентов |
Трансплантация эмбрионов крупного рогатого скота является
биотехнологическим приемом в селекции, позволяющим получать большее количество потомков (по сравнению с традиционными методами
воспроизводства) от генетически ценных родителей.
Метод эмбриотрансплантации способствует:
• получению быков-производителей и выдающихся тёлок от лучших племенных животных в количестве большем, чем может принести корова за один год;
• ускорению селекционного процесса за счет сокращения интервалов между поколениями;
• увеличению генетического разнообразия быков для одной самки, а также создания семейств и стад коров на основе одной родоначальницы;
• предимплантационной диагностике эмбрионов с целью выявления нежелательных рецессивных генов и хромосомных аномалий;
• осуществлению межвидовых пересадок;
• получению химерных животных;
• оздоровлению стад от инфекционных заболеваний;
• созданию банков криоконсервированных эмбрионов, сохранению ценных и исчезающих пород и генотипов;
• получению животных с желаемым полом.
На современном этапе развития животноводства внедрение трансплантации эмбрионов в практику племенных и товарных хозяйств позволяет повысить эффективность программ по комплексному совершенствованию продуктивных и технологических качеств крупного рогатого скота и обеспечить скорейшее качественное изменение стад.
з
Приложение 1
КАРТОЧКА ДОНОРА (КОРОВА/ТЕЛКА)
Хозяйство_Порода_
Инв. №_
Кличка_
Дата рождения_
Живая масса_кг.
|
Молочная иродуктивность | |||||||||||||||||||||||||||||||||||
|
|
Воспроизводительная функция | |||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||
|
Средняя продолжительность астрального цикла_дней | |||||||||||||||||||||||||||||||||||||||||||||
|
Результаты ректального исследования | ||||||||||||||||||||
| ||||||||||||||||||||
Результаты лабораторных исследований_
Физиологическое состояние животного_
Содержание, кормление_
Заключение специалиста при отборе коровы в качестве донора Дальнейшее использование_
Дата
Ф.И.О.
Место для размещения организации по трансплантации эмбрионов должно быть выбрано с учетом благополучия местности по инфекционным заболеваниям животных, рельефа, залегания грунтовых вод, господствующих ветров и возможностей удобного выхода на шоссейные и железнодорожные магистрали и удаленности от них, населенных пунктов и животноводческих объектов на расстояние, установленное по согласованию с местными органами государственного санитарного и ветеринарного надзора.
Размещение всех зданий и сооружений на территории организации для трансплантации эмбрионов животных должно обеспечить их рациональную технологическую взаимосвязь и соблюдение необходимых ветеринарносанитарных условий.
Территория организации должна быть огорожена, а проезд и проход через неё посторонних лиц и транспорта должны быть запрещены.
На территории организации должны находиться только производственные здания, доноры и реципиенты эмбрионов.
Современные технологии производства эмбрионов позволяют проводить работы на территории хозяйств, в которых располагаются животные доноры и реципиенты.
Для проведения работ на территории заказчика предусматривается наличие мобильной эмбриологической лаборатории или комплекта оборудования для осуществления выезда на предприятие с целью получения эмбрионов in vivo или трансвагинального забора ооцитов для последующего производства эмбрионов in vitro.
Для производства эмбрионов методом in vitro необходимо наличие стационарной лаборатории.
При необходимости длительного хранения эмбрионов в замороженном виде организация по трансплантации эмбрионов должна иметь оборудованное помещение.
Для производства эмбрионов стационарная лаборатория должна быть оснащена следующими устройствами и оборудованием:
• системой отопления, кондиционирования и дезинфекции помещения для создания необходимого микроклимата;
• холодильным оборудованием;
• газовыми инкубаторами для in vitro;
• комплексом оборудования для транс вагинальной аспирации ооцитов для in vitro;
• стереомикроскопами;
• нагревательными поверхностями;
• программным замораживателем;
• комплектом инструментов для витрификации;
• стационарными и переносными сосудами Дьюара;
• размораживателем;
• стерилизаторами для используемого инструмента;
• ультразвуковым сонографом с датчиками для диагностики состояния половых путей и стельности (при необходимости);
• необходимыми средами, расходным материалом и лабораторной посудой.
2. ОТБОР ДОНОРОВ И СЕМЕНИ БЫКОВ
Организации по трансплантации эмбрионов должны использовать в качестве доноров только животных, имеющих племенную ценность.
Отбор животных в доноры эмбрионов проводят по генетическим параметрам животного, индивидуальному развитию, продуктивности и признакам здоровья.
Генетическое превосходство животного определяется ценностью его предков, длительностью хозяйственного использования, собственной продуктивностью и продуктивностью его потомства, а также соответствием стандарту (по типу) породы.
При подборе коров-допоров для использования в целях сохранения генофонда локальных пород руководствуются задачами поддержания всего генетического разнообразия.
Доноры эмбрионов должны удовлетворять следующим требованиям:
• не иметь признаков, отрицательно влияющих на племенное использование;
• иметь известное происхождение, достоверность которого подтверждается соответствующим документом;
• не иметь экстерьерных недостатков;
• для получения эмбрионов in vivo животные должны быть клинически здоровыми, иметь регулярный половой цикл;
• животные доноры должны получать полноценное кормление и бесстрессовое содержание.
Для осеменения доноров и оплодотворения ооцитов, используют сперму быков-производителей согласно утвержденному селекционному плану хозяйства.
Используемое семя должно быть от выдающихся быков-производителей, имеющих высокую оценку племенной ценности. Прошедших генетические исследования на достоверность происхождения и отсутствие наследственных заболеваний.
3. ТЕХНОЛОГИИ ПРОИЗВОДСТВА И ТРАНСПЛАНТАЦИИ ЭМБРИОНОВ КРУПНОГО РОГАТОГО СКОТА
В настоящее время в практике скотоводства применяются две технологии получения эмбрионов методами in vivo и in vitro.
Метод in vivo характеризуется тем, что развитие эмбрионов до стадий, необходимых для трансплантации, происходит в репродуктивном тракте животного-донора.
При применении метода in vitro процессы дозревания яйцеклеток, их оплодотворения и культивирования эмбрионов производятся в лабораторных условиях вне организма животного-донора.
|
Таблица 1 Основные технологические этапы | ||||||||||||||||||||||||
| ||||||||||||||||||||||||
4. ПОЛУЧЕНИЕ ЭМБРИОНОВ КРУПНОГО РОГАТОГО СКОТА МЕТОДОМ IN VIVO
4.1. Отбор животных в доноры эмбрионов
Отбор животных в доноры проводят специалисты хозяйства и специалисты по трансплантации эмбрионов.
При отборе животных в доноры учитывают следующие признаки:
- клинически здоровые, без патологий репродуктивного тракта, без признаков нарушения обмена веществ (ожирение, дистрофия и т.д.), реагирующие полиовуляцией при гормональной обработке.
Из числа доноров исключают животных с узким анусом, нарушенным половым циклом, фолликулярными кистами, а также животных имеющих незавершенную инволюцию матки.
Отбирают коров-доноров с нормальным течением послеродового периода, у которых на протяжении 60 дней после отела зарегистрированы две овуляции и хотя бы одна выраженная охота.
4.2. Методы стимуляции доноров для получения эмбрионов
Гормональную обработку с целью индицирования реакции полиовуляции начинают через 50-60 дней после отела. Перед этим контролируют состояние половой системы животного с помощью ректогенитального обследования или УЗИ-сканера. Наличие выраженной охоты и хорошо сформированного желтого тела в одном из яичников на 8-14 день цикла являются показанием для начала гормональной обработки. В случае отсутствия признаков явной охоты или ее пропуске, при нормальном состоянии половой системы приход животного в охоту стимулируют введением аналогов простагландина F-2a.
|
Таблица 2. Примерные схемы гормональной стимуляции полиовуляции | ||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||
Охота у доноров с полиовуляцией обычно начинается через 36-48 часов после введения препарата простагландина F-2a. Коров при полиовуляции осеменяют от 2-х до 3-х раз с 12-часовым интервалом. Первое осеменение проводят спустя 8-12 часов после начала охоты. Сперму вводят в тело матки или в оба рога. Осеменение проводят одной- двумя дозами спермы.
После проведения процедуры по осеменению донора в журнал вносят данные о кличке быка, количества спермодоз и качестве спермы.
4.3. Использование готовых сред и их приготовление Приготовление растворов проводят в стерильных условиях, используя стерильную посуду, которую вскрывают непосредственно перед употреблением.
При работе с эмбрионами применяют модифицированный сбалансированный солевой раствор (Дюльбекко и др.) Непосредственно перед работой по извлечению эмбрионов в раствор фосфатно-солевого буфера, используемый для вымывания, добавляют 2% фетальной сыворотки крови крупного рогатого скота или бычьего сывороточного альбумина (BSA) из расчета 4 г/л среды для. Перед использованием среду для культивирования фильтруют через бактериальный мембранный фильтр (0=0,22 мкм).
Возможно использование готовых сред различных производителей, которые прошли регистрацию и сертификацию в контрольных органах Российской Федерации.
Извлечение эмбрионов
Обычно извлечение эмбрионов проводят на 7-8 день после осеменения донора (день охоты принимают за 0 день).
Перед извлечением эмбрионов проводят ректальное исследование донора для определения состояния половой системы и уровня реакции яичников.
Все инструменты и среды, используемые для извлечения эмбрионов, должны быть стерильными.
Эффективность получения эмбрионов во многом зависит от способа их извлечения, квалификации персонала, правильного использования приборов и инструментов.
Для извлечения эмбрионов необходимы следующие инструменты и растворы:
- катетер для извлечения эмбрионов в сборе;
- санитарный чехол;
- два пластиковых шприца на 150 мл;
- шприц для воздуха (10-20 мл);
-два зажима для шлангов;
- емкость для сбора вымывной жидкости
- среда Дюльбекко для извлечения эмбрионов (400-1000 см3);
- 2% раствор новокаина для сакральной анестезии (5 см3);
- фильтровальная бумага или бумажные салфетки;
- 70° этиловый спирт;
- одноразовые перчатки;
-гель УЗИ для смазки катетера
Процедура вымывания эмбрионов представляет собой подачу промывочного раствора в рога матки донора, орошения внутренней полости рога матки с целью извлечения находящихся там эмбрионов, забора промывочного раствора с эмбрионами из рога матки, сбора его в специальный сосуд или локализация вымытых эмбрионов в эмбриосборнике (фильтре).
Среду для извлечения эмбрионов вводят в рог матки отдельными порциями с помощью пластикового шприца емкостью 150 мл. На промывание одного рога расходуется 200-500 см3 среды. После извлечения жидкости из одного рога технолог отодвигает катетер назад в тело матки, вводит стилет и переводит катетер в левый рог и повторяет все манипуляции.
После извлечения последней порции жидкости из второго рога проводят санацию матки. Для этого, не выпуская из манжетки воздух, к катетеру присоединяют шприц с 40 см3 среды, содержащей антибиотики широкого спектра действия или санирующие препараты, используемые в среде для извлечения эмбрионов (ГАМП или полиген из расчета 300 или бООмкг/смЗ среды).
Вымывание эмбрионов проводят, соблюдая все правила обращения с животными, техники безопасности и с соблюдением норм и правил ветеринарного контроля. После проведения процедуры вымывания эмбрионов составляют акт (см. приложения) Используемую среду для вымывания эмбрионов, собирают в стерильную емкость или фильтруют через эмбриональный фильтр, и поиск эмбрионов проводят непосредственно в фильтре.
Перед началом процедуры вымывания эмбрионов животных доноров ректально исследуют на наличие жёлтых тел на яичниках. Наружные половые органы моют и насухо вытирают. Для снятия моторики кишечника и расслабления матки вводят эпидурально 5 см3 2% раствора новокаина. Хвост животного отводят в сторону и фиксируют в этом положении, чтобы он нс мешал при работе.
Технолог аккуратно вводит катетер во влагалище до упора в шейку матки и под ректальным контролем проводит катетер через шейку матки в тело и затем продвигает его в правый (или левый) рог до тех пор, пока не почувствует, что конец катетера упирается в изгиб рога. Ассистент освобождает резьбовой зажим стилета, и технолог, вытаскивая стилет, продвигает катетер дальше в рог матки. После того, как катетер введен глубоко в рог матки, ассистент накачивает манжетку катетера воздухом, вводя в нее примерно 15-20 см3.
ю