ГОСТ ISO 16212-2016
Продукция парфюмерно-косметическая. Микробиология. Подсчет дрожжей и плесневых грибов
Устанавливает метод определения количества дрожжей и плесневых грибов, содержащихся в парфюмерно-косметической продукции, путем подсчета колоний на избирательной агаризованной питательной среде после инкубации в аэробных условиях.
Оглавление
1 Область применения
2 Нормативные ссылки
3 Термины и определения
4 Принцип
5 Разбавители, нейтрализаторы и питательные среды
6 Инструменты и стеклянная лабораторная посуда
7 Штаммы микроорганизмов
8 Обращение с парфюмерно-косметической продукцией и лабораторными пробами
9 Методика
10 Подсчет колоний (чашечный метод и метод мембранной фильтрации)
11 Выражение результатов
12 Нейтрализация антигрибковых свойств продукции
13 Протокол испытаний
Приложение А (справочное) Прочие нейтрализующие разбавители
Приложение В (справочное) Прочие разбавители
Приложение С (справочное) Прочие питательные среды
Приложение D (справочное) Нейтрализаторы антигрибковой активности консервантов и промывные жидкости
Библиография
Приложение Д.А (справочное) Сведения о соответствии государственных стандартов ссылочным международному и европейскому стандартам
21 страница
| Дата введения | 01.04.2017 |
|---|---|
| Добавлен в базу | 01.01.2019 |
| Актуализация | 01.01.2021 |
Организации:
| 27.07.2016 | Утвержден | Евразийский совет по стандартизации, метрологии и сертификации | 89-П |
|---|---|---|---|
| 19.08.2016 | Утвержден | Госстандарт Республики Беларусь | 66 |
| Разработан | БелГИМ | ||
| Издан | БелГИСС | 2016 г. |
Perfume and cosmetic products. Microbiology. Detection of yeast and mould
Чтобы бесплатно скачать этот документ в формате PDF, поддержите наш сайт и нажмите кнопку:

стр. 1

стр. 2

стр. 3

стр. 4

стр. 5

стр. 6

стр. 7

стр. 8

стр. 9

стр. 10

стр. 11

стр. 12

стр. 13

стр. 14

стр. 15

стр. 16
стр. 17

стр. 18
стр. 19

стр. 20

стр. 21
ГОСУДАРСТВЕННЫЙ СТАНДАРТ ГОСТ ISO 16212-2016
РЕСПУБЛИКИ БЕЛАРУСЬ
Продукция парфюмерно-косметическая МИКРОБИОЛОГИЯ
Подсчет дрожжей и плесневых грибов
Прадукцыя парфумерна-касметычная М1КРАБ1ЯЛОГ1Я
Падлiк дражджэй i плесневых грыбоу
(ISO 16212:2008, ЮТ) Издание официальное
Г осстандарт Минск
GS
Предисловие
Евразийский совет по стандартизации, метрологии и сертификации (ЕАСС) представляет собой региональное объединение национальных органов по стандартизации государств, входящих в Содружество Независимых Государств. В дальнейшем возможно вступление в ЕАСС национальных органов по стандартизации других государств.
Цели, основные принципы и основной порядок проведения работ по межгосударственной стандартизации установлены ГОСТ 1.0-2015 «Межгосударственная система стандартизации. Основные положения» и ГОСТ 1.2-2015 «Межгосударственная система стандартизации. Стандарты межгосударственные, правила и рекомендации по межгосударственной стандартизации. Правила разработки, принятия, обновления и отмены».
Сведения о стандарте
1 ПОДГОТОВЛЕН республиканским унитарным предприятием «Белорусский государственный институт метрологии» (БелГИМ)
2 ВНЕСЕН Госстандартом Республики Беларусь
3 ПРИНЯТ Евразийским советом по стандартизации, метрологии и сертификации по переписке (протокол № 89-П от 27 июля 2016 г.) 1 2 3
|
За принятие стандарта проголосовали: | |||||||||||||||||||||
|
(2) N = с / (V х d) = 60/(1 х мг1) = 60/0,1 = G00 или 6 x 102 дрожжей и плесневых грибов на кубический сантиметр или грамм пробы.
Пример 3—Две чашки для двух разведений
S = 1 г; V= 1; результаты подсчета, полученные для разведения 10~2: 235 и 282; для разведения 10~3: 31 и 39
(3) N = wm/(Vx d) = 235+ 282 + 31 + 39/1(2 + 0,1 х 2) х 10 1 = 587/0,022 = 26 682.
Округление результата в соответствии с указаниями, приведенными выше, дает 27000 или 2,7 х 1и дрожжей и плесневых грибов на кубический сантиметр или грамм пробы.
Пример 4—Два мембранных фильтра на одно разведение
S = 1 г;\/ = 1; результаты подсчета, полученные для разведения 101:18 и 22
(1) N = т / (V х d) = 20/(1 х ЮГ1) = 20/0,1 = 200 или 2* 1(? дрожжей и плесневых грибов на кубический сантимепф или грамм пробы.
Пример 5— Один мембранный фильтр на одно разведение
S = 1 г; V= 1; результаты подсчета, полученные для разведения 101: 65
(2) N = с / (V х d) = 65/(1 х мг1) = 65/0,1 = 650 или §5* К? аэробных дрожжей и плесневых грибов на кубический сантиметр или грамм пробы.
Пример 6—Два мембранных фильтра на два разведения
S = 1 г; V= 1; результаты подсчета, полученные для разведения 101: 121 и 105; для разведения 10~2:15 и 25
(3) N = wm/(Vx d} = 121 + 105 +15 + 25/1(2 + 0,1 х 2J х Ю1 = 266/0,22 = 1 209.
Округление результата в соответствии с указаниями, приведенными выше, дает 1200 или
1,2 х ю3 дрожжей и плесневых грибов на кубический сантиметр или грамм пробы.
Пример 7—Две чашки для одного разведения
S = 1 г; V= 1; результаты подсчета, полученные для разведения 16Г1: 28 и 22
(1) N = т / (V х d) = 25/(1 х юг1) = 25/0,1 = 250 or 2,5 х 102 дрожжей и плесневых грибов на кубический сантимепф или грамм пробы.
Расчетное количество составляет 250 или 2,5 х к? дрожжей и плесневых грибов на кубический сантимепф или грамм пробы.
Пример 8
S = 1 г; V= 1; результаты подсчета, полученные для разведения 102:0 и О
(1) N = < 1/d х Vx s, <(1 /0,1) х 1 х 1, < ю дрожжей и плесневых грибов на кубический сантиметр или грамм пробы.
Расчетное количество дрожжей и плесневых грибов составляет менее 10 на кубический сантиметр или грамм пробы.
12 Нейтрализация антигрибковых свойств продукции
12.1 Общие требования
Описанные ниже процедуры демонстрируют, что микроорганизмы могут расти в условиях проведения анализа.
12.2 Приготовление инокулята
Перед проведением испытаний производят посев Candida albicans на поверхность неселективной агаризованной питательной среды Сабуро с глюкозой. Инкубируют при температуре (32,5 ±2,5) °С в течение 18-24 ч.
Стерильной петлей отбирают часть культуры и ресуспендируют в разбавителе (см. 5.2) для приготовления калиброванной суспензии с количеством клеток 1 * 103 КОЕ/см3 (количество клеток можно измерить, используя спектрофотометр); см. ISO 21148.
Используют данную суспензию и ее разведения в течение 2 ч.
12.3 Валидация методов подсчета
12.3.1 Принцип выполнения
Нейтрализованную пробу (исходную суспензию или разведение пробы, что зависит от антигрибковых свойств или низкой растворимости продукции) смешивают с разведением эталонного штамма. Высевают на чашку Петри или фильтруют через мембранный фильтр. После инкубации проверяют морфологию колоний и сравнивают полученное число колоний с контрольным посевом (без добавления пробы).
Если количество микроорганизмов составляет менее 50 % (0,3 log) от количества в контрольной пробе, модифицируют методику (используя другие разбавители, нейтрализаторы или сочетание того и другого, см. приложение D). При отсутствии роста инокулята результаты испытания признаются не- 4
ГОСТ I SO 16212-2016
действительными, если только возможная контаминация продукции данным видом микроорганизмов не является маловероятной.
12.3.2 Валидация глубинного метода посева
Смешивают 9 см3 исходной суспензии и/или ее разведения (ий) в нейтрализующем разбавителе (или в другом см. 5.2) с 1 см3 суспензии микроорганизмов, содержащих от 1000 до 3000 КОЕ/см3. Переносят 1 см3 в чашку Петри (предпочтительно в две параллельные чашки) и заливают от 15 до 20 см3 расплавленной агаризованной питательной среды (см. 5.4.2), выдержанной на водяной бане при температуре не выше 48 °С. Параллельно готовят и заливают чашку с контрольным посевом, используя тот же разбавитель и ту же суспензию микроорганизмов, но без пробы.
После инкубации в течение 3-5 сут при температуре (25 ± 2,5) °С или в альтернативных условиях (см. примечания к 4.2 и 4.3) подсчитывают колонии на чашках и сравнивают полученные результаты с результатами в контрольном посеве. Разбавитель и метод подсчета считают подходящими при разведении 1:10 (при использовании 1 см3 исходной суспензии), если количество микроорганизмов в ва-лидационном тесте не менее 50 % (0,3 log) от количества микроорганизмов в контрольном посеве.
12.3.3 Валидация поверхностного метода посева
Смешивают 9 см3 исходной суспензии в нейтрализующем разбавителе (или в другом, см. 5.2) с 1 см3 суспензии микроорганизмов, содержащих от 10000 до 30000 КОЕ/см3 (или менее, если распределят 0,5 см3 или 1 см3 суспензии). Распределяют не менее 0,1 см3 суспензии по поверхности застывшей агазированной среды (см. 5.4.2), предпочтительно в двух повторах. Параллельно готовят и заливают чашку с контрольным посевом, используя тот же разбавитель и ту же суспензию микроорганизмов, но без пробы.
После инкубации в течение 3-5 сут при температуре (25 ± 2,5) °С или в альтернативных условиях (см. примечания к 4.2 и 4.3) подсчитывают колонии на чашках и сравнивают полученные результаты с результатами в контрольном посеве. Разбавитель и метод подсчета считают подходящими при разведении 1:10 (при использовании 1 см3 исходной суспензии), если количество микроорганизмов в ва-лидационном тесте не менее 50 % (0,3 log) от количества микроорганизмов в контрольном посеве.
12.3.4 Валидация метода мембранной фильтрации
Смешивают соответствующее количество исходной суспензии или ее разведения, использованного в испытании (см. 9.3.2.3), с соответствующим количеством калиброванной суспензии микроорганизмов, количество клеток в которой соответствует приблизительно 100 КОЕ.
Фильтруют сразу же весь объем и промывают мембранный фильтр, используя необходимый объем воды (см. 5.1), разбавителя (см. 5.2.3) или нейтрализующего разбавителя (см. 5.2.2). Переносят мембранный фильтр на поверхность соответствующей агаризованной питательной среды.
Параллельно готовят контрольный посев при условиях, описанных выше, но без добавления продукции. Фильтруют и промывают контрольный мембранный фильтр при тех же условиях.
После инкубации в течение 3-5 сут при температуре (25 ± 2,5) °С или в альтернативных условиях (см. примечания к 4.2 и 4.3) производят подсчет колоний на мембранных фильтрах и сравнивают с результатами на контрольном мембранном фильтре. Метод мембранной фильтрации и разбавитель считают подходящими, если количество микроорганизмов в валидационном тесте не менее 50 % (0,3 log) от количества микроорганизмов в контрольном посеве.
13 Протокол испытаний
Протокол испытания должен содержать:
a) всю информацию, необходимую для полной идентификации продукции;
b) используемый метод;
c) полученные результаты;
d) все детали приготовления исходной суспензии;
e) описание метода с указанием использованных нейтрализующих веществ и питательных сред;
f) валидацию метода, даже если испытание проводилось отдельно;
д)любые моменты, неуказанные в настоящем стандарте или рассматриваемые как необязательные, вместе с деталями, которые могут повлиять на полученные результаты. 5
Приложение А (справочное)
Прочие нейтрализующие разбавители
А1 Общие положения
Для приготовления исходной суспензии может использоваться любой нейтрализующий разбавитель при условии, что он был проверен и подтверждена его пригодность для этой цели. Представленные ниже нейтрализующие разбавители являются примерами подходящих составов. Общие сведения о нейтрализации - см. в приложении D.
А2 Жидкий бульон Eugon LT100
А. 2.1 Общие сведения
Данная среда содержит компоненты, которые нейтрализуют ингибиторы, присутствующие в пробе (лецитин и полисорбат 80), а также диспергирующий агент (окгоксинол 9).
А. 2.2 Состав
- панкреатический гидролизат казеина 15,0 г;
- папаиновый гидролизат соевой муки 5,0 г;
- L-цистин 0,7 г;
- натрия хлорид 4,0 г;
- натрия сульфит 0,2 г;
- глюкоза 5,5 г;
- яичный лецитин 1,0 г;
- полисорбат 80 5,0 г;
- окгоксинол 9 1,0 г;
- вода 1000 см3.
А.2.3 Приготовление
Последовательно растворяют в горячей воде: полисорбат 80, окгоксинол 9 и яичный лецитин до полного растворения. Растворяют прочие компоненты, помешивая при нагревании. Разливают раствор в подходящую лабораторную посуду. Стерилизуют в автоклаве при температуре 121 °С в течение 15 мин. После стерилизации pH среды должен быть равен 7,0 ± 0,2 при измерении при комнатной температуре.
АЗ Лецитин-полисорбатный разбавитель (ЯП)
А. 3.1 Состав
-полипептон 1,0 г;
- яичный лецитин 0,7 г;
- полисорбат-80 20,0 г;
-вода 980 см3.
А.3.2 Приготовление
Смешивают и растворяют компоненты при нагревании. Охлаждают до температуры 25 °С перед разливкой раствора в подходящую лабораторную посуду. Стерилизуют в автоклаве при температуре 121 °С в течение 15 мин. После стерилизации pH среды должен быть равен 7,2 ± 0,2 при измерении при комнатной температуре.
ГОСТ I SO 16212-2016
Приложение В (справочное)
Прочие разбавители
В.1 Общие положения
Для приготовления исходной суспензии может использоваться любой разбавитель при условии, что он был проверен и подтверждена его пригодность для этой цели. Представленный ниже разбавитель является примером подходящего состава.
В.2 Буферный пептоновый раствор (pH 7)
В.2.1 Состав
1,0 г;
4,3 г;
3,6 г;
7,2 г; 1000 см .
- мясной пептон
- натрия хлорид
- однозамещенный фосфорнокислый калий
- двузамещенный фосфорнокислый двуводный натрий
- вода
В.2.2 Приготовление
Растворяют компоненты в горячей воде. Перемешивают и охлаждают до температуры 25 °С перед разливкой раствора в подходящую лабораторную посуду. Стерилизуют в автоклаве при температуре 121 °С в течение 15 мин. После стерилизации pH среды должен быть равен 7,1 ± 0,2 при измерении при комнатной температуре.
В.З Фосфатный буфер (pH 7,2)
В.3.1 Состав
- однозамещенный фосфорнокислый калий 34 г;
- вода 500 см3.
В.З.2 Приготовление
Растворяют компоненты в воде в мерной колбе объемом 1000 см3. Доводят значение pH до 7,2 ± 0,1 путем добавления приблизительно 175 см3 раствора гидроксида натрия (4,3 г /100 см3).
Доливая воду, доводят окончательный объем раствора до 1000 см3. Окончательная концентрация фосфатного раствора должна составлять 0,05 моль/дм3. Полученный раствор используют как маточный. Хранят охлажденным.
Перед использованием разводят маточный раствор водой в пропорции 1:800 и стерилизуют в автоклаве при температуре 121 °С в течение 15 мин.
11
Приложение С (справочное)
Прочие питательные среды
С.1 Общие положения
Может использоваться любая питательная среда при условии, что она была проверена и подтверждена ее пригодность для этой цели. Описанные ниже питательные среды являются примерами таких допустимых составов.
С.2 Агар для подсчета
С.2.1 Питательная среда на основе картофельного агара с глюкозой с добавлением
антибиотиков
С.2.1.1 Состав
- картофельный экстракт 4,0 г;
- глюкоза 20,0 г;
- агар 15,0 г;
- хлорамфеникол 0,05 г;
- вода 1000 см3.
С.2.1.2 Приготовление
Перемешивают все компоненты и разливают питательную среду в подходящую лабораторную посуду. Стерилизуют в автоклаве при температуре 121 °С в течение 15 мин. После стерилизации и охлаждения pH должен быть равен 5,6 ± 0,2 при измерении при комнатной температуре.
В качестве альтернативы применяемый хлорамфеникол может быть заменен 0,10 г бензилпени-циллина калия и 0,10 г тетрациклина на кубический дециметр питательной среды, которые добавляются в виде стерильного раствора непосредственно перед применением.
20.0 г;
2.0 г;
0,5 г;
5.0 г;
1.0 г;
15.0 г; 0,05 г; 1000 см .
С.2.2 Глюкозно-пепгоновая (ГП) агаризованная среда с антибиотиками С.2.2.1 Состав
- глюкоза
- дрожжевой экстракт
- магния сульфат
- пептон
- однозамещенный фосфорнокислый калий
- агар
- хлорамфеникол
- вода
С.2.2.2 Приготовление
Перемешивают все компоненты и разливают питательную среду в подходящую лабораторную посуду. Стерилизуют в автоклаве при температуре 121 °С в течение 15 мин. После стерилизации и охлаждения pH должен быть равен 5,7 ± 0,1 при измерении при комнатной температуре.
В качестве альтернативы применяемый хлорамфеникол может быть заменен 0,10 г бензилпени-циллина калия и 0,10 г тетрациклина на кубический дециметр питательной среды, которые добавляются в виде стерильного раствора непосредственно перед применением.
С.З Солодовая питательная среда
С. 3.1 Состав
- солодовый экстракт 30,0 г;
- соевый пептон, папаиновый гидролизат соевой муки 3,0 г;
- агар 15,0 г;
- хлорамфеникол 0,05 г;
- вода 1000 см3.
12
ГОСТ I SO 16212-2016
C.3.2 Приготовление
Компоненты (включая хлорамфеникол) или сухую готовую среду растворяют в нагретой воде. Разливают питательную среду в подходящую лабораторную посуду. Стерилизуют в автоклаве при температуре 115 °С в течение 10 мин. После стерилизации pH раствора должен быть равен 5,6 ± 0,2 при измерении при комнатной температуре.
13
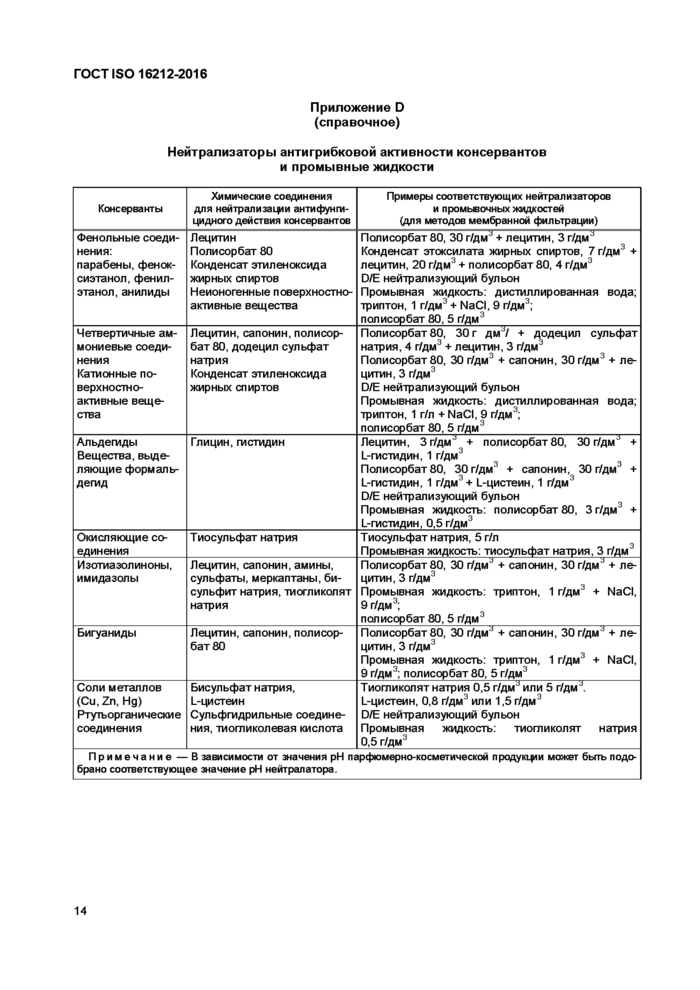
Приложение D (справочное)
Нейтрализаторы антигрибковой активности консервантов и промывные жидкости
|
Консерванты |
Химические соединения для нейтрализации антифунпл-цидного действия консервантов |
Примеры соответствующих нейтрализаторов и промывочных жидкостей (для методов мембранной фильтрации) |
|
Фенольные соединения: парабены, фенок-сиэтанол,фенил-этанол, анилиды |
Лецитин Полисорбат 80 Конденсат этилен оксид а жирных спиртов Неионогенные поверхностноактивные вещества |
Полисорбат 80, 30 г/дм" + лецитин, 3 г/дм" Конденсат этокси лата жирных спиртов, 7 г/дм3 + лецитин, 20 г/дм3 + полисорбат 80, 4 г/дм3 D/Е нейтрализующий бульон Промывная жидкость: дистиллированная вода; триптон, 1 г/дм3 + NaCI, 9 г/дм3; полисорбат 80, 5 г/дм3 |
|
Четвертичные аммониевые соединения Катионные поверхностно-активные вещества |
Лецитин, сапонин, полисор-бат 80, додецил сульфат натрия Конденсат этилен оксид а жирных спиртов |
Полисорбат 80, 30 г дм3/ + додецил сульфат натрия, 4 г/дм3 + лецитин, 3 г/дм3 Полисорбат 80, 30 г/дм3 + сапонин, 30 г/дм3 + лецитин, 3 г/дм3 D/Е нейтрализующий бульон Промывная жидкость: дистиллированная вода; триптон, 1 г/л + NaCI, 9 г/дм3; полисорбат 80, 5 г/дм3 |
|
Альдегиды Вещества, выделяющие формальдегид |
Глицин, гистидин |
Лецитин, Зг/дм3 + полисорбат 80, 30 г/дм3 + L-гистидин, 1 г/дм3 Полисорбат 80, 30 г/дм3 + сапонин, 30 г/дм3 + L-гистидин, 1 г/дм3+ L-цистеин, 1 г/дм3 D/Е нейтрализующий бульон Промывная жидкость: полисорбат 80, 3 г/дм3 + L-гистидин, 0,5 г/дм3 |
|
Окисляющие соединения |
Тиосульфат натрия |
Тиосульфат натрия, 5 г/л Промывная жидкость: тиосульфат натрия, 3 г/дм3 |
|
И зотиазол ин оны, имидазолы |
Лецитин, сапонин, амины, сульфаты, меркаптаны, бисульфит натрия, ти огл и копят натрия |
Полисорбат 80, 30 г/дм3 + сапонин, 30 г/дм3 + лецитин, 3 г/дм3 Промывная жидкость: триптон, 1 г/дм3 + NaCI, 9 г/дм3; полисорбат 80, 5 г/дм3 |
|
Бигуаниды |
Лецитин, сапонин, полисор-бат80 |
Полисорбат 80, 30 г/дм3 + сапонин, 30 г/дм3 + лецитин, 3 г/дм3 Промывная жидкость: триптон, 1 г/дм3 + NaCI, 9 г/дм3; полисорбат 80, 5 г/дм3 |
|
Соли металлов (Си, Zn, Hg) Ртутъорганические соединения |
Бисульфат натрия, L-цистеин Сульфгидрильные соединения, тиогликолевая кислота |
Тиогликолят натрия 0,5 г/дм3 или 5 г/дм3. L-цистеин, 0,8 г/дм3 или 1,5 г/дм3 D/Е нейтрализующий бульон Промывная жидкость: тиогликолят натрия 0,5 г/дм3 |
|
Примечание — В зависимости от значения pH парфюмерно-косметической продукции может быть подобрано соответствующее значение pH нейтралатора. | ||
ГОСТ I SO 16212-2016
Библиография
[1][2]
[3]
[4]
[5]
[6]
[7]
[8]
[9]
CO LI PA, Guidelines on Microbial Quality Management, 1997, published by the European Cosmetic, Toiletry and Perfumery Association (COLIPA)
(Руководство по менеджменту качества в микробиологии)
CTFA, Microbioloey Guidelines, 2001, published by the Cosmetic, Toiletry and Fragrance Association, ISBN 1-882621-32-8 (Руководство по микробиологии)
EP, Microbiological Examination of non-sterile products, 4th edition, 2002, published by the European Pharmacopoeia
(Микробиологический анализ нестерильной продукции)
FDA, Bacteriological Analytical Manual, 8th edition, 1995 published by the U.S. Food and Drug Ad m in istration, http ://www. cfsan .fda. gov/~ebam /b am -23 .htm I (Руководство по бактериологическому анализу)
JP 14, General Tests — Microbial Limit Test, 2001, published by the Japanese Pharmacopoeia Общие испытания. Испытания на предельное содержание микроорганизмов)
USP 28, Microbial Limit Test (61), 2005, published by the U.S. Pharmacopoeia (Испытания на предельное содержание микроорганизмов)
Atlas, R. М. Flandbook of Microbiological Media, CRC Press, 1993, ISBN 0-8493-2944-2 (Справочник по микробиологическим средам)
Singer, S. The Use of Preservative Neutralizers in Diluents and Plating Media, Cosmetics and Toiletries, 102, December 1987, p. 55
(Применение нейтрализаторов консервантов в разбавителях и средах для чашек Петри, косметике и туалетных принадлежностях)
ISO 18415:2007
[10][11]
ISO 18416:2007 EN 13624:2003
Cosmetics— Microbiology— Detection of specified microorganisms (Staphylococcus aureus, Escherichia coli, Pseudomonas aeruginosa, Candida albicans,) and non-specified microorganisms (Косметика. Микробиология. Обнаружение специфических и неспецифических микроорганизмов)
Cosmetics — Microbiology — Detection of Candida albicans (Косметика. Микробиология. Обнаружение Candida albicans)
Chemical disinfectants and antiseptics — Quantitative suspension test for the evaluation of fungicidal activity of chemical disinfectants for instruments used in the medical area— Test method and requirements (phase 2, step 1)
(Средства дезинфицирующие химические и антисептики. Количественный суспензионный метод испытания для оценки фунгицидного действия химических дезинфицирующих средств на медицинские инструменты. Метод испытания и требования (фаза 2, ступень 1))
15
Приложение Д.А (справочное)
Сведения о соответствии государственных стандартов ссылочным международному и европейскому стандартам
|
Таблица Д.А.1 | |||||||||
|
16
УДК 665.57/.58:579.63.083.12(083.74)(476) МКС 71.100.70 IDT
Ключевые слова: продукция парфюмерно-косметическая, микробиологические исследования, микроорганизмы, разбавители, питательные среды, штаммы микроорганизмов
17
ГОСТ I SO 16212-2016
Информация о введении в действие (прекращении действия) настоящего стандарта и изменений к нему на территории указанных выше государств публикуется в указателях национальных (государственных) стандартов, издаваемых в этих государствах, а также в сети Интернет на сайтах соответствующих национальных (государственных) органов по стандартизации.
Ответственный за выпуск Н. А. Баранов
Сдано в набор 19.10.2016. Подписано в печать 02.11.2016. Формат бумаги 60x64/8. Бумага офсетная. Гарнитура Arial. Печать ризографическая. Усл.печ.л.2,56 Уч -изд. л. 1,10 Тираж2 экз. Заказ 1983
Издатель и полиграфическое исполнение:
Научно-производственное республиканское унитарное предприятие «Белорусский государственный институт стандартизации и сертификации» (БелГИСС) Свидетельство о государственной регистрации издателя, изготовителя, распространителя печатных изданий
№ 1/303 от 22.04.2014 ул. Мел ежа, 3, комн. 406, 220113, Минск.
ГОСУДАРСТВЕННЫЙ СТАНДАРТ РЕСПУБЛИКИ БЕЛАРУСЬ
Продукция парфюмерно-косметическая МИКРОБИОЛОГИЯ Подсчет дрожжей и плесневых грибов
Прадукцыя парфумерна-касметычная М1КРАБ1ЯЛОГ1Я Падлн< дражджэй i плесневых грыбоу
Perfume and cosmetic products Microbiology Detection of yeast and mould
Дата введения — 2017-04-01
1 Область применения
Настоящий стандарт устанавливает метод определения количества дрожжей и плесневых грибов, содержащихся в парфюмерно-косметической продукции, путем подсчета колоний на избирательной агаризованной питательной среде после инкубации в аэробных условиях.
Чтобы обеспечить качество и безопасность продукции для потребителя, рекомендуется проводить соответствующий анализ микробиологического риска с целью определения видов парфюмернокосметической продукции, к которой применим настоящий стандарт. К продукции с низкой степенью микробиологического риска относится продукция с низкой водной активностью, продукция на спиртовой основе, продукция с крайними значениями pH и т. д.
Из-за большого разнообразия парфюмерно-косметической продукции в рассматриваемой области применения отдельные детали данного метода могут быть непригодными для некоторых видов продукции (например, для нерастворимой в воде продукции). Установленный в настоящем стандарте метод испытания можно заменить другими методами (например, автоматизированными) при условии, что была продемонстрирована их равнозначность или что альтернативный метод валидирован другим образом.
Подсчитанные дрожжи могут быть идентифицированы с помощью соответствующих идентифицирующих тестов, например, таких, какие описаны в [9], [10]. Идентификация подсчитанных плесневых грибов при необходимости проводится с помощью других подходящих тестов.
2 Нормативные ссылки
Для применения настоящего стандарта необходимы следующие ссылочные стандарты. Для датированных ссылок применяют только указанное издание ссылочного стандарта, для недатированных ссылок применяют последнее издание ссылочного стандарта (включая все его изменения).
ISO 21148:2005 Cosmetics— Microbiology— General instructions for microbiological examination (Косметика. Микробиология. Общие указания по микробиологическому контролю)
EN 12353:2013 Chemical disinfectants and antiseptics— Preservation of test organisms used for the determination of bactericidal (including Legionella), mycobactericidal, sporicidal, fungicidal and virucidal (including bacteriophages) activity (Средства дезинфицирующие химические и антисептики. Консервация тест-микроорганизмов, используемых для определения бактерицидной (включая микроорганизмы Legionella), микобакгерицидной, спорицидной, фунгицидной и вируцидной (включая бактериофаги) активности)
3 Термины и определения
В настоящем стандарте применены следующие термины с соответствующими определениями:
3.1 дрожжи (yeast): Одноклеточные грибы, размножающиеся преимущественно вегетативно, почкованием, и способные к росту в условиях испытаний, предусмотренных настоящим стандартом.
3.2 плесневые грибы (mould): Микроскопические грибы, включая споры и конидии, образующие мицелий и способные к росту в условиях испытаний, предусмотренных настоящим стандартом.
Издание официальное
3.3 продукция (product): Часть идентифицированной парфюмерно-косметической продукции, полученная лабораторией для испытания (анализа).
3.4 проба (sample): Часть продукции в количестве не менее 1 г или 1 см3, которая используется при проведении испытаний для приготовления исходной суспензии.
3.5 исходная суспензия (initial suspension): Суспензия (или раствор) пробы в определенном объеме соответствующей жидкости (разбавитель, нейтрализатор, бульон или их сочетание).
3.6 разведение пробы (sample dilution): Разведение исходной суспензии.
4 Принцип
4.1 Общие требования
Настоящий метод предусматривает количественное определение колоний на селективной агари-зованной питательной среде. Вероятное ингибирование роста грибов пробой должно быть нейтрализовано, чтобы можно было обнаружить все жизнеспособные микроорганизмы (см. [2]). Во всех случаях и вне зависимости от применяемого метода нейтрализация антигрибковых свойств продукции должна быть проверена и валидирована (см. [3], [5], [6]).
4.2 Чашечный метод
Чашечный метод включает несколько этапов.
a) Подготовка чашек для глубинного или поверхностного посева с использованием указанной питательной среды и посев определенного количества исходной суспензии или разведения продукции.
b) Аэробная инкубация посевов при температуре (25 ± 2,5) °С в течение 3-5 сут.
c) Подсчет количества колониеобразующих единиц (КОЕ) и вычисление количества дрожжей и плесневых грибов в одном кубическом сантиметре или грамме продукции.
Примечание — Альтернативные условия инкубации— при температуре (22,5±2,5)°С в течение 5-7 сут при использовании питательной среды, не содержащей антибиотик.
4.3 Мембранная фильтрация
Метод мембранной фильтрации включает несколько этапов.
a) Перенос соответствующего количества пробы, установленного методом валидации, в фильтровальный аппарат, увлажненный небольшим количеством соответствующего стерильного разбавителя. Немедленной фильтрации и промывкой согласно установленной процедуре. Перенос мембранного фильтра на поверхность указанной агар изованн ой питательной среды, как установлено в ISO 21148.
b) Аэробная инкубация чашек при температуре (25 ± 2,5) °С в течение 3-5 сут.
c) Подсчет количества колониеобразующих единиц (КОЕ) и вычисление количества дрожжей и плесневых грибов в одном кубическом сантиметре или грамме продукции.
Примечание — Альтернативные условия инкубирования — при температуре (22,5 ± 2,5) °С в течение 5-7 сут при использовании питательной среды, не содержащей антибиотик.
5 Разбавители, нейтрализаторы и питательные среды
5.1 Общие положения
Общие требования приведены в ISO 21148. Если в настоящем стандарте упоминается вода, то это означает, что применяют дистиллированную или очищенную воду, как установлено в ISO 21148.
Для количественного определения дрожжей и плесневых грибов могут применяться разбавители, нейтрализаторы и питательные среды, перечисленные ниже. Прочие разбавители, нейтрализаторы и питательные среды могут быть использованы в случае подтверждения их пригодности для этой цели.
5.2 Нейтрализующие разбавители и разбавители
5.2.1 Общие положения
Разбавитель используют для диспергирования пробы. Он может содержать в себе нейтрализаторы, в случае если сама проба обладает антигрибковыми свойствами. Эффективность нейтрализации должна быть подтверждена до начала количественного определения (см. раздел 12). Сведения о пригодных для использования нейтрализаторах см. в приложении D.
ГОСТ I SO 16212-2016
5.2.2 Нейтрализующий разбавитель
полисорбатом 20 (бульон SCDLP 20)
5.2.2.1.1 Состав
- панкреатический гидролизат казеина 20,0 г;
- соевый лецитин 5,0 г;
- полисорбат 20 40 см6;
- вода 960 см6.
5.2.2.1.2 Приготовление
5.2.2.1 Жидкая питательная среда с гидролизатом казеина, соевым лецитином и
Полисорбат 20 растворяют в 960 см6 воды, перемешивая при нагревании на водяной бане при температуре (49±2)°С. Добавляют панкреатический гидролизат казеина и соевый лецитин. Нагревают в течение 30 мин до получения раствора. Перемешивают питательную среду и разливают в подходящую лабораторную посуду. Стерилизуют в автоклаве при температуре 121 °С в течение 15 мин. После стерилизации значение pH раствора, измеренное при комнатной температуре, должно составлять 7,3 ± 0,2.
5.2.2.2 Прочие нейтрализующие разбавители
При необходимости могут использоваться прочие нейтрализующие разбавители (см. приложение А и приложение D).
5.2.3 Разбавитель
5.2.3.1 Жидкость А
5.2.3.1.1 Состав
- п епти чески й гид рол и зат животн ой ткан и 1,0 г;
-вода до 1000 см6.
5.2.3.1.2 Приготовление
1 г пептона разводят в воде до получения объема 1 дм6. Нагревают, интенсивно помешивая. Разливают в подходящую лабораторную посуду. Стерилизуют в автоклаве при температуре 121 °С в течение 15 мин. После стерилизации значение pH раствора, измеренное при комнатной температуре, должно составлять 7,1 ±0,2.
5.2.3.2 Прочие разбавители
При необходимости могут использоваться прочие разбавители (см. приложение В).
5.3 Разбавитель для дрожжевой суспензии (раствор с триптоном и хлоридом натрия)
5.3.1 Состав
- триптон, панкреатический гидролизат казеина 1,00 г;
- натрия хлорид 8,50 г;
-вода 1000 см6.
5.3.2 Приготовление
Компоненты разводят в воде, помешивая при нагревании. Разливают в подходящую лабораторную посуду. Стерилизуют в автоклаве при температуре 121 °С в течение 15 мин. После стерилизации значение pH раствора, измеренное при комнатной температуре, должно составлять 7,0 ± 0,2.
5.4 Питательные среды
5.4.1 Общие требования
Питательные среды могут быть приготовлены, как описано ниже или из сухих питательных сред в соответствии с инструкциями изготовителя. Могут применяться уже готовые к использованию питательные среды, при условии, что они имеют подобный состав и/или обеспечивают показатель прорастания сравнимый с описанными ниже средами.
5.4.2 Агаризованная среда Сабуро с глюкозой и хлорамфениколом (SDCA)
5.4.2.1 Состав
- глюкоза 40,0 г;
- пептический гидролизат животной ткани 5,0 г;
- панкреатический гидролизат казеина 5,0 г;
- хл ор ам фен и кол 0,050 г;
-агар 15,0 г;
- вода 1000 см3.
5.4.2.2 Приготовление
Компоненты (включая хлорамфеникол) или сухую готовую питательную среду растворяют в воде, помешивая при нагревании. Разливают питательную среду в подходящую лабораторную посуду. Стерилизуют питательную среду в автоклаве при температуре 121 °С в течение 15 мин. После стерилизации значение pH среды, измеренное при комнатной температуре, должно составлять 5,6 ± 0,2.
Примечание — При работе с известными и не зараженными микроорганизмами продуктами используют питательные среды без добавления хлорамфеникол а.
5.4.3 Прочие питательные среды
При необходимости могут использоваться прочие питательные среды (см. приложение С).
Сабуро с глюкозой (SDA)
5.4.4.1 Состав
- глюкоза 40,0 г;
- пептический гидролизат животной ткани 5,0 г;
- панкреатический гидролизат казеина 5,0 г;
- агар 15,0 г;
- вода 1000 см3.
5.4.4.2 Приготовление
5.4.4 Агаризованная среда для культивирования эталонного штамма. Агаризованная среда
Компоненты или сухую готовую питательную среду растворяют в воде, помешивая при нагревании. Разливают питательную среду в подходящую лабораторную посуду. Стерилизуют питательную среду в автоклаве при температуре 121 °С в течение 15 мин. После стерилизации значение pH среды, измеренное при комнатной температуре, должно составлять 5,6 ± 0,2.
6 Инструменты и стеклянная лабораторная посуда
Лабораторное оборудование, инструменты и стеклянная посуда должны соответствовать ISO 21148.
7 Штаммы микроорганизмов
Для проверки эффективности нейтрализаторов используется эталонный штамм дрожжей.
Candida albicans АТСС10231 (эквивалентный штамм: IP7 8 48.72, или NCPF93179, или NBRC10 1594, или КСТС 11 17205, TISTR 12 5779, или другой эквивалентный штамм из национальной коллекции).
Выбранный штамм дрожжей считается более восприимчивым к антигрибковому действию, чем плесневые грибы, и может выступать в качестве представительного микроорганизма для грибов (дрожжей и плесени) при проведении валидации методов. Тем не менее, в особых случаях испытания эффективности нейтрализаторов могут при необходимости проводиться на дополнительном эталонном штамме плесневых грибов с использованием соответствующего протокола для приготовления калиброванного инокулята (см., например, [11], (подпункт 5.4.1.4).
Восстановление культуры осуществляется в порядке, предусмотренном поставщиком эталонного штамма. Штаммы могут храниться в лаборатории согласно EN 12353.
8 Обращение с па рфю мерно-кос мети ческой продукцией и лабораторными пробами
При необходимости продукцию, подлежащую испытаниям, хранят при комнатной температуре.
ГОСТ I SO 16212-2016
He следует выдерживать в термостате, охлаждать и замораживать продукцию (3.3) и пробы (3.4) ни до, ни после анализа.
Отбор и подготовку проб парфюмерно-косметической продукции для анализа следует проводить в соответствии с ISO 21148. Анализируют пробы, как описано в ISO 21148 и согласно методике, приведенной в разделе 9.
9 Методика
9.1 Общие положения
Для подготовки пробы, приготовления исходной суспензии и разведений используют стерильные материалы, оборудование и асептические методы. В случае приготовления исходной суспензии в подходящем разбавителе время между окончанием приготовления суспензии и моментом ее внесения в питательную среду не должно превышать 45 мин, если другое не оговорено в соответствующих протоколах или документах.
9.2 Приготовление исходной суспензии
9.2.1 Общие положения
Исходную суспензию готовят из пробы в количестве не менее 1 г или 1 см3 хорошо перемешанной анализируемой продукции.
Отмечают S, точную массу или точный объем пробы.
Концентрация исходной суспензии обычно составляет 1:10. Более значительные количества разбавителя могут потребоваться, если предполагается высокий уровень заражения продукции и/или в растворе с концентрацией 1:10 все еще проявляются антигрибковые свойства.
9.2.2 Водорастворимая продукция
Переносят количество S пробы продукции в соответствующий объем (например, 9 см3) нейтрализующего разбавителя (см. 5.2.2) или разбавителя (см. 5.2.3).
Регистрируют коэффициент разведения, обозначаемый символом d.
9.2.3 Нерастворимая в воде продукция
Переносят количество S пробы продукции в подходящую лабораторную посуду, содержащую достаточное количество солюбилизатора (например, полисорбатвО). Растворяют пробу в солюбилизаторе и добавляют соответствующее количество (например, 9 см3) нейтрализующего разбавителя (см. 5.2.2) или обычного разбавителя (см. 5.2.3).
Регистрируют коэффициент разведения, обозначаемый символом d.
9.3 Методы подсчета
9.3.1 Разведения для применяемых методов подсчета
Обычно исходная суспензия рассматривается как первое разведение, в котором выполняется подсчет. При необходимости могут выполняться дополнительные последовательные разведения (например, 1:10) исходной суспензии с применением того же самого разбавителя (в зависимости от предполагаемого уровня заражения продукции).
Как правило, подсчет проводят, используя не менее двух параллельных чашек Петри, однако существует возможность использовать лишь одну чашку Петри при проведении рутинных испытаний или если подсчет выполняется на последовательных разведениях одной и той же пробы, или исходя из ранее полученных результатов.
9.3.2 Чашечные методы
9.3.2.1 Посев глубинным методом
В чашки Петри диаметром от 85 до 100 мм добавляют 1 см3 исходной суспензии и/или разведения пробы, установленных методом валидации (см. раздел 12), и заливают 15-20 см3 расплавленной агаризованной питательной среды (см. 5.4.2), которая поддерживалась в таком состоянии на водяной бане при температуре не выше 48 °С. При использовании чашек Петри большего диаметра количество агаризованной питательной среды пропорционально увеличивают.
Смешивают исходную суспензию и/или разведение пробы с питательной средой, осторожно вращая или наклоняя чашки для ее равномерного распределения. Дают среде в чашках Петри застыть на горизонтальной поверхности при комнатной температуре. 13
9.3.2.2 Посев поверхностным методом
В чашки Петри диаметром от 85 до 100 мм помещают от 15 до 20 см3 расплавленной агаризован-ной питательной среды (см. 5.4.2), которая поддерживалась в таком состоянии на водяной бане при температуре не выше 48 °С. При использовании чашек Петри большего диаметра количество агари-зованной питательной среды пропорционально увеличивают.
Дают среде застыть в чашках, например, поместив их в ламинарный бокс или в термостат. Распределяют по поверхности среды измеренное количество, но не менее 0,1 см3 исходной суспензии и/или разведения пробы, приготовленных в соответствии с валидировэнным методом (см. раздел 12).
9.3.2.3 Метод мембранной фильтрации
Используют мембранный фильтр с номинальным размером пор не более 0,45 мкм.
Переносят соответствующее количество исходной суспензии или разведения пробы, приготовленного соответствующим образом (предпочтительно не менее 1 гили 1 см3 продукции) на фильтр.
Сразу же выполняют фильтрацию и промывают мембрану (соблюдая порядок, определенный при валидации, см. раздел 12).
Переносят мембрану на поверхность агаризованной питательной среды (см. 5.4.2).
9.3.2.4 Инкубация
Если не указано другое, переворачивают инокулированные чашки вверх дном и помещают их в термостат, поддерживающий температуру (25 ± 2,5) °С, на срок от 3 до 5 сут или в альтернативных условиях (см. примечания к 4.2 и 4.3). После инкубации чашек следует (по возможности) немедленно приступить к подсчету. В противном случае, если не указано иное, чашки можно оставить на хранение на срок, не превышающий 24 ч, в холодильнике при температуре (5 ± 3) °С.
Примечание 1 — В некоторых случаях, если существует вероятность того, что частицы продукции будут приняты за колонии, целесообразно подготовить дополнительные чашки, содержащие те же разведения пробы, и агаризованую питательную среду, которые хранят в холодильнике для сравнения с инкубированными чашками.
Примечание 2— В случае подозрений на присутствие в пробе одновременно дрожжей и плесневых грибов, могут проводиться соответствующие промежуточные проверки.
10 Подсчет колоний (чашечный метод и метод мембранной фильтрации)
После инкубации подсчитывают колонии:
-на чашках Петри, содержащих от 15 до 150 колоний; если насчитывается менее 15колоний, см. 11.2.3;
-на мембранах, содержащих от 15 до 150 колоний; если насчитывается менее 15 колоний, см. 11.2.3.
11 Выражение результатов
11.1 Метод подсчета при посеве чашечным методом
Вычисляют количество N микроорганизмов, присутствующих в пробе S, используя:
- m —среднее арифметическое колоний подсчитанных на параллельных чашках (1),
- с — количество колоний, подсчитанных на одиночной чашке (2) или
- wm — среднее взвешенное колоний, полученное из двух последовательных разведений (3), по следующим формулам:
N=mf(V*cl) (1)
N=cf(V*d) (2)
N=wmf(V*d), (3)
где т — среднее арифметическое колоний подсчитанных на параллельных чашках;
V — объем инокулята, внесенного в каждую чашку, см3;
d — коэффициент разведения, соответствующий разведению, сделанному для получения исходной суспензии (см. 9.2), или первому разведению, для которого выполняется подсчет;
с — количество колоний, подсчитанных на одиночной чашке. 14
ГОСТ I SO 16212-2016
Среднее взвешенное колоний, полученное из двух последовательных разведений хс, задается формулой
- Zc Хс (л1 + 0,1л2)’
где — сумма колоний, подсчитанных на всех чашках, выбранных для подсчета из двух последовательных разведений;
л1 —количество чашек, использованных для подсчета количества микроорганизмов в исходной суспензии (или в первом из подсчитанных разведений);
л2 —количество чашек, на которых подсчитано количество микроорганизмов для 1СГ1 разведений исходной суспензии (или для второго подсчитанного разведения).
Округляют результат вычислений до двух значащих цифр после запятой. При этом, если последняя цифра менее 5, предшествующая ей цифра не изменяется; если последняя цифра 5 или более, предшествующую цифру увеличивают на единицу. Выполняют описанные действия последовательно до получения двух значащих цифр после запятой. Отмечают полученное значение N.
11.2 Интерпретация результатов
11.2.1 Необходимо принимать во внимание изменчивость, которая свойственна чашечным методам. Два результата должны рассматриваться как различные только тогда, когда разность между ними превышает 50 % или когда эта разность, выраженная логарифмически, превышает 0,3 log.
Для более точного подсчета учитывают только чашки или мембранные фильтры, на которых содержится не менее 15 и не более 150 колоний. Проверяют, чтобы подсчеты были получены из разведений, подтвержденных путем валидации выбранного метода (см. раздел 12).
11.2.2 В случае когда количество КОЕ на чашках или мембранных фильтрах составляет более 15 и менее 150, результат должен быть представлен следующим образом:
- если значение S составляет не менее 1 г или 1 см3 и значение V не менее 1 см3, то количество дрожжей и плесневых грибов на кубический сантиметр или грамм пробы равняется A//S;
-если значение S составляет менее 1 г или 1 см3 и/или значение V менее 1 см3, то количество дрожжей и плесневых грибов в пробе (необходимо отметить испытуемое количество пробы с учетом значений S и V) равняется N,
где значение S соответствует массе или объему пробы (см. 9.2).
Результат должен быть представлен числом в интервале между 1,0 и 9,9, умноженным на 10 в соответствующей степени (см. примеры).
11.2.3 В случае когда количество КОЕ на чашках или мембранных фильтрах составляет менее 15, результат должен быть представлен следующим образом:
- если значение S составляет не менее 1 г или 1 см3, а значение V не менее 1 см3, расчетное количество дрожжей и плесневых грибов на кубический сантиметр или грамм пробы равняется A//S;
- если значение S составляет менее 1 г или 1 см3 и/или V менее чем 1 см3, расчетное количество дрожжей и плесени в пробе равняется N,
где значение S соответствует массе или объему пробы (см. 9.2).
Результат должен быть представлен числом в интервале между 1,0 и 9,9, умноженным на 10 в соответствующей степени (см. примеры).
11.2.4 В случае когда колонии небыли обнаружены, результат должен быть представлен следующим образом:
- количество дрожжей и плесневых грибов составляет менее 1/d * V * S на грамм или кубический сантиметр продукции (SHe менее 1 г или 1 см3);
- количество дрожжей и плесневых грибов в пробе S составляет менее 1/d* V (необходимо отметить испытуемое количество пробы с учетом значений S и V) (S менее 1 г или 1 см3),
где d — коэффициент разбавления исходной суспензии (см. 9.2);
V—равен 1 (для метода с использованием глубинного посева и для мембранной фильтрации) или 0,1 (для подсчета при поверхностном посеве) (см. пример).
Пример 1 —Две чашки для одного разведения
S=1 г; V = /; результаты подсчета, полученные для разведения КГ1:38 и 42
(1) N= т/р/х d) = 40/(1 х 101) = 40/0,1 = 400 или 4 х 102 дрожжей и плесневых грибов на кубический сантиметр или грамм пробы.
Пример 2 - Одна чашка для одного разведения
S= 1 г; V= 1; результаты подсчета, полученные для разведения 10 :60 15
1
Настоящий стандарт идентичен международному стандарту IS0 16212:2008 Cosmetics — Microbiology— Enumeration of yeast and mould (Косметика. Микробиология. Подсчет дрожжей и плесени).
Международный стандарт разработан техническим комитетом по стандартизации ISO/TC217 «Косметика» Международной организации по стандартизации (ISO).
Перевод с английского языка (еп).
Официальные экземпляры международного стандарта, на основе которого подготовлен настоящий государственный стандарт, и международного и европейского стандартов, на которые даны ссылки, имеются в Национальном фонде ТИПА.
В разделе «Нормативные ссылки» и тексте стандарта ссылки на международный и европейский стандарты актуализированы.
В стандарт внесены следующие редакционные изменения:
- наименование настоящего стандарта изменено относительно наименования международного стандарта с целью применения обобщающего понятия в наименовании стандарта в соответствии с ГОСТ 1.5-2001;
- единица измерения миллилитр (мл) заменена на кубический сантиметр (см3); единица измерения литр (л) заменена на кубический дециметр (дм3).
Сведения о соответствии государственных стандартов ссылочным международному и европейскому стандартам приведены в дополнительном приложении Д.А.
Степень соответствия — идентичная (ЮТ)
2
ВВЕДЕН ВДЕЙСТВИЕ постановлением Госстандарта Республики Беларусь от 19августа2016г. № 66 непосредственно в качестве государственного стандарта Республики Беларусь с 1 апреля 2017 г.
3
ВВЕДЕН ВПЕРВЫЕ
© Госстандарт, 2016
Настоящий стандарт не может быть воспроизведен, тиражирован и распространен в качестве официального издания без разрешения Госстандарта Республики Беларусь
4
5
6
7
г> АТСС — Американская коллекция культур.
8
IP — Институт Пастера.
9
3> NCPF — Национальная коллекция патогенных грибов.
10
NBRC — Национальный центр биологических ресурсов.
11
5> КСТС — Корейская коллекция типовых культур.
12
е> TISTR — Таиландский институт научно-технических исследований.
13
14
15