ГОСТ ISO 11137-2-2011
Стерилизация медицинской продукции. Радиационная стерилизация. Часть 2. Установление стерилизующей дозы
Устанавливает методы определения дозы, необходимой для удовлетворения установленного требования к стерильности, и методы для обоснования значений 25 или 15 кГр как стерилизующей дозы для достижения уровня обеспечения стерильности (УС) 10 в степени минус 6. Стандарт устанавливает методы проведения проверки дозы, для того чтобы продемонстрировать непрерывную эффективность стерилизующей дозы. В стандарте определяются серии продукции/продуктов для установления дозы и проверки дозы.
Идентичен ISO 11137-2:2006.
Оглавление
1 Область применения
2 Нормативные ссылки
3 Термины, определения и обозначения
3.1 Термины и определения
3.2 Обозначения
4 Определение и техническое обслуживание серии продукции для установления, обоснования и проверки стерилизующей дозы
4.1 Общие вопросы
4.2 Определение серийности продукции
4.3 Обозначение продукта, представляющего серию продукции для проведения эксперимента с проверочной дозой или проверки стерилизующей дозы
4.4 Техническое обслуживание серии продукции
4.5 Действия в случае обнаружения несоответствия стерилизующей дозы для серии продукции
5 Выбор и испытание продукции для установления и проверки стерилизующей дозы
5.1 Характеристика продукции
5.2 Часть продукции для испытания (ЧПИ)
5.3 Метод отбора образцов
5.4 Микробиологические испытания
5.5 Облучение
6 Методы установления дозы
7 Метод 1: установление дозы с использованием информации о бионагрузке
7.1 Обоснование
7.2 Порядок осуществления действий по методу 1 для продукции со средней бионагрузкой >=1,0 для нескольких партий продукции
7.3 Порядок осуществления действий по методу 1 для продукции со средней бионагрузкой >=1,0 для единичной партии продукции
7.4 Порядок осуществления действий по методу 1 для продукции со средней бионагрузкой в интервале от 0,1 до 0,9 для нескольких или единичной партии продукции
8 Метод 2: установление дозы с использованием информации о доле положительных результатов из возрастающего дозирования для определения коэффициента экстраполяции
8.1 Обоснование
8.2 Порядок осуществления действий для метода 2А
8.3 Порядок осуществления действий для метода 2В
9 Метод обоснование значений 25 кГр или 15 кГр как стерилизующей дозы
10 Проведение проверки стерилизующей дозы
10.1 Цель и частота
10.2 Процедура для проведения проверки стерилизующей дозы, установленной с использованием метода 1 или 2
10.3 Процедура проверки стерилизующей дозы, обоснованной с использованием метода
11 Рабочие примеры
Библиография
Приложение ДА (справочное) Сведения о соответствии межгосударственных стандартов ссылочным международным стандартам
56 страниц
| Дата введения | 01.01.2013 |
|---|---|
| Добавлен в базу | 01.10.2014 |
| Актуализация | 01.01.2021 |
Этот ГОСТ находится в:
- Раздел Экология
- Раздел Электроэнергия
Организации:
| 29.11.2011 | Утвержден | Межгосударственный Совет по стандартизации, метрологии и сертификации | 40 |
|---|---|---|---|
| 13.12.2011 | Утвержден | Федеральное агентство по техническому регулированию и метрологии | 1279-ст |
| Разработан | ФГУП ВНИИНМАШ | ||
| Издан | Стандартинформ | 2013 г. |
Sterilization of health care products. Radiation. Part 2. Establishing the sterilization dose
- ГОСТ ISO 11137-1-2011 Стерилизация медицинской продукции. Радиационная стерилизация. Часть 1. Требования к разработке, валидации и текущему контролю процесса стерилизации медицинских изделий
ГОСТ ISO 13485-2011Изделия медицинские. Системы менеджмента качества. Системные требования для целей регулирования. Заменен на ГОСТ ISO 13485-2017.- ГОСТ ISO 11737-1-2012 Стерилизация медицинских изделий. Микробиологические методы. Часть 1. Оценка популяции микроорганизмов на продукции
- ГОСТ ISO 11737-2-2011 Стерилизация медицинских изделий. Микробиологические методы. Часть 2. Испытания на стерильность, проводимые при валидации процессов стерилизации
Чтобы бесплатно скачать этот документ в формате PDF, поддержите наш сайт и нажмите кнопку:

стр. 1

стр. 2

стр. 3

стр. 4

стр. 5

стр. 6

стр. 7

стр. 8

стр. 9

стр. 10

стр. 11

стр. 12

стр. 13

стр. 14
стр. 15
стр. 16
стр. 17
стр. 18

стр. 19
стр. 20

стр. 21

стр. 22

стр. 23
стр. 24

стр. 25

стр. 26
стр. 27
стр. 28

стр. 29

стр. 30
МЕЖГОСУДАРСТВЕННЫЙ СОВЕТ ПО СТАНДАРТИЗАЦИИ, МЕТРОЛОГИИ И СЕРТИФИКАЦИИ
(МГС)
INTERSTATE COUNCIL FOR STANDARDIZATION, METROLOGY AND CERTIFICATION
(ISC)
МЕЖГОСУДАРСТВЕННЫЙ
СТАНДАРТ
ГОСТISO 11137-2-2011СТЕРИЛИЗАЦИЯ МЕДИЦИНСКОЙ ПРОДУКЦИИ. РАДИАЦИОННАЯ СТЕРИЛИЗАЦИЯ
2011СТЕРИЛИЗАЦИЯ МЕДИЦИНСКОЙ ПРОДУКЦИИ. РАДИАЦИОННАЯ СТЕРИЛИЗАЦИЯ
Часть 2
Установление стерилизующей дозы
(ISO 11137-2:2006, ЮТ)
Издание официальное
|
Москва Стандартинформ 2013 |
Предисловие
Цели, основные принципы и порядок проведения работ по межгосударственной стандартизации установлены ГОСТ 1.0-92 «Межгосударственная система стандартизации. Основные положения» и ГОСТ 1.2-2009 «Межгосударственная система стандартизации. Стандарты межгосударственные, правила и рекомендации по межгосударственной стандартизации. Правила разработки, принятия, применения, обновления и отмены»
Сведения о стандарте
1 ПОДГОТОВЛЕН Федеральным государственным унитарным предприятием «Всероссийский научно-исследовательский институт стандартизации и сертификации в машиностроении» (ВНИИНМАШ)
2 ВНЕСЕН Федеральным агентством по техническому регулированию и метрологии
3 ПРИНЯТ Межгосударственным советом по стандартизации, метрологии и сертификации (протокол № 40 от 29 ноября 2011г.)
|
За принятие проголосовали: | |||||||||||||||||||||
|
4 Приказом Федерального агентства по техническому регулированию и метрологии от 13 декабря 2011 г. № 1279-ст межгосударственный стандарт ГОСТ IS011137-2—2011 введен в действие в качестве национального стандарта Российской Федерации с 1 января 2013 г.
5 Настоящий стандарт идентичен международному стандарту ISO 11137-2:2006 Sterilization of health care products — Radiation — Part 2: Establishing the sterilization dose (Стерилизация медицинской продукции. Радиационная стерилизация. Часть 2. Установление стерилизующей дозы).
Сведения о соответствии межгосударственных стандартов ссылочным международным стандартам приведены в дополнительном приложении ДА.
Степень соответствия — идентичная (ЮТ).
Стандарт подготовлен на основе применения ГОСТ Р ИС011137-2—2008
6 ВВЕДЕН ВПЕРВЫЕ
Информация о введении в действие (прекращении действия) настоящего стандарта публикуется в ежемесячно издаваемом указателе «Национальные стандарты».
Информация об изменениях к настоящему стандарту публикуется в ежегодно издаваемом информационном указателе «Национальные стандарты», а текст изменений и поправок — в ежемесячно издаваемых информационных указателях «Национальные стандарты». В случае пересмотра или отмены настоящего стандарта соответствующая информация будет опубликована в ежемесячно издаваемом информационном указателе «Национальные стандарты»
©Стандартинформ, 2013
В Российской Федерации настоящий стандарт не может быть полностью или частично воспроизведен, тиражирован и распространен в качестве официального издания без разрешения Федерального агентства по техническому регулированию и метрологии
5.1.2 Если продукт имеет требование стерильности для части продукта, то стерилизующая доза может быть установлена только на основе этой части.
Пример — Если на этикетке продукта имеется указание о стерильности только для канала протекания жидкости, то стерилизующая доза может быть установлена на основе определений бионагрузки и результатов испытаний, выполненных на этом канале.
5.2 Часть продукции для испытания (ЧПИ)
5.2.1 Для испытания продукта со средней бионагрузкой 1,0 или больше согласно таблице 1 следует использовать, если это практически осуществимо, продукт целиком (ЧПИ = 1,0). Когда использование целого продукта невозможно, его можно заменить выбранной частью (ЧПИ). Размер ЧПИ должен обеспечивать возможность манипулирования им в лаборатории и в процессе испытания.
5.2.2 Для испытания продукта со средней бионагрузкой 0,9 или меньше согласно таблице 1 следует использовать продукт целиком (ЧПИ = 1,0).
5.2.3 Если бионагрузка равномерно распределена на или в продукте, ЧПИ можно выбрать из любой части продукта. Если бионагрузка распределена неравномерно, ЧПИ должна состоять из частей продукта, выбранных произвольно, которые пропорционально представляют каждый из материалов, из которых сделан этот продукт. Если распределение бионагрузки известно, ЧПИ можно выбрать из той части продукта, которая является наиболее важной для стерилизации.
Величину ЧПИ можно вычислить на основе длины, массы, объема или площади поверхности (для примеров см. таблицу 2).
|
Таблица 2 — Примеры для вычисления ЧПИ | ||||||||||
|
5.2.4 Приготовление и упаковка испытательных частей продукции должны проводиться в условиях, обеспечивающих минимизацию изменений бионагрузки. Отбор ЧПИ следует проводить в условиях регулируемой окружающей среды, и по возможности упаковочные материалы должны быть аналогичны материалам, используемым для окончательной продукции.
5.2.5 Адекватность выбранной ЧПИ должна быть продемонстрирована. Бионагрузка ЧПИ должна быть такой, чтобы испытания на стерильность, проводимые индивидуально на 20 необлученных единицах ЧПИ, давали как минимум 17 положительных тестов на стерильность (т. е. 85 % положительных результатов). Если этот критерий не выполняется, то должна использоваться ЧПИ, более крупная, чем в первоначальном исследовании, и удовлетворяющая данному критерию. Если испытывается продукт целиком (ЧПИ = 1,0), то критерий получения как минимум 17 положительных тестов на стерильность из 20 испытаний не нужен.
5.3 Метод отбора образцов
5.3.1 Продукт для установления или проверка стерилизующей дозы должен быть образцовым для продукции, подлежащей текущим процедурам и условиям обработки. Обычно каждый продукт, используемый для определения бионагрузки или для испытания на стерильность, следует брать из отдельного упаковочного комплекта.
5.3.2 Промежуток времени между отбором образцов продукции и определением бионагрузки должен соответствовать времени между завершением последнего производственного этапа и стерилизацией продукции. Единицы продукции можно отбирать из продуктов, отбракованных в ходе производственного процесса при условии, что они подвергались такой же обработке и в тех же условиях, что и остальные продукты.
5.4 Микробиологические испытания
5.4.1 Определения бионагрузки и испытания на стерильность должны проводиться по IS011737-1 и ISO 11737-2 соответственно.
6
ГОСТ ISO 11137-2-2011
Обычно для испытаний на стерильность в качестве питательной среды рекомендуется соево-казеиновый питательный бульон с температурой инкубации (30 ±2) °С и периодом инкубации 14 дней. В сомнительных случаях, когда эта среда и указанная температура не поддерживают рост присутствующих микроорганизмов, следует использовать другие питательные среды и другую температуру инкубации (например, [7], [10], [12]).
Всегда, если есть возможность, продукт следует облучать в его первичной форме и упаковке. Однако чтобы уменьшить возможность ложноположительных результатов испытания на стерильность, продукт можно разобрать и повторно упаковать до облучения. Манипуляции до облучения неприемлемы, если они изменяют величину бионагрузки или ее ответную реакцию на облучение (т. е. манипуляции, которые изменяют химическую среду вокруг микроорганизмов, обычно это потенциал кислорода). Материалы для повторной упаковки продуктов для облучения должны быть способны противостоять воздействующим дозам и последующим манипуляциям, тем самым минимизируя вероятность контаминации.
5.4.2 Определения бионагрузки проводят на продукте, который уже прошел процесс упаковки.
Примечание — Обычно достаточно выполнить определение бионагрузки на продукте после его извлечения из упаковочного комплекта и исключить упаковочный комплект из определения бионагрузки.
5.5 Облучение
5.5.1 Облучение продукции при установлении и проверке стерилизующей дозы проводят в облучателе, который прошел аттестацию установленного (АУО), действующего (АДО) и эксплуатируемого (АЭО) оборудований согласно ISO 11137-1. Для проведения эксперимента с проверочной дозой или с возрастающей дозой составляют карту поля доз для установления самой высокой и самой низкой дозы, полученных продуктом.
5.5.2 Измерения дозы и использование источников излучения должны соответствовать ISO 11137-1.
Примечание — См. ISO 11137-3 для указаний по дозиметрическим вопросам стерилизации облучением.
6 Методы установления дозы
6.1 Еслистерилизующуюдозуустанавливаютпо18011137-1 [пункт 8.2.2, перечисление а)], характерная стерилизующая доза для данной продукции), то используют следующие методы:
a) метод 1 для нескольких и единичных партий (см. раздел 7);
b) метод 2А (см. 8.2);
c) метод 2В (см. 8.3);
d) метод, обеспечивающий такое же соответствие установленным требованиям к стерильности, как перечисления а), Ь) или с).
6.2 Если стерилизующую дозу устанавливают по ISO 11137-1:2006 [пункт 8.2.2, перечисление Ь)], то она должна быть обоснована одним из следующих методов:
a) для продукции со средней бионагрузкой в диапазоне от 0,1 до 1 ООО (включительно):
1) метод (см-9-2 или 9.3);
2) метод 1 (см. раздел 7), при условии получения стерилизующей дозы со значением < 25 кГр и достижения УС = 10-6;
3) метод 2 (см. раздел 8), при условии получения стерилизующей дозы со значением <25 кГр и достижения УС = 10-6;
4) метод, обеспечивающий такое же получение максимальногоУС = 10-6, как и вышеуказанные перечисления 1), 2) или 3) (см. 3.2.11, примечание);
b) для продукции со средней бионагрузкой в диапазоне от 0,1 до 1,5 (включительно):
1) метод VD^ax (см. 9.4 или 9.5);
2) метод 1 (см. раздел 8), при условии получения стерилизующей дозы со значением <15 кГр и достижения УС = 10-6;
3) метод 2 (см. раздел 8), при условии получения стерилизующей дозы со значением <15 кГр и достижения УС = 10-6;
4) метод, обеспечивающий такое же получение максимальногоУС = 10-6, каки вышеуказанные перечисления 1), 2) или 3) (см. 3.2.11, примечание);
c) для продукции со средней бионагрузкой < 0:
1) метод VD^ax (см. 9.2 или 9.3);
7
2) методVD^ax (см. 9.4 или 9.5);
3) метод 2 (см. раздел 8), при условии получения стерилизующей дозы со значением <15 кГр и достижения УС = 10-6;
4) метод, обеспечивающий получение максимального УС = 10-6, как и вышеуказанные перечисления 1), 2) или 3) (см. 3.2.11, примечание).
7 Метод 1: установление дозы с использованием информации о бионагрузке
7.1 Обоснование
Рассматриваемый метод установления стерилизующей дозы зависит от экспериментальной верификации того, что стойкость бионагрузки к облучению меньше или равна стойкости микробной популяции, имеющей стандартное распределение стойкостей к облучению (SDR).
Для значений SDR выполнен рационализированный отбор. SDR точно определяет стойкость микроорганизмов в значениях D10 и вероятность появления этих значений во всей популяции (см. таблицу 3). С использованием вычислительных методов определены индивидуальные дозы, требуемые для достижения значений УС = 10-2,10-3,10-4,10-5 и 10-6 с нарастающим уровнем средней бионагрузки, с определенным значением SDR. Вычисленные значения дозы для данных средних бионагрузок приведены в таблицах 5 и 6.
|
Таблица 3 — Стандартное распределение стойкостей (SDR), применяемое в методе 1 (см. [20]) | ||||||||||||||||||||||
|
В действительности определена средняя бионагрузка. Дозу, которая дает УС = 10-2 при этой средней бионагрузке, берут из таблицы 5 или 6. Полученная доза обозначается как проверочная доза, которая будет уменьшать микробную популяцию с SDR до уровня УС = 10~2. Затем сто единиц продукции подвергают облучению при выбранной проверочной дозе и для каждой единицы отдельно проводят тест на стерильность. Если будет не более двух положительных результатов из ста испытаний, снова берут значения из таблицы 5 или 6 при средней бионагрузке, чтобы получить стерилизующую дозу для любого требуемого УС.
При обосновании допущения двух положительных результатов исходят из предположения, что вероятности появления положительных чисел в окрестности ожидания одного положительного числа распределяются по закону Пуассона. При таком распределении существует вероятность 92 %, что появится ноль, один или два положительных результата (см. таблицу 4).
|
Таблица 4 — Ожидаемая вероятность положительных результатов из 100 испытаний при УС = 10~2 | ||||||||||||||||||||
| ||||||||||||||||||||
|
Примечание — Таблица В.1 ISO 11137:1995, дающая проверочную и стерилизующую дозы для метода 1, была составлена на основе использования равномерно увеличивающихся доз и соответствующего увеличения значений средних бионагрузок. Возрастание дозы было 0,1 кГр, значения средней бионагрузки увеличивались неравномерной включали как целые, таки дробные числа (т. е. 104; 112,6; 121,9; 131,9 и т. д.). Чтобы улучшить таблицу, упростив ее для использования и интерпретации, средние значения бионагрузки в таблице 5 в ISO 11137 выражены как равномерно возрастающие целые числа. Приращения значений бионагрузки выбираются так, чтобы увеличение проверочной дозы составляло около 0,1 кГр, при этом значения дозы округляются до одного десятичного знака. Равномерные увеличения значений средней бионагрузки также включены в таблицу 6. |
7.2 Порядок осуществления действий по методу 1 для продукции со средней бионагрузкой >1,0 для нескольких партий продукции
7.2.1 Общее
При использовании метода 1 выполняются шесть нижеприведенных стадий.
Примечание — Рабочий примером. 11.1.
ГОСТ ISO 11137-2-20117.2.2 Стадия 1: выбор УС и получение образцов продукции
7.2.2.1 Значение регистрируют УС для продукции, используемой по назначению.
7.2.2.2 Отображают как минимум 10 единиц продукции из каждой из трех независимых партий согласно 5.1,5.2 и 5.3.
7.2.3 Стадия 2: определение средней бионагрузки
7.2.3.1 Решают, должен ли применяться поправочный коэффициент при определении бионагрузки.
Примечание — В методе, описанном в ISO 11737-1, применяется поправочный коэффициент, выведенный из валидации метода определения бионагрузки кчислу жизнеспособных микроорганизмов. При установлении дозы по методу 1 можно использовать число жизнеспособных микроорганизмов без применения поправочного коэффициента. Когда поправочный коэффициент не используется, бионагрузка может быть недооценена. Неприменение поправочного коэффициента к бионагрузке может увеличить риск ошибки эксперимента с проверочной дозой.
7.2.3.2 Определяют бионагрузку каждой из выбранных единиц продукции и вычисляют:
a) для каждой из трех партий среднюю бионагрузку на единицу партии (среднее значение для партии);
b) среднюю нагрузку на единицу продукции для всех выбранных единиц продукции (общую среднюю бионагрузку).
Примечание — Бионагрузку обычно определяют на отдельных единицах продукции, но когда бионагрузка низкая (например, < 10), допустимо объединять 10 единиц продукции для определения средней бионагрузки для партии. Данное руководство не относится к ЧПИ; их нужно не объединять, а выбирать большую ЧПИ.
7.2.3.3 Сравнивают три средних значения для партии с общей средней бионагрузкой и определяют, есть ли какое-нибудь среднее значение для партии, которое вдвое или более превышает общую среднюю бионагрузку.
7.2.4 Стадия 3: получение проверочной дозы
Из таблицы 5 получают дозу для УС = 10-2, используя одно из следующих перечислений:
a) самую высокую среднюю бионагрузку для партии, если одно или более средних значений для партии >2 х (общая средняя бионагрузка);
b) общую среднюю бионагрузку, если каждое изсреднихзначений для партии <2 х (общая средняя бионагрузка).
Полученную дозу обозначить как проверочную.
Для определения проверочной дозы используют среднюю бионагрузку ЧПИ, если ЧПИ используется в испытаниях на стерильность.
Если средняя бионагрузка не приводится в таблице 5, используют ближайшую табличную бионагрузку, которая должна быть больше вычисленной средней бионагрузки.
7.2.5 Стадия 4: проведение эксперимента с проверочной дозой
7.2.5.1 Для выполнения стадии 4 отобрать 100 единиц из одной партии продукции. Сто единиц продукции для выполнения стадии 4 можно выбрать из одной из партий, для которых определение бионагрузки было проведено в стадии 2, или из четвертой партии, изготовленной в условиях, пригодных для нормального производства. При выборе партии для использования следует учитывать способность продукции поддерживать микробный рост.
7.2.5.2 Облучают образцы продукции с использованием проверочной дозы. Определяют дозу. Если самая высокая доза, применяемая для образцов продукции, превышает проверочную дозу более чем на 10 % и стерилизующая доза устанавливается по методу 1, то эксперимент с поверочной дозой должен быть повторен. Если среднеарифметическое самой высокой и самой низкой доз, подаваемых на образцы продукции, меньше 90 % проверочной дозы, эксперимент с проверочной дозой нужно повторить. Если средняя доза меньше 90 % проверочной дозы и при проведении испытания на стерильность получаются приемлемые результаты (см. 7.2.6.1), то проверочный эксперимент повторять не нужно.
7.2.5.3 Для каждого облученного образца продукции отдельно проводят тест на стерильность согласно ISO 11737-2, пункт 5.4.1, и записывают число положительных результатов.
7.2.6 Стадия 5: интерпретация результатов
7.2.6.1 Если получено не более двух положительных результатов из 100 проведенных испытаний на стерильность, проверку принимают.
7.2.6.2 Если получено более двух положительных результатов, верификацию не принимают.
9
Если полученный результат можно отнести за счет некорректного определения бионагрузки, неприменения поправочного коэффициента при определении бионагрузки, некорректного проведения испытаний на стерильность или некорректной подачи проверочной дозы, то эксперимент с проверочной дозой можно повторить после выполнения корректирующего действия.
Если полученный результат нельзя приписать к какой-либо причине, устраняемой корректирующим действием, то этот метод установления дозы не является правильным и альтернативный метод следует использовать для установления стерилизующей дозы (см. раздел 6).
7.2.7 Стадия 6: установление стерилизующей дозы
7.2.7.1 Если продукция используется целиком и проверка принимается, надо получить стерилизующую дозу для продукции из таблицы 5, используя ближайшую табличную среднюю бионагрузку, которая больше или равна вычисленной средней бионагрузке, и считывая дозу, необходимую для получения требуемого УС.
7.2.7.2 Если используется ЧПИ меньше 1,0 и проверка принимается, надо вычислить бионагрузку для целой продукции, поделив среднюю бионагрузку ЧПИ на значение ЧПИ. Получают стерилизующую дозу для продукции из таблицы 5, используя ближайшую табличную среднюю бионагрузку, которая больше или равна вычисленной средней бионагрузке для целой продукции, и считывая дозу, необходимую для получения требуемого УС.
|
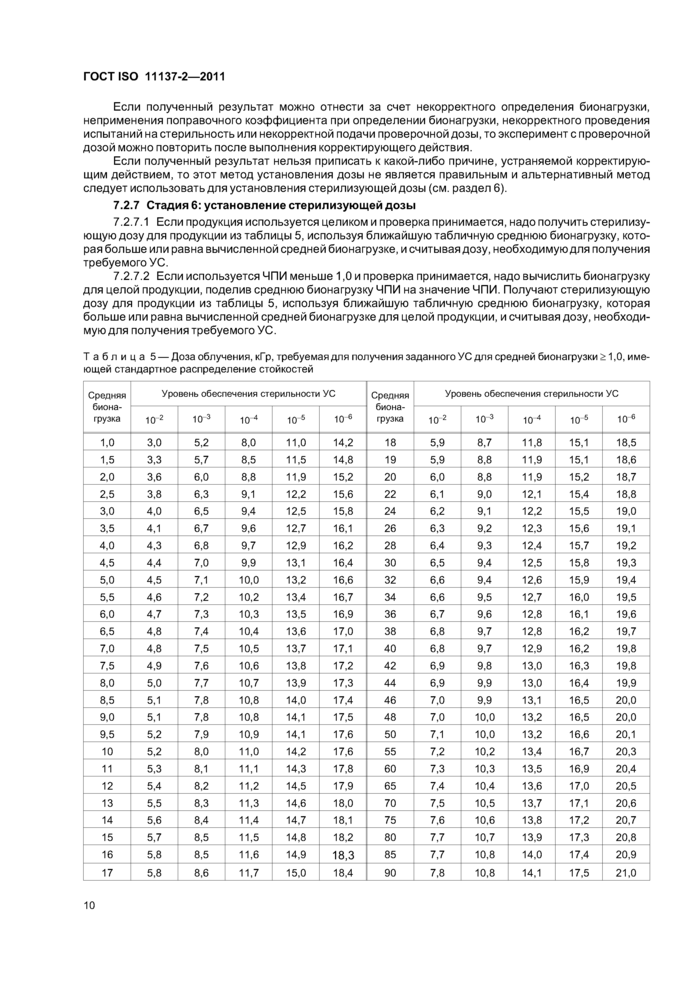
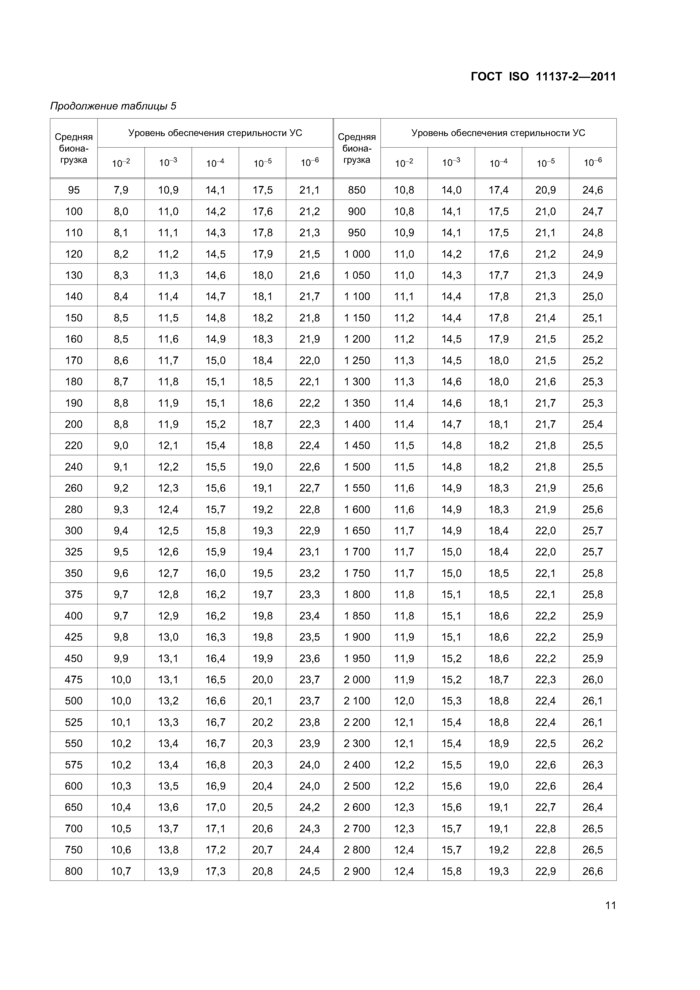
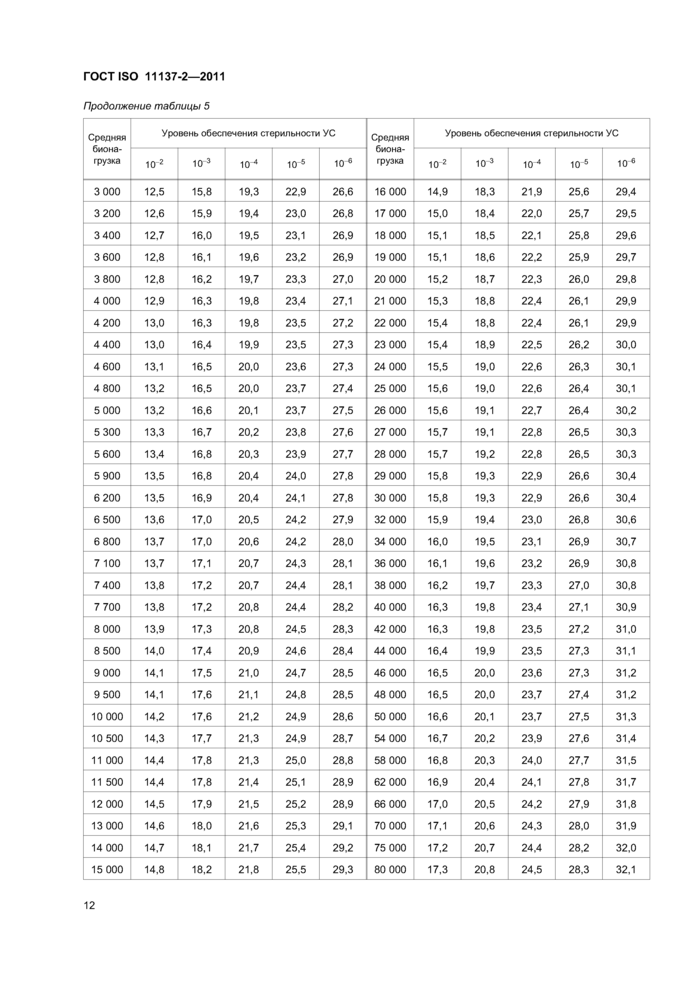
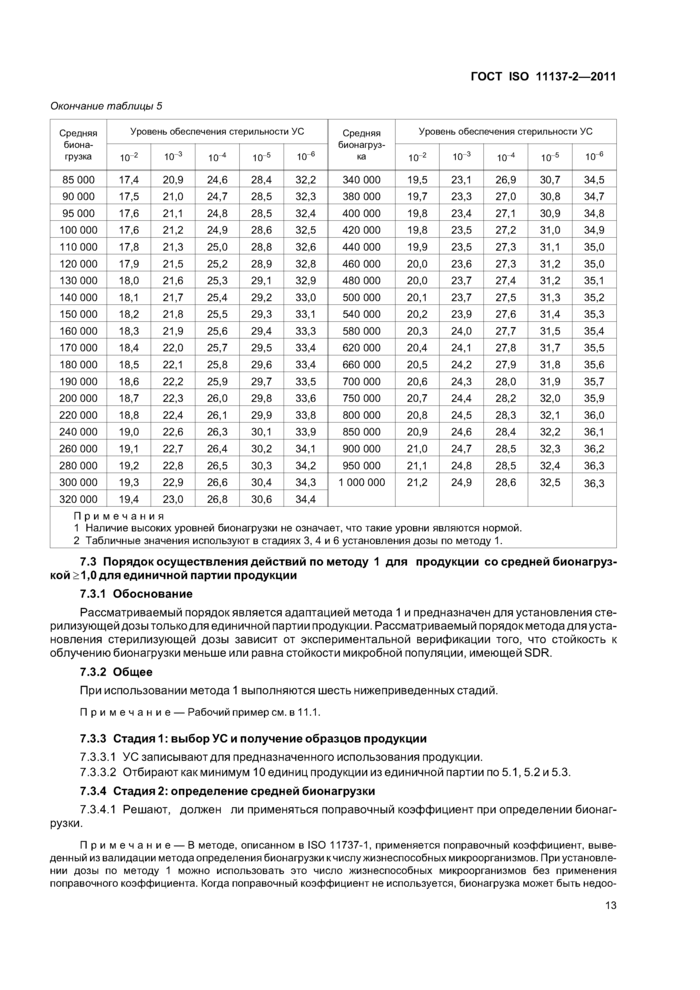
Таблица 5 — Доза облучения, кГ р, требуемая для получения заданного УС для средней бионагрузки >1,0, имеющей стандартное распределение стойкостей | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
11 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Средняя биона грузка |
Уровень обеспечения стерильности УС |
Средняя биона грузка |
Уровень обеспечения стерильности УС | ||||||||
|
1(Г2 |
1(Г3 |
10^ |
1(Г5 |
1(Г6 |
1(Г2 |
1(Г3 |
10^ |
1(Г5 |
1(Г6 | ||
|
3 ООО |
12,5 |
15,8 |
19,3 |
22,9 |
26,6 |
16 000 |
14,9 |
18,3 |
21,9 |
25,6 |
29,4 |
|
3 200 |
12,6 |
15,9 |
19,4 |
23,0 |
26,8 |
17 000 |
15,0 |
18,4 |
22,0 |
25,7 |
29,5 |
|
3 400 |
12,7 |
16,0 |
19,5 |
23,1 |
26,9 |
18 000 |
15,1 |
18,5 |
22,1 |
25,8 |
29,6 |
|
3 600 |
12,8 |
16,1 |
19,6 |
23,2 |
26,9 |
19 000 |
15,1 |
18,6 |
22,2 |
25,9 |
29,7 |
|
3 800 |
12,8 |
16,2 |
19,7 |
23,3 |
27,0 |
20 000 |
15,2 |
18,7 |
22,3 |
26,0 |
29,8 |
|
4 000 |
12,9 |
16,3 |
19,8 |
23,4 |
27,1 |
21 000 |
15,3 |
18,8 |
22,4 |
26,1 |
29,9 |
|
4 200 |
13,0 |
16,3 |
19,8 |
23,5 |
27,2 |
22 000 |
15,4 |
18,8 |
22,4 |
26,1 |
29,9 |
|
4 400 |
13,0 |
16,4 |
19,9 |
23,5 |
27,3 |
23 000 |
15,4 |
18,9 |
22,5 |
26,2 |
30,0 |
|
4 600 |
13,1 |
16,5 |
20,0 |
23,6 |
27,3 |
24 000 |
15,5 |
19,0 |
22,6 |
26,3 |
30,1 |
|
4 800 |
13,2 |
16,5 |
20,0 |
23,7 |
27,4 |
25 000 |
15,6 |
19,0 |
22,6 |
26,4 |
30,1 |
|
5 000 |
13,2 |
16,6 |
20,1 |
23,7 |
27,5 |
26 000 |
15,6 |
19,1 |
22,7 |
26,4 |
30,2 |
|
5 300 |
13,3 |
16,7 |
20,2 |
23,8 |
27,6 |
27 000 |
15,7 |
19,1 |
22,8 |
26,5 |
30,3 |
|
5 600 |
13,4 |
16,8 |
20,3 |
23,9 |
27,7 |
28 000 |
15,7 |
19,2 |
22,8 |
26,5 |
30,3 |
|
5 900 |
13,5 |
16,8 |
20,4 |
24,0 |
27,8 |
29 000 |
15,8 |
19,3 |
22,9 |
26,6 |
30,4 |
|
6 200 |
13,5 |
16,9 |
20,4 |
24,1 |
27,8 |
30 000 |
15,8 |
19,3 |
22,9 |
26,6 |
30,4 |
|
6 500 |
13,6 |
17,0 |
20,5 |
24,2 |
27,9 |
32 000 |
15,9 |
19,4 |
23,0 |
26,8 |
30,6 |
|
6 800 |
13,7 |
17,0 |
20,6 |
24,2 |
28,0 |
34 000 |
16,0 |
19,5 |
23,1 |
26,9 |
30,7 |
|
7 100 |
13,7 |
17,1 |
20,7 |
24,3 |
28,1 |
36 000 |
16,1 |
19,6 |
23,2 |
26,9 |
30,8 |
|
7 400 |
13,8 |
17,2 |
20,7 |
24,4 |
28,1 |
38 000 |
16,2 |
19,7 |
23,3 |
27,0 |
30,8 |
|
7 700 |
13,8 |
17,2 |
20,8 |
24,4 |
28,2 |
40 000 |
16,3 |
19,8 |
23,4 |
27,1 |
30,9 |
|
8 000 |
13,9 |
17,3 |
20,8 |
24,5 |
28,3 |
42 000 |
16,3 |
19,8 |
23,5 |
27,2 |
31,0 |
|
8 500 |
14,0 |
17,4 |
20,9 |
24,6 |
28,4 |
44 000 |
16,4 |
19,9 |
23,5 |
27,3 |
31,1 |
|
9 000 |
14,1 |
17,5 |
21,0 |
24,7 |
28,5 |
46 000 |
16,5 |
20,0 |
23,6 |
27,3 |
31,2 |
|
9 500 |
14,1 |
17,6 |
21,1 |
24,8 |
28,5 |
48 000 |
16,5 |
20,0 |
23,7 |
27,4 |
31,2 |
|
10 000 |
14,2 |
17,6 |
21,2 |
24,9 |
28,6 |
50 000 |
16,6 |
20,1 |
23,7 |
27,5 |
31,3 |
|
10 500 |
14,3 |
17,7 |
21,3 |
24,9 |
28,7 |
54 000 |
16,7 |
20,2 |
23,9 |
27,6 |
31,4 |
|
11 000 |
14,4 |
17,8 |
21,3 |
25,0 |
28,8 |
58 000 |
16,8 |
20,3 |
24,0 |
27,7 |
31,5 |
|
11 500 |
14,4 |
17,8 |
21,4 |
25,1 |
28,9 |
62 000 |
16,9 |
20,4 |
24,1 |
27,8 |
31,7 |
|
12 000 |
14,5 |
17,9 |
21,5 |
25,2 |
28,9 |
66 000 |
17,0 |
20,5 |
24,2 |
27,9 |
31,8 |
|
13 000 |
14,6 |
18,0 |
21,6 |
25,3 |
29,1 |
70 000 |
17,1 |
20,6 |
24,3 |
28,0 |
31,9 |
|
14 000 |
14,7 |
18,1 |
21,7 |
25,4 |
29,2 |
75 000 |
17,2 |
20,7 |
24,4 |
28,2 |
32,0 |
|
15 000 |
14,8 |
18,2 |
21,8 |
25,5 |
29,3 |
80 000 |
17,3 |
20,8 |
24,5 |
28,3 |
32,1 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Примечания 1 Наличие высоких уровней бионагрузки не означает, что такие уровни являются нормой. 2 Табличные значения используют в стадиях 3, 4 и 6 установления дозы по методу 1. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
7.3 Порядок осуществления действий по методу 1 для продукции со средней бионагрузкой >1,0 для единичной партии продукции
7.3.1 Обоснование
Рассматриваемый порядок является адаптацией метода 1 и предназначен для установления стерилизующей дозы только для единичной партии продукции. Рассматриваемый порядок метода для установления стерилизующей дозы зависит от экспериментальной верификации того, что стойкость к облучению бионагрузки меньше или равна стойкости микробной популяции, имеющей SDR.
7.3.2 Общее
При использовании метода 1 выполняются шесть нижеприведенных стадий.
Примечание — Рабочий пример см. в 11.1.
7.3.3 Стадия 1: выбор УС и получение образцов продукции
7.3.3.1 УС записывают для предназначенного использования продукции.
7.3.3.2 Отбирают как минимум 10 единиц продукции из единичной партии по 5.1,5.2 и 5.3.
7.3.4 Стадия 2: определение средней бионагрузки
7.3.4.1 Решают, должен ли применяться поправочный коэффициент при определении бионагрузки.
Примечание — В методе, описанном в ISO 11737-1, применяется поправочный коэффициент, выведенный из валидации метода определения бионагрузки к числу жизнеспособных микроорганизмов. При установлении дозы по методу 1 можно использовать это число жизнеспособных микроорганизмов без применения поправочного коэффициента. Когда поправочный коэффициент не используется, бионагрузка может быть недоо-
13
ценена. Неприменение поправочного коэффициента к бионагрузке может увеличить риск ошибки эксперимента с проверочной дозой.
7.3.4.2 Для всех выбранных единиц продукции определяют бионагрузку каждой из выбранных единиц продукции и вычисляют среднюю бионагрузку на единицу (общая средняя бионагрузка).
Примечание — Бионагрузку обычно определяют на отдельных единицах продукции, но когда бионагрузка низкая (например, < 10), допустимо объединять 10 единиц продукции для определения средней бионагрузки для партии. Это руководство не относится к ЧПИ. Отдельные ЧПИ нужно не объединять, а выбирать ЧПИ большего размера.
7.3.5 Стадия 3: получение проверочной дозы
Используя среднюю бионагрузку, получают дозу для УС = 10-2 из таблицы 5. Полученную дозу обозначают как проверочную.
Если ЧПИ будут использоваться в испытаниях на стерильность, то используют среднюю бионагрузку для ЧПИ при определении проверочной дозы.
Если средняя бионагрузка не приводится в таблице 5, то используют ближайшую табличную бионагрузку, которая больше вычисленной средней бионагрузки.
7.3.6 Стадия 4: проведение эксперимента с проверочной дозой
7.3.6.1 Из единичной партии продукции отбирают 100 единиц продукции.
7.3.6.2 С использованием проверочной дозы облучают 100 единиц продукции. Определяют дозу. Если самая высокая доза, применяемая для единиц продукции, превышает проверочную дозу более чем на 10 % и стерилизующая доза должна устанавливаться по методу 1, то эксперимент с проверочной дозой должен быть повторен. Если среднеарифметическое самой высокой и самой низкой доз, подаваемых на единицы продукции, меньше 90 % проверочной дозы, эксперимент с проверочной дозой следует повторить. Если полученная средняя доза меньше 90 % от проверочной дозы и при проведении испытания получаются приемлемые результаты (см. 7.3.7.1), то проверочный эксперимент повторять не нужно.
7.3.6.3 Для каждой облученной единицы продукции отдельно проводят тест на стерильность согласно ISO 11737-2, пункт 5.4.1, и записывают число положительных результатов.
7.3.7 Стадия 5: интерпретация результатов
7.3.7.1 Если получено не более двух положительных результатов из 100 проведенных испытаний на стерильность, проверку принимают.
7.3.7.2 Если получено более двух положительных результатов, проверку не принимают.
Если полученный результат можно отнести за счет некорректного определения бионагрузки, неприменения поправочного коэффициента при определении бионагрузки, некорректного проведения испытаний на стерильность или некорректной подачи проверочной дозы, то эксперимент с проверочной дозой следует повторить с применением корректирующего действия.
Если полученный результат нельзя приписать к какой-либо причине, устраняемой корректирующим действием, то этот метод установления дозы не является правильным и альтернативный метод следует использовать для установления стерилизующей дозы (см. раздел 6).
7.3.8 Стадия 6: установление стерилизующей дозы
7.3.8.1 Если продукция используется целиком и результаты проверки признаются, получают стерилизующую дозу для продукции из таблицы 5, используя ближайшую табличную среднюю бионагрузку, которая больше или равна вычисленной средней бионагрузке, и считывая дозу, необходимую для получения требуемого УС.
7.3.8.2 Если используется ЧПИ меньше 1,0 и результаты проверки признаются, надо вычислить бионагрузку для целой продукции, деля среднюю бионагрузку ЧПИ на значение ЧПИ. Получить стерили-зующуюдозудля продукции изтаблицыб, используя ближайшую табличную среднюю бионагрузку, которая больше или равна вычисленной средней бионагрузке для целой продукции, и считывая дозу, необходимую для получения требуемого УС.
7.4 Порядок осуществления действий по методу 1 для продукции со средней бионагрузкой в интервале от 0,1 до 0,9 для нескольких или единичной партии продукции
Для продукции со средней бионагрузкой в интервале от 0,1 до 0,9 включительно должна проводиться процедура для установления дозы по методу 1, для нескольких партий (см. 7.2) или единичной партии (см. 7.3), за исключением:
a) целая продукция должна использоваться согласно таблице 1;
b) при определении бионагрузки должен использоваться поправочный коэффициент;
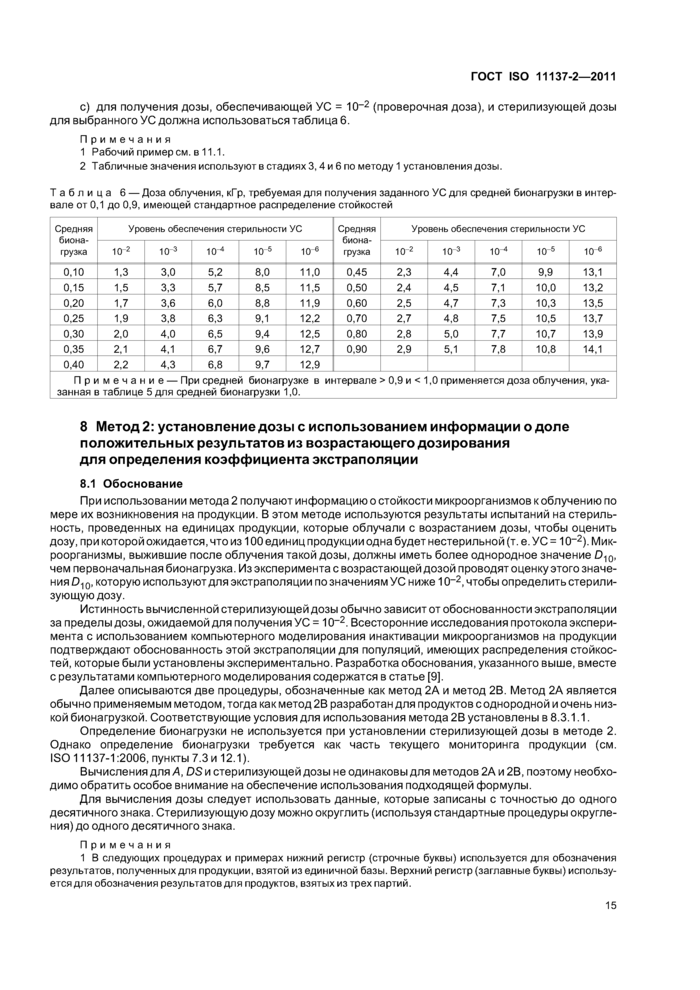
с) для получения дозы, обеспечивающей УС = 10~2 (проверочная доза), и стерилизующей дозы для выбранного УС должна использоваться таблица 6.
Примечания
1 Рабочий примером, в 11.1.
2 Табличные значения используют в стадиях 3,4 и 6 по методу 1 установления дозы.
|
Таблица 6 — Доза облучения, кГ р, требуемая для получения заданного УС для средней бионагрузки в интервале от 0,1 до 0,9, имеющей стандартное распределение стойкостей | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Примечание — При средней бионагрузке в интервале > 0,9 и < 1,0 применяется доза облучения, ука-занная в таблице 5 для средней бионагрузки 1,0._ | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
8 Метод 2: установление дозы с использованием информации о доле положительных результатов из возрастающего дозирования для определения коэффициента экстраполяции
8.1 Обоснование
При использовании метода 2 получают информацию о стойкости микроорганизмов к облучению по мере их возникновения на продукции. В этом методе используются результаты испытаний на стерильность, проведенных на единицах продукции, которые облучали с возрастанием дозы, чтобы оценить дозу, при которой ожидается, что из 100 единиц продукции одна будет нестерильной (т. е.УС= 10-2). Микроорганизмы, выжившие после облучения такой дозы, должны иметь более однородное значение D10, чем первоначальная бионагрузка. Из эксперимента с возрастающей дозой проводят оценку этого значения D10, которую используют для экстраполяции по значениям УС ниже 10-2, чтобы определить стерилизующую дозу.
Истинность вычисленной стерилизующей дозы обычно зависит от обоснованности экстраполяции за пределы дозы, ожидаемой для получения УС = 10-2. Всесторонние исследования протокола эксперимента с использованием компьютерного моделирования инактивации микроорганизмов на продукции подтверждают обоснованность этой экстраполяции для популяций, имеющих распределения стойкостей, которые были установлены экспериментально. Разработка обоснования, указанного выше, вместе с результатами компьютерного моделирования содержатся в статье [9].
Далее описываются две процедуры, обозначенные как метод 2А и метод 2В. Метод 2А является обычно применяемым методом, тогда как метод 2В разработан для продуктов с однородной и очень низкой бионагрузкой. Соответствующие условия для использования метода 2В установлены в 8.3.1.1.
Определение бионагрузки не используется при установлении стерилизующей дозы в методе 2. Однако определение бионагрузки требуется как часть текущего мониторинга продукции (см. ISO 11137-1:2006, пункты 7.3 и 12.1).
Вычисления для A, DS и стерилизующей дозы не одинаковы для методов 2А и 2В, поэтому необходимо обратить особое внимание на обеспечение использования подходящей формулы.
Для вычисления дозы следует использовать данные, которые записаны с точностью до одного десятичного знака. Стерилизующую дозу можно округлить (используя стандартные процедуры округления) до одного десятичного знака.
Примечания
1 В следующих процедурах и примерах нижний регистр (строчные буквы) используется для обозначения результатов, полученных для продукции, взятой из единичной базы. Верхний регистр (заглавные буквы) используется для обозначения результатов для продуктов, взятых из трех партий.
15
Содержание
1 Область применения...................................................1
2 Нормативные ссылки..................................................1
3 Термины, определения и обозначения.......................................1
3.1 Термины и определения.............................................1
3.2 Обозначения.....................................................2
4 Определение и техническое обслуживание серии продукции для установления, обоснования
и проверки стерилизующей дозы...........................................3
4.1 Общие вопросы...................................................3
4.2 Определение серийности продукции......................................3
4.3 Обозначение продукта, представляющего серию продукции для проведения эксперимента
с проверочной дозой или проверки стерилизующей дозы.........................4
4.4 Техническое обслуживание серии продукции.................................4
4.5 Действия в случае обнаружения несоответствия стерилизующей дозы для серии продукции . . 5
5 Выбор и испытание продукции для установления и проверки стерилизующей дозы...........5
5.1 Характеристика продукции............................................5
5.2 Часть продукции для испытания (ЧПИ)....................................6
5.3 Метод отбора образцов..............................................6
5.4 Микробиологические испытания........................................6
5.5 Облучение......................................................7
6 Методы установления дозы..............................................7
7 Метод 1: установление дозы с использованием информации о бионагрузке................8
7.1 Обоснование.....................................................8
7.2 Порядок осуществления действий по методу 1 для продукции со средней бионагрузкой > 1,0
для нескольких партий продукции.......................................8
7.3 Порядок осуществления действий по методу 1 для продукции со средней бионагрузкой > 1,0
для единичной партии продукции.......................................13
7.4 Порядок осуществления действий по методу 1 для продукции со средней бионагрузкой в интервале от 0,1 до 0,9 для нескольких или единичной партии продукции..................14
8 Метод 2: установление дозы с использованием информации о доле положительных результатов
из возрастающего дозирования для определения коэффициента экстраполяции............15
8.1 Обоснование....................................................15
8.2 Порядок осуществления действий для метода 2А.............................16
8.3 Порядок осуществления действий для метода 2В.............................18
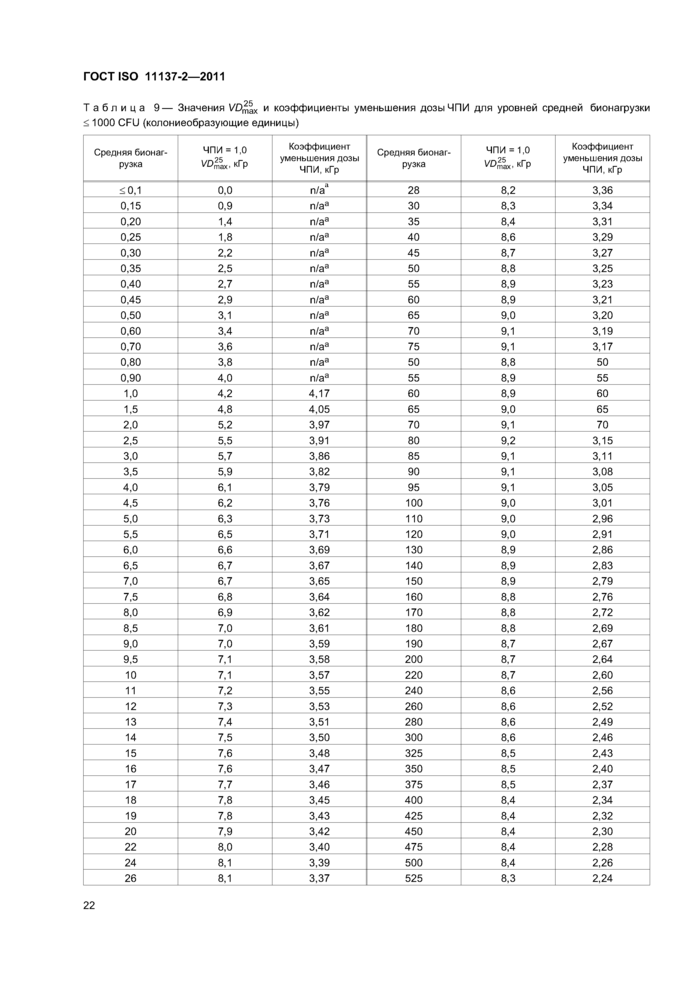
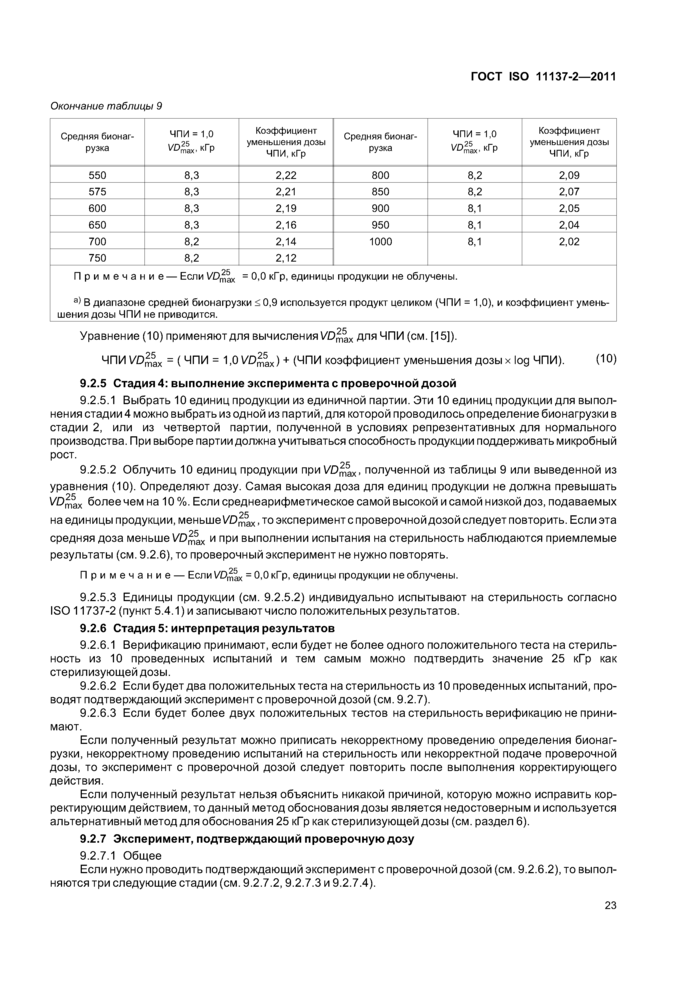
9 Метод VDmax\ обоснование значений 25 кГр или 15 кГр как стерилизующей дозы............20
9.1 Обоснование....................................................20
9.2 Процедура для метода VD^ для нескольких партий продукции...................21
9.3 Процедура для метода VD^x для единичной партии продукции...................24
9.4 Процедура для метода MD^ax для нескольких партий продукции...................25
9.5 Процедура для метода MD^ax для единичной партии продукции...................27
2 Для метода 2 продукт должен использоваться целиком (ЧПИ = 1,0), тогда как для метода 2А можно использовать или целый продукт, или его часть (ЧПИ < 1,0).
8.2 Порядок осуществления действий для метода 2А
8.2.1 Общее
При применении метода 2А выполняются пять следующих стадий.
Примечание — Рабочие примеры см. в 11.2.2 и 11.2.3.
8.2.2 Стадия 1: выбор УС и получение образцов продукции
8.2.2.1 Записывают УС для предназначенного использования продукции.
8.2.2.2 Отбирают как минимум 280 единиц продукции из каждой из трех независимых партий согласно 5,1; 5,2 и 5,3. Может понадобиться дополнительный продукт для валидации адекватности УС< 1 (см. 5.2.5).
8.2.3 Стадия 2: проведение эксперимента с возрастающей дозой
8.2.3.1 Общее
8.2.3.1.1 В каждой из трех партий продукции облучить 20 единиц продукции, используя серию как минимум из девяти доз, начиная с2 кГр и увеличивая с номинальными приращениями 2 кГр. Определяют каждую возрастающую дозу. Самая высокая доза при каждой номинальной возрастающей дозе используется затем в идентификации первой дробной положительной дозы ffp и d*. Полученная доза может отличаться от номинальной возрастающей дозы на +1,0 кГр или+ 10%, в зависимости от того, какое значение больше. Если среднеарифметическое самой высокой и самой низкой дозы приданной возрастающей дозе меньше значения, взятого при нижнем пределе, можно проводить облучение 20 следующих единиц продукции при этой конкретной возрастающей дозе.
8.2.3.1.2 Для облученных единиц продукции индивидуально проводят испытание на стерильность согласно ISO 11737-2, пункт 5.4.1, и записывают число положительных результатов.
8.2.3.1.3 Из результатов эксперимента получают следующее:
a) А и первую дробную положительную дозу (FFP) (см. 8.2.3.2);
b) D* (см. 8.2.3.3);
c) партию CD* (см. 8.2.3.4).
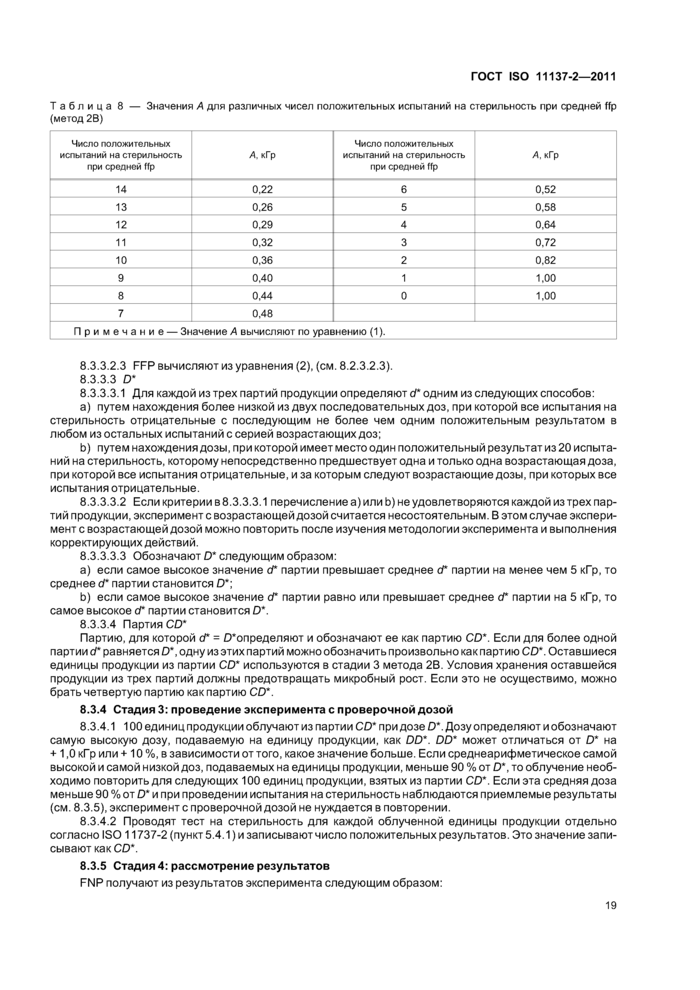
8.2.3.2 А и FFP
8.2.3.2.1 Для каждой из трех партий продукции определяют самую низкую дозу из серии возрастающих доз, при которой как минимум одно из 20 испытаний на стерильность отрицательное. Эту дозу обозначают какАр для конкретной партии и находят среднюю ffp для этих трех партий. Если две или три партии показывают одну и ту же ffp, то в качестве средней ffp выбирают дозу для партии, которая показывает более высокое или самое высокое число положительных результатов.
8.2.3.2.2 Значение А получают из таблицы 7, используя число положительных испытаний на стерильность при средней ffp.
|
Таблица 7 — Значения А для различных чисел положительных испытаний на стерильность при средней ffp (метод 2А) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||
10 Проведение проверки стерилизующей дозы..................................28
10.1 Цель и частота..................................................28
10.2 Процедура для проведения проверки стерилизующей дозы, установленной с использова
нием метода 1 или 2.............................................29
10.3 Процедура проверки стерилизующей дозы, обоснованной с использованием метода VDmax . 31
11 Рабочие примеры...................................................34
11.1 Рабочие примеры для метода 1.......................................34
11.2 Рабочие примеры для метода 2.......................................37
11.3 Рабочие примеры для метода VDmax....................................43
11.4 Рабочий пример проверки стерилизующей дозы для установления дозы с использованием метода 1, заключением которого явилось требование увеличения стерилизующей дозы ... 45
11.5 Рабочий пример проверки стерилизующей дозы для установления дозы с использованием метода 2А, заключением которого явилось требование увеличения стерилизующей дозы ... 46
11.6 Рабочий пример проверки стерилизующей дозы для обоснования стерилизующей дозы
с использованием метода VD^ax ......................................47
Библиография........................................................48
Приложение ДА (справочное) Сведения о соответствии межгосударственных стандартов ссылочным международным стандартам................................49
IV
ГОСТ ISO 11137-2-2011Введение
Серия стандартов ISO 11137 под общим названием «Стерилизация медицинской продукции. Радиационная стерилизация» состоит из следующих стандартов:
- Часть 1. Требования к разработке, валидации и текущему контролю процесса стерилизации медицинских изделий;
- Часть 2. Установление стерилизующей дозы;
- Часть 3. Руководство по вопросам дозиметрии.
Настоящее первое издание указанной серии стандартов отменяет действие стандарта ISO 11137—2000 и заменяет его.
V
МЕЖГОСУДАРСТВЕННЫЙ СТАНДАРТ
СТЕРИЛИЗАЦИЯ МЕДИЦИНСКОЙ ПРОДУКЦИИ. РАДИАЦИОННАЯ СТЕРИЛИЗАЦИЯ
Часть 2 Установление стерилизующей дозы
Sterilization of health care products. Radiation. Part 2. Establishing the sterilization dose
Дата введения — 2013—01—01
1 Область применения
Настоящий стандарт устанавливает методы определения дозы, необходимой для удовлетворения установленного требования к стерильности, и методы для обоснования значений 25 или 15 кГр как стерилизующей дозы для достижения уровня обеспечения стерильности (УС) 10-6. Настоящий стандарт устанавливает методы проведения проверки дозы, для того чтобы продемонстрировать непрерывную эффективность стерилизующей дозы.
В настоящем стандарте определяются серии продукции/продуктов для установления дозы и проверки дозы.
2 Нормативные ссылки
Следующие ссылочные нормативные документы являются обязательными при применении данного документа. Для датированных ссылок применяется только цитированное издание документа. Для недатирован ных ссылок необходимо использовать самое последнее издание нормативного ссылочного
документа (включая любые изменения).
ISO 11137-1:2006 Sterilization of health care products — Radiation — Part 1: Requirements for development, validation and routine control of a sterilization process for medical devices (Стерилизация медицинской продукции. Радиационная стерилизация. Часть 1. Требования к разработке, валидации и текущему контролю процесса стерилизации медицинских изделий)
ISO 11737-1:2003 Sterilization of medical devices — Microbiological methods — Parti: Determination of a population of microorganisms on products (Стерилизация медицинских изделий. Микробиологические методы. Часть 1. Оценка популяции микроорганизмов на продукции)
ISO 11737-2:2003 Sterilisation of medical devices. Microbiological methods. Part 2. Tests of sterility performed in the validation of a sterilization process (Стерилизация медицинских изделий. Микробиологические методы. Часть 2. Испытания на стерильность, проводимые при валидации процессов стерилизации)
ISO 13485:2003 Medical devices Quality management systems — Requirements for regulatory purposes (Изделия медицинские. Системы менеджмента качества. Системные требования для целей регулирования)
3 Термины, определения и обозначения
3.1 Термины и определения
В настоящем стандарте применены термины по ISO 11137-1, а также следующие термины с соответствующими определениями:
3.1.1 партия (batch): Определенное количество изделий, являющихся или предполагаемых единообразными похарактеру и качеству, которые были изготовлены в определенном цикле производства.
[ISO/TS 11139:2006]
3.1.2 бионагрузка (bioburden): Популяция жизнеспособных организмов на/в продукции и/или системе защиты стерильности.
[ISO/TS 11139:2006]
Издание официальное
3.1.3 ложноположительный результат (false positive): Результат испытания, интерпретируемый как появление роста числа микроорганизмов, принадлежащих испытуемой продукции или ее части, в то время как этот рост обусловлен внешним микробным загрязнением или помутнением, вызванным взаимодействием между продукцией или ее частями и испытательной средой.
3.1.4 доля положительных результатов (fraction positive): Коэффициент, в котором числитель показывает число положительных испытаний, а знаменатель — число проведенных испытаний.
3.1.5 возрастающая доза (incremental dose): Возрастающий ряд значений дозы, при которых облучается определенное количество продукции или ее частей, при определении и подтверждении стерилизующей дозы по методу 2В.
3.1.6 отрицательный результат испытания на стерильность (отрицательный тест) (negative test of sterility): Результат испытания, который не показывает никакого микробного роста в продукции или ее части, подвергнутых тесту на стерильность.
3.1.7 упаковочный комплект (packaging system): Комбинация системы защиты стерильности и защитной упаковки.
[ISO/TS 11139:2006]
3.1.8 положительный результат испытания на стерильность (положительный тест) (positive test of sterility): Результат испытания, который показывает микробный рост из продукции или ее части, подвергнутых тесту на стерильность.
3.1.9 часть продукции для испытания (ЧПИ) [sample item portion (SIP)]: Определенная часть медицинской продукции, которая испытывается.
3.1.10 система защиты стерильности (sterile barrier system): Минимальная упаковка, которая предотвращает проникновение микроорганизмов и обеспечивает асептическое представление продукции в месте использования.
3.1.11 уровень обеспечения стерильности (УС) [sterility assurance level (SAL)]: Вероятность возникновения жизнеспособного микроорганизма на единице продукции после стерилизации.
[ISO/TS 11139:2006]
Примечание — Данный термин имеет количественное значение, обычно 10-6 или 10-3. При применении этого количественного значения к обеспечению стерильности УС = 10-6 имеет более низкое значение, но дает более высокий уровень обеспечения стерильности, чем УС = 10-3.
3.1.12 проверка стерилизующей дозы (sterilization dose audit): Процедура, предпринятая для подтверждения соответствия установленной стерилизующей дозы.
3.1.13 верификационная доза (verification dose): Значение дозы, обеспечивающее УС = 10-2 для единицы продукции, используемое при определении стерилизующей дозы.
3.2 Обозначения
В настоящем стандарте применены следующие обозначения:
3.2.1 А — доза для корректировки средней дозы ffp путем ее уменьшения до дозы FFP.
3.2.2 CD* — число испытаний на стерильность с положительным результатом, полученное на основе испытаний, проведенных индивидуально на 100 единицах продукции, облученных в эксперименте с проверочной дозой по методу 2.
3.2.3 сГ — доза, полученная из эксперимента с возрастающей дозой, проведенного на единицах продукции, взятых изданной партии.
3.2.4 D* — первоначальная оценка дозы, обеспечивающей УС = 10-2 для испытываемых единиц продукции.
Примечание — Обычно это среднее из значений 3d*, полученных для данной продукции.
3.2.5 D** — окончательная оценка дозы, обеспечивающей УС = 10-2 для испытываемых единиц продукции, которая используется при вычислении стерилизующей дозы.
3.2.6 DD* — доза, подаваемая в эксперименте с проверочной дозой по методу 2.
3.2.7 DS — оценка значения D10 для микроорганизмов, присутствующих на продукции после облучения дозой DD*.
3.2.8 3Ha4eHueD(Dvalue,D10value) — время или доза, требуемые для обеспечения инактивации 90 % популяции испытываемых микроорганизмов при установленных условиях.
[ISO/TS 11139:2006]
Примечание — В настоящем документе D10 применяется только для обозначения дозы, а не времени.
3.2.9 первая дробная положительная доза (first fraction positive dose) ffp — самая низкая доза в ряду возрастающих доз, применяемых для единиц продукции, взятых из данной партии изделий, при
2
ГОСТ ISO 11137-2-2011
которой как минимум одно из 20 одинаковых испытаний на стерильность имеет отрицательный результат.
3.2.10 первая дробная положительная доза (First Fraction Positive dose)
FFP — доза, при которой ожидается 19 положительных результатов из 20 испытаний на стерильность, вычисленная путем вычитания Л из среднего значения 3 ffp доз.
3.2.11 первая доза без положительных результатов (First No Positive dose)
FNP — оценка дозы, обеспечивающей УС = 10-2 для испытываемых единиц продукции, которая используется в вычислении DS.
3.2.12 VD^ax — максимальная проверочная доза для подтверждения правильности выбора стерилизующей дозы 15 кГр, обеспечивающей достижение УС = 10-6 для данной бионагрузки.
3.2.13 — максимальная проверочная доза для подтверждения правильности выбора сте
рилизующей дозы 25 кГр, обеспечивающей достижение УС = 10-6 для данной бионагрузки.
4 Определение и техническое обслуживание серии продукции для установления, обоснования и проверки стерилизующей дозы4.1 Общие вопросы
Установление стерилизующей дозы и проведение проверки стерилизующей дозы являются процедурами, которые составляют часть определения процесса (см. ISO 11137-1, раздел 8) и поддержания эффективности процесса (см. ISO 11137-1, раздел 12). Для этих процедур продукцию можно сгруппировать по сериям; определение серии продукции основано главным образом на числе и типах микроорганизмов, присутствующих на или в продукции (бионагрузка). Тип микроорганизма характеризуется его стойкостью к облучению. Такие параметры, как плотность и конфигурация продукта в пределах упаковочного комплекта, не учитываются при установлении серии продукции, потому что они не являются факторами, которые влияют на бионагрузку.
При использовании серии продукции для установления стерилизующей дозы и для проверки этой дозы важно знать о рисках, таких как уменьшение возможности обнаружения случайного изменения в пределах производственного процесса, которое влияет на эффективность стерилизации. Кроме того, при использовании единичного продукта для представления серии продукции можно не обнаружить изменений, которые происходят в других компонентах этой серии продукции. Оценка риска, связанного с уменьшением возможности обнаружения изменений в других компонентах серии продукции, а также разработка и реализация плана технического обслуживания серии продукции должны быть проведены перед испытаниями.
Примечание — См. ISO 14971 для руководящих указаний по менеджменту рисков.
4.2 Определение серийности продукции
4.2.1 Критерии для определения серийности продукции должны быть документированы. Продукцию оценивают по этим критериям, и рассматриваются сходные черты между потенциальными компонентами серии продукции. Рассмотрение включает все параметры, связанные с продукцией, которые влияют на бионагрузку, включая, но не ограничиваясь этим, к ним относятся:
a) природа и источники сырьевых материалов, включая влияние (если таковое имеется) сырьевых материалов, которые могли быть получены более чем из одного источника;
b) компоненты;
c) конструкция и размер продукции;
d) производственный процесс;
e) производственное оборудование;
f) производственная среда;
д) местонахождение производства.
Результат оценки и рассмотрения должен быть документирован (см. ISO 11137-1:2006, пункт 4.1.2).
4.2.2 Продукт только тогда включают в серию продукции, когда подтверждается, что относящиеся к нему параметры (см. 4.2.1) аналогичны и находятся под контролем.
4.2.3 Для того, чтобы продукт был введен в серию продукции, должно быть продемонстрировано, что бионагрузка включает аналогичное число и аналогичные типы микроорганизмов.
4.2.4 Включение продукта более чем из одного местонахождения производства в серию продукции должно быть специально обосновано и документировано (см IS011137-1:2006, пункт 4.1.2). Должно быть рассмотрено влияние на бионагрузку:
а) географических и/или климатических различий между местонахождениями производства;
3
b) любых различий в управлении производственным процессом или окружающей средой;
c) источников сырьевых материалов и вспомогательных средств обработки (например, вода).
4.3 Обозначение продукта, представляющего серию продукции для проведения эксперимента с проверочной дозой или проверки стерилизующей дозы4.3.1 Изделие для представления как серия продукции
4.3.1.1 Число и типы микроорганизмов на или в изделии должны применяться как основание для выбора изделия, которое будет представлять серию продукции.
4.3.1.2 Серия продукции должна быть представлена:
a) главным изделием (см. 4.3.2)
или
b) эквивалентным изделием (см. 4.3.3),
или
c) имитирующим изделием (см. 4.3.4).
4.3.1.3 Формальная документированная оценка предпринимается для решения, какой из трех потенциальных представительных продуктов в 4.3.1.2 является подходящим. В этой оценке рассматривают следующее:
a) число микроорганизмов, составляющих бионагрузку;
b) типы микроорганизмов, составляющих бионагрузку;
c) окружающая среда, в которой появляются микроорганизмы;
d) размер продукта;
e) число компонентов;
f) сложность продукта;
д) степень автоматизации производства;
h) производственная среда.
4.3.2 Главное изделие
Элемент серии продукции считается главным изделием только тогда, когда оценка (см. 4.3.1.3) показывает, что признак этого элемента выше всех других элементов серии продукции. В некоторых ситуациях может быть несколько элементов в пределах серии продукции, каждый из которых может считаться главным продуктом. В таких случаях каждый из этих элементов может быть выбран как главное изделие, чтобы представлять серию продукции согласно 4.3.3.
4.3.3 Эквивалентное изделие
Группа продуктов считается эквивалентной только в том случае, если оценка (см. 4.3.1.3) показывает, что для элементов группы требуется одинаковая стерилизующая доза. Выбор эквивалентного продукта для представления серии должен быть случайным или согласно запланированной схеме включения различных элементов серии продукции. Объем производства и наличие продуктов следует учитывать при выборе эквивалентного продукта для представления серии продукции.
4.3.4 Имитирующее изделие
Имитирующее изделие может представлять серию продукции только в том случае, если оно составляет аналогичную или более значительную проблему для процесса стерилизации, чем элементы серии продукции. Имитирующее изделие упаковывают таким же образом и с использованием таких же материалов, что и подлинный продукт.
Примечание — Имитирующее изделие не предназначено для клинического использования; его изготовляют только для установления или поддержания стерилизующей дозы.
Имитирующее изделие может быть:
a) изделием, аналогичным подлинному продукту по материалу и размеру и подвергаемым аналогичным производственным процессам (например, кусок материала, используемый для имплантатов, который проходит через весь производственный процесс);
b) комбинацией компонентов из продуктов в пределах серии продукции, которые, как правило, не комбинируются для использования (например, набор трубок, содержащий разнообразные фильтры, зажимы и задвижки, которые являются компонентами других продуктов в этой серии продукции).
4.4 Техническое обслуживание серии продукции4.4.1 Периодическая экспертиза
Экспертиза должна проводиться с установленной частотой для гарантии, что серия продукции и продукты, используемые для представления каждой серии, остаются действительными. Ответствен-
4
ность за экспертизу продукта и/или процесса, которые могли повлиять на состав серии продукции, принадлежит компетентному персоналу. Такие проверки должны проводиться не меньше одного раза в год. Результат экспертизы должен быть документирован согласно ISO 11137-1:2006, пункт 4.1.2.
4.4.2 Модификация продукции и/или производственного процесса
Модификации продукции, связанные с сырьевыми материалами (природа и источник), компонентами или конструкцией продукции (включая размер), и/или модификации производственного процесса, связанные с оборудованием, окружающей средой или местонахождением, должны оцениваться посредством официальной документированной системы контроля изменений. Такие модификации могут изменять положения, на основе которых была определена серия продукции или сделан выбор продукта для представления серии. Значительные модификации могут потребовать определения новой серии продукции или выбора другого образца продукции.
4.4.3 Регистрация данных
Регистрационные данные о сериях продукции следует хранить в соответствии с IS011137-1:2006, пункт4.1.2.
4.5 Действия в случае обнаружения несоответствия стерилизующей дозы для серии продукции
При установлении или проведении проверки стерилизующей дозы в случае обнаружения несоответствия значения стерилизующей дозы следует считать, что это значение стерилизующей дозы не соответствует всем элементам данной серии продукции. Соответствующие действия должны применяться ко всем продуктам, содержащим данную серию.
5 Выбор и испытание продукции для установления и проверки стерилизующей дозы
5.1 Характеристика продукции
5.1.1 Продукция для стерилизации может состоять из:
a) индивидуального медицинского продукта в упаковочном комплекте;
b) набора компонентов в упаковочном комплекте, которые собирают в месте использования для составления медицинского продукта, вместе с аксессуарами для использования этого продукта в сборе;
c) нескольких медицинских продуктов в упаковочном комплекте;
d) набора, включающего разнообразные медицинские продукты, связанные с процедурами.
Единицы продукции для установления и обоснования дозы берутся согласно таблице 1.
|
Таблица 1 —Характеристика единиц продукции для установления и проверки стерилизующей дозы | |||||||||||||||||||||
| |||||||||||||||||||||