ГОСТ 33638-2015
Методы испытаний химической продукции, представляющей опасность для окружающей среды. Испытания по воздействию на половозрелость рыб
Купить ГОСТ 33638-2015 — бумажный документ с голограммой и синими печатями. подробнее
Распространяем нормативную документацию с 1999 года. Пробиваем чеки, платим налоги, принимаем к оплате все законные формы платежей без дополнительных процентов. Наши клиенты защищены Законом. ООО "ЦНТИ Нормоконтроль"
Наши цены ниже, чем в других местах, потому что мы работаем напрямую с поставщиками документов.
Способы доставки
- Срочная курьерская доставка (1-3 дня)
- Курьерская доставка (7 дней)
- Самовывоз из московского офиса
- Почта РФ
Устанавливает метод испытания воздействия веществ на половозрелость рыб FSDT in vivo, предназначенный для обнаружения химических веществ с андрогенными и эстрогенными свойствами, а также антиандрогенными, антиэстрогенными и ингибирующими стероидогенез свойствами.
Содержит требования OECD Test No 234:2011
Оглавление
1 Область применения
2 Термины и определения
3 Общие положения
4 Принцип метода
5 Информация об испытуемом веществе
6 Описание метода
6.1 Испытательные камеры
6.2 Выбор тестовых видов
6.3 Содержание родительского стада рыб
6.4 Обращение с эмбрионами и личинками
6.5 Вода
6.6 Испытуемые растворы
7 Проведение испытания
7.1 Условия воздействия
7.2 Испытуемые концентрации
7.3 Контроль
7.4 Периодичность аналитических определений и измерений
7.5 Наблюдения и измерения
7.6 Отбор рыбы
7.7 Отбор проб для анализа VTG и определения пола с помощью гистологического исследования
7.8 Измерение VTG
7.9 Определение пола
7.10 Вторичные половые признаки
8 Данные и отчет о проведении испытания
8.1 Обработка результатов
8.2 Соотношение полов и генетический пол
8.3 Концентрации VTG
8.4 Интерпретация результатов
8.5 Отчет о проведении испытания
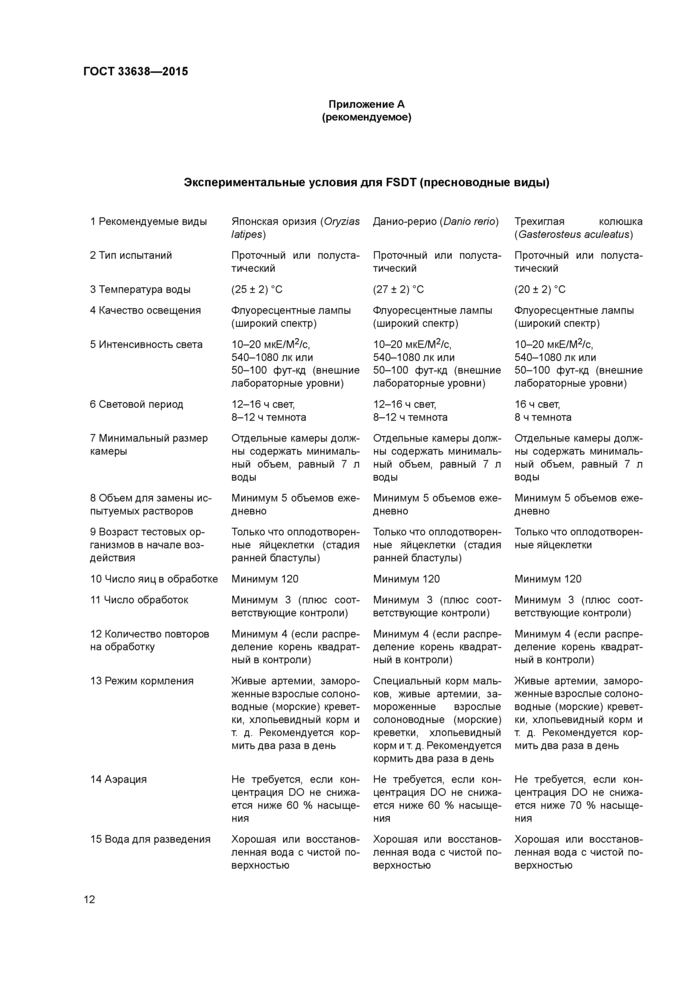
Приложение А (рекомендуемое) Экспериментальные условия для FSDT (пресноводные виды)
Приложение Б (рекомендуемое) Химические характеристики приемлемой воды для разведения
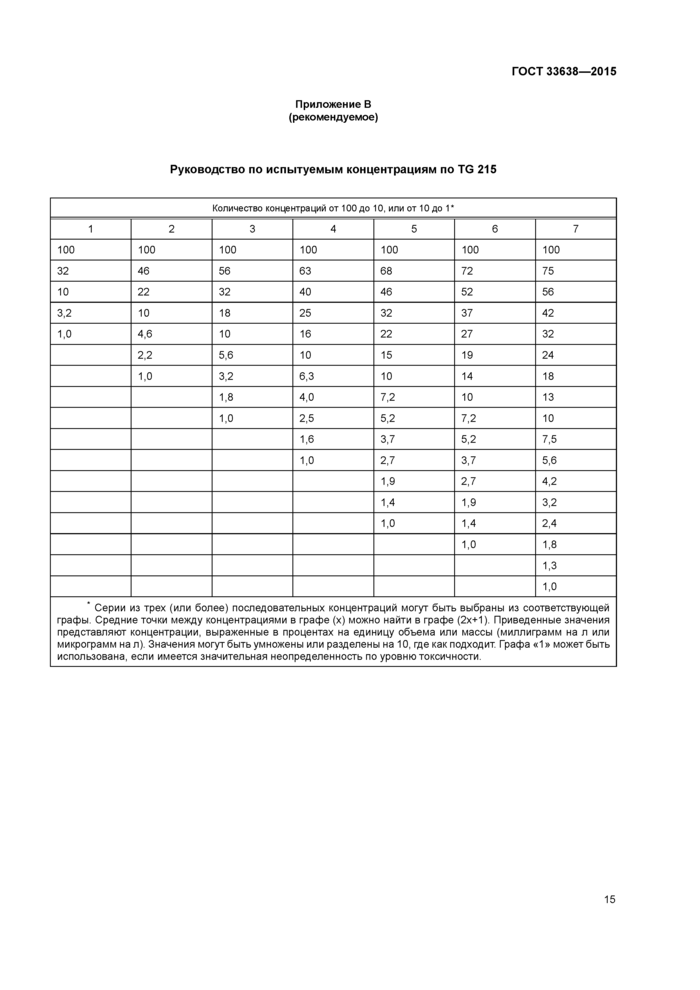
Приложение В (рекомендуемое) Руководство по испытуемым концентрациям по TG 215
Приложение Г (рекомендуемое) Руководство по гомогенизации головной и хвостовой частей от неполовозрелых данио-рерио, черного толстоголова, трехиглой колюшки и японской оризии
Приложение Д (рекомендуемое) Руководство для количественного определения вителлогенина в гомогенате головного и хвостового концов у данио-рерио
Приложение Е (рекомендуемое) Руководство по подготовке тканевых срезов для определения пола и стадии гонад
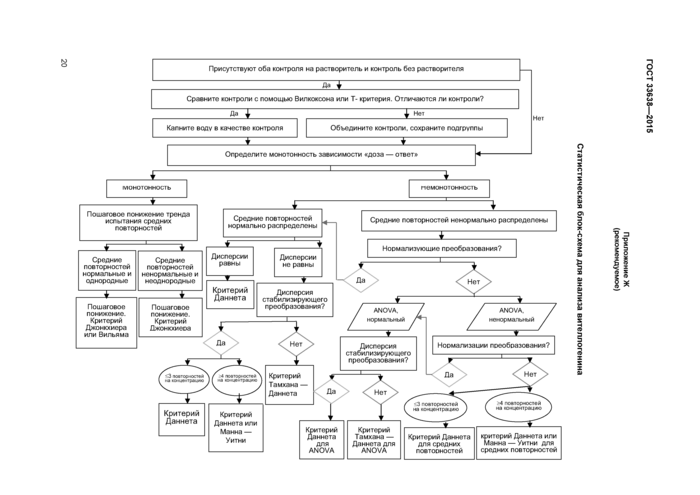
Приложение Ж (рекомендуемое) Статистическая блок-схема для анализа вителлогенина
Приложение И (рекомендуемое) Статистическая блок-схема для анализа соотношения полов
Приложение К (рекомендуемое) Руководство по отбору проб тканей для определения генетического пола и для определения генетического пола с помощью PCR-метода
Приложение Л (рекомендуемое) Руководство по отбору проб тканей для определения генетического пола с использованием PCR у трехиглой колюшки
Приложение М (рекомендуемое) Руководство по процедуре искусственного оплодотворения для трехиглой колюшки
Приложение ДА (справочное) Сравнение структуры международного документа со структурой настоящего стандарта
Библиография
| Дата введения | 01.09.2016 |
|---|---|
| Добавлен в базу | 01.02.2017 |
| Актуализация | 01.01.2021 |
Этот ГОСТ находится в:
- Раздел Экология
Организации:
| 27.10.2015 | Утвержден | Межгосударственный Совет по стандартизации, метрологии и сертификации | 81-П |
|---|---|---|---|
| 13.11.2015 | Утвержден | Федеральное агентство по техническому регулированию и метрологии | 1780-ст |
| Разработан | ФГУП ВНИИ СМТ | ||
| Издан | Стандартинформ | 2015 г. |
Testing of chemicals of environmental hazard. Fish sexual development test
Чтобы бесплатно скачать этот документ в формате PDF, поддержите наш сайт и нажмите кнопку:

стр. 1

стр. 2

стр. 3

стр. 4

стр. 5

стр. 6

стр. 7

стр. 8
стр. 9

стр. 10

стр. 11

стр. 12

стр. 13

стр. 14

стр. 15

стр. 16

стр. 17
стр. 18

стр. 19

стр. 20
стр. 21

стр. 22

стр. 23

стр. 24

стр. 25
стр. 26
стр. 27

стр. 28

стр. 29

стр. 30
МЕЖГОСУДАРСТВЕННЫЙ СОВЕТ ПО СТАНДАРТИЗАЦИИ, МЕТРОЛОГИИ И СЕРТИФИКАЦИИ
(МГС)
INTERSTATE COUNCIL FOR STANDARDIZATION, METROLOGY AND CERTIFICATION
(ISC)
МЕЖГОСУДАРСТВЕННЫЙ
СТАНДАРТ
МЕТОДЫ ИСПЫТАНИЙ ХИМИЧЕСКОЙ ПРОДУКЦИИ, ПРЕДСТАВЛЯЮЩЕЙ ОПАСНОСТЬ ДЛЯ ОКРУЖАЮЩЕЙ СРЕДЫ
Испытания по воздействию на половозрелость рыб
(OECD, Test No 234:2011, MOD)
Издание официальное
ГОСТ
33638—
2015
|
Москва Стандартинформ 2016 |
Предисловие
Цели, основные принципы и основной порядок проведения работ по межгосударственной стандартизации установлены ГОСТ 1.0-92 «Межгосударственная система стандартизации. Основные положения» и ГОСТ 1.2-2009 «Межгосударственная система стандартизации. Стандарты межгосударственные, правила и рекомендации по межгосударственной стандартизации. Правила разработки, принятия, применения, обновления и отмены»
Сведения о стандарте
1 ПОДГОТОВЛЕН Федеральным государственным унитарным предприятием «Всероссийский научно-исследовательский институт стандартизации материалов и технологий» (ФГУП «ВНИИ СМТ») на основе аутентичного перевода на русский язык документа, указанного в пункте 5
2 ВНЕСЕН Федеральным агентством по техническому регулированию и метрологии (Росстандарт)
3 ПРИНЯТ Межгосударственным советом по стандартизации, метрологии и сертификации (протокол от 27 октября 2015 г. № 81-П)
|
За принятие стандарта проголосовали: | ||||||||||||||||||
|
4 Приказом Федерального агентства по техническому регулированию и метрологии от 13 ноября 2015 г. № 1780-ст межгосударственный стандарт ГОСТ 33638-2015 введен в действие в качестве национального стандарта Российской Федерации с 1 сентября 2016 г.
5 Настоящий стандарт модифицирован по отношению к международному документу OECD, Test No. 234:2011 Fish Sexual Development Test (ОЭСР, Тест № 234:2011 Испытания по воздействию на по-ловозрелость рыб) путем изменения структуры.
Сравнение структуры международного документа со структурой настоящего стандарта приведено в приложении ДА.
Перевод с английского языка (ел).
Степень соответствия — модифицированная (MOD)
6 ВВЕДЕН ВПЕРВЫЕ
ГОСТ 33638-20156.5 Вода
В качестве испытуемой воды подходит любая вода, в которой тестовые виды в контроле выживают по меньшей мере также, как в воде, описанной в приложении Б. Она должна быть постоянного качества в течение всего периода испытания. В целях гарантии того, что вода для разведения не оказывает существенного влияния на результаты испытания (например, за счет взаимодействия с испытуемым веществом) или негативно воздействует на производительность родительского стада, через определенные интервалы времени отбирают воду для анализа. Такие показатели, как общий органический углерод, проводимость, pH и содержание взвешенных твердых частиц измеряют, например, раз в три месяца, когда известно, что вода для разведения относительно постоянна по своему качеству. Измерения тяжелых металлов (например, Си, Pb, Zn, Hg, Cd, Ni), основных анионов и катионов (например, Са, Mg, Na, К, Cl, SO^ и пестицидов необходимо проводить, если качество воды вызывает сомнение. Подробная информация о химическом анализе и отборе проб воды приведена в 7.4.1.
6.6 Испытуемые растворы
6.6.1 Если это возможно с практической точки зрения, то используют проточную систему. При проведении испытаний с проточным дизайном для доставки серии концентраций в испытательные камеры необходима система, непрерывно дозирующая и разбавляющая исходный стоковый раствор испытуемого вещества (например, дозирующий насос, пропорциональный разбавитель и сатурационная система). Скорость потоков растворов и воды для разведения проверяют через определенные интервалы времени в ходе испытания, и они не должны изменяться более чем на 10 % в течение всего испытания. Подходящая скорость потока составляет не менее пяти объемов испытательных камер за 24 ч [4]. Не используют пластиковые трубки или другие материалы, содержащие биологически активные химические вещества или вещества, адсорбирующие испытуемое вещество.
6.6.2 Стоковый раствор предпочтительно готовят без использования растворителей простым смешиванием или перемешиванием испытуемого вещества в воде для разведения с помощью механических средств (например, встряхиванием или ультразвуком). Если испытуемое вещество трудно растворимо в воде, то используют процедуры, описанные в Руководстве ОЭСР по работе с веществами, с которыми трудно проводить манипуляции [38]. Предпочтительно растворитель не используют, но в некоторых случаях он применяется для получения достаточно концентрированного стокового раствора. Примеры подходящих растворителей приведены в ссылке [38].
6.6.3 Следует избегать полустатических условий испытаний, если только на то не имеются веские причины, связанные с испытуемым веществом (например, его стабильностью, ограниченной доступностью, высокой стоимостью или опасностью при применении). Для полустатического метода выполняют две различные процедуры восстановления. В первом случае новые испытуемые растворы готовят в чистых камерах, и выжившие яйца и личинки осторожно переносят в новые камеры, во втором тестовые организмы остаются в испытательных камерах, а часть (не менее двух третей) испытуемой воды меняется ежедневно.
7 Проведение испытания7.1 Условия воздействия7.1.1 Сбор яиц и продолжительность
7.1.1 Сбор яиц и продолжительность
Для предупреждения генетического смещения яйца собирают минимум от трех пар или групп, предназначенных для разведения, смешивают и произвольно отбирают для начала испытания. Описание искусственного оплодотворения для трехиглой колюшки приведено в приложении Л. Испытание начинают как можно раньше после оплодотворения яиц, предпочтительно эмбрионы погружают в испытуемые растворы, прежде чем начнется расщепление бластодиска, или сразу же после этой стадии и не позднее 12 ч после оплодотворения. Испытание продолжается до завершения половой дифференциации в контрольной группе (60 сут после вылупления для японской оризии, трехиглой колюшки и данио-рерио).
7.1.2 Загрузка
В начале испытания число оплодотворенных яиц должно составлять не менее 120 на каждую концентрацию, которые разделяют между не менее четырьмя повторностями (для контроля принято распределение квадратный корень). Яйца произвольно распределяют (с помощью статистических таблиц
5
для рандомизации) между обработками. Уровень загрузки должен быть достаточно низким для поддержания концентрации растворенного кислорода на уровне не менее 60 % ASV без прямой аэрации камер. Для испытаний в проточных условиях рекомендуемый уровень загрузки составляет не более 0,5 г/л за 24 ч и не более 5 г/л раствора в любое время. Не позднее 28 сут после оплодотворения имеющееся количество рыбы в повторностях перераспределяют таким образом, чтобы по возможности в каждой повторности находилось равное количество рыбы. Если при воздействии испытуемого химического вещества имеет место гибель рыбы, то количество повторностей сокращают таким образом, чтобы по возможности плотность рыбы поддерживалась равной для отдельных концентраций.
7.1.3 Свет и температура
Световой период и температура воды должны соответствовать содержанию тестовых видов. Условия для FSDT приведены в приложении А.
7.1.4 Кормление
Корм и кормление являются критическими факторами, и очень важно, чтобы необходимое количество корма обеспечивалось для каждой стадии в соответствующие интервалы времени и на уровне, достаточном для поддержания нормального роста. Рыб кормят вволю с небольшим избытком. Для получения достаточной скорости роста рыбу кормят не менее двух раз в день (допускается один раз в день по выходным) с интервалом не менее трех часов между каждым кормлением. Излишки корма и фекалии удаляют по мере необходимости для предупреждения накопления отходов и выделений. Корма и режимы кормления постоянно корректируются по мере накопления опыта для улучшения выживаемости и оптимизации роста. Следовательно, должна быть проведена предварительная работа для подтверждения предлагаемого режима кормления признанными экспертами в этой области. Кормление прекращают за 24 ч до окончания испытания. Примеры соответствующего корма перечислены в приложении А и [39].
7.2 Испытуемые концентрации
7.2.1 Испытуемые вещества размещают согласно приложению В. Минимум три испытуемые концентрации используют не менее чем в четырех повторностях. При выборе диапазона испытуемых концентраций учитывают результаты острого опыта, в частности, кривую зависимости 1_С50 от периода воздействия. Если результаты будут использоваться для оценки риска, то рекомендуется пять испытуемых концентраций
7.2.2 Не следует тестировать концентрации химических веществ, на 10 % превышающие LC50, установленную в опыте для взрослых особей, или менее 10 мг/л. Максимальная испытуемая концентрация должна составлять 10 % значения 1_С50 для особей, находящихся на личиночной/неполовозре-лой стадии развития.
7.3 Контроль
7.3.1 Дополнительно к испытуемым концентрациям ставят контроль на воду для разведения (не менее четырех повторностей) и при необходимости контроль на растворитель (не менее четырех повторностей). В испытании используют только проверенные растворители для исключения статистически значимого влияния на параметры испытания.
7.3.2 Если используется растворитель, то его конечная концентрация не должна превышать 0,1 мл/л [38], и она должна быть одинаковой во всех испытательных камерах, за исключением контроля на воду для разведения. Однако по возможности такой растворитель не используют или используют его в минимальной концентрации.
7.4 Периодичность аналитических определений и измерений
7.4.1 Химический анализ концентраций испытуемого вещества проводят до начала испытания для проверки соответствия критериям приемлемости. Все повторности анализируют по отдельности в начале и конце испытания. Во время испытания одна повторность на каждую испытуемую концентрацию анализируется не менее одного раза в неделю, изменяясь систематически между повторностями (1,2, 3,4,1,2,...). Если пробы оставляют для анализа на более позднее время, то способ хранения проб должен быть предварительно валидирован. Пробы фильтруют (например, с использованием фильтра с размером пор 0,45 мкм) или центрифугируют для гарантии того, что анализ выполняется на истинном растворе химического вещества.
7.4.2 В ходе испытания во всех испытательных камерах измеряют такие показатели, как содержание растворенного кислорода, pH, общую жесткость, проводимость, соленость (при необходимости) 6
ГОСТ 33638-2015
и температуру. Один раз в неделю измеряют как минимум содержание растворенного кислорода, соленость (при необходимости) и температуру, в то время как pH, проводимость и жесткость — в начале и конце испытания. Температуру желательно контролировать постоянно как минимум в одной испытательной камере.
7.4.3 Результаты должны основываться на измеренных концентрациях. Однако если концентрация испытуемого вещества в ходе всего испытания в растворе сохранялась на удовлетворительном уровне, например в пределах ± 20 % номинальной концентрации, то результаты могут основываться на номинальных или на измеренных значениях концентрации испытуемого вещества.
7.5 Наблюдения и измерения7.5.1 Стадия эмбрионального развития
Воздействие начинают сразу же после оплодотворения до расщепления бластодиска и не позднее 12 ч после оплодотворения для того, чтобы охватить стадии раннего эмбрионального развития.
7.5.2 Вылупление и выживаемость
Наблюдения за вылуплением и выживаемостью проводят не менее одного раза в сутки, и данные регистрируют. Мертвые эмбрионы, личинки и молоди рыбы удаляют сразу же при обнаружении, поскольку они быстро разлагаются и оказывают негативное действие на других рыб. Особую осторожность следует соблюдать при удалении мертвых особей, чтобы не ударить и физически не повредить прилегающие к ним яйца/личинки, которые являются очень хрупкими и чувствительными ко всякому воздействию. Критерии гибели различаются в зависимости от стадии развития:
- для яиц, особенно на ранних стадиях, имеет место потеря прозрачности и изменение окраски, вызванные свертыванием и/или осаждением белка, что приводит к появлению белого матового внешнего вида;
- для личинок и молоди рыб неподвижность и/или отсутствие дыхательных движений, и/или отсутствие сердечных сокращений, и/или белая матовая окраска центральной нервной системы, и/или отсутствие реакции на механические раздражители.
7.5.3 Аномальный внешний вид
Регистрируют количество личинок или рыб с аномальной формой тела и описывают внешний вид и характер аномалий. Необходимо отметить, что аномальные эмбрионы и личинки встречаются и в норме, и для некоторых видов могут составлять порядка нескольких процентов в контроле(ях). Аномальных особей удаляют из испытательных камер только в случае гибели. Однако это может противоречить некоторым принятым локальным правилам, и если отмечаются значительные страдания (суверенностью можно прогнозировать очень тяжелый и летальный исход), то рыбу подвергают анестезии и эвтаназии согласно 5.6.1 и учитывают как гибель при анализе данных.
7.5.4 Аномальное поведение
По внешнему виду регистрируют аномалии, например гипервентиляцию, нескоординированное плавание, аномальную неподвижность и атипичное пищевое поведение.
7.5.5 Масса
В конце испытания всех выживших рыб подвергают эвтаназии (анестезию проводят при отборе пробы крови) и измеряют индивидуальную массу тела (после промакивания насухо).
7.5.6 Длина
7.5.6.1 В конце испытания измеряют длину тела у отдельных рыб (стандартную длину).
7.5.6.2 Результаты указанных измерений являются основой части или всех следующих данных, приводимых в отчете:
- общая гибель;
- число здоровой рыбы в конце испытания;
- время начала и окончания вылупления;
- длина и масса выживших особей;
- число деформированных личинок;
- число рыб, проявляющих аномальное поведение.
7.6 Отбор рыбы
Отбор рыбы проводят в конце испытания. Отобранную рыбу подвергают эвтаназии, например с использованием MS-222 (100-500 мг на 1 л, забуференном 200 мг NaHC03 на л) или FA-100 (4-аллил-2-метоксифенол: эвгенол), и измеряют сырую массу каждой рыбы (после промакивания насухо) или проводят анестезию, если требуется отобрать пробы крови (см. 7.7.2.3).
7
7.7 Отбор проб для анализа VTG и определения пола с помощью гистологического исследования
7.7.1 Всю рыбу отбирают и подготавливают для определения пола и VTG. Для определения пола проводят гистологический анализ всей рыбы. Для измерения VTG берут подгруппу не менее из 16 рыб из каждой повторности. Если полученные результаты по подгруппе являются неопределенными, то анализ VTG проводят на большем количестве рыбы.
7.7.2 Процедура отбора проб для анализа VTG и определения пола зависит от метода анализа
VTG.
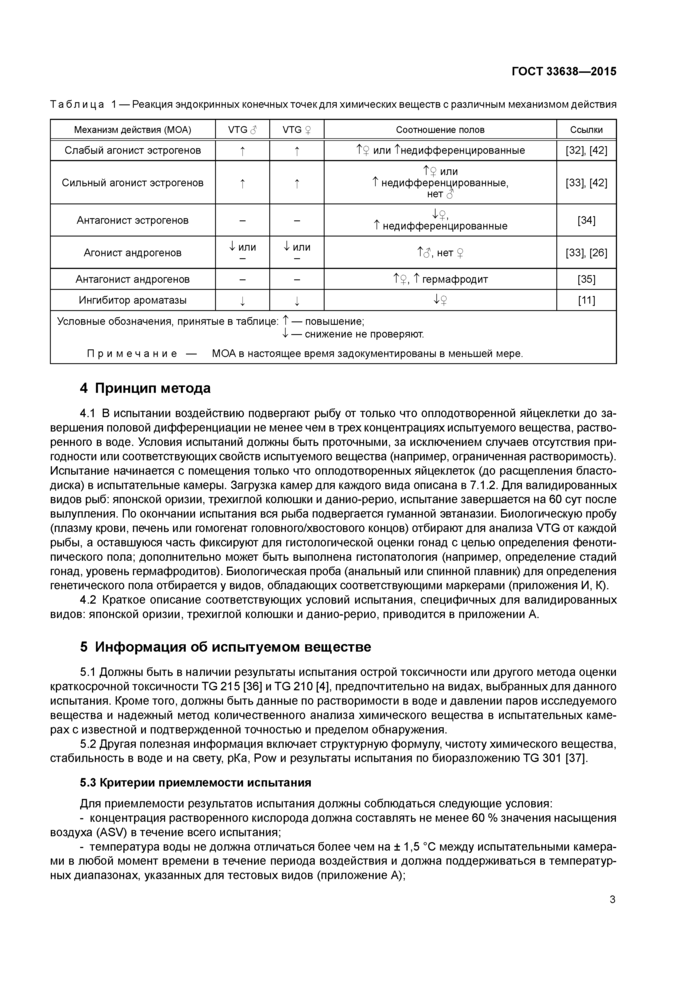
7.7.2.1 Метод с гомогенатом головного/хвостового концов для анализа VTG Рыбу подвергают эвтаназии. Голову и хвост каждой рыбы отделяют от тела срезами, сделанными непосредственно сзади грудных плавников и непосредственно сзади спинного плавника, с помощью скальпеля (см. рисунок 1). Головную и хвостовую часть от каждой рыбы объединяют, взвешивают, индивидуально нумеруют, замораживают в жидком азоте и хранят для анализа на VTG при температуре - 70 °С или ниже. Часть туловища рыбы нумеруют и фиксируют в соответствующем фиксаторе для последующего гистологического анализа [27]. С использованием данного метода анализа VTG и гистопатологии оценивают каждую особь, и, таким образом, возможное изменение уровня VTG может быть связано с фенотипическим полом рыбы или генетическим полом рыбы (японской оризии и трехиглой колюшки). Дополнительная информация приведена в приложениях Г и Д.
|
Срез сзади спинного плавника Срез сзади грудного плавника Рисунок 1 — Способ приготовления срезов рыбы для измерения VTG в гомогенате головного/хвостового концов и гистологической оценки средней части |
1.1.2.2 Метод с гомогенатом печени для анализа VTG
Рыбу подвергают эвтаназии. Печень извлекают и хранят при -70 °С или ниже. Рекомендуемые процедуры для извлечения печени и предварительной обработки приведены в TG 229 [40] или 230 [41]. Затем печень от каждой рыбы гомогенизируют по отдельности, как описано в TG 229 и 230. Собранную надосадочную жидкость используют для измерения VTG с использованием ELISA (см. для примера количественной оценки приложение Д для данио-рерио или TG 229 для японской оризии). Следуя данному подходу, также можно иметь соответствующие данные по каждой рыбе как по VTG, так и гистологии гонад.
7.7.2.3 Метод с плазмой крови для анализа VTG
Отбирают кровь от анестезированной рыбы сердечной пункцией, срезом хвостовой вены или хвоста, и центрифугируют при температуре 4 °С для получения плазмы. До использования плазму хранят при температуре - 70 °С или ниже. Всю рыбу подвергают эвтаназии и фиксируют для гистологического исследования. Для соответствия VTG с полом рыбы пробы плазмы крови и рыбы нумеруют по отдельности.
77.2.4 Определение генетического пола
Биологическую пробу для определения генетического пола отбирают индивидуально от каждой рыбы, имеющей соответствующий видовой маркер. У японской оризии отбирают анальный или спинной плавник. В приложении И приведено подробное описание, включая отбор проб тканей и определение пола с помощью PCR-метода. Аналогично для трехиглой колюшки в приложении К приведено описание отбора проб ткани и определение пола PCR-методом.
7.8 Измерение VTG
Измерение VTG должно основываться на количественно и аналитически валидированном методе. Должна быть представлена информация по внутрилабораторной и межлабораторной вариабельности
8
ГОСТ 33638-2015
метода, используемого в данной лаборатории. Причиной меж- и внутрилабораторной вариабельности (вероятнее всего) являются различные стадии развития в популяции рыб. С учетом вариабельности определения VTG значения NOEC, основанные только на одной конечной точке, следует интерпретировать с большой осторожностью. Имеются различные аналитические методы оценки синтеза VTG на видах рыб, используемых в настоящем методе. Относительно чувствительной и специфичной методикой проведения измерения является определение концентрации белка с помощью иммуноферментного твердофазного анализа (ELISA). Следует использовать гомологичные антитела (продуцированные на VTG у рыбы того же вида) и наиболее широко применяемые гомологичные стандарты.
7.9 Определение пола
7.9.1 В зависимости от процедуры отбора проб для анализа VTG целую рыбу или оставшуюся среднюю часть каждой рыбы помещают в предварительно промаркированные кассеты для гистологической проводки и фиксируют в соответствующем фиксаторе для гистологического определения пола (при необходимости также для определения стадии гонад). Руководство по фиксации и заливке приведено в приложении Е, а также в руководстве ОЭСР по диагностике гистопатологии гонад рыб, связанной с эндокринной системой [27]. После проводки образцы рыбы заливают в парафиновые блоки. Образцы располагают в продольном направлении в парафиновом блоке. Делают не менее шести продольных срезов (толщиной 3-5 мкм) во фронтальной плоскости, включая ткань гонад из обеих гонад от каждой особи. Интервал между этими срезами должен составлять примерно 50 мкм для самцов и 250 мкм для самок. Однако поскольку каждый блок будет часто включать и самцов и самок (если более одной особи залито в каждый блок), то интервал между срезами в этих блоках должен равняться примерно 50 мкм до тех пор, пока не будет получено не менее шести срезов гонад от каждого самца. После этого интервал между срезами можно увеличить приблизительно до 250 мкм для самок. Срезы окрашивают гематоксилином и эозином и исследуют с помощью световой микроскопии, обращая особое внимание на пол (самец, самка, гермафродит или недифференцированные). Гермафродит определяется по наличию более чем одного ооцита в семеннике на шесть проанализированных срезов или сперматогенных клеток (да/нет) в яичниках. Гистопатология и определение стадии яичника и семенника не являются обязательными, но если такие исследования проводятся, то результаты подвергают статистическому анализу и регистрируют. Следует отметить, что у некоторых видов рыб в норме отсутствует полностью развившаяся пара гонад, и может присутствовать только одна гонада (например, у японской оризии, а иногда и у данио-рерио). Все такие наблюдения должны быть зарегистрированы.
7.9.2 Определение генетического пола у особей японской оризии основано на присутствии или отсутствии гена DMY, определяющего пол самцов, находящегося в Y-хромосоме. Генотипирование пола оризии проводят секвенированием гена DMY из ДНК, экстрагированной, например, из части анального или спинного плавника. Присутствие гена DMY указывает на особь XY (самец) независимо от фенотипа, а отсутствие DMY указывает на особь XX (самка) независимо от фенотипа [28]. Рекомендации по подготовке тканей и проведению PCR приведены в приложении И. Определение генетического пола у особей трехиглой колюшки также выполняют с помощью метода PCR, описанного в приложении К.
7.9.3 О наличии гермафродитов (см. раздел 2) указывают в отчете.
7.10 Вторичные половые признаки
Вторичные половые признаки находятся под контролем эндокринной системы у таких видов, как японская оризия, поэтому наблюдения за внешним видом рыбы, если это возможно, производят по окончании воздействия испытуемого вещества. У самок японской оризии папиллярные образования на задней части анального плавника являются андрогензависимыми признаками.
Соответствующие фотографии вторичных половых признаков у самцов и андрогенизированных самок приведены в [41].
8 Данные и отчет о проведении испытания8.1 Обработка результатов
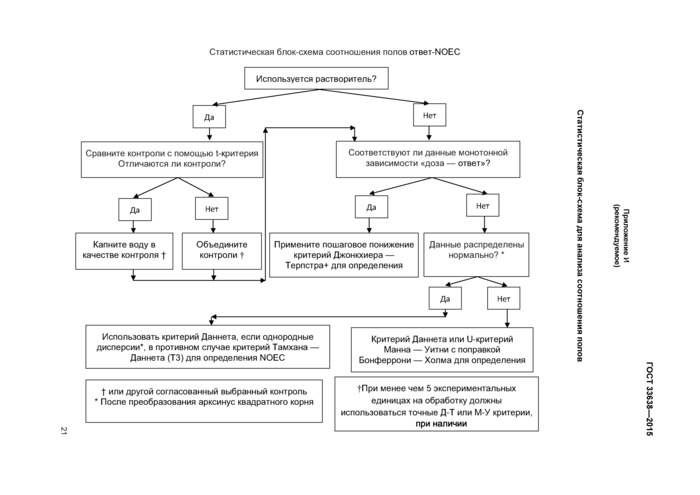
Важно, чтобы самый мощный обоснованный статистический критерий определял конечную точку. Повторность является экспериментальной единицей, но вариабельность внутри повторности включают в статистическую проверку. Блок-схема для принятия решения при определении наиболее подходящих статистических критериев при обработке характеристик полученных экспериментальных данных пред-
9
ставлена в приложении Ж. Статистический уровень значимости составляет 0,05 для всех включенных конечных точек.
8.2 Соотношение полов и генетический пол
Если зависимость «доза — ответ» монотонна, то соотношения полов должны быть проанализированы на значимость от воздействия (NOEC/LOEC подход) с использованием критерия Джонкхиера — Терпстра (критерия тренда). Если выявлена немонотонность, то применяют метод парных сравнений. В случае если выявлены нормальность и однородность дисперсии, используют критерий Даннета. Если гетерогенность дисперсии не выявлена, то используют критерий Тамхана — Даннета. В противном случае используют точный критерий Манна — Уитни с поправкой Бонферрони — Холма. Блок-схемы, описывающие статистику соотношения полов, приведены в приложении Ж. Соотношения полов представляют в таблицах как отношение концентраций ± SD у самцов, самок, гермафродитов и недифференцированных. Должна быть выделена статистическая значимость. Примеры приведены в [2]. Генетический пол должен быть представлен как процент фенотипической трансформации пола самцов, самок, гермафродитов и недифференцированных.
8.3 Концентрации VTG
8.3.1 Концентрации VTG анализируют на предмет статистически значимого эффекта воздействия (NOEC/LOEC подход). Критерий Даннета более предпочтителен, чем t-критерий с поправкой Бонферрони. Если используется поправка Бонферони, то желательно пользоваться также поправкой Бонфе-рони — Холма. Необходимо выполнить log-трансформацию значений VTG для достижения нормальности и однородности дисперсии. Далее, если подтверждается монотонность «концентрация — ответ», то критерий Джонкхиера — Терпстра предпочтительнее любого из вышеперечисленных. Если используются t-критерии или критерий Даннета, то отсутствует необходимость в использовании F-критерия ANOVA. Дополнительные сведения см. в блок-схеме в приложении Ж. Результаты представляют в таблице в виде средней концентрации ± SD для самцов, самок, гермафродитов и недифференцированных по отдельности. Должна быть выделена статистическая значимость для фенотипических самок и фенотипических самцов. Примеры приведены в [2].
8.3.2 Фактические концентрации испытуемого вещества
Фактические концентрации испытуемого вещества в камерах анализируют с периодичностью, указанной в 5.4.1. Результаты приводят в таблицах в виде средних концентраций ± SD для базовых значений повторностей, а также для базовых значений концентраций с информацией о количестве проб и с выпадающими значениями из средних концентраций обработки выделяют ±20 %. Примеры приведены в [2].
8.4 Интерпретация результатов
Результаты испытаний интерпретируют с осторожностью, когда измеренные концентрации испытуемого вещества в испытуемых растворах находятся на уровнях, близких к пределу чувствительности аналитического метода.
8.5 Отчет о проведении испытания
Отчет о проведении испытания должен включать в себя следующую информацию:
8.5.1 Испытуемое вещество:
- соответствующие физико-химические свойства;
- химическая идентификация;
- данные, включающие чистоту и аналитический метод количественного определения испытуемого вещества.
8.5.2 Условия испытания:
- используемая методика испытаний (например, проточная полустатическая/ восстанавливаемая);
- дизайн испытания, включая испытуемые концентрации, способ приготовления стоковых растворов (в приложении), периодичность восстановления (указывают солюбилизирующий агент и его концентрацию, при использовании);
- номинальные испытуемые концентрации, средние измеренные значения и их стандартные отклонения в испытательных камерах и метод, с помощью которого они были определены (используемый
ю
аналитический метод должен быть представлен в приложении). Доказательства того, что измерения относятся к концентрации испытуемого вещества в истинном растворе;
- качество воды в испытательных камерах: pH, жесткость, температура и концентрация растворенного кислорода;
- подробная информация о кормлении (например, тип корма, источник, скармливаемое количество и периодичность кормления, результаты анализа на примеси (например, ПХД, ПАУ и хлороргани-ческих пестицидов), при необходимости.
8.5.3 Результаты:
- доказательства того, что контроль соответствовал критериям валидации: данные по скорости вылупления представляют в таблицах в виде процентов на каждую повторность и на каждую концентрацию. Отмечают выпадающие значения из критериев приемлемости (при проведении контроля);
- выживаемость представляют в виде процентов на каждую повторность и на каждую концентрацию. Отмечают выпадающие значения из критериев достоверности (при проведении контроля);
- четкое указание результатов, полученных на различных наблюдаемых конечных точках: выживаемость эмбрионов и успешное вылупление, внешние аномалии; длина и масса; измерения VTG (нг/г гомогената, нг/мл плазмы или нг/мг печени); данные по гистологии гонад, соотношение полов, генетический пол; случаи любых необычных реакций со стороны рыбы и каких-либо видимых эффектов, вызванных испытуемым веществом.
8.5.4 Результаты представляют в виде средних значений ± стандартное отклонение (SD) или стандартная ошибка (SE). Статистику указывают как минимум в виде NOEC и LOEC и доверительных интервалов. Руководствуются статистической блок-схемой (приложение Ж).
11
Экспериментальные условия для FSDT (пресноводные виды)
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
12 |
16 Продолжительность воздействия испытуемым веществом
17 Биологические конечные точки
60 сут после вылупления
60 сут после вылупления
60 сут после вылупления
18 Критерии приемлемости испытания для объединенных повторностей контролей
Результат вылупления, макроморфология выживших особей, VTG гистология гонад, генетический пол, соотношение полов
Результат вылупления более 80 %;
выживание после вылупления более или равно 70 %;
рост (сырая масса рыбы после промокания) более 150 мг.
Длина (стандартная длина) более 20 мм. Соотношение полов (самцов или самок) 30-70 %
Результат вылупления макроморфология выживших особей, VTG гистология гонад, генетический пол, соотношение полов
Результат вылупления более 80 %;
выживание после вылупления более или равно 70 %;
рост (сырая масса рыбы после промокания) более 150 мг Длина (стандартная длина) более 20 мм. Соотношение полов (самцов или самок) 30-70 %
Результат вылупления, макроморфология выживших особей, VTG гистология гонад, генетический пол, соотношение полов
Результат вылупления более 80 %;
выживание после вылупления более или равно 70 %;
рост (сырая масса рыбы после промокания) более 150 мг.
Длина (стандартная длина) более 20 мм. Соотношение полов (самцов или самок) 30-70 %
13
|
Химические характеристики приемлемой воды для разведения | ||||||||||||||||
|
14
Информация об изменениях к настоящему стандарту публикуется в ежегодном информационном указателе «Национальные стандарты», а текст изменений и поправок — в ежемесячном информационном указателе «Национальные стандарты». В случае пересмотра (замены) или отмены настоящего стандарта соответствующее уведомление будет опубликовано в ежемесячном информационном указателе «Национальные стандарты». Соответствующая информация, уведомление и тексты размещаются также в информационной системе общего пользования — на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет (www.gost.ru).
© Стандартинформ, 2016
В Российской Федерации настоящий стандарт не может быть полностью или частично воспроизведен, тиражирован и распространен в качестве официального издания без разрешения Федерального агентства по техническому регулированию и метрологии
|
Руководство по испытуемым концентрациям по TG 215 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
15
Содержание
1 Область применения.................................................................1
2 Термины и определения...............................................................1
3 Общие положения....................................................................2
4 Принцип метода.....................................................................3
5 Информация об испытуемом веществе..................................................3
6 Описание метода....................................................................4
6.1 Испытательные камеры...........................................................4
6.2 Выбор тестовых видов............................................................4
6.3 Содержание родительского стада рыб...............................................4
6.4 Обращение с эмбрионами и личинками..............................................4
6.5 Вода...........................................................................5
6.6 Испытуемые растворы............................................................5
7 Проведение испытания...............................................................5
7.1 Условия воздействия..............................................................5
7.2 Испытуемые концентрации.........................................................6
7.3 Контроль........................................................................6
7.4 Периодичность аналитических определений и измерений...............................6
7.5 Наблюдения и измерения..........................................................7
7.6 Отбор рыбы.....................................................................7
7.7 Отбор проб для анализа VTG и определения пола
с помощью гистологического исследования..............................................8
7.8 Измерение VTG..................................................................8
7.9 Определение пола................................................................9
7.10 Вторичные половые признаки......................................................9
8 Данные и отчет о проведении испытания.................................................9
8.1 Обработка результатов............................................................9
8.2 Соотношение полов и генетический пол.............................................10
8.3 Концентрации VTG...............................................................10
8.4 Интерпретация результатов........................................................10
8.5 Отчет о проведении испытания.....................................................10
Приложение А (рекомендуемое) Экспериментальные условия для FSDT
(пресноводные виды).....................................................12
Приложение Б (рекомендуемое) Химические характеристики
приемлемой воды для разведения..........................................14
Приложение В (рекомендуемое) Руководство по испытуемым
концентрациям noTG215..................................................15
Приложение Г (рекомендуемое) Руководство по гомогенизации головной и хвостовой частей от неполовозрелых данио-рерио,
черного толстоголова, трехиглой колюшки и японской оризии....................16
Приложение Д (рекомендуемое) Руководство для количественного определения вителлогенина в гомогенате головного
и хвостового концов у данио-рерио..........................................17
Приложение Е (рекомендуемое) Руководство по подготовке тканевых срезов
для определения пола и стадии гонад........................................18
ГОСТ 33638-2015
Приложение Ж (рекомендуемое) Статистическая блок-схема
для анализа вителлогенина................................................20
Приложение И (рекомендуемое) Статистическая блок-схема
для анализа соотношения полов............................................21
Приложение К (рекомендуемое) Руководство по отбору проб тканей
для определения генетического пола и для определения
генетического пола с помощью PCR-метода...................................22
Приложение Л (рекомендуемое) Руководство по отбору проб тканей
для определения генетического пола с использованием PCR
у трехиглой колюшки......................................................25
Приложение М (рекомендуемое) Руководство по процедуре
искусственного оплодотворения для трехиглой колюшки........................27
Приложение ДА (справочное) Сравнение структуры международного документа
со структурой настоящего стандарта.......................................29
Библиография........................................................................32
V
Введение
Настоящий стандарт разработан на основании решения, принятого в 1998 г. о необходимости разработки нового или обновлению существующего Руководства по испытанию для скрининга и испытания потенциальных веществ, оказывающих отрицательное влияние на эндокринную систему. Метод испытания воздействия на половозрелость рыб (FSDT) был определен в качестве перспективного метода, охватывающего чувствительную стадию цикла развития рыб, реагирующую на химические вещества с эстроген- и андрогенподобным действием. Метод испытания проходил межпабораторную проверку достоверности применения с 2006 по 2010 гг., в которой были валидированы в качестве объектов воздействия японская оризия (Oryzias latipes), данио-рерио (Danio rerio) и трехиглая колюшка (Gasterosteus aculeatus) и частично валидирован черный толстоголов (Pimephales promelas) [1]-[3]. Данный протокол основан на использовании японской оризии, трехиглой колюшки и данио-рерио. По существу, протокол является расширением [4], в котором воздействие продолжается до наступления половозрелости у рыб, т. е. около 60 сут после вылупления (dph) для японской оризии, трехиглой колюшки и данио-рерио (период воздействия может быть короче или длиннее для других видов, которые будут валидироваться в дальнейшем), и добавляются конечные точки, чувствительные к воздействию эндокринной системы. С использованием FSDT оценивается влияние химических веществ на ранней стадии цикла развития рыб с предполагаемым отрицательным воздействием на эндокринную систему (например, ингибиторов эстрогенеза, андрогенеза и стероидогенеза), а именно на половозрелость. Испытание включает сочетание двух основных эндокринных конечных точек: концентрацию вителлогенина (VTG) и фенотипическое соотношение полов, позволяющих объяснить механизм действия испытуемого химического вещества. FSDT могут использоваться для оценки опасности и риска за счет изменения фенотипического соотношения полов в релевантной популяции. Однако если метод применяется для оценки опасности или риска, то не следует использовать колюшек, поскольку имеющиеся данные по валидации показывают, что у данного вида рыб редко наблюдаются изменения фенотипического соотношения полов в результате воздействия испытуемых веществ.
Протокол основан на рыбе, подвергнутой воздействию химических веществ через воду во время периода полового созревания, в котором, как ожидается, рыбы проявляют наиболее высокую чувствительность к влиянию химических веществ, оказывающих отрицательное влияние на эндокринную систему и препятствующих половому развитию. В качестве показателей связанных с эндокринной системой нарушений развития измеряются две основные конечные точки: концентрация VTG и соотношение полов, что определяется исследованием гистологии половых желез. Гистопатология половых желез (оценка и определение стадий развития ооцитов и сперматозоидов) не является обязательной. Кроме того, где это возможно, определяется генетический пол (например, на японской оризии и трехиглой колюшке). Наличие маркера генетического пола дает существенное преимущество, поскольку это повышает мощность статистики соотношения полов и позволяет определить индивидуальную смену фенотипического пола. Другие основные конечные точки, которые следует измерять, включают скорость вылупления, выживание, длину и массу тела. Метод испытания может быть адаптирован к другим видам рыб, помимо упомянутых выше, при условии проведения процедуры валидации, аналогичной проделанной для японской оризии, трехиглой колюшки и данио-рерио, где контрольные рыбы в конце испытания проходят половое дифференцирование, уровни VTG были достаточно высокими для выявления значительных изменений, связанных с химическим веществом, и чувствительность тест-системы устанавливалась с помощью стандартных активных для эндокринной системы химических веществ, таких как антиэстрогены, антиандрогены, ингибиторы ароматазы и т. д. Кроме того, отчет(ы) по валидации со ссылкой на данные FSDT с использованием других видов рыб должен(ны) быть рассмотрен(ы) ОЭСР, а итоги валидации должны рассматриваться в качестве удовлетворительных.
VI
ГОСТ 33638-2015 СТАНДАРТ
МЕЖГОСУДАРСТВЕННЫЙ
МЕЖГОСУДАРСТВЕННЫЙ
МЕТОДЫ ИСПЫТАНИЙ ХИМИЧЕСКОЙ ПРОДУКЦИИ, ПРЕДСТАВЛЯЮЩЕЙ ОПАСНОСТЬ ДЛЯ ОКРУЖАЮЩЕЙ СРЕДЫ
Испытания по воздействию на половозрелость рыб
Testing of chemicals of environmental hazard.
Fish Sexual Development Test
Дата введения — 2016—09—01
1 Область применения
1.1 Настоящий стандарт устанавливает метод испытания воздействия веществ на половозрелость рыб FSDT in vivo, предназначенный для обнаружения химических веществ с андрогенными и эстрогенными свойствами, а также антиандрогенными, антиэстрогенными и ингибирующими стерои-догенез свойствами. Фазы валидации FSDT (1 и 2) охватывают эстрогены, андрогены и химические вещества, ингибирующие стероидогенез. Эффекты антагонистов эстрогенов и андрогенов в FSDT представлены в таблице 1.
1.2 FSDT не распространяется на репродуктивную стадию развития рыб, и, следовательно, в данном методе испытанию подвергаются химические вещества, которые, как предполагается, влияют на воспроизведение в более низких концентрациях, чем на половое развитие, и их оценивают в методе, касающемся воспроизведения.
2 Термины и определения
В настоящем стандарте применены следующие термины с соответствующими определениями:
2.1 основная конечная точка (apical endpoint): Вызывающая эффект на уровне популяции.
2.2 ASV: Значение насыщения воздуха.
2.3 биомаркер (biomarker): Вызывающий эффект на уровне отдельного организма.
2.4 dph (days post hatch): Дни после вылупления.
2.5 DMY: Y-сцепленный DM-домен гена, необходимый для развития самца рыбы оризия.
2.6 ELISA (enzyme-Linked Immunosorbent Assay): Иммуноферментный твердофазный анализ.
2.7 масса рыбы (fish weight): Сырая масса рыбы (масса, определенная после промакивания насухо).
2.8 FSDT (Fish Sexual Development Test): Тест по оценке влияния на половозрелость рыб.
2.9 HPG ось (HPG axis): Гипоталамо-гипофизарно-гонадная ось.
2.10 рыбы-гермафродиты (intersex fish): Рыба с более чем одной яйцеклеткой в семенниках на 6 проанализированных срезов или сперматогенными клетками в яичниках (да/нет).
2.11 уровень загрузки (loading rate): Сырая масса рыбы на единицу объема воды.
2.12 МОА (mode of action): Механизм действия.
2.13 RT-PCR (reverse Transcriptase Polymerase Chain-Reacti): Полимеразная цепная реакция с обратной транскриптазой.
2.14 TG (test Guideline): Руководство по испытанию.
2.15 недифференцированная рыба (undifferentiated fish): Рыба с гонадами с неразличимыми половыми клетками.
2.16 Vitellogenin (VTG): Вителлогенин.
Издание официальное
3 Общие положения
3.1 VTG в норме продукцируется печенью яйцекладущих позвоночных самок в ответ на эндогенный эстроген в крови [5]. Продукт является предшественником белков яичного желтка и после синтеза в печени транспортируется с кровотоком в яичники, где он захватывается и модифицируется под действием развивающихся яиц. Синтез VTG происходит на очень низком уровне, хотя детектируется у неполовозрелых рыб и взрослых самцов рыб, поскольку они не имеют достаточного уровня эстрогена в крови. Однако печень способна синтезировать и секретировать VTG в ответ на стимуляцию экзогенным эстрогеном [6]-[8].
3.2 Измерение VTG служит для обнаружения химических веществ с эстрогенным, антиэстроге-ным, андрогенным механизмом действия и химических веществ, нарушающих стероидогенез, например, ингибиторов ароматазы. Обнаружение химических веществ с эстрогенным действием можно проводить по измерению индукции VTG у самцов рыбы, и в специальной научной литературе имеется большое количество сообщений по этому вопросу. Индукция VTG была также продемонстрирована после воздействия ароматизированных андрогенов [9], [10]. Снижение уровня циркулирующих эстрогенов у самок, например в результате ингибирования ароматазы, катализирующей превращение эндогенного андрогена в природный эстроген 17[3-эстрадиол, приводит к снижению концентрации VTG, что используется для обнаружения химических веществ, обладающих ингибирующими свойствами в отношении ароматазы, или ингибиторов стероидогенеза в более широком смысле [11]. Установлено и имеется много сообщений о биологическом значении изменения уровня VTG после ингибирования эстрогенов/ ароматазы [12], [13]. Однако, возможно, что на синтез VTG у самок также могут оказывать влияние химические вещества, обладающие общей токсичностью и эффектами, не связанными с эндокринной системой.
3.3 Было успешно разработано и стандартизировано для широкого применения несколько методов количественной оценки VTG в пробах крови, печени, всем теле или гомогенате головного/хвостово-го концов, отобранных от отдельных рыб. Это относится к данио-рерио, трехиглой колюшке и японской оризии, а также частично валидированному виду толстоголова; имеются методы видоспецифического иммуноферментного твердофазного анализа (ELISA), в которых используется иммунохимия для количественной оценки VTG [8], [14]-[20]. У японской оризии и данио-рерио существует высокая корреляция между измеренными уровнями VTG в плазме крови, печени и гомогенатах, хотя анализ гомогенатов показывает несколько более низкие значения, чем анализ проб плазмы [21]-[23]. В приложение Г приведены методики отбора проб для анализа VTG.
3.4 Изменение фенотипического соотношения полов (пропорции полов) является конечной точкой, отражающей смену пола. В принципе, эстрогены, антиэстрогены, андрогены, антиандрогены и химические вещества, ингибирующие стероидогенез, могут влиять на соотношение полов у развивающихся рыб [24]. Было показано, что эта смена пола является частично обратимой у данио-рерио [25] после воздействия химических веществ с эстрогеноподобным действием, тогда как смена пола после воздействия химических веществ с андрогеноподобным действием является постоянной [26]. Пол определяется как самка, самец, гермафродит (ооциты и сперматогенные клетки в одной гонаде) или недифференцированные, которые устанавливаются гистологическим исследованием половых желез у отдельных рыб. Руководящие указания приведены в приложении Е и [27].
3.5 Генетический пол определяется с помощью генетических маркеров, когда они имеются у данного вида рыб. У самки или самца японской оризии соответственно гены XX и XY могут быть обнаружены с помощью полимеразной цепной реакции (PCR), или Y-сцепленный DM-домен гена (DMY) может быть определен (DMY отрицательный или положительный), как описано в [28], [29]. Для трехиглой колюшки существует аналогичный метод PCR для определения генетического пола, описанный в приложении К. Если генетический пол может быть индивидуально связан с фенотипическим полом, то мощность испытания повышается, и поэтому генетический пол следует определять у видов с уставленными генетическими половыми маркерами.
3.6 В совокупности две основные эндокринные конечные точки, VTG и соотношение полов, могут свидетельствовать об эндокринном механизме действия (МОА) химического вещества (см. таблица 1). Соотношение полов является важным биомаркером на уровне популяции [30], [31] и для некоторых четко определенным механизмом действия, результаты FSDT могут быть использованы для оценки опасности и рисков, если это будет сочтено целесообразным регулирующим органом. В настоящее время такими механизмами действия обладают ингибиторы эстрогенов, андрогенов и стероидогенеза.
|
Таблица 1 — Реакция эндокринных конечных точек для химических веществ с различным механизмом действия | ||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||
4 Принцип метода
4.1 В испытании воздействию подвергают рыбу от только что оплодотворенной яйцеклетки до завершения половой дифференциации не менее чем в трех концентрациях испытуемого вещества, растворенного в воде. Условия испытаний должны быть проточными, за исключением случаев отсутствия пригодности или соответствующих свойств испытуемого вещества (например, ограниченная растворимость). Испытание начинается с помещения только что оплодотворенных яйцеклеток (до расщепления бластодиска) в испытательные камеры. Загрузка камер для каждого вида описана в 7.1.2. Для валидированных видов рыб: японской оризии, трехиглой колюшки и данио-рерио, испытание завершается на 60 сут после вылупления. По окончании испытания вся рыба подвергается гуманной эвтаназии. Биологическую пробу (плазму крови, печень или гомогенат головного/хвостового концов) отбирают для анализа VTG от каждой рыбы, а оставшуюся часть фиксируют для гистологической оценки гонад с целью определения фенотипического пола; дополнительно может быть выполнена гистопатология (например, определение стадий гонад, уровень гермафродитов). Биологическая проба (анальный или спинной плавник) для определения генетического пола отбирается у видов, обладающих соответствующими маркерами (приложения И, К).
4.2 Краткое описание соответствующих условий испытания, специфичных для валидированных видов: японской оризии, трехиглой колюшки и данио-рерио, приводится в приложении А.
5 Информация об испытуемом веществе
5.1 Должны быть в наличии результаты испытания острой токсичности или другого метода оценки краткосрочной токсичности TG 215 [36] и TG 210 [4], предпочтительно на видах, выбранных для данного испытания. Кроме того, должны быть данные по растворимости в воде и давлении паров исследуемого вещества и надежный метод количественного анализа химического вещества в испытательных камерах с известной и подтвержденной точностью и пределом обнаружения.
5.2 Другая полезная информация включает структурную формулу, чистоту химического вещества, стабильность в воде и на свету, рКа, Pow и результаты испытания по биоразложению TG 301 [37].
5.3 Критерии приемлемости испытания
Для приемлемости результатов испытания должны соблюдаться следующие условия:
- концентрация растворенного кислорода должна составлять не менее 60 % значения насыщения воздуха (ASV) в течение всего испытания;
- температура воды не должна отличаться более чем на ± 1,5 °С между испытательными камерами в любой момент времени в течение периода воздействия и должна поддерживаться в температурных диапазонах, указанных для тестовых видов (приложение А);
3
- должен иметься в наличии валидированный метод анализа испытуемого химического вещества с пределом обнаружения значительно ниже самой низкой номинальной концентрации, и должны быть получены данные, подтверждающие удовлетворительное сохранение концентрации испытуемого вещества в растворе в пределах ± 20 % средней измеряемой величины;
- общая выживаемость оплодотворенных яйцеклеток в контроле и в тех случаях, когда он имеется, в контроле на растворитель должна быть более или равна пределам, определенным в приложении А;
- критерии приемлемости, связанные с ростом и соотношением полов, по окончании испытания основываются на данных, полученных в контрольных группах (объединенных контролях на растворитель и воду, если они значительно отличаются, то только на растворитель):
Японская оризия
> 150 мг
> 20 мм 30-70 %
Сырая масса рыбы, после промокания насухо Длина (стандартная)
(самцы или самки)
Рост
Соотношение
полов
Данио-рерио Трехиглая колюшка > 75 мг > 120 мг
>14 мм > 20 мм
30-70 % 30-70 %
При использовании растворителя он не должен оказывать статистически значимое влияние на выживаемость и нарушать эндокринную функцию или оказывать другие отрицательные эффекты на ранних стадиях развития, что показывает контроль на растворитель.
Если наблюдается отклонение от критериев приемлемости испытания, то последствия следует учитывать применительно к достоверности результатов испытания и проанализированные данные включают в отчет.
6 Описание метода6.1 Испытательные камеры
Могут быть использованы камеры из стекла, нержавеющей стали или других химически инертных материалов. Размеры камер должны быть достаточно большими, чтобы обеспечивались критерии уровня загрузки, приведенные ниже. Желательно, чтобы испытательные камеры располагались произвольно в месте проведения испытания. Рандомизированный блочный дизайн с каждой концентрацией, присутствующей в каждом блоке, является предпочтительнее полностью рандомизированного дизайна. Испытательные камеры должны быть защищены от нежелательного нарушения.
6.2 Выбор тестовых видов
Рекомендуемые виды рыб приведены в приложении А. Процедуры включения новых видов приведены во введении.
6.3 Содержание родительского стада рыб
Подробную информацию о содержании родительского стада рыб в удовлетворительных условиях можно найти в TG 210 [4]. Родительское стадо рыб кормят один или два раза в день соответствующим кормом.
6.4 Обращение с эмбрионами и личинками
6.4.1 Вначале эмбрионы и личинки подвергают воздействию в основной камере, в которой находятся более маленькие камеры из стекла или нержавеющей стали, снабженные сетчатыми сторонами или днищами, для обеспечения потока испытуемого вещества через камеру. Нетурбулентный поток через эти маленькие камеры обеспечивают суспендированием их содержимого передвижением рукой камеры вверх и вниз, но всегда сохраняя организмы, погруженными в воду.
6.4.2 Если контейнеры, решетки или сетки с яйцами использовались для содержания яиц внутри основной испытательной камеры, то эти ограничивающие устройства удаляют после вылупления личинок, за исключением сеток, которые остаются для предупреждения исчезновения рыб. Если существует необходимость в переносе личинок, то они не должны подвергаться воздействию воздуха и не следует использовать сетки для высвобождения рыбы из контейнеров с яйцами. Сроки такого переноса зависят от тестового вида рыб, и перенос не всегда требуется.
4