ГОСТ 32645-2014
Методы испытания по воздействию химической продукции на организм человека. Определение нейротоксичности на грызунах
Купить ГОСТ 32645-2014 — бумажный документ с голограммой и синими печатями. подробнее
Распространяем нормативную документацию с 1999 года. Пробиваем чеки, платим налоги, принимаем к оплате все законные формы платежей без дополнительных процентов. Наши клиенты защищены Законом. ООО "ЦНТИ Нормоконтроль"
Наши цены ниже, чем в других местах, потому что мы работаем напрямую с поставщиками документов.
Способы доставки
- Срочная курьерская доставка (1-3 дня)
- Курьерская доставка (7 дней)
- Самовывоз из московского офиса
- Почта РФ
При исследовании и количественной оценке токсикологических характеристик химических веществ важно рассматривать потенциальные нейротоксические эффекты. Руководства по испытанию токсичности повторной дозы уже включают наблюдения для оценки нейротоксичности. Стандарт может быть использован для проведения исследований по получению дополнительной информации или для подтверждения наличия нейротоксических реакций, наблюдаемых при исследовании соматической токсичности повторной дозы. Однако, в ряде случаев (при рассмотрении вопроса о возможной нейротоксичности некоторых классов химических веществ) можно предположить, что нейротоксичность более уместно оценивать только с помощью настоящего стандарта без предварительного выявления потенциальной нейротоксичности в испытаниях соматической токсичности повторной дозы.
Идентичен OECD Test № 424:1997
Оглавление
1 Область применения
2 Термины и определения
3 Принцип тестирования
4 Описание метода
5 Процедура испытания
6 Наблюдения
7 Данные и отчет о проведении испытания
Библиография
| Дата введения | 01.06.2015 |
|---|---|
| Добавлен в базу | 21.05.2015 |
| Актуализация | 01.01.2021 |
Этот ГОСТ находится в:
- Раздел Экология
Организации:
| 28.03.2014 | Утвержден | Межгосударственный Совет по стандартизации, метрологии и сертификации | 65-П |
|---|---|---|---|
| 26.09.2014 | Утвержден | Федеральное агентство по техническому регулированию и метрологии | 1231-ст |
| Разработан | ФГУП ВНИЦ СМВ | ||
| Разработан | ТК 339 Безопасность сырья, материалов и веществ | ||
| Издан | Стандартинформ | 2015 г. |
OECD guidelines for the testing of chemicals. Neurotoxicity Study in Rodents
Чтобы бесплатно скачать этот документ в формате PDF, поддержите наш сайт и нажмите кнопку:

стр. 1

стр. 2

стр. 3

стр. 4

стр. 5

стр. 6

стр. 7

стр. 8

стр. 9

стр. 10

стр. 11

стр. 12

стр. 13
стр. 14

стр. 15

стр. 16
МЕЖГОСУДАРСТВЕННЫЙ СОВЕТ ПО СТАНДАРТИЗАЦИИ, МЕТРОЛОГИИ И СЕРТИФИКАЦИИ
(МГС)
INTERSTATE COUNCIL FOR STANDARDIZATION, METROLOGY AND CERTIFICATION
(ISC)
МЕЖГОСУДАРСТВЕННЫЙ
СТАНДАРТ
МЕТОДЫ ИСПЫТАНИЯ ПО ВОЗДЕЙСТВИЮ ХИМИЧЕСКОЙ ПРОДУКЦИИ НА ОРГАНИЗМ ЧЕЛОВЕКАИспытание нейротоксичности на грызунах(OECD, Test №424: 1997, IDT)
(OECD, Test №424: 1997, IDT)
Издание официальное
ГОСТ
32645—
2014
|
Москва Стандартинформ 2015 |
Предисловие
Цели, основные принципы и основной порядок проведения работ по межгосударственной стандартизации установлены в ГОСТ 1.0-92 «Межгосударственная система стандартизации. Основные положения» и ГОСТ 1.2-2009 «Межгосударственная система стандартизации. Стандарты межгосударственные, правила, рекомендации по межгосударственной стандартизации. Правила разработки, принятия, обновления и отмены»
Сведения о стандарте
1 ПОДГОТОВЛЕН Федеральным государственным унитарным предприятием «Всероссийский научно-исследовательский центр стандартизации, информации и сертификации сырья, материалов и веществ» (ФГУП «ВНИЦСМВ»);
Техническим комитетом по стандартизации № 339 «Безопасность сырья, материалов и веществ» Федерального агентства по техническому регулированию и метрологии
2 ВНЕСЕН Федеральным агентством по техническому регулированию и метрологии
3 ПРИНЯТ Межгосударственным советом по стандартизации, метрологии и сертификации (протокол от 28 марта 2014 г. № 65-П)
За принятие стандарта проголосовали:
|
Краткое наименование страны по МК (ИС0 3166) 004 - 97 |
Код страны по МК (ИСО 3166) 004-97 |
Сокращенное наименование национального органа по стандартизации |
|
Азербайджан |
AZ |
Аз стандарт |
|
Армения |
AM |
Минэкономики Республики Армения |
|
Беларусь |
BY |
Госстандарт Республики Беларусь |
|
Казахстан |
KZ |
Госстандарт Республики Казахстан |
|
Киргизия |
KG |
Кыргызстандарт |
|
Молдова |
MD |
Молдова-Стандарт |
|
Россия |
RU |
Росстандарт |
|
Таджикистан |
TJ |
Таджикстандарт |
|
Туркменистан |
TM |
Т уркменстандартлары |
|
Узбекистан |
uz |
Узстандарт |
|
Украина |
UA |
Департамент технического регулирования Минэкономторг |
4 Настоящий стандарт идентичен международному документу OECD Test № 424:1997 Neurotoxicity Study in Rodents (ОЭСР, Тест № 424:1997 «Испытание нейротоксичности на грызунах»)
Перевод с английского языка (еп).
Степень соответствия - идентичная (IDT)
5 Приказом Федерального агентства по техническому регулированию и метрологии от 26 сентября 2014 г. № 1231-ст межгосударственный стандарт ГОСТ 32645-2014 введен в действие в качестве национального стандарта Российской Федерации с 1 июня 2015 г.
6 ВВЕДЕН ВПЕРВЫЕ
ГОСТ 32645-2014
первых 13 недель, затем примерно в 3-месячным интервалом, если состояние здоровья животных и изменений массы тела не предполагают другой периодичности.
6.6 Офтальмология
Для испытаний продолжительностью более 28 дней офтальмологическое обследование с помощью офтальмоскопа или аналогичного инструмента должно проводиться до введения исследуемого вещества и по окончании исследования. Желательно проводить обследование всех животных или, по крайней мере, животных в группах с высокими дозами и контрольных группах. При обнаружении изменений глаз, или если клинические признаки указывают на необходимость проведения обследования, проводится обследование всех животных. Для долгосрочных испытаний офтальмологическое обследование также должно проводиться на 13 неделе испытания. Офтальмологическое обследование не проводится, если подобные данные уже доступны из других исследований с аналогичной продолжительностью и для аналогичных доз.
6.7 Гематология и клиническая биохимия
В случае, когда испытание нейротоксичности проводится в сочетании с испытанием соматической токсичности повторной дозы, гематологические исследования и клиническая биохимия должны проводиться в соответствии с Руководством по испытанию соматической токсичности повторной дозы. Отбор проб должен производиться таким образом, чтобы любые потенциальные нейроповеденческие эффекты были минимизированы.
6.8 Гистопатология
Нейропатологическое обследование должно быть разработано таким образом, чтобы дополнить и расширить результаты наблюдений, полученные во время стадии испытания in vivo. Ткани, по крайней мере, 5 животных / пола / группы (таблица 1) должны быть зафиксированы in situ, с использованием общепризнанных техник перфузии и методов фиксации. Любые изменения веса тканей должны быть зарегистрированы. Когда исследование проводится как отдельное испытание для выявления нейротоксичности или характеристики нейротоксического действия, остальные животные также могут быть использованы либо для проведения конкретных нейроповеденческих [17, 18], нейропатологических [17, 18, 19, 20], нейрохимических [17, 18, 21, 22] и электрофизиологических [17, 18, 23, 24] процедур, которые могут дополнить представленные в настоящем руководстве процедуры и обследования, либо для гистопатологических обследований. Проведение дополнительных процедур особенно полезны, когда эмпирические наблюдения и ожидаемые эффекты указывают на конкретный тип нейротоксичности или наличие органа-мишени [9, 10]. Кроме того, остальные животные могут также использоваться для стандартных патологических оценок, как описано в Руководстве по испытанию токсичности повторной дозы.
Общая процедура окрашивания, например, гематоксилин-эозином (Н&Е), должна быть выполнена для всех образцов тканей, зафиксированных в парафине, затем должны быть проведены микроскопические обследования. Если наблюдается или ожидается появление признаков периферической нейропатии, должны быть обследованы закрепленные в пластике образцы периферической нервной ткани. Клинические признаки могут также свидетельствовать о необходимости осмотра дополнительных тканей или использования специальных процедур окрашивания. Руководство по дополнительным тканям для обследования представлены в [10, 11]. Также может быть полезным использование соответствующих специальных красителей для демонстрации конкретных видов патологических изменений [25].
Гистологическое исследование должно быть проведено для отделов центральной и периферической нервной системы. Обследуемые области, как правило, должны включать: передний мозг, центральный отдел головного мозга, в том числе рассечение гиппокампа, средний мозг, мозжечок, варолиев мост, продолговатый мозг, глаза, зрительный нерв, сетчатку, спинной мозга на шейном и поясничном отделах позвоночника, дорсальные корешковые ганглии, волокна дорсального и вентрального корешков, проксимальный конец седалищного нерва, проксимальный конец большеберцового нерва (в колене) и ветви большеберцового нерва в икроножных мышцах. Спинной мозг и отделы периферической нервной системы должны быть представлены в виде крестовых или поперечных и продольных срезов. Необходимо уделить внимание сосудам нервной системы. Также необходимо обследовать образец скелетных мышц, особенно икроножных мышц. Особое внимание следует уделить участкам с клеточной и волокнистой структурой и отделам ЦНС и ПНС, подверженным известному влиянию нейротоксинов.
Руководство по нейропатологическим изменениям, обычно возникающим в результате воздействия токсических веществ, представлено в [10, 11]. Рекомендуется проводить поэтапное изучение образцов тканей, в котором образцы тканей из групп с высокой дозой сравнивают с контрольными образцами. Если никакие нейропатологические изменения не наблюдаются в образцах из данных групп, дальнейший анализ не требуется. Если нейропатологические изменения
7
наблюдаются в группе с высокой дозой, образцы от каждой из потенциально пораженных тканей из групп со средней и низкой дозой должны быть отмечены и последовательно осмотрены.
Если какие-либо доказательства нейропатологических изменений получены при качественном осмотре, второй осмотр должен проводиться для всех отделов нервной системы, демонстрирующих такие изменения. Потенциально пораженные ткани из всех групп дозирования должны быть закодированы и осмотрены в случайном порядке без раскрытия кода. Частота и тяжесть каждого поражения должны быть зарегистрированы. После оценки всех тканей от всех групп дозирования, код раскрывается и проводится статистический анализ с целью получения описания зависимости «доза -отклик». Примеры различных степеней тяжести каждого поражения должны быть описаны.
Нейропатологические результаты следует оценивать в контексте поведенческих наблюдений и измерений, а также с учетом других данных предыдущих и параллельных испытаний соматической токсичности исследуемого вещества.
7 Данные и отчет о проведении испытания7.1 Данные
Необходимо регистрировать индивидуальные данные для животных. Кроме того, все данные должны быть представлены в табличной форме с указанием количества животных в каждой тестовой и контрольной группе в начале испытания, количества животных, обнаруженных мертвыми во время испытания или умерщвленных из гуманных соображений, и времени смерти или умерщвления, количества животных, демонстрирующих признаки токсичности, с описанием наблюдаемых признаков токсичности, в том числе время появления, длительность, тип и тяжесть любого токсического воздействия, количества животных с поражениями, в том числе тип и тяжести поражений.
Результаты исследования должны быть оценены с точки зрения частоты, тяжести и корреляции нейроповеденческих и нейропатологических эффектов (а также нейрохимических и электрофизиологических эффектов при проведении дополнительных наблюдений) и любых других наблюдаемых побочных эффектов. Когда это возможно, численные результаты должны быть обработаны надлежащим и приемлемым статистическим методом. Статистические методы необходимо подбирать на этапе подготовки к испытанию.
7.2 Отчет о проведении испытания
Отчет о проведении испытания должен содержать следующую информацию:
Исследуемое вещество:
- физическая природа (в том числе изомеризация, чистота и физико-химические свойства);
- идентификационные данные.
Растворитель (при необходимости):
- обоснование выбора растворителя.
Тестовые животные:
- вид / штамм используемых животных;
- количество, возраст и пол животных;
- источник, условия содержания, акклиматизации и питания и т.д.;
- индивидуальный вес животных в начале испытания.
Условия проведения испытания:
- описание подготовки исследуемого вещества / диеты, достигнутая концентрация, стабильность и однородность полученных препаратов;
- вводимые дозы, в том числе информация о растворителе, объем и физическое состояние вводимого препарата;
- описание нанесения / введения исследуемого вещества;
- обоснование выбора доз;
- обоснование пути поступления и продолжительность воздействия;
- при необходимости, перерасчет концентрации исследуемого вещества в пище / питьевой воде (ppm) в фактическую дозу (мг / кг веса тела / день);
- качество пищи и питьевой воды.
Наблюдение и процедура испытания:
- подробная информация о распределении животных из каждой группы в подгруппы для перфузии;
- система подсчета, включая критерии и шкалы для каждого измерения в подробных клинических наблюдениях;
- сведения о функциональных испытаниях на сенсорную реакцию и раздражители различных модальностей (например, слуховые, зрительные и проприоцептивные); для оценки конечностей -
8
ГОСТ 32645-2014
сила сцепления; для оценки двигательной активности (в том числе описание автоматических устройств для обнаружения активности), а также другие используемые процедуры;
- подробная информация об офтальмологическом обследовании и, если необходимо, гематологических исследованиях и испытаниях по клинической биохимии с указанием соответствующих начальных значений;
- описание специальных нейроповеденческих, нейропатологических, нейрохимических и электрофизиологических процедур.
Результаты испытания:
- масса тела / изменения массы тела, включая изменения массы тела при умерщвлении;
- потребление продуктов питания и питьевой воды, при необходимости;
- данные о токсичности для полов и уровней доз, в том числе признаки токсичности и смертности;
- характер, тяжесть и продолжительность (время начала и дальнейший ход) подробных клинических наблюдений (с указанием их обратимости);
- подробное описание всех функциональных результатов испытания;
- результаты аутопсии;
- подробное описание всех нейроповеденческих, нейропатологических и нейрохимических и электрофизиологических результатов, при наличии;
- данные об абсорбции и метаболизме, при наличии;
- статистическая обработка данных, при необходимости.
Обсуждение результатов:
- информация о зависимости «доза - отклик»;
- отношение любых других токсических эффектов к выводу о нейротоксическом потенциале исследуемого вещества;
- NOAEL.
Выводы:
- конкретный вывод об общей нейротоксичности исследуемого вещества (рекомендуется).
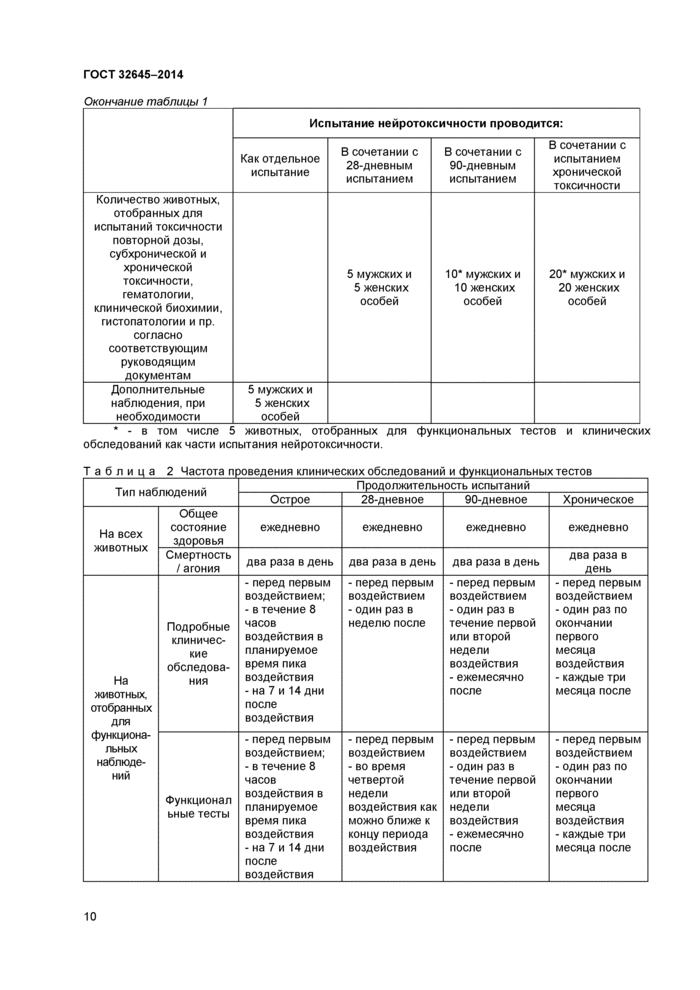
Т а б л и ц а 1 Минимальное количество животных в группе при проведении испытания нейротоксичности отдельно или в сочетании с другими исследованиями
|
Испытание нейротоксичности проводится: | ||||
|
Как отдельное испытание |
В сочетании с 28-дневным испытанием |
В сочетании с 90-дневным испытанием |
В сочетании с испытанием хронической токсичности | |
|
Общее количество животных в группе |
10 мужских и 10 женских особей |
10 мужских и 10 женских особей |
15 мужских и 15 женских особей |
25 мужских и 25 женских особей |
|
Количество животных, отобранных для проведения функциональных тестов, в том числе подробного клинического обследования |
10 мужских и 10 женских особей |
10 мужских и 10 женских особей |
10 мужских и 10 женских особей |
10 мужских и 10 женских особей |
|
Количество животных, отобранных для перфузии in situ и нейрогистопатологии |
5 мужских и 5 женских особей |
5 мужских и 5 женских особей |
5 мужских и 5 женских особей |
5 мужских и 5 женских особей |
9
|
Окончание таблицы 1 | |||||||||||||||||||
| |||||||||||||||||||
|
* - в том числе 5 животных, отобранных для функциональных тестов и клинических обследований как части испытания нейротоксичности. | |||||||||||||||||||
|
Таблица 2 Частота проведения клинических обследований и функциональных тестов | |||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||
Библиография
1. Руководящий документ OECD Test 424 «Neurotoxicity Study in Rodents»
2. OECD Environment Monograph No. 76, Guidance Document for the Development of OECD Guidelines for the Testing of Chemicals, OECD, Paris, 1993.
3. OECD Summary Report of the ad hoc Meeting on Neurotoxicity Testing, held outside Washington, United States, March 1990.
4. OECD Chairman’s Report of the Meeting of the ad hoc Working Group of Experts on Systemic Short-term and (Delayed) Neurotoxicity, OECD, Paris, 1992.
5. U.S. Environmental Protection Agency Pesticide Assessment Guidelines (1991). Subdivision F. Hazard Evaluation: Human and Domestic Animals, Addendum 10. Neurotoxicity. Series 81, 82 and 83. EPA 540/09-91-123. PB 91-154617.
6. United States Environmental Protection Agency (1992). Health Effects Testing Guidelines Subpart 6 - Neurotoxicity. 40 CFR 798. 6050-6400.
7. OECD Report of the Meeting of the ad hoc OECD Working Group on Neurotoxicity, held in Ottawa, Canada, March 1995.
8. OECD Guidance Document on Neurotoxicity Testing Strategies and Test Methods. OECD, Paris, In Preparation.
9. Test Guideline for a Developmental Neurotoxicity Study, OECD Guidelines for the Testing of Chemicals. In Preparation.
10. World Health Organization (WHO) (1986). Environmental Health Criteria Document 60: Principles and Methods for the Assessment of Neurotoxicity Associated with Exposure to Chemicals.
11. Spencer, P.S. and Schaumburg, H.H. (1980). Experimental and Clinical Neurotoxicology. Eds. Spencer, P.S. and Schaumburg, H.H. eds. Williams and Wilkins, Baltimore/London.
12. Tupper D.E. and Wallace, R.B. (1980). Utility of the Neurologic Examination in Rats. Acta Neurobiol. Exp., 40, 999-1003.
13. Gad, S.C. (1982). A Neuromuscular Screen for Use in Industrial Toxicology. J. Toxicol. Environ. Health, 9, 691-704.
14. Moser V.C., McDaniel, K.M. and Phillips, P.M. (1991). Rat Strain and Stock Comparisons Using a Functional Observational Battery: Baseline Values and Effects of Amitraz. Toxicol. Appl. Pharmacol., 108, 267-283.
15. Meyer O.A., Tilson, H.A., Byrd, W.C. and Riley, M.T. (1979). A Method for the Routine Assessment of Fore- and Hind- limb Grip Strength of Rats and Mice. Neurobehav. Toxicol., 1,233-236.
16. Crofton K.M., Howard, J.L., Moser, V.C., Gill, M.W., Reiter, L.W., Tilson, H.A. and MacPhail, R.C. (1991). Interlaboratory Comparison of Motor Activity Experiments: Implication for Neurotoxicological Assessments. Neurotoxicol. Teratol., 13, 599-609.
17. Tilson, H.A., and Mitchell, C.L. eds. (1992). Neurotoxicology Target Organ Toxicology Series. Raven Press, New York.
18. Chang, L.W., ed. (1995). Principles of Neurotoxicology. Marcel Dekker, New York.
19. Broxup, B. (1991). Neuropathology as a Screen for Neurotoxicity Assessment. J. Amer. Coll. Toxicol., 10, 689-695.
20. Moser, V.C., Anthony, D.C., Sette, W.F. and MacPhail, R.C. (1992). Comparison of Subchronic Neurotoxicity of 2-Hydroxyethyl Acrylate and Acrylamide in Rats. Fund. Appl. Toxicol., 18, 343-352.
21. O’Callaghan, J.P. (1988). Neurotypic and Gliotypic Proteins as Biochemical Markers of Neurotoxicity. Neurotoxicol. Teratol., 10, 445-452.
22. O’Callaghan, J.P. and Miller, D.B. (1988). Acute Exposure of the Neonatal Rat to Triethyltin Results in Persistent Changes in Neurotypic and Gliotypic Proteins. J. Pharmacol. Exp. Ther., 244, 368-378.
23. Fox, D.A., Lowndes, H.E. and Birkamper, G.G. (1982). Electrophysiological Techniques in Neurotoxicology. In: Nervous System Toxicology. Mitchell, C.L. ed. Raven Press, New York, pp. 299-335.
24. Johnson, B.L. (1980). Electrophysiological Methods in Neurotoxicity Testing. In: Experimental and Clinical Neurotoxicology. Spencer, P.S. and Schaumburg, H.H. eds., Williams and Wilkins Co., Baltimore/London, pp. 726-742.
25. Bancroft, J. D. and Steven A. (1990). Theory and Practice of Histological Techniques. Chapter 17, Neuropathological Techniques. Lowe, James and Cox, Gordon eds. Churchill Livingstone.
11
УДК 661:615.099:006.354 МКС 13.020.01 ЮТ
Ключевые слова: химическая продукция, воздействие на организм человека, метод испытаний, нейротоксичность, грызуны
Подписано в печать 12.01.2015. Формат 60x84V8.
Уел. печ. л. 1,86. Тираж 33 экз. Зак. 158.
Подготовлено на основе электронной версии, предоставленной разработчиком стандарта
ФГУП «СТАНДАРТИНФОРМ»
123995 Москва, Гранатный пер., 4. www.gostinfo.ru info@gostinfo.ru
ГОСТ 32645-2014
Информация об изменениях к настоящему стандарту публикуется в ежегодном информационном указателе «Национальные стандарты», а текст изменений и поправок - в ежемесячном информационном указателе «Национальные стандарты». В случае пересмотра (замены) или отмены настоящего стандарта соответствующее уведомление будет опубликовано в ежемесячном информационном указателе «Национальные стандарты». Соответствующая информация, уведомление и тексты размещаются также в информационной системе общего пользования - на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет
© Стандартинформ, 2015
В Российской Федерации настоящий стандарт не может быть полностью или частично воспроизведен, тиражирован и распространен в качестве официального издания без разрешения Федерального агентства по техническому регулированию и метрологии
Введение
Руководства ОЭСР по испытаниям химических веществ периодически пересматриваются с учетом научно-технического прогресса. Это необходимо для эффективного реагирования на научный прогресс, достигнутый в идентификации опасностей и получении соответствующих данных. Предложения по разработке новых и / или обновлению существующих руководств по проведению испытаний могут вносить страны-члены ОЭСР, секретариат ОЭСР, а также международное научное сообщество. Рекомендации по процедурам разработки руководящих документов ОЭСР представлены в монографии OECD Environment 76 [2].
Проект настоящего руководства был разработан в результате двух специальных совещаний: специального совещания ОЭСР по испытаниям нейротоксичности, которое состоялось в Вашингтоне в марте 1990 года [3], и последующего консультативного совещания специальной рабочей группы экспертов по соматической краткосрочной и (отложенной) нейротоксичности, которое состоялось в Париже в феврале 1992 года [4]. Проект был основан на двух предложениях, разработанных в результате указанных встреч, и Руководства по нейротоксичности Агентства по охране окружающей среды США [5, 6]. Окончательное предложение было подготовлено специальной рабочей группой ОЭСР по нейротоксичности, заседание которой проходило в Оттаве, Канада, в марте 1995 года [7]. Рабочая группа приняла во внимание замечания от национальных координаторов в рамках Программы ОЭСР по разработке руководств по испытаниям химических веществ, а также предложение Канады по испытанию нейротоксичности.
Настоящее руководство было разработано в целях получения информации, необходимой для подтверждения или более подробной характеристики потенциальной нейротоксичности химических веществ для взрослых животных. Испытание, описанное в руководстве, может проводиться в сочетании с существующими испытаниями токсичности повторной дозы или выполняться как самостоятельное исследование. При подготовке испытаний на основании настоящего руководства рекомендуется также использовать Руководство ОЭСР по стратегиям и методам испытания нейротоксичности [8]. Это особенно важно, когда предполагается вносить изменения в наблюдения и процедуры испытания, рекомендованные настоящим руководством в качестве стандартных. Руководство ОЭСР по стратегиям и методам испытания нейротоксичности был подготовлено для содействия в выборе других процедур испытания для использования при определенных обстоятельствах. Оценка нейротоксичности для развития и потомства является предметом отдельного Руководства [9].
IV
ГОСТ 32645-2014 СТАНДАРТ
МЕЖГОСУДАРСТВЕННЫЙ
МЕТОДЫ ИСПЫТАНИЯ ПО ВОЗДЕЙСТВИЮ ХИМИЧЕСКОЙ ПРОДУКЦИИ НА ОРГАНИЗМ ЧЕЛОВЕКА.Испытание нейротоксичности на грызунах
МЕЖГОСУДАРСТВЕННЫЙ
Испытание нейротоксичности на грызунах
OECD guidelines for the testing of chemicals.
Neurotoxicity Study in Rodents
Дата введения - 2015—06—01
1 Область применения
При исследовании и количественной оценке токсикологических характеристик химических веществ важно рассматривать потенциальные нейротоксические эффекты. Руководства по испытанию токсичности повторной дозы уже включают наблюдения для оценки нейротоксичности. Настоящий стандарт может быть использован для проведения исследований по получению дополнительной информации или для подтверждения наличия нейротоксических реакций, наблюдаемых при исследовании соматической токсичности повторной дозы. Однако, в ряде случаев (при рассмотрении вопроса о возможной нейротоксичности некоторых классов химических веществ) можно предположить, что нейротоксичность более уместно оценивать только с помощью настоящего стандарта без предварительного выявления потенциальной нейротоксичности в испытаниях соматической токсичности повторной дозы. Подобные случаи включают, например:
наблюдение неврологических симптомов или ней ропатологических поражений в испытаниях токсичности, за исключением исследований токсичности повторных доз или
наличие структурных особенностей или иных сведений, позволяющих отнести исследуемые вещества к известным нейротоксикантам.
Кроме того, могут быть и другие случаи, когда использование настоящего руководства является приемлемым; более подробная информация представлена в Руководстве ОЭСР по стратегиям и методам испытания нейротоксичности [8].
Настоящее руководство было разработано с учетом возможности адаптации его к проведению конкретных процедур, необходимых для подтверждения специфической гистопатологической и поведенческой нейротоксичности химического вещества, а также для получения характеристики и количественного описания нейротоксических реакций.
В прошлом нейротоксичность приравнивалась к нейропатии, включающей нейропатологические поражения или неврологические нарушения, такие как припадки, параличи или тремор. Несмотря на то, что нейропатия является важным проявлением нейротоксичности, в настоящее время понятно, что существует множество других признаков токсического поражения нервной системы (например, потеря координации движений, дефицит сенсорных реакций, дисфункции способности к обучению и памяти), которые могут не выявляться в испытаниях на нейропатию и других исследованиях.
Настоящее руководство по испытанию нейротоксичности предназначено для выявления основных нейроповеденческих и нейропатологических реакций у половозрелых особей грызунов. В то время как поведенческие реакции, даже при отсутствии морфологических изменений, могут отражать негативное воздействие на организм, не все изменения в поведении характерны для нервной системы. Таким образом, любые наблюдаемые изменения следует оценивать в сочетании с соответствующими гистопатологическими, гематологическими и биохимическими данными, а также данными о других видах соматической токсичности. Испытания, представленные в настоящем стандарте, предназначены для получения характеристики и количественного описания нейротоксических реакций и включают в себя определенные гистопатологические и поведенческие процедуры, результаты которых могут в дальнейшем дополнительно подтверждаться электрофизиологическими и / или биохимическими исследованиями [8, 9,10,11].
Нейротоксиканты могут воздействовать на несколько мишеней в нервной системе с разным механизмом действия. Поскольку ни один набор тестов не способен полностью оценить потенциальное нейротоксическое действие всех веществ, может быть необходимо использование другие in vivo или in vitro методов, специфичных для наблюдаемого или ожидаемого типа нейротоксичности._
Издание официальное
1
Настоящее руководство также может использоваться в сочетании с Руководством ОЭСР по стратегиям и методам испытания нейротоксичности [8] для разработки исследований, направленных на получение подробной характеристики или повышения чувствительности количественного определения «доза - ответ» для более точной оценки уровня воздействия, при котором не наблюдается никаких неблагоприятных эффектов (NOAEL), или обоснования известных или предполагаемых опасностей химических веществ. Например, исследования могут быть проведены для определения и оценки нейротоксических механизмов или дополнения уже имеющихся данных с использованием основных нейроповеденческих и нейропатологических процедур наблюдения. Такие исследования не требуют повторного получения данных, которые могут быть получены с использованием стандартных процедур, рекомендованных в настоящем стандарте, если такие данные уже существуют и не являются необходимыми для интерпретации результатов исследования.
В настоящем испытании нейротокичности, при использовании отдельно или в сочетании с другими испытаниями, может быть получена информация, позволяющая:
определить, является ли поражение нервной системы в результате воздействия химического вещества обратимым;
получить характеристику изменений нервной системы, связанных с воздействием химического вещества, и понимание основного механизма воздействия;
получить описание зависимостей «доза - ответ» и «время - ответ» для оценки NOAEL (который может быть использован для установления критериев безопасности химического вещества).
В настоящем руководстве описан пероральной способ поступления исследуемого вещества в организм животного. Другие пути поступления (например, накожный и ингаляционный) могут быть более приемлемыми, но это потребует изменения экспериментальных процедур. Выбор пути введения (поступления) исследуемого вещества в организм животного зависит от пути воздействия на человека и имеющихся токсикологических и кинетических данных.
2 Термины и определения
В настоящем стандарте применены следующие термины с соответствующими определениями:
2.1 доза (Dose): количество вводимого тестовому организму исследуемого вещества. Доза выражается как масса (г, мг) или масса исследуемого вещества на единицу массы тестового организма (например, мг/кг), или постоянная концентрация исследуемого вещества в рационе (ppm).
2.2 дозировка (Dosage): общий термин, используемый для обозначения дозы, частоты ее введения и продолжительности приема.
2.3 негативное воздействие (Adverse effect): Любое, связанное с воздействием внешних факторов изменение по сравнению с исходным уровнем, которое снижает способность организма к выживанию, воспроизводству или адаптации к окружающей среде.
2.4 нейротоксикант (Neurotoxicant): любой химический, биологический или физический агент, обладающий потенциальной нейротоксичностью.
2.5 нейротоксичность (Neurotoxicity): негативные изменения в структуре и функциях нервной системы, вызванные воздействием химических, биологических или физических агентов.
2.6 NOAEL: это аббревиатура уровня отсутствия наблюдаемого вредного воздействия после введения вещества, и является максимальной дозой, не вызывающей обнаруживаемого вредного воздействия на здоровье.
3 Принцип тестирования
Исследуемое вещество вводят перорально нескольким группам лабораторных животных в определенном диапазоне доз. Обычно требуется также введение повторных доз, и период дозирования может составлять 28 дней, 90 дней для испытания подострой токсичности или 1 год и более для испытания хронической токсичности. Процедуры, изложенные в настоящем стандарте, также могут использоваться для испытания острой нейротоксичности. Животных испытывают для обнаружения и описания характеристик поведенческих и / или неврологических отклонений. В течение каждого периода наблюдения оценивается целый ряд моделей поведения, которые могут быть обусловлены действием нейротоксикантов. По окончании испытания выборку животных каждого пола из каждой группы подвергают перфузии in situ, и отделы головного мозга, спинного мозга и периферических нервов препарируют и исследуют.
Когда испытание проводится как отдельное исследование для выявления нейротоксичности или получения характеристик нейротоксического действия, животные из каждой группы, не используемые для перфузии и последующего гистопатологического обследования (таблица 1), могут
ГОСТ 32645-2014
использоваться для проведения определенных нейроповеденческих, ней ропатологических, нейрохимических и электрофизиологических процедур, позволяющих дополнить данные, полученные в стандартных испытаниях, представленных в руководстве [8]. Данные дополнительные процедуры могут быть особенно полезными, когда эмпирические наблюдения и ожидаемые реакции указывают на конкретный тип нейротоксичности или воздействие на определенный орган-мишень. В ином случае, остальные животные могут быть использованы для оценок, подобных предусмотренным руководствами по проведению испытаний токсичности повторных доз на грызунах.
В случае, когда процедуры, предусмотренные в настоящем стандарте, проводятся в сочетании с другими испытаниями, необходимо использовать количество животных, достаточное для удовлетворения требований к проведению всех испытаний.
4 Описание метода4.1 Животные4.1.1 Выбор видов
4.1.1 Выбор видов
Наиболее предпочтительным видом является крыса, хотя при определенном обосновании могут использоваться и другие виды грызунов. Для проведения испытания, как правило, используют стандартные лабораторные линии молодых половозрелых здоровых особей. Женские особи не должны быть рожавшими или беременными. Испытание, как правило, начинают как можно раньше после прекращения грудного вскармливания, желательно не позднее, чем животные достигнут возраста шесть недель, и, в любом случае, ранее девятинедельного возраста. Однако, при проведении настоящего испытания в сочетании с другими исследованиями данные возрастные параметры могут нуждаться в корректировке. В начале исследования отклонение в весе используемых животных не должно превышать ± 20% от средней массы тела животных каждого пола. В случаях, когда кратковременное испытание повторной дозы проводится в качестве предварительного перед долгосрочным исследованием, в обоих исследованиях необходимо использовать животных одной и той же линии, полученных из одного источника.
4.1.2 Условия содержания и кормления
Температура в экспериментальном помещении для животных должна поддерживаться на уровне 22 ± 30 °С. Несмотря на то, что относительная влажность должна быть как минимум 30 % и не превышать 70 %, за исключением времени уборки комнаты, оптимальное значение составляет 50 % -60 %. Освещение должно быть искусственным в последовательности: 12 часов - свет, 12 часов -темнота. При кормлении может быть использована обычная лабораторная диета с неограниченным количеством питьевой воды. Громкий переменный шум необходимо свести к минимуму. При получении исследуемого вещества с пищей, на выбор диеты может повлиять необходимость обеспечения подходящего содержания исследуемого вещества в пище. Животных можно содержать отдельно или размещать в клетках небольшими группами одного пола.
4.1.3 Подготовка животных
Здоровые молодые животные должны быть случайным образом распределены в группы дозирования и контрольную группу. Клетки должны быть установлены таким образом, чтобы возможные эффекты, связанные с их размещением, были минимальными. Животных однозначно идентифицируют и помещают в клетки, как минимум, за пять дней до начала исследования для обеспечения адаптации к лабораторным условиям.
4.2 Способ введения исследуемого вещества и подготовка дозы
В настоящем стандарте предусмотрен пероральный способ введения исследуемого вещества. Исследуемое вещество может вводиться перорально посредством желудочного зонда, с пищей, питьевой водой или в капсулах. Также могут использоваться и другие пути введения (например, дермальный или ингаляционный), но это может потребовать изменения рекомендуемых экспериментальных процедур. Выбор пути введения зависит от возможного воздействия на человека и имеющейся токсикологической информации и данных о кинетике. Основания для выбора пути введения, а также итоговые изменения экспериментальных процедур, приведенных в настоящем стандарте, должны быть приведены в отчете о проведении испытания.
При необходимости, исследуемое вещество может быть растворено или суспендировано в соответствующем растворителе. Рекомендуется в первую очередь рассматривать возможность использования водного раствора / суспензии, а затем раствора / суспензии в масле (например, кукурузном масле), затем возможные растворы / суспензии в других растворителях. Токсикологические характеристики растворителя должны быть известны. Кроме того, следует учитывать также следующие характеристики растворителя: влияние на абсорбцию, распределение, метаболизм или удержание исследуемого вещества, влияние на химические свойства исследуемого вещества, вызывающие изменение его токсикологических свойств; влияние на потребление пищи или воды или характер питания животных.
3
5 Процедура испытания
5.1 Количество и пол животных
При проведении самостоятельного испытания в каждой группе дозирования и контрольной группе необходимо использовать, как минимум, по 20 животных (10 женских и 10 мужских особей) для проведения подробного клинического обследования и функциональных тестов. По крайней мере, 5 мужских и 5 женских особей, отобранных из данных 10 мужских и 10 женских особей, подвергают перфузии in situ и используют для подробного нейрогистопатологического исследования в конце испытания. В случаях, когда только ограниченное число животных из данной группы дозирования наблюдают на наличие признаков нейротоксического действия, следует рассмотреть вопрос о включении данных животных группы для перфузии. Когда исследование проводится в сочетании с испытанием токсичности повторной дозы, необходимо использовать достаточное количество животных для достижения целей обоих исследований. Минимальное количество животных в группе для различных комбинаций исследований приведено в таблице 1. Если планируется проводить промежуточные умерщвления животных, наблюдения обратимости нейротоксических эффектов в группах восстановления или сохранения / появления отложенных эффектов после воздействия или иные дополнительные наблюдения, количество животных должно быть увеличено для возможности проведения соответствующих наблюдений и гистопатологического обследования.
5.2 Исследуемые и контрольные группы
Необходимо использовать, как минимум, три группы дозирования и контрольную группу, но если на основании оценки имеющихся данных, появление какой-либо реакции при повторной дозе 1000 мг / кг массы тела / сутки не ожидается, может быть проведено тестирование с использованием предельной дозы. Если соответствующие данные не доступны, проводится исследование по выбору диапазона доз, которые будут использоваться в основном испытании. За исключением введении исследуемого вещества, с животными из контрольной группы следует обращаться также, как с животными из экспериментальных групп. Если для введения исследуемого вещества используется растворитель, контрольная группа должна получать его в максимальном используемом объеме.
5.3 Проверка достоверности тестирования
Лаборатория, проводящая испытание, должна представить данные, подтверждающие возможность проводить подобные исследования и оценивать чувствительность используемых процедур. Такие данные должны свидетельствовать о возможности выявления и, при необходимости, количественной оценки изменений в различных объектах исследования испытания, рекомендуемых для наблюдения, таких как автономные признаки, сенсорные реакции, сила сцепления конечностей и двигательная активность.
Информация о химических веществах, которые вызывают различные виды нейротоксических реакций и могут использоваться в качестве положительных контрольных веществ, представлена в документах по ссылкам 9-16. Данные предыдущих исследований могут быть использованы, если основные аспекты экспериментальных процедур остаются неизменными. Рекомендуется проводить периодическое обновление информации предыдущих исследований. Новые данные, подтверждающие чувствительность экспериментальных процедур, должны разрабатываться, когда некоторые основные элементы проведения испытания или процедуры были изменены испытательной лабораторией.
5.4 Выбор дозы
Уровни доз должны подбираться с учетом любых полученных ранее данных о токсичности и кинетических данных для исследуемого вещества или родственных соединений. Максимальный уровень дозы должен быть выбран с целью индуцирования нейротоксического действия или очевидного соматического токсического эффекта. Таким образом, убывающая последовательность доз должна быть выбрана таким образом, чтобы продемонстрировать любой эффект, зависимый от дозы, и при наименьшей дозе - уровень воздействия, при котором не наблюдается никаких неблагоприятных эффектов (NOAEL). В общем случае, уровень дозы должен быть установлен таким образом, чтобы основное токсическое воздействие на нервную систему можно было отличить от признаков, относящихся к соматической токсичности. Наиболее оптимальными являются двух- и трехкратные интервалы, и добавление четвертой тестовой группы часто предпочтительнее использования значительных интервалов между уровнями доз (например, более чем десятикратных). В случае, когда существует обоснованная оценка воздействия на человека, ее следует также принимать во внимание.
5.5 Исследование предельной дозы
Если исследование с одним уровнем дозы не менее 1000 мг/кг массы тела/сутки с использованием описанных процедур не приводит к появлению видимого нейротоксического действия и если, исходя из данных для структурно родственных веществ, появление признаков 4
токсичности не ожидается, нет необходимости проводить полное исследование с использованием трех уровней доз. Ожидаемое воздействие на человека может указывать на необходимость использования в исследование предельной дозы более высокой дозы при пероральном пути поступления. Для других путей поступления (ингаляционном и дермальном) максимально достижимый уровень дозы часто может определяться исходя из физико-химических свойств исследуемого вещества. В испытании острой токсичности при пероральном пути поступления предельная доза должна составлять не менее 2000 мг/кг.
5.6 Введение дозы
Тестовым животным вводят исследуемое вещество ежедневно, семь дней в неделю, в течение не менее 28 дней. Использование пятидневного режима дозирования или более короткого периода дозирования должно быть обосновано.
Если исследуемое вещество вводят через желудочный зонд, животным необходимо вводить однократную дозу с помощью желудочной трубки или подходящей интубационной канюли. Максимальный объем жидкости, который может быть введен за один раз, зависит от размера тестовых животных. Объем не должен превышать 1 мл на 100 г массы тела животного. В случае водных растворов, может быть приемлемо введение до 2 мл на 100 г массы тела. За исключением случаев раздражающих или едких веществ, которые, как правило, оказывают в высоких концентрациях раздражающее действие, изменения тестового объема должны быть минимизированы путем выравнивания концентраций для обеспечения постоянного объема для всех доз.
Для веществ, которые вводятся с пищей или питьевой воды, важно гарантировать, что вводимые количества исследуемого вещества не препятствуют нормальному питанию или не нарушают водный баланс.
Когда вещество вводится с пищей, то может использоваться либо постоянная пищевая концентрация (ppm), либо постоянный уровень дозы по отношению к массе животного; использование альтернативного варианта должно быть обосновано. Для веществ, вводящихся через зонд, доза должна вводиться в одно и то же время каждый день, и обеспечивать поддержание постоянной дозы по отношению к массе животного. В случае, когда кратковременное испытание повторной дозы проводится в качестве предварительного перед долгосрочным исследованием, в обоих исследованиях необходимо использовать аналогичные диеты. В испытаниях острой токсичности, когда введение разовой дозы не представляется возможным, доза может вводиться более мелкими фракциями в течение не более 24 часов.
6 Наблюдения
6.1 Частота проведения наблюдений и тестов
В исследованиях повторной дозы период наблюдений должен охватывать весь период дозирования. В исследованиях острой токсичности наблюдения необходимо проводить в 14-дневный период после дозирования. Для животных в сопутствующих группах, находящихся без воздействия в период после дозирования, наблюдения должны охватывать этот период.
Наблюдения необходимо проводить с достаточной частотой так, чтобы вероятность обнаружения любого поведенческого и/или неврологического отклонения была максимальной. Желательно проводить наблюдения каждый день в одно и то же время с учетом возможного пикового периода ожидаемого эффекта после дозирования. Частота клинических наблюдений и функциональных тестов представлена в таблице 2. Если кинетические или другие данные, полученные в предыдущих испытаниях, указывают на необходимость использования других временных интервалов для проведения наблюдений, тестов или последующих периодов, в испытании используют альтернативный график в целях получения максимальной информации. Изменение графика испытаний должно быть обосновано.
6.2 Наблюдения за общим состоянием здоровья и смертностью / заболеваемостью
Состояние здоровья всех животных необходимо тщательно обследовать, по крайней мере, один
раз в день, а также, по крайней мере, два раза в день обследовать животных на заболеваемость и смертность.
6.3 Подробное клиническое обследование
Подробное клиническое обследование необходимо проводить для всех животных, отобранных для этой цели (таблица 1) один раз перед первым введением исследуемого вещества (для проведения сравнений внутри группы) и в различные периоды после в зависимости от продолжительности испытания (таблица 2). Подробное клиническое обследование в сопутствующих группах восстановления должно проводиться по истечении периода восстановления. Подробное клиническое обследование должно проводиться вне клетки содержания на стандартной площадке. Результаты обследования должны быть тщательно зарегистрированы с использованием системы
5
подсчета, в которой предусмотрены критерии или количественные шкалы для каждого измерения в обследовании. Используемые критерии или шкалы должны быть четко определены испытательной лабораторией.
Необходимо обеспечить минимальное изменение условий проведения испытания (непосредственно не связанных с обработкой животных), обследование должно проводиться квалифицированными наблюдателями, не участвующими в настоящем испытании.
Рекомендуется проводить обследования структурировано так, чтобы четко определенные критерии (включая определение «нормального» состояния) систематически применялись для каждого животного в любое время обследования. «Нормальное» состояние должно быть надлежащим образом зарегистрировано. Все наблюдаемые признаки должны быть зарегистрированы. По возможности, необходимо также сообщать величины наблюдаемых признаков. Клиническое обследование должно включать, но не ограничиваться, изучение изменений кожи, меха, глаз, слизистых оболочек, появление выделений и экскрементов и вегетативной активности (например, слезотечение, пилоэрекция, изменение размеров зрачка, необычный способ дыхания и / или дыхание через рот, любые нестандартные признаки мочеиспускания или дефекации, а также обесцвечивание мочи).
Любые необычные результаты в отношении положения тела, уровня активности (например, снижение или повышение интереса к исследованию стандартной площадки) и координации движений также необходимо регистрировать. Изменения в походке (например, раскачивающаяся походка, атаксия), позы (например, прогиб в спине) и реакции на обращение, размещение или другие раздражители окружающей среды, а также наличие клонических или тонизирующих движений, судорог и дрожи, стереотипии (например, чрезмерная чистоплотность, необычные движения головой, хождение по кругу), аномальное поведение (например, укусы или чрезмерное вылизывание, самоповреждение, хождение задом, вокализация) или агрессия должны быть зарегистрированы.
6.4 Функциональные тесты
Подобно детальным клиническим обследованиям, функциональные тесты необходимо проводить один раз до введения исследуемого вещества и с определенной частотой после введения исследуемого вещества для всех животных, отобранных для этой цели (таблица 1). Частота проведения функциональных тестов также зависит от продолжительности испытания (таблица 2). В дополнение к периодам наблюдения, указанным в таблице 2, функциональное обследование для сопутствующей группы восстановления также должно проводиться как можно ближе к запланированному времени умерщвления животных. Функциональные тесты должны включать в себя проверку сенсорной реакции на раздражители различных модальностей (например, слуховые, зрительные и проприоцептивные раздражители [12, 13, 14]), оценку силы сцепления конечностей [15] и оценку двигательной активности [16]. Двигательная активность должна быть измерена с помощью автоматического устройства, способного обнаруживать как уменьшение, так и увеличение активности. Любая используемая система оценок должна быть количественной, должны быть подтверждены и продемонстрированы ее чувствительность и достоверность. Каждый используемый прибор должен быть проверен для гарантии надежности показаний во времени и согласованности с другими устройствами. Более подробная информация о процедурах, которые можно использовать, приведена в соответствующих документам (см. ссылки). Если существуют другие данные (например, о зависимости «структура - активность», эпидемиологические данные других токсикологических исследований) для демонстрации потенциального нейротоксического действия, необходимо рассматривать включение в испытание специализированных тестов для сенсорных и моторных функций или обучения и памяти для изучения возможных подобных последствий. Более подробная информация о специализированных тестах и их использовании представлена в Руководстве по стратегиям и методам проведения испытаний нейротоксичности [8].
В редких случаях, животных, которые демонстрируют признаки токсичности в степени, оказывающей значительное влияние на результаты функциональных тестов, можно исключить из проведения функциональных тестов. Исключение животных из функциональных тестов должно быть обосновано.
6.5 Масса тела и потребление пищи/воды
Для испытаний продолжительностью до 90 дней всех животных необходимо взвешивать, по крайней мере, один раз в неделю. Измерения потребление продуктов питания (потребление воды, в случае, когда исследуемое вещество поступает с водой) необходимо оценивать также, как минимум, один раз в неделю. Для длительного исследования всех животных необходимо взвешивать, по крайней мере, один раз в неделю в течение первых 13 недель, затем, по крайней мере, один раз каждые 4 недели. Потребление продуктов питания (потребление воды, в случае, когда исследуемое вещество поступает с водой) необходимо оценивать, как минимум, один раз в неделю в течение