ГОСТ 32379-2013
Методы испытания по воздействию химической продукции на организм человека. Испытания по оценке репродуктивной/эмбриональной токсичности (скрининговый метод)
Купить ГОСТ 32379-2013 — бумажный документ с голограммой и синими печатями. подробнее
Распространяем нормативную документацию с 1999 года. Пробиваем чеки, платим налоги, принимаем к оплате все законные формы платежей без дополнительных процентов. Наши клиенты защищены Законом. ООО "ЦНТИ Нормоконтроль"
Наши цены ниже, чем в других местах, потому что мы работаем напрямую с поставщиками документов.
Способы доставки
- Срочная курьерская доставка (1-3 дня)
- Курьерская доставка (7 дней)
- Самовывоз из московского офиса
- Почта РФ
Может быть использован для получения предварительных данных о возможном воздействии на репродуктивность и/или эмбрион как на первоначальном этапе оценки токсических свойств нового химического вещества, так и при исследовании известных химических веществ, вызывающих опасения. Метод исследования может использоваться как часть ряда первоначальных скрининговых исследований химических веществ, о которых отсутствуют или ограничены токсикологические данные; как исследование по поиску уровня дозы химического вещества для более широких репродуктивных/эмбриональных исследований или для других значимых целей.
Стандарт предполагает пероральный способ введения тестируемого вещества. При использовании другого способа введения требуется обоснование.
Идентичен OECD Test № 421:2010
Переиздание. Апрель 2019 г.
Оглавление
1 Область применения
2 Термины и определения
3 Принцип метода испытания
4 Подготовка
5 Процедура испытания
6 Наблюдения
7 Данные и отчет о проведении испытания
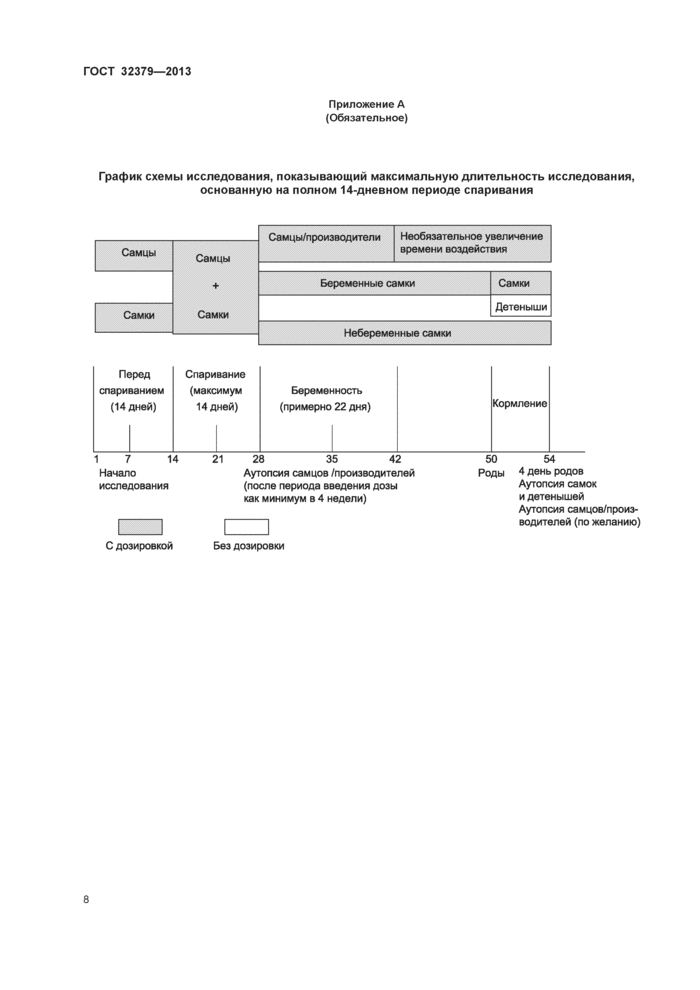
Приложение А (обязательное) График схемы исследования, показывающий максимальную длительность исследования, основанную на полном 14-дневном периоде спаривания
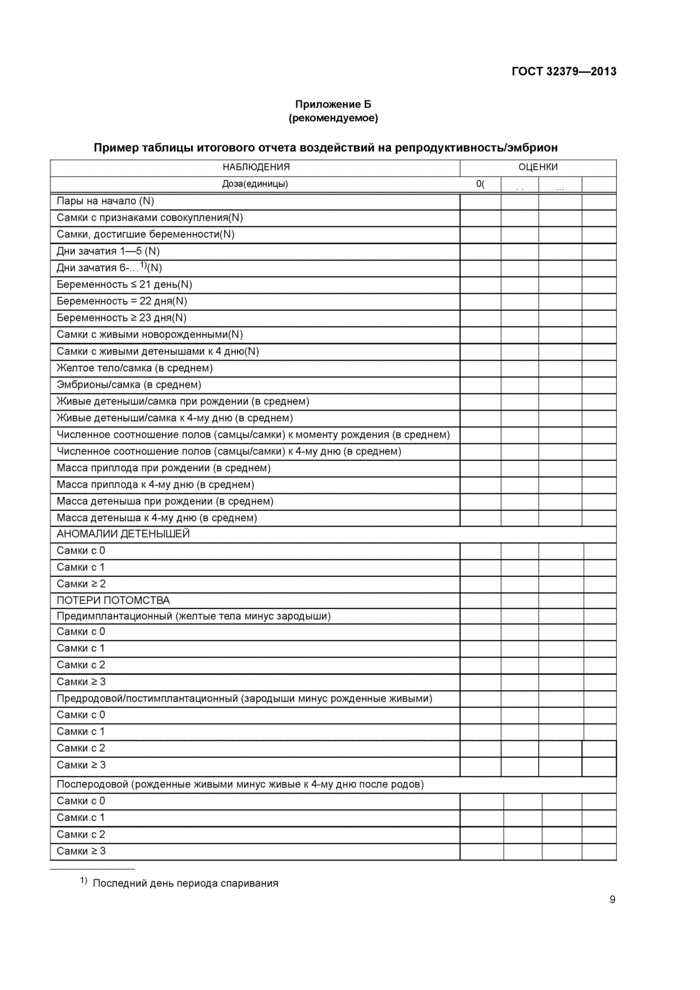
Приложение Б (рекомендуемое) Пример Таблицы итогового отчета воздействий на репродуктивность/эмбрион
Библиография
| Дата введения | 01.08.2014 |
|---|---|
| Добавлен в базу | 21.05.2015 |
| Актуализация | 01.01.2021 |
Этот ГОСТ находится в:
- Раздел Экология
Организации:
| 18.10.2013 | Утвержден | Межгосударственный Совет по стандартизации, метрологии и сертификации | 60-П |
|---|---|---|---|
| 22.11.2013 | Утвержден | Федеральное агентство по техническому регулированию и метрологии | 807-ст |
| Разработан | ФГУП ВНИЦ СМВ | ||
| Разработан | ФБУЗ Российский регистр потенциально опасных химических и биологических веществ Роспотребнадзора | ||
| Издан | Стандартинформ | 2014 г. | |
| Издан | Стандартинформ | 2019 г. |
Testing of chemicals of human hazard. Reproduction/developmental toxicity screening test
Чтобы бесплатно скачать этот документ в формате PDF, поддержите наш сайт и нажмите кнопку:

стр. 1

стр. 2

стр. 3

стр. 4

стр. 5

стр. 6

стр. 7

стр. 8

стр. 9

стр. 10

стр. 11
стр. 12
стр. 13

стр. 14

стр. 15

стр. 16
МЕЖГОСУДАРСТВЕННЫЙ СОВЕТ ПО СТАНДАРТИЗАЦИИ, МЕТРОЛОГИИ И СЕРТИФИКАЦИИ
(МГС)
INTERSTATE COUNCIL FOR STANDARDIZATION, METROLOGY AND CERTIFICATION
(ISC)
МЕЖГОСУДАРСТВЕННЫЙ
СТАНДАРТ
МЕТОДЫ ИСПЫТАНИЯ ПО ВОЗДЕЙСТВИЮ ХИМИЧЕСКОЙ ПРОДУКЦИИ НА ОРГАНИЗМ ЧЕЛОВЕКАИзучение хронической токсичности при ингаляционном поступлении
(OECD, Test №452:2008, IDT)
Издание официальное
ГОСТ
32383—
2013
|
Москва Стандартинформ 2014 |
Предисловие
Цели, основные принципы и порядок проведения работ по межгосударственной стандартизации установлены ГОСТ 1.0-92 «Межгосударственная система стандартизации. Основные положения» и ГОСТ 1.2-2009 «Межгосударственная система стандартизации. Стандарты межгосударственные, правила и рекомендации по межгосударственной стандартизации. Правила разработки, принятия, обновления и отмены»
Сведения о стандарте
1 ПОДГОТОВЛЕН Федеральным бюджетным учреждением здравоохранения «Российский регистр потенциально опасных химических и биологических веществ» Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека (ФБУЗ «Российский регистр потенциально опасных химических и биологических веществ» Роспотребнадзора);
Федеральным государственным унитарным предприятием «Всероссийский научно-исследовательский центр стандартизации, информации и сертификации сырья, материалов и веществ» (ФГУП «ВНИЦСМВ»)
2 ВНЕСЕН Федеральным агентством по техническому регулированию и метрологии
3 ПРИНЯТ Межгосударственным советом по стандартизации, метрологии и сертификации (протокол от 18 октября 2013 г. № 60-П)
|
За принятие проголосовали: | |||||||||||||||||||||
|
4 Настоящий стандарт идентичен международному документу OECD Test № 452:2008 «Chronic Toxicity Studies» (Исследование хронической токсичности).
Перевод с английского языка (еп).
Степень соответствия - идентичная (IDT)
5 Приказом Федерального агентства по техническому регулированию и метрологии от 22 ноября 2013 г. № 812-ст межгосударственный стандарт ГОСТ 32383-2013 введен в действие в качестве национального стандарта Российской Федерации с 1 августа 2014 г.
6 ВВЕДЕН ВПЕРВЫЕ
холестерин, как минимум, два анализа на гепатоцеллюлярный анализ (аланин-аминотрансфераза, аспартат-аминотрансфераза, глютаминат дегидрогеназа, желчные кислоты), и, как минимум, два анализа на гепатобилиарный анализ (щелочная фосфатаза, гамма-глутаминтрансфераза, 5-нуклеотидаза, общий билирубин, желчные кислоты). Другие клинические химические показатели, такие как триглицерид натощак, специфицеские гормоны и холинэстераза могут быть измерены в случае необходимости в зависимости от токсичности вещества. В целом необходим гибкий подход в зависимости от наблюдаемого и/или ожидаемого воздействия каждого конкретного вещества.
Анализ мочи должен проводиться, как минимум, у 10 самцов и 10 самок каждой группы на образцах, собранных за одинаковые промежутки времени, как и в случае с гематологией и клинической химией. Нет необходимости проводить измерения в три месяца, если за предыдущие 90 дней при аналогичном уровне концентрации не наблюдалось воздействия на мочу. В последние экспертные рекомендации по исследованию клинической патологии был включен следующий список параметров: внешний вид, объем, осмотическая концентрация раствора или относительная плотность, pH, общий белок и глюкоза. Другие исследования включают кетон, уробилиноген, билирубин и скрытую кровь. Дополнительные исследования могут быть использованы при необходимости расширить изучение наблюдаемых воздействий.
4.6 Патология4.6.1 Макроскопическая аутопсия
Все животные, участвующие в исследовании, как правило, подвергаются полной, детальной макроскопической аутопсии, которая включает тщательное исследование наружной поверхности тела, всех отверстий, черепных, грудных и брюшных полостей и их содержимого. При этом может быть сделан резерв (в группах для промежуточных умерщвлений или во вспомогательных группах) для измерений, ограниченных отдельными, важными показателями, такими как нейротоксичность или иммунотоксичность. Этих животных не нужно подвергать аутопсии и дальнейшим процедурам. Индикаторные животные могут требовать аутопсии в каждом отдельном случае, на усмотрение руководителя исследования.
Значимые органы следует собрать у всех животных, исключая тех, что указаны выше. Надпочечник, мозг, придатки яичка, сердце, почки, печень, яичники, селезенка, яички, щитовидная железа (оценив постфиксацию, с паращитовидной железой) и матка всех животных (кроме тех, что были найдены умершими и/или были промежуточно умерщвлены) должны быть отсечены, если необходимо, от прилегающих тканей и взвешены, как можно быстрее после отсечения для предотвращения высыхания. В случае если органы парные, например, почки, надпочечники, оба органа должны быть взвешены отдельно. В исследованиях с использованием мышей, взвешивание надпочечных желез не обязательно.
Ткани, которые необходимо подвергнуть консервации в наиболее подходящем средстве фиксации в качестве образца для дальнейшего гистопатологического исследования, представлены в таблице 1.
6
|
Т а б л и ц а 1 - Ткани, которые необходимо подвергнуть консервации | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Ткани, приведенные в квадратных скобках, не являются обязательными. В случае с парными органами, например, почки, надпочечники, следует сохранять оба органа. Любые другие органы, считающиеся на основе известных свойств исследуемого вещества возможными органами-мишенями, также следует сохранить. Для других органов/тканей (и в дополнение к отдельно сохраняемым тканям из дыхательных путей) список органов, как он установлен для перорального введения, должен быть пересмотрен.
4.6.2 Гистопатология
Минимальными гистопатологическими анализами должны быть:
-все ткани из группы с высокой концентрацией и контрольной группы;
-все ткани животных, умерших или умерщвленных в течение исследования;
-все ткани, имеющие макроскопические аномалии;
-ткани органов-мишеней или ткани животных, имеющие изменения, связанные с проводимым исследованием, из группы, получавшей наивысшую концентрацию, и из всех других групп;
-в случае с парными органами, например, почки, надпочечники, должны быть исследованы оба органа.
7
Данные для каждого отдельного животного должны содержать все параметры по оценке воздействия. Дополнительно все данные должны быть сведены в таблицу, отражающую для каждой тестовой группы количество животных на начало исследования; количество животных, умерших во время исследования или умерщвленных по гуманным соображениям, и время каждой смерти или умерщвления; количество обнаруженных признаков токсичности; описание наблюдаемых признаков токсичности, включая время начала, продолжительность и тяжесть любых токсических воздействий; количество животных, демонстрирующих патологию, тип патологии и процент животных, демонстрирующих каждый тип патологии.
Данные контроля предыдущих исследований могут быть полезными при интерпретации результатов настоящего исследования в случаях, когда имеется информация о различиях в контрольных данных. Данные контроля предыдущих исследований должны предоставляться из той же лаборатории за последние 5 лет при условии использования животных той же линии и того же возраста.
По возможности, численные результаты должны быть оценены специальными и общепринятыми статистическими методами. Статистические методы и данные для анализа должны быть выбраны во время разработки исследования. При необходимости, этот выбор должен предусматривать корректировку выживаемости.
5 Отчёт
Отчёт об исследовании должен содержать следующую информацию:
Исследуемое вещество:
-физические природа, чистота и физико-химические свойства;
-идентификационные данные;
-источник вещества;
-номер партии.
Среда (при необходимости):
-обоснование выбора среды (если это не вода).
Подопытные животные:
-вид/род и обоснование сделанного выбора;
-число, возраст, пол в начале исследования;
-происхождение, условия содержания, питание и так далее;
-масса каждого животного в начале исследования.
Данные об условиях проведения исследования:
-обоснование метода введения и выбора концентрации;
-по необходимости, статистические методики, используемые для анализа данных;
-подробное описание приготовления состава тестируемого вещества/пищи, достигнутая концентрация, устойчивость и однородность вещества;
-способ введения вещества и подробное описание введения;
-описание носа и/или всего тела;
-качество пищи и воды.
Результаты:
-данные о выживших;
-масса/изменения массы;
-потребление еды, подсчёт энергетической ценности, если проведён, и потребление воды, если возможно;
-реакция на токсичность по полу и уровню концентрации, включая признаки токсичности; -характер, охват и, если выявлена, тяжесть и продолжительность клинических наблюдений (были они промежуточными или постоянными);
-офтальмологический осмотр;
-гематологические анализы;
-клинические биохимические анализы;
-анализ мочи;
-результат любых исследований нейротоксичности или иммунотоксичности;
-конечная масса тела;
-масса органов и их соотношение, если возможно;
-данные аутопсии;
-детальное описание гистопатологических показателей, имеющих отношение к проводимому исследованию;
-данные абсорбции, если возможно.
Статистическая обработка результатов (где это возможно):
-масса тела до и после исследования;
-масса органов до и после исследования;
-потребление пищи или воды и энергетическая ценность пищи. Изучение результатов включает:
-соотношение зависимости концентрация-ответ;
-рассмотрение любой формы воздействия;
-изучение возможности моделирования;
-данные контроля предыдущих исследований;
-значимость для человека.
Заключение
9
Библиография
[1] Руководящий документ ОЭСР Test № 452 «Chronic Toxicity Studies»
[2] Руководство ОЭСР Test № 116 «On the design and conduct of chronic toxicity and
carcinogenicity studies, supporting TG 451,452 and 453»
[3] Руководство ОЭСР Test № 412 «Repeated Dose Inhalation Toxicity: 28-day or 14-day Study»
[4] Руководство ОЭСР Test № 413 «Subchronic Inhalation Toxicity: 90-Day Study»
[5] Руководство ОЭСР Test № 19 «Guidance document on the recognition, assessment, and use of
clinical signs as humane endpoints for experimental animals used in safety evaluation Unclassified»
[6] OECD (Rome, 1995). Report of the Consultation Meeting on Sub-chronic and Chronic Toxicity/Carcinogenicity Testing.
[7] Combes RD, Gaunt, I, Balls M (2004). A Scientific and Animal Welfare Assessment of the OECD Health Effects Test Guidelines for the Safety Testing of Chemicals under the European Union REACH System. ATLA 32, 163-208.
[8] Barlow SM, Greig JB, Bridges JW et al (2002). Hazard identification by methods of animal-based toxicology. Food. Chem. Toxicol. 40, 145-191.
[9] Chhabra RS, Bucher JR, Wolfe M, Portier C (2003). Toxicity characterization of environmental chemicals by the US National Toxicology Programme: an overview. Int. J. Hyg. Environ. Health 206, 437-445.
[10] OECD Guidelines for the Testing of Chemicals. No. xx. Guidance Document on the design and conduct of chronic toxicity and carcinogenicity studies [alternate: Guidance Document on the selection of doses for use in chronic toxicity and carcinogenicity studies],
[11] OECD Guidelines for the Testing of Chemicals. No. 39. Draft Guidance Document on Acute Inhalation Toxicity Testing. Version 9, March 2008.
[12] OECD Guidelines for the Testing of Chemicals. TG 412, Subacute Inhalation Toxicity: 28-Day Study.
[13] OECD Guidelines for the Testing of Chemicals. TG 413, Subchronic Inhalation Toxicity: 90-Day Study.
[14] Carmichael NG, Barton HA, Boobis AR et al (2006). Agricultural Chemical Safety Assessment: A Multisector Approach to the Modernization of Human Safety Requirements. Critical Reviews in Toxicology 36, 1-7.
[15] Barton HA, Pastoor TP, Baetcke T et al (2006). The Acquisition and Application of Absorption, Distribution, Metabolism, and Excretion (ADME) Data in Agricultural Chemical Safety Assessments. Critical Reviews in Toxicology 36, 9-35.
[16] Doe JE, Boobis AR, Blacker A et al (2006). A Tiered Approach to Systemic Toxicity Testing for Agricultural Chemical Safety Assessment. Critical Reviews in Toxicology 36, 37-68. Draft consultant’s proposal. V. 8. OECD TG 452 November, 2008, 13
[17] Cooper RL, Lamb JS, Barlow SM et al (2006). A Tiered Approach to Life Stages Testing for Agricultural Chemical Safety Assessment. Critical Reviews in Toxicology 36, 69-98.
[18] OECD Guidelines for the Testing of Chemicals. No. 19. Guidance Document on the recognition, assessment, and use of clinical signs as humane endpoints for experimental animals used in safety evaluation (2000).
[19] Rhomberg, LR, Baetcke, K, Blancato, J, Bus, J, Cohen, S, Conolly, R, Dixit R, Doe, J, Ekelman, K, Fenner-Crisp, P, Harvey, P, Hattis, D, Jacobs, A, Jacobson-Kram, D, Lewandowski, T, Liteplo, R, Pelkonen, O, Rice, J, Somers, D, Turturro, A, West, W, Olin, S. Issues in the Design and Interpretation of Chronic Toxicity and Carcinogenicity Studies in Rodents: Approaches to Dose Selection Grit Rev. Toxicol. 37 (9) 729 - 837 (2007).
[20] ILSI (International Life Sciences Institute) (1997). Principles for the Selection of Doses in Chronic Rodent Bioassays. Foran JA (Ed.). ILSI Press, Washington, DC.
[21] EEC Council Directive 86/609/EEC on the approximation of laws, regulations and administrative provisions of the Member States regarding the protection of animals used for experimental and other scientific purposes. Official Journal, 29, L358, 18th December 1986.
[22] National Research Council, 1985. Guide for the care and use of laboratory animals. NIH Publication No. 86-23. Washington D.C., US. Dept, of Health and Human Services.
[23] GV-SOLAS (Society for Laboratory Animal Science, Gesellschaft fur Versuchstierkunde, 1988). Publication on the Planning and Structure of Animal Facilities for Institutes Performing Animal Experiments. ISBN 3-906255-04-2.. http://www.gv-solas.de/publ/heft1_1988.pdf
[24] GV-SOLAS (Society for Laboratory Animal Science, Gesellschaft fur Versuchstierkunde, 2006). Microbiological monitoring of laboratory animals in various housing systems, http://www.gv-solas.de/auss/hyg/hyg-p7_e.html
10
[25] IPCS (1986). Principles and Methods for the Assessment of Neurotoxicity Associated with Exposure to Chemicals. Environmental Health Criteria Document No. 60.
[26] Tupper, D.E., Wallace, R.B. (1980). Utility of the Neurologic Examination in Rats. Acta Neurobiol. Exp., 40, 999-1003.
[27] Gad, S.C. (1982). A Neuromuscular Screen for Use in Industrial Toxicology. J. Toxicol.Environ. Health, 9, 691-704.
[28] Moser, V.C., McDaniel, K.M., Phillips, P.M. (1991). Rat Strain and Stock Comparisons Using a Functional Observational Battery: Baseline Values and Effects of Amitraz. Toxicol. Appl. Pharmacol., 108, 267-283.
[29] Meyer O.A., Tilson H.A., Byrd W.C., Riley M.T. (1979). A Method for the RoutineAssessment of Fore- and Hind-limb Grip Strength of Rats and Mice. Neurobehav. Toxicol., 1, 233-236. Draft consultant’s proposal. V. 8. OECD TG 452 November, 2008, 14
[30] Crofton K.M., Howard J.L., Moser V.C., Gill M.W., Reiter L.W., Tilson H.A., MacPhail R.C. (1991). Interlaboratory Comparison of Motor Activity Experiments: Implication for Neurotoxicological Assessments. Neurotoxicol. Teratol., 13, 599-609.
[31] Weingand K, Brown G, Hall R et al. (1996). Harmonisation of Animal Clinical Pathology Testing in Toxicity and Safety Studies. Fundam. &Appl. Toxicol., 29: 198-201.
[32] EMEA (draft) document ‘Non-clinical guideline on drug-induced hepatotoxicity’ (Doc. Ref. EMEA/CHMP/SWP/a50115/2006)
[33] Crissman JW, Goodman DG, Hildebrandt PK et al. (2004). Best Practices Guideline: Toxicological Histopathology. Toxicologic Pathology 32,126-131.
11
УДК 661:615.099:006.354 МКС 71.100.01, 13.100
Ключевые слова: химическая продукция, воздействие на организм человека, токсичность, хроническая, ингаляционная._
Подписано в печать 05.11.2014. Формат 60x84Vs.
Уел. печ. л. 1,86. Тираж 32 экз. Зак. 3994.
Подготовлено на основе электронной версии, предоставленной разработчиком стандарта
ФГУП «СТАНДАРТИНФОРМ»
123995 Москва, Гранатный пер., 4. www.gostinfo.ru info@gostinfo.ru
ГОСТ 32383-2013
Информация об изменениях к настоящему стандарту публикуется в ежегодном информационном указателе «Национальные стандарты», а текст изменений и поправок - в ежемесячном информационном указателе «Национальные стандарты». В случае пересмотра (замены) или отмены настоящего стандарта соответствующее уведомление будет опубликовано в ежемесячном информационном указателе «Национальные стандарты». Соответствующая информация, уведомление и тексты размещаются также в информационной системе общего пользования - на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет
© Стандартинформ, 2014
В Российской Федерации настоящий стандарт не может быть полностью или частично воспроизведен, тиражирован и распространен в качестве официального издания без разрешения Федерального агентства по техническому регулированию и метрологии
Введение
Большая часть исследований хронической токсичности осуществляется на грызунах и, поэтому данный стандарт предназначен, прежде всего, для исследований, осуществляемых на особях этого вида. Если проведение таких исследований потребуется на особях другого вида, изложенные принципы и методы также могут быть использованы, с надлежащими изменениями, в соответствии с целями и руководством [2].
В исследованиях хронической токсичности используются три основных способа введения: пероральный, дермальный (накожный) и ингаляционный. Выбор способа введения зависит от физических и химических свойств тестируемого вещества, а также от основного пути поступления в организм человека. Дополнительные сведения по выбору способа поступления в организм содержатся в руководстве [2].
В данном стандарте внимание уделяется ингаляционному способу введения.
Хотя долгосрочные исследования хронической токсичности, включающие накожный и пероральный пути введения, также могут понадобиться для оценки риска здоровью человека и/или по определенным нормативным требованиям.
Кроме данного стандарта при разработке должны быть приняты во внимание долгосрочные исследования, включающие ингаляционный метод введения, руководства [3] и [4].
Цели исследований хронической токсичности, охватываемые настоящим стандартом, включают: -определение опасных свойств химических веществ;
-определение органов-мишеней;
-описание зависимости «концентрация-ответ»;
-определение наивысшего уровня воздействия, при котором не наблюдается вредный эффект (NOAEL) или исходной точки для установления статистически достоверного нижнего предела концентрации, которая предопределяет изменения в ответных реакциях на вредное воздействие, что соответствует ЕС10 (ВМС);
-прогнозирование воздействия хронической токсичности на уровне организма человека; -предоставление данных для проверки гипотез относительно механизма действия.
IV
|
Поправка к ГОСТ 32383-2013 Методы испытания по воздействию химической продукции на организм человека. Изучение хронической токсичности при ингаляционном поступлении | ||||||
| ||||||
|
(ИУС № 4 2015 г.) |
1
ГОСТ 32383-2013СТАНДАРТ
МЕЖГОСУДАРСТВЕННЫЙ
МЕЖГОСУДАРСТВЕННЫЙ
МЕТОДЫ ИСПЫТАНИЙ ПО ВОЗДЕЙСТВИЮ ХИМИЧЕСКОЙ ПРОДУКЦИИ НА ОРГАНИЗМ ЧЕЛОВЕКА. Изучение хронической токсичности при ингаляционном поступлении
Testing of chemicals of human hazard Chronic toxicity studies
Дата введения — 2014—08—01
1 Область применения
Настоящий стандарт устанавливает порядок проведения исследования хронической токсичности. В оценке и анализе токсических свойств химического вещества до начала проведения исследования испытательной лабораторией должна быть проанализирована вся доступная информация по исследуемому веществу с тем, чтобы сфокусировать план исследования для более успешного тестирования возможной хронической токсичности и минимизировать использование животных. Данные, которые будут содействовать проведению исследования, включают: идентификацию, химическую структуру и физико-химические свойства исследуемого вещества; любую информацию о механизме действия; результаты любых in vitro и in vivo исследований токсичности; предполагаемое использование и вероятное воздействие на человеческий организм; доступные данные испытаний (Q)SAR и токсические свойства структурно родственных веществ; имеющиеся токсикокинетические данные (однократная концентрация, а также кинетика повторной концентрации, при наличии) и данные, полученные из других исследований повторного воздействия. Изучение хронической токсичности может быть проведено после получения первоначальных данных по изучению токсичности повторной концентрации в течение 28 и/или 90 дней. Поэтапный подход к исследованию хронической токсичности следует рассматривать как часть общей оценки возможного неблагоприятного воздействия на здоровье определенного химического вещества.
Исследование хронической токсичности предоставляет информацию по возможной опасности для здоровья, вероятно, возрастающей от повторяющихся воздействий в течение большей части продолжительности жизни грызунов. Исследование позволяет выявить данные о токсическом воздействии вещества, определить органы-мишени. Также в ходе его определяют наивысший уровень воздействия, при котором не наблюдается вредный эффект воздействия (NOAEL), что может быть использовано для установления критерия безопасности воздействия на организм человека. Следует также подчеркнуть необходимость тщательного клинического наблюдения за животными для получения максимально возможного количества информации.
В проведении исследования хронической токсичности необходимо всегда придерживаться основополагающих принципов и соображений, изложенных в [5].
Метод выбора основной концентрации зависит от первоначальных целей или задач исследования. При выборе подходящего уровня концентрации должен быть достигнут баланс между риском отсева с одной стороны и характеристикой ответных реакций на низкие концентрации и их значимость - с другой. Это чрезвычайно важно в случае комбинированного исследования хронической токсичности и канцерогенности.
Проведение комбинированного исследования хронической токсичности и канцерогенности требует большего анализа в сравнении с исследованиями хронической токсичности и канцерогенности, проводимыми раздельно. Следует внимательно отнестись к принципам выбора при проведении комбинированного исследования хронической токсичности и канцерогенности. Раздельные исследования могут являться необходимыми по определенным нормативным требованиям.
2 Термины и определения
В настоящем стандарте применены следующие термины с соответствующими определениями:
2.1 концентрация: Количество вводимого тестируемого вещества на единицу массы или объема объекта окружающей среды (мг/м3, ppm).
Издание официальное2.2 уровень воздействия, при котором не наблюдается вредный эффект (NOAEL):
Наивысший уровень концентрации, при которой не наблюдается вредный эффект, связанный с воздействием.
3 Принцип метода испытания
Исследуемое вещество вводится ежедневно порциями нескольким группам подопытных животных в течение 12 месяцев, хотя можно также выбрать более длительный или короткий периоды. Этот период был выбран в связи с тем, что он достаточен для того, чтобы стали очевидны любые проявления кумулятивной токсичности, не смешиваясь при этом с проявлениями возрастных изменений. Отклонение от продолжительности воздействия в 12 месяцев должно быть обосновано, особенно в случае сокращения срока. Тестируемое вещество вводится ингаляционно. План исследования может также включать одно или несколько промежуточных умерщвлений, например, к трем и шести месяцам. Для этого необходимо добавить дополнительные группы животных. В течение периода приема вещества животных тщательно обследуют на предмет выявления признаков токсичности. Животные, которые умерли или были умерщвлены в ходе тестирования, подвергаются аутопсии. По окончании исследования выживших животных умерщвляют и также проводят аутопсию.
4 Описание метода4.1 Животные4.1.1 Подбор видов животных
4.1.1 Подбор видов животных
Данный стандарт охватывает главным образом оценку и анализ хронической токсичности на грызунах, хотя подобные исследования на негрызунах могут понадобиться в соответствии с определенными нормативными требованиями. Выбор вида животных должен быть обоснован. План и проведение исследования хронической токсичности на видах негрызунов, когда это необходимо, должны быть основаны на принципах, содержащихся в данном стандарте. Дополнительная информация по выбору вида и рода экспериментальных животных содержится в руководстве [2].
Предпочтительным видом грызунов являются крысы, хотя могут использоваться и другие виды, например, мыши. Крысы и мыши были выбраны в качестве экспериментальных моделей за их сравнительно короткую продолжительность жизни, широкое применение в фармакологических и токсикологических исследованиях, их восприимчивость к индукции новообразований и доступность этих хорошо изученных видов. Вследствие этих качеств, имеется большое количество информации об их психологии и патологии. Следует использовать молодых здоровых взрослых животных лабораторных видов. Исследование хронической токсичности следует проводить на животных того же рода и того же происхождения, что и животные, использовавшиеся в предварительных токсикологических исследованиях небольшой продолжительности. Женские особи должны быть нерожавшими и не беременны.
4.1.2 Содержание и кормление
Животные могут находиться отдельно или содержаться в клетках небольшими группами одного пола. Отдельное проживание следует применять только, если это научно обосновано. Клетки надо размещать таким образом, чтобы свести к минимуму возможное влияние их местоположения. Температура в помещении с экспериментальными животными должна быть (22±3) С. Относительная влажность должна быть как минимум 30 % и не должна превышать 70 % (если только не проводится уборка помещения) оптимальная влажность от 50 % до 60 %. Освещение должно быть искусственным в последовательности 12 часов-свет, 12 часов-темнота. Для кормления могут использоваться обычные лабораторные диеты с неограниченным количеством питьевой воды. Диета должна отвечать всем потребностям в питании тестируемого вида. Содержание загрязняющих веществ, которые могут повлиять на результаты исследования (остатки пестицидов, стойкие органические загрязнители, фитоэстрогены, тяжелые металлы и микотоксины) должны быть по возможности минимизированы. Аналитические данные по питанию и уровню загрязняющих веществ в пище должны собираться периодически, как минимум, в начале исследования и, когда меняется используемая партия, и их следует включать в заключительный отчет. Должны также предоставляться аналитические данные по питьевой воде, используемой в исследовании.
4.1.3 Подготовка животных
Должны использоваться здоровые животные, которые прошли акклиматизацию в лабораторных условиях, как минимум, в течение семи дней и над которыми прежде не ставились эксперименты. В случае с грызунами, введение концентрации следует начинать, как можно раньше, после отлучения от матери и акклиматизации, желательно, до того, как животным исполнится восемь недель. Тестируемые животные должны быть описаны по роду, виду, происхождению, полу, массе и возрасту.
2
ГОСТ 32383-2013
В начале исследования разница в массе подопытных животных должна быть минимальна и не превышать ± 20 % от средней массы всех животных, задействованных в исследовании, отдельно каждого пола. Животные должны быть случайным образом распределены на контрольную и тестовую группы. После распределения заметной разницы в средней массе между группами каждого пола быть не должно. Если же она имеется, следует, по возможности, повторить распределение. Каждое животное должно быть помечено индивидуальным идентификационным номером, и этот номер следует нанести на перманентной основе, с помощью татуировки, вживления микрочипа или другим подходящим способом.
4.2 Основное испытание4.2.1 Количество и пол животных
Должны использоваться животные обоих полов. Следует использовать такое количество животных, чтобы по окончании исследования в каждой группе оставалось достаточное их количество для биологического и статистического анализов. Как правило, грызуны - минимум 20 животных, а негрызуны, как минимум, по 4 животных в каждой группе каждого пола для каждого уровня концентрации. В исследованиях, где задействованы мыши, может возникнуть необходимость в дополнительных животных в каждой группе для проведения всех необходимых гематологических анализов. В зависимости от цели исследования, можно увеличить статистическую значимость основных показателей, распределив неравномерно животных по концентрациям.
4.2.2 Резерв для промежуточных умерщвлений, вспомогательные группы и индикаторные животные
При исследовании можно сделать резерв для промежуточных умерщвлений, например, в шесть месяцев, для получения данных о развитии токсических изменений и данных о механизме воздействия, если это научно обосновано. Также можно задействовать вспомогательные группы для отслеживания обратимости любых токсических изменений, вызванных химическими веществами при исследовании. Как правило, их распределяют на группу с самым высоким уровнем концентрации и контрольную группу. Если запланировано промежуточное умерщвление, количество животных, включенных в план исследования, должно быть увеличено на число животных, которых планируется умертвить до завершения исследования. Этим животным следует провести такое же обследование (включая массу тела, потребление воды и пищи, гематологические и клинические биохимические показатели, выявление патологий), как и животным в стадии хронической токсичности основного исследования. Можно также сделать резерв (в группах промежуточного умерщвления) для измерений, ограниченных особыми, ключевыми показателями, такими как нейротоксичность или иммунотоксичность.
4.2.3 Концентрация
Следует использовать как минимум три уровня концентрации и параллельный контроль, за исключением тех случаев, когда проводится исследование с максимально возможной концентрацией. Чаще всего при выборе уровней концентрации основываются на результатах краткосрочных исследований повторной концентрации или исследованиях по обнаружению диапазона концентраций. Необходимо принимать во внимание любые существующие токсикологические и токсикокинетические данные по тестируемому или родственным ему веществам.
Если нет ограничений по физико-химической природе или биологическому воздействию исследуемого вещества, должна быть выбрана самая высокая концентрация для определения основных органов-мишеней и токсичных эффектов воздействия. Однако следует избегать страданий, тяжелой токсичности, болей или смерти. Самый высокий уровень концентрации следует выбрать для получения признаков интоксикации, как, например, о токсичности свидетельствуют изменения уровня сывороточного фермента или невозможность набрать массу (примерно 10 %).
Однако в зависимости от целей исследования может быть выбрана наивысшая концентрация ниже, чем концентрация, подтверждающая наличие токсичности, например, если концентрация вызывает побочное действие, которое, тем не менее, слабо отражается на продолжительности жизни или массе тела.
Разница между концентрациями должна быть направлена на определение зависимости «концентрация-ответ» и установление наивысшего уровня концентрации, при которой не наблюдается вредный эффект воздействия (NOAEL) или других предполагаемых результатов исследования, например, ВМС при самом низком уровне концентрации. Условия, которые должны быть приняты во внимание при установлении нижних концентраций, включают: предполагаемый наклон кривой зависимости «концентрация-ответ», концентрации, при которых могут происходить важные изменения в метаболизме или вид токсического действия, когда предполагается пороговая величина, или когда предполагается исходная точка для экстраполяции низкой концентрации.
Избранная разница в уровне концентрации зависит от параметров тестируемого вещества и не может быть прописана в этом стандарте. Но диапазон от двух до четырех зачастую оптимален для
3
установления снижения уровней концентрации, а при использовании очень больших интервалов (например, диапазон примерно от шести до десяти) между концентрациями предпочтительно добавление четвертой тестируемой группы. При выборе концентрации и разницы в уровнях концентраций следует использовать [2], но в целом следует избегать использования диапазона выше 10, а его применение должно быть обосновано.
При выборе концентрации для проведения исследований хронической токсичности и канцерогенности необходимо учесть:
-знания или предположения о нелинейностях или точках изгиба в зависимости «концентрация-ответ»;
-фармакокинетику и концентрацию, когда метаболическая индукция, насыщение или нелинейность между внешними и внутренними концентрациями происходят или не происходят;
-признаки поражения, влияния или показатели воздействия на основные биологические процессы;
-основные (или предполагаемые) проявления механизма действия, как то концентрация, при введении которых начинает увеличиваться цитотоксичность, нарушается гормональный уровень, подавляется гомеостатический механизм и т.д.;
-интервалы кривой «концентрация-эффект», где необходима чрезвычайно надежная оценка, например, в пределах ожидаемых ВМС или предполагаемых пороговых величин;
-уровни анализа предполагаемого воздействия на организм человека.
Контрольная группа не должна получать исследуемое вещество. С животными из контрольной группы следует обращаться также, как и с тестируемыми группами. Если используется среда, контрольная группа должна получать ее в максимальном объеме от используемого в группах.
4.3 Введение исследуемого вещества
Исследуемое вещество вводится ингаляционно. Способ и метод введения зависят от цели исследования, физическо-химических свойств вещества, его биологической усвояемости и основного способа и метода введения в организм человека. Целесообразность способа и метода введения должна быть обоснована.
При ингаляционном введении животные получают концентрацию исследуемого вещества ежедневно (семь дней в неделю), как правило, в течение одного года. Любой другой режим концентрации, например, пять дней в неделю, должен быть обоснован.
4.4 Продолжительность исследования
Несмотря на то, что этот данный стандарт рассчитан на двенадцати месячное исследование хронической токсичности, план исследования допускает, что может быть применен, как более короткий (например, шесть или девять месяцев), так и более длинный (например, 18 или 24 месяца) период исследований, в зависимости от целей и задач эксперимента. Отклонения от продолжительности воздействия в 12 месяцев должны быть обоснованы, особенно в случае сокращения сроков. Вспомогательные группы, включенные для наблюдения за обратимостью любых токсических изменений, вызванных химическим веществом, следует держать без концентраций не менее четырех недель, но не более одной трети от общего периода исследования после прекращения воздействия.
4.5 Наблюдения
Все животные должны исследоваться на предмет болезненности или смерти и на наличие особых токсикологических значимых признаков, в частности нейрофункциональных и нейроповеденческих, обычно в начале и в конце каждого дня. Дополнительно, животные должны проверяться, как минимум один раз в выходные и праздничные дни. Общее клиническое наблюдение должно осуществляться, как минимум один раз в день, предпочтительно в одно и то же время, принимая во внимание период максимума предполагаемого воздействия концентрации. Клиническое состояние животных следует фиксировать.
Подробное клиническое наблюдение должно быть проведено, как минимум один раз до начала воздействия (учитывая предмет исследования), к концу первой недели исследования и впоследствии ежемесячно. Протокол наблюдений должен быть согласован так, чтобы обеспечить минимальную разницу между отдельными наблюдателями, и независимость от тестовой группы. Эти обследования необходимо делать вне клетки, каждый раз в одном месте, в одно и то же время. Их следует тщательно фиксировать, желательно используя систему количественных показателей, четко оговоренную испытательной лабораторией. Необходимо следить за тем, чтобы варьирование в условиях наблюдения было минимальным. Отмеченные признаки должны включать, не только, изменения кожи, шерсти, глаз, слизистых оболочек, возникновение секреции и экскреции и автономной активности (например, слезоотделение, пилоэрекция, размер зрачка, аномальный способ дыхания). Изменения в походке, положении тела, реакции на прикосновение, как и наличие клонических или тонических движений, стереотипах (например, чрезмерное умывание, однообразные
ГОСТ 32383-2013
движения по кругу) или аномалиях поведения (например, членовредительство, хождение задом наперед) также должны регистрироваться.
Офтальмологический осмотр с использованием офтальмоскопа или другого подходящего инструмента следует проводить всем животным до первого введения исследуемого вещества. По окончании исследования этот осмотр желательно провести всем животным, но, как минимум, группе с высокой концентрацией и контрольной группе. Если обнаружены изменения, имеющие отношение к терапии, следует осмотреть всех животных. Если структурный анализ или другие данные говорят об офтальмологической токсичности, тогда частота офтальмологических осмотров должна быть увеличена.
Для химических веществ, для которых предварительные исследования на токсичность с повторным приемом концентрации в течение 28 и/или 90 дней показали потенциальную возможность оказывать нейротоксическое воздействие, сенсорную химическую активность к раздражителям различного типа (например, слуховые, визуальные и проприоцептивные раздражители) оценку силы захвата и двигательной активности можно проводить, по выбору, до начала исследования и затем в три, шесть, девять и двенадцать месяцев. Однако можно использовать и другие, не приведенные в списке процедуры.
Для химических веществ, где предварительные исследования на токсичность с повторным приемом концентрации через 28 и/или 90 дней показали потенциальную возможность оказывать иммунотоксическое воздействие, дальнейшие исследования этого результата могут по желанию проводиться до 12 месяцев.
4.5.1 Масса тела, потребление пищи/воды и питательность пищи
Все животные должны взвешиваться в начале исследования, как минимум, раз в неделю первые 13 недель и, как минимум, ежемесячно в дальнейшем. Измерения потребления пищи и питательности пищи следует производить еженедельно первые 13 недель и, как минимум, ежемесячно в дальнейшем. Необходимо также учитывать потребление воды для исследований, в которых активность потребления воды изменяется. Измерения потребления воды следует проводить еженедельно первые 13 недель и, как минимум, ежемесячно в дальнейшем, когда вещество вводится через питьевую воду.
4.5.2 Гематология и клиническая биохимия
В исследованиях, в которых используются грызуны, гематологические исследования необходимо проводить, как минимум, на 10 самцах и 10 самках каждой группы в три, шесть и двенадцать месяцев, всегда используя одних и тех же животных. В случае с мышами могут потребоваться вспомогательные животные с тем, чтобы проводить все необходимые гематологические исследования. В исследованиях с негрызунами пробы берутся у меньшего количества животных (например, четыре особи каждого пола каждой группы в случае с исследованием собак). Нет необходимости проводить измерения в три месяца, если за предыдущие 90 дней при аналогичном уровне концентрации не наблюдалось воздействия на гематологические параметры. Образцы должны быть собраны к концу запланированного периода исследования, в период исследования к трем и шести месяцам, и к 12 месяцу непосредственно перед или во время процедуры умерщвления животных. Пробы крови следует брать из указанных мест, например, сердечная пункция или из ретро-глазной пазухи и, по возможности, хранить в подходящих условиях. Необходимо исследовать приведенный список параметров: общая и лейкоцитарная формула, содержание эритроцитов, содержание тромбоцитов, концентрация гемоглобина, гематокрит (гематокритное число), среднее гематокритное число (MCV), среднее содержание гемоглобина в эритроцитах (МСН), концентрация гемоглобина в эритроцитах (МСНС), протромбиновое время и время образования и активности тромбопластина. Кроме того, необходимо исследовать тельца Гейнца или другую атипичную морфологию эритроцитов и метгемоглобин, если присутствуют любые признаки анемии или других нарушений кроветворения. Если химические вещества оказывают влияние на кроветворительную систему, можно также измерить число ретикулярных клеток и цитологию костного мозга, хотя они не обязательны для регулярного проведения.
Клинические биохимические показатели при исследовании токсического воздействия на ткани и особенно влияние на почки и печень следует определять в пробах крови, полученных от, как минимум, 10 самцов и 10 самок каждой группы за одинаковые временные интервалы, как предписано для гематологических исследований, всегда используя одних и тех же животных. Для мышей могут потребоваться вспомогательные животные с тем, чтобы проводить все необходимые клинические биохимические исследования. Нет необходимости проводить измерения в три месяца, если за предыдущие 90 дней при аналогичном уровне концентрации не наблюдалось воздействия на клинические биохимические параметры. Рекомендуется голодание для животных (за исключением мышей) вечером, накануне забора крови. Необходимо исследовать приведенный список параметров: глюкоза, моча (азот мочевины), креатинин, общий белок, альбумин, кальций, натрий, калий, общий