МУ 3214-85
Методические указания по серотипированию бактерий Escherichia coli по жгутиковому (H) антигену упрощенным, ускоренным способом
Купить МУ 3214-85 — бумажный документ с голограммой и синими печатями. подробнее
Цена на этот документ пока неизвестна. Нажмите кнопку "Купить" и сделайте заказ, и мы пришлем вам цену.
Распространяем нормативную документацию с 1999 года. Пробиваем чеки, платим налоги, принимаем к оплате все законные формы платежей без дополнительных процентов. Наши клиенты защищены Законом. ООО "ЦНТИ Нормоконтроль"
Наши цены ниже, чем в других местах, потому что мы работаем напрямую с поставщиками документов.
Способы доставки
- Срочная курьерская доставка (1-3 дня)
- Курьерская доставка (7 дней)
- Самовывоз из московского офиса
- Почта РФ
Данные методические указания предназначены для бактериологических лабораторий санитарно-эпидемиологических станций всех категорий
Оглавление
1. Введение
2. Реактивы, сыворотки, приборы, оборудование
3. Обоснование целесообразности исследования и принцип метода
4. Методика анализа и ход исследования
4.1. Техника посева бактерий на полужидкие среды и пересевы с них
4.2. Ход исследования
5. Интерпретация результатов и выдача ответа
6. Приложение
6.1. Пробирки Крейджи
6.2. Полужидкий питательный агар
6.3. Плотная питательная среда
6.4. Диагностические сыворотки
| Дата введения | 01.01.2021 |
|---|---|
| Добавлен в базу | 01.01.2019 |
| Актуализация | 01.01.2021 |
Этот документ находится в:
Организации:
| 21.02.1984 | Утвержден | Минздрав СССР | 3214-85 |
|---|---|---|---|
| Разработан | Московская областная СЭС | ||
| Разработан | Центральный научно-исследовательский институт вакцин и сывороток имени И.И. Мечникова |
ГОСТ 10958-78Стекла защитные для приборов общепромышленного применения. Технические условия. Заменен на ГОСТ 10958-2018.- ГОСТ 6259-75 Реактивы. Глицерин. Технические условия
- ГОСТ 20292-74 Приборы мерные лабораторные стеклянные. Бюретки, пипетки. Технические условия
- ГОСТ 10515-75 Пробирки стеклянные. Технические условия
Чтобы бесплатно скачать этот документ в формате PDF, поддержите наш сайт и нажмите кнопку:

стр. 1

стр. 2

стр. 3

стр. 4

стр. 5
стр. 6
стр. 7

стр. 8

стр. 9

стр. 10

стр. 11

стр. 12

стр. 13

стр. 14

стр. 15
1985
МЕТОДИЧЕСКИЕ УКАЗАНИЯ ПО СЕРОТИПИРОВАНИЮ БАКТЕРИЙ ESCHERICHIA COLI ПО ЖГУТИКОВОМУ (Н) АНТИГЕНУ УПРОЩЕННЫМ, УСКОРЕННЫМ СПОСОБОМ
Москва
Разработаны: Центральным научно-исследовательским
институтом вакцин и сывороток имени И. И. Мечникова (Ю. А. Ратинер)
Московской областной санитарно-эпидемиологической станцией (А. А. Ершов)
Методические указания рассмотрены Лабораторным советом при Главном санитарно-эпидемиологическом управлении Министерства здравоохранения СССР и рекомендованы к утверждению.
2
чтобы получить бактериальную взвесь плотностью около 20— 40 млрд, клеток в мл. Для этого в пробирку с агаровой культурой наливают суспендирующий раствор примерно до 72— 3А (если выращивание проводили при 37° С) или до 7з (если культуру выращивали при 30" С) высоты выросшего газона бактерий, укладывают пробирку на 3—5 мин. в наклонном положении, чтобы смочить весь газон и тем самым облегчить смывание бактерий.
Подготовленную таким образом бактериальную взвесь исследуют в реакции агглютинации на стекле с Н-сыворот-ками (см. приложение, п. 6.4), сначала с поливалентными, а затем с моновалентными, соответствующими той поливалентной, с которой был получен положительный результат. Для этого на предметное стекло наносят капли сывороток (на одно предметное стекло можно нанести до трех капель) в объеме около 0,05 мл (это примерно соответствует объему капли, свободно падающей из конца пастеровской пипетки). В каждую каплю вносят примерно такой же объем исследуемой бактериальной взвеси п перемешивают стеклянной палочкой, распределяя жидкость на участке стекла диаметром 1,2—1,5 см. Результат учитывают через 0,5—2 мин. над вогнутым зеркалом (от микроскопа), просматривая в нем увеличенное изображение капли и слегка, очень медленно покачивая стекло так, чтобы жидкость в капле медленно переливалась от одного ее края к противоположному и наоборот.
5. Интерпретация результатов и выдача ответа
Реакция агглютинации считается положительной при формировании хорошо различимого агглютината только в присутствии одной сыворотки из использованных поливалентных или моновалентных (капли, содержащие остальные сыворотки, выполняют в данном случае роль контроля). Некоторые штаммы, выращенные на агаре с глицерином, могут давать очень слабую ложноположительную реакцию агглютинации, которая однако не препятствует регистрации положительного результата, если он четко проявился с одной из использованных сывороток. Н-антиген исследуемого штамма соответствует наименованию моновалентной сыворотки, с которой получен положительный результат.
Полиагглютинабельные штаммы среди свежевыделенных встречаются крайне редко. Их Н-антпген можно определить посредством реакции иммобилизации в полужидком агаре пли после дополнительного пассирования в пробирках Крейд-жи при повторном типированци на стекле.
11
Отсутствие положительных реакций агглютинации со
всеми имеющимися в наличии сыворотками может быть обусловлено тем, что Н-антиген штамма не соответствует ни одной из использованных сывороток, или недостаточной флагеллированностью культуры, особенно в случае энтеро-инвазивных разновидностей эшерихий. Способность бактерий агглютинироваться Н-сывороткой можег быть увеличена дополнительным пассажем в пробирке Крейджи.
Идентификацией Н-антигена заканчивается анализ эше-рихий, подозреваемых в качестве возбудителя заболевания, и выдается окончательный ответ, в котором указывают полную антигенную формулу штамма, включая Н-антиген (например, 055:К59(В5) :Н6). Если у подвижного штамма Н-антиген не идентифицирован, его обозначают с вопросительным знаком (например, 026:К60(В6) : Н?), в антигенной формуле неподвижных штаммов Н-антиген обозначают со знаком «минус» (020 : К84 : Н~). В тех случаях, когда закончена идентификация соматических антигенов, а идентификация Н-антигена задерживается не менее чем до следующего дня, выдают предварительный ответ, в котором указывают только серогруппу (т. е. соматические антигены) выделенной разновидности бактерий, а после определения Н-антпгена — окончательный ответ с полной антигенной формулой.
6. ПРИЛОЖЕНИЕ
6.1. Пробирки Крейджи
Пробирки Крейджи предназначены для пассирования подвижных бактерий через полужидкий агар с цепью селекции наиболее подвижных вариантов и монтируются следующим образом. В бактериологическую пробирку, содержащую примерно 7 мл полужидкого агара, опускают открытую с обоих концов стеклянную трубку с внутренним диаметром около 4—7 мм и такой длиной, чтобы, опустившись на дно пробирки, она выступала над поверхностью среды примерно на 2 см (трубки можно нарезать из пастеровских пипеток). Пробирку закрывают ватно-марлевой пробкой и стерилизуют автоклавированием в режиме, принятом для стерилизации питательных сред. Для контроля стерильности их выдерживают в термостате при 30—37° С двое суток. До использования пробирки Крейджи можно сохранять в вертикальном положении в завязанном целлофановом пакете или в коробке с плотно закрывающейся крышкой (для уменьшения скорости усыхания среды) при комнатной температуре
12
или в холодильнике (при температуре не ниже + 1°С) до 1,5—2 месяцев, если не появятся признаки заметного усыхания верхнего слоя среды.
6.2. Полужидкий питательный агар
Полужидкий питательный агар с 0,3% содержанием агар-агара используют для селекции подвижных клеток исследуемого штамма при подготовке культуры для определения Н-антигена. Указанную концентрацию агар-агара нельзя превышать, т. к. незначительное увеличение плотности среды приводит к значительному удлинению времени миграции бактерий через полужидкий агар в пробирках Крейджи, а уменьшение концентрации ниже 0,25% не обеспечивает необходимую эффективность селекции. Среду лучше готовить на основе бульона Хоттингера (бульона Хоттннгера — 1 л, агара-агара — 3 г, хлористого натрия — 4 г), но можно применять бульон, приготовленный на любой другой питательной основе, обеспечивающей хороший рост эшерихий. Среду используют в обычных бактериологических пробирках или пробирках Крейджи. Застывшую в пробирках среду нельзя встряхивать, т. е. нарушать ее целостность, т. к. образующиеся в ней невидимые трещины заполняются жидкостью, что исключает возможность эффективной селекции наиболее подвижных вариантов бактерий.
6.3. Плотная питательная среда
Среду готовят из сухого питательного агара на рыбном гидролизате, используя дозировку 5 г сухого порошка на 100 мл дистиллированной воды. Добавляют 2—5% глицерина (2—5 мл на 100 мл среды), размешивают, прогревают при 100° С до полного расплавления порошка, разливают в чистые бактериологические пробирки по 4—5 мл и стерилизуют автоклавированием 20 минут при 121° С. Пробирки со стерильной расплавленной средой оставляют под углом для образования скошенной поверхности среды после ее застывания или в вертикальном положении. Не использованные пробирки со скошенной средой сохраняют до 7 дней, а среду, застывшую столбиком — до 4 недель при +4 — + 10° С. Среду, застывшую столбиком, перед использованием растапливают на водяной бане и скашивают. При необходимости можно стерильный глицерин (121° С, 20 мин.) добавлять в стерильную, не содержащую глицерина среду в выше указанной пропорции. Помимо агара на основе рыбного гидролизата можно использовать среду, состоящую из
13
25 г сухого кислотного гидролизата казеина, 20 г сухого дрожжевого экстракта и 15 г агар-агара на 1 литр дистиллированной воды с добавкой 2—5% глицерина.
При отсутствии глицерина можно применять 1,2—1,5% агар Хоттингера с добавкой 0,2—-0,4% глюкозы. Можно использовать выпускаемый в ампулах для внутривенного введения 40% раствор глюкозы (0,5—1 мл на 100 мл среды). Глюкозу добавляют к расплавленной стерильной среде, перемешивают, разливают в бактериологические пробирки по 4—5 мл. Пробирки оставляют для затвердения среды под таким углом, чтобы скошенная поверхность среды доходила до дна пробирки.
6.4. Диагностические сыворотки
Агаровые культуры в реакции агглютинации на стекле способны реагировать не только с Н-, но и с О- пли К-анти-телами. Поэтому сыворотки, применяемые для определения Н-антигена, не должны содержать антител к соматическим антигенам исследуемых штаммов. Этому условию отвечают выпускаемые в нашей стране (предприятие Центрального НИИ вакцин и сывороток им. И. И. Мечникова) в высушенном виде диагностические эшерихиозные Н-сыворотки, предназначаемые для идентификации Н-антнгена у энтеропато-генных разновидностей эшерихий методом иммобилизации в полужидком агаре, которые при изготовлении специально контролируются на отсутствие антител к соматическим антигенам эшерихий соответствующих О- (ОК) -групп. Эти препараты позволяют определять 15 наиболее часто встречающихся Н-антигенов и состоят из 4-х поливалентных смесей: НА (Н2, Н6, Н11), НВ (Н12, НЗО, Н32), НС (Н4, Н9, НЮ, Н21, Н34) и НД (Н7, Н19, Н25, Н«635»), —и 15-ти соответствующих моновалентных сывороток.
Сухую сыворотку, содержащуюся в ампуле, растворяют в изотоническом растворе хлористого натрия (рН = 6,8— 7,2), взятом в Уз объема, указанного на этикетке для полужидкого агара. Растворенные сыворотки сохраняют свою
специфическую активность при температуре Р4--рЮ°С до
1,5 месяца.
14
Л 70436 от 17.04.85 г. Зак. 578 Тир. 500
Типография Министерства здравоохранения СССР
утверждаю
Начальник Главного санитарно-эпидемиологического управления Министерства здравоохранения СССР
В. Е. Ковшило 21 февраля 1984 г.
№ 3214—85
МЕТОДИЧЕСКИЕ УКАЗАНИЯ
по серотипированию бактерий Escherichia coll по жгутиковому (Н) антигену упрощенным, ускоренным
способом
1. Введение
В большинстве практических бактериологических лабораторий идентификацию штаммов Е. coli (эшерихий), подозреваемых в качестве возбудителей инфекционных заболеваний, ограничивают определением у них только соматических О-и К-антигенов, т. е. установлением принадлежности их к той или иной О- или OK-группе. Такой уровень серотипиро-ванпя является недостаточным, т. к. каждая О- (01\)-группа включает большое число ссроваров (серотипов), различающихся по жгутиковому (Н) антигену, этиологическая и эпидемиологическая значимость которых неодинакова. Поэтому идентификация выделяемых штаммов только по О- или OK-антигенам без определения Н-антигена делает невозможным проведение достоверного, полноценного эпидемиологического анализа, необходимого для планирования и осуществления рациональных и эффективных профилактических и противоэпидемических мероприятий, а также ограничивает возможности эпидемиологического прогнозирования.
Внедрению серотипироваиия эшерихий по Н-антигену в широкую бактериологическую практику, как в нашей стране, так и за рубежом препятствовала трудоемкость и сложность существующих методов выполнения этого анализа. В специализированных лабораториях научных и в бактериологических лабораториях наиболее крупных практических учреждений, где выполняется такое исследование, наиболее широкое применение получили два метода: классический метод пробирочной реакции агглютинации и метод иммобилизации в полужидком агаре. Первый из них сопряжен с необходимостью многократного пассирования исследуемых штаммов и потому длителен во времени — занимает до недели и более, а
3
важнейшим недостатком второго является большой расход диагностических препаратов и трудоемкость приготовления в стерильных условиях полужидкого агара с сыворотками п розлива его в большое количество пробирок.
Рекомендуемый способ серотипирования эшерихий по Н-антигену посредством реакции агглютинации на стекле, основанный на феномене фенотипического повышения флагеллн-рованности (flagella — жгутики) бактериальных культур является простым, легко доступным для выполнения в бактериологических лабораториях любой категории, обеспечивает, по сравнению с классическим, значительное сокращение срока получения результата, а но сравнению с методом иммобилизации в полужидком агаре—10—15-ти кратную экономию диагностических сывороток.
Данные методические указания предназначены для бактериологических лабораторий санитарно-эпидемиологических станций всех категорий.
2. Реактивы, сыворотки, приборы, оборудование
и
е
Наименование
ГОСТ, ТУ, фармакопейная
£
£
статья или предприятие-
изготовитель
1. Диагностические сыворотки для
определения Н-антигена у энте-ропатогенных разновидностей
эшерихий методом иммобилизации в полужидком агаре.
2. Глицерин
3. Натрий хлористый
4. Формалин
5. Спирт этиловый
6. Питательный агар сухой (на рыбном гидролизате)
7. Гидролизат рыбный концентрированный (паста)
8. Агар белый вымороженный
9. Вогнутое зеркало от микроскопа
10. Термостат
ТУ 42.14.147—79. Предприятие Центрального НИИ вакцин и сывороток им. И. И. Мечникова
ФС 42 698—73 ГОСТ 6259-75 ГОСТ 4233-66 ГФК ст. 619 ГФК ст. 18
Дагестанский НИИ питательных сред
ГОСТ 15280-70 Любой марки
Любой марки, поддерживающий заданную температуру в интервале 30°—37° С
ГОСТ 20292-74 ТУ 64-2-240—79 ГОСТ 10515-75 ГОСТ 10-958-78 ТУ 64-2-235—78
11. Пипетки градуированные на 10, 5, 1 мл
12. Пипетки пастеровские
13. Пробирки
14. Предметные стекла
15. Стеклянные палочки
|
и е |
Наименование |
ГОСТ, ТУ, фармакопейная |
|
£ £ |
статья или предприятие- | |
|
изготовитель |
1. Диагностические сыворотки для
определения Н-антигена у энте-ропатогенных разновидностей
эшерихий методом иммобилизации в полужидком агаре.
2. Глицерин
3. Натрий хлористый
4. Формалин
5. Спирт этиловый
6. Питательный агар сухой (на рыбном гидролизате)
7. Гидролизат рыбный концентрированный (паста)
8. Агар белый вымороженный
9. Вогнутое зеркало от микроскопа
10. Термостат
ТУ 42.14.147—79. Предприятие Центрального НИИ вакцин и сывороток им. И. И. Мечникова
ФС 42 698—73 ГОСТ 6259-75 ГОСТ 4233-66 ГФК ст. 619 ГФК ст. 18
Дагестанский НИИ питательных сред
ГОСТ 15280-70 Любой марки
Любой марки, поддерживающий заданную температуру в интервале 30°—37° С
ГОСТ 20292-74 ТУ 64-2-240—79 ГОСТ 10515-75 ГОСТ 10-958-78 ТУ 64-2-235—78
11. Пипетки градуированные на 10, 5, 1 мл
12. Пипетки пастеровские
13. Пробирки
14. Предметные стекла
15. Стеклянные палочки
* Ратинер Ю. А. Аавторское свидетельство № 712440, Б. И. № 4, 1980; Ратинер Ю, А. Авторское свидетельство № 578339, Б, И,, № 40, 1977.
4
3. Обоснование целесообразности исследования и принцип метода
3.1. Важнейшим критерием дифференциации патогенных разновидностей эшерихий от непатогенных служат антигенные свойства их поверхностных структур (О и Кюоматиче-ские антигены клетки, И-жгутиковый антиген). Факторы патогенности и вирулентности многих патогенных эшерихий до сих пор не выяснены, но даже в тех случаях, когда они известны, например, у энтеротоксигенных штаммов, антигены поверхностных бактериальных структур служат наиболее удобным критерием для первичного отбора этих возбудителей. При этом установление только О- или 01\-группы (например, 0151, 0111 : К58 (В4) и т. д.) является недостаточным, поскольку, как отмечалось выше, разные серовары одной и той же О- (ОК)-группы (например, 0111 : К58(В4) : Н2, 0111: К58 (В4) : Н4, 0111: К58 (В4) : Н12 и т. д.) представляют собой самостоятельные разновидности организмов, нс одинаковые по их этиологической и эпидемиологической значимости. Поэтому ограничение бактериологического исследования эшерихий только установлением О- (ОК)-группы столь же малоинформативно и столь же малополезно, для решения эпидемиологических задач, как если бы, например, при сальмонеллезах идентификация сальмонелл заканчивалась не установлением конкретных сероваров (S. typhi, S. paratyphi A, S. typhimurium и т. д.), а только указанием их О-групп (А, В, С и т. д.). Известным примером неравнозначности в этиологическом и эпидемиологическом отношении разных сероваров являются эшерихии группы 0111. Серовар 0111 :К58(В4) : Н2 вызывает у детей раннего возраста чаще тяжелые формы колиэнтерита и характеризуется высокой склонностью к эпидемическому распространению, а эшерихии 0111 : К58 (В4) : Н12 обнаруживаются преимущественно при спорадических случаях, причем чаще на фоне елабовыраженной симптоматики заболевания.
Вопрос о патогенности и эпидемиологической значимости эшерихий других сероваров, входящих в группу 0111, остается до сих пор открытым. Аналогичные примеры можно привести и в отношении эшерихий других О- (ОК)-групп.
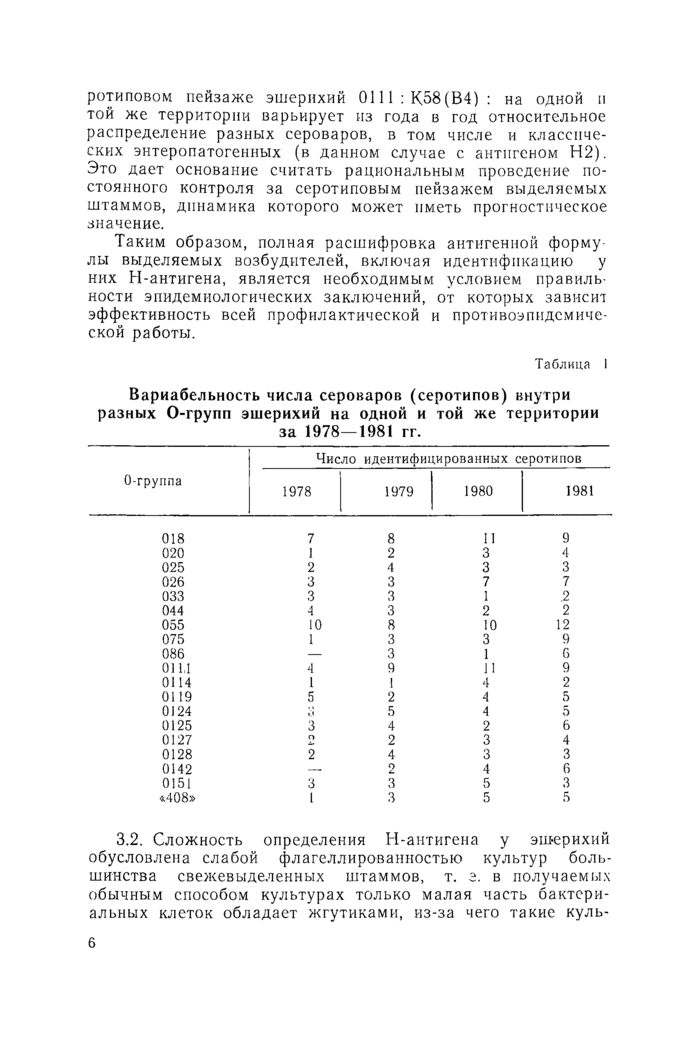
На одной и той же территории могут одновременно циркулировать несколько сероваров эшерихий одной и той же О- (ОК)-группы. Это иллюстрирует таблица 1. Поэтому совершенно очевидно значение Н-серотипирования для объективно обоснованного установления взаимосвязей (или доказательства их отсутствия) между случаями заболеваний. В таблице 2 в качестве примера представлены данные о се-
5
ротиповом пейзаже эшерихий 0111 : К58 (В4) : на одной и той же территории варьирует из года в год относительное распределение разных сероваров, в том числе и классических энтеропатогенных (в данном случае с антигеном Н2). Это дает основание считать рациональным проведение постоянного контроля за серотиповым пейзажем выделяемых штаммов, динамика которого может иметь прогностическое значение.
Таким образом, полная расшифровка антигенной формулы выделяемых возбудителей, включая идентификацию у них Н-антигена, является необходимым условием правильности эпидемиологических заключений, от которых зависит эффективность всей профилактической и противоэпидемической работы.
Вариабельность числа сероваров (серотипов) внутри разных О-групп эшерихий на одной и той же территории
за 1978—1981 гг.
|
Таблица 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
3.2. Сложность определения И-антигена у эшерихий обусловлена слабой флагеллированностью культур большинства свежевыделенных штаммов, т. г. в получаемых обычным способом культурах только малая часть бактериальных клеток обладает жгутиками, из-за чего такие куль-
туры плохо агглютинируются или вовсе не агглютинируются Н-сыворотками. Поэтому при классическом, наиболее широко распространенном методе определения Н-антигена штаммы предварительно подвергают многократному последовательному пассированию (обычно не менее четырехкратного) через полужидкий агар в V-образных пробирках или пробирках Крейджи. При этом происходит селекция наиболее подвижных вариантов и в конечном итоге удается получить популяцию, культура которой (обычно бульонная) характеризуется высокой степенью флагеллированности. С этим связана длительность процесса исследования. Из-за относительно небольшой густоты бульонных культур их исследуют классическим методом при помощи пробирочной реакции агглютинации.
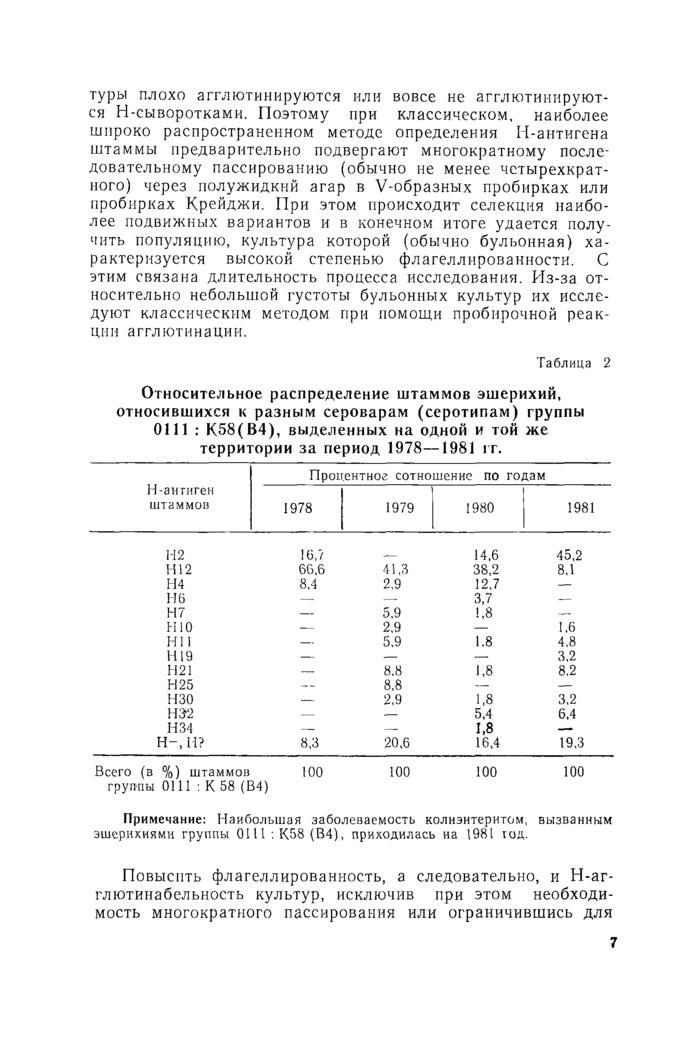
Таблица 2
Относительное распределение штаммов эшерихий, относившихся к разным сероварам (серотипам) группы 0111 : К58(В4), выделенных на одной и той же территории за период 1978—1981 гг.
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Всего (в %) штаммов 100 100 100 100 группы 0111 : К 58 (В4) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Примечание: Наибольшая заболеваемость колиэнтеритом, вызванным эшерихиями группы 0111 : К58 (В4), приходилась на 1981 год.
Повысить флагеллированность, а следовательно, и Н-аг-глютинабельность культур, исключив при этом необходимость многократного пассирования или ограничившись для
7
подавляющего большинства случаев только одним пассажем, поедставляется возможным путем добавления к полноценной богатой среде дополнительного источника энергии, например, глицерина или глюкозы. Это позволяет получать довольно хорошо флагеллированные культуры не только бульонные, но и агаровые. Из последних можно готовить густые суспензии бактерий, пригодные для исследования при помощи реакции агглютинации на стекле.
Следует иметь в виду, что длительное хранение штаммов в лабораторных условиях на питательных средах приводит к уменьшению подвижности и, следовательно, фла-геллированности. Поэтому при необходимости определения Н-антигена у таких штаммов рационально пропассировать их предварительно в пробирке Крейджи.
У неподвижных штаммов, за чрезвычайно редким исключением, жгутики отсутствуют (т. е. отсутствует Н-анти-ген). Серотипирование по Н-антигену таких штаммов возможно лишь в случае получения субкультур, восстановивших подвижность. Затруднительно определение Н-антигена у многих слабоподвижных штаммов (т. е. не образующих диффузного роста во всей среде при выращивании в 0,3% агаре в обычной бактериологической пробирке). Увеличить подвижность слабоподвпжных штаммов и восстановить подвижность у части неподвижных штаммов удается в результате нескольких последовательных пассажей на 0,3% агаре, в обычных бактериологических пробирках. Субкультуры штаммов, восстановившие и хорошо развившие подвижность, пассируют в пробирке Крейджи и типируют по Н-антигену в соответствии с методикой, описанной в п. 4.
4. МЕТОДИКА АНАЛИЗА И ХОД ИССЛЕДОВАНИЯ
4.1. Техника посева бактерий на полужидкие среды и пересевы с них
4.1.1. Пассирование в пробирках Крейджи. Пробирки Крейджи (см. приложение, п. 6.1) предназначены для пассирования подвижных бактерий через полужидкий агар (см. приложение, п. 6.2) с целью селекции наиболее подвижных вариантов. Исследуемую культуру засевают уколом петлей в среду, находящуюся внутри помещенной в пробирку трубки, и инкубируют при 37° С. Подвижные бактерии распространяются в среде, выходят у дна пробирки из трубки и по мере роста культуры поднимаются вверх снаружи от трубки, вызывая помутнение среды. Бактерии, выросшие на^ поверхности среды снаружи от трубки, берут для дальнейше-
8
го пересева. Посев в пробирку Крейджн необходимо прово-дить аккуратно. Касаться петлей края трубки нельзя, поскольку между выступающей над поверхностью среды частью трубки и стенкой пробирки, соприкасающейся с трубкой, обычно имеется капиллярное пространство, по которому находящаяся снаружи от трубки среда может подниматься до ее края. Попавшие на край трубки бактерии могут по этому капиллярному пространству, заполненному средой, спуститься снаружи от трубки вниз и дать в верхней части среды рост культуры, не прошедшей селекцию.
При первом пассаже штамма в пробирке Крейджи посев делают глубокий, почти до дна пробирки. При повторных пассажах, если возникает такая необходимость, посев делают на глубину примерно 10 мм.
4.1.2. Пассирование в обычной бактериологической пробирке. Возможны два варианта работы. При первом варианте желательно использовать пробирки с полужидким агаром, на поверхности которого отсутствует конденсат. Посев делают уколом петлей вдоль столбика среды примерно на 2/з его высоты поближе к стенке пробирки. Инкубируют при 37°С. При хорошей подвижности бактерий вся среда мутнеет. Для пересева культуры участок поверхностного слоя среды, наиболее удаленный от места укола, сдвигают прож-женой петлей к месту укола, вновь прожигают петлю и, остудив ее, захватывают бактерии у стенки пробирки из-под освобожденного от поверхностного слоя участка среды.
При втором варианте можно использовать среду с конденсатом на ее поверхности, либо без него. Посев производят так же, как и в первом варианте, но на глубину не более lU высоты столбика среды. В процессе инкубации (37° С) подвижные бактерии распространяются по среде, в т. ч. и вниз, вплоть до дна пробирки.
При необходимости (в случае слабой подвижности) повторного пассирования в полужидкой среде пересев делают петлей. Для пересева на плотную среду используют пастеровскую пипетку. Конец пипетки опускают в полужидкий агар до нижней границы роста подвижных бактерий, насасывают в пипетку немного среды с бактериями, поднимают ее над поверхностью среды, сливают 2—3 капли, а затем наносят очень маленькую каплю на поверхность плотной среды и растирают по ней петлей.
Второй вариант предпочтительнее первого, но по своей эффективности он уступает пассированию в пробирке Крейджи,
9
4.2. Ход исследования
Бактерии из колоний, намеченных для изучения, пересевают с засеянных исследуемым материалом чашек в пробирки с полужидкой средой параллельно с высевом на среды для ферментативной дифференциации. Полужидкая среда служит в данном случае, как для определения подвижности (одного из критериев родовой дифференциации бактерий), так и для селекции из подвижных штаммов наиболее подвижных вариантов. Отличить неподвижные штаммы от очень слабоподвижных проще на полужидком агаре в обычной бактериологической пробирке. Но после приобретения некоторого навыка это легко выполнимо и при использовании пробирки Крейджи, особенно если находящаяся в ней стеклянная трубка имеет больший внутренний диаметр. Поэтому, используя пробирку Крейджи, можно совместить определение подвижности с наиболее эффективной селекцией.
На следующий день после инкубации при 37° С регистрируют наличие подвижности и оценивают ее интенсивность (слабая подвижность — помутнение части питательной среды, хорошая подвижность — помутнение всей среды, в т. ч. снаружи от внутренней трубки в пробирке Крейджи. При слабой подвижности, выявленной на полужидком агаре в обычной пробирке, культуру пересевают снова на полужидкую среду (желательно в пробирку Крейджи), а если слабая подвижность выявлена в пробирке Крейджи, се инкубируют дополнительное время, пока бактерии не достигнут поверхности среды снаружи от внутренней трубки.
Подвижные штаммы типируют по Н-антигену после установления принадлежности их к роду эшерпхий и идентификации соматических антигенов. Для этого хорошо подвижные культуры пересевают из полужидкой среды на скошенный агар с глицерином (см. приложение, и. 6.3), так чтобы получить сплошной газон роста бактерий и инкубируют при 37° С (но не выше!) или при 30° С до следующего дня. Инкубация при 30° С более предпочтительна. Следует иметь в виду, что у термостатов некоторых конструкций со сплошным металлическим защитным кожухом контрольного термометра, закрывающим ртутный (или спиртовой) резервуар термометра, показания контрольного термометра могут быть на 1—0,5° С ниже истинной температуры внутри термостата.
На следующий день выросший газон бактерий смывают изотоническим раствором хлористого натрия (pH 6,8—7,2), содержащим 0,5—0,7% формалина (0,5—0,7 мл формалина на 100 мл изотонического раствора хлористого натрия) так,