ГОСТ 31582-2012
Электроды для электрокардиостимуляторов имплантируемые. Технические требования и методы испытаний
Купить ГОСТ 31582-2012 — бумажный документ с голограммой и синими печатями. подробнее
Распространяем нормативную документацию с 1999 года. Пробиваем чеки, платим налоги, принимаем к оплате все законные формы платежей без дополнительных процентов. Наши клиенты защищены Законом. ООО "ЦНТИ Нормоконтроль"
Наши цены ниже, чем в других местах, потому что мы работаем напрямую с поставщиками документов.
Способы доставки
- Срочная курьерская доставка (1-3 дня)
- Курьерская доставка (7 дней)
- Самовывоз из московского офиса
- Почта РФ
Применим к изделиям, предназначенным для использования совместно с электрокардиостимуляторами (ЭКС) в качестве имплантируемых электродов.
Оглавление
1 Область применения
2 Нормативные ссылки
3 Термины и определения
4 Технические требования
5 Методы испытаний
5.1 Общее
5.2 Измерение сопротивления электрода
5.3 Измерение импеданса электрода
5.4 Оценка тока утечки
5.5 Оценка механической прочности
5.6 Оценка долговечности
6 Комплектность, упаковка, маркировка, инструкция по применению
6.1 Комплектность
6.2 Упаковка
6.3 Маркировка
6.4 Инструкция по применению
| Дата введения | 01.01.2015 |
|---|---|
| Добавлен в базу | 01.10.2014 |
| Актуализация | 01.01.2021 |
Этот ГОСТ находится в:
- Раздел Экология
Организации:
| 24.05.2012 | Утвержден | Межгосударственный Совет по стандартизации, метрологии и сертификации | 41 |
|---|---|---|---|
| 01.11.2012 | Утвержден | Федеральное агентство по техническому регулированию и метрологии | 680-ст |
| Разработан | ФГУП ВНИИНМАШ | ||
| Издан | Стандартинформ | 2014 г. |
Implantable electrodes for cardiac pacemakers. Technical requirements and test methods
- ГОСТ 30324.0-95 Изделия медицинские электрические. Часть 1. Общие требования безопасности
- ГОСТ Р ИСО 5841-3-2010 Соединители IS-1 для имплантируемых электрокардиостимуляторов низкопрофильные. Технические требования и методы испытаний
- ГОСТ Р ИСО 11318-2010 Узлы соединительные DF-1 для имплантируемых дефибрилляторов. Технические требования и методы испытаний
ГОСТ Р ИСО 14630-2011Имплантаты хирургические неактивные. Общие требования. Заменен на ГОСТ Р ИСО 14630-2017.- ГОСТ ISO 10993-1-2011 Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 1. Оценка и исследования
- ГОСТ 31212-2003 Электрокардиостимуляторы имплантируемые. Общие технические требования и методы испытаний
- Показать все
Чтобы бесплатно скачать этот документ в формате PDF, поддержите наш сайт и нажмите кнопку:

стр. 1

стр. 2

стр. 3

стр. 4

стр. 5
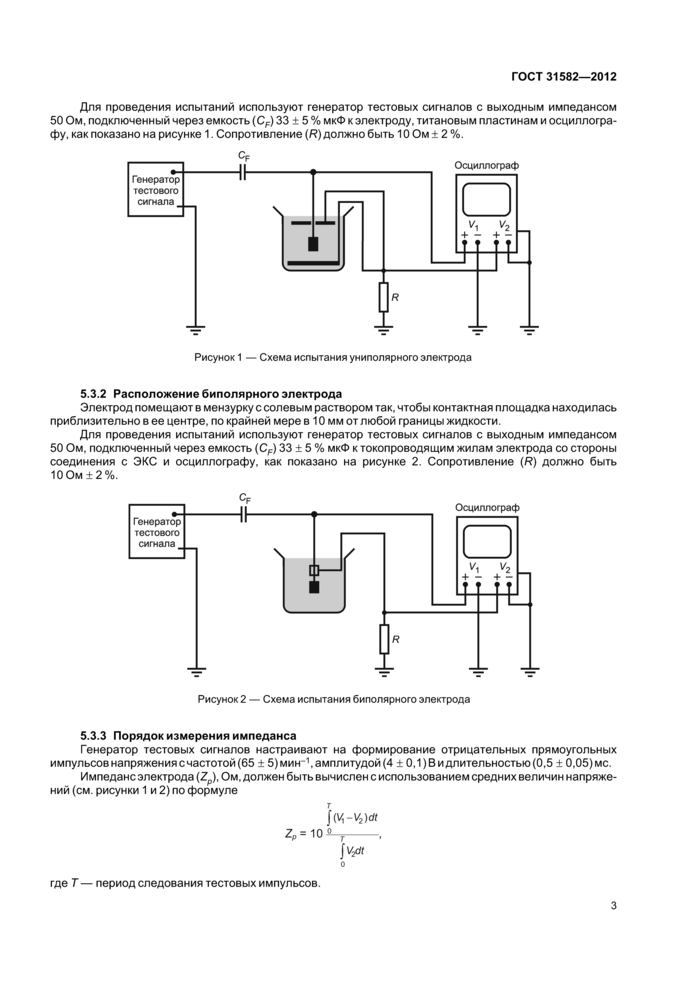
стр. 6

стр. 7

стр. 8

стр. 9

стр. 10

стр. 11
МЕЖГОСУДАРСТВЕННЫЙ СОВЕТ ПО СТАНДАРТИЗАЦИИ, МЕТРОЛОГИИ И СЕРТИФИКАЦИИ (МГС)
ГОСТ
31585—
2012
(ISO 16671:2003)
INTERSTATE COUNCIL FOR STANDARDIZATION, METROLOGY AND CERTIFICATION (ISC)
МЕЖГОСУДАРСТВЕННЫЙ
СТАНДАРТ
Имплантаты офтальмологические
РАСТВОРЫ ИРРИГАЦИОННЫЕ ДЛЯ ОФТАЛЬМОЛОГИЧЕСКОЙ ХИРУРГИИ
Общие требования безопасности
(ISO 16671:2003, MOD)
Издание официальное
Москва
Стандартинформ
2013
Предисловие
Цели, основные принципы и порядок проведения работ по межгосударственной стандартизации установлены ГОСТ 1.0-92 «Межгосударственная система стандартизации. Основные положения» и ГОСТ 1.2-2009 «Межгосударственная система стандартизации. Стандарты межгосударственные, правила и рекомендации по межгосударственной стандартизации. Правила разработки, принятия, применения, обновления и отмены».
Сведения о стандарте
1 ПОДГОТОВЛЕН Федеральным государственным унитарным предприятием «Всероссийский научно-исследовательский институт стандартизации и сертификации в машиностроении» (ВНИИНМАШ)
2 ВНЕСЕН Федеральным агентством по техническому регулированию и метрологии (Госстандарт)
3 ПРИНЯТ Межгосударственным советом по стандартизации, метрологии и сертификации (протокол № 41-2012 от 24 мая 2012 г.)
|
За принятие стандарта проголосовали: | |||||||||||||||||||||||||||
|
4 Приказом Федерального агентства по техническому регулированию и метрологии от 01 ноября 2012 г. № 650-ст межгосударственный стандарт ГОСТ 31585-2012 (ISO 16671:2003) введен в действие в качестве национального стандарта Российской Федерации с 1 января 2015 г.
5 Настоящий стандарт модифицирован по отношению к международному стандарту ISO 16671 : 2003 Ophthalmic implants - Irrigating solutions for ophthalmic surgery (Имплантаты офтальмологические. Ирригационные растворы для офтальмологической хирургии) путем изменения его структуры.
II
5.2.1.2 Для ОИР, содержащих материалы животного происхождения, должны быть применены анализ рисков и требования к менеджменту, приведенные в [3].
5.2.1.3 Для всех ОИР должны быть соблюдены требования, предъявляемые к оценке биологической безопасности по ГОСТ ISO 10993-1, ГОСТ ISO 10993-5, ГОСТ ISO 10993-10, и требования, изложенные в настоящем подразделе.
Примечания
1 При проведении оценки риска изготовитель должен учитывать взаимодействие с другими офтальмологическими имплантатами.
2 На основании типичного клинического применения ОИР классифицируются как «Имплантируемые изделия; ткань/кость». Испытания изделий данной и других категорий, представленные в таблице 1 ГОСТ ISO 10993-1, приведены только для руководства и не содержат максимальных или минимальных требований к испытаниям.
3 Допускается комбинировать испытания на биологическую совместимость, уменьшая число животных, необходимых для проведения испытания. Два испытания могут быть проведены одновременно на одном животном при условии, что испытуемое животное не подвергается чрезмерной боли или страданиям.
5.2.2 Требования к оценке на наличие бактериальных эндотоксинов
5.2.2.1 ОИР следует оценивать на наличие бактериальныхэндотоксинов с помощью LAL-теста (на культуре limulus amoebocyte lysate) в соответствии с методикой, описанной в [4], или эквивалентной аттестованной методикой испытания.
5.2.2.2 ОИР, имеющий предел бактериальных эндотоксинов более 0,5 единиц эндотоксинов (ЕЭ) на миллилитр, считают не прошедшим испытание.
5.2.3 Требования к испытанию на послеоперационную воспалительную реакцию глаза
5.2.3.1 Если анализ риска указывает на необходимость проведения испытания на послеоперационную воспалительную реакцию глаза, то такое испытание ОИР следует проводить на животном в соответствии с приложением Е.
Выбор особи животного должен быть обоснован и оформлен документально. Следует применять требования, предъявляемые к содержанию животных, указанные в [5].
5.2.3.2 Испытание на животном должно отражать предполагаемое клиническое испытание. В процессе испытания должна быть проведена оценка на
ГОСТ 31585-2012
воспалительную реакцию глаза как в процессе офтальмологической хирургической операции, так и после нее, используя при этом оцениваемый ОИР и контрольный ОИР. Контрольный ОИР должен иметь подтверждение клинического использования его в качестве не оказывающего воспалительного действия на глаз в течение пяти лет. Объем испытуемого ОИР должен имитировать предполагаемое использование с учетом внутриглазного объема глаза человека и животного. Если испытуемый ОИР вызывает большее раздражение глаза или воспаление, чем ОИР, используемый как контрольный, необходимо провести оценку соотношения риск/польза.
5.2.3.3 Послеоперационную воспалительную реакцию глаза необходимо контролировать и оценивать в соответствии с приложением Д.
На основании анализа риска и требований к менеджменту соответствующая оценка в соответствующие моменты времени может включать в себя измерение толщины роговицы и биомикроскопию с использованием щелевой лампы. Все серьезные неблагоприятные воздействия следует документировать.
5.2.3.4 Результаты испытания раздражения и воспаления испытуемого ОИР должны быть меньше или равными результатам испытания контрольного ОИР. В противном случае испытуемый ОИР должен быть подвергнут клинической оценке.
5.3 Требования к клинической оценке5.3.1 Общие требования
5.3.1.1 Клиническое испытание ОИР следует проводить по приложению Е. В дополнение к клиническому испытанию по приложению Е следует применять общие требования к клиническому испытанию субъектов по ГОСТ31580.7.
6 Требования к стерильности ОИР
6.1 Готовый ОИР должен быть стерильным. При стерилизации должны применяться требования к стерилизации неактивных хирургических имплантатов, указанные в ГОСТ ИСО 14630, и требования по ГОСТ 31214.
6.2 Для стерилизации ОИР, а также первичного контейнера емкости не следует применять этиле- ноксид, если его применение не обосновано.
6.3 К ОИР или его первичному контейнеру, при стерилизации которых используется этиленоксид и связанные с ним загрязнения, проникающие в ОИР, должны быть применены следующие ограничения:
9
- этиленоксид: менее 20мг/л;
этиленхлоргидрин: менее 100 мг/л.
Примечание — Установлено, что требования, определяющие приемлемые уровни остаточного этиленоксида (ЭО), указанные в ГОСТ ISO 10993-7, не подходят к изделиям, находящимся в контакте с высокочувствительными тканями, например, тканями глаза. Дополнительные указания по применению ГОСТ ISO 10993-7 приведены в [6].
6.4 Для ОИР, которые периодически не стерилизуются, но подвергаются асептической обработке, должны применяться требования по [7]. Предельное значение нормы загрязнения для ОИР должно составлять 1СГ3, что должно быть подтверждено документально.
Примечание — Технический информационный отчет [4] не содержит требований по предельному содержанию этиленхпоргидрина (ЭХГ). Предполагается, что в будущей редакции международного стандарта будет установлено предельное содержание ЭХГ для интраокулярных изделий, содержащих хлорид, в четыре раза выше содержания ЭО. Это следует учитывать при оценке биологической безопасности ОИР и для соответствия будущей редакции стандарта.
6.5 К ОИР, которые не стерилизуют, но подвергают асептической обработке, должны быть применены требования [7]. Соответствие данному международному стандарту должно быть подтверждено аттестованным исследованием в среде с предельным значением нормы загрязнения 1СГ3
Примечание — [7] устанавливает общие требования и содержит руководство по процессам, программам и методикам аттестации и контроля медицинских изделий, подвергаемых асептической обработке. Данный международный стандарт, в частности, применим к обработке физиологических (водных) растворов и, следовательно, имеет отношение к изготовлению ОИР. Будущие части данного международного стандарта будут посвящены специализированным процессам, таким как фильтрация и лиофилизация.
7 Требования к стабильности ОИР
7.1 Изготовитель должен определить и установить срок годности ОИР при хранении в складских помещениях и системах доставки. Определение срока годности при хранении должно быть проведено в реальном масштабе времени или проверено по ускоренной методике испытания для подтверждения, что основные характеристики по безопасности и эффективные эксплуатационные качества готового ОИР и системы доставки находятся в установленных пределах в течение обозначенного срока годности при ожидаемых условиях транспортирования и хранения. Испытание в реальном масштабе времени
ГОСТ 31585-2012
должно быть проведено при нормальных условиях хранения и изменений температуры, а относительная влажность воздуха должна составлять (60 ± 20) %.
При испытании по ускоренной методике температура должна быть не более 45 °С, а относительная влажность воздуха должна составлять 40 %.
7.2 Параметры, которые необходимо контролировать во время исследования срока годности при хранении: pH, осмоляльность раствора, уровни микрочастиц, стерильность, цвет, чистота и другие параметры, установленные при анализе рисков как критические для безопасного применения ОИР.
7.3 Установленный срок службы ОИР при хранении должен быть пересмотрен, если при анализе рисков выявлено изменение технологии, что может повлиять на стабильность ОИР.
Примечание — Изменения состава ОИР, исходных материалов и их поставщиков, условий изготовления, включая процесс стерилизации, тип упаковки или упаковочные материалы, могут оказать неблагоприятное влияние на срок службы ОИР при хранении.
8 Требования к упаковке ОИР8.1 Требования к защите от повреждения
8.1.1 ОИР должны быть защищены от повреждения при хранении и транспортировании.
8.1.2 Должны быть применены требования к упаковке медицинских изделий, указанные в ГОСТ ИСО 14630 и [8].
8.2 Требования к защите стерильности
ОИР при транспортировании должны быть упакованы таким образом, чтобы оставаться стерильными в пределах или ниже норм, указанных для условий транспортирования, хранения и погрузочно-разгрузочных работ. Должны соблюдаться требования к стерильному барьеру, указанные в [9].
9 Требования к информации, предоставляемой изготовителем ОИР
9.1 Должны соблюдаться общие требования к информации, предоставляемой изготовителем медицинских изделий, указанные в [10], и частные требования к ОИР, приведенные в настоящем разделе.
9.2 По применимости допускается использовать символы вместо текста. Если используются символы, должны быть применены требования национального
11
стандарта государств, упомянутых в предисловии, как проголосовавших за принятие настоящего межгосударственного стандарта*
На этикетке должны быть указаны присутствие в ОИР группы буферной добавки и, при ее наличии, буферная способность.
9.3 Если ОИР подвержен повреждению под действием факторов окружающей среды, на транспортном контейнере должны быть нанесены четкие предупредительные знаки.
Номер партии и конечный срокдействия могут быть указаны на самоклеящейся этикетке.
9.4 Вкладыш должен быть вложен в упаковку так, чтобы его можно было взять и прочитать, не повреждая стерильного барьера.
9.5 Минимальная информация, наносимая на контейнер для хранения, вкладыш в упаковку, стерильный барьер и первичный контейнер, приведена в таблице 2.
|
Таблица 2 — Информация, предоставляемая изготовителем | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
*В Российской Федерации действует ГОСТ Р ИСО 15223-1-2010 «Изделия медицинские. Символы, применяемые при маркировании на медицинских изделиях, этикетках и в сопроводительной документации. Часть 1. Общие требования» |
|
Окончание таблицы 2 | ||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||
13
Приложение А (справочное)Методы измерения pH и определения буферной способности ОИРА.1 Общие требования
А.1 Общие требования
А. 1.1 В настоящем приложении приведен пример методов измерения pH и определения буферной способности ОИР.
А.2 Требования к оборудованию и вспомогательным устройствам
А. 2.1 Стеклянная колба.
А.2.2 Бюретка емкостью 10 мл для подачи титрированного раствора с ценой деления 0,1 мл.
А.2.3 Чашка для размешивания.
А.2.4 Палочка для помешивания.
А.2.5 Гидроокись натрия (NaOH), 0,005-нормальный стандартный объемный раствор.
А.2.6 Соляная кислота (HCI), 0,01-нормальный стандартный объемный раствор.
А.2.1 Калиброванный рН-метр.
А.З Порядок подготовки, проведения измерения и правила обработки результатов измерения
А.3.1 Растворы гидроокиси натрия и соляной кислоты приготовить общепринятыми методами и перед применением разбавить до нужной концентрации.
А.3.2 В стеклянную колбу влить 25 мл образца (объем Vs) и измерить pHi с помощью калиброванного pH- метра.
А.3.3 С помощью бюретки добавить достаточное количество
титрированного стандартного объемного раствора HCI, чтобы обеспечить изменение показателя pH на 1,0 единицу pH (рНг). Записать объем добавленного титрированного раствора (Ц).
А.3.4 Повторить операции со второй аликвотной пробой образца, используя титрированный стандартный объемный раствор NaOH.
А.3.5 Рассчитать буферную способность по формуле
VtN
ЦЛрНг-рН,)’ГОСТ 31585-2012
где V{ — объем добавленного титрированного раствора;
Vs — объем раствора образца, мл;
N — нормальность титрированного раствора.
А.3.6 В окончательном отчете записать буферную способность по кислоте и буферную способность по основанию, моль/л на pH (или моль-экв./л).
Для растворов со значительной буферной способностью объем образца допускается регулировать до получения нужного объема титрированного раствора.
15
Приложение Б (обязательное)Метод проверки загрязнения ОИР видимыми микрочастицамиБ.1 Общие требования
Б.1 Общие требования
Метод проверки заключается в проведении визуальной оценки ОИР на наличие видимых микрочастиц с помощью устройства наблюдения.
Б.2 Требования к оборудованию и вспомогательным устройствам
Б.2.1 Устройство наблюдения, в состав которого входят:
Б.2.1.1 Матовая черная панель, установленная вертикально.
Б.2.1.2 Матовая белая панель, установленная вертикально рядом с черной панелью.
Б.2.1.3 Регулируемый патрон, снабженный источником света и
рассеивателем.
Б.2.1.4 Источник света в точке наблюдения должен создавать освещенность не менее 2000 лк. Для емкостей из цветного стекла и пластмассы освещенность должна быть более 2000 лк.
Б.З Порядок подготовки, проведения проверки и правила обработки результатов проверки
Б.3.1 Снять все этикетки с емкости, содержащей ОИР, промыть и высушить ее наружные стороны.
Б.3.2 Осторожно поворачивая емкость, следить за появлением
микрочастиц перед белой поверхностью. Воздушные пузыри в емкости недопустимы.
Б.3.3 Появление микрочастиц считать в течение 5 с.
Б.3.4 Провести операции по Б.З.2—Б.3.3 перед черной панелью.
Б.3.5 Сумму микрочастиц, появившихся перед белой и черной панелями, считают уровнем загрязнения ОИР видимыми микрочастицами и документируют
ГОСТ 31585-2012Приложение В (справочное)
Метод проверки загрязнения ОИР невидимыми микрочастицами
В.1 Общие требования
Метод проверки заключается в проведении оценки ОИР на наличие невидимых микрочастиц с помощью устройства электронной системы подсчета микрочастиц по ослаблению света.
В.2 Требования к оборудованию и вспомогательным устройствам
В.2.1 Общие требования
В.2.1.1 Устройство представляет собой электронную систему подсчета микрочастиц, взвешенных в растворе, обеспечивающую соответствующую подачу ОИР, в которой должен быть установлен датчик ослабления света, например, типа KL-04, фирма RION.
В.2.2 Требования к пределу измерения концентрации датчика
В.2.2.1 Используемое устройство должно иметь предел измерения концентрации максимального числа определяемых микрочастиц на миллилитр, который превышал бы предполагаемую концентрацию микрочастиц в испытуемом ОИР.
Предел измерения концентрации устройства указывается уровнем подсчета микрочастиц, при котором совпадающий счет вследствие одновременного присутствия двух или более микрочастиц в просматриваемом объеме датчика ослабления света составляет менее 10 % подсчетов, суммированных для микрочастиц размерами 10 мкм. Предел измерения концентрации микрочастиц должен быть указан в паспорте устройства.
В.2.3 Требования к динамическому диапазону датчика
В.2.3.1 Динамический диапазон датчика должен охватывать наименьший размер микрочастиц, которые подлежат подсчету в испытуемом ОИР.
В.2.4 Требования к воде
В.2.4.1 Используемая вода должна быть пропущена через пористый фильтр для очистки ее от микрочастиц. Размеры пор фильтра должны быть не более 1,2 мкм.
В.2.5 Требования к калибровке
В.2.5.1 Устройство калибруют по набору сферических микрочастиц
17
Сравнение структуры международного стандарта со структурой настоящего стандарта приведено в приложении Ж.
Дополнительные термины с соответствующими определениями внесены в текст стандарта и выделены путем заключения их в рамки из тонких линий.
Измененные фразы, слова, показатели и/или их значения выделены в тексте курсивом.
Степень соответствия - модифицированная (MOD).
Стандарт подготовлен на основе применения ГОСТ Р 53468-2009 (ISO 16671 - 2003)
6 ВВЕДЕН ВПЕРВЫЕ
Информация о введении в действие (прекращении действия) настоящего стандарта публикуется в ежемесячно издаваемом информационном указателе «Национальные стандарты».
Информация об изменениях к настоящему стандарту публикуется в ежегодно издаваемом информационном указателе «Национальные стандарты», а текст изменений и поправок - в ежемесячно издаваемом информационном указателе «Национальные стандарты». В случае пересмотра или отмены настоящего стандарта соответствующая информация будет опубликована в ежемесячно издаваемом информационном указателе «Национальные стандарты»
© Стандартинформ, 2013
В Российской Федерации настоящий стандарт не может быть полностью или частично воспроизведен, тиражирован и распространен в качестве официального издания без разрешения Федерального агентства по техническому регулированию и метрологии
III
размерами от 10 до 25 мкм в монодисперсной суспензии. Набор сферических микрочастиц диспергируют в воде по В.2.4.1 до получения соответствующей концентрации микрочастиц. В процессе диспергирования не допускаются агрегатные состояния микрочастиц.
В.З Порядок подготовки, проведения проверки и правила обработки результатов проверки
В.3.1 Общие требования
В.3.1.1 Проверку проводят в условиях ограниченного загрязнения микрочастицами с использованием вытяжного шкафа с ламинарным потоком воздуха через высокоэффективный сухой воздушный фильтр (НЕРА).
В.3.1.2 Для обеспечения соответствия рабочих параметров устройства требуемой точности проверки оператор, проводящий проверку, должен пройти соответствующее обучение.
В.3.1.3 Перед контрольной проверкой используемая стеклянная посуда должна быть чисто вымыта с применением теплого моющего средства и тщательно ополоснута большим количеством воды по В.2.4.1.
В.3.1.4 Во время переноса исследуемого ОИР в емкость, подлежащую контролю, не допускается проникновение воздушных пузырьков.
В.3.2 Порядок подготовки к проведению контрольной проверки
В.3.2.1 Контрольная проверка заключается в определении загрязнения микрочастицами пяти образцов воды по В.2.4.1 объемом 5 мл каждый в соответствии с В.3.3.
В.3.2.2 Если число микрочастиц размерами более 10 мкм превышает 25 в совокупном объеме образцов воды 25 мл, то общие требования безопасности проведения проверки не являются достаточными для проведения основной проверки ОИР. Следует повторить подготовительные этапы и провести повторную контрольную проверку.
В.3.2.3 ОИР, прошедшие контрольную проверку, подвергают процедуре определения загрязнения.
В.3.3 Порядок проведения проверки и оценка результатов
В.3.3.1 Для многокомпонентных ОИР требуется тщательное смешивание отдельных компонентов в соответствии с указаниями на этикетке.
В.3.3.2 Перемешивают содержимое ОИР, медленно переворачивая емкость не менее 25 раз. В случае необходимости, осторожно удаляют герметичную упаковку.
ГОСТ 31585-2012 (ISO 16671:2003)МЕЖГОСУДАРСТВЕННЫЙ СТАНДАРТ
Имплантаты офтальмологические РАСТВОРЫ ИРРИГАЦИОННЫЕ ДЛЯ ОФТАЛЬМОЛОГИЧЕСКОЙ ХИРУРГИИ Общие требования безопасности
Ophthalmic Implants. Irrigating solutions for ophthalmic surgery. General safety requirements
Дата введения 2015-01-01
1 Область применения
Настоящий стандарт распространяется на офтальмологические ирригационные растворы (далее — ОИР) класса неактивных хирургических имплантатов, используемые во время хирургических операций на передней камере глаза субъекта. ОИР не оказывают принципиального иммунологического, фармакологического или метаболического действия.
Стандарт устанавливает требования безопасности в отношении предусмотренного применения, характеристик конструкции, доклинической и клинической оценок, стерилизации, упаковки и этикетирования ОИР и информации, предоставляемой их изготовителем.
2 Нормативные ссылки
В настоящем стандарте использованы нормативные ссылки на следующие межгосударственные стандарты:
ГОСТ ISO 10993-1-2011 Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 1. Оценка и исследования
ГОСТ ISO 10993-5-2011 Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 5. Исследования на цитотоксичность: методы in vitro
ГОСТ ISO 10993-6-2011 Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 6. Исследования местного действия после имплантации
Издание официальное
ГОСТ ISO 10993-7-2011 Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 1. Остаточное содержание этиленоксида после стерилизации
ГОСТ ISO 10993-10-2011 Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 10. Исследования раздражающего и сенсибилизирующего действия
ГОСТ ISO 10993-12-2011 Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 12. Приготовление проб и контрольные образцы
ГОСТ ИСО 14630—20021 Неактивные хирургические имплантаты. Общие технические требования
ГОСТ ISO 14971-2011 Изделия медицинские. Применение менеджмента риска к медицинским изделиям
ГОСТ 31214-2003 Изделия медицинские. Требования к образцам и документации, представляемым на токсикологические, санитарно-химические испытания, испытания на стерильность и пирогенность
ГОСТ 31508-2012 Изделия медицинские. Классификация в зависимости от потенциального риска применения. Общие требования
ГОСТ 31580.7-2012 (ISO 11979-7:2001) Имплантаты
офтальмологические. Интраокулярные линзы. Часть 7. Клинические испытания
Примечание - При пользовании настоящим стандартом целесообразно проверить действие ссылочных стандартов по указателю «Национальные стандарты», составленному по состоянию на 1 января текущего года, и по соответствующим информационным указателям, опубликованным в текущем году. Если ссылочный стандарт заменен (изменен), то при пользовании настоящим стандартом, следует руководствоваться заменяющим (измененным) стандартом. Если ссылочный стандарт отменен без замены, то положение, в котором дана ссылка на него, применяется в части, не затрагивающей эту ссылку.
3 Термины и определения
В настоящем стандарте применены термины по национальным стандартам государств, упомянутых в предисловии, как проголосовавших за принятие
ГОСТ 31585-2012
настоящего межгосударственного стандарта, а также следующие термины с соответствующими определениями2:
3.1 базовая окружность (reference circle): Окружности стандартного размера диаметром 10 или 25 мкм, используемые для измерения эквивалентного диаметра частицы.
3.2 диаметр эквивалентной площади (equivalent area diameter): Диаметр круга, площадь которого эквивалентна площади частицы.
3.3 динамический диапазон датчика (sensor dynamic range): Диапазон размеров микрочастиц, в котором они могут быть точно измерены и подсчитаны.
3.4 контейнер для хранения (storage container): Часть упаковки,
предназначенная для защиты ОИР во время транспортирования и хранения и содержащая упаковочную вставку и герметичный стерильный пакет, внутри которого находятся ОИР и система доставки.
3.5 контрольная группа (control populations): Субъекты, которым
имплантированы документированные ОИР.
3.6 клинический испытатель (clinical investigator): Лицо и/или
организация, ответственные за проведение клинических испытаний и несущие клиническую ответственность за благополучие вовлеченных субъектов.
3.7 клиническое испытание (clinical investigation): Любое разработанное и запланированное систематическое изучение с целью проверки безопасности и/или эксплуатационных свойств ОИР с участием субъектов.
3.8 окончательный отчет (final report): Документ, заполняемый после завершения испытаний ОИР, в том числе клинических, содержащий описание и оценку результатов.
3.9 офтальмологический ирригационный раствор, ОИР (ophthalmic irrigating solution): Водный раствор, который физиологически совместим с внутриглазной средой и функционирует преимущественно только механически.
3.10 план клинических испытаний, ПКИ (clinical investigation plan): Документ, определяющий цели, задачи, предполагаемую методологию, систему контроля, проведения анализа и хранения данных клинических испытаний.
3.11 поле зрения окулярной сетки, ПЗС (graticule field of view): Площадь внутри большой окружности, разделенная перекрестьем на квадранты.
ГОСТ 31585-2012
3.12 серьезный неблагоприятный исход (adverse device effect): Послеоперационный исход, потенциально угрожающий зрению.
Примечание — Примеры серьезных неблагоприятных исходов приведены в таблицах А.1 и А.2 ГОСТ 31580.7.
3.13 система доставки (delivery system): Герметичный контейнер, в котором поставляется ОИР и дополнительные компоненты для введения данного ОИР в глаз.
3.14 стерильный барьер (sterile barrier): Пакет, в котором содержится ОИР и система доставки, которая поддерживает стерильность во время транспортирования и хранения.
3.15 субъект (subject): Лицо, участвующее в клинических испытаниях с применением испытуемого ОИР и/или в качестве субъекта контрольной группы.
3.16 объемный анализ (volumetry): Совокупность методов химического количественного анализа, основанных на измерении объемов растворов, осадков для установления концентрации (массы) определяемого вещества (включает титрометрический анализ).
4 Общие требования безопасности ОИР4.1 Требования к предусмотренным характеристикам
4.1.1 Предусмотренные характеристики ОИР должны быть определены изготовителем. Предусмотренные характеристики ОИР должны отвечать общим требованиям к предусмотренным характеристикам для неактивных хирургических имплантатов, установленных по ГОСТ ИСО 14630.
4.1.2 Предельные значения предусмотренных характеристик ОИР должны быть определены с учетом действующих нормативных документов, опубликованной клинической и научной литературы, идентифицированных результатов испытаний, доклинической оценки и клинических испытаний.
4.2 Требования к конструктивным особенностям4.2.1 Общие требования
4.2.1.1 Должны применяться общие требования к предусмотренным характеристикам неактивных хирургических имплантатов по ГОСТ ИСО 14630.
4.2.2 Требования к концентрации компонентов
4.2.2.1 Концентрация каждого компонента вещества в готовом ОИР должна быть определена, документирована и представлена в виде массы вещества на единицу объема раствора.
4.2.2.2 Так как методика испытаний может оказать влияние на представленную фактическую концентрацию, в клиническом отчете должны быть приведены и описаны стандартные физико-химические методы. Нормативные документы на каждый компонент вещества, при их наличии, также должны быть указаны.
4.2.3 Требования к используемой воде
4.2.3.1 Чистота используемой воды должна соответствовать чистоте воды для инъекций в соответствии с [1], [2].
4.2.4 Требования к определению характеристик готового ОИР
4.2.4.1 Общие требования
Изготовитель должен описать и документировать физические характеристики, которые могут повлиять на эффективность использования ОИР в офтальмологической хирургии.
Примечание — Физические характеристики следует измерять в условиях, соответствующих времени использования ОИР.
4.2.4.2 Требования к показателю pH и буферной способности
Показатель pH готового ОИР следует измерять с помощью калиброванного
pH-метра при температуре (25 ± 2) °С. Значение показателя pH ОИР должно быть подтверждено документально.
Примечание — Значение показателя pH ОИРдолжно быть близким к значению показателя pH внутренней среды глазного яблока (pH 7,38) для предотвращения повреждения клеток роговичного эндотелия. Исследования in vitro показали, что диапазон значений показателя pH, переносимый эндотелием, сужается с увеличением времени воздействия.
Для определения буферной способности ОИР следует применять метод, пример которого приведен в приложении А.
Классификация ОИР по диапазону значений показателя pH и буферной способности раствора приведена в таблице 1.
|
Таблица 1 — Классификация ОИР по показателю pH и буферной способности | ||||||||||||||||
| ||||||||||||||||
|
4.2.4.3 Требования к химическим и биологическим загрязняющим |
примесям
Идентификация потенциально опасных химических и биологических
загрязняющих примесей должна быть проведена посредством анализа рисков. В исходных материалах биологического происхождения эти примеси могут включать в себя протеины, нуклеиновые кислоты или другие биологические вещества. Примеси в готовом ОИР, представляющие потенциальную опасность для тканей глаза или системную опасность, должны быть идентифицированы, а их концентрация определена и представлена в окончательном отчете.
Примеси, загрязняющие ОИР, состоят из инородных, мобильных нерастворимых микрочастиц, кроме пузырьков газа, присутствующих в растворах.
Загрязняющие примеси должны быть определены с помощью стандартных аналитических методов, при их наличии, которые должны быть описаны. Предельные концентрации идентифицированных примесей должны быть установлены и описаны. Необходимость проведения испытания для проверки биологического действия этих примесей в процессе оценки биологической безопасности возникает в результате анализа рисков.
4.2.4.4 Требования к осмотическому давлению
Изготовитель должен определить и документировать диапазон осмотической концентрации ОИР. Осмотическое давление готового ОИР должно быть в диапазоне от 200 до 400 мОсм/кг. Осмотическое давление должно определяться с помощью парового или криоскопического осмометра при нормальных условиях.
4.2.4.5 Требования к спектральному коэффициенту пропускания
Коэффициент пропускания готового ОИР должен быть измерен в диапазоне
от 300 до 1100 нм. Результаты должны быть представлены в графической форме: коэффициент пропускания, %, в зависимости от длины волны, нм.
4.2.4.6 Требования к микрочастицам
Присутствие в готовом ОИР микрочастиц определенных размеров, видимых и невидимых, приводит к потенциальной возможности возникновения в ОИР неблагоприятных явлений. При проведении оценки рисков необходимо определить потенциальную возможность загрязнения или образования частиц в ОИР в процессе изготовления в условиях, ожидаемых при транспортировании и хранении, а также при использовании ОИР.
Изготовитель должен охарактеризовать потенциальную опасность, связанную с частицами каждого вида, выявленными при проведении оценки рисков.
Общие требования к оценке потенциального риска применения готового
ГОСТ 31585-2012
ОИР должны соответствовать ГОСТ 31508.
В ОИР не должно содержаться видимых микрочастиц. Метод проверки загрязнения ОИР видимыми микрочастицами должен соответствовать методу, приведенному в приложении Б. Для определения в ОИР невидимых частиц следует применять методы по приложению В или Г.
Метод по приложению В следует применять при определении следующих уровней микрочастиц:
не более 50 микрочастиц размерами не менее 10 мкм на 1 мл ОИР; не более 5 микрочастиц размерами не менее 25 мкм на 1 мл ОИР; не более 2 микрочастиц размерами не менее 50 мкм на 1 мл ОИР.
Метод по приложению Г следует применять при определении следующих уровней микрочастиц:
- не более 25 микрочастиц размером не менее 10 мкм на 1 мл ОИР;
- не более 2,5 микрочастиц размером не менее 25 мкм на 1 мл ОИР; не более 1 микрочастицы размером не менее 50 мкм на 1 мл ОИР.
Примечание — Метод с затенением света по приложению В основан на блокаде света. Аморфные, полужидкие или другие морфологически неразличимые микрочастицы способствуют затенению света и, следовательно, подсчету микрочастиц. В микроскопическом методе по приложению Г аморфные, полужидкие или другие морфологически неразличимые микрочастицы представляются в виде пятна или выцветшего места на поверхности мембранного фильтра и не считаются микрочастицами. Для компенсации этой разницы уровни микрочастиц данного метода составляют половину уровней микрочастиц метода по приложению В.
5 Требования к оценке конструкции ОИР5.1 Общие требования
5.1.1 Оценка конструкции ОИР должна проводиться для подтверждения соответствия его предусмотренным характеристикам.
Требования к оценке конструкции ОИР должны соответствовать общим требованиям, приведенным в ГОСТ ИСО 14630 для неактивных хирургических имплантатов.
5.2 Требования к доклинической оценке биологической безопасности5.2.1 Общие требования
5.2.1.1 Оценку биологической безопасности ОИР следует начинать с анализа рисков, проводимого и документированного в соответствии с ГОСТ ISO 14971. Результаты анализа рисков должны определить испытания, необходимые для оценки биологической безопасности ОИР.
7
1
В Российской Федерации действует ГОСТ Р ИСО 14630-2011 «Имплантаты хирургические неактивные. Общие требования»
2
В Российской Федерации действует ГОСТ Р 51892-2002 (ИСО 11979-1:99) Имплантаты офтальмологические. Интраокулярные линзы. Часть 1. Термины и определения
3