ГОСТ 26503-85
Животные сельскохозяйственные. Методы лабораторной диагностики клостридиозов
Купить ГОСТ 26503-85 — бумажный документ с голограммой и синими печатями. подробнее
Распространяем нормативную документацию с 1999 года. Пробиваем чеки, платим налоги, принимаем к оплате все законные формы платежей без дополнительных процентов. Наши клиенты защищены Законом. ООО "ЦНТИ Нормоконтроль"
Наши цены ниже, чем в других местах, потому что мы работаем напрямую с поставщиками документов.
Способы доставки
- Срочная курьерская доставка (1-3 дня)
- Курьерская доставка (7 дней)
- Самовывоз из московского офиса
- Почта РФ
Распространяется на все виды сельскохозяйственных животных, пушных зверей и птицу и устанавливает методы лабораторной диагностики клостридиозов
Ограничение срока действия снято: Протокол № 5-94 МГС от 17.05.94 (ИУС 11-94)
Оглавление
1 Методы выделения чистых культур клостридий
2 Метод биохимической идентификации
3 Метод биологической идентификации
4 Идентификация типов летальных токсинов
| Дата введения | 01.01.1986 |
|---|---|
| Добавлен в базу | 01.09.2013 |
| Актуализация | 01.01.2021 |
Этот ГОСТ находится в:
- Раздел Экология
- Раздел Электроэнергия
Организации:
| 28.03.1985 | Утвержден | Госстандарт СССР | 945 |
|---|
Agricultural animals. Methods for laboratory diagnostics of clostridium
Чтобы бесплатно скачать этот документ в формате PDF, поддержите наш сайт и нажмите кнопку:

стр. 1

стр. 2

стр. 3

стр. 4

стр. 5
стр. 6
стр. 7
стр. 8

стр. 9

стр. 10

стр. 11
стр. 12

стр. 13

стр. 14

стр. 15

стр. 16

стр. 17

стр. 18
ГОСУДАРСТВЕННЫЙ СТАНДАРТ
СОЮЗА ССР
ЖИВОТНЫЕСЕЛЬСКОХОЗЯЙСТВЕННЫЕ
МЕТОДЫ ЛАБОРАТОРНОЙ ДИАГНОСТИКИ КЛОСТРИДИОЗОВ
ГОСТ 26503-85
Ценя S кош
Ценя S кош
Издание официальное
ГОСУДАРСТВЕННЫЙ КОМИТЕТ СССР ПО СТАНДАРТАМ
Москва
РАЗРАБОТАН Министерством сельского хозяйства СССР ИСПОЛНИТЕЛИ
Л. В. Кириллов, Л. И. Сторэжев, Н. В. Зайцев
ВНЕСЕН Министерством сельского хозяйства СССР
Член Коллегии А. Д. Третьяков
УТВЕРЖДЕН И ВВЕДЕН В ДЕЙСТВИЕ Постановлением Государственного комитета СССР по стандартам от 29 марта 1985 г. № 945.
ГОСТ 26503-85 Стр. 9
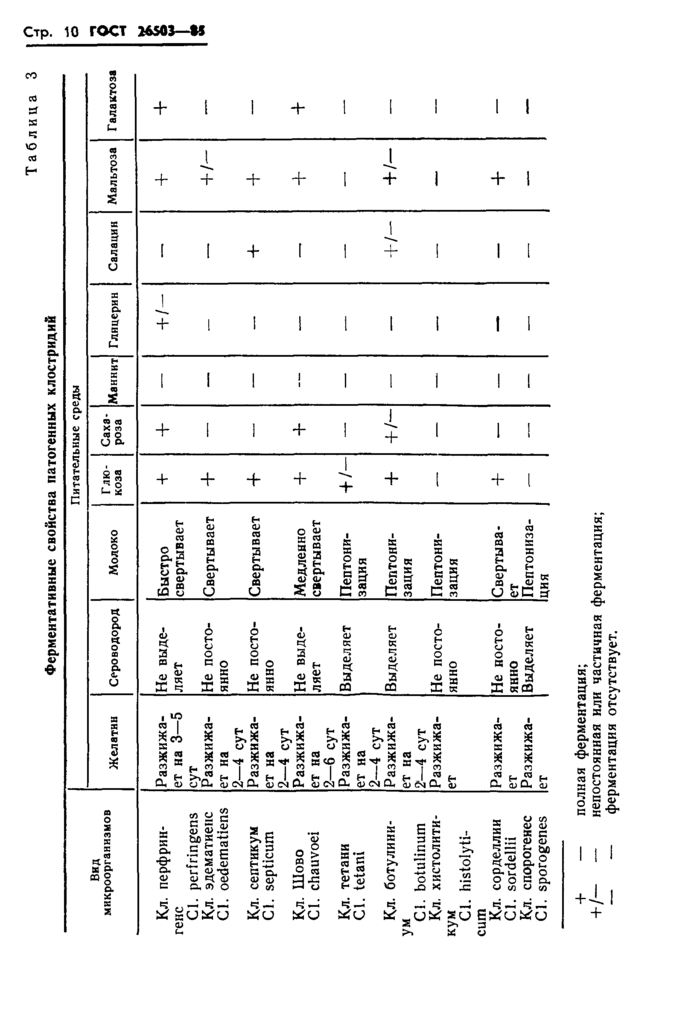
2.1.1. Для проведения исследования используют чистые культуры анаэробных микроорганизмов, выделенные из патологического материала путем отбора характерных колоний, по п. 1.3.
2.2. Аппаратура, материалы и реактивы
2.2.1. Для проведения исследования применяют аппаратуру» материалы и реактивы, приведенные в п. 1.2 с дополнением:
дельное молоко;
набор полужидких питательных сред с добавлением соответствующих углеводов или многоатомных спиртов.
2.3. Проведение исследования
2.3.1. Культуры 12—24 ч роста засевают в пробирки с желатином, мясо-пептонным бульоном, молоком, с набором питательных сред с добавлением углеводов или многоатомных спиртов.
2.3.2. Результаты исследования оценивают ежедневно в течение 7 сут в соответствии с требованиями, приведенными в табл. 3.
3. МЕТОД БИОЛОГИЧЕСКОЙ ИДЕНТИФИКАЦИИ
Сущность метода заключается в обнаружении возбудителей и их токсинов в патологическом материале. Данный метод используется так же для определения токсигенных и вирулентных свойств выделенных культур клостридий.
3.1. Метод отбора проб
3.1.1. Отбор и подготовка проб проводится в соответствии с пп. 1.1.1; 1.1.2; 1.1.3.
3.2. Аппаратура, материалы и реактивы
3.2.1. Для проведения исследований применяют аппаратуру, материалы и реактивы, приведенные в п. 1.2 с дополнением:
сыворотки Cl. perfringens антитоксические типов А, С, D, Е;
сыворотки Cl. botulinum антитоксические типов А, В, С, Е и F.
3.3. Проведение исследований
3.3.1. Обнаружение токсина CL perfringens в содержимом кишечника
3.3.1.1. В зависимости от консистенции материала содержимое кишечника разводят физиологическим раствором 1:1 или 1:2. Смесь выдерживают при комнатной температуре в течение 1 ч. Затем фильтруют через ватно-марлевый фильтр и центрифугируют 20 мин при 3—5 тыс. об/мин. Полученную надосадочную жидкость проверяют на токсичность путем внутривенного или внутрибрюшин-ного введения двум белым мышам массой 16—18 г в дозе 0,5 см3 или внутривенного введения кролику массой ‘1,8—2,0 кг в дозе 1,0—1,5 см3. При наличии токсина животные погибают в течение 12 ч, а в случае гибели в более поздние сроки (до 24 ч) проводят бактериологическое исследование с целью исключения сопутствующих инфекций.
Стр. 10 ГОСТ 26503—SS
со
Я
Еf Я
ч
\о
СО
н
#я
S
ч
Я
о.
н
о
о
4 я
и
3
5 Я Ф
U
О
н
сО
Е
СО
а
н
о
»Е
О
а
о
ф
3
s
ш
S
н
«О
н
S
Ф
£
о.
о
е
§
о
а
и
&>
3
в
л
5
н
<9
S
С
я
«
о
f-
в
я
Ч
я
U
я
«
8
Л
Ч
Я
£
£
В
£
Я
Ч
Я
U
£
В
Си
V
£
В
£
н
в
в
в
я
*
я я
х « я о о Ои
* « ,** о с- £
О
в
о
4 о
5
et
a
о
«
о
со
О
а
с
и
в
в
н
я
г
*
я
о
S
я
в
В
Я
« fe
в а.
0Q о
а.
в
в
г
+ 1
+
+
+
+
4-
+
+
+
+ + +
+
+
+
+
ь
ф
со
о Е
?£ о о* 3 £
.2? в
ЦЭ о
|
н |
н |
|
ф |
ф |
|
я |
я |
|
09 |
ю |
|
3 |
3 |
|
н |
ь |
|
в. |
а. |
|
ф |
ф |
|
а |
m |
|
и |
и |
О Ф
* 5
я Й
S34 О,
ф ф
5 3
■
Е
Я
о
6-
В
Ф
С
■
я
я
о
*-
я
ф
С
я
я
о
н
в
ф
С
я
CQ
3
н
о.
ф
я
(
я
со
я
я
о
н
с »
ф w
USC5
|
1 ф чС |
о н и |
о н о |
ф ч | ||
|
3 |
о |
о |
3 | ||
|
03 |
{- |
в о |
в о |
09 |
н |
|
ф X |
ф я ч |
" * Jm к |
ф * X к |
ф X |
ф я ч |
|
н |
н |
|
ф |
ф |
|
я |
я |
|
ч |
ч |
|
ф |
ф |
|
ч |
ч |
|
3 |
3 |
|
0Q |
со |
о
н
о
о
в о ф Е X к
н
ф
к
w =3
к g S
Ф й a
X «СП
о
н
о
о
|
, |
ю |
|
та |
1 |
|
X |
со |
|
я | |
|
* я |
та я |
|
я а |
н ф |
Я
я
о.
•е-
а.
ф
в
полная ферментация;
непостоянная или частичная ферментация; ферментация отсутствует.
I
- л
Б,*
О я
к
I
г _ я
о я
я __ я
Й
I
с- я
е-СО”|(Оич|СО |СО i CO “ t СО С Я СО ^ Я (, со р. СО , СО ,
oQ< S cs Он <ц сч СХ фс^Ом ф <n Q* фс^Ои а>
. я
Б. и
О я
СО £
. СО
Б.*
О я
к
со Я
я
*
я
*
со
Я
а
я
К
я
*
Я
в* та фО,
ЙУ 2 с я g
Ф Ф .я
ы> Я -й С н л
н
я
* Ё
S ф и Ф.ТЗ
Ф Ч а. <п
3 -
>>Н
я я
Я о В О-
ф ф
о со
Ч —, е; _«
^ Йий<0
Ф
и
|
Ч »“Ч |
|
я
я
я
ч
>>
н
о
хо
В g
я я
:§§
5 У
о я
л X
о
Н-»
со
О СО ф ф Я С Ф Ф
. tj tl/Q
S>y®o
я
я
ч
ч
0.2
о»£ О о
и а,
Ф 00
Ч — Ч Ч «—< Ч i—
£ >. з
я о
+JJ
+
ГОСТ 26503-85 Стр. И
3.3.2. Определение токсичности выделенных культур
При определении токсичности Cl. perfringens используют популяции микроорганизмов, выращенных в течение 8—16 ч в МППБ с добавлением 0,5 % глюкозы к объему среды.
При определении токсичности культур типов D и Е их подвергают активации добавлением 0,5 % панкреатина или 0,25 % трипсина при pH 8,0—8,2, который устанавливают путем подщелачивания 10 %-ным раствором NaOH. Смесь культуры с ферментом выдерживают при температуре 37—38 °С в течение 1—2 ч. После активации токсичность культур типов D и Е значительно увеличивается, а токсичность культур типа С резко снижается. Токсичность культур типа В может сохраниться на прежнем уровне за счет активации эпсилон-токсина. Определение токсичности проводят на белых мышах в соответствии с п. 3.3.1.
3.3.3. Обнаружение токсина Cl.botulinume патологическом материале
Пробы корма, содержимое желудка, кусочки печени и другой материал исследуют раздельно. Для этого пробу массой 25— 30 г растирают в ступке со стерильным песком и заливают равным или двойным количеством физиологического раствора. Полученную взвесь выдерживают 2 ч при температуре 20—22 °С, после чего центрифугируют 30 мин при 3 тыс. об/мин. Надосадоч-ную жидкость делят на две части и одну прогревают в кипящей водяной бане в течение 30 мин. Каждым фильтратом (гретым и негретым) заражают по две белых мыши массой 16—18 г каждая или двух морских свинок массой 300—350 г каждая. Белых мышей заражают внутривенно или внутрибрюшинно в дозе 0,5—0,8 см3, морских свинок подкожно в дозе 3—5 см3 (одной свинке гретый фильтрат, другой — негретый). Кровь больных животных вводят сразу после взятия внутрибрюшинно двум белым мышам или подкожно морской свинке в дозах, указанных выше.
При наличии ботулинического токсина животные, зараженные некипяченым материалом, погибают через 2—5 сут с характерной клиникой ботулизма (шаткая походка, учащенное дыхание, расслабление мускулатуры, западание брюшной стенки — «осиная талия»). Животные, которым вводили кипяченый материал, остаются здоровыми.
3.3.4. Определение токсичности выделенных культур Cl.botu-linum
При определении токсичности культур Cl.botulinum используют популяции микроорганизмов, выращенные на МППБ с добавлением 0,5 % глюкозы, в течение 5—7 сут. Микробные клетки отделяют фильтрованием или центрифугированием. Фильтрат или центрифугат вводят внутрибрюшинно двум белым мышам в дозе 0,5—1,0 см3 или морской свинке в дозе 3,0—5,0 см3. При наличии
токсина животные погибают на 2—5 сут с характерной клиникой ботулизма.
3.3.5. Обнаружение токсина Cl.tetani в патологическом материале
Суспензию материала вводят подкожно в лапку двум белым мышам или двум морским свинкам в дозе 0,5—1,0 см3. При наличии токсина у животных в течение 3—5 сут развивается характерная клиника столбняка.
3.3.6. Определение токсичности Cl. tetani
Токсичность штампов Cl. tetani устанавливают на белых мышах массой 16—18 г каждая или на морских свинках. Фильтрат* 10—12-суточной культуральной жидкости вводят в лапку подкожно двум белым мышам или двум морским свинкам в дозе 0,5—1,0 см3. При наличии токсина у животных в течение 3—5 сут развивается характерная клиника столбняка.
3.3.7. Обнаружение токсина CL oedematiens в патологическом материале при подозрении на некротический гепатит
Кусочки печени с некротическими очагами в количестве 25—30 г измельчают в ступке и заливают равным количеством физиологического раствора. Полученную взвесь выдерживают 2 ч при температуре 20—22 °С, после чего центрифугируют 20 мин при 3000 об/мин. Надосадочную жидкость вводят внутрибрюшин-но или подкожно двум белым мышам в дозе 0,5—1,0 см3. При наличии токсина животные погибают в течение 24—72 ч.
3.3.8. Определение токсичности выделенных культур Cl. oedematiens
Токсичность культур устанавливают на двух белых мышах, которым внутривенно или внутрибрюшинно вводят фильтрат двухсуточных исследуемых культур. При наличии токсина гибель белых мышей наступает через 24—72 ч.
3.3.9. Обнаружение Cl.chauvoel в патологическом материале
Кусочки пораженных мышц измельчают и растирают в ступке с песком и небольшим количеством мясо-пептонного бульона, в равномерную взвесь. Полученную взвесь в разведении 1:5—1:10 вводят подкожно в области брюшных мышц двум морским свинкам массой 350—400 г в дозе 0,5—1,0 см3. При наличии Cl.chau-voei животные погибают в течение 24—96 ч.
Мышечный экссудат вводят таким же способом в дозе 0,5— 1,0 см3. У павших свинок отмечают характерную для эмфизематозного карбункула патологоанатомическую картину (см. п. 1.3.3).
3.3.10. Определение патогенности культур Cl.chauvoei
Патогенность культур Cl.chauvoei устанавливают путем подкожного заражения двух морских свинок массой 350—400 г каждая, которым вводят 18—24 ч культуру возбудителя эмкара в дозе 0,5—1,0 см3. Животные погибают в течение 24—48 ч с характер-
ГОСТ 26503-85 Стр. 13
ной для эмфизематозного карбункула патологоанатомической картиной (см. п. 1.3.3).
3.3.11. Обнаружение CL septicum и других возбудителей злокачественного отека и брадзота в патологическом материале
Кусочки пораженных тканей или другой патологический материал (паренхиматозные органы, часть стенки сычуга и др.) измельчают и растирают в ступке с песком и небольшим количеством мясо-пептонного бульона. Полученную гомогенную взвесь вводят подкожно в область брюшных мышц двум морским свинкам в дозе 0,5—1,0 см3. При наличии в материале Cl. septicum и других возбудителей животные погибают через 18—36 ч с характерной патологоанатомической картиной (см. п. 1.3.3).
3.3.12. Определение патогенности культур CL septicum
Патогенность культур Cl. septicum устанавливают путем заражения двух морских свинок массой 350—400 г каждая, которым культуру суточного инкубирования в среде Китта-Тароцци вводят подкожно в область брюшных мышц в дозе 0,5—1,0 см3. Животные погибают через 18—24 ч с характерной патологоанатомической картиной (см. п. 1.3.3).
4. ИДЕНТИФИКАЦИЯ ТИПОВ ЛЕТАЛЬНЫХ ТОКСИНОВ
Cl. perfringens и Cl. botulinum
4.1. Типы основных летальных токсинов Cl. perfringens и С1. Ьо-iulinum устанавливают в реакции нейтрализации их типовыми антитоксическими сыворотками.
4.2. Постановка реакции нейтрализации с диагностическими антитоксическими сыворотками Cl. perfringens типов А, С, D, и Е.
Реакцию нейтрализации используют для определения типа основных летальных токсинов Cl. perfringens в содержимом кишечника павших животных и в фильтратах или центрифугатах культур микроорганизмов указанного вида типов А, В, С, D, Е и F.
Реакцию ставят на белых мышах или морских свинках, или кроликах. При постановке реакции на мышах результаты оцениваются по гибели или выживанию животных, обработанных смесью сывороток и токсина. При использовании морских свинок или кроликов определяют наличие или отсутствие дерманекротического действия смесей сывороток и токсина на месте их внутрикожного введения. Для этого у животных удаляют шерсть на боку (ближе к сагитальной линии) и на следующий день в это место вводят смеси сывороток и токсина.
4.2.1. Для определения типа основного токсина исследуемый материал разливают по 1,0 см3 в пять пробирок и добавляют по 1,0 см3 сыворотки каждого типа: в первую пробирку сыворотку типа А, во вторую — типа С, в третью — типа D, в четвертую — типа Е (активность сывороток каждого типа предварительно дово-
Стр. 14 ГОСТ 26S03—S5
дят етерильным физиологическим раствором до 10 АЕ), в пятую добавляют 1 см3 физиологического раствора (контроль). Смесь сывороток и исследуемого материала после выдерживания при 37—38 °С в течение 30 мин вводят по 0,5 см3 внутривенно или внутрибрюшинно двум белым мышам или внутрикожно по 0,2 см3 морской свинке или кролику. Одновременно в тех же дозах вводят испытуемую культуру без сыворотки (контроль). Для каждой смеси используют отдельный шприц. Наблюдение за животными ведут в течение 48 ч.
4.2.2. Результаты реакции нейтрализации учитывают при гибели контрольных белых мышей или образовании некроза в контроле у морской свинки (кролика).
Животные, получившие смесь токсина с гомологичной сывороткой, остаются живыми, а у морских свинок и кроликов некроз не развивается. Оценку результатов проводят в соответствии с табл. 4.
|
Таблица 4 Определение типа основного токсина Cl. perfringens | ||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||
|
+ — белые мыши пали, у морских свинок и кроликов некрозы на месте введения. — — белые мыши живы, у морских свинок и кроликов некрозы отсутствуют. Н — результаты не учитывают. | ||||||||||||||||||||||||||||||||||||||||||
4.3. Тип летального токсина Cl. botulinum определяют в реакции нейтрализации антитоксическими сыворотками типов А, В, С, Е и F.
Реакцию ставят по схеме: исследуемый материал по 2,4 см3 разливают в шесть пробирок, в пять из которых добавляют по 0,6 см3 типовых сывороток: в первую — типа А, во вторую — типа — Вит. д., в шестую пробирку такой же объем физиологического раствора. Смесь сывороток с исследуемым материалом выдерживают в течение 30 мин при температуре 35—37 °С и по
ГОСТ 26503-85 Стр. 15
0,8—1,0 см3 вводят подкожно двум белым мышам. Результаты реакции нейтрализации учитывают в течение 4 сут. Животные, которым исследуемый материал ввели в смеси с гомологичной сывороткой, остаются живыми, а остальные погибают с клиническими признаками ботулизма.
Редактор Н В. Бобкова Технический редактор В Н. Прусакова Корректор Е. И. Евтеева
Сдано в набор 17.04 85 Подп к печ. 26.06.85 1,0 уел. п. л. 1,25 уел кр отт 1,04 уч -изд, л,
Тираж 12000 Цена 5 коп
Ордена «Знак Почета» Издательство стандартов, 123840, Москва, ГСП,
Новопресненскнй пер., 3.
Калужская типография стандартов, ул. Московская, 256. Заю. 1250
ГОСУДАРСТВЕННЫЙ СТАНДАРТ СОЮЗА ССР
ГОСТ
26503-85
(СТ СЭВ 3456—81)
ЖИВОТНЫЕ СЕЛЬСКОХОЗЯЙСТВЕННЫЕ
Методы лабораторной диагностики
клостридиозов
Agricultural animals. Methods for laboratory diagnostics of Clostridium
ОКСТУ 9809
Постановлением Государственного комитета СССР по стандартам от 29 марта 1985 г. № 945 срок действия установлен
с 01.01.86 до 01.01.91
Несоблюдение стандарта преследуется по закону
Настоящий стандарт распространяется на все виды сельскохозяйственных животных, пушных зверей и птицу и устанавливает методы лабораторной диагностики клостридиозов.
Стандарт обязателен для республиканских, областных (краевых) ветеринарных лабораторий и ветеринарных научно-исследовательских учреждений.
Методы биохимической идентификации клостридий и определение типов токсинов Cl. botulinum проводят в научно-исследовательских учреждениях.
Стандарт соответствует СТ СЭВ 3456—81, кроме теста имму-нофлуоресценции и лицетин-вителлинового метода описания антигенной структуры клостридий и питательных сред, не применяемых в нашей стране.
1. МЕТОДЫ ВЫДЕЛЕНИЯ ЧИСТЫХ КУЛЬТУР КЛОСТРИДИЙ
Сущность метода заключается в выделении возбудителей клостридиозов животных путем посева проб патологического материала в жидкие питательные среды и постановке биологической пробы.
1.1. Метод отбора проб
1.1.1. Для диагностических исследований при подозрении на инфекционные болезни клостридиальной этиологии направляют в
Издание официальное Перепечатка воспрещена
★
© Издательство стандартов, 1985
лабораторию свежие трупы ягнят, поросят, птиц и пушных зверей в целом виде. От трупов телят и взрослых животных отбирают кусочки паренхиматозных органов (печень, селезенка, почки), кровь из сердца, неоткрытую трубчатую кость.
При подозрении на инфекционную энтеротоксемию животных и анаэробную дизентерию ягнят дополнительно берут отрезок тонкого отдела кишечника с содержимым, концы которого перевязывают шпагатом; при подозрении на ботулизм отбирают пробы кормов, содержимого желудка и кровь от больных животных, при подозрении на столбняк — раневой экссудат и кусочки ткани из глубины раны; при подозрении на эмфизематозный карбункул — кусочки пораженных мышц и отечный экссудат; при подозрении на некротический гепатит — кусочки печени с некротическими участками; при подозрении на брадзот — измененные участки сычуга и инфильтрат подкожной клетчатки; при подозрении на злокачественный отек — тканевой экссудат, кусочки пораженных мышц, и тканей, а при поражении половых органов — истечение из влагалища и кусочки органов.
1.1.2. Содержимое желудка и кишечника направляют в лабораторию после консервирования хлороформом (одна капля на 10 см3 патологического материала). Допускается пересылать неконсервированный патологический материал, а также консервированный в стерильном 30—40 %-ном растворе глицерина.
1.1.3. Отобранные пробы должны быть доставлены в лабораторию не позднее 4 ч с момента гибели животного, а консервированные — в течение 1—2 сут.
1.2. А п п а р а ту р а, материалы и реактивы Для проведения исследования применяют: микроскоп биологический; микроскоп стереоскопический; термостат с температурой нагрева 37—38 °С; микроанаэростат; холодильник бытовой; насос вакуумный; потенциометр или рН-метр; центрифугу с частотой вращения 5 тыс. об/мин; пипетки стеклянные мерные вместимостью от 1 до 10 см3 по ГОСТ 20292-74;
чашки Петри по ГОСТ 23932-79;
пробирки стеклянные по ГОСТ 25336-82;
раствор генциан-виолета или кристалл-виолета карболовый;
раствор Люголя;
лакмус 1 %-ный раствор;
фуксин карболовый Циля;
кислоту карболовую (фенол) кристаллическую по ГОСТ 6417-72;
ГОСТ 26503-85 Стр. 3
агар микробиологический по ГОСТ 17206-84 или
агар пищевой по ГОСТ 16280-70;
пептон сухой ферментативный по ГОСТ 13805-76;
спирт этиловый ректификованный по ГОСТ 5962-67;
зелень малахитовую 1 %-ный раствор;
кровь барана стерильную;
желатин пищевой по ГОСТ 11293-78;
глицерин по ГОСТ 6259-75;
Д-глюкозу по ГОСТ 6038-79;
сахарозу по ГОСТ 5833-75;
маннит;
салицин;
мальтозу;
галактозу;
среды питательные для культивирования анаэробов: бульон мясо-пептонный печеночный под вазелиновым маслом (среда Китта-Тароцци);
агар мясо-пептонный печеночный с добавлением 0,5 % глюкозы и 5 % дефибринированной стерильной крови барана; среды питательные для культивирования аэробов: бульон мясо-пептонный по ГОСТ 20730-75; агар мясо-пептонный;
воду 2%-ную пептонную с добавлением одного из используемых углеводов или многоатомных спиртов.
1.3. Проведение исследования
1.3.1. Из отобранных проб патологического материала делают мазки-отпечатки, которые окрашивают по Граму. Присутствие многочисленных грамположительных палочек и спор позволяет предположить наличие возбудителей клостридиозов (см. табл. 1),
1.3.2. Из отобранных проб патологического материала делают посевы в жидкую питательную среду, используемую для культивирования анаэробных микроорганизмов, а также в МПБ и на МПА. Перед посезом пробирки и флаконы с МППБ выдерживают в кипящей водяной бане в течение 15—20 мин для удаления растворенного в среде воздуха, а затем охлаждают их путем постепенного добавления холодной воды в водяную баню. Посевы выдерживают в термостате при температуре 37—38 °С в течение 24—48 ч, а при подозрении на столбняк и ботулизм посевы делают в два флакона, один из которых прогревают при 80 °С в течение 1 ч и инкубируют в течение 2—5 сут.
При появлении характерных признаков роста (помутнение среды, газообразование) делают дробный посев полученных культур на 3—5 чашках Петри с мясо-пептонным печеночным агаром, в который добавляют 0,5 % глюкозы и 5 % стерильной дефибринированной крови барана к объему среды. Чашки помещают, не переворачивая, в микроанаэростат или эксикатор, из которого
Стр. 4 ГОСТ 26503-85
та
tS
5
Ч
хо
0
t-
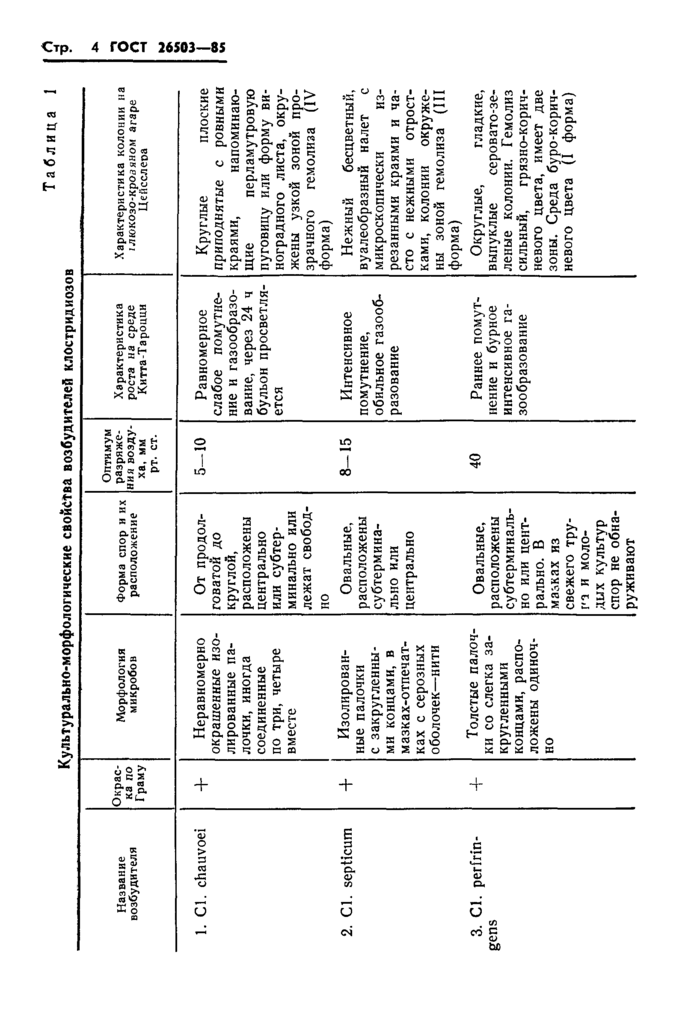
Культурально-морфологические свойства возбудителей клостридиозов
СЧ
•У
со
S о.
S 2 х Ь о *
Ч s О 5 2 О 93 X О W « <У Я га Ч
на-
a |
a ~
X
«ms я Pt =f Я (U я
ft cuo « w a.
S.*h
ft я £ Я ft
fl L h
£•5 я
5 g* x o.
s►» s s «
4 s H
«SO
я « О *
F- £.« * н
sis**
в
X
к -- ^ * я
g£
gs
oo
я о
а§
R
я я
U o
Охо Чо о a ■в* я сия
Is
и 2 « я к 2 5*я р.
R
ч
О)
н
§
>»
г S
вэ
Ф Я 1 SS2
* а «
о I *
е- 0 Я
с О S ^ О» О
с
О S
ф
а
ф н
а я
ч
>* o' s я я ^ я я
си Си
с я
2 я
>>т
и
R ^
£.|
S °
I-©-
ч
о. я Ф ч с я
>>о> си сиС^ я с о
о
»я
(б$ н * о о Я 0
ч
»я о о
я
м
я
4
о
5
ф
и.
§ я
>>
я
я
0
о
и
>х
я
- я О «о Я ^ и ^
Ч о я 2 Я g S
£3§&
Я * Я 'S-
ЭЯ
а я
Я f-
t- а;
ф ч И я
Я SB
Ф я Ф
ЮэЯ о
я а>
я £
_ Я Д *Я Я сз 2 О- О
Яо| (П О ф I- си § * >»* 0 S
*
ф
X
я а 5 я
СО м
си * я а я
§ *
S ф
а а:
я я
я со ф
Ф ^г
Си ф
я я я о
2 О
* Я ^ О 0 я 0 S ч си
я а о
я я *©•
ф ф
Я со
я
со л я Я
е я О о.
Ч Р м О
я я 5 ¥
2 «и А
8. . g
ф Я К
я о Я и о ч о
Я#я
а
ф
ф
а
Я Ф
Г» *Я
и 0
ч
си Я ф —.
* >>53 5 О g я ч а ф я
0 Ч Ф
Ё-*
нS*
си^_
ю
0 — 0 Н «н
ф Ч ф
0 Ф 0
Cf
CJ
о о
U lJ и
о 3 о
0 Я 0 Ф О ф Я я Я
<ь
« 5 2 >, S.S
о
я я
CS Ф 0
0 NO
CU 0
ч
ф
'g п ф О Ф о о сиси 2 ф с 0 я и .Я я Ф о К £ я
Ф Я Ч ф
■ я >>н
к 0 хо ф
хо
ф §
о 9
я „ 9 0 ф 2 я я ы
Ф Я ф Я ф о « « я fc н 0
ни 55 я со О хо 40 я о си
ф
я
я
0
0
о
tф
% я о си с >>
ХО
ф
ф —
я *
* ф
та «с
Си я
ф
я
ф
я я 0 0
о
Я 0
ф 0
я си ф хо £ о 5 о
Я 0
о
ю
ю
00
о
I
ч
§ § о ”
а
я
ф
9*эЯ "Я о
о си
S ^ ч о я хо
н
о
0 н я о
sfs °
я >» ч Н
си ф
н
>Х Ф я я Си 0 Ф Ч
я си Я я
0 0
я И S ч
.а ,
Ф я —
Я % S
SH-
f с н О фо - н
0 0 ф Си Ф Ч Я
я
ч
о
я
о
я
0
ч
0
си
Е-
я
* а е§ з?Й 5 *
я о
ч о я
ч
0
0
о
о о
Я 0
си я
ф
0 Я 0 Ф
о- 3
« 3
Е &
о
|
си я я о ч ч |
|
ф | ||||||||||||||||||||||||||||||||
0 Я
о
си I
<и X ф ф
я о ч X о
0 ХО
я о
я
о
ч
0
я
ф
3 и
ф
4 о н
н
я
SCO
я я
S -
CU Я
Л1 Ч
„ н s д * ф ХО Ч Л 0 >, О 0 0 си Ф Я си S
О X Я 0
|?А
н ч
о О
^ я
ф -ес 0
Ф я
h
Я
^ 1% * о * а рз
Ч Ф си
о Я с 3
я ф Я К 0 Я
си Ч о
Я Ч
S g
0 Я
о. о о я я ч
+
+
+
|
ф |
Е |
1 |
|
о |
я |
с |
|
> |
ф |
• 9^ |
|
я | ||
|
0 |
си | |
|
л |
ф |
0> |
|
ф |
со | |
|
и |
и |
и |
|
со | ||
|
,_и |
сч |
со С |
|
ф | ||
|
&и0 |
ГОСТ 26503-85 Стр. 5
V§
«з
ь
ф
3
а;
ф
ч
о
о
§
>я
X 2 О®
Ч 5 Я
3|&
Ос;
со 0*3
я я «
Я>
IIя
|g&
^ 2 со Н Ч ь. И и ад «О
ft2
СО 35
X
• Ф
3*з
X
- S3
X
со ч лг М
Ф о
л
н
со
сс
8 s
О Я о- * ф Ч
3 S
О)
X
X
S'*/
В
к
л Ч си 2 X Л X
г
ф
ь
I „-и I
н »к ф си х з в о S * £•©*
X
г
з
х _
X 2 х 3
со Я „ _ *. ф з ль си£ о- н
2?ч*« х g 2 о о ^ 3 о ан 2 о ю а. в о 2
„ ь
° -
2 2
I I
Он ч
О X
•©< ч
X
о
аГ »х 3 о х X Ч Л a
5 «
х а)
OQ X
х а,
а, о
S *
К
■ I
Ф о
3 В
** X си
«2
£ °
£ в
X
о
сх
ф
° »х
► X Ф ш
3 о н И X о х а.
з х х о х
X
X _
ф х as х Ч X о 2 а? и.
н
о
н
>>
а
н
О
X
e- 2
Ф Си
х о О-в*
X
- о w
2 Я 5
S-rfS
си 3 о х х со
2 в
3 о
4 Си и
£«
* X X X
о
ч
rfS
|ё
5 В
S 5
ч
и
2 i си Зхо
§ с»-8-
4 х
2 5д
t- о~
х>
х-к^
2 SX
£ Н а £ х в Э^Л * ю ч
н ф о ч в f- S
5 >» X ^
ls§¥
X О X 2
«8 л) |! §8
ft СО
О)
н
X СО
-. Я Ч -f
g 3
©О
ft
СО
я н
СО
со н Г йиС СО О,®
X
fttf
X
X •
А S I м
О) И I о Si в со х 5 ч >>
О * ^
'О 3 «VO
я в>
- s 8**
О ч ф
°5^
Си СС - CS
>> •
ф
н
X
н
► X X X о Ч
f-
g X
4 2
5 в
2g
о Я
о ч
си _
с X X
а>
'ki
X X
«3 л
о X
CQ - X Ф X X
£ о и е зо О «с х Чох X о
си
1
о
VQ О
о
2 35
X X
я X Ф о X X f- ф
>> н
2 g о X
С ф
ф
ч
|
ф ф о ю X X Ф X X |
« g
X X X
о
X X
си о
я >,о
s S °
§ 2
|
s S Я СИ Н о с О СО |
|
И
s О S я
я
O.S
о i
si
со 2
р
е *
ч
X
X
о
X
N
ф ч
Н X
о о
ч >» о X
си
н
X
. 3
Ф в
3 ф
2 *
4 °
X
ш
X о
ч X
1
X
2 л --. Си о X
Ф Я Си
^ 1Г
- 3
ф в
3 Ф
X X X ф
си я я х
ч
о
к и
о \о » м
X >, X ф
си о я х
н
X
X
я
ч
X
X
о
ф
о
X
я
ч ^г-о й
и О
X
* Я
о s 5 0,0
О ф я С Ь я ^
о \о ч 5 — х х ^ X
а. О Ж •—" >>
сс
Я Я «- О 0\0 5 о
о ft
-0- я
fts
Is
I
X
ч
о
X
ф
3
X
с
ф
3 х
со
I
» ° I
х ^ я Ф%Й*Х ч >о х
и О О
X
си X
X ч
X
I— L— >^ * Си*©* Си
о
2
я 3
2 X
я
о
о в В
§ s S
s-si
egg
X rt*
Ф I
я- I
-н СО
X
Ч х
Си X X
S
ч
о
X
ф
3
X
X
>*_£ си*©* & си ^ о 2
I
в к" ф 5 Ч 2
X X
>. X си X
X о X в
X
я 3
х я
в л
2 5
X X
л ж
ф
я в X в Ф о
к
о ч
о <п 1
у Э я х х о Си X X
xt
|
я о н ф 3 я »ж о СС си в н ^ и ф S |
| |||||||||||||||||||||||||||||||||||||||||||||||||
Ао>>
flC!
9*«ft
+
+
+
к S3 S
3g
я Ч
« >> « о
д s
Я
|
X Е |
"ф | |
|
ф -а |
-ТЗ t_ |
о со |
|
ф |
о | |
|
о |
сл | |
|
' | ||
|
и |
и |
и - |
|
сЛ |
3 | |
|
ч* в |
ю |
со В |
|
.3 |
и | |
ч
чо
a
t-i
qj
*
4
о
о
Q.
£5
<S
*S
og
gSg,
§ g S'
* О 4
ОТ 9“ о В Я о
О w
sS
— X Q«o «> £ * a нЧо
X Ь- tm ОТ _ ОТ
о."
ОТ 31
X
S
н
О Li
* а
a -
<D
' ф
2 3
со с:
о 5-
х S
О, И ф ф
а £
о
я
«г «я
3
Я
р*
я
О,
со
о
о,
С
I « s*
Я О е*
o-Ss
С Ф
Я Н
я S
я * ^
О 3 S с-
Ч о х
о е я я
ф _
5 * >>
Он
Ъ£ Ф 3 н
ф
3
о.
ф
0
1
о
я
*
со
ст Си
я о
§«•
. S ►-*
2 Ф Т1, Я С-,
cd х
х fc
и О
О) Ф
3 5 «
о а
Он sr ь* cd у—^ О Он cd ео s
Й о* Он я к 2 Ф f- я л **
£* ч «_ ** ф н я я _
Я О Я Ч*—I
is§
Нй cj ft о s « a £•« Я
от
от 21 f-
2-5 £ от о л X оХ
от
»я
ч 5! 2
Я 0) я 40 С «
о я . я я Н я я ф я Ч О о о О- о о >.хО я о
Л- 3 I | я
Й 4 я >» о, «
S ф Ьн Ф н Я н О g. -S^S
° « 5 Ц 33
S * 3 И н 3 Он* ф н фя W -2
ОмЯедфе^ ^;
s о.йОи®И ««Сю'ОЯЗ^, S S О q я я *5 с-ООноЧ*нЗ ОЯСсоОО-ЯЯ
и
о
я х
£ S
cd
Я I
со
ф>^ И
чсо 2 3 я
Й СО Я
s ф о
* Он с
. ф
Й * *
Р Й00
ая7
я 1
я <£) л я о Я Л О Х“
я Он л 2
я о о * о н я 4 я о я ^
Ф Я Ф *
НС*
* в ф ,
►в н н
Н о Ф Ф
Я л
Ч Н
>»ф
ХО *
£ ф
ф в
* о
0J Он
ч я
* 5
cd я в я
Он*
ф 21
к >» О я о s е 4
я я о о
я
я
о*
I
ХО
о
о
со
я
и
S
3 я л
4
я н
ф S н
I Н _
Ф ф . о я в &t fe
а- Ф 2 О
► ^ о * я
а<51 о-ч Ф
S^rcS|
Я I я л я я оо я я ^ \о
О Ч г" ™ я со О Ф С Ф я ф (-, Я cd О Он Он О Ч Я о.
я о х н я я
1*3 = 5
s К И- °
£ о. я .
В « К >< н
Л ОТ S 5^0.
О ая «
|
о |
LO | |
|
<м 1 |
ю 1 |
*7 |
|
1 ю мМ |
1 со |
1 СО |
х
яо> Я S S
О §6
5§
§ё
|s
О в.
е-
So
». 3 е л ф
ф я § ч я 3 ф а- я я
* ^ я g-«
* О S g §
н
я я 4 . о о
X Он
• X
ч
я
я
о
**
Я >^VQ
я Я О н
я о, я о
н. О Ф я
2 Он
5 Он 53 сп 2 g 4 Я 5\о я»*
я >, ч ^ о- о я О
ОнХО
е я Он я О ф
* 2 и О
X Я £
Я 2 я
Й ОнЧ S S h G ^
я
я
ч
я
я
о
о я я ч я
_ w rv Он U О (->> ч \о - я
О. О >, О Ф
я я о я я
ч ^ g-g.
ф
3
я
ф я
я
Си
I
я
я
3 s а I а
* в я 5 м
Л) - А я в1
и ХО >.© Он О
^ я 2
Ф В S то Я £ S хо 54 55 О я ч
о
О S У * 4
в- я с о. я
s s «
Ф хо ~ ,_Ф я о н з о. о я 2 я
я
5 аз
и
О £V
Is
я
я
О Я
* I
я я
ф
ч
с_
я
о
ч
я
с
о *
* 2 о я я я o,=t о
я S я
я
I
ф
я я
я
И и а 3 о 5 я я 2 ф я
я
М М у " 1Й
>\ я Я „ вг
о. о я я
ООО
ч я я
г
я
с
ф
3 н о
4 о н
с- я
>. я
о. я я о
Я я
я
я
у я я 3 я я я я
я
Я я
и Ф о Я я о я *
ф
- S ^
0-0.4
я в -cm * о S с и
I
я
о
S"
с *
я
я
я
я
о
н
£3
я *
cd О
Я Я
+
+
+
№
S|
в 5
т X от >0 £ § я
|
О | |
|
и. О |
О ч-> |
|
о. |
О |
|
сЯ |
^5 |
|
* | |
|
^ И |
и |
|
. Ф | |
|
г- с |
оо |
|
ф | |
|
Ь£ |
в
о
с
и
05
ГОСТ 26503-85 Стр. 7
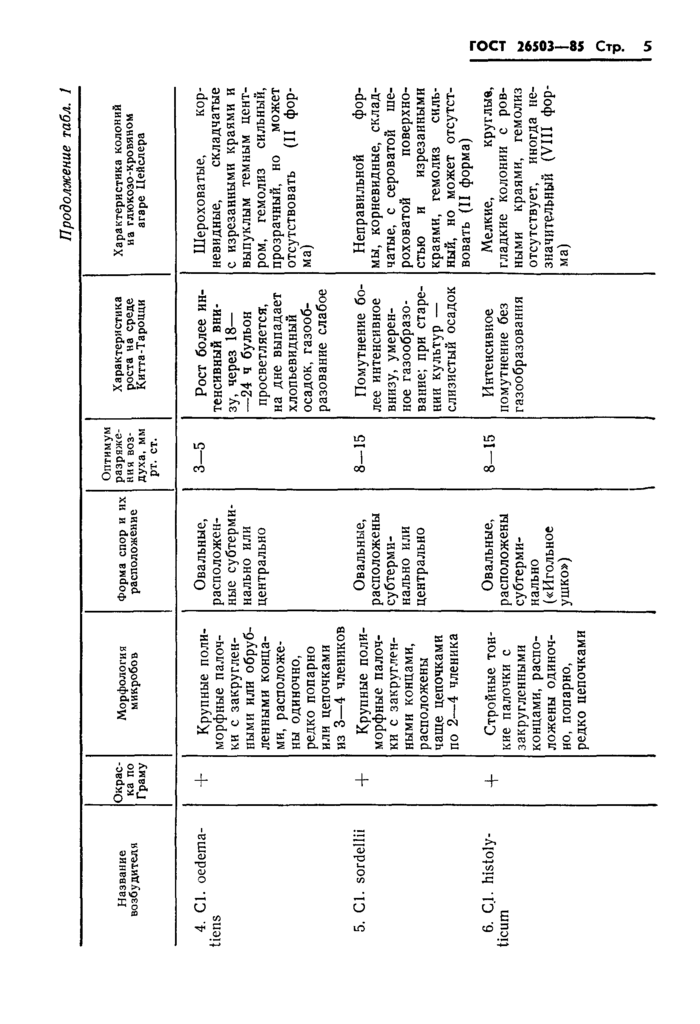
удаляют воздух при помощи вакуум-насоса и выдерживают в термостате при температуре 37—38 °С в течение 12—48 ч. Полученные отдельные колонии, которые по структуре напоминают колонии клостридий, определяют по формам роста по Цейсслеру и отвивают в жидкие питательные среды, которые инкубируют при температуре 37—38 °С в течение 24—48 ч.
При получении второй генерации посев делают также и на среды, предназначенные для культивирования аэробной микрофлоры (МПБ, МПА). Для дальнейшей работы отбирают культуры, которые не дают роста в контрольных посевах (МПБ, МПА).
Для ускорения работы допускается посев проб патологического материала на твердые питательные среды в чашках Петри. Дальнейший отбор выросших колоний делают так же, как и при пересеве с жидкой питательной среды.
1.3.3. Патологический материал очищают путем пассажа через морскую свинку. Для этого измельченный в ступке материал или первичный посев материала в жидкой питательной среде вводят подкожно в области брюшных мышц или внутримышечно морской свинке массой 350—450 г в объеме 0,5—1,0 см3.
Животных, павших в течение 72 ч, вскрывают, учитывают патологоанатомическую картину (см. табл. 2), а из места введения крови, взятой из сердца и печени, делают посевы в жидкие и на твердые питательные среды, а также мазки-отпечатки с мест посева и диафрагмальной поверхности печени.
|
Таблица 2 Патологоанатомическая картина у морских свинок | ||||||||
|
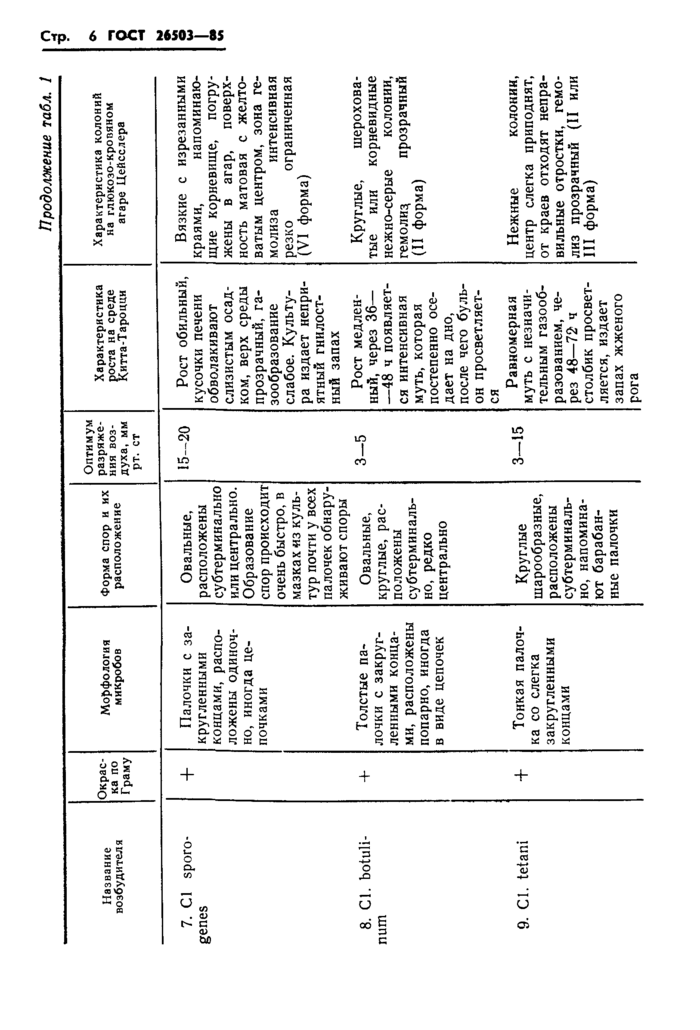
Продолжение табл. 2
Название (тип) возбудителя клостридиозов
Патологоанатомические изменения
Cl. septicum
возбудитель брадзота, злокачественного отека
Cl. oedematiens
возбудитель некротического
гепатита, злокачественного отека
Cl. histolyticum
возбудитель злокачественного
отека
Кожа легко отделяется от мышц. Мышцы и подкожная клетчатка светло-красного или розового цвета, в подкожной клетчатке большое количество пузырьков газа. Кишечник вздут, наполнен разжиженными массами, содержащими пузырьки газа, сосуды инъецированы. В грудной полости и сердечной сорочке обнаруживают значительное количество транссудата
На месте инъекции наблюдается желатинозный, студенистый отек от желтоватого до слабо-розового цвета. Мышцы бледные.
Cl. sordellii
возбудитель злокачественного отека
Cl. sporogenes
Cl. botulinum возбудитель ботулизма
Cl. tetani
возбудитель столбняка
При заражении в мышцу бедра кожа красно-фиолетовая, напряжена, иногда лопается. Мышцы теряют свою структуру, расплавляются и превращаются в кашицеобразную массу с примесью сгустков крови. Мягкие ткани отделяются от костей и сосудов. Газ не образуется, гнилостного распада нет
На месте инъекции наблюдается желатинозный студенистый отек от желтоватого до слабо-розового цвета. Мышцы бледные
Патогенен в ассоциации с другой микрофлорой
Патологоанатомические изменения не характерны
Патологоанатомические изменения не характерны
1.3.4. В качестве дополнительных тестов для идентификации культур Cl. chauvoei и Cl. septicum используют результаты исследования мазков-отпечатков с диафрагмальной поверхности печени морских свинок: при наличии Cl. septicum обнаруживают удлиненные формы в виде нитей, Cl. chauvoei — одиночные короткие палочки; заражение кроликов культурой Cl. chauvoei не вызывает их гибели.
2. МЕТОД БИОХИМИЧЕСКОЙ ИДЕНТИФИКАЦИИ
Сущность метода заключается в определнии вида клостридий на основе изучения их ферментативных свойств.
2.1.Метод отбора проб