МУ 2620-82
Методические указания по гигиенической оценке микробных средств защиты растений от насекомых и болезней на основе неспорообразующих микроорганизмов
Купить МУ 2620-82 — бумажный документ с голограммой и синими печатями. подробнее
Цена на этот документ пока неизвестна. Нажмите кнопку "Купить" и сделайте заказ, и мы пришлем вам цену.
Распространяем нормативную документацию с 1999 года. Пробиваем чеки, платим налоги, принимаем к оплате все законные формы платежей без дополнительных процентов. Наши клиенты защищены Законом. ООО "ЦНТИ Нормоконтроль"
Наши цены ниже, чем в других местах, потому что мы работаем напрямую с поставщиками документов.
Способы доставки
- Срочная курьерская доставка (1-3 дня)
- Курьерская доставка (7 дней)
- Самовывоз из московского офиса
- Почта РФ
Методические указания предназначаются в помощь научным работникам, осуществляющим исследования по гигиенической оценке новых микробных препаратов
Оглавление
1. Общие положения
2. Порядок представления новых микробных препаратов на гигиеническое исследование
3. Объем и порядок исследования неспорообразующих микроорганизмов и микробных препаратов на их основе
3.1. Методы оценки безопасности микроорганизмов - основного действующего начала микробных препаратов
3.2. Методы гигиенической оценки товарной формы микробного препарата
3.3. Изучение загрязнения воздуха рабочей зоны в условиях промышленного производства и сельскохозяйственного применения микробных препаратов
3.4. Эпидемиологический анализ заболеваемости людей, контактирующих с микробными препаратами
3.5. Изучение влияния микробных препаратов на процессы микробного самоочищения воды
3.6. Изучение влияния микробных препаратов на процессы микробного самоочищения почвы
Приложение. Среды для изучения нормальной микрофлоры организма
Литература
| Дата введения | 01.01.2021 |
|---|---|
| Добавлен в базу | 01.01.2019 |
| Актуализация | 01.01.2021 |
Этот документ находится в:
Организации:
| 22.09.1982 | Утвержден | Заместитель Главного государственного санитарного врача CCCР | 2620-82 |
|---|
Чтобы бесплатно скачать этот документ в формате PDF, поддержите наш сайт и нажмите кнопку:

стр. 1

стр. 2

стр. 3

стр. 4

стр. 5

стр. 6
стр. 7

стр. 8

стр. 9

стр. 10

стр. 11

стр. 12

стр. 13

стр. 14

стр. 15

стр. 16

стр. 17

стр. 18

стр. 19

стр. 20

стр. 21

стр. 22

стр. 23

стр. 24

стр. 25
МИНИСТЕРСТВО ЗДРАВООХРАНЕНИЯ СССР
ВСЕСОЮЗНЫЙ НАУЧНО-ИССЛЕДОВАТЕЛЬСКИЙ ИНСТИТУТ ГИГИЕНЫ И ТОКСИКОЛОГИИ ПЕСТИЦИДОВ, ПОЛИМЕРНЫХ И ПЛАСТИЧЕСКИХ МАСС
МЕТОДИЧЕСКИЕ УКАЗАНИЯ
1982
1982
ПО ГИГИЕНИЧЕСКОЙ ОЦЕНКЕ МИКРОБНЫХ СРЕДСТВ ЗАЩИТЫ РАСТЕНИЙ ОТ НАСЕКОМЫХ И БОЛЕЗНЕЙ НА ОСНОВЕ НЕСПОРООБРАЗУЮЩИХ МИКРООРГАНИЗМОВ
КИЕВ
МИНИСТЕРСТВО ЗДРАВООХРАНЕНИЯ СССР
ВСЕСОЮЗНЫЙ НАУЧНО-ИССЛЕДОВАТЕЛЬСКИЙ ИНСТИТУТ ГИГИЕНЫ И ТОКСИКОЛОГИИ ПЕСТИЦИДОВ, ПОЛИМЕРНЫХ И ПЛАСТИЧЕСКИХ МАСС
МЕТОДИЧЕСКИЕ УКАЗАНИЯ
1982
1982
ПО ГИГИЕНИЧЕСКОЙ ОЦЕНКЕ МИКРОБНЫХ СРЕДСТВ ЗАЩИТЫ РАСТЕНИЙ ОТ НАСЕКОМЫХ И БОЛЕЗНЕЙ НА ОСНОВЕ НЕСПОРООБРАЗУЮЩИХ МИКРООРГАНИЗМОВ
КИЕВ
длительном заражении per os лабораторных животных исследуемыми культурами мышам в течение 2-х мес, а крысам в течение 4-х мес. ежедневно с питьевой водой через специальные поилки вводят микроорганизмы. При этом испытываются дозы, при однократном введении которых не обнаруживаются какие-либо отклонения в поведении, температуре и массе тела, морфологическом составе крови и в состоянии нормальной аутофлоры организма.
При заражении лабораторных животных через дыхательные пути используют специальные герметичные камеры, в которых находятся животные и производится подача микробов или микробных препаратов в виде аэрозольного облака. Подача воздуха в камеры с динамическим режимом работы производится со скоростью 3—4 л/мин. Животные в камере находятся в специальных «Домиках», предохраняющих их шерстный покров от попадания па него микробов и микробных препаратов. Однократное ингаляционное воздействие на животных в затравочной камере продолжается в течение 2-х часов для мышей и 4-х часов для крыс и кроликов, многократное при той же экспозиции -— в течение 2-х месяцев для мышей и 4-х месяцев для крыс. При оценке инфективности учитывают внешний вид и поведение животных, проводят ректальную термометрию, измерение массы тела, обнаружение исследуемых микроорганизмов в крови, внутренних органах и выделениях животных, определяют наличие и нарастание титра специфических антител, проводят патоморфологические исследования.
Выявление специфических антител в сыворотке животных проводят с помощью реакции аглютинации с живыми культурами исследуемых бактерий общепринятым методом, выявление специфических преципитинов — с помощью реакции кольцепре-ципитации с растворимыми антигенами исследуемых микроорганизмов. Антигены извлекают из микробных клеток принятыми в микробиологии методами (химическими или методом ультразвуковой дезинтеграции). Активность антигенов проверяют в реакции кольцепреципитации с иммунными сыворотками, получаемыми путем иммунизации кроликов.
Для получения преципитирующих сывороток к изучаемым культурам в качестве антигенов для иммунизации кроликов используют в первых трех инъекциях гретые 1 час при температуре 58—60° суспензии бактериальных клеток в физиологическом растворе, последующие инъекции проводят живой культурой бактерий. Кроликов иммунизируют внутривенно 7-кратно с 4—5-дневными интервалами дозами от 108 до 4-109 микробных клеток в объеме 0,5 мл физиологического раствора. Через 10
дней после последней иммунизации кроликов обескровливают, полученные сыворотки используют для проверки активности антигенов.
Наблюдения за лабораторными животными, зараженными однократно культурой исследуемых микроорганизмов проводят в течение 30 дней. Бактериологический посев крови проводят ежедневно в течение первых трех дней после заражения, затем 1 раз в неделю. 1 раз в неделю проводят умертвление группы животных (4—6 животных), перед этим проводят тотальный забор крови для бактериологических исследований и для получения сывороток. Умертвленных животных вскрывают, кусочки органов отбирают для бактериологических исследований и для изготовления гистологических препаратов. Для патоморфологических исследований кусочки органов фиксируют в 10%-ном формалине, препараты окрашивают гематоксилином и эозином.
Если при поступлении бактерий в больших количествах в организм, у последнего не наблюдается каких-либо клинических симптомов и отклонений в поведении, патоморфологических изменений в органах, исследуемые микроорганизмы не инвазивны и не обнаруживаются в крови и внутренних органах, не вызывают образование специфических антител в крови, то такие микроорганизмы не обладают инфективностыо для теплокровных организмов.
При изучении влияния исследуемых микроорганизмов на иммунологическую реактивность животных и выявлении возможного аллергенного действия определяют титр лизоцима в сыворотке, фагоцитарную активность лейкоцитов и фагоцитарный индекс, показатель повреждения нейтрофилов (ППН), агломерацию лейкоцитов, проводят кожные реакции, у части животных воспроизводят анафилактический шок.
Титр лизоцима в сыворотке определяют по просветлению сыворотки с культурой Micrococcus lysodeicticus (Е. Ф. Черну-шенко, Л. С. Когосова).
При изучений фагоцитарной активности лейкоцитов определяют фагоцитарную активность (процент фагоцитирующих нейтрофилов на 100 подсчитанных) и фагоцитарный индекс (среднее число фагоцитированных микробов на 1 активный нейтрофил) . Суть метода заключается в угнетении фагоцитарной функции сенсибилизированных лейкоцитов при повторном, разрешающем воздействии на них аллергена. Для проведения исследований из вены животного берут 0,1 мл крови, вносят в пробирку с 0,1 мл 5%-ного раствора цитрата натрия, прибавляют 0,1 мл УЗ-антигена (взвесь УЗ-антигена— 10 мг/мл). За-
11
тем прибавляют 0,1 мл суспензии убитой нагреванием тест-культуры стафилококка (штамм № 209, концентрация — 2,5 млрд, микробных клеток в 1 мл). После 30 минут выдерживания пробирок в термостате при 37° С готовят мазки, высушивают, фиксируют метанолом и окрашивают по Романовскому. Под иммерсионным микроскопом подсчитывают количество активных фагоцитов и количество поглощенных микробов на 100 нейтрофилов. Вычисляют фагоцитарную активность и фагоцитарный индекс.
Показатель повреждения нейтрофилов (ППН), обладающий, по данным ряда авторов, достаточной информативностью в комплексной диагностике бактериальной аллергии, определяют по В. А. Фрадкину, агломерацию лейкоцитов — по И. Е. Сосон-кину. В качестве антигенов используют ультразвуковые антигены (УЗ-антигены), а также формоловые антигены, полученные из штаммов исследуемых бактерий формоловым методом (А. Е. Вершигора).
Итогом опытов с однократным введением исследуемых микроорганизмов является установление пороговой дозы, под которой понимают минимальную дозу, при введении которой в организме возникает небольшой, но статистически достоверный сдвиг какого-либо специфического показателя.
Параллельно с постановкой опытов по определению вирулентности, токсичности, токсигенности и пнфективности микробов проводится также эксперимент по выявлению аллергенных свойств путем воспроизведения анафилактического шока на морских свинках.
Для воспроизведения анафилактического шока морским свинкам подкожно вводят по 0,3 мл растворимого УЗ-антигена (концентрация — 10 мг/мл) 2-кратно через день. Через 16—21 день животным внутрисердечио вводят дозу антигена в 10 раз большую. Замеряют температуру тела до внутрисердечной инъекции, через 30 мин и через 1 час после нее, а также наблюдают поведение животных. Клиническая картина острой формы анафилактического шока характеризуется появлением вынужденных движений, взъерошивания шерсти, почесывания мордочки, затем наступает одышка, судороги, нередко непроизвольное мочеиспускание и дефекация и через 3—10 мин животное погибает от асфиксии.
При затяжной форме симптомы шока развиваются медленнее. У животных наблюдается резко выраженная депрессия, сонливый вид, полузакрытые или закрытые глаза. Животные либо погибают, либо постепенно, обычно через несколько часов, возвращаются к нормальному состоянию.
12
Аллергенное действие исследуемых микробов выявляют также в опытах на морских свинках, которым подкожно трехкратно с интервалом в 3 дня вводят культуру микроорганизмов. Иммунологическую перестройку организма изучают через 14 дней после последнего введения с помощью постановки кожных проб, теста ППН, реакции агломерации. При постановке кожных проб на свежевыстриженный участок кожи (как неповрежденной, так и скарифицированной) сенсибилизированных животных наносят УЗ-антиген в концентрации 10 мг/мл или формоловый антиген. При наличии аллергизации организма через 12—24 часа возникает аллергическая реакция, сопровождающаяся эритемой, инфильтрацией, иногда изъязвлением и некрозом ткани.
По силе аллергенного действия микроорганизмы условно подразделяются на группы:
1. Сильный аллерген, вызывающий у не менее, чем 80% животных аллергические реакции с быстрым развитием и выраженным проявлением всех клинико-морфологических признаков аллергии.
2. Средней силы аллерген, при котором у 50—80% животных наблюдаются аллергические реакции с большинством клинико-морфологических признаков.
3. Слабый аллерген, вызывающий положительные аллергические реакции у менее, чем 50% животных. Клинико-морфо-логические признаки аллергии выражены слабо и не полностью.
Если исследуемый микроорганизм обладает сильным или средним аллергенным действием, делается заключение о нецелесообразности внедрения его в практику сельского хозяйства. Если микроорганизм относится к слабым аллергенам, эти его свойства учитываются при нормировании микробных препаратов в объектах окружающей среды.
Для обнаружения дисбактериотического действия микробов проводят бактериологическое исследование испражнений, секрета слизистых верхних дыхательных путей и кожи животных.
При этом в фекалиях определяют количество кишечных палочек (посев на среду Эндо), количество гемолитических бактерий (посев на 5%-ный кровяной агар), энтерококков (на среде с ТТХ), стафилококков (посев на дрожжевой солевой агар — ДСА), грибов (на среде Сабуро), бактероидов (на среде КАБ), лактобацилл (на среде Ленцнера), протея (посев на бульон с мочевиной). Состав сред приведен в приложении.
Все посевы на аэробы инкубируют 24—48 часов при 37° С, посевы на анаэробы инкубируют 24—48 часов в атмосфере
13
углекислого газа при 37° С. Определяют количество микроорганизмов в 1 г фекалий.
При изучении микрофлоры кожи используют отпечатки на предметных стеклах с агаровой питательной средой, прикладываемых к определенным участкам кожи (Н. Н. Клемпарская, Г. А. Шальнова). При этом используют среду Коростелева для учета кокковой флоры, 5%-ный кровяной агар для учета гемолитических форм, среду Эндо — для учета кишечных палочек. Определяют количество микроорганизмов на I см2 поверхности кожи.
Исследование микрофлоры слизистых верхних дыхательных путей проводят с помощью стерильных дисков по Г. А. Шально-вой с использованием среды Эндо и 5%-ного кровяного агара. Учитывают количество бактерий на 1 см2 слизистой.
Полученные материалы используют при нормировании микробных препаратов па основе указанных микроорганизмов в различных средах.
В условиях промышленного производства и сельскохозяйственного применения микробных препаратов при высоком микробном загрязнении воздуха возможно попадание промышленных штаммов микроорганизмов на' открытые участки кожи и слизистые оболочки работающих, приводящие к различным неблагоприятным последствиям. В связи с этим при изучении патогенных свойств микроорганизмов проводится определение влияния производственных микроорганизмов на конъюнктиву глаз кроликов, как наиболее общепринятую модель для изучения поражений конъюнктивы, а также на кожу морских свинок и кроликов. При этом в конъюнктивальную полость кроликов вводится по 2 капли взвеси суточной агаровой культуры бактерий на физиологическом растворе в разных концентрациях однократно или трехкратно (три дня подряд по 1 разу в день). Наблюдения проводятся ежедневно в течение 1 мес.
При изучении действия бактерий на кожу на выбритую кожу (как неповрежденную, так и скарифицированную) боковой поверхности живота наносят взвесь суточной агаровой культуры исследуемых микробов в разных концентрациях (108—1011 кле-ток/мл). Нанесение и втирание взвеси стеклянной палочкой осуществляют ежедневно в течение 3-х дней. Наблюдения за животными проводят в течение 1 мес.
На основании всех полученных материалов по гигиенической оценке исследуемого штамма микроорганизмов (как в острых, так и в хронических опытах) решается вопрос о возможности его использования в сельском хозяйстве и целесообразности проведения дальнейших исследований по разработке техноло-
14
гии изготовления препаратов на основе изученных микроорганизмов.
3.2. Методы гигиенической оценки товарной формы микробного препарата
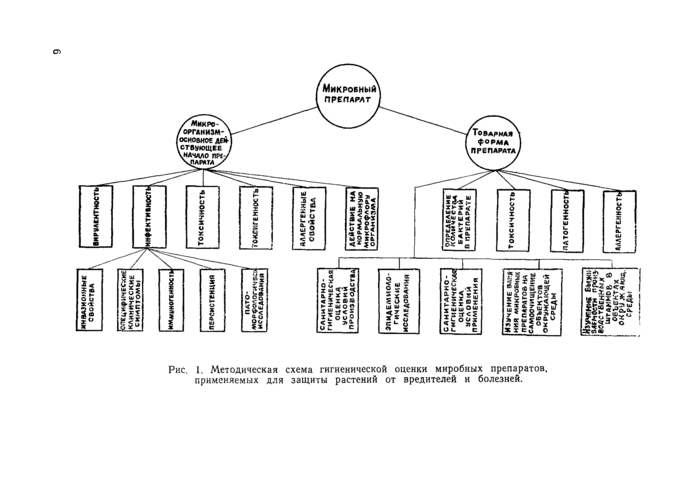
При изучении безопасности товарной формы микробных препаратов согласно приведенной на рис. 1 схеме учитывают количество микробов — основного действующего начала в препарате, токсичность препарата, патогенность, аллергенные свойства препарата. Кроме того, проводят оценку условий промышленного производства и сельскохозяйственного применения микробного препарата, изучают выживаемость входящих в микробный препарат микроорганизмов в объектах окружающей среды и влияние на процессы самоочищения воды и почвы, проводят эпидемиологические исследования.
Определение количества бактерий в 1 г препарата проводят общепринятым методом путем посева различных разведений препарата в физиологическом растворе на твердые питательные среды.
Токсичность препаратов определяется путем вычисления его ЛД50 при различных путях введения лабораторным животным (в желудок, через органы дыхания, на кожу и слизистые) в различных концентрациях на физиологическом растворе. Выражается этот показатель в зависимости от пути введения в мг/кг веса животного или в мг/м3 воздуха. Оценка токсичности микробных препаратов производится по аналогии с химическими препаратами согласно ГОСТ 12.007-76 «Вредные вещества. Классификация и общие требования безопасности», по которому вредные вещества по степени воздействия на организм подразделяются на 4 класса опасности:
1- й — вещества чрезвычайно опасные;
2- й — вещества высокоопасные;
3- й — вещества умеренно опасные;
4- й — вещества малоопасные.
Класс опасности вредных веществ устанавливается в зависимости от норм и показателей, указанных в таблице 4.
15
Класс опасности вредных веществ (по ГОСТ 12. I. 007—76)
Наименование
показателя
Нормы для класса опасности
1-го
2-го
3-го
4-ГО
Предельно допусти-мая концентрация (ПДК) вредных веществ в воздухе ра
бочей зоны (мг/м3) менее 0,1 0,1 —1,0 1,1 —10,0 более 10,0
Средне смертельная доза при введении в
желудок (мг/кг) менее 15 15—150 151—5000 более 5000
Средне смертельная доза при нанесении на кожу
менее 100 100—500
501—2500 более 2500
Средне смертельная концентрация в воздухе (мг/м3)
менее 500 500—5000 5001—50000 более 50000
При изучении патогенных свойств микробных препаратов лабораторным животным вводят препараты (как однократно, так и длительно) и проводят исследования, аналогичные исследованиям при изучении микробов.
Наблюдение за животными, подвергавшимися однократному воздействию препаратом, проводят в течение 1 мес. При многократном воздействии препарат вводят животным в течение 2 мес для мышей и 4 мес для крыс. У животных, подвергавшихся ингаляционной затравке микробным препаратом в камере, проводят также изучение фиброзных изменений в легких по содержанию коллагена (оксипролина) в сухой ткани легких (М. Хвапил), определяют также процент сухого вещества в легких. Сравнивают показатели опытных животных с показателями контрольных.
Для выявления действия препаратов на кожу животным проводят накожные аппликации препаратом в виде густой кашицы в стерильной водопроводной воде.
Для выявления аллергии у животных, подвергавшихся многократному ингаляционному и пероральному воздействию микробных препаратов используют кожные пробы, а также иммунологические реакции — определение ППН, реакции агломерации, реакции фагоцитоза. Исследования проводятся ана-
16
Класс опасности вредных веществ (по ГОСТ 12. I. 007—76)
Наименование
показателя
Нормы для класса опасности
1-го
2-го
3-го
4-ГО
Предельно допусти-мая концентрация (ПДК) вредных веществ в воздухе ра
бочей зоны (мг/м3) менее 0,1 0,1 —1,0 1,1 —10,0 более 10,0
Средне смертельная доза при введении в
желудок (мг/кг) менее 15 15—150 151—5000 более 5000
Средне смертельная доза при нанесении на кожу
менее 100 100—500
501—2500 более 2500
Средне смертельная концентрация в воздухе (мг/м3)
менее 500 500—5000 5001—50000 более 50000
При изучении патогенных свойств микробных препаратов лабораторным животным вводят препараты (как однократно, так и длительно) и проводят исследования, аналогичные исследованиям при изучении микробов.
Наблюдение за животными, подвергавшимися однократному воздействию препаратом, проводят в течение 1 мес. При многократном воздействии препарат вводят животным в течение 2 мес для мышей и 4 мес для крыс. У животных, подвергавшихся ингаляционной затравке микробным препаратом в камере, проводят также изучение фиброзных изменений в легких по содержанию коллагена (оксипролина) в сухой ткани легких (М. Хвапил), определяют также процент сухого вещества в легких. Сравнивают показатели опытных животных с показателями контрольных.
Для выявления действия препаратов на кожу животным проводят накожные аппликации препаратом в виде густой кашицы в стерильной водопроводной воде.
Для выявления аллергии у животных, подвергавшихся многократному ингаляционному и пероральному воздействию микробных препаратов используют кожные пробы, а также иммунологические реакции — определение ППН, реакции агломерации, реакции фагоцитоза. Исследования проводятся ана-
16
логично исследованиям микроорганизмов, составляющих основное действующее начало микробных препаратов.
По результатам экспериментальных исследований на животных составляется заключение о токсичности микробного препарата, о неблагоприятном воздействии на организм животных, устанавливается пороговая доза по лимитирующему показателю. На основании данных о патогенных свойствах препарата решается вопрос о целесообразности проведения дальнейших гигиенических исследований.
3.3. Изучение загрязнения воздуха рабочей зоны в условиях промышленного производства и сельскохозяйственного применения микробных препаратов
Санитарно-микробиологическое исследование воздуха при производстве и применении микробных препаратов проводится как с целью изучения влияния такого загрязнения на заболеваемость работающих, так и для разработки профилактических мероприятий.
При микробиологическом исследовании воздуха определяют общее число бактерий в воздухе и количество производственных микроорганизмов. Для определения общего количества бактерий в воздухе используют МПА, для определения в воздухе производственных штаммов микроорганизмов применяют специальные дифференциально-диагностические среды. При этом можно пользоваться любыми эффективными приборами, применяемыми для микробиологических исследований воздуха.
Наибольшее распространение в практике микробиологических исследований в настоящее время получили аппарат для бактериологического исследования воздуха (прибор Кротова) и пробоотборник аэрозольный бактериологический (ПАБ-1). Можно использовать также и другие приборы: бактериоулови-тель Киктенко, прибор для отбора проб воздуха ПОВ-1, прибор Андерсена. Методы исследований с помощью указанных приборов подробно изложены в «Справочнике по санитарной микробиологии» (под ред. Л. В. Григорьевой, 1981 г.).
3.4. Эпидемиологический анализ заболеваемости людей, контактирующих с микробными препаратами
При проведении исследований по выявлению у людей заболеваний, этиологически связанных с микробными препаратами, обращают внимание на наличие специфических жалоб у работающих, а также проводят бактериологическое и серологиче-
17
ское обследование этих лид. При анализе специфической заболеваемости на предприятиях микробиологической промышленности вычисляют индекс заболеваемости согласно формуле:
где И3 — индекс заболеваемости; I — количество заболеваний, возникших в результате контакта с микробным препаратом; С — общее количество лиц, имевших контакт с препаратом при исследуемом уровне микробного загрязнения. Сопоставление индекса заболевания с уровнем микробного загрязнения позволяет выявить степень зависимости между этими показателями.
При проведении бактериологического обследования лиц, контактирующих с микробными препаратами в процессе их производства и применения, исследованию подлежат кровь, выделения людей (моча, слюна, фекалии), открытые участки кожных покровов, слизистые, оболочки конъюнктивальной полости и верхних дыхательных путей.
При серологическом исследовании определяют наличие в сыворотке людей специфических антител, содержание иммуноглобулинов. По показаниям для выявления возможного аллергенного действия микробных препаратов ставят реакцию специфической агломерации лейкоцитов (РСАЛ), реакцию пассивной гемагглютинации по Бойдену с введением в реакции специфических микробных аллергенов.
При эпидемиологическом анализе заболеваемости учитывают не только заболеваемость лиц, занятых производством и применением микробных препаратов в сельском хозяйстве, но и населения, проживающего в районах расположения предприятий микробиологической промышленности и районах применения препаратов.
При этом учитывают заболевания, вызванные тем видом или родом микроорганизмов, к которому относятся и производственные штаммы, вычисляют показатель заболеваемости, удельный вес той или иной нозологической формы, коэффициент корреляции.
Показатель заболеваемости — количество случаев заболеваний, вызванных исследуемыми микроорганизмами за год, отнесенное на 100 000 населения. Высчитывается по формуле:
■ 100000
число больных
численность населения
При определении показателя возрастной заболеваемости в приведенной выше формуле в числителе ставят число больных
18
данной возрастной группы, а в знаменателе — численность населения этой же возрастной группы.
Удельный вес заболеваний, вызванных производственными микроорганизмами, во всей совокупности заболеваний, вызванных микроорганизмами того или иного рода или вида, выражается в процентах и определяется по формуле:
число случаев конкретной болезни .jqq общее число заболеваний, вызванных микроорганизмами, относящимися к тому же роду или виду
Коэффициент корреляции (г) вычисляется по формуле:
dx * ^ dy V*dx»-*dy”
где d — отклонение от средней арифметической признаков х и у; г — коэффициент корреляции; ^ — сумма.
Для установления корреляционной связи можно использовать менее точный, но зато очень простой метод вычисления корреляции рангов ( р ). Формула коэффициента:
= i
Р п(пМ)
где d2—квадрат отклонения от средней, п — число наблюдений.
3.5. Изучение влияния микробных препаратов на процессы микробного самоочищения воды
Исследования проводятся как в лабораторных условиях в модельных водоемах, так и в натурных условиях, когда объектом исследования служит вода открытых водоемов, расположенных вблизи предприятий микробиологической промышленности.
При изучении влияния микробных препаратов на процессы микробного самоочищения воды в модельные водоемы с водой (10—15 л) из открытого водоема (река, озеро) вносят суточные культуры патогенных и санитарно-показательных микроорганизмов в различных разведениях (104—10б клеток/л), а также микробные препараты в количествах, в которых они теоретически могут попасть в воду водоема при обработках при соблюдении норм расхода препарата. Из санитарно-показательных микроорганизмов вносят кишечные палочки, энтерококки, из патогенных — шигеллы и сальмонеллы.
Посев воды из аквариумов проводят общепринятым методом сразу после заражения, через 1, 3, 5, 7, 10, 15, 20 и 30
19
Настоящие методические указания предназначаются в помощь научным работникам, осуществляющим исследования по гигиенической оценке новых микробных препаратов.
Составитель — канд. мед .наук Т. Г. Омельянец.
суток. Действие микробных препаратов оценивают по изменению относительно контроля численной характеристики микробной популяции во времени, сроков гибели бактерий и их морфологических свойств. При этом определяют общее количество бактерий, количество споровых микроорганизмов, кишечных палочек, энтерококков, шигелл, сальмонелл. При определении общего количества бактерий посев воды проводят общепринятым методом в 1,5%-ный МПА, общее количество споровых микроорганизмов определяют путем посева на 1,5% МПА различных разведений проб воды, предварительно прогретых при 80° в течение. 15 мин.
Количество энтерококков определяют с помощью среды с трифенилтетразолийхлоридом (ТТХ), количество шигелл и сальмонелл — путем посева проб воды на дифференциальнодиагностические среды — Эндо, Плоскирева с последующей идентификацией выделенных культур и на среды накопления — селенитовую, магниевую, среду с охмеленным суслом.
Основной целью санитарно-микробиологического исследования в натурных условиях воды открытых водоемов в районах, расположенных вблизи предприятий микробиологической промышленности, или в районах применения микробных препаратов является определение санитарно-эпидемиологического состояния воды и процессов самоочищения и разработка на основании результатов исследования гигиенических рекомендаций по охране здоровья людей.
Пробы воды отбираются с поверхности водоема и на глубине 1—2 м в точках отбора проб. Исследования проводят на участке обработок (в 2-х точках) и выше и ниже по течению (реки, канала, арыка) на расстоянии 50 м, 100 м и 300 м. С целью определения санитарно-микробиологического состояния водоема определяют общую микробную обсемененность, количество споровых микроорганизмов, количество кишечных палочек, энтерококка и количество производственных микроорганизмов — основного действующего начала микробных препаратов. По эпидпоказаниям проводят определение в воде сальмонелл и шигелл.
3.6. Изучение влияния микробных препаратов на процессы микробного самоочищения почвы
При изучении влияния микробных препаратов на процессы самоочищения почвы в лабораторных условиях в сосуды с почвой, не токсичной по отношению к индикаторным микроорганизмам, вносят санитарно-показательные и патогенные микро-
20
«УТВЕРЖДАЮ» Заместитель Главного Государственного санитарного врача СССР
А. И Зайченко 22 сентября 1982 г.
No 2620—82
МЕТОДИЧЕСКИЕ УКАЗАНИЯ ПО ГИГИЕНИЧЕСКОЙ ОЦЕНКЕ МИКРОБНЫХ СРЕДСТВ
ЗАЩИТЫ РАСТЕНИЙ ОТ НАСЕКОМЫХ И БОЛЕЗНЕЙ НА ОСНОВЕ НЕСПОРООБРАЗУЮЩИХ МИКРООРГАНИЗМОВ
1. Общие положения
Одним из эффективных методов защиты растений от вредителей и болезней является микробиологический метод, сущность которого состоит в использовании болезнетворных для вредителей микробов, а также микробов — антагонистов возбудителей заболеваний растений.
Как средства защиты растений микроорганизмы применяются в виде микробных препаратов, куда они в высушенном или нативном состоянии входят в качестве основного действующего начала. Наряду с микробами в микробные препараты входят и другие компоненты: остатки питательной среды, на которой выращивались микробы, наполнители или приманочные продукты, стабилизаторы.
На основе неспорообразующих микроорганизмов в настоящее время микробиологической промышленностью выпускаются препараты разного назначения: микробные инсектициды (средства борьбы с вредителями-насекомыми), микробные роденти-циды (средства борьбы с вредными мышевидными грызунами)1 и микробные препараты для борьбы с возбудителями болезней растений.
В последние годы ассортимент микробных препаратов, предлагаемых для применения в сельском хозяйстве, в том числе и препаратов на основе неспорообразующих бактерий, продолжа-
ет расширяться. Основными направлениями развития народного хозяйства на 1981 —1985 гг. и на период до 1990 г., утвержденными XXVI съездом КПСС, предполагается значительное расширение производства и применения микробиологических средств защиты растений.
Учитывая возможное неблагоприятное воздействие микробных препаратов на организм и окружающую среду, применение новых микробных препаратов в сельском хозяйстве может допускаться только после проведения их гигиенической оценки и с разрешения Министерства здравоохранения СССР.
Микробные препараты, которые предлагаются к применению в сельском хозяйстве в качестве средств защиты растений не должны содержать патогенных для человека или полезных животных микроорганизмов.
2. Порядок представления новых микробных препаратов на гигиеническое исследование
Новые микробные препараты, предлагаемые к применению в качестве средств защиты растений, принимаются на исследование только по поручению Министерства здравоохранения СССР.
Для исследования должен быть представлен штамм микроорганизма, на основе которого изготовлен микробный препарат, и микробный препарат в виде товарного продукта.
Направляемые материалы должны сопровождаться следующими сведениями:
а) наименование препарата и его товарная форма;
б) наименование штамма бактерий — основного действующего начала препарата, характеристика морфолого-культуральных свойств штамма;
в) сведения о патогенных свойствах бактерий для теплокровных организмов;
г) состав микробного препарата, краткая характеристика посторонней микрофлоры, наполнителя, стабилизатора, питательной среды для выращивания микробов;
д) назначение препарата (против каких вредителей и возбудителей болезней и на каких объектах предполагается его применение);
е) краткое описание технологического режима изготовления микробного препарата;
ж) способы применения препарата;
з) методы обнаружения микробного препарата (по основ-
ному действующему началу) в продуктах питания, воде, воздухе, почве.
3. Объем и порядок исследования неспорообразующих
микроорганизмов и микробных препаратов на их основе
Гигиеническая оценка микробных препаратов на основе неспорообразующих бактерий должна проводиться в 2 этапа:
1) оценка патогенных свойств микроорганизмов, входящих в состав микробного препарата;
2) санитарно-гигиеническая оценка товарной формы микробного препарата.
При исследовании новых микробных препаратов, используемых в качестве микробных инсектицидов и средств борьбы с болезнями растений, руководствуются разработанной во ВНИИ-ГИНТОКС’е методической схемой, приведенной на рис. 1.
При изучении патогенных свойств микроорганизмов и микробных препаратов на их основе важное значение имеет выбор экспериментальных животных. Как известно, наиболее чувствительной моделью к воздействию микроорганизмов и продуктов их метаболизма являются мыши, широко используемые в практике микробиологических исследований. Для установления наличия видовой чувствительности используют также белых крыс, кроликов, морских свинок. Подбор животных и формирование из них однородных групп осуществляют с учетом одинаковой массы тела и отсутствия различий в поведении, общем состоянии, содержании лейкоцитов в крови и состоянии нормальной микрофлоры организма.
ЗЛ. Методы оценки безопасности микроорганизмов —
основного действующего начала микробных препаратов
Одним из узловых вопросов при оценке производственных штаммов микроорганизмов является установление их патогенности. При этом согласно приведенной методической схеме учитывают вирулентность штамма, его инфективность, токсичность, токсигенность, аллергенные свойства штамма, антагонистическое действие по отношению к нормальной микрофлоре организма.
О вирулентности бактерий судят по величине ЛДзо (дозы микробных клеток, вызывающей гибель 50% зараженных животных) при различных способах введения (внутрибрюшинном, пероральном, интраназальном) белым мышам массой 16—18 г и крысам массой 90—100 г. Внутрибрюшинное введение осуще-
5
|
Рис. 1. Методическая схема гигиенической оценки миробных препаратов, применяемых для защиты растений от вредителей и болезней. |
ствляют общепринятым методом, при пероральном введении взвесь бактерий в физрастворе вводят животным натощак с помощью металлического зонда с тупым концом. При интра-назальном введении взвесь бактерий вводят под легким эфирным наркозом мышам в количестве 0,007—0,05 мл и крысам 0,05—0,2 мл.
Расчет числа микробных клеток на дозу при всех способах введения проводят по оптическому стандарту мутности. Каждый штамм вводят животным в 5—8 дозах, на каждую дозу используют не менее 6 животных, контрольной группе животных (по 6 штук) водят физиологический раствор. Наблюдение за животными проводят в течение 15 дней, после чего производят расчет ЛД5о-
Оцеика штаммов по вирулентности проводится по таблице 1 2, согласно которой все изученные штаммы условно подразделяются на высоковирулентные, умеренно вирулентные и не вирулентные.
|
Таблица 1 Распределение штаммов микроорганизмов по группам вирулентности | |||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||
относится к высоковирулентным или умеренно вирулентным, то проведение дальнейших исследований этого штамма не целесообразно. В этом случае выдается заключение о вирулентных свойствах штамма и невозможности его использования в сельском хозяйстве.
Не вирулентные штаммы подвергаются дальнейшим исследованиям.
Для выявления инвазионных свойств изучаемых культур
микробов используют перевиваемую культуру клеток Нер-2.
Клетки выращивают на покровных стеклах размером 0,5Х ХКО см, помещенных в стерильные пробирки. После получения монослоя среду роста в пробирках заменяют на среду поддержки, содержащую 1 млрд, микробных клеток в 1 мл. Пробирки инкубируют в термостате при 37° С в течение 3-х дней с ежедневным учетом цитотоксического действия изучаемых культур методом микроскопии под малым увеличением. В целях определения способности микроорганизмов проникать в клетки Нер-2 каждые 24 часа вынимают из пробирок покровные стекла с монослоем, фиксируют их в растворе Буавена, а затем окрашивают по Романовскому-Гимза.
Об инвазивности культур судят также по их способности проникать внутрь тканей органов животных при заражении изучаемыми микроорганизмами.
При определении токсичности микроорганизмов отмытую физиологическим раствором их суточную культуру в различных разведениях прогревают на водяной бане в течение 1 часа при 60°, после чего вводят мышам внутрибрюшинно в различных дозах. Учет гибели животных проводят в течение 15 дней, после чего рассчитывают ЛД50 по приведенной выше формуле.
Оценка штаммов по токсичности убитых культур проводится по таблице 2, согласно которой все изученные штаммы условно подразделяются на высоко токсичные, средней токсичности, мало токсичные и не токсичные.
|
Таблица 2 Распределение штаммов микроорганизмов по группам токсичности | ||||||||||
|
Токсигенность исследуемых микробов, т. е. способность образовывать и выделять в питательную среду токсины, определяют путем внутрибрюшинного введения белым мышам фильтратов экзотоксина, получаемых путем фильтрования через бакте-
риальные фильтры 3-х и 7-и-суточных бульонных культур исследуемых микробов. Оценку токсигенности штаммов проводят согласно таблице 3.
Таблица 3
|
Значение ЛД50 фильтратов микробов при различных путях введения мышам (в мл/животное) | ||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||
Распределение микробов по группам токсигенности
ным таблицам к высоко токсичным и средней токсичности, к высоко токсигенным и средней токсигенности дальнейшим гигиеническим исследованиям не подлежат. В заключении указывается на непригодность этих штаммов для использования в сельском хозяйстве. Мало токсичные и не токсичные штаммы, мало токсигенные и не токсигенные штаммы микроорганизмов, предлагаемые для применения в качестве средств защиты растений, подлежат дальнейшим исследованиям по определению их инфективности, аллергенности и т. д. согласно схеме.
Инфективность определяют путем изучения взаимодействия между макроорганизмом и исследуемыми бактериями с учетом возможных естественных путей поступления последних в организм. С этой целью белым мышам вводят как однократно, так и длительно в течение 2-х месяцев, суточную агаровую культуру микроорганизмов per os и через верхние дыхательные пути. Во всех случаях животных перед опытом подвергают бактериологическому обследованию.
Доза микроорганизмов, используемых для однократного заражения, подбирается с учетом результатов исследований по определению вирулентности микробов (ЛДэо): испытываются дозы (не менее 2-х), не вызывающие гибели ни одного из зараженных животных при аналогичном способе введения. При
9
1
Настоящие методические указания не касаются методов гигиенической оценки микробных родентицидов.
3
2
Критерии оценки штаммов по показателям вирулентности, токсичности и токеигенности разработаны во ВНИИГИНТОКС’е на основе данных литературы, а также на основе полученных Т. Г. Омельянец данных экспериментальных и эпидемиологических исследований.
7