ГОСТ 25383-82
Животные сельскохозяйственные. Методы лабораторной диагностики кокцидиоза
Купить ГОСТ 25383-82 — бумажный документ с голограммой и синими печатями. подробнее
Распространяем нормативную документацию с 1999 года. Пробиваем чеки, платим налоги, принимаем к оплате все законные формы платежей без дополнительных процентов. Наши клиенты защищены Законом. ООО "ЦНТИ Нормоконтроль"
Наши цены ниже, чем в других местах, потому что мы работаем напрямую с поставщиками документов.
Способы доставки
- Срочная курьерская доставка (1-3 дня)
- Курьерская доставка (7 дней)
- Самовывоз из московского офиса
- Почта РФ
Распространяется на все виды сельскохозяйственных животных и птиц и устанавливает методы лабораторной диагностики кокцидиоза
Ограничение срока действия снято: Постановление Госстандарта № 624 от 30.06.92
Оглавление
1 Методы отбора проб
2 Методы исследований
| Дата введения | 01.01.1983 |
|---|---|
| Добавлен в базу | 01.09.2013 |
| Актуализация | 01.01.2021 |
Этот ГОСТ находится в:
- Раздел Экология
- Раздел Электроэнергия
Организации:
| 11.08.1982 | Утвержден | Госстандарт СССР | 3154 |
|---|
Domectic animals. Methods of laboratory diagnostics of coccidiosis
Чтобы бесплатно скачать этот документ в формате PDF, поддержите наш сайт и нажмите кнопку:

стр. 1

стр. 2

стр. 3

стр. 4

стр. 5

стр. 6

стр. 7

стр. 8

стр. 9

стр. 10

стр. 11
стр. 12

стр. 13
ГОСУДАРСТВЕННЫЙ СТАНДАРТ
СОЮЗА ССР
ЖИВОТНЫЕ СЕЛЬСКОХОЗЯЙСТВЕННЫЕ
МЕТОДЫ ЛАБОРАТОРНОЙ ДИАГНОСТИКИ КОКЦИДИОЗА
ГОСТ 25383-82 (СТ СЭВ 2547-80)
Издание официальное
ГОСУДАРСТВЕННЫЙ КОМИТЕТ СССР ПО СТАНДАРТАМ
Москва
РАЗРАБОТАН Министерством сельского хозяйства СССР ИСПОЛНИТЕЛИ
Б. А. Тимофеев, И. А. Кобловз, Л. М. Шалоза ВНЕСЕН Министерством сельского хозяйства СССР
УТВЕРЖДЕН И ВВЕДЕН В ДЕЙСТВИЕ Постановлением Государственного комитета СССР по стандартам от 11 августа 1982 г. № 3154
(Продолжение изменения к ГОСТ 25383—82)
2.2 3.1. У домашней птицы наличие 50000 ооцист на 1 г кала не влияет на зоотехнические показатели цыплят, обнаружение более 100000 оосцист на 1 г кала свидетельствует о заражении средней степени, обнаружение ооцист в количестве более 300000 на 1 г кала — о высокой степени заражении и малой эффективности применяемого препарата.
У крупного рогатого скота и овец наличие до 1000 ооцист в I г кала свидетельствует о низкой степени заражения, до 5000 — о средней степени заражения, более 5000 — о высокой степени заражения,
У кроликов наличие до 10000 ооцист на 1 г кала служит признаком низкой степени заражения, до 100000 — высокой степени заражения, более 100000 — очень высокой степени заражения».
Пункт 2.3. Наименование изложить в новой редакции: «2.3. Метод исследования павших или убитых животных».
Пункт 2.3.1.1. Заменить ссылку: ГОСТ 10073 —75 на ГОСТ 25330-82.
Пункт 2.3.2.1. Первый абзац. Заменить слова: «патологически измененные части кишок» на «исследуемые части кишок».
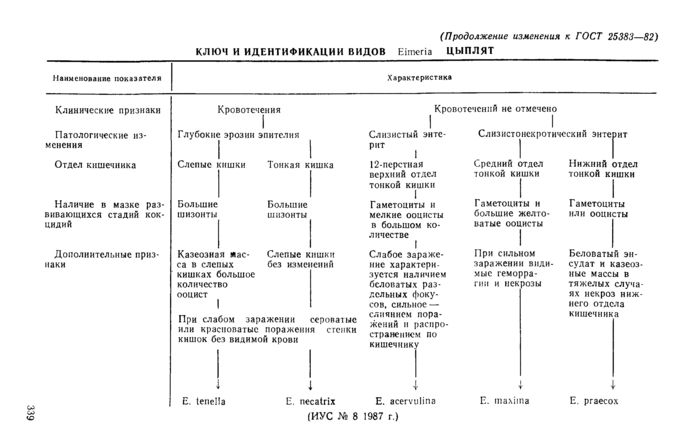
Пункт 2.3 3.1 изложить в новой редакции: «2.3.3.1. Для своевременной диагностики кокцидиоза у домашней птицы подсчет ооцист проводят один раз в 7 дней, начиная в двух-, трехнедельного возраста цыплят. Из каждой группы вскрывают по 4—6 ослабленных птиц. Исследуют соскобы со слизистой и содержимое кишечника в месте перехода дненадцатиперстной кишки в тощую, середины тонкого отдела кишечника и слепых кишок. Несколько капель наносят на предметное стекло, разбавляют водой и накрывают покровным стеклом. Просматривают под микроскопом 20 полей зрения, определяют среднее количество ооцист на, одно поле зрения и проводят идентификацию кокцидий вида Ei.meria в соответствии с ключом идентификации, представленном на схеме. В зависимости от клинических проявлений, степени и характера изменений отделов кишечника, локализации поражения и стадий развития кокцидий определяют виды ооцист Е. tenella, Е. necatrix, Е. acervulina^. maxima, Е. ргаесох. (см. схему. См. с. 339)ъ.
Раздел 2 дополнить пунктами — 2.3.4, 2.3.4.1:
«2.3.4. Оценка результатов
2.3.4.1. Наличие ооцист видов Е. acervulina менее 50 и ооцист Е. tenella, Е. necatrix, Е. maxima менее 5 кокцидий в поле зрения — признак низкой степени заражения.
При установлении разных стадий развития кокцидий в большом количестве у павших птиц или животных кокцидиоз считают причиной падежа».
Пункт 2 4 1.1. Исключить слова: «и дополнительно: счетную камеру Горяева или Мак Мастера; гомогенизатор электрический».
Пункт 2.4.2.1 изложить в новой редакции: «2.4.2.1. Пробу подстилки хорошо перемешивают и взвешивают 100 г. Заливают 1 дм3 воды, выдерживают до набухания содержимого и тщательно размешивают. Полученную суспензию фильтруют через марлю, осадок отбрасывают. Фильтрат тщательно перемешивают и отбирают 100 см3 в центрифужную пробирку. Центрифугируют в течение 5 мин с частотой вращения 5000 мин-1. Жидкую часть сливают, к осадку добавляют 50 см3 флотационного раствора, тщательно перемешивают и центрифугируют в течение 5 мин с частотой вращения 5000 мин-1. Из пробирки снимают при помощи петли поверхностный слой и в счетной камере Горяева подсчитывают количество ооцист во всех 225 квадратах. Полученное число ооцист умножают на 5555, и определяют'количество ооцист в 1 г подстилки».
Пункты 2.4.3, 2.4.5 исключить.
(Продолжение см. с. 339)
338
Наименование показателя
Клинические признаки
Патологические изменения
Отдел кишечника
(Продолжение изменения к ГОСТ 25383—82) КЛЮЧ И ИДЕНТИФИКАЦИИ ВИДОВ Eimeria ЦЫПЛЯТ
Кровотечения Глубокие эрозии эпителия
Слепые кишки Тонкая кишка
Наличие в мазке раз- Большие вивающихся стадий кок- шизонты цидий
Большие
шизонты
Характеристика
Кровотечений не отмечено
Слизистый энтерит
Слизистонекротический энтерит
Дополнительные признаки
Казеозная мае- Слепые кишки
са в слепых без изменений
кишках большое
количество
ооцист
При слабом заражении сероватые или красноватые поражения стенки кишок без видимой крови
12-перстная верхний отдел тонкой кишки
I
Гаметоциты и мелкие ооцисты в большом количестве
I
Слабое заражение характеризуется наличием беловатых раздельных фокусов, сильное — слиянием поражений и распространением по кишечнику
Средний отдел тонкой кишки
Нижний отдел тонкой кишки
Гаметоциты и большие желтоватые ооцисты
При сильном заражении видимые геморра
гии и нек
розы
Гаметоциты или ооцисты
Беловатый эн-судат и казеозные массы в тяжелых случаях некроз нижнего отдела кишечника
i
I
со
со
«2
|
Е. tenella |
Е. necatrix Е. acervulina |
Е. maxima |
Е. ргаесох |
|
(ИУС № 8 1987 г.) |
УДК 636 : 576.8.07 : 006.354 Группа С79
I
ГОСУДАРСТВЕННЫЙ СТАНДАРТ СОЮЗА ССР
ЖИВОТНЫЕ СЕЛЬСКОХОЗЯЙСТВЕННЫЕ
25383-82
(СТ СЭВ 2547—80J
Методы лабораторной диагностики кокцидиоза
DuineMi'' Miiiruils. .Methods of laboratory diagnostics
of coccidiosis
—■—■ чц i■ ni—щи—■uni—ишимии—nriTiii ■—mi——i—ti~——ШШГ .nnimui4M mi rm— " •»—Д—^мЯ|*—***
Постановлением Государственного комитета СССР по стандартам от 11 августа 1982 г. № 3154 срок действия установлен
с 01.01.83 до 01.01.88
Несоблюдение стандарта преследуется по закону
Настоящий стандарт распространяется на все ви iu сельскохозяйственных животных и птиц и устанавливает методы лабораторной диагностики кокцидиоза.
Стандарт полностью соответствует СТ СЭВ 2547—80.
1. МЕТОДЫ ОТБОРА ПРОБ
1.1. Для проведения исследований отбирают пробы кала животных, пробы патологического материала, а также пробы по;-стнлкн.
1.2. Пробы кала берут от живых п павших животных.
1.2.1. От живых животных пробы кала берут у животных из одного стада, станка или же стаи с учетом числа животных в группе.
Если число животных в группе менее 100, кал берут не менее чем от 20 животных; в группе с числом животных от 101 до 500 — от 10%; с числом животных от 501 до 1000 — от 5% и с числом животных свыше 1000—от 2% животных.
1 2.2. Кал берут из прямой кишки животного. От каждой головы крупного рогатого скота берут 50 г кала, овец, коз и свиней -20 г, домашней птицы и кроликов— 10 г.
Отобранные пробы смешивают, получая объединенную пробу.
Издаике официальное
В случае проведения исследований кала от каж юго животного смешивание проб нс производят.
Перепечатка воспрещена
Издательство стандартов, 1982
Стр. 2 ГОСТ 25383-82
Допускается отбирать пробы кала с пола станков, выгулов и т. п.
1.2.3. От павших животных кал берут из конца ободочной кишки или из прямой кишки в количествах, указанных в п. 1.2.2.
1.2.4. Отобранные пробы кала упаковывают в полиэтиленовый пакет или помещают в хорошо закрывай: щийся сосуд.
До проведения исследований пробы хранят при температуре 2—4°С или консервируют, добавляя 2,5%-ный раствор бихромата калия.
1.3. Пробы патологического материала отбирают при вскрытии павших животных.
Пробы берут из патологоанатомически измененных частей кишки, у кроликов—также из желчного пузыря и паренхимы печени, у гусей — из почек. Если пробы нельзя исследовать сразу, кишку разрезают в продольном направлении и помещают в 2,5%-ный раствор бихромата калия. Из печени кроликов вырезают беловатые очаги и консервируют их тем же способом. Пробы для гистологического исследования хранят в 10%-ном растворе формальдегида.
1.4. Пробы подстилки в зависимости от размера помещения отбирают не менее чем из десяти разных мест в бумажный или полиэтиленовый пакет.
1.5. Ко всем отобранным пробам прилагают сопроводительный документ с указанием:
количества проб;
размера поголовья;
системы содержания;
возраста и пола животных;
категории упитанности;
заболеваемости или смертности;
продолжительности заболевания;
способа проведенной санитарной обработки:
даты взятия материала для исследования. 1
ГОСТ 25383-82 Стр. 3
центрифугу марки М-24 или других марок с частотой вращения 2000 об/мин;
сита с ячейками размером 0,5—1,0 мм1;
стаканы стеклянные вместимостью 150—200 см3 по ГОСТ 10394-75;
чашки стеклянные лабораторные по ГОСТ 10973-75; стекла предметные по ГОСТ 9284-75 и покровные по ГОСТ 6672—75;
пипетки градуированные вместимостью 50 см3 по ГОСТ 20292-74;
посуду лабораторную фарфоровую; воронки стеклянные по ГОСТ 8613-75; штатив для пробирок; петли;
вату Iигроскопическую медицинскую по ГОСТ 5556-75; натрий хлористый по ГОСТ 4233-77; цинк сернокислый по ГОСТ 4174-77; магний сернокислый по ГОСТ 4523-77; воду дистиллированную по ГОСТ 6709-72.
2.1.2. Подготовка к исследованию
2.1.2.1. Приготовление раствора Бреза
Готовят насыщенный раствор сульфата магния и насыщенный раствор тиосульфата натрия. Растворы смешивают с дистиллированной водой в соотношении 3:3:1.
2.1.2.2. Приготовление флотационного раствора
К 1 л горячей дистиллированной воды добавляют избыток соответствующего химического реактива (насыщенного раствора хлористого натрия пли сульфата цинка или раствора Бреза), выдерживают в течение 12 ч и фильтруют через вату в чистую склянку. Плотность флотационного раствора должна составлять приблизительно 1,3 г/см3.
2.1.3. Проведение исследования
2.1.3 1. Из пробы выделяют навеску кала массой 3 г, заливают в ступке 15—20 см3 воды, размешивают до жидкой консистенции и процеживают через сито и воронку в центрифужные пробирки.
Пробирки центрифугируют с частотой вращения 2000 об/мин в течение 1—2 мин. Жидкую часть сливают, затем добавляют 10 см3 флотационного раствора и тщательно перемешивают палочкой так, чтобы не образовались пузыри. Не рекомендуется встряхивать содержимое пробирки. Пробирки с флотационным раствором снова центрифугируют, как указано выше.
С помощью петли из каждой пробирки берут по три капли раствора и наносят на предметное сгекло. Покровное стекло используют лишь для рассеяния капли в случае недостаточной обзорности поля зрения. При массовых исследованиях одной и той же пробы допускается не обжигать петлю после каждого переноса
Стр, 4 ГОСТ 25383-82
раствора на предметное стекло, достаточно лишь промыть ее несколькими резкими движениями в пробирке с водой. Однако в начале и конце исследования петлю необходимо обжигать.
Определение наличия ооцист проводят под микроскопом, используя соответствующий определитель.
2.2. Метод определения количества ооцист в кале
2.2.1. Аппаратура, материалы и реактивы
2.2.1.1. Для проведения исследования применяют аппаратуру,, материалы и реактивы, указанные в п. 2.1.1, и дополнительно счетную камеру Горяева или Мак-Мастера.
2.2.2. Проведение исследования
2.2.2.1. Исследуемую пробу кала тщательно гомогенизируют. Взвешивают от 3 до 5 г кала (в зависимости от необходимости точности определения) и размешивают в стакане с 45 см3 воды. Полученную таким образом суспензию фильтруют через сито. 10 см3 фильтрата помещают в центрифужную пробирку и центрифугируют с частотой вращения 2000 об/мин в течение 2 мин.
Жидкую часть сливают, к осадку добавляют 10 см3 флотационного раствора и тщательно перемешивают. Полученной суспензией заполняют счетную камеру. Допускается при отсутствии счетной камеры использовать предметное стекло, на которое наносят 0,15 см3 суспензии и накрывают покровным стеклом. Заполненную камеру или предметное стекло с 0,15 см3 суспензии выдерживают в течение 2 мин, чтобы ооцисты могли подняться к поверхности, и подсчитывают количество ооцист. Полученное число, умноженное на 100, представляет собой содержание ооцист в 1 г кала.
Для более точного определения допускается использовать несколько камер и ооцисты подсчитывают в нескольких камерах. При использовании камеры Горяева ооцисты подсчитывают во всех 225 квадратах и полученную сумму умножают на коэффициент 1111. Полученное количество показывает число ооцист в 1 см3 взвеси.
2.2.3. Обработка результатов
2.2.3.1. У домашней птицы обнаружение единичных ооцист (0—100 ооцист на 1 г кала) свидетельствует о наличии кокцидий в окружающей среде и течении субклинического заболевания.
Наличие 101—1000 ооцист в 1 г кала свидетельствует:
для Eimeria tenella и Eimeria necatux — о заражении средней степени;
для Eimeria maxima — о сильном заражении;
для Е. acervulina — о слабом заражении.
Наличие свыше 1000 ооцист в 1 г кала — признак сильного заражения.
У крупного рогатого скота и овец наличие до 1000 ооцист в 1 г кала (для Е. bovis и Е. zuetnii) свидетельствует о слабой инфек-
ГОСТ 25383-82 Стр. 5
ции, до 5000 — об инфекции средней тяжести, свыше 5000 — о сильной инфекции.
Для определения вида Eimeria используют существующие определители.
У кроликов наличие до 10000 ооцист на 1 г кала служит признаком слабой инфекции, до 100000 — сильной инфекции, свыше 100000 — очень сильной инфекции.
2.3. Метод исследования павших животных
Сущность метода заключается в выявлении и определении с помощью микроскопа различных стадий кокцидий в пробах, взятых при паталогоанатомическом вскрытии животных. У животных исследуют желудочно-кишечный тракт, при этом учитывают наличие в крови паталогоанатомических изменений, локализацию, а также размер, форму, цвет, структуру стадий развития.
2 3.1. Аппаратура и реактивы
2.3.1.1. Для проведения исследования применяют:
ножницы по ГОСТ 21239-77;
пинцеты по ГОСТ 21241-77;
чашки лабораторные стеклянные по ГОСТ 10973-75;
пипетки пастеровские;
натрий хлористый по ГОСТ 4233-77;
воду дистиллированную по ГОСТ 6709-72.
2.3.2. Проведение исследования
2.3.2.1. Паталогически измененные части кишок кладут в чашки Петри или другую посуду и разрезают в продольном направлении. Несколько капель содержимого кишки разбавляют на предметном стекле физиологическим раствором, накрывают покровным стеклом и рассматривают под микроскопом. Можно также соскабливать краем предметного стекла слизистую оболочку пораженной кишки. Соскоб разбавляют физиологическим раствором и рассматривают под микроскопом для установления наличия меро-зоитов, шизонтов или гамет кокцидий.
У павших кроликов исследуют беловатые очаги в печени и содержимое желчного пузыря на наличие ооцист кокцидий Eimeria. Очаги разрезают и с помощью пастеровской пипетки наносят их содержимое на предметное стекло. Накрыв препарат покровным стеклом, рассматривают его под микроскопом. Аналогичным образом поступают и с поражениями почек гусей.
2.3 3. Обработка результатов
2.3.3.1. В случае установления единичных стадий развития кокцидий заболевание кокцидиозом рассматривается как вторичная инфекция, которая не играет главную роль в падеже животных. При установлении разных стадий развития патогенных видов кокцидий в большом количестве и исключении других инфекционных заболеваний кокцидиоз считают причиной падежа животных
Стр. 6 ГОСТ 25383-82
2.4. Метод исследования подстилки на наличие ооцист кокци-дий
Сущность метода заключается в подсчете количества ооцист в 1 г подстилки и определении по данным подсчета тяжести клинического течения кокцидиоза и резистентности кокцидий к используемому антикокцидиозному препарату.
2.4.1. Аппаратура, материалы и реактивы
2.4.1.1. Для проведения исследования применяют аппаратуру, материалы и реактивы, указанные в п. 2.1.1, и дополнительно:
счетную камеру Горяева или Мак-Мастера;
гомогенизатор электрический.
2.4.2. Проведение исследования
2.4.2.1. Пробу подстилки хорошо перемешивают. Взвешивают 10 г пробы с погрешностью не более 0,02 г и перекладывают в стакан с 100 см3 воды, ставят в холодильник, выдерживают в течение 12 ч и гомогенизируют 2—3 мин в электрическом гомогенизаторе с частотой вращения 2000 об/мин. Полученную суспензию фильтруют в течение 5 мин. Жидкую часть сливают, к осадку добавляют 10 см3 флотационного раствора и тщательно перемешивают, встряхивая пробирку. Наполняют счетную камеру или помещают 0,15 см3 суспензии на предметное стекло, накрывают ее покровным стеклом и выдерживают в течение 2 мин. Число ооцист умножают на коэффициент 67, что представляет собой количество ооцист в 1 г подстилки.
2.4.3. Обработка результатов
2.4.3.1. Определение вида кокцидий проводят согласно соответствующему определителю.
При наличии до 5000 ооцист Е. acervulina в 1 г подстилки не придают им никакого клинического значения. Наличие до 5000 ооцист Е. tenella или Е. nccatux в 1 г подстилки свидетельствует о слабом течении кокцидиоза у содержавшихся на этой подстилке цыплят или же о снижении действия используемого кокцидиоста-тика. Наличие 1000 ооцист Е. maxima в 1 г подстилки свидетельствует о клиническом течении кокцидиоза и недостаточной эффективности аптикокцидиозного препарата.
2.5. Метод установления интенсивности инфекции
2.5.1. Проведение исследования
2.5.1.1. Интенсивность инфекции ооцистами Eimeria или другими формами развития этого рода устанавливают подсчетом их в микроскопическом препарате и делением полученного числа на 3.
2.5.2. Обработка результатов
2.5.2.1. Подсчитанное число ооцист делят на 3. Это число будет равным числу паразитов в 1 г кала. В зависимости от этого дтя самых патогенных видов Eimeria устанавливают следующие степени интенсивности инфекции:
ГОСТ 25383-82 Стр. 7
слабая инфекция ( + ) — 1—10 ооцист на 1 г кала; средняя инфекция ( + +) —11—100 ооцист на 1 г кала; сильная инфекция ( + + +)—больше 100 ооцист на 1 г кала. При оценке интенсивности инфекции следует учитывать не только наличие ооцист различных видов Eimeria, но и присутствие других паразитов.
Группа С79
Изменение № 1 ГОСТ 25383-82 Животные сельскохозяйственные. Методы лабораторной диагностики кокцидиоза
Утверждено и введено в действие Постановлением Государственного комитета СССР по стандартам от 27.05.87 № 1714
Дата введения 01.01.88
Пункты 2.1.1.1, 2.1.2.1 изложить в новой редакции:
42.1.1.1. Для проведения исследования применяют:
микроскоп с окулярным микрометром марки МБИ-3 по ГОСТ 8284—78; весы лабораторные общего назначения по ГОСТ 24104-80 с наибольшие пределом взвешивания 200 г;
центрифугу с частотой вращения 5000 мин-1;
25336—£2;
чашки стеклянные лабораторные по ГОСТ 25336-82;
стекла предметные по ГОСТ 9284-75 и покровные по ГОСТ 6672-75;
пипетки градуированные исполнений 1, 2, 4, 5, 6, 2-го класса точности вме
стаканы стеклянные вместимостью 150—200 см3 и 1000 см3 по ГОСТ
стимостью 50 см3 по ГОСТ 20292-74; посуду лабораторную фарфоровую; воронки стеклянные по ГОСТ 25336-82; штатив для пробирок; петли;
марлю медицинскую по ГОСТ 9442-77;
вату гигроскопическую медицинскую по ГОСТ 5556-81;
фильтры беззольные по ГОСТ 12026-76;
натрий хлористый по ГОСТ 4233-77;
воду дистиллированную по ГОСТ 6709-72.
2.1 2.1. Приготовление флотационного раствора
К 1 дм3 горячей воды добавляют 400 г хлористого нагрия, тщательно размешивают, выдерживают 30 мин и фильтруют через вату или складчатым фильтр в чистую склянку. Плотность флотационного раствора дол киа составлять 1,3 г/см3».
Пункт 24.2,2 исключить.
Пункт 24.34 изложить в новой редакции: «24.34. Из пробы выделяют па-' ьеску кала массой 3—5 г, помещают навеску в ступку, заливают 15—20 см золы. размешивают до жидкой консистенции и процеживают через марлю в-центрифужные пробирки.
Пробирки центрифугируют в течение 5 мин с частотой вращения. 5000 мин-1. Жидкую часть сливают, затем добавляют 10 см3 флотационн jro раствора, тщательно перемешивают палочкой и повторно центрифугируют. При помощи петли из каждой пробирки берут по три капли раствора, наносят на предметное стекло и накрывают покровным стеклом. Определяют налете социст под микроскопом. После проведения одного исследования петлю обжигают»
Пункт 2.24 4. Исключить слова: «или Мак. Мастера».
Пункты 22.2 1, 2.2.34 изложить в новой редакции: «22.2.1. Взвешивают
5 г кала, взятого из отобранной пробы, и тщательно размешивают в ступке с 45^см3 воды. Полученную суспензию фильтруют через один слой марли, осадок отбрасывают. 10 см3 фильтрата помещают в центрифужную пробирку и центрифугируют в течение 5 мин с частотой вращения 5000 мин-1. Жидкую часть сливают, к осадку добавляют 10 см3 флотационного раствора, тщательно перемешивают и еще раз центрифугируют в течение 5 мин с частотой вращения 5000 мин-1. Из пробирки снимают при помощи петли поверхностный слой жидкости и в счетной камере Горяева подсчитывают количество ооцист во всех 225 квадратах. Для определения количества ооцист в 1 г кала, подсчитанное з камере Горяева, число ооцист умножают на 1111.
(Продолжение см. стр. 338)
337
1
МЕТОДЫ ИССЛЕДОВАНИЙ
2.1. Методы определения наличия ооцист в кале
Сущность метода заключается в определении с помощью микроскопа наличия ооцист кокцидий, всплывающих на поверхность раствора с исследуемым материалом.
2.1.1. Аппаратура, материалы и реактивы 2.1 Л Л. Для проведения исследования применяют: микроскоп с окулярным микрометром марки МБИ-3 по ГОСТ
8284—78,
весы лабораторные по ГОСТ 24104-80;