ГОСТ 20235.2-74
Мясо кроликов. Методы бактериологического анализа
Купить ГОСТ 20235.2-74 — бумажный документ с голограммой и синими печатями. подробнее
Распространяем нормативную документацию с 1999 года. Пробиваем чеки, платим налоги, принимаем к оплате все законные формы платежей без дополнительных процентов. Наши клиенты защищены Законом. ООО "ЦНТИ Нормоконтроль"
Наши цены ниже, чем в других местах, потому что мы работаем напрямую с поставщиками документов.
Способы доставки
- Срочная курьерская доставка (1-3 дня)
- Курьерская доставка (7 дней)
- Самовывоз из московского офиса
- Почта РФ
Распространяется на мясо кроликов и устанавливает методы бактериологического анализа, предусматривающие определение аэробов (сальмонелл, бактерий рода Эшериши, стафилококков, стрептококков, листерий, пастерелл) и анаэробов (ботулизм, перфрингренс).
Переиздание. Май, 1981 г.
Оглавление
1 Методы отбора образцов
2 Аппаратура, материалы, реактивы и питательные среды
3 Подготовка к анализу
4 Проведение анализа
| Дата введения | 01.07.1975 |
|---|---|
| Добавлен в базу | 01.09.2013 |
| Актуализация | 01.01.2021 |
Этот ГОСТ находится в:
- Раздел Экология
- Раздел 07 МАТЕМАТИКА. ЕСТЕСТВЕННЫЕ НАУКИ
- Раздел 07.100 Микробиология
- Раздел 07 МАТЕМАТИКА. ЕСТЕСТВЕННЫЕ НАУКИ
- Раздел Электроэнергия
- Раздел 07 МАТЕМАТИКА. ЕСТЕСТВЕННЫЕ НАУКИ
- Раздел 07.100 Микробиология
- Раздел 07 МАТЕМАТИКА. ЕСТЕСТВЕННЫЕ НАУКИ
Организации:
| 02.10.1974 | Утвержден | Государственный комитет стандартов Совета Министров СССР | 2284 |
|---|
Meat of rabbit. Method of bacteriological analysis
- ГОСТ 7031-75 Песок кварцевый для тонкой керамики
- ГОСТ 4233-77 Реактивы. Натрий хлористый. Технические условия
ГОСТ 492-73Никель, сплавы никелевые и медно-никелевые, обрабатываемые давлением. Марки. Заменен на ГОСТ 492-2006.- ГОСТ 6709-72 Вода дистиллированная. Технические условия
- ГОСТ 1027-67 Реактивы. Свинец (II) уксуснокислый 3-водный. Технические условия
- ГОСТ 11773-76 Реактивы. Натрий фосфорно-кислый двузамещенный. Технические условия
- ГОСТ 12026-76 Бумага фильтровальная лабораторная. Технические условия
- ГОСТ 13739-78 Масло иммерсионное для микроскопии. Технические требования. Методы испытаний
- ГОСТ 13805-76 Пептон сухой ферментативный для бактериологических целей. Технические условия
- ГОСТ 1770-74 Посуда мерная лабораторная стеклянная. Цилиндры, мензурки, колбы, пробирки. Общие технические условия
- ГОСТ 19342-73 Печень крупного рогатого скота и свиней замороженная. Технические условия
- ГОСТ 20235.0-74 Мясо кроликов. Методы отбора образцов. Органолептические методы определения свежести
- ГОСТ 245-76 Реактивы. Натрий фосфорнокислый однозамещенный 2-водный. Технические условия
- ГОСТ 3118-77 Реактивы. Кислота соляная. Технические условия
- ГОСТ 3164-78 Масло вазелиновое медицинское. Технические условия
- ГОСТ 3204-76 Реактивы. Кальций фосфорнокислый двузамещенный 2-водный. Технические условия
- ГОСТ 3773-72 Реактивы. Аммоний хлористый. Технические условия
- ГОСТ 4159-79 Реактивы. Йод. Технические условия
- ГОСТ 4198-75 Реактивы. Калий фосфорнокислый однозамещенный. Технические условия
- ГОСТ 4201-79 Реактивы. Натрий углекислый кислый. Технические условия
- ГОСТ 4204-77 Реактивы. Кислота серная. Технические условия
- ГОСТ 4208-72 Реактивы. Соль закиси железа и аммония двойная сернокислая (соль Мора). Технические условия
- ГОСТ 4209-77 Реактивы. Магний хлористый 6-водный. Технические условия
- ГОСТ 4220-75 Реактивы. Калий двухромовокислый. Технические условия
- ГОСТ 4232-74 Реактивы. Калий йодистый. Технические условия
- ГОСТ 4234-77 Реактивы. Калий хлористый. Технические условия
- ГОСТ 4328-77 Реактивы. Натрия гидроокись. Технические условия
- ГОСТ 5833-75 Реактивы. Сахароза. Технические условия
- ГОСТ 5962-67 Спирт этиловый ректификованный. Технические условия
- ГОСТ 6038-79 Реактивы. D-глюкоза. Технические условия
- ГОСТ 61-75 Реактивы. Кислота уксусная. Технические условия
- ГОСТ 6259-75 Реактивы. Глицерин. Технические условия
- ГОСТ 6672-75 Стекла покровные для микропрепаратов. Технические условия
- ГОСТ 6691-77 Реактивы. Карбамид. Технические условия
- ГОСТ 779-55 Мясо-говядина в полутушах и четвертинах. Технические условия
- ГОСТ 8253-79 Мел химически осажденный. Технические условия
- ГОСТ 9284-75 Стекла предметные для микропрепаратов. Технические условия
- ГОСТ 4599-73 Индикаторы. Феноловый красный
- ГОСТ 5850-72 Индикаторы. Фенолфталеин
- ГОСТ 5853-51 Индикаторы. Метиловый красный
- ГОСТ 10090-74 Спиртовки лабораторные стеклянные. Технические условия
- ГОСТ 10394-72 Стаканы и колбы стеклянные лабораторные. Технические условия
- ГОСТ 10515-75 Пробирки стеклянные. Технические условия
- ГОСТ 10973-75 Чашки стеклянные лабораторные
- ГОСТ 4-75 Углерод четыреххлористый технический. Технические условия
- Показать все
Чтобы бесплатно скачать этот документ в формате PDF, поддержите наш сайт и нажмите кнопку:

стр. 1

стр. 2

стр. 3

стр. 4

стр. 5

стр. 6

стр. 7

стр. 8

стр. 9

стр. 10

стр. 11

стр. 12

стр. 13

стр. 14

стр. 15

стр. 16

стр. 17

стр. 18

стр. 19
стр. 20
стр. 21

стр. 22

стр. 23

стр. 24

стр. 25

стр. 26

стр. 27

стр. 28

стр. 29

стр. 30
УДК 637.517.92 : 576.8.07:006.354 Группа Н19
ГОСУДАРСТВЕННЫЙ СТАНДАРТ СОЮЗА ССР
ГОСТ
20235.2-74
МЯСО КРОЛИКОВ Методы бактериологического анализа
Meat of rabbits.
Methods of bacteriological analysis
Постановлением Государственного комитета стандартов Совета Министров СССР от 2 октября 1974 г. № 2284 срок введения установлен
с 01.07.75
до 01.07.90
Проверен в 1979 г. Срок действия продлен
Несоблюдение стандарта преследуется по закону
Настоящий стандарт распространяется на мясо кроликов и устанавливает методы бактериологического анализа, предусматривающие определение аэробов (сальмонелл, бактерий рода Эше-риши, стафилококков, стрептококков, листерий, пастерелл) и анаэробов (ботулизм, перфрингренс).
1. МЕТОДЫ ОТБОРА ОБРАЗЦОВ
1.1. Отбор образцов проводят по ГОСТ 20235.0-74.
2. АППАРАТУРА, МАТЕРИАЛЫ, РЕАКТИВЫ И ПИТАТЕЛЬНЫЕ СРЕДЫ
2.1. Для проведения анализа применяют: автоклав электрический по ГОСТ 9586-75; котлы с паровой рубашкой;
аппарат Коха;
петлю для бактериологического анализа; баню водяную;
весы лабораторные по ГОСТ 24104-80; воронки стеклянные по ГОСТ 8613-75; дистиллятор; дуршлаг;
колбы стеклянные лабораторные по ГОСТ 10394-72; 1 2
ГОСТ 20235.2-74 Стр. 2
кристаллизаторы по ГОСТ 10973-75; лоток;
лупу по ГОСТ 8309-75; рН-метр;
микроскоп по ГОСТ 8284-78; мясорубку бытовую;
ножницы прямые, изогнутые длиной 14 см; нож;
осветитель ОИ-19; пинцеты;
прибор для счета колоний; пластинку с сеткой для счета колоний; пеналы металлические для пипеток;
поплавки для пробирок и колб длиной 20, 45 и 75 мм и диаметром соответственно 5, 9 и 10 мм; петледержатели;
проволоку из никелевых сплавов диаметром 0,3—0,5 мм по ГОСТ 492-73;
плитку электрическую;
пробирки стеклянные бактериологические по ГОСТ 10515-75; пипетки вместимостью 1, 2, 5 и 10 см3; пипетки пастеровские; скальпель;
стекла предметные по ГОСТ 9284-75; стекло покровное по ГОСТ 6672-75; спиртовки стеклянные по ГОСТ 10090-74; колбы стеклянные по ГОСТ 10394-72; стаканы стеклянные по ГОСТ 10394-72; ступки фарфоровые с пестиками;
термостат электрический для выращивания бактерий с автоматическим терморегулятором до температуры 50°С и с ценой деления 0,2°С;
флаконы стеклянные вместимостью 100—250 см3; холодильник бытовой электрический с температурой в камере 4—6°С;
холодильники походные (сумки);
цилиндры измерительные вместимостью 10, 100, 500 и 1000 см2 по ГОСТ 1770-74;
часы песочные на 1, 2 и 3 мин по ГОСТ 10576-74;
чашки Петри по ГОСТ 10973-75;
шкаф сушильный лабораторный;
штативы для пробирок;
бумагу фильтровальную по ГОСТ 12026-76;
вату медицинскую гигроскопическую по ГОСТ 5556-75;
нитки по ГОСТ 6309-80;
13
3.2.23. Приготовление полужидкого агара
К мясо-пептонному бульону, приготовленному по п. 3.2.2, добавляют 0,5% агара. Среда должна иметь pH 7,0—7,2. Среду стерилизуют 20 мин при температуре 120°С.
3.2.24. Приготовление плазмы крови
В пробирку вносят 2 см3 5%-ного раствора лимоннокислого натрия и 8 см3 только что полученной крови кролика. Нитратную кровь ставят на 18—20 ч в холодильник при температуре 4—6°С или подвергают центрифугированию при 3000 об/мин в течение 15 мин. В результате чего над осадком эритроцитов образуется прозрачный слой жидкости желтоватого цвета — плазмы, которую разводят физиологическим раствором 1: 4.
3.2.25. Приготовление дефибринированной крови
В колбу со стеклянными бусами сливают 8 см3 только что взятой крови кролика и непрерывно встряхивают в течение 10— 15 мин, в результате чего находящийся в крови фибрин выпадает в осадок и обволакивает бусы. Дефибринированную кровь сливают в другую колбу или пробирку. Слитая дефибринированная кровь утрачивает способность свертываться.
3.2.26. Приготовление среды с безоксирибонуклеиновой кислотой
В стерильный растопленный 2%-ный мясо-пептонный агар, приготовленный по п. 3.2.4 или по п. 3.2.5, добавляют натриевую соль дезоксирибонуклеиновой кислоты из расчета 2 г на 1 см9 среды. Перед добавлением дезоксирибонуклеиновой кислоты растворяют в дистиллированной воде, содержащей три—пять капель 1 и. раствора гидрата окиси натрия. Среду стерилизуют 30 ми» в водяной бане. В среду добавляют хлористый кальций из расчета 0,8 мг на 1 см3, разливают в чашки и подсушивают на воздухе. Среда должна иметь pH 8,6.
3.2.27. Приготовление кровяного агара
К ЮО мл расплавленного стерильного мясо-пептонного агара, приготовленного по п. 3.2.4 и охлажденного до температуры 45°С, стерильно прибавляют 5—10 см3 дефибринированной стерильна взятой крови лошади, кролика или барана. Готовую среду разливают в стерильные чашки Петри, дают ей застыть и подсушивают в термостате при температуре 37°С. Слой агара должен быть равномерно окрашен в красный цвет.
3.2.28. Приготовление среды Китт-Тароцци
500 г говяжьей печени режут на куски массой по 30—40 г, заливают водой и кипятят в течение 15—20 мин. Воду сливают, куски печени разрезают на кусочки массой 1,5—3,0 г, заливают водой, подщелоченной двууглекислым натрием до pH 7,2—7,4, и кипятят в течение 10—15 мин, не допуская бурного кипения. Общее количество добавленной воды 1000 см3. Затем печень промь»-22
ГОСТ 20235.2-74 Стр. 12
вают в дуршлаге под струей воды в течение 1 ч и два-три раза дистиллированной водой.
Кусочки печени раскладывают во флаконы, заливают водой и стерилизуют 20 мин при температуре 120°С.
Для приготовления среды Китт-Тароцци пробирки заполняют на 1,0—1,5 см кусочками печени, заливают мясо-пептонным бульоном, приготовленным по п. 3.2.2, с добавлением 1 г глюкозы. Высота слоя бульона 6—7 см в обычных пробирках, 9—10 см — в высоких. На поверхность среды в пробирке перед стерилизацией наслаивают 0,5—1 см3 вазелинового масла. Стерилизуют 20 мин при температуре 120°С.
3.2.29. Приготовление среды Вильсона-Блъра
На дистиллированной воде готовят 20%-ный раствор серноватистокислого натрия и 8%-ный раствор хлористого железа. Оба раствора кипятят.
100 см3 3%-ного мясо-пептонного агара, приготовленного по п. 3.2.4 или п. 3.2.5, растапливают на водяной бане и добавляют 1 г глюкозы, 10 см3 20%-ного раствора серноватистокислого натрия и' 1 см3 8%-ного раствора хлористого железа. Среду разливают в пробирки по 7 см3.
3.2.30. Приготовление кровяного агара Цейсслера
К ЮО см3 мясо-пептонного агара, приготовленного по п. 3.2.4 или п. 3.2.5, добавляют 1 г глюкозы, устанавливают pH 7,2, разливают во флаконы по 100 см3 и стерилизуют 30 мин при температуре 112°С. Перед употреблением к расплавленной и охлажденной до температуры 45°С среде прибавляют 20 см3 свежевзятой дефибринированной крови кролика. Среду разливают в чашки Петри.
3.2.31. Приготовление молока по Тукаеву
К 1%-ной пептонной воде прибавляют 5—6 см3 обезжиренного молока, среду подвергают дробной стерилизации по 30 мин при температуре 100°С трое суток подряд.
3.2.32. Приготовление среды. <гЛакмусовое молоко»
Обезжиренное молоко стерилизуют в течение 15—20 мин при
температуре 112°С. Не допускается к применению стерилизованное молоко коричневого цвета и с карамелизованным сахаром.
Перед употреблением к 200 см3 стерилизованного молока добавляют примерно 1 см3 лакмусовой настойки до получения сиреневатого окрашивания и 1 см3 солянокислого цистеина до конечной концентрации цистеина 0,08%.
Смесь асептически разливают по пробиркам высоким столбиком, кипятят на водяной бане в течение 15—20 мин и охлаждают. Среду готовят перед проведением анализов.
23
Для приготовления солянокислого цистеина 1 г цистеина растворяют в 0,25 см3 1 н. раствора соляной кислоты.
Стр. 13 ГОСТ 20235.2-74
3.2.33. Приготовление лакмусовой настойки
К Ю см3 этилового 96° спирта добавляют 1 г лакмуса и выдерживают трое суток в термостате при температуре 37°С, ежесуточно сливая окрашенный спирт и заливая новой порцией этилового спирта, после чего лакмус подсушивают в термостате, заливают дистиллированной водой и выдерживают при комнатной температуре в течение суток. Настойку фильтруют и хранят в темной склянке.
3.2.34. Приготовление реактива Эрлиха
В 50 см3 этилового 96° спирта растворяют 4 г парадиметилами-добензолальдегида, затем медленно добавляют 50 см3 концентрированной соляной кислоты. Реактив хранят в склянке из темного стекла при температуре 4—8°С.
3.2.35. Приготовление реактива Ковача
В 75 см3 амилового спирта растворяют 5 г парадиметиламидо-бензолальдегида, затем медленно добавляют 25 см3 концентрированной соляной кислоты. Реактив хранят в склянке из темного стекла при температуре 4—8°С.
3.2.36. Приготовление реактива для определения сероводорода
В 100 см3 дистиллированной воды растворяют 20 г уксуснокислого свинца и 1 г двууглекислой соды. В этом растворе пропитывают полоски фильтровальной бумаги (1X2 см) и высушивают их при температуре 18—23°С.
3.2.37. Приготовление реактива для реакции с метилротом
В 300 см3 этилового спирта растворяют 0,1 г метилового красного, затем смешивают с 500 см3 дистиллированной воды.
3.2.38. Приготовление реактива для реакции Фогес-Просту эра
В 500 см3 дистиллированной воды растворяют 200 г гидрата
окиси калия. Креатин добавляют на кончике скальпеля в одну пробирку перед употреблением. Креатин хранят в сухом месте.
3.2.39. Приготовление насыщенного спиртового раствора метиленовой сини
В 100 см3 этилового 96° спирта растворяют 8—9 г метиленовой сини. Раствор фильтруют.
3.2.40. Приготовление спирто-водного раствора метиленовой сини
К 30 см3 дистиллированной воды добавляют 1 см3 насыщенного спиртового раствора.
3.2.41. Приготовление метиленовой сини (Леффлера)
К 100 см3 дистиллированной воды добавляют 20 см3 насыщенного спиртового раствора метиленовой сини и 1 см3 1%-ного спиртового раствора гидрата окиси калия.
3.2.42. Приготовление фуксин-насыщенного спиртового раствора
8—9 г основного фуксина высыпают во флакон, заливают
100 см3 этилового 96° спирта и ставят на 18—24 ч в термостат 24
ГОСТ 20235.2-74 Стр. 14
с температурой 37°С. Флаконы периодически взбалтывают. В течение указанного времени значительная часть краски растворяется и на дне флакона остается осадок, свидетельствующий о насыщении раствора.
Насыщенный раствор хранят во флаконах из темного стекла.
Из насыщенного спиртового раствора готовят фуксин-спирто-водный раствор. Для этого к 1 см3 насыщенного раствора прибавляют 9 см3 дистиллированной воды.
3.2.43. Приготовление фуксина Циля-Карболового
1 г основного кристаллического фуксина Циля растирают в ступке с 5 г кристаллической карболовой кислоты и 0,5 см3 глицерина. Во время растирания небольшими порциями прибавляют 10 см3 этилового 96° спирта. После того, как краска полностью разотрется, прибавляют при постоянном помешивании 100 см3 дистиллированной воды. Раствор краски фильтруют. Фуксин Циля стойкий и его хранят во флаконах из темного стекла с притертой пробкой.
Перед работой к одной части карболового фуксина Циля прибавляют девять частей дистиллированной воды.
3.2.44. Приготовление кристаллвиолета и генциан фиолетового для окраски по Граму
В 100 см3 этилового 96° спирта растворяют 1 г кристаллвиолета и 1 см3 глицерина.
Краску наливают в лоток. Фильтровальную бумагу нарезают полосками шириной 2,0—2,5 см и длиной 30—50 см. Полоску погружают на несколько секунд в краску так, чтобы она окрасилась с обеих сторон. Окрашенные полоски вынимают пинцетом, дают краске стечь и подвешивают на шпагате для высушивания. Бумагу сушат на воздухе при температуре 18—23°С. Высушенные полоски бумаги разрезают на кусочки размером 2X2 см и хранят в банке из темного стекла.
3.2.45. Приготовление раствора Люголя
В 10 см3 дистиллированной воды растворяют 2 г йодистого калия. Затем прибавляют 1 г кристаллического йода. Раствор выдерживают несколько часов до полного растворения йода, после чего прибавляют 290 см3 дистиллированной воды.
3.3. Приготовление препаратов
3.3.1. Поверхность паренхиматозных органов тазобедренных мышц и пораженных участков мяса кролика стерилизуют, прикладывая раскаленный шпатель или обжигая тампоном, смоченным в спирте. Затем вырезают стерильными ножницами кусочки размером 1,5Х1»0Х 1,5 или 2.0Х1ДХ2.5 см и прикладывают поверхностями срезов к предметному стеклу по три отпечатка на двух предметных стеклах. Препараты высушивают на воздухе, фиксируют, окрашивают по Граму, Романовскому—Гимза и метиленовой синь-
25
Переиздание. Май, 1981 г.
Стр. 15 ГОСТ 20235.2-74
кой (в зависимости от характера патологических изменений и предполагаемого диагноза). Мазки микроскопируют.
3.3.2. Приготовление мазков из культуры
3.3.2.1. Метод раздавленной капли
На середину предметного стекла наносят петлей для бактериологических испытаний или пипеткой каплю анализируемой культуры, осторожно покрывают ее покровным стеклом, чтобы под. ним не образовалось пузырьков воздуха и жидкость не выступала за края покровного стекла.
3.3.2.2. Для приготовления мазков требуются чистые обезжиренные предметные стекла (капли воды на поверхности чистого-сухого стекла должны расплываться, а не принимать шаровидную форму). Чтобы приготовить мазок из культуры с плотной средой,, на предметное стекло наносят небольшую каплю стерильного физиологического раствора или водопроводной воды, затем при соблюдении асептики открывают пробирку или чашку Петри и,, захватив немного материала прокаленной и остуженной бактериологической петлей, размешивают его в этой капле. Полученную взвесь растирают на площади 1 см2. Материал из жидкой среды берут пипеткой или бактериологической петлей и готовят препарат аналогичным образом непсредственно на стекле.
Приготовленный препарат высушивают на воздухе. Если высушиваемые препараты содержат патогенный материал, их накрывают стеклянным колпаком. После приготовления мазка петлю прожигают на пламени горелки, а пипетку опускают в сосуд с дезинфицирующим раствором. Для фиксации мазок трижды медленно проводят через пламя спиртовой или газовой горелки. При излишнем нагревании сильно изменяется структура клеток и мазок плохо окрашивается, при недостаточной фиксации мазок можно смыть при последующей обработке. Фиксацию можно проводить, погружая мазки в фиксирующие жидкости — на 5 мин в метиловый спирт, на 15—20 мин в этиловый 96° спирт, на 5 мин в ацетон, на 10—15 мин в смесь равных объемов абсолютного-спирта и эфира по Никифорову. После фиксации препарат высушивают на воздухе.
3.3.3. Окраска препаратов
3.3.3.1. Окраска мазков по Г раму
При окраске по Граму на фиксированный мазок кладут кусочек фильтровальной бумаги и наливают карболовый генциан фиолетового на 2 мин, после чего снимают бумажку, сливают краску и, промывая водой, наливают на мазок раствор Люголя (мазок чернеет). Через 1 мин его сливают и наливают этиловый спирт на 0,5—1 мин, причем препарат нужно покачивать и менять спирт.
26
ГОСТ 20235.2-74 Стр. 16
Затем мазок промывают водой и дополнительно окрашивают разведенным фуксином в течение 1—2 мин. Краску сливают, промывают водой, обсушивают фильтровальной бумагой.
Окраску по Граму можно применять в видоизменении Синева, согласно которому вместо карболового генциан фиолетового применяют раствор следующего состава: 1 г кристаллвиолета, 100 см3 этилового 96° спирта, 1 см3 глицерина (необязательно). Кристалл-виолет можно заменить равным количеством метиллвиолета или генциан фиолетового.
Для окрашивания мазков на фиксированный мазок накладывают полоску фильтровальной бумаги, пропитанной спиртовым раствором кристаллвиолета, и наносят несколько капель воды, которая полностью впитывается бумагой, последняя плотно прилегает к стеклу. Выдерживают 2 мин, затем бумажку удаляют пинцетом и дальнейшую окраску производят по Граму.
3.3.3.2. Окраска спор
Мазок, приготовленный по п. 3.3.2, окрашивают при нагревании 1—2 мин карболовым фуксином Циля, до появления паров, промывают водой и обесцвечивают погружением в 2%-ный раствор азотной кислоты в спирте или 1 % -ный водный раствор серной кислоты.
Обесцвечивать нужно так, чтобы на препарате не было видно следов красителя. Затем промывают водой и докрашивают водным раствором метиленового синего. Споры окрашиваются в красный цвет.
3.3.3.3. Окраска капсул методом. Михина
Фиксированный мазок окрашивают в течение 2—3 мин синькой Леффлера при подогревании (до появления паров), после чего краску быстро смывают водой и мазок высушивают между листками фильтровальной бумаги. Бактерии окрашиваются в темно-синий цвет, капсулы — в светло-розовый.
3.3.3.4. Окраска капсул методом Романовского-Гимза
Краску Романовского-Гимза фабричного изготовления перед окрашиванием мазков растворяют из расчета одна капля краски на 1 см3 дистиллированной воды. Разведенную краску наливают в чашку Петри, на дно которой кладут две тонкие стеклянные палочки или спички. Мазок, предварительно зафиксированный метиловым спиртом, после высушивания кладут намазанной поверхностью вниз и наливают краску до соприкосновения с мазком. Мазки окрашивают в течение 30—40 мин, затем препарат промывают водой и высушивают на воздухе в вертикальном положении. Микробы окрашиваются в сине-фиолетовый цвет, капсулы — в красно-фиолетовый.
27
Стр. 17 ГОСТ 20235.2-74
4. ПРОВЕДЕНИЕ АНАЛИЗА
4.1. Определение аэробов
4.1.1. Наряду с бактериоскопией мазков-отпечатков проводят посев паренхиматозных органов, пораженных мышц кусочками размером 1,5X1.ОХ 1.5 или 2,ОХ 1,5X2,5 см путем контакта их с поверхностью элективных сред (Эндо, Плоскирева, Левина, вис-мут-сульфитный агар), а на мясо-пептонный агар путем посева взвеси материала на его поверхность. Для приготовления взвеси из глубины пораженных мышц и органов берут пробу массой 1—3 г, тщательно растирают в ступке с небольшим количеством стерильного песка, добавляют стерильный физиологический раствор или стерильную воду для разведения материала 1:10. Затем стерильной пипеткой берут 0,2—1 см3 взвеси и переносят на поверхность мясо-пептонного агара, приготовленного по п. 3.2.4. Внесенный материал стерильным шпателем равномерно распределяют по всей поверхности среды. Чашки с посевами помещают в термостат и выдерживают 16—24 ч при температуре 37°С, а посевы на висмут-сульфитном агаре — 48 ч. Посевы просматривают невооруженным глазом или под микроскопом с увеличением в 8—10 раз.
4.1.2. Одновременно с посевами на твердые среды проводят посевы материала на среды обогащения. Анализ проводят по следующей методике. При соблюдении асептики из образца вырезают пробы массой по 25 г (две из мышц и две из паренхиматозных органов), помещают их отдельно в стерильные ступки. Пробы хорошо измельчают и вносят в 225 см3 одной из сред: Мюллера» Кауфмана, селенитового бульона, хлористомагниевой. Посевы выдерживают 16—24 ч при температуре 37°С. Затем из сред обогащения проводят посев на элективные среды и помещают на 16— 48 ч в термостат с температурой 37°С.
В зависимости от результатов бактериоскопии и характера роста на твердых питательных средах в дальнейшем проводят анализ проб из образцов на основании определенных при этом отдельных видов микробов.
4.1.3. Определение сальмонелл
4.1.3.1. Сущность метода заключается в определении сальмонелл на элективных средах и установлении биохимических и серологических свойств сальмонелл.
Биохимические свойства сальмонелл определяют на средах, содержащих углеводы и многоатомные спирты. Под действием ферментов, выделяемых микробами, одни среды остаются неизменными и их цвет не меняется, в то время как другие углеводы и многоатомные спирты расщепляются, образуя кислые продукты, которые изменяют цвет индикатора и соответственно цвет среды. 28
ГОСТ 20235.2-74 Стр. 1»
Некоторые сальмонеллы продуцируют и выделяют протеолитические ферменты, которые расщепляют белки до продуктов глубокого распада — индола и сероводорода.
Серологические свойства определяют в реакции агглютинации с агглютинирующими сыворотками. Поливалентную агглютинирующую сыворотку применяют для дифференциации культур рода Salmonella от других возбудителей кишечных инфекций.
На средах с лактозой (Эндо, Левина, Плоскирева) колонии сальмонелл бесцветные, на висмут-сульфитном агаре — черные с металлическим блеском, на месте снятой колонии остается черный след. Черное окрашивание среды зависит от восстановления солей бактериями.
4.1.3.2. Проведение анализа
Если наблюдается обильный рост однородных колоний (чистая культура), то эту культуру используют для анализа. В случае сомнений в чистоте культуры проводят ее пересев на скошенный мясо-пептонный агар. Посевы помещают на 24 ч в термостат с температурой 37°С.
При обнаружении характерных колоний на сальмонеллы из небольшой части колонии делают мазок, окрашивают по Граму и определяют подвижность в раздавленной капле. Бактерии сальмонелл представляют собой неспорообразующие маленькие палочки с закругленными концами, по Граму окрашиваются отрицательно. Бактерии из рода сальмонелл подвижны, но из них галлина-рум и пуллорум неподвижны.
Для изучения биохимических свойств проводят посев на короткий пестрый ряд, состоящий из сред Гисса с лактозой, глюкозой, сахарозой и маннитом.
Часть подозрительной колонии снимают бактериологической петлей и размешивают в 0,5—1 см3 физиологического раствора. Полученную взвесь засевают пастеровской пипеткой на указанные среды и помещают на 12—16 ч в термостат с температурой 37°С, после чего посевы просматривают и учитывают ферментативные свойства микробов. Бактерии сальмонеллезной группы не разлагают лактозу и сахарозу, не меняют окраску среды.
Бактерии сальмонеллезной группы расщепляют глюкозу с образованием кислоты и газа, а маннит — с образованием кислоты. Вследствие образования кислоты меняется цвет среды.
Для определения индола и сероводорода посев производят в пептонную воду. Подозрительную на сальмонеллу колонию растирают в 0,5—1 л физиологического раствора. Полученную взвесь засеивают пастеровской пипеткой на указанную среду и помещают на 24 ч в термостат с температурой 37°С.
Для определения индола в пробирку с суточной культурой осторожно по стенке добавляют 5—10 капель реактива Эрлиха.
29
При наличии индола не позднее чем через 5 мин в пограничном слое образуется ярко-красное кольцо, при отсутствии — кольцо остается светло-желтого цвета. Сальмонеллы индола не образуют.
Для определения индолообразования пользуются также реактивом Ковача. К 24-часовой культуре добавляют 0,2—0,3 см3 реактива и взбалтывают. Результаты учитывают через 10 мин; реактив поднимается на поверхность среды и при наличии индола окрашивается в темно-красный цвет.
Для определения сероводорода в пробирку с анализируемой культурой под пробки помещают полоски фильтровальной бумаги, смоченные уксуснокислым свинцом и высушенные. Полоски фильтровальной бумаги не должны соприкасаться с питательной средой. Посевы выдерживают в термостате одни—трое суток при температуре 37°С. Если культура выделяет сероводород, то бумажка, смоченная раствором уксуснокислого свинца, чернеет от образующегося сернистого свинца. Сальмонеллы выделяют сероводород.
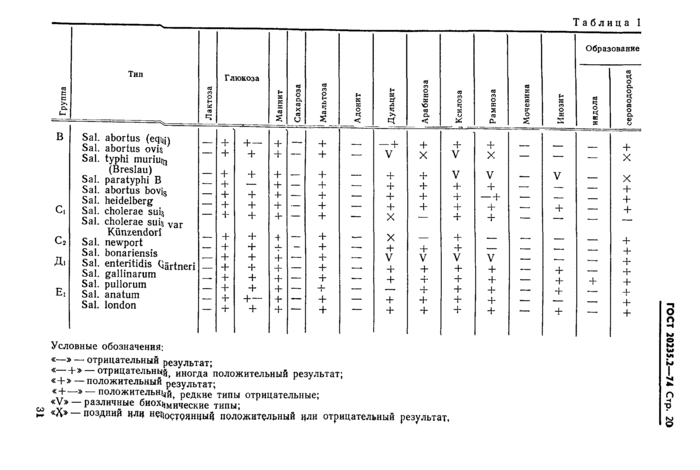
Для полной биохимической типизации бактерий сальмонелл проводят посев на расширенный пестрый ряд (табл. 1).
При наличии в препаратах палочек, характерных для сальмонелл и других грамотрицательных бактерий, культуру анализируют в реакции агглютинации на предметном стекле с поливалентной О-сывороткой.
Поливалентную агглютинирующую сыворотку применяют для дифференциаций культур рода Salmonella от других возбудителей кишечных инфекций, а монорецептурные О- и Н-сыворотки — для идентификации сальмонеллезных культур.
Предварительно культуры испытывают в реакции агглютинации на предметном стекле с поливалентной сывороткой.
Отрицательная реакция с поливалентной сывороткой означает, что испытуемая культура не принадлежит к роду Salmonella пяти основных групп (В, Сь Сг, Дь Ei) и последующий анализ с О- и Н-агглютинирующими сыворотками не проводят.
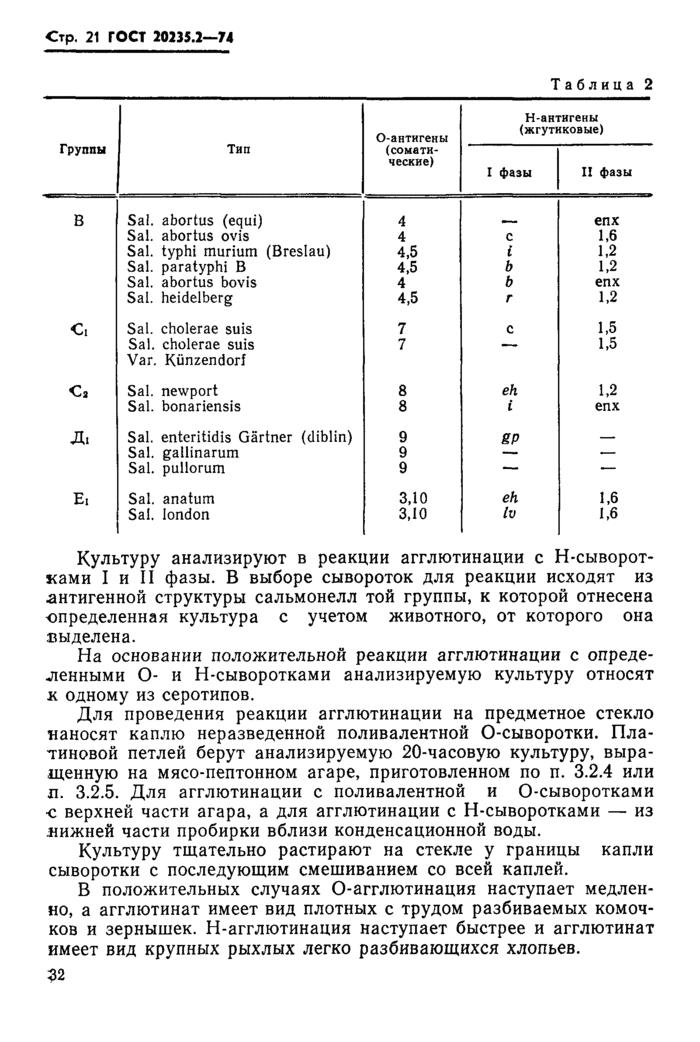
Положительная агглютинация анализируемой культуры дает основание отнести ее к роду Salmonella одной из пяти основных групп (В, Сь Сг, Дь Ei). Такую культуру окончательно идентифицируют в реакции агглютинации с О- и Н-сыворотками, устанавливая в культуре наличие лишь основных, имеющих дифференциальное значение антигенов (табл. 2).
Идентификацию сальмонеллезных культур проводят в следующем порядке. Сначала культуру испытывают в реакции агглютинации с одной из О-сывороток, которую выбирают для кролика. При отрицательной реакции с первоначально взятой О-сывороткой культуру испытывают в реакции агглютинации с остальными четырьмя групповыми О-сыворотками и на основании положительной реакции агглютинации относят культуру к одной из групп. 30
|
Таблица 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Условные обозначения: | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
«—» — отрицательный результат;
ГОСТ 20235.2-74 Стр. 20
« Ь» отрицательно^ иногда положительный результат;
«+» — положительный результат;
^ '* положительной^ редкие типы отрицательные;
00 ^ различные биох^мические
типы;
^ «сд» — поздниц цлц непостоянный положительный цли отрицательный результат,
марлю медицинскую по ГОСТ 9412-77; ткань для фильтрования;
масло вазелиновое медицинское по ГОСТ 3164-78;
масло иммерсионное для микроскопии по ГОСТ 13739-78;
мел химический осажденный по ГОСТ 8253-79;
песок кварцевый для тонкой керамики по ГОСТ 7031-75;
экстракт дрожжевой;
диализат дрожжевой;
дрожжи прессованные хлебопекарные;
желчь крупного рогатого скота свежую или сухую обезвоженную;
кровь кролика свежую;
молоко обезжиренное;
мясо говяжье по ГОСТ 779-55;
печень говяжью по ГОСТ 19342-73;
аммоний хлористый по ГОСТ 3773-72;
арабинозу;
глюкозу х. ч. по ГОСТ 6038-79; галактозу;
глицерин по ГОСТ 6259-75;
дульцит;
железо хлористое;
йод кристаллический по ГОСТ 4159-79;
калия гидрат окиси;
калий йодистый по ГОСТ 4232-74;
калий фосфорнокислый однозамещенный по ГОСТ 4198-75;
калий хлористый по ГОСТ 4234-77;
калий двухромовокислый по ГОСТ 4220-75;
калий фосфорнокислый двузамещенный по ГОСТ 3204-76;
ксилозу;
кислоту серную по ГОСТ 4204-77; кислоту соляную по ГОСТ 3118-77; кислоту уксусную по ГОСТ 61-75; кислоту карболовую; креатин;
кислоту розоловую;
кальций хлористый кристаллический;
лактозу х. ч.;
малонат;
магний сернокислый; маннит по ГОСТ 8321-74;
магний хлористый кристаллический по ГОСТ 4209-77; мальтозу;
мочевину по ГОСТ 6691-77;
14
|
Таблица 2 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Культуру анализируют в реакции агглютинации с Н-сыворотками I и II фазы. В выборе сывороток для реакции исходят из антигенной структуры сальмонелл той группы, к которой отнесена определенная культура с учетом животного, от которого она выделена.
На основании положительной реакции агглютинации с определенными О- и Н-сыворотками анализируемую культуру относят к одному из серотипов.
Для проведения реакции агглютинации на предметное стекло наносят каплю неразведенной поливалентной О-сыворотки. Платиновой петлей берут анализируемую 20-часовую культуру, выращенную на мясо-пептонном агаре, приготовленном по п. 3.2.4 или л. 3.2.5. Для агглютинации с поливалентной и О-сыворотками ■с верхней части агара, а для агглютинации с Н-сыворотками — из .нижней части пробирки вблизи конденсационной воды.
Культуру тщательно растирают на стекле у границы капли сыворотки с последующим смешиванием со всей каплей.
В положительных случаях О-агглютинация наступает медленно, а агглютинат имеет вид плотных с трудом разбиваемых комочков и зернышек. Н-агглютинация наступает быстрее и агглютинат имеет вид крупных рыхлых легко разбивающихся хлопьев.
?2
ГОСТ 20235.2-74 Стр. 4
масло вазелиновое по ГОСТ 3164-78; натрий-аммоний фосфорнокислый; натрий серноватистокислый СТ СЭВ 223—75; натрий фосфорнокислый двузамещенный безводный по ГОСТ 11773—76;
натрия гидрат окиси по ГОСТ 4328-77;
натрий фосфорнокислый однозамещейный по ГОСТ 245-76;
натрий кислый селенистокислый;
натрий лимоннокислый;
натрий двууглекислый по ГОСТ 4201-79;
натрий хлористый по ГОСТ 4233-77;
парадиметиламидобензолальдегид;
рамнозу;
сахарозу по ГОСТ 5833-75; салицин;
соль закиси железа и аммония двойную сернокислую по ГОСТ 4208-72;
соль натриевую дезоксирибонуклеиновой кислоты; углерод по ГОСТ 4-75;
свинец уксуснокислый по ГОСТ 1027-67 (СТ СЭВ 263—76); спирт амиловый чистый;
спирт этиловый ректификованный по ГОСТ 5962-67;
хинозол;
фенилаланин;
эфир серный;
индикатор Андреде;
бромтимоловый синий;
брйллиантовый зеленый;
генциан фиолетовый;
кристаллвиолет;
метиловый красный по ГОСТ 5853-51; метиловый синий;
феноловый красный по ГОСТ 4599-73; фенолфталеин по ГОСТ 5850-72; фуксин основной;
воду дистиллированную по ГОСТ 6709-72; воду питьевую по ГОСТ 2874-73; азур-эозин по Романовскому; эозин;
агар висмут-сульфитный; агар микробиологический по ГОСТ 17206-71; бактоагар Плоскирева сухой; синьку Леффлера;
пептон сухой для бактериологических целей по ГОСТ 13805-76;
15
Стр. 5 ГОСТ 20235.2-74
пептон импортный чешской фирмы «Спофа» или венгерской фирмы «Рихтер»;
кровь кролика свежую; плазму цитратную кроличью сухую; среду Гисса сухую с индикатором ВР; среду Левина сухую;
сыворотки поливалентные и монорецепторные О и Н — агглютинирующие;
сыворотки антиботулинические; среду Эндо сухую.
3. ПОДГОТОВКА К АНАЛИЗУ
3.1. Подготовка и стерилизация посуды и материалов.
3.1.1. Вся посуда для бактериологического анализа перед стерилизацией должна быть тщательно вымыта и высушена.
3.1.2. Пробирки должны быть закрыты ватными пробками и завернуты в бумагу; горлышки колб и флаконов закрывают ватной пробкой, а сверху — бумажным колпачком, который обвязывают ниткой.
3.1.3. Пробки для пробирок и колб готовят из ваты, обвертывают слоем марли и завязывают ниткой на свободном конце.
3.1.4. Чашки Петри укладывают в металлические пеналы или завертывают в бумагу. Между крышками и дном чашек, предназначенных для разливки среды Эндо, можно положить кружки фильтровальной бумаги диаметром на 1—2 см больше диаметра чашки.
3.1.5. В конце пипетки, который берется в рот, вкладывают кусочек ваты. Пипетки помещают в металлические пеналы по 6—10 шт. в каждый или завертывают в бумагу.
3.1.6. Подготовленную посуду стерилизуют сухим паром в течение 1 ч в сушильном шкафу при температуре 160±5°С.
При отсутствии сушильного шкафа посуду стерилизуют в течение 30 мин в автоклаве при температуре 126±2°С.
3.1.7. Стерильную посуду вынимают из сушильного шкафа после его охлаждения до температуры ниже 60°С и хранят в плотно закрытых шкафах или ящиках лабораторных столов.
3.2. Приготовление питательных сред, реактивов, красок
3.2.1. Приготовление мясной воды
Говяжье или конское мясо освобождают от костей, жира и сухожилий, измельчают на мясорубке и заливают холодной водой из расчета 1000 см3 воды на 500 г мяса. Смесь воды с измельченным мясом медленно ьагревают до кипения и кипятят в течение 1,5 ч. Небольшое количество смеси (до 5 л) можно кипятить на
16
ГОСТ 2023S.2—74 Стр. 6
открытом огне при частом помешивании во избежание пригора-ния частичек мяса. Большое количество смеси лучше кипятить в котлах с паровой рубашкой. Для определения готовности мясной воды сначала фильтруют небольшое количество смеси в пробирку через бумажный фильтр. Если жидкость прозрачная — вода готова.
Затем жидкость и весь сок из вареного мяса отжимают через ткань, доливают кипяченой водой до первоначального объема, разливают в чистую посуду (колбы, бутыли) и стерилизуют 20 мин в автоклаве при температуре 120°С.
3.2.2. Приготовление мясо-пептонного бульона
К 1000 мл мясной воды, приготовленной по п. 3.2.1, добавляют 10 г сухого пептона и 0,5 г хлористого натрия, кипятят в течение 30 мин, после чего доводят уровень воды до первоначального объема. Затем фильтруют через бумажный фильтр, устанавливают pH 7,0—7,2 насыщенным раствором двууглекислого натрия или 10%-ным раствором гидрата окиси натрия, 15—20 мин стерилизуют при температуре 120°С. Если после стерилизации в мясо-пеп-тонном бульоне выпадает осадок, его фильтруют вторично и снова стерилизуют. Вторичную стерилизацию для предотвращения выпадения осадка проводят при более низкой температуре.
3.2.3. Приготовление физиологического раствора
В 1000 мл дистиллированной воды растворяют 8,5 г химически чистого хлористого натрия. Раствор доводят до кипения, охлаждают, фильтруют через бумажный фильтр, разливают в колбы или пробирки и стерилизуют 20 мин в автоклаве при температуре 120°С.
3.2.4. Приготовление мясо-пептонного агара
К 1000 мл мясо-пептонного бульона, приготовленного по п. 3.2.2, перед стерилизацией добавляют 20 г агара и кипятят на слабом огне при постоянном помешивании до полного растворения.
Мясо-пептонный агар, охлажденный до температуры 50—55°С, осветляют яичным белком (из расчета один белок на 1000 см3 мясо-пептонного агара), помещают в автоклав, не завинчивая крышку автоклава, или в аппарат Коха на 1 ч, чтобы белок свернулся и, оседая, увлек за собой взвешенные частицы. Горячий мясо-пептонный агар фильтруют через ватно-марлевый фильтр и устанавливают pH 7,0—7,4. Разливают во флаконы и пробирки и 20 мин стерилизуют в автоклаве при температуре 120°С.
3.2.5. Приготовление питательного агара
К 100 см3 дистиллированной воды добавляют 5 г порошка агара, тщательно размешивают и кипятят на слабом огне до полного расплавления агара в закрытой посуде при периодическом помешивании во избежание пригорания, фильтруют, разливают в про-
17
Стр. 7 ГОСТ 2023S.2—74
бирки или флаконы и 20 мин стерилизуют при температуре 120°С или по 30 мин текучим паром трое суток подряд.
3.2.6. Приготовление среды Левина
К 100 мл расплавленного мясо-пептонного агара с pH 7,0—7,4, приготовленного по п. 3.2.4, добавляют 2 см3 0,5%-ного водного раствора предварительно подогретой на водяной бане метиленовой сини, 1,5 см3 2%-ного раствора эозина, 2 г лактозы и 0,2 г дву-замещенного фосфорнокислого калия. Растворы красок готовят на дистиллированной воде и стерилизуют 1 ч при температуре 100°С. После добавления всех компонентов в указанном порядке среду тщательно перемешивают, разливают в чашки и подсушивают. Среда должна быть красно-фиолетового цвета.
3.2.7. Приготовление среды Мюллера
Для приготовления среды Мюллера вначале готовят растворы серноватистокислого натрия и Люголя.
В мерный цилиндр с 50 г серноватистокислого натрия добавляют до 100 см3 дистиллированной воды. Полученный раствор стерилизуют текучим паром.
Для приготовления раствора Люголя в 100 см3 дистиллированной воды растворяют 25 г кристаллического йода, 20 г йодистого калия.
Для приготовления среды Мюллера в стерильную колбу помещают 4,5 г х. ч. мела и стерилизуют сухим жаром, наливают 90 см3 мясо-пептонного бульона, приготовленного по п. 3.2.2, стерилизуют 30 мин при температуре 120°С, после чего стерильно добавляют 2 см3 раствора Люголя и 10 см3 раствора серноватистокислого натрия. Среду взбалтывают и разливают в колбы.
3.2.8. Приготовление среды Кауфмана
К ЮО мл стерильной среды Мюллера, приготовленной по п. 3.2.7, добавляют 1 см3 0,1%-ного водного раствора бриллиантовой зелени и 5 см3 стерильной желчи крупного рогатого скота. Смесь хорошо взбалтывают, но не стирилизуют.
3.2.9. Приготовление селенитовой среды
Среду готовят из двух основных растворов — А и Б.
Раствор А состоит из 5 г пептона чешской фирмы «Спофа» или венгерской фирмы «Рихтер», 7 г безводного двузамещенного фосфорнокислого натрия, 3 г однозамещенного фосфорнокислого натрия, 4 г х. ч. лактозы, 100 см3 дистиллированной воды pH 6,9—7,1, Раствор стерилизуют 30 мин при температуре 112°С.
Раствор Б состоит из 10%-ного раствора кислого селенистокислого натрия, приготовленного на стерильной воде. Раствор готовят непосредственно перед употреблением.
При изменении серии любого из входящих в среду компонентов (пептона, кислого селенистокислого натрия, фосфатов) производят предварительную подтитровку, для чего экспериментально опреде-18
ГОСТ 20235.2-74 Стр. 8
ляют точную пропорцию фосфорнокислого двузамещенного безводного натрия и фосфорнокислого однозамещенного натрия, которая с используемыми образцами пептона и селенистокислого натрия дает pH не выше 6,9—7,1, что регулируется изменением соотношения фосфатов.
Для приготовления селенитовой среды к 50 см3 раствора А стерильно добавляют 2 см3 раствора Б. Среду разливают в стерильные пробирки по 5—7 см3, но не стерилизуют.
3.2.10. Приготовление хлористомагниевой среды «М» (модифицированной)
Среду готовят из трех основных растворов А, В и С.
Для приготовления раствора А в 90 см3 дистиллированной воды растворяют 0,42 г пептона, 0,7 г хлористого натрия, 0,15 г однозамещенного фосфорнокислого натрий, 2 мл дрожжевого диализата.
Для приготовления раствора В в 9 см3 дистиллированной воды растворяют 3,6 г кристаллического хлористого магния.
Раствор С состоит из 0,09 см3 5%-ного водного раствора бриллиантовой зелени.
Для приготовления хлористомагниевой среды «М» (модифицированной) растворы А, В и С смешивают и стерилизуют 30 мин при температуре 112,5°С.
Концентрированную среду готовят, удваивая содержание всех компонентов, кроме дистиллированной воды.
При отсутствии дрожжевого диализата допускается применять дрожжевой экстракт.
3.2.11. Приготовление дрожжевого экстракта
В 2000 мл дистиллированной воды растворяют 1000 г прессованных хлебопекарных дрожжей. Полученную суспензию стерилизуют 30 мин текучим паром, затем отстаивают в холодильнике при температуре 4—6°С в течение пяти-шести суток.
Жидкость над осадком декантируют, приливают 2,5 см3 0,01%-ного раствора кристаллвиолета, разливают во флаконы или пробирки и вновь стерилизуют при температуре 100°С в течение 30 мин. Экстракт хранят в холодильнике при температуре 4—6°С в течение двух недель.
3.2.12. Приготовление среды Эндо
К 100 мл холодной дистиллированной воды прибавляют 5 г порошка сухой среды Эндо, тщательно размешивают, нагревают при помешивании до полного расплавления агара, кипятят на слабом огне 3—5 мин, не допуская пригорания. Горячую среду фильтруют через рыхлый ватный, предварительно смоченный дистиллированной водой и отжатый фильтр и вновь доводят до кипения.
После остывания среду разливают в стерильные чашки Петри слоем 4—5 мм и после застывания подсушивают в термостате. Чашки со средой, во избежание ее покраснения, нельзя оставлять
19
Стр. 9 ГОСТ 20235.2-74
на солнечном свету. Среду готовят непосредственно перед анализом.
3.2.13. Приготовление среды Плоскирева
В 100 см3 холодной дистиллированной воды тщательно размешивают 6 г порошка сухой среды Плоскирева, нагревают при помешивании до полного расплавления агара, кипятят на слабом огне 2—3 мин, не допуская пригорания, до образования быстро оседающей крупнопузырчатой пены. Горячую среду разливают в стерильные чашки Петри слоем 4—5 мм и оставляют их открытыми на 40 мин для остывания и подсушивания, после чего чашки закрывают крышками или картонками и среда готова к посеву.
3.2.14. Приготовление висмут-сульфитного агара
В 100 см3 холодной дистиллированной воды тщательно размешивают 6 г порошка сухого висмут-сульфитного агара, кипятят на слабом огне 3—5 мин при закрытой крышке или пробке, не допуская пригорания.
После остывания среду разливают в стерильные чашки Петри слоем 4—5 мм, предварительно взболтав для равномерного распределения остатка. Чашки Петри оставляют открытыми на 40 мин для остывания и подсушивания.
3.2.15. Приготовление среды Гисса
К 100 мл дистиллированной воды прибавляют 1 г пептона, 0,5 г хлористого натрия и нагревают до растворения, затем фильтруют до тех пор, пока раствор не станет совершенно прозрачным. Устанавливают pH 7,0, прибавляют 0,5 г углерода и 1 см3 индикатора Андреде.
Среду разливают по 5 см3 в пробирки с поплавками и стерилизуют 20 мин при температуре 110°С. Среда должна быть бесцветной или соломенно-желтого цвета, без розового оттенка. Можно использовать готовые среды Гисса.
Для приготовления индикатора Андреде к 100 см3 дистиллированной воды добавляют 16 см3 1 н. раствора гидрата окиси натрия и 0,5 г кислого фуксина. Раствор стерилизуют 5 мин при температуре ПО—112°С. Среду хранят в склянке из темного стекла.
3.2.16. Приготовление пептонной воды
К 1000 см3 дистиллированной воды добавляют 10 г пептона и 5 г хлористого натрия, кипятят до растворения пептона, фильтруют и устанавливают pH 7,2—7,4, после чего стерилизуют 30 мин при температуре 120°С.
3.2.17. Приготовление среды Кристенсена
К 100 см3 расплавленного мясо-пептонного агара (pH 7,2,), приготовленного по п. 3.2.4, добавляют 0,5 мл 10%-ного водного раствора хлористого железа, стерильно разливают в пробирки столбиком и немедленно охлаждают.
20
ГОСТ 20235.2-74 Стр. 10
3.2.18. Приготовление среды Христенсена с мочевиной
К 1000 см3 дистиллированной воды прибавляют 1 г пептона, 5 г хлористого натрия, 1 г глюкозы, 2 г фосфорнокислого однозаме-шенного калия, 6 см3 фенолового красного (1 :500) и 20 г мочевины и нагревают до полного растворения солей.
Среду фильтруют через бумажный фильтр, устанавливают pH ■6,8—6,9, разливают в пробирки по 5—6 см3 и стерилизуют на водяной бане по 15—20 мин трое суток подряд. Готовая среда бесцветная. Особое внимание необходимо обращать на pH среды.
3.2.19. Приготовление среды для реакции с метилротом и Фо-зес-Проскауэра
В 1000 см3 горячей дистиллированной воды растворяют 5 г дву-замещенного фосфорнокислого натрия, 7 г пептона, 5 г глюкозы, фильтруют и устанавливают pH 6,9—7,0. Среду разливают в пробирки по 5 см3 и стерилизуют в водяной бане по 15 мин ежедневно трое суток подряд. Готовая среда должна быть бесцветной и прозрачной.
3.2.20. Приготовление индикатора бромтимолблау
В 40 см3 дистиллированной воды растворяют 1 г бромтимолблау, нагревают до кипения и добавляют 25 см3 0,1 н. раствора гидрата окиси калия, в результате чего жидкость приобретает зеленоватый оттенок. Затем дистиллированной водой доводят объем до 500 см3. Индикатор хранят в темной склянке с притертой пробкой.
3.2.21. Приготовление агара Симмонса
В 1000 см3 дистиллированной воды растворяют 5 г хлористого натрия, 0,2 г сернокислого магния, 1,5 г фосфорнокислого натрия-аммония, 2 г двузамещенного фосфорнокислого калия, 5 г нейтрального лимоннокислого натрия, 20 г агара-агара. Раствор фильтруют, добавляют 40 см3 раствора бромтимолблау (1 : 500). Среду разливают в пробирки по 5—6 см3, стерилизуют при температуре 121°С в течение 20 мин, после чего скашивают. Готовая среда должна быть оливкового цвета.
3.2.22. Приготовление фенилаланинового агара
К 1000 мл дистиллированной воды прибавляют 3 г дрожжевого экстракта, 2—1 г DL или L-фенилаланина, 1 г двузамещенного фосфорнокислого натрия, 5 г хлористого натрия, нагревают при постоянном помешивании до полного растворения добавленных компонентов. Затем устанавливают pH 7,2—7,4 и добавляют 12 г агара. После добавления агара среду кипятят на слабом огне при постоянном помешивании до полного растворения агара. Приготовленный агар фильтруют, разливают в пробирки и стерилизуют 10—15 мин в автоклаве при температуре 121°С. После стерилизации питательную среду скашивают.
21
1
Издание официальное Перепечатка воспрещена
2