ГОСТ ISO/TS 13136-2016
Микробиология пищевой продукции и кормов для животных. Полимеразная цепная реакция в режиме реального времени для определения патогенных микроорганизмов. Горизонтальный метод определения бактерий Escherichia coli, продуцирующих Шига-токсин, в том числе серогрупп O157, O111, O26, O103 и O145
Устанавливает метод идентификации бактерий Escherichia coli, продуцирующих Шига-токсин (STEC), посредством обнаружения следующих генов: a)основных генов вирулентности STEC, stx и eae (см. [2], [3]); b)генов, входящих в состав ДНК бактерий Escherichia coli серогрупп O157, O111, O26, O103, и O145 (см. [3], [4]).
Идентичен ISO/TS 13136:2012
Оглавление
1 Область применения
2 Нормативные ссылки
3 Термины и определения
4 Сущность метода . .
5 Разбавители, питательные среды и реактивы
6 Оборудование и лабораторная посуда
7 Отбор проб
8 Подготовка пробы для испытания
9 Методика проведения испытания
10 Интерпретация результатов
11 Эксплуатационные характеристики
Приложение А (обязательное) Блок-схема процедуры проведения анализа
Приложение В (обязательное) Блок-схема процедуры выделения и подтверждения
Приложение С (справочное) Идентификация Escherichia coli, продуцирующих Шига-токсин (STEC), путем выявления генов вирулентности мультиплексной ПЦР-амплификацией и обнаружение продуктов ПЦР путем электрофореза в агарозном геле
Приложение D (справочное) Внутренний контроль амплификации
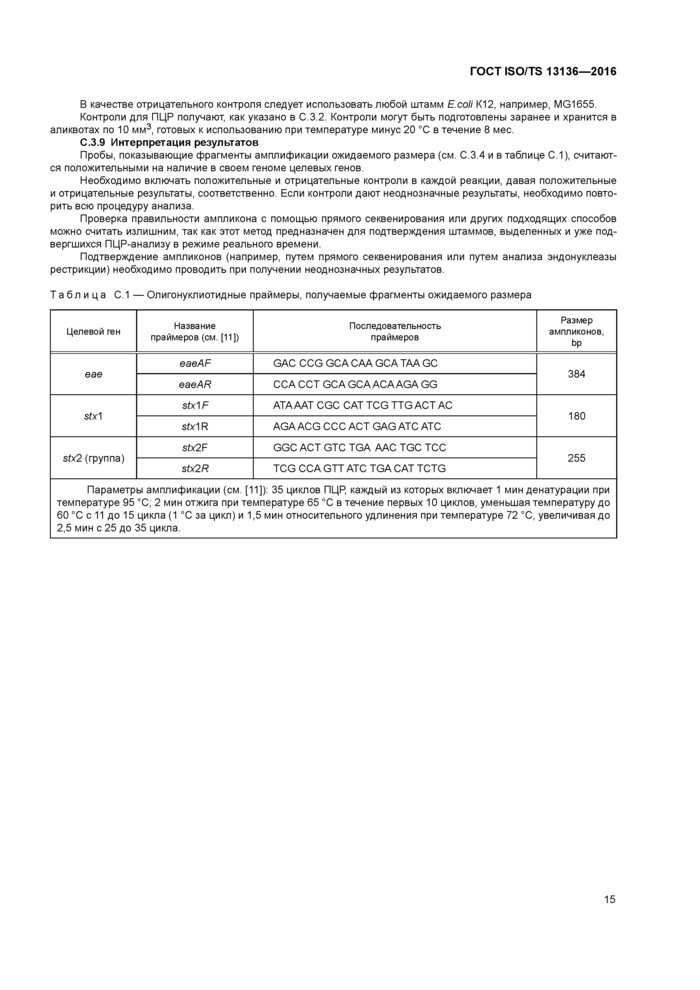
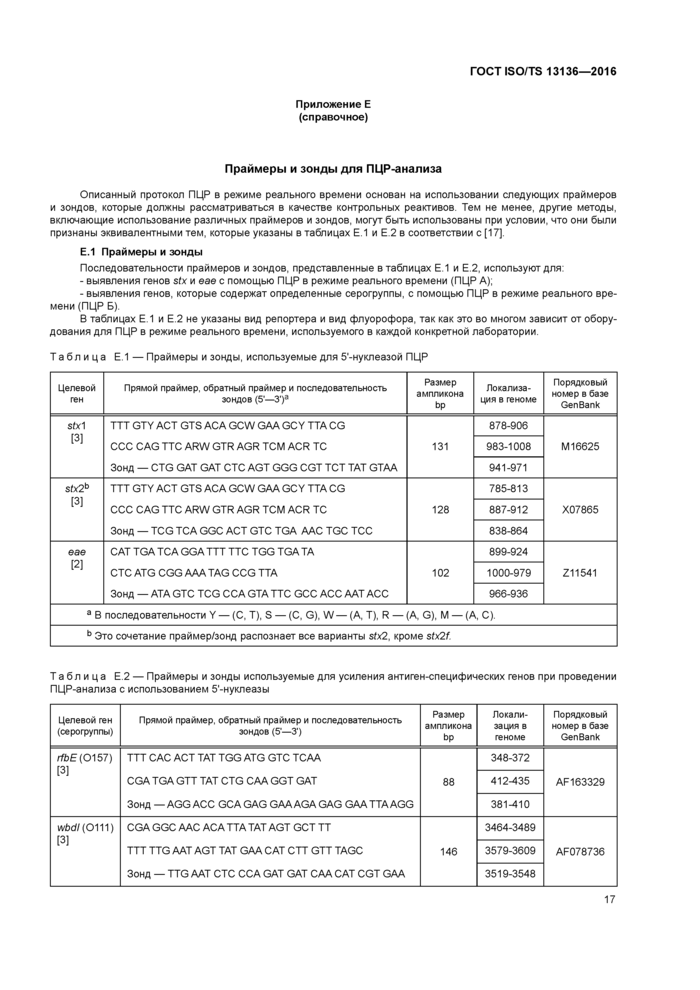
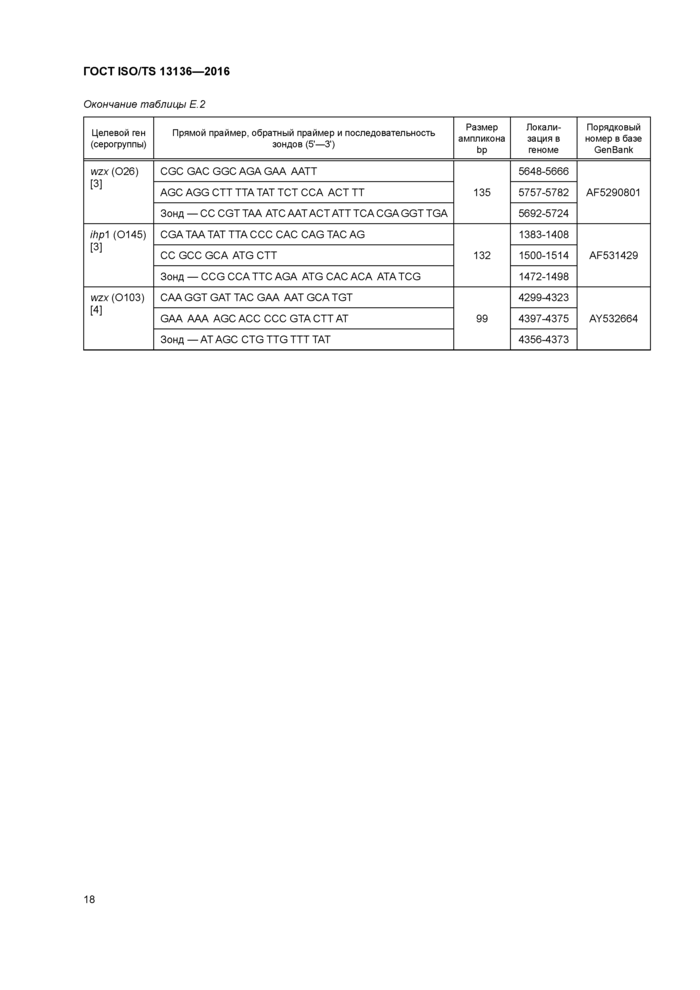
Приложение Е (справочное) Праймеры и зонды для ПЦР-анализа
Приложение F (обязательное) Выделение чистых штаммов ЭТЕС
Приложение ДА (справочное) Сведения о соответствии ссылочных международных стандартов межгосударственным стандартам
Библиография
28 страниц
| Дата введения | 01.07.2017 |
|---|---|
| Добавлен в базу | 01.02.2017 |
| Актуализация | 01.01.2021 |
Этот ГОСТ находится в:
- Раздел Экология
- Раздел 07 МАТЕМАТИКА. ЕСТЕСТВЕННЫЕ НАУКИ
- Раздел 07.100 Микробиология
- Раздел 07 МАТЕМАТИКА. ЕСТЕСТВЕННЫЕ НАУКИ
- Раздел Электроэнергия
- Раздел 07 МАТЕМАТИКА. ЕСТЕСТВЕННЫЕ НАУКИ
- Раздел 07.100 Микробиология
- Раздел 07 МАТЕМАТИКА. ЕСТЕСТВЕННЫЕ НАУКИ
- Раздел Экология
- Раздел 65 СЕЛЬСКОЕ ХОЗЯЙСТВО
- Раздел 65.120 Корма для животных
- Раздел 65 СЕЛЬСКОЕ ХОЗЯЙСТВО
- Раздел Электроэнергия
- Раздел 65 СЕЛЬСКОЕ ХОЗЯЙСТВО
- Раздел 65.120 Корма для животных
- Раздел 65 СЕЛЬСКОЕ ХОЗЯЙСТВО
- Раздел Экология
Организации:
| 27.07.2016 | Утвержден | Межгосударственный Совет по стандартизации, метрологии и сертификации | 89-П |
|---|---|---|---|
| 07.11.2016 | Утвержден | Федеральное агентство по техническому регулированию и метрологии | 1606-ст |
| Разработан | ФГБНУ ВНИИТеК | ||
| Издан | Стандартинформ | 2016 г. |
Microbiology of food and animal feed. Real-time polymerase chain reaction (PCR)-based method for the detection of food-borne pathogens. Horizontal method for the detection of Shiga toxin-producing Escherichia coli (STEC) and the determination of O157, O111, O26, O103 and O145 serogroups
Чтобы бесплатно скачать этот документ в формате PDF, поддержите наш сайт и нажмите кнопку:

стр. 1

стр. 2

стр. 3

стр. 4

стр. 5

стр. 6

стр. 7

стр. 8

стр. 9

стр. 10
стр. 11
стр. 12
стр. 13
стр. 14
стр. 15

стр. 16

стр. 17

стр. 18
стр. 19

стр. 20
стр. 21
стр. 22

стр. 23
стр. 24

стр. 25

стр. 26

стр. 27

стр. 28
МЕЖГОСУДАРСТВЕННЫЙ СОВЕТ ПО СТАНДАРТИЗАЦИИ, МЕТРОЛОГИИ И СЕРТИФИКАЦИИ (МГС)
INTERSTATE COUNCIL FOR STANDARDIZATION, METROLOGY AND CERTIFICATION (ISC)
МЕЖГОСУДАРСТВЕННЫЙ
СТАНДАРТ
ГОСТISO/TS 13136-2016
Микробиология пищевой продукции и кормов для животных
ПОЛИМЕРАЗНАЯ ЦЕПНАЯ РЕАКЦИЯ В РЕЖИМЕ РЕАЛЬНОГО ВРЕМЕНИ ДЛЯ ОПРЕДЕЛЕНИЯ ПАТОГЕННЫХ МИКРООРГАНИЗМОВ
Горизонтальный метод определения бактерий Escherichia coli, продуцирующих Шига-токсин, в том числе серогрупп 0157, 0111, 026, 0103 и 0145
(ISO/TS 13136:2012, IDT)
Издание официальное
Москва
Стандартинформ
2016
Предисловие
Цели, основные принципы и основной порядок проведения работ по межгосударственной стандартизации установлены в ГОСТ 1.0-2015 Межгосударственная система стандартизации. Основные положения» и ГОСТ 1.2-2015 «Межгосударственная система стандартизации. Стандарты межгосударственные. правила и рекомендации по межгосударственной стандартизации. Правила разработки, принятия, обновления и отмены»
Сведения о стандарте
1 ПОДГОТОВЛЕН Федеральным государственным бюджетным научным учреждением «Всероссийский научно-исследовательский институт технологии консервирования» (ФГБНУ «ВНИИТеК») на основе официального перевода на русский язык англоязычной версии международного документа, указанного в пункте 5. который выполнен ФГБНУ «ВНИИТеК»
2 ВНЕСЕН Федеральным агентством по техническому регулированию и метрологии
3 ПРИНЯТ Межгосударственным советом по стандартизации, метрологии и сертификации (протокол от 27 июля 2016 г. Ne 89-П)
|
За принятие проголосовали: | ||||||||||||||||||
|
4 Приказом Федерального агентства по техническому регулированию и метрологии от 7 ноября 2016 г. № 1606-ст межгосударственный стандарт ГОСТ ISO/TS 13136—2016 введен в действие в качестве национального стандарта Российской Федерации с 1 июля 2017 г.
5 Настоящий стандарт идентичен международному документу ISO/TS 13136:2012 «Микробиология пищевой продукции и кормов для животных. Полимеразная цепная реакция в режиме реального времени для определения патогенных микроорганизмов. Горизонтальный метод определения бактерий Escherichia coli, продуцирующих Шига-токсин, в том числе серогрулп 0157, ОШ. 026, 0103 и 0145» (Microbiology of food and animal feed — Real-time polymerase chain reaction (PCR)-based method for the detection of food-borne pathogens — Horizontal method for the detection of Shiga toxin-producing Escherichia coli (STEC) and the determination of 0157, 0111.026, 0103 and 0145 serogroups», IDT].
Международный документ разработан Техническим комитетом по стандартизации ISO/TC 34 «Пищевые продукты» Международной организации по стандартизации (ISO).
При применении настоящего стандарта рекомендуется использовать вместо ссылочных международных стандартов соответствующие им межгосударственные стандарты, сведения о которых приведены в дополнительном приложении ДА
6 ВВЕДЕН ВПЕРВЫЕ
Информация об изменениях к настоящему стандарту публикуется в ежегодном информационном указателе «Национальные стандарты» (по состоянию на 1 января текущего года), а текст изменений и поправок — в ежемесячном информационном указателе «Национальные стандарты». В случае пересмотра (замены) или отмены настоящего стандарта соответствующее уведомление будет опубликовано в ежемесячном информационном указателе «Национальные стандарты». Соответствующая информация, уведомление и тексты размещаются также в информационной системе общего пользования — на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет (www.gost.ru)
© Стандартинформ, 2016
В Российской Федерации настоящий стандарт не может быть полностью или частично воспроизведен. тиражирован и распространен в качестве официального издания без разрешения Федерального агентства по техническому регулированию и метрологии
II
ГОСТ isorrs 13136—2016
выделения, после чего проводят прямой посев на подходящую плотную среду и скрининг колоний на наличие генов вирулентности.
Для подтверждения наличия генов вирулентности в выделенных колониях используют протоколы, описывающие проведение стандартной ПЦР. ПЦР в режиме реального времени (см. приложения С и Е). а также протокол проведения любого другого вида ПЦР. которая аналогична ранее указанным видам ПЦР
Блок-схема выделения бактерий STEC приведена на рисунке В.1, а методика данной процедуры — в приложении F.
10 Интерпретация результатов
a) Пробы, не содержащие бактерий с s/x-геном: в х г или х см3 анализируемой пробы STEC не обнаружены (см. ISO 7218).
При отсутствии генов stx, проведение испытания прекращают и не проводят дальнейшего определения наличия гена еае и генов, присутствующих в серогруппах, приведенных в разделе 1.
В случае, когда не удалось провести выделение бактерий из проб, положительных на наличие s/x-генов. тогда:
b) Пробы, положительные на наличие s/x-генов: в х г или х см3 анализируемой пробы предположительно обнаружены STEC.
c) Пробы, положительные на наличие генов stx и еае: в х г или х см3 анализируемой пробы предположительно обнаружены STEC. вызывающие повреждение путем прикрепления бактерий и разрушения ими щеточной каймы эпителия клеток кишечника.
d) Пробы, положительные на наличие генов stx и еае, а также генов, характерных для одной из серогрупп, приведенных в разделе 1: в х г или х см3 анализируемой пробы предположительно обнаружена серогруппа STEC XX1).
В случае, когда удалось провести выделение и подтверждение бактерий из проб, положительных на наличие s/x-генов. тогда:
e) Выделенные штаммы Е. coli. положительные на наличие s/x-гена: наличие STEC в х г или х см3 анализируемой пробы.
О Выделенные штаммы Е. coli, положительные на наличие генов stx и еае: в х г или х см3 анализируемой пробы обнаружены STEC. вызывающие повреждение путем прикрепления бактерий и разрушения ими щеточной каймы эпителия клеток кишечника.
д) Выделенные штаммы Е. Coli, положительные на наличие генов stx и еае, а также генов, характерных для одной из серогрупп, приведенных в разделе 1: обнаружена серогруппа STEC ХХ2) в х г или х см3 анализируемой пробы
11 Эксплуатационные характеристики
11.1 Метод ПЦР в режиме реального времени, установленный в настоящем стандарте, прошел процедуру валидационного исследования в соответствии с требованиями, приведенными в [17].
11.2 Чувствительность и предел обнаружения бактерий методом ПЦР в режиме реального времени были определены с помощью разведений плазмид, содержащих клонированные гены, кодирующие специализированную экспрессию (см. (81). Результаты данного исследования приведены в таблице 1.
|
Таблица 1 — Чувствительность и предел обнаружения 5'-нуклеазы с помощью ПЦР для некоторых генов, рассматриваемых в настоящем стандарте (см [8]) | ||||||||||||
| ||||||||||||
|
^ XX — это серогруппа с искомыми генами 2) Серогруппа, выделенный штамм которой используют для обнаружения присутствия соответствующих генов или при помощи фенотипичного определения |
|
Окончание таблицы 1 | ||||||||||||
|
Дополнительное исследование (см. (17]) проводилось с целью определения эффективности предлагаемых подходов к проведению ПЦР в режиме реального времени при анализе смешанных культур серогрупп STEC, приведенных в области применения настоящего стандарта: при этом предполагается использовать лабораторный штамм К-12 (С600). Результаты исследования приведены в таблице 2.
|
Таблица 2 — Обнаружение малого числа бактерий STEC в смешанных культурах (см (15]) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
11.3 Исследование включало изучение комплекта из пяти имитационных каркасных тампонов (влажных губок), содержащих целевые микроорганизмы, в том числе серогруппы STEC 0157 и 026. а также фоновую микрофлору (см. таблицу 3). При выборе имитационных каркасных тампонов в качестве матрицы для анализа руководствовались основными положениями (см. (19]).
|
Таблица 3 — Состав проб, исследованных в ходе межлабораторного испытания Значения приведены в КОЕ/см3 | ||||||||||||||||||
|
ГОСТ isorrs 13136—2016
|
Окончание таблицы 3 | ||||||||||||||||||||||||
|
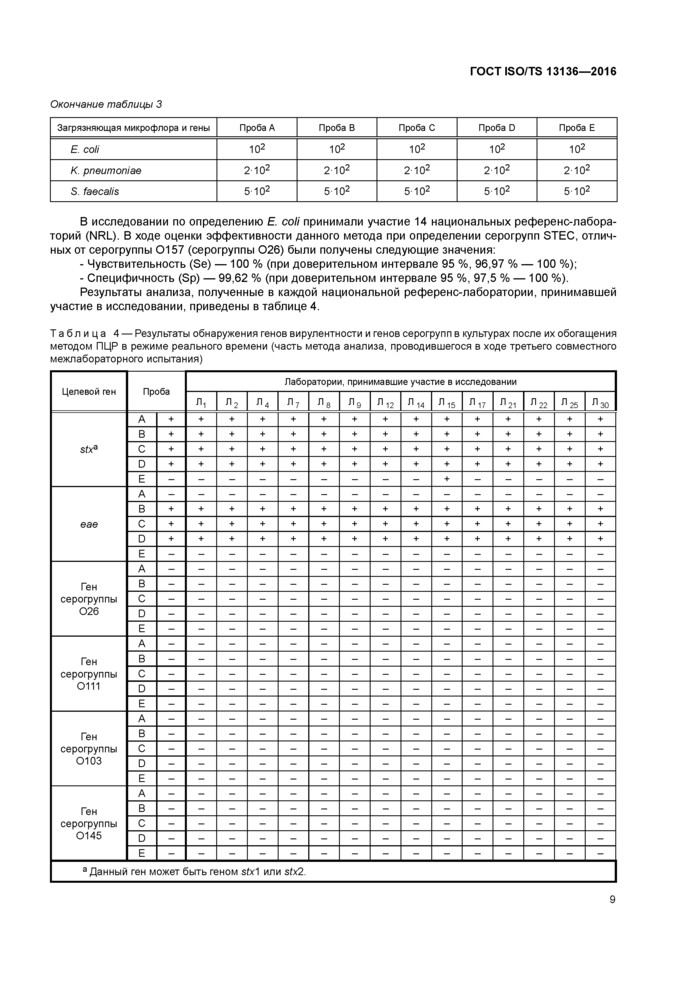
В исследовании по определению Е. coli принимали участие 14 национальных референс-лабораторий (NRL). В ходе оценки эффективности данного метода при определении серогрупп STEC. отличных от серогруппы 0157 (серогруппы 026) были получены следующие значения.
- Чувствительность (Se) —100 % (при доверительном интервале 95 %. 96.97 % — 100 %);
- Специфичность (Sp) — 99.62 % (при доверительном интервале 95 %. 97,5 % — 100 %). Результаты анализа, полученные в каждой национальной референс-лаборатории. принимавшей
участие в исследовании, приведены в таблице 4.
|
Таблица 4 — Результаты обнаружения генов вирулентности и генов серогрупп в культурах после их обогащения методом ПЦР в режиме реального времени (часть метода анализа, проводившегося в ходе третьего совместного |
|
9 |
Национальные референс-лаборатории получили запрос, чтобы они также проводили выделение серогрупп STEC. отличных от серогруппы 0157. которыми загрязнены пробы. Результаты данной процедуры приведены в таблице 5.
|
Таблица 5 — Выделение бактерий серогруппы STEC 026 из культур после их обогащения методом ПЦР в режиме реального времени (Подтверждение позитивных культур путем выделения инфекционных штаммов, проводившегося в ходе третьего совместного межлабораторного испытания) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Отчет, включающий всесторонний анализ результатов, полученных в ходе третьего совместного межлабораторного испытания, имеется в открытом доступе (см. (9)).
Расширенная неопределенность U, характеризующая концентрацию бактерий в инокуляте, равна 0,22 log10 КОЕ/см3 для штаммов Е. coli (соответствующая информация приведена в (20]).
10
ГОСТ ISOATS 13136—2016
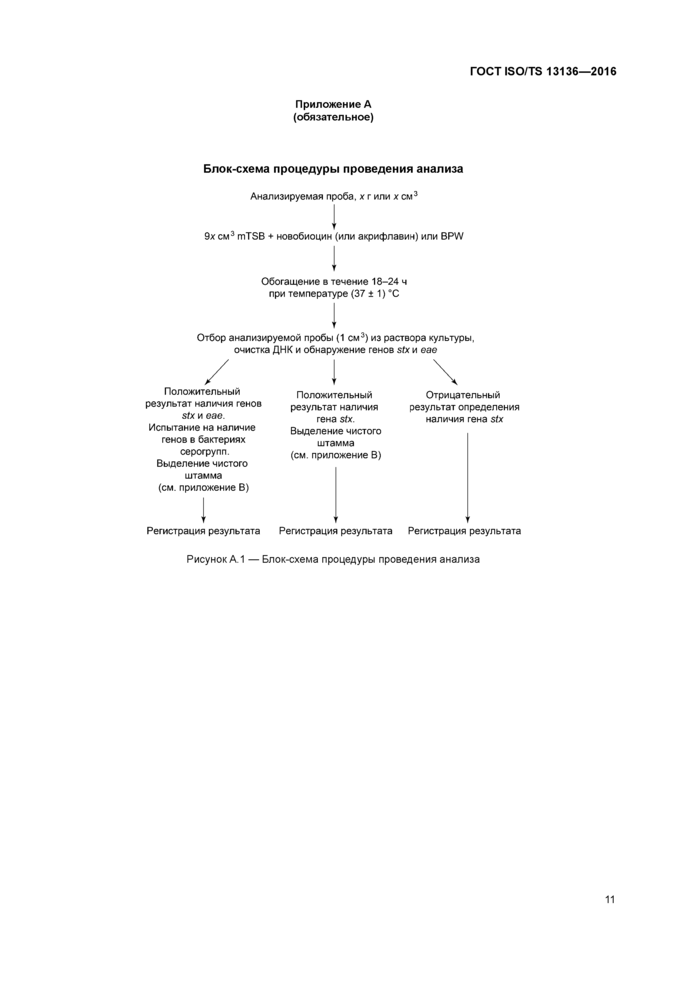
Приложение А (обязательное)
Блок-схема процедуры проведения анализа
Анализируемая проба, х г или ж см3
I
9х см3 mTSB ♦ новобиоцин (или акрифпавич) или BPW
I
Обогащение в течение 18-24 ч при температуре (37 11) *С
I
Отбор анализируемой пробы (1 см3) из раствора культуры, очистка ДНК и обнаружение генов six и оно
Положительный результат наличия генов
StX И ООО
Испытание на наличие генов в бактериях серогрупп. Выделение чистого штамма (см приложение В)
1
Регистрация результата
I
Положительный результат наличия гена stx Выделение чистого штамма (см приложение В)
Регистрация результата
Отрицательный результат определения наличия гена stx
Регистрация результата
Рисунок А1 — Блок-схема процедуры проведения анализа
11
ГОСТ ISO/TS 13136—2016
Приложение В (обязательное)
Блок-схема процедуры выделения и подтверждения')
В 1 В случае, если проба положительная для одного из генов серогрупп. на которые распространяется данный метод, в целях повышения эффективности выделения бактерий допускается проводить обогащение бактерий определенных серогрупп
Обогащение в жидкой питательной среде или путем штрихового посева на поверхности подходящей плотной среды Инкубирование в течение 18-24 ч при температуре (37 ♦ 1) *С
I
Отбор не более 50 колоний Е сой с характерной морфологией Посев на питательный агар (отдельных колоний) и инокуляция колоний в воду (колоний, объединенных по 10 штук).
Проведение ПЦР-аналиэа на обнаружение генов stx и еае в изолированных или объединенных колониях
I
Если колония является положительной на наличие генов, выявленных при анализе, переходят к следующей нижеуказанной процедуре Если слившиеся колонии также демонстрируют положительный результат, инкубируют колонии на питательном агаре Проводят испытание отдельных колоний, выполняя операции со слившимися колониями.
как это указано выше
I
Устанавливают принадлежность положительных колоний к виду Е. сой и определяют серогрулпу в случае, если проба была положительной, что было установлено в ходе проведения ПЦР для обнаружения конкретной серогруппы (например, при помощи ПЦР
или реакции агглютинации)
1
Штамм отправляют в реферейс-лабораторию для более подробного определения характеристик (данная процедура не является обязательной)
I
Регистрация результата
Рисунок В 1 — Блок-схема процедуры выделения чистых штаммов и подтверждения результата
4 См приложение F.
ГОСТ isorrs 13136—2016
Содержание
1 Область применения .................................................................1
2 Нормативные ссылки .................................................................1
3 Термины и определения...............................................................2
4 Сущность метода ....................................................................2
5 Разбавители, питательные среды и реактивы..............................................3
6 Оборудование и лабораторная посуда...................................................4
7 Отбор проб..........................................................................5
8 Подготовка пробы для испытания.......................................................5
9 Методика проведения испытания .......................................................5
10 Интерпретация результатов...........................................................7
11 Эксплуатационные характеристики.....................................................7
Приложение А (обязательное) Блок-схема процедуры проведения анализа ....................11
Приложение В (обязательное) Блок-схема процедуры выделения и подтверждения .............12
Приложение С (справочное) Идентификация Escherichia coli, продуцирующих Шига-токсин (STEC),
путем выявления генов вирулентности мультиплексной ПЦР-амллификацией
и обнаружение продуктов ПЦР путем электрофореза в агарозном геле...........13
Приложение D (справочное) Внутренний контроль амплификации............................16
Приложение Е (справочное) Праймеры и зонды для ПЦР-анализа............................17
Приложение F (обязательное) Выделение чистых штаммов STEC............................19
Приложение ДА (справочное) Сведения о соответствии ссылочных международных стандартов
межгосударственным стандартам.........................................20
Библиография........................................................................21
гост iso/ts 131зе—2016
Введение
Escherichia coli. продуцирующая Шига-токсин (STEC). является патогенной кишечной палочкой, которая может вызывать диарею, а также более тяжелые заболевания человека, такие как геморрагический колит и гемолитико-уремический синдром (ГУС). Хотя существует большое количество серо-rpynn STEC. серогруппы 0157. 026. 0111. 0103 и 0145 гарантированно вызывают наиболее тяжелые заболевания, в частности, ГУС (см. (1)).
Примечание — Необходимо принимать во внимание все виды Eschenchia coli. выделяющие Шига-токсин. поскольку они патогенны для человека и потенциально способны вызвать тяжелые заболевания в зависимости от характеристик рисков, которые несут в себе продовольственные товары (готовая к употреблению пищевая продукция или пищевая продукция, предназначенная для потребления после технологической обработки, такой как пастеризация, приготовление пищи и т п.. проводимой с целью снижения широкого спектра бактерий, присутствующих в пищевой продукции), а также от состояния здоровья лкэдей, потребляющих пищевую продукцию
Кроме того, учитывая высокую геномную пластичность данного вида бактерий, не исключено, что новые механизмы вирулентности могут приводить к созданию новых серопатогрупп, таких как продуцирующая Шига-токсин энтероагрегативная серопатогруппа Е cob 0104. которая вызвала вспышки ГУС в Германии и Франции в мае и июне 2011 г Новые атипичные серопатогруппы Е. cob могут образовываться в результате трансформации генов stx при воздействии бактериофага на штамм Е. coli. патогруппы которого не продуцируют Шига-токсин
Метод, установленный в настоящем стандарте, распространяется на данные атипичные штаммы и они могут быть надежно выявлены, поскольку в них присутствуют гены sfx
IV
МЕЖГОСУДАРСТВЕННЫЙ СТАНДАРТ
Микробиология пищевой продукции и кормов для животных
ПОЛИМЕРАЗНАЯ ЦЕПНАЯ РЕАКЦИЯ В РЕЖИМЕ РЕАЛЬНОГО ВРЕМЕНИ ДЛЯ ОПРЕДЕЛЕНИЯ
ПАТОГЕННЫХ МИКРООРГАНИЗМОВ
Горизонтальный метод определения бактерий Escherichia coli, продуцирующих Шига-токсин, в том числе серогрупп 0157, ОШ, 026, 0103 и 0145
Microbiology of food and animal feed Real-time polymerase chain reaction (PCR)-based method for the detection of food-borne pathogens Honzontal method for the detection of Shiga toxin-producing Eschenchia coli (STEC) and the determination of 0157. ОШ. 026. 0103 and 0145 serogroups
Дата введения — 2017—07—01
1 Область применения
Настоящий стандарт устанавливает метод идентификации бактерий Escherichia coli, продуцирующих Шига-токсин (STEC), посредством обнаружения следующих генов:
a) основных генов вирулентности STEC, stx и еае (см. (2]. [3]);
b) генов, входящих в состав ДНК бактерий Escherichia coli серогрупп 0157, Oil 1. 026. 0103 и 0145 (см. (3]. [4]).
При обнаружении одного или обоих видов генов stx проводят разделение штаммов.
Выделение STEC из проб, в которых присутствуют бактерии с генами, характерными для серогрупп. на которые распространяется метод настоящего стандарта, можно упростить путем использования методик обогащения, предназначенных для работы с серогруппами (например, иммуномагнитного разделения).
В методе, установленном в настоящем стандарте, полимеразную цепную реакцию (ПЦР) в режиме реального времени используют в качестве контрольной методики обнаружения генов вирулентности и генов, присутствующих в геноме серогрупп.
Настоящий стандарт распространяется на:
1) продукцию, предназначенную для потребления человеком и кормления животных;
2) пробы окружающей среды, взятые из зоны производства пищевых продуктов и осуществления технологических операций с пищевыми продуктами;
3) пробы окружающей среды из зоны производства сырья.
В настоящем стандарте применены следующие условные обозначения:
- stx. гены, ответственные за синтез Шига-токсина (используют также синоним — vtx):
- Stx: Шига-токсин (используют также синоним — Vtx (веротоксин)];
- STEC: Escherichia coli. выделяющие Шига-токсин (используют также синоним—VTEC (Escherichia coli, выделяющие веротоксин)!;
- еае: гены интимина.
2 Нормативные ссылки
Для применения настоящего стандарта необходимы следующие ссылочные стандарты. В случае недатированных ссылок применяют последнее издание ссылочного стандарта (включая все его изменения).
ISO 7218 Microbiology of food and animal feeding stuffs. General requirements and guidance for microbiological examinations (Микробиология пищевых продуктов и кормов для животных. Общие требования и рекомендации по микробиологическим исследованиям)
Издание официальное
ISO 20838 Microbiology of food and animal feeding stuffs. Polymerase chain reaction (PCR) for the detection of food-borne pathogens. Requirements for amplification and detection for qualitative methods (Микробиология пищевых продуктов и кормов для животных. Полимеразная цепная реакция (ПЦР) для обнаружения патогенных микроорганизмов в пищевых продуктах. Требования к амплификации и детектированию для качественного анализа)
ISO 22174 Microbiology of food and animal feeding stuffs. Polymerase chain reaction (PCR) for the detection of food-borne pathogens. General requirements and definitions (Микробиология пищевых продуктов и кормов для животных. Полимеразная цепная реакция (ПЦР) для обнаружения патогенных микроорганизмов в пищевых продуктах Общие требования и определения)
3 Термины и определения
В настоящем стандарте применены следующие термины с соответствующими определениями:
3.1 Escherichia coli, продуцирующие Шига-токсин; STEC (Shiga toxin-producing Escherichia coli (STEC)J: Штаммы E. coli, имеющие гены, ответственные за синтез Шига-токсина
3.2 Escherichia coli, продуцирующие Шига-токсин (STEC), вызывающие повреждение путем прикрепления бактерий и разрушения ими щеточной каймы эпителия клеток кишечника (Shiga toxin-producing Escherichia coli causing the attaching and effacing lesion. STEC causing the attaching and effacing lesion): Штаммы E. coli. имеющие гены, ответственные за синтез Шига-токсина и ген. ответственный за синтез интимина (еае).
Примечание — Данная комбинация генов вирулентности часто бывает причиной наиболее тяжелых форм болезней, вызванных STEC
3.3 Escherichia coli, продуцирующие Шига-токсин (STEC), серогруппы которых являются высокопатогенными (Shiga toxin-producing Escherichia coli belonging to highly pathogenic serogroups. STEC belonging to highly pathogenic serogroups): Штаммы E. coli. имеющие гены, ответственные за синтез Шига-токсина, ген. ответственный за синтез интимина (еае) и относящиеся к серогруппам 0157. 0111.026. 0103 и 0145.
4 Сущность метода
4.1 Общие положения
Используемый метод состоит из следующих последовательных этапов:
a) микробное обогащение;
b) выделение нуклеиновых кислот (ДНК);
c) выявление генов вирулентности;
d) выявление генов, присутствующих в серогруппах;
e) селекция из положительных проб.
Примечание — Блок-схема проведения исследования представлена на рисунке А 1
4.2 Микробное обогащение
Бактерии STEC выявляют после увеличения их количества путем инкубирования анализируемой пробы в неселективной жидкой питательной среде, например:
a) модифицированный триптон-соевый бульон (триптон-соевый бульон с добавлением соли желчных кислот № 3. концентрация которой — 1.5 г/дм3, и добавлением новобиоцина. концентрация которого — 16 мг/дм3) — mTSB+N;
b) забуференная пептонная вода (BPW);
c) модифицированный триптон-соевый бульон (триптон-соевый бульон с добавлением соли желчных кислот № 3, концентрация которой — 1,5 г/дм3, и добавлением акрифлавина, концентрация которого — 12 мг/дм3) — mTSB+A. для анализа молока и молочных продуктов.
mTSB используют при анализе проб, предположительно содержащих большие количества нецелевых микроорганизмов.
Новобиоцин и акрифлавин подавляют рост грамположительных бактерий и способствуют росту грамотрицательных бактерий, в том числе STEC.
2
ГОСТ isorrs 13136—2016
BPW применяют для анализа проб, которые предположительно содержат подвергнутые стрессу целевые бактерии (например, пробы замороженных продуктов), чтобы реанимировать подвергнутые стрессу бактерии STEC. и предположительно содержащие меньшее количество нецелевых микроорганизмов. чем свежие пробы.
Примечание — Добавление ноеобиоцина является спорным и было исследовано несколькими авторами Было установлено, что минимальная ингибирующая концентрация антибиотика для бактерий STEC, не относящихся к серогруппе 0157. ниже, чем для штаммов серогруплы 0157 (см (5)) Добавление ноеобиоцина при обогащении в mTSB. когда концентрация ноеобиоцина является типичной (20 мг/дм3), как это установлено в (19). приводило к подавлению роста приблизительно одной трети клеток штаммов бактерий, не относящихся к серогруппе 0157 (см (6)). что повышает риск ложно-отрицательных результатов
4.3 Выделение нуклеиновых кислот (ДНК)
Нуклеиновые кислоты экстрагируют в соответствии с требованиями используемой системой ПЦР в режиме реального времени.
4.4 Выявление целевых генов
Очищенную ДНК используют для обнаружения следующих целевых генов:
- основные гены вирулентности для STEC: генов stx. кодирующих токсины Шига и еае-гена. кодирующего белок массой 90 кда — интимин, участвующих в механизме адгезии, которая является характерным признаком штаммов STEC. вызывающих тяжелые заболевания. Гены stx кодируют семейство токсинов, в том числе два основных типа: s/xl и stx2. Stx2 состоит из семи четко установленных вариантов — от stx2а до stx2д (см. (22)). Варианты генов stx2a. stx2b и stx2c, присутствующие в штаммах бактерий STEC, в числе генов, которые приведены в разделе 1. представляют собой целевые гены, кодирующие Шига-токсин. на которые распространяется настоящий стандарт.
В базе данных GenBank генам, кодирующим данные варианты sfx2, присвоены следующие обозначения: stx2a: Х07865; stx2b: L11078; stx2c М59432.
- ген еае, кодирующий интимин:
-гены для определения соответствующей серогруплы: г1ЬЕ(0157). wbdl(0111), wzx(026), /7тр1 (0145) и wzx(O103).
4.5 Выявление
Выявление целевых генов проводят в соответствии с требованиями используемой системы ПЦР в режиме реального времени.
4.6 Селекция из положительных проб
Если есть подозрение, что в пробе присутствуют STEC, проводят селекцию микроорганизмов. В случае обнаружения по меньшей мере одной серогруплы, которая описана в разделе 1. допускается проводить обогащение данной серогруплы (например, методом иммуномагнитного разделения), после чего проводят посев на агар с триптоном, желчью и глюкуроновой кислотой (ТВХ) или на определенную селективную среду, если существует такая возможность (см. приложение F. примечания 2 и 3). Данную операцию проводят с целью облегчения отделения STEC от фоновой микрофлоры.
5 Разбавители, питательные среды и реактивы
В ходе проведения анализа, если не указано иное, используют реактивы только признанной аналитической степени чистоты и стерильную, дистиллированную, деминерализованную воду или воду эквивалентной чистоты.
5.1 Питательные среды
5.1.1 Модифицированный триптон-соевый бульон (mTSB)
5.1.1.1 Базовый состав и pH среды
Ферментативный перевар казеина — 17 г;
Ферментативный перевар сои — 3 г;
0(+)-глюкоза — 2.5 г;
Натрия хлорид — 5 г;
3
ГОСТ ISO/TS 13136—2016
Калий фосфорнокислый двухзамещенный (KjHPO^ — 4 г;
Соли желчных кислот № 3 — 1.5 г;
Дистиллированная вода —до 1000 см3; pH (7.4 ±0.2) ед. pH.
Процедура приготовления среды следующая: компоненты сухой питательной среды растворяют в воде. Устанавливают pH на уровне (7.4 ± 0,2) ед. pH при температуре 25 °С и стерилизуют автоклавированием при температуре 121 °С в течение 15 мин.
5.1.1.2 Раствор новобиоцина Состав раствора:
Новобиоцин —0.16 г;
Вода —10 см3.
Процедура приготовления раствора следующая: новобиоцин растворяют в воде и стерилизуют путем мембранной фильтрации с помощью фильтров с размерами лор 0.22 мкм или 0.45 мкм.
Раствор готовят в день его использования.
5.1.1.3 Раствор акрифлавина Состав раствора:
Акрифлавин — 0.12 г;
Вода —10 см3.
Процедура приготовления раствора следующая: акрифлавин растворяют в воде и стерилизуют путем мембранной фильтрации с помощью фильтров с размерами пор 0,22 мкм или 0,45 мкм.
Раствор готовят в день его использования.
5.1.1.4 Приготовление готовой питательной среды
Непосредственно перед использованием 1 см3 раствора новобиоцина (см. 5.1.1.2) или раствора акрифлавина добавляют (см. 5.1.1.3) к 1000 см3 охлажденного бульона mTSB (сгл. 5.1.1.1).
Конечная концентрация новобиоцина в mTSB должна быть 16 мг/дм3.
Конечная концентрация акрифлавина в mTSB должна быть 12 мг/дм3.
5.1.2 Забуференная пептонная вода (BPW)
Состав и pH BPW:
Пептоны —10 г;
Натрия хлорид — 5.0 г;
Натрий фосфорнокислый двухзамещенный двенадцативодный (Na2HP04 • 12 Н20) — 3.5 г;
Калий фосфорнокислый однозамещенный (КН2РОд) — 1.5 г;
Вода — до 1000 см3; pH (7.0 ± 0.2) ед. pH.
Процедура приготовления BPW следующая: компоненты сухой питательной среды растворяют в воде. Устанавливают pH на уровне (7.0 ± 0.2) ед. pH при температуре 25 °С и стерилизуют автоклавированием при температуре 121 °С в течение 15 мин.
5.2 Реактивы для экстракции нуклеиновых кислот (ДНК)
Реактивы, используемые для экстракции нуклеиновых кислот, не приведены в настоящем пункте, поскольку они могут быть разными в зависимости от используемого метода (см 9.3).
5.3 Реактивы, используемые при проведении ПЦР
Используют реактивы, приведенные в ISO 20838.
5.3.1 Олигонуклеотиды (праймеры) и зонды обнаружения
Праймеры и зонды для обнаружения конкретных целевых последовательностей генов стандартными методами ПЦР и методами ПЦР в режиме реального времени приведены в приложениях С и Е.
6 Оборудование и лабораторная посуда
Используют обычное оборудование, необходимое для микробиологической лаборатории (аи. ISO 7218) и. в частности, следующее.
6.1 Баня водяная или нагревательный блок, способные поддерживать температуру до 100 ®С.
6.2 Термостат (ал. ISO 7218). способный поддерживать температуру на уровне (37 ± 1) °С.
4
ГОСТ isorrs 13136—2016
6.3 Оборудование для выделения нуклеиновых кислот (ДНК), выбираемое в зависимости от используемого метода, при необходимости.
6.4 Пипетки вместимостью от 1 мм3 до 100 мм3 (см. (16)).
6.5 Тонкостенные микропробирки для проведения ПЦР в режиме реального времени, вместимостью 0.2 и 0.5 см3, многолуночные микропланшеты для проведения ПЦР или другая подходящая прозрачная одноразовая пластиковая лабораторная посуда.
6.6 Амплификатор. некоторые торговые марки которого доступны на рынке и который выбирают в зависимости от методов, используемых в лаборатории.
6.7 Прибор для обнаружения продуктов ПЦР
Прибор для проведения ПЦР в режиме реального времени позволяет обнаружить световое излучение. которое появляется после ПЦР-анализа с использованием 5'-нуклеазы.
6.8 Перистальтический смеситель со стерильными пакетами, в некоторых случаях оснащенный прибором регулирования скорости и времени.
7 Отбор проб
Отбор проб не является частью метода, установленного в настоящем стандарте. Информация об отборе проб приведена в определенных стандартах на конкретную продукцию, а также в определенных нормативных документах. В случае, когда стандарт, где приведена информация об отборе проб конкретного вида продукции, отсутствует, рекомендуется, чтобы заинтересованные стороны пришли к соглашению по данному вопросу.
В лабораторию необходимо доставить представительную пробу, которая не была повреждена или изменена в процессе транспортирования или хранения.
8 Подготовка пробы для испытания
Испытуемую пробу подготавливают в соответствии с конкретным стандартом на конкретный вид продукции. В случае, когда стандарт, где приведена информация о подготовке проб конкретного вида продукции, отсутствует, рекомендуется, чтобы заинтересованные стороны пришли к соглашению по данному вопросу.
9 Методика проведения испытания
9.1 Приготовление анализируемой пробы и исходной суспензии
9.1.1 Общие положения
Используют количество среды для обогащения, необходимое для получения окончательного разведения 10"1 первоначальной анализируемой пробы.
9.1.2 Приготовление анализируемых проб с предположительно высоким уровнем фоновой микрофлоры
В случае твердых проб пищевой продукции порцию анализируемой пробы (х г) в стерильных условиях переносят в мешок перистальтического смесителя, содержащий 9х см3 бульона mTSB, в который добавлен новобиоцин или акрифлавин (см. 5.1.1 4). Рекомендуется использовать мешки, оснащенные фильтрами.
Полученную смесь гомогенизируют в смесителе (см. 6.8; см. ISO 7218).
В случае жидких проб пищевой продукции порцию анализируемой пробы (х см3) в стерильных условиях переносят в мешок перистальтического смесителя, содержащий 9х см3 бульона mTSB для обогащения, в который добавлен новобиоцин или акрифлавин (см. 5.1.1.4).
9.1.3 Приготовление анализируемых проб, предположительно содержащих целевые бактерии, подвергнутые стрессу
Замороженные пробы размораживают при комнатной температуре, затем порцию анализируемой пробы (х г или х см3) переносят в мешок перистальтического смесителя или пробирку, содержащую 9х см3 BPW (см. 5.1.2) и далее действуют, как это описано выше.
5
9.2 Обогащение
9.2.1 Инкубирование
Содержимое мешка перистальтического смесителя, пробирки или флакона (см. 9.1.2) инкубируют при температуре (37 ± 1) X в течение 18—24 ч.
9.2.2 Контроль над процессом (для ПЦР в реальном времени)
Контроль над процессом выполняют в соответствии с положениями, изложенными в ISO 22174.
Руководство по внутреннему контролю амплификации (IAC) и контролю над процессом приведены в приложении D и С.3.8.
9.3 Выделение нуклеиновых кислот (ДНК)
Методики экстракции нуклеиновых кислот (ДНК) должны соответствовать методикам, применяемым в отношении грамотрицательных бактерий. Полный перечень методов приведен в (10). Кроме того, допускается использовать имеющиеся в продаже наборы в соответствии с инструкциями изготовителя.
9.4 ПЦР-амплификация (для ПЦР в режиме реального времени)
9.4.1 Общие положения
Используемый процесс ПЦР-амплификации применяют при проведении ПЦР в режиме реального времени.
Необходимо выполнять все требования к ПЦР-амплификации, которые изложены в ISO 20838.
Информация о праймерах и зондах для обнаружения, использующихся при проведении ПЦР в режиме реального времени, приведена в приложении Е.
9.4.2 Обнаружение продуктов ПЦР
Прибор для обнаружения продуктов ПЦР улавливает световое излучение, как только оно возникает в процессе амплификации.
9.4.3 Интерпретация результатов ПЦР-анализа
Результаты, полученные при проведении ПЦР. в том числе контрольные, информация о которых приведена в ISO 22174 и в приложении D. обрабатывается программным обеспечением прибора для амплификации. В ходе процесса амплификации программное обеспечение прибора контролирует ПЦР-амплификацию с использованием 5‘-нуклеазы посредством анализа интенсивности флуоресценции ре-портерного красителя для каждой пробы. Rn. ДRn — это разность Rn и контрольного значения интенсивности флуоресценции репортерного красителя, определенного в результате первых нескольких циклов. Значение порогового цикла. Cf. определяют как номер цикла, при котором значение интенсивности флуоресценции Д/?я данной пробы превышает установленное значение порогового цикла.
В случае, если были получены сомнительные результаты, проводят проверку кривых значений излучения на графике. Для проб, демонстрирующих положительный результат, характерна кривая, на которой явно выражено усиление флуоресценции, начиная с количества циклов, значения которых соответствуют Ct
Если полученные значения приводят к непредвиденным результатам, то анализ повторяют.
Данный метод является последовательным (см. блок-схему на рисунке А.1). Стадии данного метода следующие:
- стадия 1: обнаружение генов, кодирующих Шига-токсин и гена, кодирующего интимин (см. ПЦР А. приведено в приложении Е: данную процедуру можно также провести с помощью дуплексной ПЦР);
- стадия 2 а): проведение испытания проб, содержащих бактерии с генами stx и еае гена, на молекулярное серогруплирование (см. ПЦР Б. приведено в приложении Е);
- стадия 2 б): Выделение штаммов бактерий из проб, бактерии в которых содержат гены, кодирующие Шига-токсин; допускается использовать метод обогащения конкретных серогрупп (например, им-муномагнитное разделение) для повышения эффективности отделения клеток бактерий STEC от проб, содержащих хотя бы одну из серогрупп. приведенных в разделе 1 (см. 9.5 и рисунок В 1).
9.5 Выделение штаммов
Выделение штаммов бактерий STEC необходимо для подтверждения того, что положительный результат ПЦР-анализа получен из ДНК именно этих живых бактериальных клеток.
В случае наличия одного из генов, характерных для серогрупп. приведенных в разделе 1. допускается проведение обогащения конкретной серогруппы с целью повышения эффективности стадии
6