ГОСТ 1030-81
Вода хозяйственно-питьевого назначения. Полевые методы анализа
Купить ГОСТ 1030-81 — бумажный документ с голограммой и синими печатями. подробнее
Распространяем нормативную документацию с 1999 года. Пробиваем чеки, платим налоги, принимаем к оплате все законные формы платежей без дополнительных процентов. Наши клиенты защищены Законом. ООО "ЦНТИ Нормоконтроль"
Наши цены ниже, чем в других местах, потому что мы работаем напрямую с поставщиками документов.
Способы доставки
- Срочная курьерская доставка (1-3 дня)
- Курьерская доставка (7 дней)
- Самовывоз из московского офиса
- Почта РФ
Распространяется на природные воды хозяйственно-питьевого назначения и устанавливает полевые методы органолептического и физико-химического анализов в процессе гидрогеологической съемки, поисков и разведки источников хозяйственно-питьевого водоснабжения.
Данные о замене опубликованы в ИУС 10-1987
Оглавление
1. Определение температуры и органолептических показателей
2. Определение химического состава
| Дата введения | 01.01.1983 |
|---|---|
| Добавлен в базу | 01.09.2013 |
| Завершение срока действия | 01.01.1988 |
| Актуализация | 01.01.2021 |
Этот ГОСТ находится в:
- Раздел Автомобильные дороги
- Раздел Экология
Организации:
| 11.08.1981 | Утвержден | Государственный комитет СССР по стандартам | 3765 |
|---|---|---|---|
| Издан | Издательство стандартов | 1984 г. |
House keeping and potable water. Field methods of analysis
Чтобы бесплатно скачать этот документ в формате PDF, поддержите наш сайт и нажмите кнопку:

стр. 1

стр. 2

стр. 3

стр. 4

стр. 5

стр. 6

стр. 7

стр. 8

стр. 9

стр. 10

стр. 11

стр. 12

стр. 13

стр. 14

стр. 15

стр. 16

стр. 17

стр. 18

стр. 19
стр. 20

стр. 21

стр. 22
Группа Н09
ГОСУДАРСТВЕННЫ Й СТАНДАРТ СОЮЗА ССР
ВОДА ХОЗЯЙСТВЕННО-ПИТЬЕВОГО НАЗНАЧЕНИЯ
Полевые методы анализа
House keeping and potable water.
Field methods of analysis
Постановлением Государственного комитета СССР по стандартам от 11 августа 1981 г. № 376$ срок действия установлен
с 01.01.83 до 01.01.88
Несоблюдение стандарта преследуется по закону
Настоящий стандарт распространяется на природные воды хозяйственно-питьевого назначения и устанавливает полевые методы органолептического и физико-химического анализов в процессе гидрогеологической съемки, поисков и разведки источников хозяйственно-питьевого водоснабжения.
Общие требования по ГОСТ 24902-81.
1. ОПРЕДЕЛЕНИЕ ТЕМПЕРАТУРЫ И ОРГАНОЛЕПТИЧЕСКИХ ПОКАЗАТЕЛЕЙ (ЗАПАХ, ВКУС, ЦВЕТНОСТЬ, МУТНОСТЬ)
1.1. Определение температуры
Температуру воды определяют термометром с делениями на 0,1° С. Для определения температуры воды колодцев и источников применяют родниковые («ленивые») термометры, для воды буровых скважин — максимальные термометры. Помимо ртутных термометров используют также электрические термометры и термоэлементы.
1.2. Определение запаха
В чистый, без запаха стеклянный сосуд вместимостью 50—100 мл наливают анализируемую воду, примерно на */« объема, закрывают его стеклянной или корковой пробкой, затем взбалтывают пробу, вынимают пробку и сразу нюхают.
Интенсивность запаха оценивают по пятибалльной системе по ГОСТ 3351-74. При этом учитывают характер запаха (землистый, нефтепродуктов и.др.).
Издания официальное ★
Перепечатка поспрошена
211
14
1.3. Определение вкуса
Вкус воды определяют при отсутствии подозрений на ее загрязненность. Анализируемую воду набирают в рот, не проглатывая, и задерживают несколько секунд. Интенсивность вкуса оценивают по пятибалльной системе по ГОСТ 3351-74. При этом учитывают характер привкуса (соленый, кислый, щелочный, металлический и др.).
1.4. Определение цветности
Цветность определяют только в прозрачной природной воде. Пробирку диаметром 14—16 мм из бесцветного стекла наполняют анализируемой водой до высоты 10—12 см и рассматривают сверху на белом фоне.
Качественно различают следующие степени цветности: бесцветная, слабо-желтоватая, светло-желтая, желтая, интенсивно желтая.
1.5. Определение мутности
Пробирку диаметром 14—16 мм из бесцветного стекла наполняют анализируемой водой до высоты 10—12 см и рассматривают сверху на черном фоне. Качественно различают следующие степени мутности: прозрачная, слабо опалесцирующая, опалесцирующая, слабо мутная, мутная, очень мутная.
2. ОПРЕДЕЛЕНИЕ ХИМИЧЕСКОГО СОСТАВА
2.1. Общие требования
2.1.1. Для анализа химического состава воды применяют: колориметрические методы для определения pH, общего железа, нит-рит-иона, иона аммония, нитрат-иона, фтора и суммы металлов;
объемные методы — для определения карбоната-иона, гидро-карбонат-иона, хлор-иона, иона кальция и общей жесткости;
турбидиметрические методы — для определения сульфат-иона;
расчетные методу для определения иона магния, иона натрия, сухого остатка и карбонатной жесткости.
Допускается, кроме установленных настоящим стандартом методов, применять другие методы (например, инструментальные), удовлетворяющие требованиям ГОСТ 24902-81.
2.1.2. Применяемые реактивы должны быть «чистые для анализа» (ч.д. а.) или «химически чистые» (х.ч.), если квалификация специально не оговорена в методе анализа.
2.1.3. Колориметрически^ методы определения компонентов проводят способом «стандартных серий» в пробирках одинакового диаметра из бесцветного стекла с меткой 5 мл. Следует иметь в виду, что возникающие в процессе колориметрических реакций окраски, обычно малоустойчивы. Поэтому шкалы модельных эталонов для сравнения приходится готовить многократно одновременно с проведением анализа воды. Для устранения этбго недостатка
212
Железо начинает оказывать заметное влияние на определение фтора при массовой концентрации железа более 2 мг/дм3. Поэтому в сильно железистых водах определение фтора по настоящему стандарту не проводят.
2.2.7.2. Подготовка к анализу
Приготовление лантанализаринкомплексонового лака Лак готовят смешиванием следующих растворов Раствор соли лантана: 1,293 г бромистого лантана (ЬаВгзХ
Х7Н20) или 0,905 г хлористого лантана (LaCl3-6H20) помещают в мерную колбу вместимостью 100 мл, приливают 10 мл кислоты (1:10) и доводят дистиллированной водой до метки;
раствор ализаринкомплексона: 0,240 г ализаринкомплексона
помещают в небольшой стаканчик или стеклянную бюксу, приливают 11 мл аммиачного буферного раствора и растирают стеклянной палочкой до полного растворения реактива;
аммиачный буферный раствор: 20 г уксуснокислого аммония (CH3COONH4) растворяют в мерной колбе вместимостью 100 мл в 30—50 мл дистиллированной воды, приливают 10 мл 25%-ного раствора аммиака и доводят до метки дистиллированной водой;
ацетатный буферный раствор (рН = 5,0) : 41 г уксуснокислого аммония (CH3COONH4) помещают в мерную колбу вместимостью 250 мл; смачивают дистиллированной водой, приливают 30 мл ледяной уксусной кислоты и доводят до метки дистиллированной водой.
Лантанализаринкомплексоновый лак готовят из указанных растворов следующим образом: в мерную колбу вместимостью 1 л наливают 50,0 мл раствора соли лантана, прибавляют весь объем (250 мл) ацетатного буферного раствора и весь объем (11,0 мл) раствора ализаринкомплексона, приливают 500 мл ацетона и доводят дистиллированной водой до метки. Ввиду токсичности и горючести ацетона реактив готовят под тягой.
Раствор хранят в склянке из стекла с притертой пробкой в темном месте. Срок годности б мес.
Приготовление буферной смеси
3,60 г янтарной кислоты растирают в ступке с 7,00 г тетра-борнокислого натрия (Na2B407* ЮН20). Смесь хранят в плотно закрытом сосуде.
2.2.7.3. Проведение анализа
Анализируемую воду наливают в колориметрическую пробирку до метки 5 мл, вносят ~0,1 г буферной смеси и перемешивают до растворения; pH раствора при этом будет ~ 5,0.
Затем приливают к пробе при помощи пипетки с резиновой грушей 2,0 мл лантанализаринкомплексонового лака, перемешивают и через 20 мин сравнивают со шкалой эталонов, приготовленных в аналогичных условиях.
221
Для приготовления шкалы эталонов пользуются разбавленным стандартным раствором фтористого натрия, приготовленным по ГОСТ 4212-76.
Шкалу составляют для следующих значений F (м^/дм3): 0,0; 0,5; 0,7| 1,0; 1,2; 1,5; 1,7; 2,0.
Если окраска жидкости окажется синее, чем крайний эталон (2,0 мг/дм3), анализируемую воду разбавляют в 2—5 раз дистиллированной водой и определение повторяют. При вычислении результатов учитывают величину разбавления.
При повышенном содержании в анализируемой воде растворенных органических веществ определить фтор по настоящему стандарту невозможно (окраска колориметрируемой жидкости получается другого оттенка, чем шкала эталонов). В этих случаях порцию анализируемой воды объемом 20—25 мл встряхивают в течение 3—5 мин с небольшим количеством порошка активированного угля марки БАУ или ОУ щелочной и фильтруют. Определение фтора выполняют из фильтрата.
2.3. Объемные методы
2.3.1. Определение массовой концентрации к а р-бонат-иона (СОз2^)
2.3.1 Л. Определение основано на реакции карбонат-иона с ионами водорода:
С023~ + Н+~> нсо-.
Анализ проводится титриметрическим методом в присутствии индикатора фенолфталеина. Присутствие аналитических концентраций карбонат-иона возможно лишь в водах, pH которых более 8,0—8,2.
2.3.1.2. Подготовка к анализу
Приготовление 0,1%-ного раствора фенолфталеина — по ГОСТ 4919.1-77.
Приготовление 0,05 н. титрованного раствора соляной кислоты из фиксанала.
2.3.1.3. Проведение анализа
В пробирку с меткой 10 мл наливают до метки анализируемую воду и прибавляют из тарированной капельницы ~0,1 мл 0,1 %-ного раствора фенолфталеина. Если вода остается бесцветной или слабо-розовой — карбонат-ион отсутствует. Если жидкость окрасится в отчетливо розовый цвет, ее титруют 0,05 н. раствором соляной кислоты до тех пор, пока окраска побледнеет до слаборозовой. Полученный раствор оставляют для определения гидрокарбонат-иона (см. п. 2.3.2.3).
2.3.1.4. Обработка результатов
Массовую концентрацию карбонат-иона (X) в мг/дм3 вычисляют по формуле
222
V • н • 60 • 1000 Vl
где V — объем титрованного раствора соляной кислоты, израсходованный на определение, мл; н — нормальность раствора соляной кислоты;
Vi — объем воды, взятый для анализа, мл;
60 — эквивалентная масса карбонат-иона в данной реакции.
Полученный результат округляют до целых чисел.
2.3.2. Определение массовой концентрации гидрокарбонат-иона (НСОз-)
2.3.2.1. Определение основано на реакции гидрокарбонат-иона с ионами водорода:
нсо^- + Н+ С02 + Н20.
Анализ проводится титриметрическим методом в присутствии индикатора метилового оранжевого.
2.3.2.2. Подготовка к анализу
Приготовление 0,1%-ного раствора метилового оранжевого — по ГОСТ 4919.1-77.
Приготовление 0,05 и. титрованного раствора соляной кислоты из фиксанала
2.3.2.3. Проведение анализа
В пробирку с меткой 10 мл наливают до метки анализируемую воду и прибавляют 1—2 капли 0,1%-ного раствора метилового оранжевого. Титруют жидкость 0,05 н. раствором соляной кислоты до перехода желтой окраски жидкости в розовую.
Если в анализируемой воде был найден карбонат-ион, определение гидрокарбонат-иона продолжают в той же пробе, в которой определялся карбонат-ион (см. п. 2.3.1.3). При вычислении массовой концентрации количество титрованного раствора соляной кислоты уменьшают на объем, пошедший при определении карбонат-иона.
2.3.2.4. Обработка результатов
Массовую концентрацию гидрокарбонат-иона (Х{) в мг/дм3 вычисляют по формуле
v (Г* - Ks) ■ н . 61 • 1000 л1-- ,
V4
где Уг — объем титрованного раствора соляной кислоты, израсходованный на определение НСОз”, мл; у3 — объем титрованного раствора соляной кислоты, израсходованный на определение СОз2", мл; н — нормальность раствора соляной кислоты;
V4 — объем воды, взятый на анализ, мл;
61—эквивалентная масса гидрокарбонат иона.
223
ГОСТ 1030—B1
Полученный результат округляют до целых чисел.
2.3.3. Определение массовой концентрации хлор-иона (С1~)
Меркуриметрический метод
2.3.3.1. Определение основано на реакции хлор-иона с ионом двухвалентной ртути, которая образует растворимую, но мало-диссоциированную соль — хлорную ртуть:
Hg2+ + 2С1~ HgCl2.
В качестве индикатора используется дифенилкарбазон. Величина pH титруемого раствора устанавливается в интервале 3,0—3,5 (контролируется индикатором бромфеноловым синим в процессе проведения анализа).
2.3.3.2. Подготовка к анализу
Приготовление смешанного индикатора (раствор)
0,50 г дифенилкарбазона и 0,050 г бромфенолового синего растворяют в 100 мл спирта ректификата.
Приготовление азотной кислоты (1:200)
Приливают мерным цилиндром 5 мл концентрированной азотной кислоты к 1 л дистиллированной воды.
Приготовление азотнокислой ртути 0,05 н. титрованного раствора.
8,4 г азотнокислой ртути (Hg(N03)2-I/2H20) растворяют в 100 мл дистиллированной воды, содержащей 1—1,5 мл концентрированной азотной кислоты, и доводят раствор дистиллированной водой до 1 л. Нормальность раствора азотнокислой ртути устанавливают по 0,05 н. раствору хлористого натрия, проводят титрование по п. 2.3.3.3.
2.3.3.3. Проведение анализа
В пробирку с меткой 10 мл наливают до метки анализируемую воду и прибавляют из тарированной капельницы около 0,1 мл раствора смешанного индикатора до фиолетовой окраски. Прибавляют по каплям раствор азотной кислоты (1:200) до перехода окраски в желтый цвет и еще 1—2 капли азотной кислоты. Подготовленную таким образом жидкость титруют 0,05 н. раствором азотнокислой ртути до перехода окраски из желтой в сине-фиолетовую.
2.3.3.4. Обработка результатов
Массовую концентрацию хлор-иона (Хг) в мг/дм3 вычисляют по формуле
Х.=
У5 • н - 35,5. 1000
где Уь — объем титрованного раствора азотнокислой ртути, израсходованный на определение, мл;
224
ГОСТ 1030—St
н — нормальность титрованного раствора азотнокислой рту--ти;
Уб — объем воды, взятый на анализ, мл;
35,5 — эквивалентная масса хлора.
Полученный результат округляют до целых чисел.
Аргентометрический метод
2.3.3.5. Метод основан на реакции хлор-иона с ионом серебра;
Ag++Cl--*Ag СЦ.
В качестве индикатора используется хромовокислый калий.
Титрование можно выполнять в пределах pH (5,0—8,0).
2.3.3.6. Подготовка к анализу
Приготовление 10%-ного раствора хромовокислого калия
10 г К2СЮ4 растворяют в 90 мл дистиллированной воды.
Приготовление 0,05 н. титрованного раствора азотнокислого серебра
Готовят из фиксанала или из препарата соли азотнокислого серебра. В последнем случае навеску 8,5 г AgN03 растворяют в 1 л дистиллированной воды и устанавливают нормальность по 0,05—0,1-н. раствору хлористого натрия, приготовленному из фиксанала. Титрование проводят по п. 2.3.3.3.
2.3.3.7. Проведение анализа
В пробирку с меткой 10 мл наливают до метки анализируемую воду, прибавляют из тарированной капельницы — 0,1 мл 10%-ного раствора хромовокислого калия и титруют 0,05 н. раствором азотнокислого серебра до появления неисчёзающей бурой окраски.
2.3.3.8. Обработка результатов
Массовую концентрацию хлор-иона (Хг) в мг/дм3 вычисляют по п. 2.3.3.4.
2.3.4. Определение общей жесткости
2.3.4.1. Определение основано на реакции солей кальция и магния с реактивом двунатриевая соль этилендиаминтетрауксусной кислоты (трилон Б):
Са2+ + Na2H2R Na2CaR + 2Н+;
Mg2+ + NaaH2R -* Na2MgR + 2H+,
где R — радикал этилендиаминтетрауксусной кислоты.
Анализ проводится титриметрическим методом в присутствии, индикатора эриохромчерный Т.
2.3.4.2. Подготовка к анализу
Приготовление буферного раствора
225
5 г хлористого аммония (NH4CI) растворяют в дистиллированной воде, добавляют 40 мл 10%-ного раствора аммиака, приготовленного по ГОСТ 4517-75, и доводят объем дистиллированной водой до 100 мл.
15-781
ГОСТ 1030—Sf
Приготовление индикатора эриохромчерный Т по ГОСТ 4919.1-77.
Приготовление 0,05 н. титрованного раствора трилона Б из фиксанала
2.3.4.3. Проведение анализа
В пробирку с меткой 10 мл наливают >до метки анализируемую воду из тарированной капельницы., приливают 0,2 мл буферного раствора и вносят 0,02—0,03 г смеси индикатора эриохромчерный Т. Раствор перемешивают и медленно титруют 0,05 н. раствором трилона Б до перехода окраски из винно-красной через фиолетово-синюю в ярко-голубую.
2.3.4.4. Обработка результатов
Общую жесткость (Аз) в мг-экв/дм3 вычисляют по формуле v v7 • н • 1000
3~ V*
где V7 — объем титрованного раствора трилона Б, израсходованный на определение, мл; н — нормальность раствора трилона Б;
Fs — объем воды, взятый на анализ, мл.
Полученный результат округляют до второго десятичного знака.
2.3.5. Определение массовой концентрации иона кальция (Са^)
2.3.5.1. Определение основано на реакции иона кальция с реак
тивом двунатриевая соль этилендиаминтетрауксусной кислоты (трилон Б): Са2+ + Na2H2R Na2CaR + 2Н+,
где R — радикал этилендиаминтетрауксусной кислоты.
Анализ проводится титриметрическим методом в сильно щелочной среде (pH ~ 12—13) в присутствии индикатора флуорексона (кальцеин).
2.3.5.2. Подготовка к анализу
Приготовление флуорексона (кальцеина) —по ГОСТ 4919.1-77.
Приготовление соляной кислоты (1 :100)
Приливают мерным цилиндриком 10 мл концентрированной соляной кислоты (плотность 1,19 г/см3) к 1 мл дистиллированной воды.
Приготовление 10%-ного раствора гидроокиси натрия
10 г гидроокиси натрия растворяют в 90 мл дистиллированной воды. Раствор отстаивают 2 дня и хранят в плотно закрытом полиэтиленовом сосуде.
Приготовление 0,05 н. титрованного раствора трилона Б из фиксанала
2.3.5.3. Проведение анализа
В пробирку с меткой 10 мл наливают до метки анализируе-
226
мую воду и удаляют гидрокарбонат-ион. Для этого в пробирку помещают кусочек бумаги конго и прибавляют по каплям раствор соляной кислоты (1:100) при интенсивном перемешивании шариком-мешалкой до перехода окраски бумаги из красной в сиреневую. При перемешивании удаляется и большая часть двуокиси углерода, мешающего определению.
Бумагу извлекают и прибавляют из тарированной полиэтиленовой капельницы — 0,5 мл 10%-ного раствора гидроокиси натрия и 0,02—0,03 г индикатора флуорексон (индикатор целесообразно отбирать титрованным мерничком). Раствор перемешивают и титруют на фоне черной бумаги 0,05 н. раствором трилона Б до перехода флуоресцирующей окраски из зеленой в розовую.
2.3.5.4. Обработка результатов
Массовую концентрацию иона кальция (А4) в мг/дм3 вычисляют по формуле
у — v* * н * 20 ‘ 1000
где Уд — объем титрованного раствора трилона Б, израсходованный на определение, мл; н — нормальность раствора трилона Б;
Ую— объемы воды, взятой на анализ, мл;
20 — эквивалентная масса кальция.
Полученный результат округляют до целых чисел.
2.4. Турбидиметрические методы
2.4.1. Определение массовой концентрации сульфонат-иона (SO^)
2.4. J.l. Определение основано на реакции сульфат-иона с ионами бария и образовании осадка сульфата бария.
SO2" + Ва2+ — BaS041 .
Для определения величины бсадка используются различные варианты турбидиметрического метода.
В водах, содержащих SO^~ менее 30 мг/дм3, определение проводят путем сравнения образовавшегося осадка с эталонами или со «стандартной суспензией», а при содержании более 30 мг/дм3 — по измерению высоты столба суспензии сульфата бария.
Анализ выполняют в прозрачной воде. Если вода содержит механические примеси и взвеси, ее предварительно фильтруют.
Метод определения сравнения с эталонами
2.4.1.2. Определение основано на сравнении интенсивности образовавшегося помутнения -от выделившегося осадка сульфата бария с модельными эталонами, приготовленными одновременно с анализируемой пробой.
2.4.1.3. Подготбвка к анализу
Приготовление азотнокислого бария (насыщенный раствор)
227
10 г Ва (N03)2 растворяют при нагревании в 100 мл дистиллированной воды и охлаждают до комнатной температуры. Выпавшие кристаллы азотнокислого бария не препятствуют использованию раствора.
2.4.1.4. Проведение анализа
Анализируемую воду наливают в пробирку до метки 10 мл, добавляют из капельницы 2 капли раствора соляной кислоты (1:1) и 0,5 мл насыщенного раствора азотнокислого бария, взбалтывают и через 10—15 мин сравнивают со шкалой эталонов, приготовленных в аналогичных условиях в пробирках того же диаметра я цвета стекла.
Шкалу рекомендуется составить для следующих значений SO42'-(мг/дм3): 0; 5; 10; 20; 25; 30.
Метод определения с применением стандартной суспензии
2.4.1.5. Определение основано на сопоставлении интенсивности образовавшегося помутнения от выделившегося осадка сульфата бария, с помутнением, образующимся при внесении в воду, помещенную в контрольную пробирку, суспензии сульфата бария.
2.4.1.6. Подготовка к анализу
Приготовление азотнокислого бария (насыщенный раствор) и соляной кислоты (1:1) по п. 2.4.1.3.
Приготовление стандартной суспензии
Стандартную суспензию готовят смешиванием двух растворов.
Раствор А—1,09 г высушенного при температуре 105—110° С Ва (ЫОз)2, растворяют в мерной колбе вместимостью 1 л в дистиллированной воде.
Раствор Б — 0,1 н. (приблизительно) раствор серной кислоты, в которую добавляют 50 мл 5%-ного раствора питьевого желатина на каждый литр кислоты (5 г желатина растворяют в 95 мл горячей воды).
Стандартную суспензию готовят смешиванием равных объемов растворов А и Б и через 10—15 мин употребляют. 1 мл такой суспензии содержит 0,486 мг BaSQt, что соответствует 0,200 мг SO42-. Суспензия пригодна в течение рабочего дня.
2.4.1.7. Проведение анализа
Анализируемую воду наливают в пробирку из бесцветного стекла до метки 10 мл, добавляют из капельницы 2 капли раствора соляной кислоты (1:1) и 0,5 мл насыщенного раствора азотнокислого бария и взбалтывают. Через 10—15 мин перемешивают еще раз. Одновременно с последним перемешиванием в другую пробирку такого же диаметра наливают 10 мл той же анализируемой воды и при помощи градуировочной пипетки приливают хорошо взболтанную свежеприготовленную «стандартную суспензию» до образования помутнения, одинакового по интенсивности с помутнением в первой пробирке.
228
2.4.1.8. Обработка результатов
Массовую концентрацию сульфат-иона (Х5) в мг/дм3 вычисляют по формуле
Х5 = Уп • 0,2 . 100,
где Vu — объем стандартной суспензии, мл;
0,2 — концентрация суспензии, соответствующая мг/см3;
100 — коэффициент пересчета на объем 1 л.
2.4.1.9. Метод определения по высоте столба суспензии
Определение основано на изменении степени помутнения от
осадка сульфата бария, образующегося в результате реакции сульфат-иона и иона бария при соответствующих условиях проведения анализа.
2.4.1.10. Аппаратура .
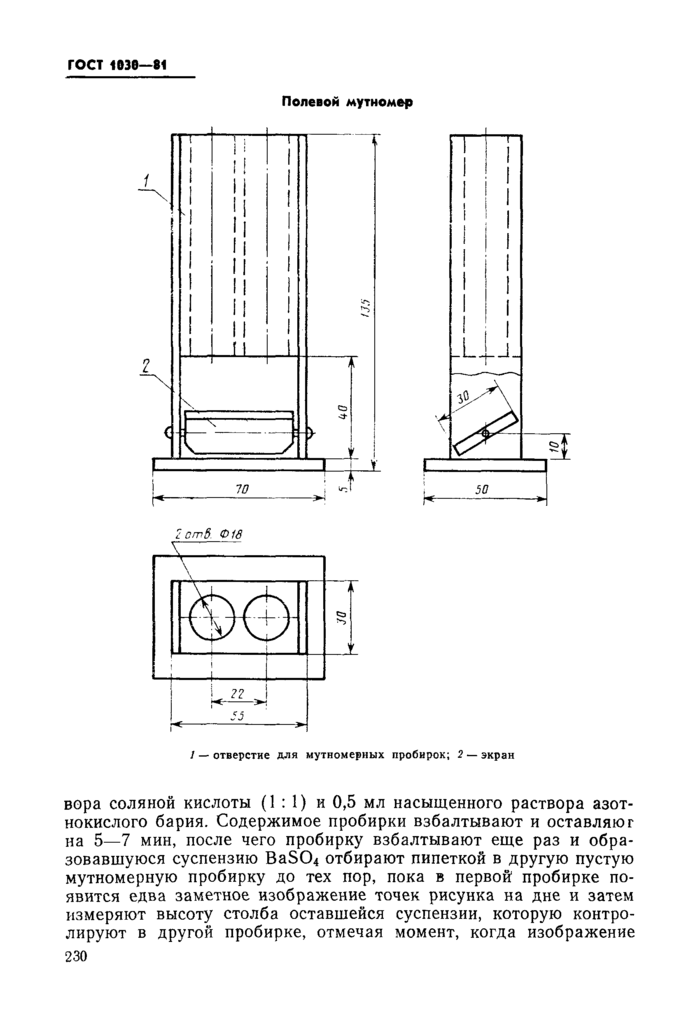
Пробирки мутномерные. Применяются пробирки бесцветного прозрачного стекла внутренним диаметром 14,0—14,5 мм и вместимостью около 20 мл. Пробирки градуируются по высоте до 100 мм через 1 мм (градуировка может быть заменена полоской миллиметровой бумаги, наклеенной на пробирку). На дне пробирки черным лаком или другой несмывающейся краской наносят по всей площади дна крест с четырьмя точками. Толщина линий креста и точек около 1 мм.
Мутномер полевой. Полевой мутномер (см. чертеж) представляет собой брусок, выполненный из дерева или темной пластмассы с двумя просверленными сквозными отверстиями для мутномерных пробирок. Он укрепляется на плоской фанерной или пластмассовой подставке. Нижняя часть бруска обрезана на расстоянии 40 мм от подставки. В обрезанной части бруска к стенкам мутномера крепится экран, представляющий собой дощечку с белой поверхностью. Экран должен иметь возможность вращаться на 45°.
2.4.1.11. Подготовка к анализу
Приготовление азотнокислого бария (насыщенный раствор) и соляной кислоты (1:1) по п. 2.4.1.3.
2.4.1.12. Проведение анализа
Для проведения анализа пользуются двумя мутномерными пробирками. На каждую пробирку надевают резиновое кольцо и обе пробирки вставляют в отверстия мутномера. Передвижением колец пробирки фиксируют таким образом, чтобы нижняя часть пробирок была выдвинута в вырез мутномера на расстояние около 1 см. Экран устанавливают под углом 45° к подставке' (при этом дно пробирок окажется на требуемом расстоянии 2 см от экрана).
Работа проводится при рассеянном, но достаточно сильном (200—500 лк) дневном освещении экрана.
В одну из мутномерных пробирок наливают анализируемую воду до высоты 100 мм. Прибавляют из капельницы 2 капли раст-
229
гост юзе—8i
Полевой мутномер
2 от8. Ф18
1 — отверстие для мутномерных пробирок; 2 — экран
|
Полевой мутномер |
|
2 от8. Ф18 |
1 — отверстие для мутномерных пробирок; 2 — экран
вора соляной кислоты (1:1) и 0,5 мл насыщенного раствора азотнокислого бария. Содержимое пробирки взбалтывают и оставляют на 5—7 мин, после чего пробирку взбалтывают еще раз и образовавшуюся суспензию BaS04 отбирают пипеткой в другую пустую мутномерную пробирку до тех пор, пока в первой пробирке появится едва заметное изображение точек рисунка на дне и затем измеряют высоту столба оставшейся суспензии, которую контролируют в другой пробирке, отмечая момент, когда изображение 230
разрешается при полевых анализах выполнять колориметрирова-ние не только путем сравнения возникающей окраски с модельными -эталонами, но и с имитирующими эту окраску устойчивыми растворами или окрашенными пленочными шкалами. При работе с пленочными шкалами применяют колориметрические пробирки, внутренний диаметр которых не выходит за пределы (12,8 ±0,4) мм.
2.1.4. Объемные методы определения компонентов проводят в пробирках вместимостью 15—20 мл и имеющих метку 10 мл. Перед определением пробирку два-три раза ополаскивают анализируемой водой и затем наливают воду до метку. Жидкость перемешивают стеклянной палочкой с шариком на конце. На пробирку с титруемой жидкостью надевают резиновое кольцо и помещают в полевой мутномер (см. п. 2.4.1.4).
Для анализа маломинерализованных вод допускается применять менее концентрированные титрованные растворы (0,02 н.— 0,03 н.).
2.2. Калориметрические методы
2.2.1. Определение в о д о р о д н о г о п о к а з а т е л я (pH)
2.2.1.1. Определение выполняют для интервала pH 5,4—8,0 колориметрическим методом, применяя универсальный индикатор.
2.2.1.2. Подготовка к анализу
Приготовление универсального индикатора
Раствор А. 0,100 г индикатора бромтимоловый синий растворяют в фарфоровой ступке в присутствии 8,0 мл 0,02 н. раствора гидроокиси натрия, прибавляют 50 мл этилового спирта ректификата, переносят в мерную колбу вместимостью 250 мл и доводят объем раствора дистиллированной водой до метки.
Раствор Б. 0,025 г индикатора метиловый красный растворяют в фарфоровой ступке в присутствии 4,6 мл 0,02 н. раствора гидроокиси натрия, прибавляют 50 мл этилового спирта ректификата, переносят в мерную колбу вместимостью 250 мл и доводят объем раствора дистиллированной водой до метки.
Растворы А и Б сливают в соотношении 1:1.
Приготовление 0,1%-ного раствора метилового оранжевого — по ГОСТ 4919.1-77.
2.2.1.3. Проведение анализа
Анализируемую воду наливают в колориметрическую пробирку до метки 5 мл, прибавляют при помощи тарированной капельницы 0,10 мл универсального индикатора, перемешивают жидкость и сразу же сравнивают со шкалой эталонов.
Эталоном служат буферные растворы, к 5 мл каждого из которых добавляют 0,10 мл универсального индикатора. Буферные растворы готовят по ГОСТ 4919.2-77.
Шкалу составляют для следующих значений pH: 5,4; 5,6; 5,8; 6,0; 6,2; 6,4; 6,6; 6,8; 7,0; 7,2; 7,4; 7,6; 7,8с 8,0.
213
точек на ее дне скроется. Берут средний результат обоих измерений и по табл. 3 находят содержание сульфат-иона в анализируемой воде.
|
Таблица 3 | ||||||||||||||||||||||||||||||||
|
Если изображение на дне мутномерной пробирки при высоте столба суспензии окажется менее 40 мм, пробу разбавляют дистиллированной водой в два раза и определение повторяют.
Если в этом случае суспензия окажется слишком плотной, повторяют определение при разбавлении анализируемой воды в 4 раза и т. д., увеличивая разбавление каждый раз вдвое. Общую величину разбавления учитывают при вычислении окончательного результата.
2.5. Расчетные методы
2.5.1. Определение массовой концентрации иона магния (Mg^)
Массовую концентрацию иона магния (Хв) в мг/дм3 вычисляют по формуле
Х6 = (а—с . 0,05) • 12,16,
где а —общая жесткость, мг/дм3;
с — массовая концентрация нона кальция, мг/дм3;
0,05 — коэффициент для пересчета нона кальция в миллиграмм-эквивалентную форму;
12,16 — эквивалентная масса магния.
Полученный результат округляют до целых чисел.
2.5.2. Определение массовой концентрации иона натрия (Na+)
Массовую концентрацию иона натрия (Х7) в мг/дм3 вычисляют по формуле
Х7 = (2Л —а). 23,
где БД—сумма анионов, мг-экв/дм* (см. табл. 4); а — общая жесткость, мг-экв/дм3;
23 — эквивалентная масса натрия.
231
Если pH окажется равным или менее 5,4, анализируемую воду проверяют качественной реакцией, добавляя к 5 мл воды каплю 0,1%-ного раствора метилового оранжевого. ЕсЛи окраска при этом окажется розовой, записывают результаты: рН<4,5. Анализ пробы на другие компоненты в этом случае прекращают. Если окраска окажется желтой, записывают результат: pH<5,4. Если pH воды окажется больше 8,0, записывают результат: рН>8Д
2.2.2. Определение массовой концентрации железа (Fe)
Ортофенантролиновый метод
2.2.2.1. Определение основано на способности иона закисного железа образовывать в интервале pH 3—9 с ортофенантролином комплексное соединение, окрашенное в оранжево-красный цвет.
Окисное железо восстанавливают до закисного солянокислым гидроксиламином в нейтральной или слабокислой среде
2.2.2.2. Подготовка к анализу
Приготовление 10%-ного раствора гидроокиси натрия
10 г гидроокиси натрия растворяют в 90 мл дистиллированной воды. Раствор хранят в полиэтиленовом сосуде.
Приготовление 10%-ного раствора солянокислого гидроксцла-мина.
10 г солянокислого гидроксиламина (NH2OH-HCl) растворяют в 90 мл дистиллированной воды.
Приготовление ацетатного буферного раствора
250 г уксуснокислого аммония (CH3COONH4) растворяют в 150 мл дистиллированной воды. Добавляют 700 мл ледяной уксусной кислоты и доводят объем до 1 мл дистиллированной водой.
Приготовление 0,1%-ного раствора ортофенантролина
0,10 г моногидрата ортофенантролина (Ci2H8N2*H20) растворяют в 100 мл дистиллированной воды, подкисленной 3—4 каплями соляной кислоты (1:1). Реактив хранят в темном стеклянном сосуде с притертой пробкой.
2.2.2.3. Проведение анализа
10 мл анализируемой воды в зависимости от pH среды доводят из капельниц 10%-ным раствором гидроокиси натрия или соляной кислотой (1:10) в присутствии индикаторной бумаги конго до перехода окраски бумаги в фиолетовый цвет (рН-4—5). Приливают поочередно 0,2 мл 10%-ного раствора солянокислого гидроксиламина, 1 мл ацетатного буферного раствора и 0,50 мл 0,1%-ного раствора ортофенантролина. После прибавления каждого реактива содержимое пробирки перемешивают. Оставляют раствор не менее чем на 15—20 мин для полного развития окраски. Окрашенный раствор отливают в сухую колориметрическую пробирку до метки 5 мл и сравнивают со шкалой эталонов железа, приготовленных в аналогичных условиях.
214
Для приготовления шкалы эталонов пользуются разбавленными стандартными растворами соли Мора, приготовленными по ГОСТ 4212-76.
Шкалу составляют для следующих значений Fe (мг/дм3): 0,00; 0,10; 0,20; 0,25; 0,30; 0,40; 0,50; 0,70; 1,00; 1,50.
Если окраска жидкости окажется интенсивнее крайнего эталона (1,5 мг/дм3), анализируемую воду разбавляют ё десять раз дистиллированной водой, не содержащей железа, и определение повторяют. При вычислении результатов учитывают величину разбавления.
Дипиридиловый метод
2.2.2.4. Определение основано на способности иона закисного железа образовывать в интервале pH 3,5—8,5 с а, а'-дипиридилом комплексное соединение, окрашенное в красный цвет.
Окисное железо восстанавливают до закисного солянокислым гидроксиламином в нейтральной или слабокислой среде.
2.2.2.5. Подготовка к анализу
Приготовление 0,1%-наго раствора а, а'-дипиридила
0,10 г реактива растворяют в 100 мл дистиллированной воды.
Реактив хранят в темном стеклянном сосуде с притертой пробкой,.
Приготовление 10%-ного раствора гидроокиси натрия, 10%-ного раствора солянокислого гидроксиламина и ацетатного буферного раствора по п. 2.2.2.2.
2.2.2 6. Проведение анализа
10 мл анализируемой воды в зависимости от pH среды доводят из капельниц 10%-ным раствором гидроокиси натрия или соляной кислотой (1:10) в присутствии индикаторной бумаги конго до перехода окраски бумаги в фиолетовый цвет (pH = 4—5). Приливают поочередно 0,2 мл 10%-ного раствора солянокислого гидроксиламина, 1 мл ацетатного буферного раствора и 1,0 мл 0,1 %-ного раствора а, а'-дипиридила. После прибавления каждого реактива содержимое пробирки перемешивают. Оставляю^ раствор не менее чем на 15—20 мин для полного развития окраски. Окрашенный раствор отливают в сухую колориметрическую пробирку до метки 5 мл и сравнивают со шкалой эталонов железа, приготовленных в аналогичных условиях.
Для приготовления шкалы эталонов пользуются разбавленными стандартными растворами соли Мора, приготовленными по ГОСТ 4212-76.
Шкалу составляют для следующих значений Fe (мг/дм3): 0,00; 0,10; 0,20; 0,25; 0,30; 0,40; 0,50; 0,70; 1,00; 1,50.
Если окраска жидкости окажется интенсивнее крайнего эталона (1,5 мг/дм3), анализируемую воду разбавляют в десять раз дис-
215
тиллированной водой, не содержащей железа, и определение повторяют. При вычислении результатов учитывают величину разбавления.
2.2.3. Определение массовой концентрации нитрит-иона (N02~)
2.2.3.1. Определение основано на реакции нитрит-иона с реактивом Грисса. Сульфаниловая кислота и альфа-нафтиламин, содержащиеся в реактиве, образуют в кислой среде с нитрит-ионом окрашенное в розовый цвет азосоединение.
2.2.3.2. Подготовка к анализу
Приготовление реактива Грисса
Тщательно смешивают растертые в ступке до порошкообразного состояния 89 г винно-каменной кислоты, 10 г сульфаниловой кислоты и 1 г альфа-нафтиламина. Герметически закрытый реактив при хранение в темном месте не должен окрашиваться.
2.2.3.3 Проведение анализа
Анализируемую воду наливают в колориметрическую пробирку до метки 5 мл, добавляют около 0,05 г порошка реактива Грисса, раствор взбалтывают до растворения кристаллов и через 15— 20 мин сравнивают со шкалой эталонов азотистокислого натрия, приготовленных в аналогичных условиях. Если температура окружающей среды будет ниже 20—25° С, время выстаивания воды увеличивают или подогревают раствор до 50—60° С и через 5— 10 мин колориметрируют.
Для приготовления шкалы эталонов пользуются соответственно разбавленным стандартным раствором азотистокислого натрия, приготовленным по ГОСТ 4212-76.
Шкалу составляют для следующих значений N02- (мг/дм3): 0ДО; 0,01; 0,02; 0,05; 0,10; 0,20; 0,50; 1,00.
Если окраска жидкости окажется интенсивнее крайнего эталона (1,00 мг/дм3), записывают результат: ГТО2" > 1 мг/дм3.
2.2 4. Определение массовой концентрации иона аммония (NH4+)
2.2.4.1. Определение основано на реакции иона аммония с реактивом Несслера. Дву йодистая ртуть, содержащаяся в реактиве, образует в щелочной среде окрашенное в желтый цвет соединение йодистый меркураммоний (0 = Hg2 = NH2 — J).
2.2.4 2t Подготовка к анализу
Приготовление реактива Несслера — по ГОСТ 4517-75. Реактив хранят в полиэтиленовой капельнице.
Приготовление виннокислого калия — натрия (сегнетовая соль)
Сегнетовую соль подвергают сушке в термостате при температуре 80—90° С в течение 2—3 ч для удаления аммонийных солей, затем проверяют на чистоту проведением холостого опыта.
216
гост 10№-st
2.2.4.3. Проведение анализа
Анализируемую воду наливают в колориметрическую пробирку до метки 5 мл, добавляют ~0,1 г сегнетовой соли и прибавляют из тарированной капельницы 1,0 мл реактива Несслера. Раствор перемешивают и через 1—2 мин сравнивают со шкалой эталонов хлористого аммония, приготовленных в аналогичных условиях.
Для приготовления шкалы пользуются соответственно разбавленным стандартным раствором хлористого аммония, приготовленным по ГОСТ 4212-76.
Шкалу составляют для следующих значений NH4+ (мг/дм3): 0,0; 0,1; 0,2; 0,4; 0,7; 1,0; 1,5; 2,0; 3,0.
Если окраска жидкости окажется интенсивнее крайнего эталона (3,0 мг/дм3), записывают результат: МН4+>3 мг/дм3.
2.2.5. Определение массовой концентрации нитрат-ион а (N03“)
2.2.5 1. Определение основано на реакции между салициловой кислотой и нитрат-ионами с образованием нитропроизводных салициловой кислоты, которые в щелочной среде окрашены в желтый цвет.
Определению мешает ион хлора, если его массовая концентрация в воде превышает 500 мг/дм3, и железо, если его массовая концентрация превышает 0,5 мг/дм3. От влияния более высоких концентраций железа освобождаются в процессе выполнения анализа. При концентрации хлор-иона более 500 мг/дм3 анализируемую воду разбавляют и определение повторяют.
2.2.5.2 Подготовка к анализу
Приготовление 10%-ного раствора салициловой кислоты или салициловокислого натрия
10 г салициловой кислоты или 10 г салициловокислого натрия растворяют в 90 мл этилового спирта (салициловая кислота) или 90 мл дистиллированной воды (салициловокислый натрий).
Приготовление 20%-ного раствора гидроокиси натрия
20 г гидроокиси натрия растворяют в 80 мл дистиллированной воды. Раствор хранят в полиэтиленовом сосуде плотно закрытым.
2.2.5.3 Проведение анализа
В небольшую фарфоровую чашку наливают пипеткой с делениями на 0,01 см3 1,00 мл анализируемой воды. Если в вбде содержится более 0,5 мг/дм3 железа, в чашку вносят ~ 0,1 г сегнетовой соли. Содержание чашки выпаривают досуха на водяной бане*-По охлаждении в чашку добавляют 4—5 капель раствора салициловой кислоты (салициловокислого натрия) так, чтобы смочить весь сухой остаток и осторожно при помощи пипетки с резиновой грушей около 0,5 мл концентрированной серной кислоты плотностью 1,83 г/см3. Стеклянной палочкой тщательно растирают сухой остаток с кислотой по дну и стенкам чашки. Затем, не вынимая палочку из чашки, дают жидкости постоять около 5 мин
217
и добавляют 3—4 мл дистиллированной воды с таким расчетом, чтобы смыть стенки чашки. К полученному сернокислому раствору осторожно приливают маленьким цилиндром или градуированной пробиркой 4—5 мл 20%-ного раствора гидроокиси натрия. При наличии в анализируемой воде нитрат-иона сразу возникает желтая окраска.
Содержимое чашки по стеклянной палочке сливают в пробирку с меткой на 10 мл, ополаскивают чашку и палочку небольшими порциями (по нескольку капель) дистиллированной воды и доводят объем раствора до метки. Если при этом выпадает осадок основных солей магния, то раствор оставляют для отстаивания осадка. Прозрачный раствор наливают в колориметрическую пробирку до метки 5 мл и сравнивают со шкалой эталонов, приготовленных в аналогичных условиях.
Для приготовления шкалы пользуются соответственно разбавленным стандартным раствором азотнокислого калия, приготовленным по ГОСТ 4212-76.
Шкалу составляют для следующих значений N03~ (мг/дм3): 0; 5; 10; 15; 20; 30; 40; 45; 50; 60.
Шкала устойчива в течение 6 мес при хранении в сосудах с притертой стеклянной пробкой в темном месте.
Если окраска жидкости окажется интенсивнее крайнего эталона (60 мг/дм3), анализируемую воду разбавляют в 5 раз дистиллированной водой и определение повторяют. При вычислении результатов учитывают величину разбавления.
2.2.6. Определение массовой концентрации суммы металлов (2Ме)
2.2.6.1. Определение основано на реакции цинка, меди и свинца с дитизоном, в результате которой образуются окрашенные в оранжево-красный цвет дитизонаты металлов.
2.2.6.2. Подготовка к анализу
Приготовление аммиака
Для определения суммы металлов применяют аммиак высокой степени чистоты. При отсутствии аммиака квалификации «ос. ч», его получают насыщением очищенной дистиллированной воды концентрированным аммиаком. Для этого в эксикатор наливают 1 л 25%-ного аммиака и на вкладыш эксикатора ставят выпарительную чашку с 500 мл очищенной воды. Эксикатор закрывают и оставляют на двое суток. Получают в чашке аммиак концентрацией ~ 17%.
Очищенную дистиллированную воду получают повторной перегонкой дистиллированной воды. Воду доводят до необходимой чистоты 0,01%-ным раствором очищенного дитизона в четыреххлористом углероде, добавляя на 300—500 мл воды порциями по 10—15 мл дитизона до тех пор, пока зеленый цвет раствора перестанет изменяться.
Полученный очищенный раствор аммиака разбавляют очищенной дистиллированной водой в 10 раз, прибавляя 10 мл аммиака к 100 мл воды.
Приготовление буферного раствора (pH = 8,0) Смешивают 55,9 мл 0,05 н. раствора буры с 44,1 мл 0,1 н. раствора соляной кислоты (см. ГОСТ 4819.2-77). Компоненты буферных растворов готовят на очищенной дистиллированной воде.
Приготовление четыреххлористого углерода Четыреххлористый углерод очищают перегонкой в стеклянном аппарате с дефлегматором при 76° С на водяной' бане. Перегонку проводят под тягой.
Приготовление очищенного дитизона 1 г препарата растворяют в 100 мл хлороформа. Жидкость помещают в делительную воронку вместимостью 500 мл, добавляют 10 мл 3%-ного раствора аскорбиновой кислоты и 100 мл разбавленного очищенного аммиака (1 : 100). Встряхивают смесь в воронке в течение 2 мин, затем оставляют воронку в вертикальном положении до полного разделения слоев. Нижний хлороформенный слой сливают в другую делительную воронку, следя за тем, чтобы в оранжевом водном аммиачном растворе не осталось капелек хлороформа. Извлечение дитизона свежими порциями аммиачного раствора с аскорбиновой кислотой повторяют до тех пор, пока новые порции водно-аммиачного раствора перестанут окрашиваться в желтый цвет (для этого обычно требуется 5—6 извлечений). Аммиачные экстракты-, содержащие дитизон, собирают вместе в делительную воронку вместимостью 1 л и, осторожно помешивая, нейтрализуют соляной кислотой (1 : 1), пока дитизон выпадет в виде темных хлопьев, а цвет раствора из оранжевого перейдет в бледно-зеленоватый. Полученный дитизон отфильтровывают через бумажный фильтр, два-три раза промывают 1%-ным водным раствором аскорбиновой кислоты, собирая осадок струей из про-мывалки в нижнюю часть фильтра, и оставляют на воздухе до высушивания. Очищенный дитизон хранят в темной бюксе или пробирке с притертой пробкой. Все работы по очистке дитизона проводят в вытяжном шкафу.
Приготовление 0,01%-ного раствора дитизона 0,010 г дитизона растворяют в 100 мл четыреххлористого углерода. Раствор хранят в темном стеклянном сосуде с притертой, пробкой. Срок годности 6 мес.
Чистота применяемых для определения суммы -металлов реактивов и посуды проверяется проведением холостых опытов.
2.2.6.3. Проведение анализа
В ополоснутую несколько раз анализируемой водой делительную воронку вместимостью 100 мл с предварительно нанесенной на ней меткой 25 мл наливают до метки анализируемую воду, прибавляют 1,0 мл буферного раствора н при помощи тарированной
219
капельницы или пипетки с резиновой грушей 2,0 мл-0,01 %-ного раствора дитизона. Встряхивают содержимое воронки в течение 1 мин, вносят из капельницы 2 капли раствора очищенного аммиака (концентрации 1:10) и вновь встряхивают в течение 15— 20 с. Воронку оставляют до расслоения жидкости. После расслоения сливают органический слой в колориметрическую пробирку и сравнивают со шкалой эталонов, приготовленных в тех же условиях.
Основной стандартный раствор суммы металлов готовят из смеси цинка, меди и свинца в молярных соотношениях 3:1:1. С этой целью в мерную колбу вместимостью 1 л помещают 0,392 г металлического цинка, 0,127 г металлической меди и 0,414 г металлического свинца, приливают 20 мл концентрированной азотной кислоты и после растворения металлов доливают дистиллированной водой до метки. Получают 0,01 М раствор суммы металлов.
Раствор устойчив в течение года.
Из основного стандартного раствора готовят рабочий стандартный раствор концентрацией 0,001 ммоль/дм3.
Разбавление проводят в два этапа. Вначале получают промежуточный раствор разбавлением основного раствора в 100 раз, а затем разбавлением промежуточного раствора еще в 100 раз.
Промежуточный раствор-устойчив в течение месяца.
Из рабочего стандартного раствора соответствующим разбавлением приготавливают эталоны шкалы. Все операции по приготовлению конечного рабочего и эталонных растворов выполняются в день, проведения анализа.
Все разбавления проводят очищенной дистиллированной водой.
Шкалу составляют для следующих значений в анализируемой воде 2Ме: 0,0000; 0,0001; 0,0002; 0,0003; 0,0005; 0,0008;
0,0010 ммоль/дм3, что соответствует в условном пересчете 2Ме на цинк (с округлением до одного значащего десятичного знака) 0,000; 0,006; 0,010; 0,020; 0,030; 0,050; 0,060 мг/дм3.
Если окраска жидкости окажется интенсивнее крайнего эталона, результат записывают: 2Ме> 0,001 ммоль/дм3.
2.2.7. Определение массовой концентрации фтора (F)
2.2.7.1. Определение основано на реакции фтора и лантанали-заринкомплексонового лака с образованием окрашенного в синий цвет тройного комплекса фторида, трехвалентного лантана и али-заринкомплексона. Определению мешают алюминий, железо и повышенное содержание органических веществ.
Ввиду того, что содержание алюминия в нейтральных и около-нейтралъных природных водах (рН = 6—8) обычно очень незначительно, влиянием алюминия пренебрегают.
От влияния органических веществ освобождаются, как1 указано в п. 2.2.7.3.
220