ГОСТ Р 57129-2016
Лекарственные средства для медицинского применения. Часть 1. Изучение стабильности новых фармацевтических субстанций и лекарственных препаратов. Общие положения
Купить ГОСТ Р 57129-2016 — бумажный документ с голограммой и синими печатями. подробнее
Распространяем нормативную документацию с 1999 года. Пробиваем чеки, платим налоги, принимаем к оплате все законные формы платежей без дополнительных процентов. Наши клиенты защищены Законом. ООО "ЦНТИ Нормоконтроль"
Наши цены ниже, чем в других местах, потому что мы работаем напрямую с поставщиками документов.
Способы доставки
- Срочная курьерская доставка (1-3 дня)
- Курьерская доставка (7 дней)
- Самовывоз из московского офиса
- Почта РФ
Стандартом определена информация, включаемая в международное регистрационное досье на новые фармацевтические субстанции (молекулы) и изготовленные из них препараты.
Идентичен ICH Q1A:2003
Оглавление
1 Область применения
1.1 Общие принципы
2 Руководства
2.1 Фармацевтические субстанции
2.2 Лекарственный препарат
3 Термины
Библиография
| Дата введения | 01.05.2017 |
|---|---|
| Добавлен в базу | 01.02.2017 |
| Актуализация | 01.01.2021 |
Этот ГОСТ находится в:
- Раздел Экология
Организации:
| 10.10.2016 | Утвержден | Федеральное агентство по техническому регулированию и метрологии | 1344-ст |
|---|---|---|---|
| Разработан | Первый Московский государственный медицинский университет им. И.М. Сеченова | ||
| Издан | Стандартинформ | 2016 г. |
Medicines for medical applications. Part 1. Stability testing of new drug substances and products. General principles
Чтобы бесплатно скачать этот документ в формате PDF, поддержите наш сайт и нажмите кнопку:

стр. 1

стр. 2

стр. 3

стр. 4

стр. 5

стр. 6

стр. 7

стр. 8

стр. 9

стр. 10

стр. 11

стр. 12

стр. 13

стр. 14

стр. 15
стр. 16

стр. 17
стр. 18

стр. 19

стр. 20
ГОСТР
57129—
2016
ФЕДЕРАЛЬНОЕ АГЕНТСТВО ПО ТЕХНИЧЕСКОМУ РЕГУЛИРОВАНИЮ И МЕТРОЛОГИИ
НАЦИОНАЛЬНЫЙ
СТАНДАРТ
РОССИЙСКОЙ
ФЕДЕРАЦИИ
ЛЕКАРСТВЕННЫЕ СРЕДСТВА ДЛЯ МЕДИЦИНСКОГО ПРИМЕНЕНИЯ
Часть 1
Изучение стабильности новых фармацевтических субстанций и лекарственных препаратов. Общие положения
(ЮН Q1A:2003, Stability testing of new drug substances and products, IDT)
Издание официальное
|
Москва Стандартииформ 2016 |
Предисловие
1 ПОДГОТОВЛЕН Государственным бюджетным образовательным учреждением высшего профессионального образования Первым московским государственным медицинским университетом имени И М. Сеченова Министерства здравоохранения Российской Федерации (Первым МГМУ имени И М. Сеченова) на основе собственного перевода на русский язык англоязычной версии стандарта, указанного в пункте 4.
2 ВНЕСЕН Техническим комитетом по стандартизации ТК 458 «Разработка, производство и контроль качества лекарственных средств»
3 УТВЕРЖДЕН И ВВЕДЕН В ДЕЙСТВИЕ Приказом Федерального агентства по техническому регулированию и метрологии от 10 октября 2016г. № 1344-ст
4 Настоящий стандарт идентичен международному документу ЮН Q1A:2003 «Изучение стабильности новых фармацевтических субстанций и лекарственных препаратов» (ЮН Q1A «Stability testing of new drug substances and products». IDT) Международной конференции no гармонизации технических требований для регистрации лекарственных средств для медицинского применения (International Conference on Hamionisation of Technical Requirements for Registration of Pharmaceuticals for Human Use; ICH)
Наименование настоящего стандарта изменено относительно наименования международного документа в связи с особенностями построения межгосударственной системы стандартизации.
5 ВВЕДЕН ВПЕРВЫЕ
Правипа применения настоящего стандарта установлены в статье 26 Федерального закона «О стандартизации в Российской Федерации». Информация об изменениях к настоящему стандарту публикуется в ежегодном (по состоянию на 1 января текущего года) информационном указателе «Национальные стандарты», а официальный текст изменений и поправок — в ежемесячно издаваемом информационном указателе «Национальные стандарты». В случае пересмотра (замены) или отмены настоящего стандарта соответствующее уведомление будет опубликовано в ближайшем выпуске ежемесячного информационного указателя «Национальные стандарты». Соответствующая информация, уведомление и тексты размещаются также в информационной системе общего пользования — на официальном сайте Федерального агентства по техническому регулированию и метрологии (www. gost. ru)
© Стандартинформ. 2016
Настоящий стандарт не может быть полностью или частично воспроизведен, тиражирован и распространен в качестве официального издания без разрешения Федерального агентства по техническому регулированию и метрологии
ГОСТ P 57129—2016
(например. 0. 3 и 6 мес). Если имеются предположения (исходя из опыта, полученного при разработке), что результаты ускоренного исследования будут близки к критериям значительных изменений, следует проводить расширенные исследования или путем испытания дополнительного количества образцов при окончании исследования, или путем включения в план исследования дополнительной временной точки.
Для проведения двенадцатимесячного промежуточного исследования стабильности, обусловленного выявлением значительных изменений при ускоренном исследовании, рекомендуется использование по крайней мере четырех временных точек, включая испытания при закладке на хранение и при завершении исследования (например. 0. 6. 9 и 12 мес).
При соответствующем обосновании исследования стабильности могут быть проведены по сокращенному плану, то есть разработанному с использованием построения матриц или брэкетинга. при котором сокращена частота проведения испытаний или не проводится проверка влияния на стабильность определенных комбинаций факторов.
2.2.7 Условия хранения
Как правило, лекарственный препарат следует оценивать в условиях хранения (с соответствующими допусками), позволяющих проверить его термическую стабильность и. если применимо, его чувствительность к действию влаги или возможность испарения растворителя. Выбранные условия и длительность проведения исследований стабильности должны обеспечивать получение данных о заявляемой в регистрационном досье стабильности лекарственного препарата при хранении, транспортировании и последующем использовании.
Для того чтобы обосновать информацию относительно приготовления, условий хранения и периода использования полученного после растворения или разведения препарата, указываемую в маркировке. должны быть проведены исследования стабильности лекарственного препарата после его восстановления (приготовления раствора) или разведения, если применимо. Такие исследования следует проводить на восстановленном или разведенном препарате в течение заявляемого периода его применения в рамках регистрационных (формальных) исследований стабильности опытных серий; испытания проводят при закладке на хранение и в последней временной точке исследования. Если на момент подачи регистрационного досье данные длительных исследований в течение всего заявленного срока не получены, то должны быть представлены данные на момент истечения 12 мес или на последний период времени, для которого имеются данные по стабильности. Как правило, эти исследования не требуется повторять на сериях, исследуемых в соответствии с обязательством о продолжении исследований стабильности.
На момент подачи регистрационного досье продолжительность длительных исследований не менее трех опытных серий должна составлять не менее 12 мес; исследования следует продолжать в течение времени, достаточного для охвата заявленного срока годности. Дополнительные данные, собранные в течение времени экспертизы регистрационного досье, должны быть представлены уполномоченному органу по его запросу. Данные, полученные при проведении ускоренных исследований и. если необходимо, при промежуточных условиях, могут быть использованы для оценки влияния кратковременных отклонений от условий хранения, указанных в маркировке (такие отклонения могут возникнуть. например, при транспортировании).
|
2.2.7.1 Общий случай | |||||||||||||||
| |||||||||||||||
Условия для длительного исследования, ускоренного исследования, и, если применимо, промежуточных исследований, приведены в последующих разделах. Принципы общего случая используются, если лекарственный препарат не указан в последующих отдельных разделах. Могут быть использованы альтернативные условия исследований, если это обосновано.
Если в ходе длительного исследования стабильности при температуре 25 °С (±2) и относительной влажности 60 % (±5) было выявлено «значительное» изменение в любой период времени шестимесячного ускоренного исследования, то с целью выявления значительных изменений должны быть проведены дополнительные промежуточные исследования стабильности. В первоначальное регистрационное досье должны быть включены данные за шесть месяцев 12-месячного промежуточного исследования стабильности.
Под «значительным изменением» лекарственного препарата понимается следующее:
1 изменение показателя «Количественное определение» на 5 % от первоначального значения: или несоответствие требованиям к активности, при использовании биологических или иммунологических методов анализа;
2 превышение допустимого уровня содержания любого продукта разложения:
3 несоответствие требованиям по описанию, физическим показателям и функциональным характеристикам (например, окраска, разделение фаз. способность к ресуспендированию, комкование, твердость. доставка дозы при однократном нажатии клапана); однако в условиях ускоренных испытаний некоторые изменения физических свойств могут быть ожидаемы (например, размягчение суппозиториев, расплавление кремов);
4 несоответствие требованиям по показателю pH;
5 несоответствие требованиям по показателю «Растворение» при проведении испытания на 12 единицах лекарственной формы.
2.2.7.2 Лекарственные препараты, упакованные в непроницаемую упаковку
Чувствительность к действию влаги или возможность испарения растворителя не представляют
проблемы для лекарственных препаратов, упакованных в непроницаемую первичную упаковку, которая препятствует проникновению влаги или потере растворителя. Таким образом, исследования стабильности лекарственных препаратов, помещенных в непроницаемую упаковку, могут быть проведены в любых условиях контролируемой влажности атмосферы или в условиях влажности окружающей среды.
2.2.7.3 Лекарственные препараты, упакованные в полупроницаемую упаковку
|
Могут быть разработаны и другие сопоставимые подходы для неводных препаратов, содержащих растворители. | |||||||||||||||
| |||||||||||||||
В дополнение к исследованиям физической, химической, биологической и микробиологической стабильности лекарственных препаратов в виде водных растворов, упакованных в полупроницаемую упаковку, необходимо проводить оценку возможной потери воды. Такая оценка может быть проведена в описанных далее условиях с низкой относительной влажностью. В конечном счете необходимо доказать. что лекарственные препараты в виде водных растворов, хранящиеся в полупроницаемой упаковке. могут выдерживать условия низкой относительной влажности.
Если в ходе длительного исследования стабильности при температуре 25 °С (±2) и относительной влажности 40 % (±5) в любой период времени шестимесячного ускоренного исследования было выявлено «значительное» изменение, за исключением потери воды, то с целью выявления значительных изменений должны быть проведены дополнительные промежуточные исследования стабильности при температуре 30 °С. как описано в разделе «Общий случай». Если в ходе ускоренных исследований потеря воды была единственным «значительным» изменением, то промежуточные исследования не проводят. При этом должны быть представлены данные, свидетельствующие об отсутствии риска значительной потери воды в лекарственном препарате в течение заявленного срока годности при его хранении при температуре 25 °С и относительной влажности 40 %.
ГОСТ P 57129—2016
Потеря воды, составляющая 5 % от первоначального содержания, считается «значительным» изменением лекарственного препарата, упакованного в полупроницаемую упаковку после хранения в течение трех месяцев при температуре 40 °С и относительной влажности не более 25 %. Однако при соответствующем обосновании потеря воды, составляющая 5 % или более после хранения в течение трех месяцев при температуре 40 вС и относительной влажности не более 25 %, может быть приемлемой для препаратов в упаковке малых объемов (вместимостью 1 мл или менее) или для однодозовых лекарственных препаратов.
Альтернативой исследованию при стандартных величинах относительной влажности, рекомендуемых в приведенной выше таблице (или для длительных, или для ускоренных исследований), являются проведение исследований стабильности при более высокой относительной влажности и определение потери воды при стандартной величине влажности расчетным путем. С этой целью экспериментальным путем определяют коэффициент проницаемости для упаковки с укупорочным средством или. как показано в приведенном далее примере, используют вычисленный коэффициент скорости потери воды при хранении в атмосфере с двумя различными значениями относительной влажности, но при одной и той же температуре. Коэффициент проницаемости для упаковки с укупорочным средством может быть определен экспериментально с использованием условий «наихудшего случая» для исследуемого лекарственного препарата (например, препарат с наименьшей концентрацией действующего вещества).
Пример определения потери воды
Для препарата с определенной упаковкой укупорочного средства, определенного размера упаковки и при данном объеме наполнения приемлемый подход по определению скорости потери воды при стандартной относительной влажности заключается в вычислении путем умножения скорости потери воды, определенной при альтернативной относительной влажности, но при такой же температуре, на величину скорости потери воды, приведенную далее в таблице. При этом необходимо продемонстрировать линейность скорости потери воды при альтернативной относительной влажности в течение периода хранения.
|
Например, при температуре 40 °С вычисленная скорость потери воаы в процессе хранения при относительной влажности не более 25 % является скорость потери воды, измеренной при относительной влажности 75 %. умноженная на 3.0 — соответствующий коэффициент соотношения скоростей потери воды. | |||||||||||||||
|
|
Можно использовать также подтвержденные коэффициенты скорости потери воды в условиях влажности, отличающихся от условий, указанных в приведенной выше таблице. 2.2.7.4 Лекарственные препараты, предназначенные для хранения в холодильнике | |||||||||
|
Если лекарственный препарат упакован в полупроницаемую упаковку, должна быть представлена соответствующая информация для оценки скорости потери воды в препарате.
Данные по исследованию стабильности при хранении в холодильнике оцениваются, как указано в разделе данного руководства по оценке результатов исследований, за исключением приведенных ниже случаев.
Если значительное изменение было выявлено ме>кду 3-м и 6-м месяцами ускоренного исследования, предлагаемый срок годности должен рассчитываться на основании данных о стабильности, полученных при длительном исследовании в заявляемых условиях хранения.
Если значительное изменение было выявлено в первые три месяца ускоренного исследования, то должно быть представлено обсухщение влияния краткосрочных нарушений условий хранения, указанных
9
в маркировке, например при транспортировании ипи приготовлении. Это обсуждение может быть подкреплено. если приемлемо, данными последующего исследования стабильности на одной серии лекарственного препарата в течение короткого, менее трех месяцев, периода времени с более частым, чем обычно, проведением испытаний. Считается нецелесообразным продолжение шестимесячного исследования стабильности, если значительное изменение было выявлено в первые 3 месяца исследования.
|
2.2.7.5 Лекарственные препараты, предназначенные для хранения в морозильной камере | ||||||
|
Для лекарственных препаратов, предназначенных для хранения в морозильной камере, срок годности должен устанавливаться на основании фактических данных о стабильности, полученных при длительном исследовании. Учитывая отсутствие условий для ускоренного исследования стабильности лекарственных препаратов, предназначенных для хранения в морозильной камере, на одной серии субстанции в условиях повышенных температур [например, при 5 °С(±3) или 25 °С(±2)) в течение приемлемого периода времени должно быть проведено изучение впияния краткосрочных нарушений условий хранения, указанных в маркировке.
2.2.7.6 Лекарственные препараты, предназначенные для хранения при температуре ниже -20*С
Планы исследования стабильности лекарственных препаратов, предназначенных для хранения при температуре ниже -20°С. разрабатываются индивидуально для каждого случая.
2.2.8 Обязательства по проведению исследований стабильности
При отсутствии на дату регистрации продукта данных длительного исследования опытных серий лекарственного препарата в предлагаемых условиях хранения о его стабильности на весь заявляемый в регистрационном досье срок годности должны быть взяты обязательства по продолжению исследований стабильности в лострегистрационный период с целью достоверного подтверждения срока годности.
Если регистрационное досье содержит данные о стабильности, полученные при длительном исследовании трех промышленных серий в предлагаемых условиях хранения на весь заявленный срок использования, то обязательство о проведении исследований стабильности в пострегистрационный период не требуется. В остальных случаях заявитель должен выполнить одно из нижеперечисленного:
1 Обязательство по продолжению исследований стабильности на протяжении всего заявленного срока годности и шестимесячных ускоренных исследований, если в представленном регистрационном досье имеются данные по стабильности по крайней мере трех промышленных серий.
2 Обязательство по продолжению длительных исследований стабильности на протяжении всего заявленного срока годности и ускоренных исследований в течение шести месяцев, а также проведению длительных (в течение всего заявленного срока годности) и шестимесячных ускоренных исследований стабильности дополнительных промышленных серий (чтобы общее число исследованных серий было не менее трех), если в представленном регистрационном досье имеются данные по стабильности менее чем трех промышленных серий.
3 Обязательство по проведению длительного исследования стабильности трех первых промышленных серий в течение заявленного срока годности и ускоренных исследований в течение шести месяцев. если в представленном регистрационном досье отсутствуют данные исследования стабильности промышленных серий лекарственного препарата.
Протокол исследований стабильности, проводимых в рамках взятого обязательства, не должен отличаться от протокола исследования стабильности опытных серий, если иное научно не обосновано.
Если вследствие выявления «значительного» изменения при ускоренных исследованиях стабильности опытных серий понадобилось проведение промежуточных исследований, то исследования стабильности в рамках взятого обязательства могут быть проведены либо в промежуточных, либо в ускоренных условиях. Однако если при проведении ускоренных исследований стабильности в рамках взятого обязательства наблюдается «значительное» изменение, следует также провести исследования при промежуточных условиях.
2.2.9 Оценка данных
Следует применять систематический подход для изложения и оценки информации по стабильности. которая должна включать (в зависимости от ситуации) результаты физических, химических.
Ю
ГОСТ P 57129—2016
биологических и микробиологических испытаний, в том числе особенных характеристик лекарственной формы (например, скорости растворения твердых лекарственных форм для приема внутрь).
Цель исследования стабильности — установить на основе результатов испытаний не менее трех серий лекарственного препарата его срок годности и требуемые условия хранения, применимые ко всем последующим сериям препарата, производимым и упаковываемым в аналогичных условиях. Степень изменчивости отдельных серий влияет на обоснованность прогноза о том. что произведенные в будущем промышленные серии будут соответствовать спецификации в течение заявленного срока годности.
Если данные свидетельствуют об очень незначительной степени разложения и изменчивости, то даже без их статистической обработки заявленный срок годности будет одобрен регуляторным органом В этом случае обычно не требуется проведения формального статистического анализа; достаточно предоставление обоснования его отсутствия.
Приемлемым подходом для оценки количественных показателей, которые, предположительно, должны меняться с течением времени, является определение времени, при котором усредненная кривая скорости разложения с односторонним доверительным интервалом при вероятности 95 % пересекается с нормой (предельно допустимым значением) для этого показателя. Если анализ данных показывает, что изменчивость от серии к серии незначительна, рекомендуется комбинировать индивидуальные данные для каэдой серии в одну общую величину. Это может быть сделано первоначально путем соответствующей статистической обработки (например, вычисление p-значений при уровне значимости более 0.25 для отклонения нулевой гипотезы) величины наклонов регрессионных кривых и величин отрезков, отсекаемых ими на оси ординат (исходные значения показателя) для каждой отдельной серии. Если данные стабильности отдельных серий комбинировать нельзя, общий срок годности должен быть установлен по минимальному времени, в течение которого качество любой серии будет, предположительно, соответствовать установленным требованиям.
Необходимость преобразования данных для последующей оценки методом линейной регрессии будет зависеть от характера любых зависимостей (закономерностей) скорости разложения действующего вещества. Обычно зависимости можно выразить линейной, квадратичной и кубической функцией на арифметической или логарифмической шкале Для проверки статистической степени согласия индивидуальных данных стабильности всех серий и объединенных данных серий (где это возможно) с предполагаемой линией или кривой разложения должны быть использованы статистические методы.
При наличии обоснования допускается для установления на момент регистрации более длительного. по сравнению с имеющимися данными, срока годности ограниченная экстраполяция данных о стабильности, полученных при длительном исследовании в предлагаемых условиях хранения. Это обоснование должно учитывать данные о механизме разложения действующего вещества, результатах ускоренного исследования стабильности, статистической степени согласия любой математической модели, размера серий, наличия дополнительных данных и т. д. Однако при этой экстраполяции считается. что и далее (за временными рамками изученного периода) будут иметь место выявленные закономерности процесса разложения.
При любой оценке изучаются не только данные количественного определения действующего вещества. но и содержание продуктов разложения и другие соответствующие показатели качества. При необходимости, должна быть проведена проверка баланса масс, а также различные характеристики стабильности и разложения.
2.2.10 Указания/маркировка
Указания об условиях хранения должны быть приведены в маркировке в соответствии с нацио-нальными/региональными требованиями. Указываемые условия хранения основаны на оценке данных по изучению стабильности лекарственного препарата. При необходимости, должны быть приведены особые указания, в частности для лекарственных препаратов, которые не выдерживают замораживания. Использование терминов «хранение в условиях окружающей среды» или «хранение при комнатной температуре» не приемлемы.
Таким образом, должна существовать прямая связь между указанием об условиях хранения в маркировке и установленной стабильностью лекарственного препарата. На этикетке упаковки следует указывать дату истечения срока годности.
3 Термины
Приводимые далее определения представлены для улучшения интерпретации руководства (приведены в алфавитном порядке русского языка).
11
|
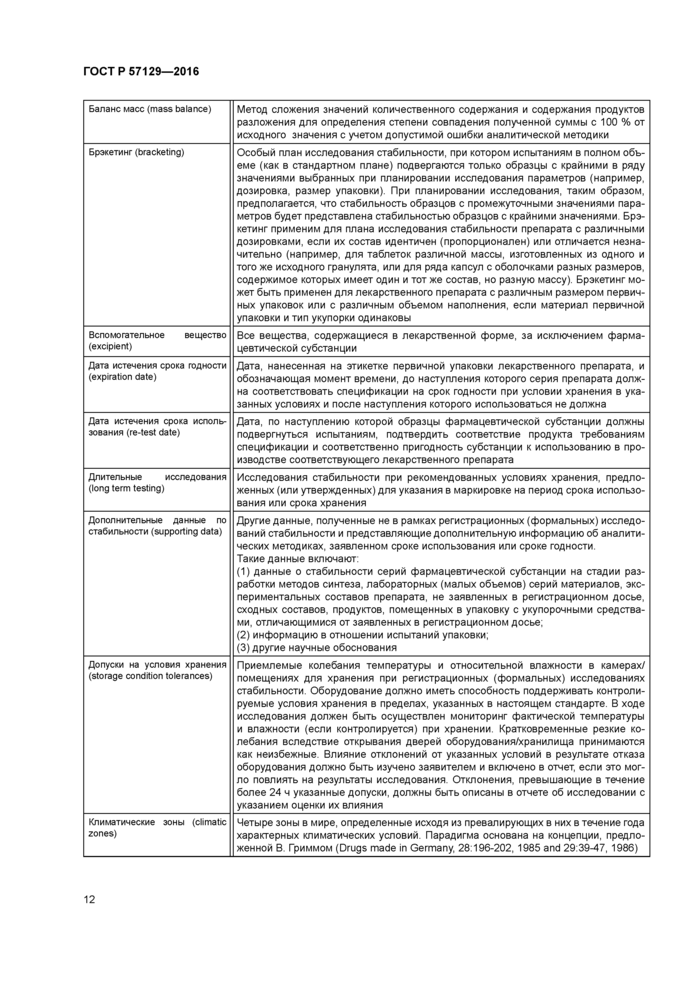
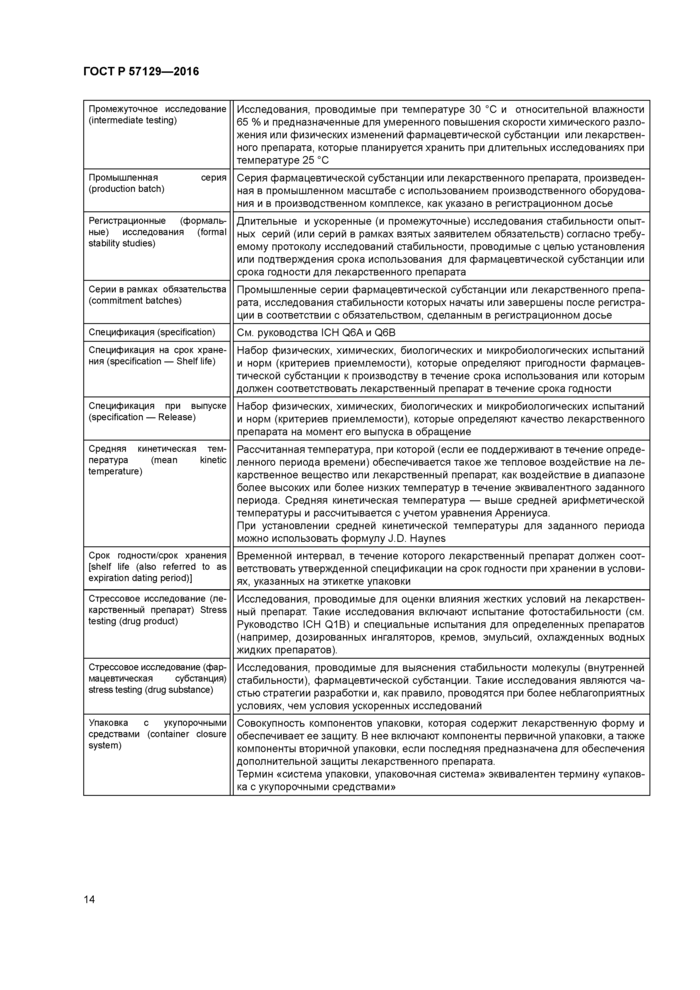
Баланс масс (mass balance) |
Метод сложения значений количественного содержания и содержания продуктов разложения для определения степени совпадения полученной суммы с 100 % от исходного значения с учетом допустимой ошибки аналитической методики |
|
Брэкетинг (bracketing) |
Особый план исследования стабильности, при котором испытаниям в полном объеме (как в стандартном плане) подвергаются только образцы с крайними в ряду значениями выбранных при планировании исследования параметров (например, дозировка, размер упаковки) При планировании исследования, таким образом, предполагается, что стабильность образцов с промежуточными значениями параметров будет представлена стабильностью образцов с крайними значениями Брэ-кетинг применим для плана исследования стабильности препарата с различными дозировками, если их состав идентичен (пропорционален) или отличается незначительно (например, для таблеток различной массы, изготовленных из одного и того же исходного гранулята, или для ряда капсул с оболочками разных размеров, содержимое которых имеет один и тот же состав, но разную массу). Брэкетинг может быть применен для лекарственного препарата с различным размером первичных упаковок или с различным объемом наполнения, если материал первичной упаковки и тип укупорки одинаковы |
|
Вспомогательное вещество (excipient) |
Все вещества, содержащиеся в лекарственной форме, за исключением фармацевтической субстанции |
|
Дата истечения срока годности (expeabon date) |
Дата, нанесенная на этикетке первичной упаковки лекарственного препарата, и обозначающая момент времени, до наступления которого серия препарата должна соответствовать спецификации на срок годности при условии хранения в указанных условиях и после наступления которого использоваться не должна |
|
Дата истечения срока использования (re-test date) |
Дата, по наступлению которой образцы фармацевтической субстанции должны подвергнуться испытаниям, подтвердить соответствие продукта требованиям спецификации и соответственно пригодность субстанции к использованию в производстве соответствующего лекарственного препарата |
|
Длительные исследования (long term testing) |
Исследования стабильности при рекомендованных условиях хранения, предложенных (или утвержденных) для указания в маркировке на период срока использования или срока хранения |
|
Дополнительные данные по стабильности (supporting data) |
Другие данные, полученные не в рамках регистрационных (формальных) исследований стабильности и представляющие дополнительную информацию об аналитических методиках, заявленном сроке использования или сроке годности Такие данные включают (1) данные о стабильности серий фармацевтической субстанции на стадии разработки методов синтеза, лабораторных (малых объемов) серий материалов, экспериментальных составов препарата, не заявленных в регистрационном досье, сходных составов, продуктов, помещенных в упаковку с укупорочными средствами. отличающимися от заявленных в регистрационном досье. (2) информацию в отношении испытаний упаковки, (3) другие научные обоснования |
|
Допуски на условия хранения (storage condition tolerances) |
Приемлемые колебания температуры и относительной влажности в камерах/ помещениях для хранения при регистрационных (формальных) исследованиях стабильности Оборудование должно иметь способность поддерживать контролируемые условия хранения в пределах, указанных в настоящем стандарте В ходе исследования должен быть осуществлен мониторинг фактической температуры и влажности (если контролируется) при хранении Кратковременные резкие колебания вследствие открывания дверей оборудования/хранилища принимаются как неизбежные Влияние отклонений от указанных условий в результате отказа оборудования должно быть изучено заявителем и включено в отчет, если это могло повлиять на результаты исследования Отклонения, превышающие в течение более 24 ч указанные допуски, должны быть описаны в отчете об исследовании с указанием оценки их влияния |
|
Климатические зоны (climatic zones) |
Четыре зоны в мире, определенные исходя из превалирующих в них в течение года характерных климатических условий Парадигма основана на концепции, предложенной В Гриммом (Drugs made In Germany. 28 196-202, 1985 and 29 39-47, 1986) |
ГОСТ P 57129—2016
Содержание
1 Область применения....................................................................................................................................1
1.1 Общие принципы....................................................................................................................................1
2 Руководства...................................................................................................................................................1
2.1 Фармацевтические субстанции.............................................................................................................1
2.2 Лекарственный препарат.......................................................................................................................5
3 Термины......................................................................................................................................................11
Библиография................................................................................................................................................16 1
Введение
Целью данного стандарта является установление единых со странами Европейского союза, Соединенными Штатами Америки. Японии и других стран, применяющих международные руководства ЮН. подходов к изучению стабильности новых фармацевтических субстанций и лекарственных препаратов.
В стандарте приведено описание основного объема данных по стабильности новых фармацевтических субстанций и лекарственных препаратов, требующегося для включения в регистрационное досье, при этом обеспечена достаточная гибкость принятия решений в различных практических ситуациях. необходимая вследствие особых научных положений и параметров оцениваемых материалов. При наличии научно обоснованных причин могут быть использованы альтернативные подходы.
Настоящий стандарт идентичен Руководству ЮН Q1A по изучению стабильности новых фармацевтических субстанций и лекарственных препаратов (ЮН Q1A Stability testing of new drug substances and products) Международной конференции no гармонизации технических требований для регистрации лекарственных средств для медицинского применения (International Conference on Harmonisation of Technical Requirements for Registration of Pharmaceuticals for Human Use; ICH2)).
НАЦИОНАЛЬНЫЙ СТАНДАРТ РОССИЙСКОЙ ФЕДЕРАЦИИ
ЛЕКАРСТВЕННЫЕ СРЕДСТВА ДЛЯ МЕДИЦИНСКОГО ПРИМЕНЕНИЯ
Часть 1
Изучение стабильности новых фармацевтических субстанций и лекарственных препаратов.
Общие положения
Medicines for medical application Part 1 Stability testing of new drug substances and products General
Дата введения — 2017—05—01
1 Область применения
Стандартом определена информация, включаемая в международное регистрационное досье на новые фармацевтические субстанции (молекулы) и изготовленные из них препараты. Данный стандарт не содержит информацию, включаемую в регистрационное досье на воспроизведенные лекарственные средства, изменения в регистрационное досье, документацию для клинических исследований и др. При подготовке регистрационного досье для государственной регистрации в странах ЕЭС следует, в первую очередь, руководствоваться нормативными правовыми актами союза и этих стран.
Особенности порядка отбора образцов и проведения испытаний определенных лекарственных форм в предлагаемой упаковке с укупорочными средствами не включены в настоящий стандарт.
Более подробная информация по техническим требованиям к новым лекарственным формам и биотехнологическим/биологическим препаратам содержится в руководствах ЮН QIC и Q5C соответственно.
1.1 Общие принципы
Цель работ по исследованию стабильности: получение документированных данных об изменении качества фармацевтической субстанции или лекарственного препарата в течение времени под влиянием факторов окружающей среды, таких как температура, влажность, сеет: и установление рекомендуемых условий хранения и срока использования — для фармацевтической субстанции или срока годности для лекарственного препарата.
Выбор условий испытаний, описанных в руководстве, основан на анализе влияния климатических условий в ЕС. Японии и США. Средняя кинетическая температура в любой части мира может быть рассчитана по климатическим данным, и мир можно разделить на четыре климатические зоны. I-IV. В данном руководстве рассмотрены условия исследования стабильности, установленные для климатических зон I и II. Было согласовано, что данные по стабильности, полученные в одном из ретонов ЕС. США и Японии, будут взаимно признаны в двух других регионах, если информация соответствует требованиям настоящего руководства и маркировка сделана в соответствии с национальными/региональными требованиями.
2 Руководства
2.1 Фармацевтические субстанции
2.1.1 Общие принципы
Данные по стабильности фармацевтической субстанции являются неотъемлемой частью систематического подхода к оценке стабильности.
2.1.2 Испытание стабильности в «стрессовых» условиях
Испытание стабильности фармацевтической субстанции в стрессовых условиях (стрессовые испытания) может помочь в идентификации наиболее вероятных продуктов разложения (деградации), что. в свою очередь, может помочь определить пути разложения действующего вещества и внутреннюю стабильность молекулы, а также подтвердить пригодность используемых аналитических методик для оценки стабильности. Характер стрессовых условий будет зависеть от определенной фармацевтической субстанции и типа производимой из нее лекарственной формы.
Испытания в стрессовых условиях, как правило, проводятся на одной серии фармацевтической субстанции. План эксперимента должен включать изучение влияния различных температур, превышающих условия «ускоренного старения», с интервалом по 10 °С (например. 50 “С. 60 X и т.д ). влажности (например, при относительной влажности 75 % и более) и. если приемлемо, влияние окисления и фотолиза Должна быть изучена подверженность фармацевтической субстанции (в виде раствора или суспензии) гидролизу на широком диапазоне значений pH. Неотъемлемой частью исследования стабильности является изучение фотостабильности. Стандартные условия испытания фотостабильности приведены в руководстве ICH Q1B.
Изучение продуктов разложения в стрессовых условиях помогает в определении путей разложения действующего вещества, разработке и валидации пригодных аналитических методик. Однако отдельное изучение определенных продуктов разложения не является обязательным, если было установлено. что они не образуются в условиях ускоренного или естественного (длительного) старения.
Результаты этих испытаний будут представлять неотъемлемую часть данных по стабильности, представляемых в регуляторный орган.
2.1.3 Выбор серий
Данные регистрационных (официальных) исследований стабильности должны быть получены по крайней мере на трех опытных сериях фармацевтической субстанции. Серии должны быть произведены, как минимум, в опытно-промышленном масштабе с использованием аналогичного пути синтеза, метода производства и операций, которые воспроизводят планируемый технологический процесс для промышленных серий субстанции. Основные показатели качества серий фармацевтической субстанции. используемых в исследованиях на стабильность, должны соответствовать качеству материала, производимого в промышленном масштабе.
Могут быть представлены другие дополнительные данные.
2.1.4 Упаковка с укупорочными средствами
Исследования стабильности должны проводить на фармацевтической субстанции, упакованной в контейнеры с укупорочными средствами, аналогичными или воспроизводящими упаковку, предложенную в регистрационном досье для хранения и выпуска в обращение.
2.1.5 Спецификации
Спецификация, представляющая собой перечень показателей качества, ссылок на аналитические методики и предлагаемых норм, описана в руководствах ICH Q6A и Q6B Дополнительно требования к уровню содержания продуктов разложения, присутствующих в фармацевтической субстанции, описаны в руководстве ICH Q3A.
Исследования стабильности должны включать испытания показателей качества фармацевтической субстанции, которые подвержены изменениям в процессе хранения, и с высокой вероятностью могут оказать влияние на ее качество, безопасность и/или эффективность. В ходе исследования должны проводиться, если приемлемо, физические, химические, биологические и микробиологические испытания Для проведения испытаний следует использовать валидированные аналитические методики, пригодные для оценки стабильности. Применение повторностей и их количество будут зависеть от результатов валидационных исследований.
2.1.6 Частота проведения испытаний
Для длительных исследований частота проведения испытаний должна обеспечивать установление профиля стабильности фармацевтической субстанции. Для фармацевтических субстанций с предлагаемым сроком использования не менее 12 мес, частота проведения испытаний в условиях длительного хранения (старения) обычно составляет каэдые 3 мес в течение первого года хранения, кахщые 6 мес. в течение второго года и затем ежегодно до предлагаемого срока использования.
При шестимесячном ускоренном исследовании стабильности рекомендуется проводить испытания не менее трех раз. включая испытания при закладке на хранение и при завершении исследования (например. 0. 3 и 6 мес ). Если имеются предположения (исходя из опыта, полученного при разработке субстанции), что результаты ускоренного исследования будут близки к критериям значительных
2
ГОСТ P 57129—2016
изменений, следует проводить расширенные исследования или путем испытания дополнительного количества образцов при окончании исследования, или путем включения в план исследования дополнительной временной точки.
Для проведения 12-месячного промежуточного исследования стабильности, обусловленного выявлением значительных изменений при ускоренном исследовании, рекомендуется использование по крайней мере четырех временных точек, включая испытания при закладке на хранения и при завершении исследования (например, 0, 6, 9 и 12 мес).
2.1.7 Условия хранения
В целом, исследование стабильности фармацевтической субстанции следует проводить в условиях (с допустимыми отклонениями), которые обеспечивают проверку термической стабильности вещества и. если применимо, его чувствительность к влаге. Выбранные условия и длительность проведения исследований стабильности должны обеспечивать получение данных о заявляемой в регистрационном досье стабильности субстанции при хранении, транспортировании и последующем использовании.
На дату подачи в регистрационном досье должны быть представлены данные по длительному (долгосрочному) исследованию, по крайней мере, в течение 12 мес не менее чем трех опытных серий фармацевтической субстанции, и исследование должно продолжаться, чтобы подтвердить ее стабильность на протяжении заявленного срока использования. По требованию регуляторного органа должны быть представлены дополнительные данные, полученные в ходе экспертизы регистрационного досье. Данные ускоренных исследований стабильности и. если применимо, промежуточных исследований могут быть использованы для оценки краткосрочных нарушений условий хранения, указанных в маркировке (например, при транспортировании).
Условия для длительного исследования, ускоренного исследования и. если применимо, промежуточных исследований приведены в последующих разделах. Принципы общего случая используются, если фармацевтическая субстанция не указана в последующих отдельных разделах. Могут быть использованы альтернативные условия исследований, если это обосновано.
|
2.1.7.1 Общий случай | |||||||||||||||
| |||||||||||||||
Если в ходе длительного исследования стабильности при температуре 25 °С (±2) и относительной влажности 60 % (±5) было выявлено «значительное» изменение в любой период времени шестимесячного ускоренного исследования, то с целью выявления значительных изменений должны быть проведены дополнительные промежуточные исследования стабильности. Промежуточные исследования должны включать проведение всех испытаний, если другое не обосновано. В первоначальное регистрационное досье должны быть включены данные за шесть месяцев 12-месячного промежуточного исследования стабильности.
Под «значительным изменением» фармацевтической субстанции понимается ее несоответствие спецификации.
|
2.1.7.2 Фармацевтические субстанции, предназначенные для хранения в холодильнике | |||||||||
|
Данные по исследованию стабильности при хранении в холодильнике оцениваются, как указано в разделе данного руководства по оценке результатов исследований, за исключением приведенных ниже случаев.
Если значительное изменение было выявлено между третьим и шестым месяцами ускоренного исследования, предлагаемый срок использования должен рассчитываться на основании данных о стабильности. полученных при длительном исследовании в заявляемых условиях хранения.
|
2.1.7.3 Фармацевтические субстанции, предназначенные для хранения в морозильной камере | ||||||
|
Если значительное изменение было выявлено в первые три месяца ускоренного исследования, то должно быть представлено обсуждение влияния краткосрочных нарушений условий хранения, указанных в маркировке, например при транспортировании или обработке. Это обсуждение может быть подкреплено, если приемлемо, данными последующего исследования стабильности на одной серии фармацевтической субстанции в течение короткого, менее трех месяцев, периода времени с более частым, чем обычно, проведением испытаний. Считается нецелесообразным продолжение 6-месячного исследования стабильности, если значительное изменение было выявлено в первые три месяца исследования.
Для фармацевтических субстанций, предназначенных для хранения в морозильной камере, срок использования следует устанавливать на основании фактических данных о стабильности, полученных при длительном исследовании. Учитывая отсутствие условий для ускоренного исследования стабильности фармацевтических субстанций, предназначенных для хранения в морозильной камере, на одной серии субстанции в условиях повышенных температур [например, при 5 °С (±3) или 25 °С (±2)) в течение приемлемого периода времени должно быть проведено изучение влияния краткосрочных нарушений условий хранения, указанных в маркировке, например при транспортировании или обработке.
2.1.7 4 Фармацевтические субстанции, предназначенные для хранения при температуре ниже -20 °С
Планы исследования стабильности фармацевтических субстанций, предназначенных для хранения при температуре ниже -20 ’С, разрабатывают индивидуально для каждого случая.
2.1.8 Обязательства по проведению исследований стабильности
При отсутствии на дату регистрации продукта данных длительного исследования опытных серий субстанции в предлагаемых условиях хранения о ее стабильности на весь заявляемый в регистрационном досье срок использования должны быть взяты обязательства по продолжению исследований стабильности в пострегистрационный период с целью достоверного подтверждения срока использования.
Если регистрационное досье содержит данные о стабильности, полученные при длительном исследовании трех промышленных серий в предлагаемых условиях хранения на весь заявленный срок использования, то обязательство о проведении исследований стабильности в пострегистрационный период не требуется. В остальных случаях заявитель должен выполнить одно из нижеперечисленного:
1 Обязательство по продолжению исследований стабильности на протяжении всего заявленного срока использования, если в представленном регистрационном досье имеются данные по стабильности. по крайней мере, трех промышленных серий.
2 Обязательство по продолжению исследований стабильности на протяжении всего заявпенно-го срока использования и проведению длительного исследования стабильности дополнительных промышленных серий фармацевтической субстанции (чтобы общее число исследованных серий было не менее трех) в течение всего срока использования, если в представленном регистрационном досье имеются данные по стабильности менее чем трех серий.
3 Обязательство по проведению длительного исследования стабильности трех первых промышленных серий в течение заявленного срока использования, если в представленном регистрационном досье отсутствуют данные исследования стабильности промышленных серий фармацевтической субстанции.
Протокол длительного исследования стабильности, проводимого в рамках взятого обязательства, не должен отличаться от протокола исследования стабильности опытных серий, если иное научно не обосновано.
2.1.9 Оценка данных
Цель исследования стабильности — установить на основе результатов испытаний не менее трех серий фармацевтической субстанции и оценке данных о стабильности (включая, если приемлемо, результаты физических, химических, биологических и микробиологических испытаний), срок использования. применимый ко всем последующим сериям субстанции, производимым в аналогичных условиях.
4
ГОСТ P 57129—2016
Степень изменчивости отдельных серий влияет на обоснованность прогноза о том. что произведенные в будущем промышленные серии будут соответствовать спецификации в течение заявленного срока использования субстанции.
Данные могут свидетельствовать о такой незначительной степени разложения и изменчивости, что даже без их статистической обработки заявленный срок использования будет одобрен регуляторным органом. В этом случае обычно не требуется проведения формального статистического анализа, достаточно предоставления обоснования его отсутствия.
Приемлемым подходом для оценки количественных характеристик, которые, предположительно, должны меняться с течением времени, является определение времени, при котором усредненная кривая скорости разложения с односторонним доверительным интервалом при вероятности 95 % пересекается с нормой (предельно допустимым значением), установленной для характеристики. Если анализ данных показывает, что изменчивость от серии к серии незначительна, рекомендуется комбинировать индивидуальные данные для каждой серии в одну общую величину. Это может быть сделано первоначально путем соответствующей статистической обработки (например, вычисление p-значений при уровне значимости более 0,25 для отклонения нулевой гипотезы) величины наклонов регрессионных кривых и величин отрезков, отсекаемых ими на оси ординат (исходные значения показателя) для каждой отдельной серии. Если данные стабильности отдельных серий комбинировать нельзя, общий срок использования должен быть установлен по минимальному времени, в течение которого качество любой серии будет, предположительно, соответствовать установленным требованиям.
Необходимость преобразования данных для последующей оценки методом линейной регрессии будет зависеть от характера любых зависимостей (закономерностей) скорости разложения вещества. Обычно зависимости можно выразить линейной, квадратичной и кубической функцией на арифметической или логарифмической шкале. Для проверки статистической степени согласия индивидуальных данных стабильности всех серий и объединенных данных серий (где это возможно) с предполагаемой линией или кривой разложения должны быть использованы статистические методы.
При наличии обоснования допускается для установления на момент регистрации более длительного. по сравнению с имеющимися данными, срока использования, ограниченная экстраполяция данных о стабильности, полученных при длительном исследовании в предлагаемых условиях хранения. Это обоснование должно учитывать данные о механизме разложения действующего вещества, результатах ускоренного исследования стабильности, статистической степени согласия любой математической модели, размера серий, наличия дополнительных данных и т. д. Однако при этой экстраполяции считается, что и далее (за временными рамками изученного периода) будут иметь место выявленные закономерности процесса разложения.
При любой оценке изучаются не только данные количественного определения действующего вещества. но и содержание продуктов разложения и другие соответствующие показатели качества.
2.1.10 Указания/маркировка
Указания об условиях хранения должны быть приведены в маркировке в соответствии с наци-ональными/региональными требованиями. Указываемые условия хранения основываются на оценке данных по изучению стабильности фармацевтической субстанции. При необходимости, должны быть приведены особые указания, в частности для субстанций, которые не выдерживают замораживания. Использование терминов «хранение в условиях окружающей среды» или «хранение при комнатной температуре» не приемлемы.
Срок использования должен быть установлен исходя из данных о стабильности, и дата срока использования должна быть указана на этикетке упаковки, если применимо.
2.2 Лекарственный препарат
2.2.1 Общие принципы
Планирование регистрационных (официальных) исследований стабильности лекарственного препарата должно быть основано на знаниях свойств и характеристик фармацевтической субстанции, данных исследований ее стабильности и опыте, полученном при исследованиях препарата, использовавшегося в клинических исследованиях. В протоколах регистрационных исследований должны быть указаны наиболее вероятные изменения характеристик препарата при хранении и обоснование выбранных показателей качества, подлежащих испытаниям.
2.2.2 Исследование фотостабильности
Исследование фотостабильности должно быть проведено по крайней мере на одной первой (опытной) серии лекарственного препарата, если применимо. Стандартные условия исследования фотостабильности приведены в руководстве ICH Q1B.
5
2.2.3 Выбор серий
В регистрационном досье должны быть представлены данные исследований стабильности не менее чем трех опытных серий лекарственного препарата. Состав опытных серий и упаковка не должны отличаться от заявляемых для регистрации. Технологический процесс, используемый при изготовлении этих серий, должен имитировать процесс, планируемый для производства промышленных серий, и обеспечивать получение лекарственного препарата такого же качества, соответствующего спецификации на регистрируемый препарат. Две из этих трех серий должны быть, как минимум, опытно-промышленного масштаба; третья серия при наличии соответствующего обоснования может быть меньше Если возможно. серии лекарственного препарата должны быть произведены с использованием разных серий фармацевтической субстанции.
Должны быть проведены исследования стабильности каждой дозировки препарата и в упаковках всех размеров, если не применяют брэкетинг или построение матриц.
Могут быть представлены другие дополнительные данные.
2.2.4 Упаковка с укупорочными средствами
Исследование стабильности необходимо проводить с использованием лекарственного препарата, помещенного в упаковку, заявляемую в регистрационном досье (включая, при необходимости, любую вторичную упаковку и соответствующие этикетки). Любые исследования стабильности лекарственного препарата без первичной упаковки или помещенного в упаковку из иных упаковочных материалов могут составлять информативную часть стрессовых испытаний лекарственного препарата или. соответственно. рассматриваться как дополнительная вспомогательная информация.
2.2.5 Спецификации
Спецификация, представляющая собой перечень испытаний, ссылок на аналитические методики и предлагаемых норм, с учетом концепции различных норм на момент выпуска и в течение срока годности. рассмотрено детально в руководствах ЮН Q6A и Q6B Дополнительно в руководстве ЮН Q3B описаны принципы установления предельного уровня содержания продуктов разложения действующего вещества в лекарственном средстве.
Исследования стабильности должны включать испытания на показатели качества лекарственного препарата, которые подвержены изменениям в процессе хранения, и с высокой вероятностью могут оказать влияние на его качество, безопасность и/или эффективность. В ходе исследования должны проводить, если приемлемо, физические, химические, биологические и микробиологические испытания. определение содержания консервантов (например, антиоксидантов, антимикробных консервантов). а также проверку функциональных свойств (например, для системы доставки дозы). При проведении испытаний следует использовать валидированные аналитические методики, пригодные для оценки стабильности. Использование повторностей и их количество будут зависеть от результатов валидаци-онных исследований.
Нормы (критерии приемлемости) в спецификации на весь срок годности следует устанавливать с учетом всей имеющейся информации о стабильности препарата Допускаются приемлемые и обоснованные различия в нормах на момент выпуска и в течение срока годности, которые основаны на оценке стабильности и наблюдаемых изменениях при хранении. Обоснование любых различий в нормах содержания антимикробных консервантов на момент выпуска и в течение срока годности должно сопровождаться достоверной корреляцией их содержания (определяемого физико-химическим методами) с антимикробной активностью, изученной на этапе фармацевтической разработки на образцах лекарственного препарата с составом (за исключением концентрации консерванта), заявляемым в регистрационном досье. С целью проверки необходимо провести исследование стабильности одной опытной серии лекарственного препарата в отношении эффективности антимикробных консервантов (в дополнение к количественному определению консервантов) в течение заявляемого срока хранения, вне зависимости от наличия или отсутствия различий в нормах содержания консерванта на момент выпуска или в течение срока годности.
2.2.6 Частота проведения испытаний
Частота проведения испытаний при длительных исследованиях должна быть достаточной для установления профиля стабильности лекарственного препарата. При длительных исследованиях стабильности лекарственных препаратов с заявляемым сроком годности не менее 12 мес. испытания, как правило, следует проводить каждые три месяца в течение первого года, каждые шесть месяцев в течение второго года и затем ежегодно в течение заявленного срока годности.
При шестимесячном ускоренном исследовании стабильности рекомендуется проводить испытания не менее трех раз. включая испытания при закладке на хранение и при завершении исследования 6
1
2
c 25 октября 2015 года переименовг* в Международный совет по гармонизации (Council for Harmonisation ЮН)
Издание официальное