ГОСТ Р 56044-2014
Оценка медицинских технологий. Общие положения
Купить ГОСТ Р 56044-2014 — бумажный документ с голограммой и синими печатями. подробнее
Распространяем нормативную документацию с 1999 года. Пробиваем чеки, платим налоги, принимаем к оплате все законные формы платежей без дополнительных процентов. Наши клиенты защищены Законом. ООО "ЦНТИ Нормоконтроль"
Наши цены ниже, чем в других местах, потому что мы работаем напрямую с поставщиками документов.
Способы доставки
- Срочная курьерская доставка (1-3 дня)
- Курьерская доставка (7 дней)
- Самовывоз из московского офиса
- Почта РФ
Устанавливает общие положения оценки медицинских технологий и предназначен для применения в системе здравоохранения Российской Федерации.
Оглавление
1 Область применения
2 Нормативные ссылки
3 Общие положения
4 Цели и задачи оценки медицинских технологий
5 Организация оценки медицинских технологий
5.1 Орган по оценке медицинских технологий
5.2 Рабочая группа по оценке медицинской технологии
5.3 Декларация конфликта интересов
6 Порядок оценки медицинской технологии
6.1 Инициализация оценки медицинской технологии
6.2 Этапы оценки медицинской технологии
6.3 Выбор темы оценки медицинской технологии
6.4 План (протокол) оценки медицинской технологии
6.5 Источники информации
6.6 Требования к поиску релевантной информации
7 Оценка научной обоснованности результатов исследований действенности, эффективности и безопасности медицинской технологии
7.1 Внешняя валидность исследования
7.2 Внутренняя валидность исследования
7.3 Дизайн клинических исследований медицинских технологий
7.4 Клинико-экономические исследования, анализ и моделирование
8 Обобщение и оценка информации о медицинской технологии
8.1 Обобщение информации о медицинской технологии
8.2 Особенности анализа результатов клинических исследований
8.3 Систематический обзор и мета-анализ
8.4 Интерпретация результатов клинико-экономического анализа
8.5 Краткая оценка медицинской технологии
8.6 Социальные, правовые и этические аспекты применения медицинской технологии
9 Формирование отчета
9.1 Требования к рекомендациям
9.2 Актуализация отчета
Приложение А (рекомендуемое) Принятие решений о выборе медицинских технологий на основании правила «Квадрата»
Приложение Б (рекомендуемое) Конфликт интересов
Приложение В (рекомендуемое) Перечень вопросов для оценки методического качества исследований различного типа
Приложение Г (рекомендуемое) Методики проведения АВС-, VEN-, частотного и DDD-анализов
Приложение Д (рекомендуемое) Структура отчета о краткой оценке медицинской технологии.
Приложение Е (рекомендуемое) Структура отчета об оценке медицинской технологии
| Дата введения | 01.06.2015 |
|---|---|
| Добавлен в базу | 12.02.2016 |
| Актуализация | 01.01.2021 |
Этот ГОСТ находится в:
- Раздел Экология
- Раздел 11 ЗДРАВООХРАНЕНИЕ
- Раздел 11.160 Первая помощь
- Раздел 11 ЗДРАВООХРАНЕНИЕ
- Раздел Электроэнергия
- Раздел 11 ЗДРАВООХРАНЕНИЕ
- Раздел 11.160 Первая помощь
- Раздел 11 ЗДРАВООХРАНЕНИЕ
Организации:
| 11.06.2014 | Утвержден | Федеральное агентство по техническому регулированию и метрологии | 568-ст |
|---|---|---|---|
| Разработан | Межрегиональная общественная организация Общество фармакоэкономических исследований | ||
| Издан | Стандартинформ | 2015 г. |
Evaluation of medical technologies. General regulations
Чтобы бесплатно скачать этот документ в формате PDF, поддержите наш сайт и нажмите кнопку:

стр. 1

стр. 2

стр. 3

стр. 4

стр. 5

стр. 6

стр. 7

стр. 8

стр. 9

стр. 10

стр. 11

стр. 12

стр. 13

стр. 14

стр. 15

стр. 16
стр. 17
стр. 18

стр. 19

стр. 20

стр. 21

стр. 22

стр. 23

стр. 24

стр. 25

стр. 26

стр. 27

стр. 28

стр. 29

стр. 30
ФЕДЕРАЛЬНОЕ АГЕНТСТВО ПО ТЕХНИЧЕСКОМУ РЕГУЛИРОВАНИЮ И МЕТРОЛОГИИ
НАЦИОНАЛЬНЫЙ
СТАНДАРТ
РОССИЙСКОЙ
ФЕДЕРАЦИИ
ГОСТР56044-2014
2014
ОЦЕНКА МЕДИЦИНСКИХ ТЕХНОЛОГИЙОбщие положения
Издание официальное
|
Москва Стамдартинформ 2015 |
Предисловие
1 РАЗРАБОТАН Межрегиональной общественной организацией «Общество фармакоэкономи-ческих исследований»
2 ВНЕСЕН Техническим комитетом по стандартизации ТК 466 «Медицинские технологии»
3 УТВЕРЖДЕН И ВВЕДЕН В ДЕЙСТВИЕ Приказом Федерального агентства по техническому регулированию и метрологии Российской Федерации от 11 июня 2014 г. № 568-ст
4 ВВЕДЕН ВПЕРВЫЕ
Правипа применения настоящего стандарта установлены в ГОСТ Р 1.0-2012 (раздел 8). Информация об изменениях к настоящему стандарту публикуется в ежегодном (по состоянию на 1 января гпекущего года) информационном указателе «Национальные стандарты», а официальный текст изменений и поправок — в ежемесячном информационном указателе «Национальные стандарты». В случае пересмотра (замены) или отмены настоящего стандарта соответствующее уведомление будет опубликовано в ближайшем выпуске ежемесячного информационного указателя «Национальные стандарты». Соответствующая информация, уведомление и тексты размещаются также в информационной системе общего пользования — на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет (gost.ru)
© Стандартинформ, 2015
Настоящий стандарт не может быть полностью или частично воспроизведен, тиражирован и распространен в качестве официального издания без разрешения Федерального агентства по техническому регулированию и метрологии
личных изготовителей аналогичных лекарственных средств (генерических форм). Необходимы выявление этих данных в источниках и их фиксация.
6.6 Требования к поиску релевантной информации
Поиск релевантной информации следует проводить таким образом, чтобы было обеспечено максимально полное обнаружение материалов, посвященных медицинской технологии, являющейся предметом оценки.
Поиск релевантной информации проводят в два этапа.
На первом этапе устанавливают ключевые слова и временные рамки проведения поиска. Ключевыми словами для проведения поиска являются:
- наименование медицинской технологии:
- наименование заболевания, синдрома, клинической ситуации, основных симптомов, на которые направлена медицинская технология;
- соответствующие рубрики поисковой системы используемой базы данных:
- наименования технологий сравнения:
- наименования методов получения данных;
- структура (дизайн) исследования;
- другие термины и понятия по решению рабочей группы.
Для обеспечения полноты выборки информации могут использоваться ключевые слова в комбинации и различные последовательности в ключевых словах (например, «клинический анализ крови», «анализ крови клинический», «общий анализ крови»), имеющие одинаковый смысл. Обязательно использование ключевых слов на русском и английском языках, желательно — на других языках, на которых часто проводятся публикации (испанский, немецкий, французский, итальянский).
Временные рамки проведения поиска (глубина поиска—дата, с которой начинают изучение источников информации) определяет рабочая группа, исходя из сведений о времени появления медицинской технологии или альтернативной медицинской технологии, являющейся технологией сравнения.
Ограничение поиска на первом этапе по каким-либо критериям должно быть обосновано в отчете.
Пример — Гпубинэ поиска с 2001 г. связана с том. что препарат иматиниб был впервые разрешон к применению в США в 2001 г.
Не следует ограничивать поиск по таким критериям, как страна проведения исследования (наблюдения) или отсутствие публикации.
Второй этап поиска начинают с оценки релевантности полученной информации. Из первичного множества источников информации выбирают содержащие непосредственное отношение к выбранной теме оценки медицинской технологии. Релевантность, в частности, определяется позицией (углом зрения) органа (рабочей группы) или заказчика оценки медицинской информации. Угол зрения при оценке медицинской технологии может существенно влиять на выбор релевантной информации для проведения оценки.
Пример — Оценка медицинской технопогии может быть проведена с позиции плательщика за медицинскую технологию — страховой медицинской организации, бюджета, а может — с позиции получателя медицинской технологии.
По результатам анализа релевантности информации составляют таблицу, в которую должны быть сведены все найденные материалы об оцениваемой медицинской технологии. В таблицу обязательно должны быть включены следующие данные:
- полная библиографическая ссылка на источник информации согласно правилам, принятым при публикации научных исследований;
- способ построения (дизайн) исследования (согласно 7.2);
- объем выборки в исследовании (число включенных больных);
- уровень методического качества исследования;
- сравниваемые медицинские технологии;
- оцениваемые результаты — критерии: суррогатные, мягкие и твердые конечные точки, предпочтения пациентов;
- величина эффекта и его статистическая значимость;
- комментарии (особенности исследования, влияющие на достоверность результатов).
Экспертами могут быть внесены в таблицу дополнительные разделы.
При рассмотрении таблицы следует анализировать степень совпадения результатов, полученных в различных исследованиях. Если имеются противоречия в результатах различных исследований.
8
экспертам следует провести анализ их причин и зафиксировать различия и их возможные причины в отчете.
Для удобства дальнейшей работы по оценке медицинской технологии все источники релевантной информации компонуют по блокам оценки:
- эпидемиология;
- действенность;
- эффективность;
- безопасность;
- экономичность;
- законность и этичность;
- социальная значимость;
- бремя для бюджета и др.
При этом в разных блоках источники информации могут повторяться.
В случае отсутствия информации в отдельных блоках следует провести повторный поиск релевантной информации путем прицельного общения с потенциальными носителями информации — организациями-изготовителями. организациями-провайдерами. обществами пациентов, отдельными научными и практическими медицинскими экспертами и т. д.
7 Оценка научной обоснованности результатов исследований действенности, эффективности и безопасности медицинской технологии
Все найденные в результате двух этапов поиска релевантной информации исследования действенности, эффективности и безопасности медицинской технологии подлежат оценке с точки зрения научной обоснованности результатов, полученных в процессе исследований.
Научная обоснованность результатов исследования медицинской технологии определяется надежностью исследования, его валедностью — насколько хорошо инструмент измерения результатов в исследовании позволяет вынести заключение о ценности медицинской технологии, насколько при повторных исследованиях будут получены аналогичные результаты.
7.1 Внешняя валидность исследования
Внешняя (наглядная) валидность (обобщаемость) демонстрирует, что в исследовании был применен инструмент измерений, адекватный изучаемой патологии и отражающий реальные изменения в состоянии больных данной группы, в том числе и в типичной практике (реальный мир), показывающий степень применимости результатов исследования к тем группам больных, в которых технология используется или предполагается к использованию.
Для оценки внешней валидности (обобщаемости) результатов исследований экспертам необходимо определить. существуют ли особенности течения заболевания или применения медицинской технологии, которые не были учтены в анализируемом исследовании, но которые могут существенно повлиять на исходы применения технологий в практике. Такими особенностями могут быть:
- различия между демографическими, социальными и клиническими характеристиками пациентов, включенных в исследование, и пациентов в типичной практике (реальном мире).
Пример — Из исследований часто исключаются дети, пожилые, беременные и кормящие женщины, больные с сопутствующей онкологической патологией, с почечной или печеночной недостаточностью, в то же время в клинической практике использование технологии у этих пациентов может осуществляться или планироваться;
- различия между характеристиками применения технологии в клиническом (экспериментальном) исследовании и в условиях типичной практики.
Пример — В исследовании может использоваться назначение лекарственного средства в болев высоких дозах, более частое применение методов контроля за ходом лечения, исключение определенных методов сопутствующего лечения и т. п.;
- различия в поведении пациентов в клиническом исследовании и в условиях типичной практики.
Пример — В исследовании пациенты соблюдают рекомендации врачей тщательное, чем в типичной практике, а уменьшение приверженности рекомендациям будет приводить к снижению эффективности лечения в практике по сравнению с исследованием;
9
- отсутствие исследований, в которых эффективность и безопасность технологии изучались бы в непосредственном сравнении с альтернативной технологией (непрямые сравнения);
- оценка эффективности технологии на основании промежуточных, «суррогатных» клинических результатов (снижение артериального давления при гипертонии или уровня сахара при сахарном диабете) при отсутствии данных о влиянии на «мягкие» (инфаркт, инсульт, ампутация конечности, хроническая почечная недостаточность) или «твердые» конечные точки исходов (все показатели, связанные с продолжительностью жизни);
- для диагностических технологий — отсутствие данных об улучшении исходов лечения при использовании исследуемой технологии по сравнению с имеющимися альтернативами;
- для диагностических технологий, которые предполагается использовать для скрининга. — отсутствие данных о том. что раннее начало лечения приводит к улучшению исходов по сравнению с лечением, начатым при появлении симптомов болезни.
Повышение внешней валидности результатов исследования медицинской технологии для ее оценки обеспечивается обобщением данных нескольких исследований различного дизайна. При оценке внешней валидности результатов исследований медицинской технологии эксперты учитывают результаты клинических исследований, описывающих сложившуюся типичную практику ведения больных. регистры пациентов, опросы пациентов и медицинских работников, собственный опыт практической работы.
Для анализа научных исследований экспертам рекомендуется использовать перечни вопросов, приведенные в приложении В.
7.2 Внутренняя валидность исследования
Внутренняя валидность или достоверность результатов демонстрирует точность полученных характеристик технологии в отношении выборки больных, включенных в исследование. Достоверность (внутренняя валидность) результатов определяется методикой исследования, в котором она получена: способом построения — дизайном, структурой исследования и минимизацией ошибок.
Выделяют два вида ошибок в исследованиях: случайная и систематическая.
Случайная ошибка — отклонение результата в выборке от истинного значения в популяции в результате случайности. Случайная ошибка обусловлена особенностями метода исследований: результаты исследований в выборке всегда отличаются от таковых в генеральной совокупности. Случайную ошибку полностью устранить невозможно, но можно уменьшить за счет правильно спланированного исследования и заранее рассчитанного необходимого числа наблюдений. При увеличении числа наблюдений или при повторных исследованиях на выборках полученные результаты будут колебаться вокруг истинного значения. Отклонения результатов повторных исследований от истинного значения в среднем стремятся к нулю и не изменяют значения измеряемого параметра. Влияние случайной ошибки определяется через расчет доверительных интервалов.
Систематическая ошибка (смещение) — осознанная или не осознанная ошибка, заложенная в дизайне исследования или возникающая в его ходе, приводящая к однонаправленному искажению результатов влияния медицинской технологии на патологический процесс; она происходит из-за недоучета неспецифического для данной технологии любого фактора, системно влияющего на исход.
Систематическая ошибка может быть связана с различными особенностями проведения исследований:
1) Ошибки в отборе обусловлены включением в исследование участников, существенно отличающихся от лиц. не включенных в него.
Пример — Включение в исследование только больных, госпитализированных в специализированный стационар, в то время как большая часть подобных больных лечится на уровне первичной помощи, или включение в исследование лиц, дающих согласие, тогда как большинство тех, кому предлагают участие отказываются от него по религиозным соображениям, или невключение в исследование больных, которых врач-исследователь посчитал «не перспективными» для применения данной технологии.
Разновидностью ошибки в отборе является ошибка в ответах, когда испытуемые не отвечают на все или часть вопросов анкеты, причем из анализа в контрольной или. наоборот, испытуемой группе выбывает не одинаковое число включенных лиц (чаще это связано с ошибками в формулировках вопросов анкеты).
2) Ошибки в формировании групп наблюдения обусловлены неслучайным распределением участников на группы. Различия в характеристиках больных в группах не позволяют исключить влияния этих различий на исход.
Ю
Пример — Если больные о одной группе моложе или страдают менее тяжелой формой заболевания, большая частота достижения благоприятного исхода в данной группе может быть обусловлена именно этими различиями, а не применением исследуемой технологии.
3) Ошибки в измерении показателей обусловлены:
- различиями в методах и критериях измерения показателей в группах (информационные ошибки или ошибки классификации).
Пример — При отсутствии стандартизированных критериев осложнений исследователи могут одни и те же события регистрировать как осложнения в контрольной группе и не учитывать в основной, или сниженная приверженность к лечению в одной из групп вызывает смещение результатов:
- отсутствием «ослепления» — метода, при применении которого одной или нескольким участвующим в клиническом исследовании сторонам (пациентам, врачам, исследователям) неизвестно, какая лечебная медицинская технология — теститруемая или контрольная — применена к субъекту исследования (простой слепой метод предусматривает неосведомленность о назначенном им виде лечения пациентов, двойной слепой метод подразумевает неосведомленность пациентов и врачей-исследова-телей, тройной слепой метод подразумевает еще и неосведомленность мониторов и. в некоторых случаях. лиц. выполняющих статистическую обработку данных); при отсутствии «ослепления» повышается влияние особенностей человеческого восприятия на оценку результатов, вследствие чего одни и те же события трактуются исследователем по-разному в разных группах;
- отсутствием сокрытия назначения — обеспечения неосведомленности о назначаемом лечении до и во время распределения участников исследования в группы, направленного на предотвращение систематической ошибки отбора. Сокрытие назначения отличается от «ослепления», которое действует уже после распределения участников на группы на протяжении всего исследования и направлено на предотвращение систематической ошибки, связанной с наблюдением за пациентом и оценкой эффекта от лечения.
Пример — Методом сокрытия назначения является использование запечатанных конвертов с инструкциями для рандомизации.
4) Ошибки, обусловленные исследователями и исследовательскими центрами, в том числе, ошибки интервьюера, связанные с его личностью.
Пример — Интервьюер по-разному задаот вопросы разным пациентам или в некоторых случаях пускается в рассуждения, или заполняет за больного вопросник, который должен быть заполнен больным лично, или один интервьюер опрашивают группу применения технологии, а второй — группу контроля.
5) Ошибки, связанные с неправильным выбором центров: выбранные для проведения исследований исследовательские центры не отражают возможности других центров выполнять медицинскую технологию (данная систематическая ошибка больше влияет на внешнюю валидность).
6) Ошибки вследствие миграции обусловлены частым выбытием участников из-под наблюдения. Большое число выбывших заставляет сомневаться в достоверности результатов, особенно если причины выбытия были связаны с оценкой результатов.
Пример — Выбытие пациентов из исследования, проводимого на амбулаторной группе, вследствие госпитализаций или смертей о основной группе может быть результатом осложнений тестируемой медицинской технологии.
7) Вмешивающиеся внешние факторы (неспецифические воздействия) — ошибки, обусловленные наличием факторов, одновременно связанных и с исследуемой технологией, и с исходом, но неучтенные при составлении протокола (дизайна) исследования. Вмешивающиеся факторы являются источником систематической ошибки в тех случаях, когда два фактора взаимосвязаны, при этом один из них искажает эффект другого.
Пример — При оценке эффективности лечения в исследовании-наблюдении меньшая частота летальных исходов в основной группе может быть связана не собственно с лечением, а с тем, что доступ к лечению или дополнительному наблюдению у врача имели пациенты с более высоким уровнем дохода и лучшими условиями жизни, исходно характеризующиеся меньшим риском смерти. Социальный статус в данном случае выступает как неспецифический внешний вмешивающийся фактор.
8) Ошибки «памяти» обусловлены тем. что больные, более чем здоровые, склонны вспоминать факты воздействия на них патогенных факторов, или. больше «прислушиваясь» к своему состоянию, отмечать малейшие изменения, связанные с применением технологии; такие ошибки характерны для
11
исследований, в которых факт воздействия причинного фактора выявляется на основании опроса пациентов — участников исследования (например, в исследованиях «случай — контроль»).
Для выявления систематической ошибки эксперты должны проанализировать следующие элементы отчета, определяющие методическое качество исследований:
1) Наличие четко сформулированного клинического вопроса, поиску ответа на который посвящено исследование. Четко сформулированный клинический вопрос включает четыре элемента:
- описание группы пациентов, участвующих в исследовании;
- наименование технологии, которая является объектом исследования;
- наименование технологии сравнения (альтернативы для сравнения);
- наименование исхода, который рассматривается как результат применения технологии. Под исходом понимается критерий оценки изменения состояния здоровья пациента под воздействием технологии, т. е. событие, по которому исследователь судит о результате применения технологии.
Пример — Четко сформулированным клиническим вопросом является оценка влияния профилактического применения антибактериального лекарственного сродства на частоту развития гнойно-септических осложнений у больных в послеоперационном периоде по сравнению с отсутствием антибактериальной торапии.
2) Наличие ясных критериев включения пациентов в исследование и исключения пациентов из исследования. Должны быть описаны критерии, в соответствии с которыми больные включаются в исследование. Однородность группы обеспечивает достоверность результатов исследования. Соответствие критериев включения и исключения характеристикам больных, которые наблюдаются в практике, обеспечивает обобщаемость результатов исследования.
3) Обоснованность выбора технологии сравнения (альтернативы для сравнения). Выбор технологии для сравнения зависит от целей и задач исследования и должен быть обоснован исследователем. Плацебо-контроль является распространенной технологией для сравнения в рандомизированных исследованиях, однако данных о преимуществах изучаемой технологии по сравнению с плацебо обычно недостаточно, чтобы сделать заключение о месте технологии в практике, оценить ее преимущества по сравнению с альтернативными технологиями, применяемыми в аналогичных ситуациях. Во многих случаях плацебо-контроль невозможен.
Пример — По этическим соображениям исследование нового противоопухолевого средства при наличии традиционно используемой терапии возможно только при сравнении с имеющейся ктрадици-онной» технологией.
4) Выбытие участников из исследования. Участники исследования могут быть потеряны в ходе наблюдения или досрочно исключены из исследования, вследствие чего число включенных в окончательный анализ пациентов отличается от числа участников в начале исследования. Большое число выбывших из исследования (ориентировочно более 20 %) повышает вероятность систематической ошибки. В исследовании должна быть представлена информация о числе участников, выбывших из исследования, причины выбытия и характеристики выбывших из исследования участников в сравнении с оставшимися в исследовании.
5) Клиническая значимость критериев, по которым оценивались результаты применения технологии. Эксперты анализируют, какие исходы (критерии результативности) были использованы в исследовании для оценки эффективности и безопасности технологии:
- объективные критерии — показатели медицинской эффективности технологии;
- субъективные критерии — отражающие оценку результатов применения технологии самими пациентами.
В качестве объективных критериев могут быть использованы показатели, отражающие:
а) динамику физиологических и биохимических параметров, на изменение которых направлено действие медицинской технологии,—снижение артериального давления, прирост гемоглобина, уменьшение размера опухоли и т. п. — так называемые «суррогатные» точки оценки эффективности;
6) важные для пациентов изменения в их жизни и состоянии здоровья — необратимая потеря функций (хроническая недостаточность) или отдельных органов (экстирпация), или частей тела (ампутация), необратимые изменения структур органов (инфаркт, инсульт) — так называемые «мягкие» конечные точки оценки эффективности, или «твердые» конечные точки, связанные со смертью: смертность, выживаемость, продолжительность жизни и т. п.
Предпочтительным является оценка с использованием показателей группы б) (окончательных критериев), при отсутствии подобных данных допускается использование показателей группы а) (промежуточных «суррогатных» критериев).
При использовании промежуточных «суррогатных» критериев должны существовать полученные в научных исследованиях высокого методического качества доказательства того, что суррогатный показатель с высокой степенью вероятности связан с окончательным исходом и может расцениваться как его предиктор.
Пример — Снижение уровня артериального давления (АД) может рассматриваться как суррогатный критерий исхода для антигипортонзивного сродства, поскольку существуют исследования, доказавшие, что существует прямая связь между уровнем АД и повышением заболеваемости болезнями системы кровообращения, и смертности от них. Вместо с тем следует учитывать результаты исследований, свидетельствующих, что препараты, очень быстро снижающие АД в острых случаях (гипертонический криз), увеличивают частоту инсультов, что не позволяет считать критерий снижения АД оптимальным и достаточным для исследования гипотензивных препаратов.
В качестве субъективных критериев могут быть использованы показатели, отражающие самочувствие. функциональное состояние, качество жизни и отношение пациентов к процессу лечения.
6) Адекватность статистической обработки данных, полученных в исследовании. Методы статистической обработки данных должны быть описаны в исследовании. Эксперты, проводящие оценку медицинской технологии, оценивают, правильно ли выбраны и применены статистические методы с учетом характера изучаемых признаков (качественные, количественные, порядковые), их распределения. числа сравниваемых групп участников исследования (две или более) и того, относятся ли изучаемые признаки к разным группам или к одной группе до и после какого-либо воздействия. При включении исследования в оценку медицинской технологии эксперты также оценивают, было ли рассчитано необходимое число наблюдений до начала исследования, представлены ли доверительные интервалы для показателей исходов.
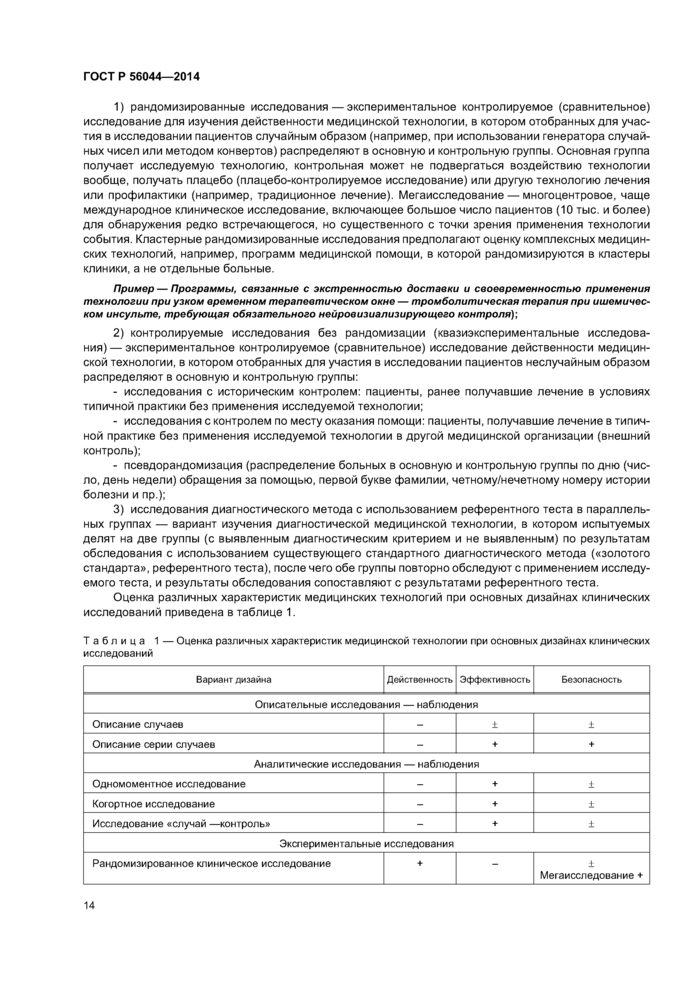
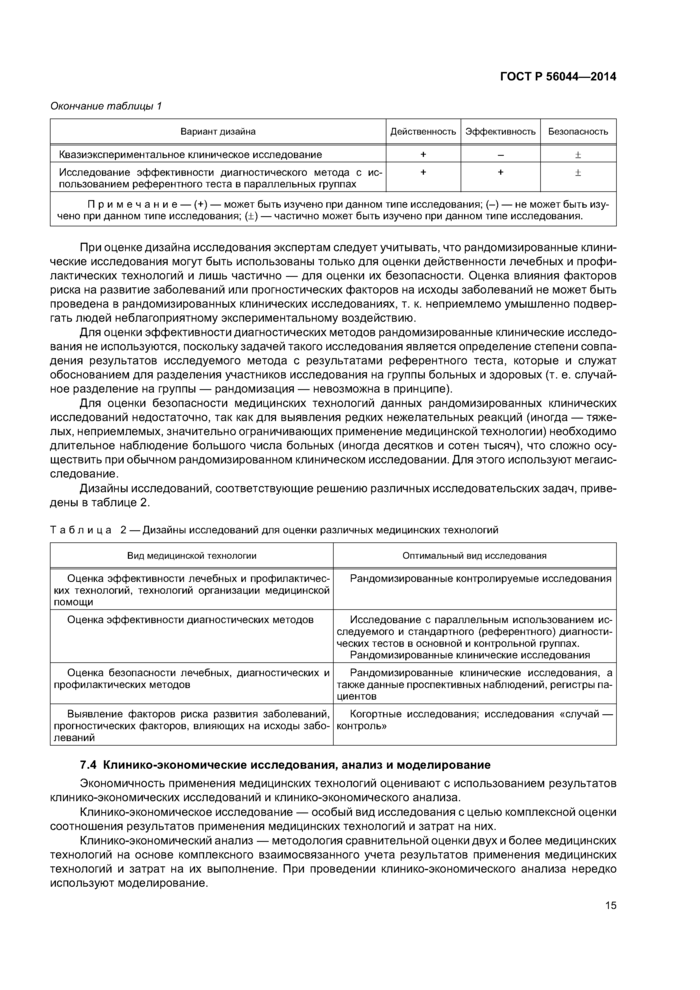
7.3 Дизайн клинических исследований медицинских технологий
Дизайн (структура) исследования — построение исследования, включающее способы выбора участников исследования, их разделения на подгруппы, применения исследуемых технологий, контроля и учета вмешивающихся факторов, сбора данных и соблюдения этических норм.
По дизайну исследования делятся на следующие группы:
а) Исследования-наблюдения — исследования, в которых исследователь наблюдает течение изучаемого процесса, не вмешиваясь в него специальными, заранее определенными как исследовательские. схемами диагностики или лечения:
1) описательные исследования-наблюдения — описание отдельных случаев или серии случаев без группы контроля:
- вариантом описательного исследования-наблюдения является регистр пациентов — лонгитудинальное исследование, связанное с формированием и ведением базы данных пациентов по унифицированным критериям отбора группы и оценки медицинской технологии:
2) аналитические исследования-наблюдения:
- одномоментное исследование — исследование, в котором в популяции или выборке из популяции одновременно изучают распространенность причинного фактора и предполагаемого следствия его воздействия, единицей наблюдения при этом является индивидуум;
- когортные исследования: определенные когорты единиц наблюдения (группа лиц, изначально объединенных каким-либо общим признаком) прослеживаются в течение некоторого периода времени. Две сравниваемые когорты формируют по наличию или отсутствию гипотетических причинных факторов и путем сравнения частоты развития исходов за время наблюдения оценивается вероятность наличия причинно-следственной связи;
- исследование «случай — контроль»: ретроспективное исследование, в котором сравнивают две группы, в одну из которых отбирают информацию о лицах с наличием исследуемого исхода, например. болезни или осложнения, а в другую — без него. Сначала формируют основную группу (случаи) и сходную с ней по основным исходным демографическим признакам и клиническим характеристикам (пол. возраст, диагноз, длительность заболевания, сопутствующая патология) контрольную, затем ретроспективно — по архивным данным или воспоминаниям, суждениям пациентов — оценивают частоту встречаемости предполагаемого причинного фактора в обеих группах. Если исследуемый параметр чаще встречался в основной группе, чем в контрольной, есть основания предполагать, что он связан с исходом.
б) Экспериментальные исследования — исследования, в которых исследователь сознательно вмешивается в наблюдаемый процесс, манипулируя одной или несколькими технологиями (изучаемыми переменными) и оставляя неизменными другие:
13
Содержание
1 Область применения............................................1
2 Нормативные ссылки............................................1
3 Общие положения.............................................1
4 Цели и задачи оценки медицинских технологий.............................3
5 Организация оценки медицинских технологий..............................3
5.1 Орган по оценке медицинских технологий.............................3
5.2 Рабочая группа по оценке медицинской технологии........................4
5.3 Декларация конфликта интересов..................................5
6 Порядок оценки медицинской технологии................................5
6.1 Инициализация оценки медицинской технологии..........................5
6.2 Этапы оценки медицинской технологии...............................5
6.3 Выбор темы оценки медицинской технологии...........................6
6.4 План (протокол) оценки медицинской технологии.........................7
6.5 Источники информации........................................7
6.6 Требования к поиску релевантной информации..........................8
7 Оценка научной обоснованности результатов исследований действенности, эффективности
и безопасности медицинской технологии.................................9
7.1 Внешняя валидность исследования.................................9
7.2 Внутренняя валидность исследования...............................10
7.3 Дизайн клинических исследований медицинских технологий..................13
7.4 Клинико-экономические исследования, анализ и моделирование................15
8 Обобщение и оценка информации о медицинской технологии....................25
8.1 Обобщение информации о медицинской технологии.......................25
8.2 Особенности анализа результатов клинических исследований.................26
8.3 Систематический обзор и мета-анализ..............................28
8.4 Интерпретация результатов клинико-экономического анализа.................28
8.5 Краткая оценка медицинской технологии.............................29
8.6 Социальные, правовые и этические аспекты применения медицинской технологии......30
9 Формирование отчета...........................................30
9.1 Требования к рекомендациям...................................31
9.2 Актуализация отчета.........................................32
Приложение А (рекомендуемое) Принятие решений о выборе медицинских технологий
на основании правила «Квадрата»............................33
Приложение Б (рекомендуемое) Конфликт интересов.........................34
Приложение В (рекомендуемое) Перечень вопросов для оценки методического качества
исследований различного типа..............................35
Приложение Г (рекомендуемое) Методики проведения ABC-, VEN-. частотного и ООО-анализов . 38
Приложение Д (рекомендуемое) Структура отчета о краткой оценке медицинской технологии... 44
Приложение Е (рекомендуемое) Структура отчета об оценке медицинской технологии.......45
ГОСТ Р 56044-2014
НАЦИОНАЛЬНЫЙ СТАНДАРТ РОССИЙСКОЙ ФЕДЕРАЦИИ
ОЦЕНКА МЕДИЦИНСКИХ ТЕХНОЛОГИЙ Общие положения
Evaluation of medical technologies. General regulations
Дата введения — 2015—06—01
1 Область применения
Настоящий стандарт устанавливает общие положения оценки медицинских технологий и предназначен для применения в системе здравоохранения Российской Федерации.
2 Нормативные ссылки
В настоящем стандарте использованы нормативные ссылки на следующие стандарты:
ГОСТ Р 52379-2005 Надлежащая клиническая практика
ГОСТ Р 52623.0-2006 Технологии выполнения простых медицинских услуг. Общие положения
Примечание — При пользовании настоящим стандартом целесообразно проверить действие ссылочных стандартов в информационной системе общего пользования — на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет или по ежегодному информационному указателю «Национальные стандарты», который опубликован по состоянию на 1 января текущего года, и по выпускам ежемесячною информационного указателя «Национальные стандарты» за текущий год. Если заменен ссылочный стандарт, на который дана недатированная ссылка, то рекомендуется использовать действующую версию этого стандарта с учетом всех внесенных в данную версию изменений. Если заменен ссылочный стандарт, на который дана датированная ссылка, то рекомендуется использовать версию этого стандарта с указанным выше годом утверждения (принятия). Если после утверждения настоящего стандарта в ссылочный стандарт, на который дана датированная ссылка, внесено изменение. затра1ивающее положение, на которое дана ссылка, то это положение рекомендуется применять без учета данного изменения. Если ссылочный стандарт отменен без замены, то положение. в котором дана ссылка на него, рекомендуется применять в части, не затрагивающей эту ссылку.
3 Общие положения
Оценка медицинских технологий и основанные на ней рекомендации используются следующими группами лиц. принимающих решения:
- плательщиками (страховые медицинские организации и фонды медицинского страхования, пациенты) в отношении компенсации затрат на медицинские технологии:
- клиницистами и пациентами относительно целесообразности применения медицинской технологии;
- менеджерами медицинских организаций относительно внедрения новых медицинских технологий или замены существующих;
- представителями фармацевтической и медицинской промышленности при разработке новых медицинских технологий и маркетинге;
- органами законодательной и исполнительной власти;
- инвесторами при финансировании новых проектов в области здравоохранения.
Позиция оценки медицинской технологии — угол зрения, под которым оценивают медицинскую технологию, может быть трех основных видов: регулирующие органы, ответственные за регистрацию
Издание официальное
новой медицинской технологии и ее дальнейший мониторинг (действенность и безопасность), плательщики (эффективность, экономичность), провайдеры и потребители медицинской технологии (эффективность, безопасность, законность и этичность).
Принятие решений базируется на научных математических, логических и экономических моделях (теория игр, древо решений, модель Маркова и др.). Общим для использования всех моделей при принятии решений является применение правила квадрата принятия решений (см. приложение А).
Правило квадрата принятия решения — лицо, принимающее решение, оказывается как бы в туннеле квадратного сечения, где на него воздействует несколько факторов — граней. Первая грань — информационная — получение релевантной информации из общего объема информации. Далее эта информация подвергается осмыслению, и на этой основе строится первичная модель решения (грань анализа и моделирования). На эту модель существенное влияние оказывают неспецифические факторы, образуя грань неспецифических воздействий. Всякая экономическая система пытается остаться в стабильном состоянии и сопротивляется любым изменениям и воздействиям, образуя грань сопротивления на уровне субъектно-объектных отношений. Процедура оценки медицинских технологий является элементом двух первых граней квадрата принятия решения.
Оценка медицинской технологии — всесторонний процесс обобщения информации о медицинской технологии, направленный на оптимизацию принятия решений, при котором изучаются краткосрочные и отсроченные медицинские, социальные, экономические и этические аспекты разработки, распространения и применения медицинской технологии, проводимый с использованием открытых, непредвзятых, систематических и устойчивых процедур.
Медицинские технологии — методы диагностики, лекарственного и нелекарственного лечения, профилактики и реабилитации, системы охраны и укрепления здоровья, использующиеся в здравоохранении. К медицинским технологиям относят:
- применение лекарств, включая биологические препараты (вакцины, сыворотки, препараты биотехнологического производства) при определенном заболевании, синдроме или клинической ситуации;
- применение крови и ее компонентов при определенном заболевании, синдроме или клинической ситуации;
- применение специализированного лечебного питания;
- использование приборов (компьютерный томограф, аппарат для измерения артериального давления), расходных материалов, (перчатки, бинты), технических устройств и приложений к мобильным телефонам и мини-компьютерам (фотофиксация, оценка энергетической ценности продуктов питания по специальному коду, шагомер и др.);
- терапевтические и хирургические процедуры (акупунктура, плазмаферез, эндоскопическая цистэктомия. методы психологического воздействия);
- иные мероприятия и процедуры (школа пациента с определенной патологией, обучение родственников и немедицинских работников процедурам ухода, дистанционные консультации с использованием телекоммуникативных систем и приспособлений);
- вспомогательные управленческие системы и процедуры (использование формуляра больницы. аутсорсинг лабораторных исследований, лицензирование деятельности организаций, система электронной или телефонной записи на приеме к врачу, применение электронной истории болезни);
- системы организации, предоставления и управления медицинской помощью (программа диспансеризации, программа иммунизации, система оплаты из средств обязательного медицинского страхования за пролеченного больного, система фондодержания врачом общей практики).
Объект оценки медицинской технологии — медицинские технологии, разрешенные к применению в системе здравоохранения Российской Федерации в установленном порядке, находящиеся в процессе официальной регистрации, применяемые в международной практике или практике других стран.
Предмет оценки медицинской технологии — данные о действенности, эффективности, безопасности и экономической целесообразности (приемлемости), этичности и законности медицинской технологии в конкретной ситуации (применение технологии в конкретной группе больных или населения по конкретным показаниям конкретным способом). Могут быть оценены другие данные, например, о биологической или терапевтической эквивалентности воспроизведенного и оригинального лекарственных средств или о терапевтической эквивалентности биологически произведенных лекарств ит. д.
Действенность медицинской технологии — эффекты от применения медицинской технологии, полученные в условиях контролируемых клинических исследований.
Эффективность медицинской технологии — эффекты от применения медицинской технологии, полученные в условиях типичной клинической практики (реального мира).
2
Безопасность медицинской технологии — степень риска развития нежелательных побочных реакций и побочных эффектов.
Экономичность медицинской технологии — приемлемое для плательщика соотношение затрат на медицинскую технологию и результатов ее применения.
Этичность и законность медицинской технологии — непротиворечив применения медицинской технологии этическим нормам, сложившимся в обществе (включая религиозные аспекты) и действующему законодательству.
4 Цели и задачи оценки медицинских технологий
Оценку медицинских технологий проводят в целях повышения качества и доступности медицинской помощи путем обеспечения неопределенного круга лиц или представителей целевой группы (лиц. принимающих решение, медицинских работников, пациентов или соответствующих организаций) объективной, обобщенной, систематизированной информацией о действенности, эффективности, безопасности, экономичности, этичности и законности методов диагностики, лечения, профилактики и реабилитации с учетом доказательной базы, этических, юридических, социальных и экономических аспектов применения медицинской технологии.
Основной целью настоящего стандарта является унификация требований к проведению оценки медицинских технологий.
Задачами настоящего стандарта являются:
- оптимизация и нормативное обеспечение процесса оценки медицинских технологий;
- создание условий для выработки правильных, научно обоснованных, оптимальных политических, организационных и экономических решений о внедрении отдельных медицинских технологий в практику на федеральном, региональном и локальном уровнях системы здравоохранения, разработки документов, регулирующих объемы и качество медицинской помощи [клинические рекомендации (протоколы лечения), стандарты медицинской помощи, перечни и формуляры лекарственных средств и др1;
- обоснование решений о финансировании медицинских технологий за счет обобществленных источников (обязательное медицинское страхование, федеральный бюджет, бюджеты субъектов федерации, добровольное медицинское страхование и т. д.) или личных средств граждан;
- планирование научных исследований в сфере здравоохранения;
- выбор оптимального метода диагностики, лечения, профилактики и реабилитации при ведении определенных групп пациентов и конкретных больных.
5 Организация оценки медицинских технологий
5.1 Орган по оценке медицинских технологий
Для проведения оценки медицинских технологий создается орган по оценке медицинских технологий. Орган по оценке медицинских технологий может быть создан на временной или постоянной основе:
- органами законодательной и исполнительной власти, включая органы управления здравоохранения любого уровня;
- фондом медицинского страхования;
- страховой медицинской организацией:
- медицинской организацией;
- научно-исследовательской медицинской организацией;
- образовательной медицинской организацией;
- профессиональной медицинской общественной организацией;
- общественной организацией пациентов.
При создании органа по оценке медицинской технологии издается соответствующий распорядительный документ, содержащий основные положения об органе: цели и задачи его деятельности, полномочия, основные правила и регламент деятельности, правила делопроизводства и хранения информации, источники финансирования и т. д.
Рекомендуется междисциплинарный состав органа по оценке медицинских технологий (включение в процесс оценки специалистов различных направлений), обеспечивающий объективность оценки, учет мнений различных заинтересованных и профессиональных сторон и целевых групп.
3
Возглавляет орган по оценке медицинских технологий руководитель, назначаемый распорядительным документом организации, создавшей орган. Руководитель органа должен обладать опытом управления работой команды, знанием английского языка, умениями поиска и критической оценки медицинской информации, быть знакомым с основными положениями медицины доказательств (клинической эпидемиологии), клинико-экономического анализа, оценки медицинских технологий, стандартизации медицинских технологий, иметь опыт работы по оценке медицинских технологий и соответствующие публикации.
Функциями органа по оценке медицинских технологий являются:
- планирование работ по оценке медицинских технологий (сбор и анализ предложений по проведению оценки конкретных медицинских технологий, выбор приоритетных технологий для оценки);
- создание рабочих групп по оценке отдельных медицинских технологий, координация их работ и обеспечение их деятельности (канцелярские принадлежности, оргтехника, связь);
- заслушивание и принятие отчетов рабочих групп;
- направление отчетов рабочих групп на публикацию, определение сайта Интернет и печатного органа (периодическое издание), где будет освещаться деятельность рабочей группы, или выбор иной методики публичного распространения информации о результатах оценки медицинской технологии, например, для ограниченного круга лиц — сотрудников медицинской организации, если оценка медицинской технологии проводится для нужд медицинской организации;
- организация обучения экспертов, участвующих в оценке медицинских технологий, консультирование по вопросам методологии оценки медицинских технологий;
- анализ результатов работ по оценке медицинских технологий, разработка и внедрение рекомендаций по их совершенствованию.
5.2 Рабочая группа по оценке медицинской технологии
Для проведения оценки отдельной медицинской технологии органом по оценке медицинских технологий формируется рабочая группа. Цели, задачи, порядок деятельности рабочей группы формулируются в установочном документе (положении о деятельности рабочей группы).
Членами рабочей группы по оценке медицинских технологий могут быть (в зависимости от задач оценки медицинских технологий) врачи различных специальностей, специалисты в области организации здравоохранения и общественного здоровья, средний медицинский персонал, провизоры, представители общественных организаций пациентов, экономисты, социальные работники, представители производителей лекарственных средств и изделий медицинского назначения, юристы, специалисты по медицинской этике и праву, в отдельных случаях — представители религиозных конфессий.
Пример — Возможно участие юристов в процессе оценки медицинской технологии (ОМТ) на стадии рецензирования отчета на предмет зкспортизы соответствия рекомендаций по применению технологии правам пациентов, или привлечение экономистов к расчету затрат на применение медицинской технологии, или приглашение представителей общественных объединений пациентов для обсуждения проекта рекомендаций по применению технологии, предназначенных для пациентов.
В состав рабочей группы могут быть включены как члены органа по оценке медицинских технологий. так и иные эксперты, рекомендуемые членами органа или членами рабочей группы. Никто не вправе отказать во включении в состав рабочей группы новому члену, рекомендованному в порядке, установленном регламентом деятельности органа.
Руководитель органа по оценке медицинских технологий назначает руководителя и секретаря рабочей группы. Руководитель рабочей группы должен обладать навыками группового управления (управления работой команды), поиска и критической оценки медицинской информации, быть знакомым с основными положениями медицины доказательств (клинической эпидемиологии), клинико-экономического анализа, оценки медицинских технологий, желательно иметь опыт работы по оценке медицинских технологий.
Руководитель рабочей группы осуществляет координацию работ по оценке медицинской технологии. обеспечивает соблюдение методологических принципов оценки медицинских технологий, ведет заседания рабочей группы, если они предусмотрены регламентом.
Секретарь рабочей группы осуществляет делопроизводство и обеспечивает взаимодействие членов рабочей группы, в том числе посредством Интернет.
Члены рабочей группы должны быть знакомы с принципами медицины доказательств (клинической эпидемиологии), клинико-экономического анализа, желательно обладать навыками поиска и критической оценки медицинской информации. При необходимости члены рабочей группы должны пройти соответствующее обучение.
4
Возможно привлечение к участию в процессе оценки медицинской технологии экспертов, не входящих в состав рабочей группы. Функции привлеченных к процессу оценки лиц определяются в установочном документе (положении о деятельности рабочей группы). Такими функциями могут быть предоставление дополнительной информации о медицинской технологии, рассмотрение проекта отчета. оценка правильности расчетов и построения моделей, формирование электронных таблиц, баз данных или математических моделей.
На первом заседании рабочей группы формируется план работы, распределяются обязанности между членами рабочей группы.
5.3 Декларация конфликта интересов
Члены органа по оценке медицинских технологий и рабочей группы по оценке медицинской технологии. привлекаемые к работе группы эксперты должны избегать конфликта интересов — наличия интересов, противоречащих общественным интересам, которые могут привести к заключениям, не отвечающим интересам пациентов, групп пациентов, системы здравоохранения, общества в целом.
Основные положения и требования по учету конфликта интересов при формировании рабочей группы (комиссии) для подготовки документов 8 рассматриваемой области приведены в приложении Б.
6 Порядок оценки медицинской технологии
6.1 Инициализация оценки медицинской технологии
Инициатором оценки медицинских технологий может быть:
- орган законодательной и исполнительной власти, включая органы управления здравоохранения любого уровня;
- фонд медицинского страхования;
- страховая медицинская организация;
- медицинская организация;
- научно-исследовательская организация;
- образовательная организация;
- профессиональная медицинская общественная организация;
- общественная организация пациентов;
- орган по оценке медицинских технологий;
- отдельный медицинский работник или пациент.
Экспертный орган может выполнять работы по оценке медицинской технологии как по собственной инициативе, так и по заказу.
6.2 Этапы оценки медицинской технологии
Оценка медицинской технологии включает следующие этапы:
- выбор темы для оценки;
- формирование плана (протокола) оценки медицинской технологии;
- формулировка вопросов для оценки;
- поиск информации о медицинской технологии (эффективности, безопасности, экономической целесообразности (приемлемости), других характеристиках);
- формирование перечня медицинских технологий, альтернативных оцениваемой медицинской технологии, применяемых для достижения аналогичных целей, и обоснование выбора альтернативных технологий;
- сведение полученных данных в структурированную форму, проведение расчетов, при необходимости;
- критический анализ информации о медицинской технологии: эффективности, безопасности, экономической целесообразности (приемлемости), других характеристик, результатов применения в практике (типичная практика), доступности, социальной значимости и пр. (первая версия отчета), анализ альтернативных медицинских технологий (если имеются);
- распространение первой версии отчета среди членов рабочей группы, или. при необходимости, среди приглашенных экспертов или внешних рецензентов;
- обсуждение и валидация полученных материалов рабочей группой, формулирование заключительных рекомендаций, предложения по созданию окончательной версии отчета;
- подготовка отчета (окончательная версия);
5
- вынесение окончательной версии отчета на заседание органа по оценке медицинских технологий, внесение поправок в окончательную версию отчета (при необходимости);
- публикация окончательной версии отчета.
Заключительный отчет должен содержать следующие характеристики оцениваемой медицинской технологии:
- описание проблемы: заболевание, группа заболеваний, синдром или симптом, на который направлена оцениваемая технология, эпидемиологические данные, бремя болезни, традиционное применение медицинских технологий, альтернативных оцениваемой технологии;
- описание и характеристики оцениваемой медицинской технологии, преимущества и недостатки. методика применения технологии, критерии оценки эффективности и безопасности; раздел может содержать иллюстративный материал, формулы, модели;
- эффективность в условиях экспериментальных исследований и клинической (типичной) практики;
- безопасность — характеристика и частота побочных эффектов и нежелательных результатов при применении медицинской технологии, возможные пути предупреждения или уменьшения степени выраженности побочных эффектов;
- экономическая (клинико-экономическая) оценка с расчетом соотношения затрат и эффективности (полезности), влияния на бюджет;
- этическая характеристика с учетом норм морали, вопросы обеспечения справедливости в доступности технологии, возможность ущемления потребностей иных, не связанных с оцениваемой технологией социальных групп или нанесение вреда (например, тестирование школьников на применение наркотиков может иметь отрицательное значение даже в случае, если школьник (или его родители) не дают согласие на тестирование];
- организационные подходы по применению технологии, включая необходимость обучения персонала. создания специализированных отделений или кабинетов и т. д.;
- социальные аспекты применения технологии с позиций различных социальных групп, выбор которых определяется особенностями оцениваемой технологии;
- правовые аспекты, соответствие нормам права, в том числе обеспечение прав человека и конфиденциальности при применении технологии;
- краткие характеристики медицинских технологий, альтернативных оцениваемой медицинской технологии;
- нерешенные в ходе оценки технологии вопросы.
Повторное рассмотрение вновь появившейся информации, актуализацию отчета и новую публикацию проводят с соблюдением изложенных выше этапов работы. Причиной для повторной оценки медицинской технологии может быть результат мониторинга ее внедрения, появление новых сведений об эффективности медицинских технологий, альтернативных оцениваемой медицинской технологии.
6.3 Выбор темы оценки медицинской технологии
При выборе тем для оценки медицинской технологии рекомендуется учитывать следующие характеристики медицинских технологий:
- социальная, медицинская и экономическая значимость заболевания, синдрома или клинической ситуации, при которых применяется обсуждаемая медицинская технология (первичная заболеваемость. распространенность, тяжесть заболевания, темп роста заболеваемости, инвалидизация. влияние на качество жизни, влияние на продолжительность жизни, ресурсоемкость, бремя болезни, затратность технологии и ее влияние на бюджет, обеспечение принципа справедливости в доступности оцениваемой и альтернативных медицинских технологий и пр.);
- предполагаемое влияние технологии на течение и исходы заболевания, синдрома или клинической ситуации, при которых она применяется;
- наличие разногласий между специалистами, администраторами, законодателями, плательщиками, потребителями и др. целевыми группами в отношении целесообразности применения технологии;
- наличие альтернативных технологий, которые могут быть использованы при данном заболевании, синдроме или клинической ситуации;
- возможность влияния на использование технологии управленческими методами;
- наличие ресурсной базы для использования медицинской технологии — здания и сооружения, разрешенные к применению оборудование, средства медицинского применения, реактивы, лекарственные средства, персонал, имеющий соответствующую квалификацию (при необходимости);
- этические и юридические аспекты (при необходимости);
- заинтересованность лиц. принимающих решения в оценке конкретной медицинской технологии:
- выполнимость оценки медицинской технологии, наличие необходимой доказательной базы.
6
Предложение о выборе темы для проведения оценки медицинской технологии, содержащее обоснования с учетом приведенных выше характеристик, представляют в Орган по оценке медицинских технологий. Орган по оценке медицинских технологий рассматривает все предложения и формирует, при необходимости, приоритетный перечень медицинских технологий, подлежащих оценке.
6.4 План (протокол) оценки медицинской технологии
До начала работы рабочая группа формирует план (протокол) по оценке медицинских технологий.
В плане (протоколе) должны быть отражены следующие вопросы:
- наименование технологии, которая будет оцениваться:
- обоснование выбора темы по оценке данной технологии:
- цели и задачи оценки медицинской технологии;
- этапы работы и сроки завершения каждого этапа:
- характеристики медицинской технологии, которые подлежат оценке (эффективность, безопасность. экономическая целесообразность (приемлемость), другое]:
- стратегия поиска данных о технологии, предполагаемые источники релевантной информации о медицинской технологии, ключевые слова, по которым будет осуществляться поиск релевантной информации;
- критерии оценки доказательств эффективности, безопасности, экономической целесообразности (приемлемости) медицинской технологии;
- принципы обобщения данных;
- состав рабочей группы;
- декларация конфликта интересов;
- почтовый и электронный адрес для переписки;
- источник финансирования работ.
6.5 Источники информации
Источники информации о медицинской технологии подразделяют на первичные и вторичные. Первичным источником является публикация результатов клинических исследований, в том числе — регистров пациентов. Вторичными источниками информации о медицинской технологии являются обобщающие источники; инструкции по применению лекарственных средств и изделий медицинского назначения, формулярные статьи на лекарственные средства, обзор литературы, систематический обзор, мета-анализ, протоколы ведения больных, клинические рекомендации (протоколы лечения) и др.
Поиск релевантной информации проводят в сети Интернет, в электронных базах данных, базах данных систематических обзоров и отчетов по оценке медицинских технологий, поиск вручную — в периодических изданиях, материалах конференций. Обязательным является проведение поиска в базе данных контролируемых испытаний Кокрановского сотрудничества, базе данных «Российская медицина» Центральной научной медицинской библиотеки Первого МГМУ им. И.М.Сеченова, Кокра-новской библиотеке и базе данных MEDLINE. Другие базы данных для поиска определяются рабочей группой исходя из медицинской технологии, являющейся предметом оценки.
В качестве дополнительных источников данных могут выступать данные регистра пациентов, обобщение формализованных наблюдений из медицинской практики, сообщения и отчеты о частоте побочных эффектов, данные о медицинской технологии, которые могут быть предоставлены изготовителями лекарственных средств, изделий медицинского назначения, провайдером медицинской технологии, медицинскими работниками, объединениями медицинских работников, объединениями пациентов, другие материалы, в которых содержится информация о результатах применения медицинской технологии, в том числе неопубликованные.
Экспертам рабочей группы следует предпринимать специальные усилия и стремиться найти результаты неопубликованных исследований, так как существует тенденция преимущественной публикации положительных результатов. Информация о наличии неопубликованных исследований может быть получена, в частности, при анализе соответствия перечня начатых клинических исследований, зарегистрированных в специализированной базе данных, перечню публикаций, обнаруженных в результате поиска.
Перечень всех найденных источников релевантной информации должен быть представлен в отчете с указанием выходных данных в соответствии с правилами публикации научной информации.
При оценке альтернативных медицинских технологий следует учитывать возможное использование технологий не в соответствии с зарегистрированными показаниями (в первую очередь это касается лекарственных средств), наличие различий в показаниях, противопоказаниях, предупреждениях у раз-
7