ГОСТ Р 54063-2010
Средства лекарственные для ветеринарного применения. Методы определения безвредности
Купить ГОСТ Р 54063-2010 — бумажный документ с голограммой и синими печатями. подробнее
Распространяем нормативную документацию с 1999 года. Пробиваем чеки, платим налоги, принимаем к оплате все законные формы платежей без дополнительных процентов. Наши клиенты защищены Законом. ООО "ЦНТИ Нормоконтроль"
Наши цены ниже, чем в других местах, потому что мы работаем напрямую с поставщиками документов.
Способы доставки
- Срочная курьерская доставка (1-3 дня)
- Курьерская доставка (7 дней)
- Самовывоз из московского офиса
- Почта РФ
Распространяется на методы определения безвредности и токсичности лекарственных средств для ветеринарного применения и устанавливает дозы, способы введения лекарственного средства и виды испытаний.
Отменен, с 01.07.2014 г. пользоваться ГОСТ 31926-2013 (ИУС 12-2013)
Оглавление
1 Область применения
2 Нормативные ссылки
3 Термины, определения и сокращения
4 Общие положения
5 Отбор проб
6 Материалы и животные
7 Подготовка к испытанию
8 Способы введения лекарственного средства
9 Дозы лекарственного средства, используемые при испытании безвредности
10 Определение полноты инактивации (остаточной токсичности и вирулентности) вакцин на лабораторных животных или культуре клеток
11 Определение аллергизирующего действия лекарственного средства
12 Определение пирогенности
13 Определение бактериальных эндотоксинов
14 Качественный анализ (метод А)
15 Количественный анализ (метод В)
16 Турбидиметические методы (С и F)
17 Хромогенные методы (D и E)
18 Предварительные испытания
19 Учет результатов
20 Испытание на токсичность фармакологических лекарственных средств
21 Определение местного действия (реактогенности)
22 Определение стерильности
23 Определение микробиологической чистоты
24 Учет результатов испытания
Библиография
| Дата введения | 01.01.2012 |
|---|---|
| Добавлен в базу | 01.09.2013 |
| Завершение срока действия | 01.07.2014 |
| Актуализация | 01.01.2021 |
Этот ГОСТ находится в:
- Раздел Экология
- Раздел 11 ЗДРАВООХРАНЕНИЕ
- Раздел 11.220 Ветеринария
- Раздел 11 ЗДРАВООХРАНЕНИЕ
- Раздел Электроэнергия
- Раздел 11 ЗДРАВООХРАНЕНИЕ
- Раздел 11.220 Ветеринария
- Раздел 11 ЗДРАВООХРАНЕНИЕ
Организации:
| 30.11.2010 | Утвержден | Федеральное агентство по техническому регулированию и метрологии | 699-ст |
|---|---|---|---|
| Разработан | ФГУ ВГНКИ | ||
| Издан | Стандартинформ | 2011 г. |
Medicine remedies for veterinary use. Methods of safety identification
- ГОСТ 6709-72 Вода дистиллированная. Технические условия
- ГОСТ 22280-76 Реактивы. Натрий лимоннокислый 5,5-водный. Технические условия
- ГОСТ 22967-90 Шприцы медицинские инъекционные многократного применения. Общие технические требования и методы испытаний
- ГОСТ 24861-91 Шприцы инъекционные однократного применения
- ГОСТ 25336-82 Посуда и оборудование лабораторные стеклянные. Типы, основные параметры и размеры
ГОСТ 25377-82Иглы инъекционные многократного применения. Технические условия. Заменен на ГОСТ 25377-2015.ГОСТ 28085-89Препараты биологические. Метод бактериологического контроля стерильности. Заменен на ГОСТ 28085-2013.- ГОСТ 29230-91 Посуда лабораторная стеклянная. Пипетки градуированные. Часть 4. Пипетки выдувные
- ГОСТ 8074-82 Микроскопы инструментальные. Типы, основные параметры и размеры. Технические требования
- ГОСТ Р 52684-2006 Средства лекарственные для ветеринарного применения. Правила приемки, методы отбора проб
- ГОСТ Р ИСО 7864-2009 Иглы инъекционные однократного применения стерильные
- Показать все
Чтобы бесплатно скачать этот документ в формате PDF, поддержите наш сайт и нажмите кнопку:

стр. 1

стр. 2

стр. 3
стр. 4

стр. 5

стр. 6

стр. 7

стр. 8

стр. 9

стр. 10

стр. 11

стр. 12
стр. 13

стр. 14
стр. 15

стр. 16

стр. 17

стр. 18

стр. 19

стр. 20
ФЕДЕРАЛЬНОЕ АГЕНТСТВО ПО ТЕХНИЧЕСКОМУ РЕГУЛИРОВАНИЮ И МЕТРОЛОГИИ
ГОСТР
54063-
2010
НАЦИОНАЛЬНЫЙ
СТАНДАРТ
РОССИЙСКОЙ
ФЕДЕРАЦИИ
СРЕДСТВА ЛЕКАРСТВЕННЫЕ ДЛЯ ЖИВОТНЫХМетоды определения безвредности
Издание официальное
Москва
Стандартинформ
2011
Предисловие
Цели и принципы стандартизации в Российской Федерации установлены Федеральным законом от 27 декабря 2002 г. № 184-ФЗ «О техническом регулировании», а правила применения национальных стандартов Российской Федерации — ГОСТ Р 1.0-2004 «Стандартизация в Российской Федерации. Основные положения»
Сведения о стандарте
1 РАЗРАБОТАН Федеральным государственным учреждением «Всероссийский государственный Центр качества и стандартизации лекарственных средств для животных и кормов» (ФГУ «ВГНКИ»)
2 ВНЕСЕН Управлением технического регулирования и стандартизации Федерального агентства по техническому регулированию и метрологии
3 УТВЕРЖДЕН И ВВЕДЕН В ДЕЙСТВИЕ Приказом Федерального агентства по техническому регулированию и метрологии от 30 ноября 2010 г. № 699-ст
4 ВВЕДЕН ВПЕРВЫЕ
Информация об изменениях к настоящему стандарту публикуется в ежегодно издаваемом информационном указателе «Национальные стандарты», а текст изменений и поправок — в ежемесячно издаваемых информационных указателях «Национальные стандарты». В случае пересмотра (замены) или отмены настоящего стандарта соответствующее уведомление будет опубликовано в ежемесячно издаваемом информационном указателе «Национальные стандарты». Соответствующая информация, уведомление и тексты размещаются также в информационной системе общего пользования — на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет
©Стандартинформ, 2011
Настоящий стандарт не может быть полностью или частично воспроизведен, тиражирован и распространен в качестве официального издания без разрешения Федерального агентства по техническому регулированию и метрологии
ГОСТ Р 54063-2010
ный анализ) или оценить, соответствует ли содержание эндотоксинов предельному значению, установленному для испытуемого препарата (качественный анализ).
Качественный анализ является основным методом проведения анализа по показателю «Бактериальные эндотоксины», этот же анализ является арбитражным.
Возможно проведение определения содержания бактериальных эндотоксинов иными методами или модификациями при условии, что результаты не противоречат результатам основного метода.
Метод определения бактериальных эндотоксинов с помощью ЛАЛ-реактива является альтернативным, наряду с ним могут быть использованы и другие методы (определение пирогенности на кроликах).
13.1 Подготовка к испытанию13.1.1 Подготовка посуды
Стеклянная и пластиковая посуда, используемая вЛАЛ-тесте, не должна содержать бактериальные эндотоксины в количествах, определяемых в тесте, и не должна оказывать влияния на ход реакции. Посуда может быть депирогенизирована при температуре 250 °С не менее 30 мин.
13.1.2 Стандарты эндотоксина
Содержание бактериальныхэндотоксинов выражается в единицахэндотоксина (ЕС) Международного стандарта эндотоксина. При проведении анализа используют контрольный стандарт эндотоксина (КСЭ), активность которого установлена по Международному стандарту эндотоксина.
Контрольный стандарт эндотоксина предназначен для проведения анализа с данной партией ЛАЛ-реактива (ТАП-реактива). Контрольный стандарт эндотоксина и ЛАП-реактив или ТАП-реактив должны быть зарегистрированы уполномоченным органом. Растворение и хранение КСЭ осуществляют согласно инструкции фирмы-производителя.
13.1.2.1 ЛАП-реактив
Используют ЛАП-реактив, предназначенный для проведения фармакопейного анализа с помощью гель-тромб теста. В случае проведения анализа методом, отличным от основного, необходимо использовать реактив, предназначенный для данного метода.
Чувствительность реактива (X) выражается в единицах эндотоксина [ЕЭ/см3 (EC/мл)] и соответствует минимальной концентрации международного стандарта эндотоксина, которая вызывает образование плотного геля при реакции с данным реактивом. ЛАП-реактив представляет собой лиофилизированный препарат. Растворение и хранение ЛАЛ-реактива осуществляют согласно инструкции фирмы-производителя.
13.1.2.2 Вода для ЛАП-теста
Вода для ЛАП-теста должна соответствовать требованиям, предъявляемым к воде для инъекций, и при этом не должна содержать бактериальные эндотоксины в количествах, определяемых в тесте.
13.1.3 Максимально допустимое разведение испытуемого лекарственного средства
Максимально допустимое разведение (МДР) — это наибольшее разведение испытуемого лекарственного средства, в котором возможно определение концентрации эндотоксина, соответствующей значению предельного содержания бактериальных эндотоксинов, установленному для данного лекарственного средства
МДР = ^, (2)
А,
гдеХ—предельное содержание бактериальных эндотоксинов: допустимое содержание бактериальныхэндотоксинов в испытуемом лекарственном средстве, указанное в нормативном документе на конкретное лекарственное средство;
С — концентрация испытуемого раствора: концентрация лекарственного средства ил и действующего вещества, для которого указано предельное содержание бактериальныхэндотоксинов;
X— чувствительность ЛАЛ-реактива, ЕЭ/см3.
Предельное содержание бактериальных эндотоксиновХрассчитывают по формуле
где К—пороговая пирогенная доза, равная 5ЕЭ/кгвчас, для испытуемого лекарственного средства, если он вводится животному любым парентеральным путем, кроме интратекального. При интратекальном пути введения лекарственного средства К составляет 0,2 ЕЭ/кг;
М— максимальная терапевтическая доза испытуемого лекарственного средства, вводимая в течение одного часа (мг; см3; ЕД на 1 кг массы тела).
9
Для радиофармацевтических лекарственных средств, вводимых парентерально, предельное содержание бактериальных эндотоксинов Х1 рассчитывают по формуле
Х=1751/, (4)
где V — максимально рекомендованная доза, см3.
Для радиофармацевтических лекарственных средств, вводимых интратекально, предельное содержание бактериальных эндотоксинов Х2 рассчитывают по формуле
Х2 = 141/. (5)
Для субстанций рассчитывают предельное содержание бактериальных эндотоксинов, используя величину М, выбранную для лекарственной формы.
13.1.4 Подготовка испытуемого образца
Каждый отобранный образец испытывают отдельно.
Для растворения и (или) разведения испытуемого лекарственного средства используют воду для ЛАЛ-теста, если не указано иного в нормативном документе на конкретное лекарственное средство. Испытуемый раствор должен иметь pH в пределах, указанных производителем ЛАЛ-реактива, обычно 6,0—8,0. В случае необходимости pH доводят растворами кислоты, основания или буферным раствором. Используемые растворы не должны содержать бактериальных эндотоксинов в количествах, определяемых в тесте, и не должны оказывать влияния на ход реакции.
13.2 Проведение анализа
В круглодонные пробирки диаметром 10 мм вносят равные объемы ЛАП-реактива и испытуемого раствора (по 0,1 см3). Реакционные смеси аккуратно перемешивают и инкубируют при температуре (37 + 1) °Свтечение(60 + 2) мин. Во время инкубирования следует избегать вибрации и ударов. По истечении указанного срока визуально регистрируют результаты как положительные, так и отрицательные. Положительная реакция (+) характеризуется образованием плотного геля, который не разрушается при аккуратном однократном переворачивании пробирки на 180°. Отрицательная реакция (-) характеризуется отсутствием такого геля.
13.2.1 Предварительные анализы
Для подтверждения достоверности и точности результатов определения бактериальных эндотоксинов, проводимых с помощью ЛАП-реактива, необходимо подтвердить чувствительность реактива, указанную на этикетке, а также убедиться в том, что испытуемое лекарственное средство не содержит факторов, мешающих проведению реакции.
13.2.1.1 Подтверждение заявленной чувствительности ЛАЛ-реактива
Анализ проводят для каждой новой серии используемого ЛАЛ-реактива, а также при изменении условий эксперимента, используемых материалов и реактивов, способныхповлиятьнарезультаттеста.
13.3 Проведение анализа
Для проведения анализа готовят растворы С и D по схеме, приведенной в таблице 1.
|
Таблица 1 — Схема эксперимента «Подтверждение заявленной чувствительности ЛАЛ-реактива» | ||||||||||||||||||||||||||||||||||||
|
Растворы С — серия разведений КСЭ в воде для ЛАЛ-теста (проверка чувствительности ЛАЛ-реактива).
Раствор D — вода для ЛАЛ-теста (отрицательный контроль).
Опыт проводят, как описано в 13.2.
ГОСТ Р 54063-201013.4 Обработка результатов
Анализ считают достоверным, если для раствора D (отрицательный контроль) во всех повторностях получены отрицательные результаты; для раствора С концентрацией 0.25Х получены отрицательные результаты.
Конечной точкой реакции для каждой из повторностей растворов С является положительный результат, полученный для раствора с наименьшей концентрацией КСЭ.
Среднегеометрическое значение чувствительности ЛАЛ-реактива Сксэ в конечной точке реакции рассчитывают по формуле
Сксэ = antilog (6)
где Сксэ — концентрация контрольного стандарта эндотоксина;
Ее — сумма логарифмов концентраций КСЭ в конечной точке реакции в каждой из повторностей; f— число повторностей.
Заявленная чувствительность ЛАЛ-реактива считается подтвержденной и используется в дальнейших расчетах в том случае, если полученное в эксперименте значение чувствительности ЛАЛ-реактива от 0,5 до 2, ОХ.
13.5 Мешающие факторы
Испытуемое лекарственное средство может содержать мешающие факторы, усиливающие и (или) ин гибирующие реакцию ЛАЛ-реактива с бактериальными эндотоксинами. Обнаружить эти явления можно, сравнив способность используемого ЛАЛ-реактива реагировать с раствором КСЭ в воде для ЛАП-теста и в растворе испытуемого лекарственного средства в стандартных условиях проведения эксперимента.
Испытанию может быть подвергнуто лекарственное средство в любом разведении, не превышаю-щемзначения МДР. Используемые вданном анализе пробы испытуемого лекарственного средства (или его разведения) не должны содержать бактериальных эндотоксинов в определяемых в тесте количествах.
13.5.1 Проведение анализа
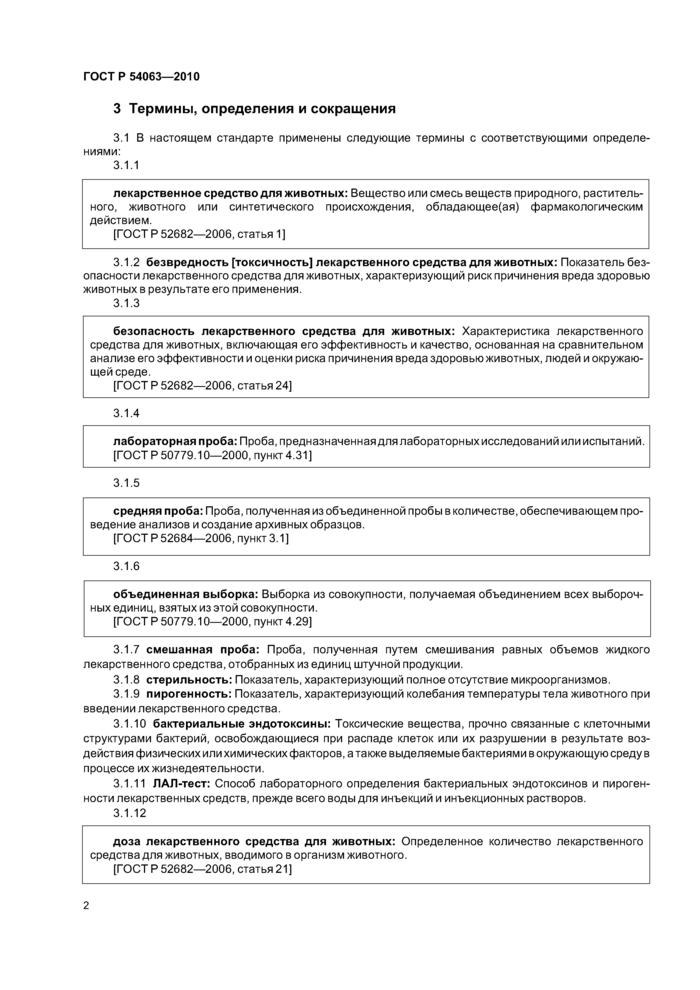
Для проведения анализа готовят растворы А—D по схеме, приведенной в таблице 2.
|
Таблица 2 — Схема эксперимента «Мешающие факторы» | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Опыт проводят по 13.2.
13.5.2 Результаты и интерпретация
Результаты эксперимента считаются достоверными, если для раствора D получены отрицательные результаты во всех повторностях; для растворов С (контроль чувствительности ЛАП-реактива) среднегеометрическое значение концентрации бактериальных эндотоксинов составляет от 0,5 до 2.0Я; для раствора А получены отрицательные результаты во всех повторностях.
По результатам, полученным для каждой из повторностей растворов В, рассчитывают среднегеометрическое значение чувствительности ЛАЛ-реактива.
Расчет проводят, как описано в 13.3. Если полученное среднее значение оказалось от 0,5 до 2,ОХ, испытуемое лекарственное средство в выбранном разведении не содержит мешающих факторов, способных ингибировать и (или) усиливать реакцию ЛАЛ-реактива с бактериальными эндотоксинами, и может быть подвергнуто анализу на содержание бактериальных эндотоксинов.
Если присутствие мешающих факторов обнаружено для испытуемого лекарственного средства, которое проверялось в разведении, меньшем МДР, анализ повторяют в большем разведении, вплоть до разведения, равного МДР. В большинстве случаев дополнительное разведение испытуемого лекарственного средства способно снять действие мешающих факторов. Использование ЛАЛ-реактива большей чувствительности позволяет увеличить степень разведения.
Действие мешающих факторов может быть преодолено соответствующей обработкой, например фильтрацией, нейтрализацией, диализом или температурной обработкой. Выбранный способ удаления мешающих факторов не должен изменять концентрацию бактериальных эндотоксинов в испытуемом лекарственном средстве, поэтому КСЭ к раствору испытуемого лекарственного средства добавляют перед проведением такой обработки, после чего проводят анализ «Мешающие факторы». Если после обработки выбранным способом результаты анализа «Мешающие факторы» окажутся удовлетворительными, то испытуемое лекарственное средство может быть подвергнуто анализу на содержание бактериальных эндотоксинов.
Если испытуемое лекарственное средство нельзя освободить от мешающих факторов, оно не может быть исследовано на предмет содержания бактериальных эндотоксинов с помощью ЛАП-теста.
14 Качественный анализ (метод А)
Задачей этого анализа является подтверждение того, что содержание бактериальных эндотоксинов в испытуемом образце не превышает значения предельного содержания бактериальных эндотоксинов, указанного в конкретном нормативном документе.
Анализ проводят с лекарственным средством в одном разведении, в котором был проведен анализ «Мешающие факторы», или в большем разведении, но не превышающем значения МДР.
14.1 Проведение анализа
Для проведения анализа готовят растворы А—D по схеме, приведенной в таблице 3.
|
Таблица 3 — Схема эксперимента «Качественный анализ» | ||||||||||||||||||||
|
Раствор А — испытуемое лекарственное средство в разведении, в котором отсутствуют мешающие факторы, или в большем разведении, не превышающем МДР.
Раствор В — испытуемое лекарственное средство в выбранном разведении, к которому добавлен КСЭ. Конечная концентрация эндотоксина в анализируемом растворе должна составлять 2Х (положительный контроль испытуемого лекарственного средства).
Раствор С — раствор КСЭ в воде для ЛАП-теста с конечной концентрацией 2Х. (положительный контроль).
Раствор D — вода для ЛАП-теста (отрицательный контроль).
Анализ проводят, какописано в 13.2.
14.2 Результаты и интерпретация
Анализ считают достоверным, если для раствора D (отрицательный контроль) получены отрицательные результаты в обеих повторностях; для раствора С (положительный контроль) во всех повторностях получены положительные результаты; для раствора В (положительный контроль испытуемого образца) в обеих повторностях получены положительные результаты.
ГОСТ Р 54063-2010
Если для раствора А в обеих повторностях получены отрицательные результаты, лекарственное средство считают выдержавшим испытания.
Если для испытуемого лекарственного средства в разведении, меньшем МДР, в обеих повторностях получены положительные результаты, анализ следует повторить в разведении, равном МДР.
Если для испытуемого лекарственного средства в разведении, равном МДР, в обеих повторностях получены положительные результаты, то лекарственное средство не соответствует требованиям нормативного документа, нормирующего содержание бактериальных эндотоксинов.
Если положительный результат получен в одной из повторностей для раствора А, то проводят повторный анализ. Лекарственное средство считают выдержавшим испытания, если в повторном анализе для обеих повторностей получены отрицательные результаты.
15 Количественный анализ (метод В)
Задачей анализа является определение содержания бактериальных эндотоксинов в используемом лекарственном средстве. Для этого используют серию последовательных разведений испытуемого лекарственного средства, начиная с того разведения, для которого был проведен анализ «Мешающие факторы», или большего, но не превышающего МДР.
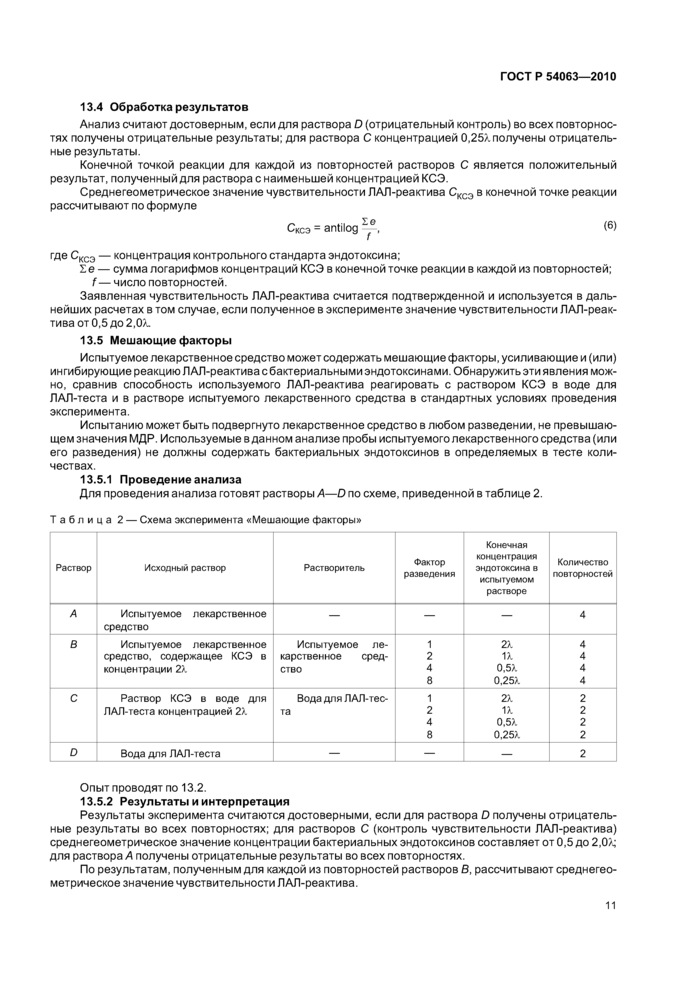
15.1 Проведение анализа
Для проведения анализа готовят растворы А—D по схеме, приведенной в таблице 4.
|
Таблица 4 — Схема эксперимента «Количественный анализ» | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
15.2 Результаты и интерпретация
Анализ считают достоверным, если для раствора D (отрицательный контроль) получены отрицательные результаты в обеих повторностях; для растворов С (контроль чувствительности ЛАЛ-реактива) среднегеометрическое значение концентрации бактериальных эндотоксинов составляет не менее 0,5Я, и не более 2Х, для раствора В (положительный контроль испытуемого образца) получены положительные результаты в обеих повторностях; для растворов А конечной точкой реакции является положительный результат, полученный для наибольшего разведения испытуемого лекарственного средства.
Значение произведения фактора этого разведения на величину чувствительности ЛАЛ-реактива (X) равно концентрации эндотоксина в растворе А, полученной для данной повторности. Среднегеометрическое значение концентрации эндотоксина рассчитывают, какописано в 13.4.
Если во всех повторностях серии растворов А получены отрицательные результаты, то концентрация бактериальных эндотоксинов в испытуемом лекарственном средстве менее чувствительности ЛАЛ-реактива, умноженной на наименьший фактор разведения.
13
Кроме приведенных методов, для определения содержания бактериальных эндотоксинов в испытуемом лекарственном средстве могут использоваться фотометрические методы (С, D, Е и F), описанные в Европейской фармакопее [3].
16 Турбидиметические методы (С и F)
Данные методы относятся к фотометрическим методам измерения увеличения степени мутности. В зависимости от принципа, положенного в основу проведения испытания, указанные методы классифицируют как турбидиметрический метод конечной точки либо турбидиметрический кинетический метод.
16.1 Турбидиметрический метод конечной точки (метод Е) основан на количественной зависимости концентрации эндотоксинов от степени мутности (поглощение или пропускание) реакционной смеси в конце инкубационного периода.
16.2 Турбидиметрический кинетический метод (метод С) основан на измерении времени, необходимого для достижения предварительно определенной величины поглощения, или степени мутности реакционной смеси.
Испытание проводят при температуре инкубации, рекомендованной производителем ЛАЛ-реакти-ва [обычно (37 + 1) °С].
17 Хромогенные методы (D и Е)
Данные методы используют для измерения количества хромофора, высвободившегося из соответствующего хромогенного пептида в результате реакции эндотоксинов с ЛАЛ-реактивом. В зависимости от принципа, положенного в основу испытания, этот метод классифицируют как хромогенный метод конечной точки или хромогенный кинетический метод.
17.1 Хромогенный метод конечной точки (метод Е) основан на количественной зависимости концентрации эндотоксинов от количества хромофора, высвободившегося к концу инкубационного периода.
17.2 В процессе испытания хромогенным кинетическим методом (метод D) измеряют время, необходимое для достижения предварительно определенной величины оптической плотности реакционной смеси или скорости окрашивания.
Испытание проводят при температуре инкубирования, рекомендованной производителем ЛАП-реактива [обычно (37 + 1) °С].
18 Предварительные испытания
Для проверки точности или валидации испытания турбидиметрическим методом либо хромогенным методом проводят предварительные испытания, позволяющие убедиться в надежности критериев для стандартной кривой и в том, что испытуемый раствор не является мешающим фактором для проведения испытания.
Валидация методики испытаний необходима, если в условия эксперимента внесены какие-либо изменения, которые могут повлиять на результаты испытания.
18.1 Проверка надежности критериев для стандартной кривой
Готовят не менее трех разведений раствора стандартного препарата эндотоксина для построения стандартной кривой. Проводят испытание, используя не менее трех параллельных рядов каждого разведения раствора стандартного препарата эндотоксина, в соответствии с рекомендациями производителя ЛАП-реактива (объемные соотношения, время инкубирования, температура, pH и т. п.).
Если при проведении испытания кинетическим методом необходимый интервал превышает 2 логарифма, включают дополнительные разведения стандартного препарата эндотоксина, для того чтобы разграничить каждое повышение логарифма на единицу в интервале значений стандартной кривой. Абсолютное значение коэффициента корреляции |г | должно быть выше или равно 0,980 для интервала концентраций эндотоксинов, указанных производителем лизата.
18.2 Испытание на наличие мешающих факторов
Выбирают значение концентрации эндотоксинов, лежащее в середине интервала значений стандартной кривой или близкое к этому значению.
Г отовят растворы А, В, С и D, как показано в таблице 5.
|
Таблица 5 — Схема эксперимента «Мешающие факторы» | ||||||||||||||||||||||||
| ||||||||||||||||||||||||
Проводят испытание не менее чем в двух параллельных пробах этих растворов в соответствии с рекомендациями производителя лизата (объем испытуемого раствора и раствора лизата, объемное соотношение испытуемого раствора и раствора лизата, время инкубирования и т. п.)
Вычисляют среднее значение количества добавленных эндотоксинов, вычитая среднюю концентрацию эндотоксинов в растворе (если они присутствуют) из средней концентрации эндотоксинов в растворе, содержащем добавленные эндотоксины.
Испытуемый раствор не содержит мешающих факторов, если в условиях проведения испытания измеренная концентрация эндотоксинов, прибавленных в испытуемый раствор, находится в интервале от 50 % до 200 % известной концентрации эндотоксинов после вычитания концентрации эндотоксинов, обнаруженных в растворе без добавленных эндотоксинов.
Если значение содержания эндотоксинов находится за пределами указанного интервала, мешающие факторы следует удалить, как описано в 13.5. Эффективность обработки контролируют посредством проведения повторного испытания на наличие мешающих факторов.
18.3 Проведение испытания
Испытания проводят в соответствии с методикой, описанной в 18.1.
19 Учет результатов
19.1 Концентрацию эндотоксинов в каждом из параллельных растворов Л рассчитывают, используя стандартную кривую, полученную для рядов положительных контролей (раствор С).
Испытание считают действительным, если выполнены следующие условия:
- результат, полученный для раствора D (отрицательный контроль), не превышает предельного контрольного значения, указанного в инструкции к используемому ЛАЛ-реактиву;
- результаты, полученные для параллельных рядов положительных контролей (раствор С), соответствуют требованиям, указанным для валидационных испытаний, как описано в 18.1, если содержание эндотоксинов, полученное после вычитания из концентрации эндотоксинов, обнаруженных в растворе В, концентрации эндотоксинов, обнаруженных в растворе А, находится в интервале от 50 % до 200 %.
19.2 Испытуемый образец соответствует требованиям испытания, если среднее значение концентрации эндотоксинов в параллельных пробах раствора А с учетом разведения и концентрации испытуемого раствора менее значения предельно допустимого содержания бактериальных эндотоксинов, установленного для испытуемого препарата.
15
20 Испытание на токсичность фармакологических лекарственных средств
Испытание токсичности фармакологических лекарственных средств проводят на здоровых белых мышах обоего пола массой 19—21 г, на которых ранее не проводили никаких испытаний.
За 24 ч до испытания и во время его проведения животные должны находиться в помещении с постоянной температурой. За 2 ч до взвешивания и отбора животных для проведения испытаний у них отбирают корм и воду.
Каждую серию лекарственного средства испытывают на пяти мышах. Растворитель (разбавитель), концентрацию раствора (тест-дозу) и способ введения указывают в нормативном документе на конкретное лекарственное средство.
Раствор препарата, подлежащего испытанию, подогревают до 37 °С и в объеме 0,5 см3 вводят в хвостовую вену со скоростью 0,1 см3/с, если нет других указаний в нормативном документе на конкретное лекарственное средство.
Если в нормативном документе на конкретное лекарственное средство предусмотрен иной путь введения препарата мышам, объем раствора, вводимого в брюшную полость, под кожу или желудок, может быть увеличен до 1 см3. Введение в желудок производят шприцем посредством инъекционной иглы, на конце которой имеется наплавленная олива, или при помощи другого приспособления, обеспечивающего поступление раствора или взвеси препарата в желудок.
21 Определение местного действия (реактогенности)
Препарат вводят методом и в дозе (концентрации), предлагаемой для использования в практике.
В случае, если препарат предполагают применять внутрикожно, подкожно или внутримышечно, оценку раздражающего действия осуществляют после однократного введения. В остальных случаях (при внутривенном, пероральном, введении в коньюнктивальный мешок) — после соответствующего числа аппликаций, которые предполагаются при его применении в практике. Количество животных в группе, дозы введения определяют в соответствии с нормативными документами на конкретное лекарственное средство.
Оценку местного действия осуществляют на основании данных осмотров, проводимых в течение срока введения лекарственного средства и последующих семи суток.
22 Определение стерильности
Стерильность (отсутствие живых микроорганизмов) инактивированных вакцин проверяют согласно ГОСТ 28085.
23 Определение микробиологической чистоты
Микробиологическую чистоту определяют в лекарственных средствах для животных, содержащих живые микроорганизмы, путем высева на элективные питательные среды, культуры клеток (для вирусных вакцин) или с использованием тест-систем, предназначенных для обнаружения ДНК посторонних бактерий, вирусов и микоплазм.
24 Учет результатов испытания
24.1 При определении безвредности биологических лекарственных средств наблюдение за животными проводят в течение срока, установленного в нормативных документах на конкретное лекарственное средство. В период проведения испытания ведут ежедневное наблюдение, отмечая отклонения от нормального поведения и клинического состояния животных.
24.2 Лекарственное средство считают выдержавшим испытание на безвредность, если в течение предусмотренного срока наблюдения не погибнет ни одно из подопытныхживотных или у вакцинированных животных не будет проявления клинических признаков болезни. (Вакцина против кокцидиоза кур).
В случае гибели одного или более животных или проявления у них клинических признаков болезни испытание повторяют на удвоенном количестве животных. Повторное испытание считается окончательным. В случае неудовлетворительных результатов повторного испытания лекарственное средство считают не выдержавшим испытание на безвредность и бракуют.
ГОСТ Р 54063-2010
24.3 При определении токсичности фармакологических лекарственных средств наблюдение за животными проводят, как правило, в течение 48 ч, если нет других указаний в нормативном документе на конкретное лекарственное средство.
24.4 Лекарственное средство считают выдержавшим испытание, если в течение предусмотренного срока наблюдения не погибнет ни одна из подопытных мышей.
В случае гибели одной мыши опыт повторяют на пяти мышах массой (20,0 + 0,5) г; в случае гибели при первоначальном испытании двух мышей повторное испытание проводят на 15 животных. Если при повторном испытании ни одна мышь не погибнет, т. е. суммарная гибель животных в двух опытах не превысит 10 %, лекарственное средство считают выдержавшим испытание. В противном случае лекарственное средство бракуют.
24.5 При определении бактериальных эндотоксинов лекарственное средство считают выдержавшим испытание, если определенное в эксперименте содержание бактериальных эндотоксинов менее значения предельного содержания бактериальных эндотоксинов, указанного в нормативном документе на конкретное лекарственное средство.
24.6 При проверке инактивированных вакцин на стерильность в посевах на питательные среды не должно быть роста микрофлоры.
24.7 При определении микробиологической чистоты лекарственного средства для животных и высеве проб на соответствующие питательные среды или культуры клеток (для вирусных вакцин) должен наблюдаться рост типичной культуры штамма (штаммов) бактерий или вирусов, из которых изготовлено испытуемое лекарственное средство, а посторонние бактерии, вирусы и микоплазмы должны отсутствовать.
17
Библиография
[1] Фармакологическая статья Вода дистиллированная для инъекций
42-26-20—2001
[2] Государственная фармакопея X Раствор натрия хлорида 0,9 %-ный изотонический
[3] Определение пирогенности. Европейская фармакопея, 6-е издание, 2007 г.
УДК 619:615.355:636.087.8:006.354 ОКС 11.220 Р31
39
Ключевые слова: средство лекарственное, безвредность, безопасность, лабораторная проба, средняя проба, стерильность, пирогенность, бактериальные эндотоксины, ЛАЛ-тест, методы определения, доза, способ введения, реактогенность, микробиологическая чистота, остаточная токсичность
Редактор Л.В. Коретникова Технический редактор В.Н. Прусакова Корректор В.И. Баренцева Компьютерная верстка И.А. Налейкиной
Сдано в набор 16.09.2011. Подписано в печать 04.10.2011. Формат 60 х 84Гарнитура Ариал. Уел. печ. л. 2,32. Уч.-изд. л. 1,90. Тираж 121 экз. Зак. 929.
ФГУП «СТАНДАРТИНФОРМ», 123995 Москва, Гранатный пер., 4. www.gostinfo.ru info@gostinfo.ru
Набрано во ФГУП «СТАНДАРТИНФОРМ» на ПЭВМ.
Отпечатано в филиале ФГУП «СТАНДАРТИНФОРМ» — тип. «Московский печатник», 117418 Москва, Нахимовский проспект, 31, к. 2.
ГОСТ P 54063—2010НАЦИОНАЛЬНЫЙ СТАНДАРТ РОССИЙСКОЙ ФЕДЕРАЦИИСРЕДСТВА ЛЕКАРСТВЕННЫЕ ДЛЯ ЖИВОТНЫХ Методы определения безвредности
СРЕДСТВА ЛЕКАРСТВЕННЫЕ ДЛЯ ЖИВОТНЫХ Методы определения безвредности
Medicine remedies for animals.
Methods of safety identification
Дата введения — 2012—01—01
1 Область применения
Настоящий стандарт распространяется на методы определения безвредности и токсичности лекарственных средств для животных и устанавливает дозы, способы введения лекарственного средства и виды испытаний.
2 Нормативные ссылки
В настоящем стандарте использованы нормативные ссылки на следующие стандарты:
ГОСТ Р ИСО 7864-2009 Иглы инъекционные однократного применения стерильные ГОСТ Р ИСО 7886-1-2009 Шприцы инъекционные однократного применения стерильные. Часть 1. Шприцы для ручного использования
ГОСТ Р 52684-2006 Средства лекарственные для животных. Правила приемки, методы отбора
проб
ГОСТ 6709-72 Вода дистиллированная. Технические условия
ГОСТ 8074-82 Микроскопы инструментальные. Типы, основные параметры и размеры. Технические требования.
ГОСТ 18300-97 Спиртэтиловый ректификованный технический. Технические условия ГОСТ 22280-76 Реактивы. Натрий лимоннокислый 5,5-водный. Технические условия ГОСТ 22967-90 Шприцы медицинские инъекционные многократного применения. Общие технические требования и методы испытаний
ГОСТ 25336-82 Посуда и оборудование лабораторные стеклянные. Типы, основные параметры и размеры
ГОСТ 25377-82 Иглы инъекционные многократного применения. Технические условия ГОСТ 28085-89 Препараты биологические. Метод бактериологического контроля стерильности ГОСТ 29230-91 (ИСО 835-4—81) Посуда лабораторная стеклянная. Пипетки градуированные. Часть 4. Пипетки выдувные
Примечание — При пользовании настоящим стандартом целесообразно проверить действие ссылочных стандартов в информационной системе общего пользования — на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет или по ежегодно издаваемому информационному указателю «Национальные стандарты», который опубликован по состоянию на 1 января текущего года, и по соответствующим ежемесячно издаваемым информационным указателям, опубликованным в текущем году. Если ссылочный стандарт заменен (изменен), то при пользовании настоящим стандартом следует руководствоваться заменяющим (измененным) стандартом. Если ссылочный стандарт отменен без замены, то положение, в котором дана ссылка на него, применяется в части, не затрагивающей эту ссылку.
Издание официальное
ГОСТ Р 54063-20103 Термины, определения и сокращения
3.1 В настоящем стандарте применены следующие термины с соответствующими определениями:
лекарственное средство для животных: Вещество или смесь веществ природного, растительного, животного или синтетического происхождения, обладающее(ая) фармакологическим действием.
[ГОСТ Р 52682-2006, статья 1]
3.1.1
3.1.2 безвредность [токсичность] лекарственного средства для животных: Показатель безопасности лекарственного средства для животных, характеризующий риск причинения вреда здоровью животных в результате его применения.
безопасность лекарственного средства для животных: Характеристика лекарственного средства для животных, включающая его эффективность и качество, основанная на сравнительном анализе его эффективности и оценки риска причинения вреда здоровью животных, людей и окружающей среде.
[ГОСТ Р 52682-2006, статья 24]
3.1.3
лабораторная проба: Проба, предназначенная для лабораторных исследований или испытаний. [ГОСТ Р 50779.10-2000, пункт 4.31]
3.1.4
средняя проба: Проба, полученная из объединенной пробы в количестве, обеспечивающем проведение анализов и создание архивных образцов.
[ГОСТ Р 52684-2006, пункт 3.1 ]
3.1.5
объединенная выборка: Выборка из совокупности, получаемая объединением всех выборочных единиц, взятых из этой совокупности.
[ГОСТ Р 50779.10-2000, пункт 4.29]
3.1.6
3.1.7 смешанная проба: Проба, полученная путем смешивания равных объемов жидкого лекарственного средства, отобранных из единиц штучной продукции.
3.1.8 стерильность: Показатель, характеризующий полное отсутствие микроорганизмов.
3.1.9 пирогенность: Показатель, характеризующий колебания температуры тела животного при введении лекарственного средства.
3.1.10 бактериальные эндотоксины: Токсические вещества, прочно связанные с клеточными структурами бактерий, освобождающиеся при распаде клеток или их разрушении в результате воздействия физических или химических факторов, а также выделяемые бактериями в окружающую среду в процессе их жизнедеятельности.
3.1.11 ЛАЛ-тест: Способ лабораторного определения бактериальных эндотоксинов и пироген-ности лекарственных средств, прежде всего воды для инъекций и инъекционных растворов.
доза лекарственного средства для животных: Определенное количество лекарственного средства для животных, вводимого в организм животного.
[ГОСТ Р 52682-2006, статья 21]
3.1.12
2
ГОСТ Р 54063-2010
3.1.13 вакцина бактерийная: Иммунобиологический препарат, содержащий живые или инактивированные бактерии и (или) продукты их жизнедеятельности.
3.2 В настоящем стандарте применено следующее сокращение:
СПФ — свободные от патогенного фактора.
4 Общие положения
Все лекарственные средства для животных подлежат проверке на безвредность и (или) токсичность. При этом в зависимости от назначения, дозы и способа введения показатели, характеризующие безвредность лекарственного средства, могут различаться.
В биологических лекарственных средствах, содержащих инактивированный вирус, определяют полноту инактивации на лабораторных животных или культурах клеток.
Полноту инактивации бактерийных вакцин определяют путем высева их на стерильность, а токсичность при испытании на животных. Испытанию на стерильность подлежат также все лекарственные средства для инъекций, глазные капли, мази, пленки и другие лекарственные средства, в отношении которых имеются соответствующие указания в нормативном документе на конкретное лекарственное средство.
Пирогенность и (или) содержание бактериальных эндотоксинов определяют в лекарственных средствах и растворах, предназначенных для инъекционного применения.
В фармакологических лекарственных средствах для животных, как правило, определяют токсичность на лабораторных животных и другие показатели, указанные выше, согласно назначению лекарственного средства.
5 Отбор проб
Для испытания безвредности (токсичности) лекарственного средства для животных отбор проб проводят по ГОСТ Р 52684.
6 Материалы и животные
Центрифуга лабораторная любой марки.
Термостат любой марки.
Холодильник бытовой.
Овоскоп.
Микроскоп биологический по ГОСТ 8074.
Пипетки мерные вместимостью от 1 до 10 см3 поГОСТ 29230.
Шприцы вместимостью от 1 до 5 см3 по ГОСТ 22967 и ГОСТ 24861.
Иглы инъекционные по ГОСТ 25377 и ГОСТ Р ИСО 7864.
Иглы с наплавленной оливой диаметром 1 мм.
Флаконы стеклянные разной вместимости.
Пробирки стеклянные по ГОСТ 25336.
Пробки резиновые или ватно-марлевые.
Пипетки глазные.
Зонд желудоч н ы й.
Вода дистиллированная по ГОСТ 6709.
Вода для инъекций [1].
Спирт этиловый ректификованный по ГОСТ 18300.
Раствор натрия хлорида 0,9 %-ный изотонический [2].
Натрий лимоннокислый 3-замещенный по ГОСТ 22280.
Поддерживающая среда: 0,5 %-ный гидролизат лактальбумина на солевом растворе Эрла по Джонсону с 5 % инактивированной сыворотки крупного рогатого скота.
1 %-ная и 5 %-ная суспензии куриных эритроцитов.
Первичная культура клеток куриных фибробластов.
Перевиваемая культура VERO (метапневмовируса птиц).
Петухи-доноры старше 6 мес.
Эмбрионы уток 10—12-суточного возраста.
Эмбрионы СПФ кур 10—12-суточного возраста.
з
Цыплята.
СПФ цыплята.
Мыши белые.
Крысы белые.
Свинки морские.
Кролики.
Поросята.
Подсвинки.
Норки.
Щенки собак.
Нутрии.
Овцы.
Тхорзофретки.
Телята.
7 Подготовка к испытанию
7.1 Для проведения испытания на безвредность жидких форм лекарственных средств из средней пробы отбирают необходимое количество упаковочных единиц (ампул, флаконов и т. д.) и готовят смешанную пробу, отбирая из них равные по объему количества лекарственного средства и перенося их в стерильный флакон (пробирку). Из смешанной пробы отбирают лабораторную пробу, которую используют для проведения испытаний на безвредность. Перед введением животным содержимое тщательно перемешивают.
7.2 Лиофилизированные формы лекарственных средств предварительно ресуспензируют в стерильном растворителе (разбавителе) согласно нормативному документу на конкретное лекарственное средство. Лабораторную пробу готовят, как указано в 7.1.
7.3 Подготовка животных
7.3.1 Животных, используемых для испытания безвредности лекарственных средств, берут только из благополучных по инфекционным болезням пунктов выращивания.
7.3.2 Для проверки на безвредность формируют опытные и контрольные группы клинически здоровых животных, прошедших карантин. В случае необходимости, оговоренной в нормативном документе на конкретное лекарственное средство, животных проверяют на наличие специфических антител.
Вид, пол, масса, возраст и количество животных, используемых для испытания, должны быть указаны в нормативном документе на конкретное лекарственное средство.
7.3.3 Животных следует содержать на постоянном сбалансированном рационе кормления, определяемом для каждого конкретного вида и возраста животного.
7.3.4 Все животные, не менее чем за сутки до проверки, должны находиться в помещении для испытания.
7.3.5 Животных используют в опыте один раз, повторное использование животных не допускается. Не допускается проверять безвредность лекарственного средства на животных, ранее использованных для проверки по другим показателям.
8 Способы введения лекарственного средства
При испытании лекарственного средства на безвредность применяют следующие способы введения:
а) внутримышечный — тест-дозу лекарственного средства вводят в мышцу бедра (внутреннюю или наружную часть) животного или среднюю треть шеи, или грудную мышцу птицы;
б) внутривенный — тест-дозу лекарственного средства вводят в одну из боковых вен хвоста мыши или в вену уха кролика, или доступную вену другого животного. Лекарственное средство перед введением подогревают до температуры 37 °С. Скорость введения должна быть 0,1 см3/с, если нет других указаний в нормативном документе на испытуемое лекарственное средство;
в) внутрибрюшинный — тест-дозу лекарственного средства вводят в брюшную полость;
г) подкожный — тест-дозу лекарственного средства вводят под кожу животного, как правило, в области спины (допускается в область шеи, бедра);
д) пероральный — тест-дозу лекарственного средства вводят внутрижелудочно через рот животного с помощью шприца и иглы с наплавленной оливой или резиновым зондом натощак или препарат
4
ГОСТ Р 54063-2010
вводят с кормом или выпаивают, следя при этом, чтобы все порции корма были съедены или вся жидкость выпита. Поить и кормить животных и птицу после введения лекарственного средства следует не ранее чем через 2—3 ч;
е) наружный:
1) трансдермальный — лекарственное средство в определенных дозах и концентрациях наносят на выстриженный или выбритый участок кожи животного (таким способом могут наноситься кремы и пластыри);
2) в растворе лекарственного средства определенных концентрации и объема проводят купание животных с заданной экспозицией (по времени);
3) нанесение лекарственного средства на слизистые оболочки путем введения его в конъюкти-вальный мешок глаза животного интраназально или другим способом, предусмотренным нормативным документом на конкретное лекарственное средство;
ж) интрацеребральный — лекарственное средство вводят непосредственно в головной мозг животного;
з) внутрикожный — лекарственное средство вводят в глубокие слои кожи;
и) интратекальный — лекарственное средство вводят в окружающее спинной мозг пространство, чтобы обеспечить его поступление непосредственно в центральную нервную систему;
к) внутризобный — лекарственное средство вводят птице в зоб.
9 Дозы лекарственного средства, используемые при испытании безвредности
9.1 Испытания безвредности живых вирусных вакцин на животных при внутримышечном введении проводят, как правило, в 10-кратной дозе, а инактивированных — в двух-четырехкратной дозе, если другое не оговорено в нормативном документе на конкретное лекарственное средство.
Бактериальные вакцины вводят, как правило, в двукратной дозе.
Объем вводимого лекарственного средства перорально: для мыши — 0,5—1,0 см3, морской свинки — 1,0—10 см3, кролика — 3 см3.
При интрацеребральном способе введения доза лекарственного средства для белой мыши составляет 0,03 см3.
При внутривенном способе введения доза лекарственного средства составляет для мыши — 0,5 см3, для кролика — 1 см3.
9.2 Дозы лекарственного средства, наносимые на кожные покровы, слизистые оболочки при определении аллергизирующего действия, приводят в нормативном документе на конкретное лекарственное средство.
9.3 При внутризобном введении ооцисты вводят непосредственно в зоб через шприц с канюлей в количестве пяти доз цыплятам пятисуточного возраста.
9.4 При испытании реактогенности лекарственное средство вводят в терапевтической дозе, рекомендованной инструкцией по применению.
9.5 Наблюдение за животными ведут в течение 5—12 сут.
10 Определение полноты инактивации (остаточной токсичностии вирулентности) вакцин на лабораторных животных или культуре клеток
Полноту инактивации (остаточную токсичность и вирулентность) проверяют в лекарственных средствах, содержащих инактивированный возбудитель. Для вирусвакцин, предназначенных для использования в птицеводстве, испытания проводят на эмбрионах кур, уток и культуре клеток куриных фибробластов, антирабические вакцины проверяют на белых мышах.
Полнота инактивации в бактерийных вакцинах характеризуется показателем стерильности, определяемой по ГОСТ 28085, и безвредности для экспериментально-биологических моделей (мышей).
В зависимости от типа возбудителя болезней у птицы проводят следующие испытания:
- При определении содержания живых орто- и парамиксовирусов (ньюкаслская болезнь, грипп птиц) вакцину вводят в аллантоисную полость куриных эмбрионов и исследуют экстраэмбриональную жидкость (ЭЭЖ) от зараженных куриных и утиных эмбрионов в капельной реакции агглютинации (РГА) с 5 %-ной суспензией эритроцитов петуха. При положительной РГА проводят повторный пассаж на удвоенном количестве эмбрионов. При подтверждении положительного результата РГА серию лекарственного средства бракуют.
5
- При определении содержания живого коронавируса (инфекционный бронхит кур) проводят два последовательных пассажа вакцины на эмбрионах кур путем заражения их в аллантоисную оболочку. По окончании срока инкубации эмбрионы асептически вскрывают и учитывают патологоанатомические изменения (отставание в росте, «карликовость», свертывание эмбриона в шар).
При обнаружении характерных изменений у эмбрионов первого пассажа проводят повторный пассаж вакцины на удвоенном количестве эмбрионов. Если изменения у эмбрионов обнаруживаются вновь, серию лекарственного средства бракуют.
- При определении содержания бирнавиридов (инфекционная бурсальная болезнь) проводят два последовательных пассажа на эмбрионах СПФ кур путем их заражения на хориоаллантоисную оболочку в области искусственной пуги путем внесения вакцины через искусственную воздушную камеру. По окончании срока инкубации оставшиеся живыми эмбрионы вскрывают, учитывая поражения (отечность головы и подчелюстного пространства, кровоизлияния в мышцах, изменения печени, отставание в росте). Объединенную пробу от эмбрионов первого пассажа используют для проведения второго заключительного пассажа, который выполняется аналогично.
- При определении содержания живого вируса ССЯ-76 проводят два последовательных пассажа вакцины на эмбрионах уток с последующей постановкой РГА. Экстраэмбриональную жидкость, собранную отдельно от каждого эмбриона второго пассажа, проверяют на гемагглютинирующую активность в капельной реакции РГА с 5 %-ной суспензией эритроцитов петуха. При положительной РГА проводят повторный пассаж на удвоенном количестве эмбрионов. При подтверждении положительного результата РГА серию лекарственного средства бракуют.
- При определении метапневмовирусов проводят три последовательных пассажа на первичной культуре клеток куриных фибробластов (REO) или VERO. Если после второго пассажа на культуре клеток куриных фибробластов присутствует цитопатогенное действие, характерное для реовируса или метапневмовируса птиц, серию лекарственного средства бракуют.
- При испытании на наличие активного вируса в антирабических вакцинах вакцину вводят мышам в мозг. Наблюдение за животными проводят в течение 21 сут. Вирус бешенства в вакцине считают инактивированным, если мыши остаются живыми. При заболевании хотя бы одной мыши с клиническими признаками бешенства серию вакцины бракуют. Мозг погибших мышей исследуют методом иммунофлуоресценции. В мазках из мозга мышей вирус бешенства обнаруживаться не должен.
11 Определение аллергизирующего действия лекарственного средства
Аллергизирующее анафилактическое действие лекарственного средства определяется путем сенсибилизации морских свинок.
Для сенсибилизации морских свинок (масса 200—250 г) могут быть использованы разные схемы введения лекарственного средства. В случаях, когда курс вакцинации предусматривает несколько введений, целесообразно применять следующую схему: первая инъекция подкожно, две последующие (с интервалом 1 сут) внутримышечно. Если вакцинация предусматривает введение лекарственного средства однократно, допускается однократная сенсибилизация. Число животных в группе должно быть не менее десяти. Разрешающую инъекцию выполняют внутривенно или внутрисердечно через две — три недели или в более отдаленный срок (в зависимости от свойств лекарственного средства). В случае, если препарат является сорбированным, для разрешающей инъекции следует использовать также и несорбированный полуфабрикат. Сенсибилизирующая и разрешающая дозы испытуемого лекарственного средства должны быть приближены к рекомендуемым для практического применения, при этом разрешающая доза не должна быть меньше сенсибилизирующей. Окончательную величину дозировок устанавливают экспериментальным путем.
После разрешающей инъекции наблюдение за животными ведут в продолжение 30 мин. Чаще всего шок проявляется в течение нескольких минут, его тяжесть оценивают по следующей шкале:
А/+/ — редкое почесывание лапами морды, взъерошивание шерсти, понижение температуры более чем на 1 °С;
Б/++/ — частое почесывание лапами морды, возможно периодическое чихание, понижение температуры;
В/+++/ — спастический кашлевый синдром, возможное падение на бок, мочеиспускание, дефекация;
ГI++++I — конвульсивные судороги, резкое нарушение дыхания, гибель животного в течение первых 5—7 мин;
Д — реакция отсутствует.
6
Индекс синдрома в группе (И) вычисляют по формуле Веигла (1960)
1^1 _ А-1 + Б-2 + В-3 + Г-4 А+Б + В + Г + Д
где А, Б, В, Г, Д — число животных с данной выраженностью синдрома;
1,2, 3,4 — цифровая индикация, которая вводится для исчисления тяжести реакции по группе в целом.
Изучаемые лекарственные средства (за исключением гетерологичных сывороток) не должны вызвать развития смертельного шока.
Выраженность анафилаксии после внутривенного или внутрисердечного введения разрешающей дозы препарата должна соотноситься с результатами, зафиксированными в группе морских свинок, подготовленных к шоку, чаще всего сенсибилизацией нормальной гетерологичной сывороткой (положительный контроль). 100 %-ная гибель животных в данной группе обычно наступает в результате предварительного подкожного введения 0,1 см3 лошадиной сыворотки, за две — три недели до разрешающей дозы 0,1—0,5 см3. Если сыворотка лиофилизирована, для сенсибилизации применяют 2,5—3,0 мг на 100 г массы тела животного (разрешающая доза 14—16 мг на 100 г массы). В тех случаях, когда при производстве лекарственного средства применяют гетерологичный белок, его используют при постановке положительного контроля.
Одновременно разрешающую дозу испытуемого лекарственного средства вводятживотным, которым вместо сенсибилизирующих инъекции препарата был введен соответствующий объем 0,9 %-ного изотонического раствора натрия хлорида (отрицательный контроль).
12 Определение пирогенности
Проверка на пирогенность предназначена для ограничения риска возникновения лихорадочного состояния (повышения температуры тела) после введения лекарственного средства.
Испытанию подлежат инъекционные лекарственные средства, предназначенные для внутривенного, внутримышечного, подкожного введения и введения в полости. При проведении исследований рекомендуется определить максимальную дозу, не вызывающую пирогенного эффекта.
Определение пирогенности проводят на здоровых кроликах обоего пола, не альбиносах, массой 2,0—3,5 кг, содержащихся на полноценном рационе. Каждый кролик должен содержаться в отдельной клетке в помещении с постоянной температурой. Колебания температуры не могут превышать ± 3 °С. При уборке клеток и взвешивании животных их оберегают от возбуждения (избегать шума и резких движений). В течение недели, предшествующей опыту, кролики не должны терять в массе. Взвешивание их проводят до дачи корма не менее трех раз через день. Животные, теряющие в массе, копыту непригодны. В течение трех суток перед испытанием у каждого подопытного кролика измеряют температуру. Измерения проводят ежедневно утром до дачи корма при помощи медицинского ртутного или электротермометра, позволяющего определить температуру сточностью до 0,1 “С.Датчиктермометра вводят в прямую кишку на глубину 7—9 см (в зависимости от массы кролика) за внутренний сфинктер на время, необходимое для достижения максимальной температуры. Исходная температура подопытных кроликов должна быть в пределах 38,5 °С—39,5 °С. Животные с более высокой или более низкой температурой для опыта непригодны. Кроме того, кроликов, впервые используемых для испытания лекарственных средств, проверяют на реактивность путем внутривенного введения 10 см3/кг 0,9 %-ного стерильного непирогенного раствора натрия хлорида, соответствующего требованиям фармакопейной статьи [2]. В случае изменения температуры у кроликов более чем на ± 0,4 °С животные считаются непригодными для опыта.
Не позднее чем за 18 ч до опыта кроликов переводят в помещение, в котором осуществляют испытание на пирогенность. Оно должно проводиться в отдельной комнате с постоянной температурой, не отличающейся от температуры помещения, в котором кролики постоянно содержались до опыта, более чем на + 2 °С, и с колебаниями во время испытания, не превышающими 2 °С, изолированной от шума, в спокойной обстановке. Вечером накануне опыта у животных убирают остаток корма. До и во время опыта животные корм не получают (воду дают без ограничения).
Вода для инъекций или другие применяемые растворители, а также шприцы и иглы должны быть стерильными и непирогенными. Испытуемые лекарственные средства должны быть стерильными. Их вводят кроликам в ушную вену. Другие пути введения указывают в частной статье на лекарственное средство. Для каждого кролика берут отдельную иглу. Растворы испытуемых лекарственных средств, подогретые до 37 °С (при отсутствии других указаний в частных статьях), вводят в количествах и растворителях, предусмотренных соответствующими частными статьями.
7
Для испытания на пирогенность воды для инъекций предварительно готовят из нее изотонический 0,9 %-ный раствор натрия хлорида. Натрия хлорид должен быть стерильным и непирогенным, что обеспечивается воздушным методом его стерилизации при температуре 180 °С или 200 °С в течение от 30 до 60 мин в зависимости от массы образца. Шприцы, иглы и необходимую стеклянную посуду стерилизуют этим же методом при температуре 180 °С в течение 60 мин. Количество вводимого изотонического 0,9 %-ного раствора натрия хлорида составляет 10 см3 на 1 кг массы кролика. Все количество раствора, предварительно нагретого до температуры 37 °С, вводят в течение 2 мин.
Испытуемый раствор проверяют на трех кроликах. Группа должна состоять из животных, близких по массе (отличающихся не более чем на 0,5 кг). Перед введением раствора у кролика дважды с интервалом 30 мин измеряют температуру. Различия в показателях температуры не должны превышать 0,2 °С. Если различия в температуре превышает 0,2 °С, кролик для испытания не используется. Результат последнего измерения принимают за исходную температуру. Раствор вводят не позднее чем через 15—30 мин после последнего измерения температуры.
Последующее измерение температуры при внутривенном введении испытуемого раствора проводят три раза с промежутками в один час. При других способах введения — пять раз с промежутками в один час, если в частной статье нет других указаний.
Воду для инъекций или раствор лекарственного средства считают непирогенными, если сумма повышений температуры у кроликов меньше или равна 1,4 °С. Если эта сумма превышает 2,2 °С, то воду для инъекций или раствор лекарственного средства считают пирогенными. В случаях, когда сумма повышений температуры у трех кроликов находится в пределах от 1,5 °С до 2,2 °С, испытание повторяют дополнительно на пяти кроликах. В этом случае воду для инъекций или раствор лекарственного средства считают непирогенными, если сумма повышений температуры у всех восьми кроликов не превышает 3,7 °С. Если же эта сумма равна 3,8 °С или больше, воду для инъекций или раствор лекарственного средства считают пирогенными.
В частной фармакопейной статье могут быть указаны другие пределы отклонения температуры.
Если в частной статье на лекарственное средство нет других указаний, случаи понижения температуры у кроликов принимают за ноль.
Кролики, бывшие в опыте, могут быть использованы для определения пирогенности повторно, но не ранее чем через трое суток, если введенный им до этого раствор лекарственного средства или вода для инъекций были непирогенными. Если же введенный раствор лекарственного средства или вода для инъекций оказались пирогенными, кролики могут быть использованы для дальнейших опытов через две недели. При повышении температуры у кроликов в подобных случаях на 1,2 °С и более они используются через три недели. Если исследуемые вещества обладают антигенными свойствами, то одних и тех же кроликов нельзя использовать для испытания повторно (если нет специальных указаний в частной статье).
Для испытания лекарственных средств для животных, введение которых требует предварительной подготовки или специальных условий введения, следует руководствоваться дополнительными указаниями, приведенными в нормативной документации на конкретное лекарственное средство.
13 Определение бактериальных эндотоксинов
Бактериальные эндотоксины определяют в инъекционных лекарственных средствах, предназначенных для парентерального и интратекального применения, и в субстанциях, используемых для их изготовления. Метод дает возможность проводить постадийный контроль содержания эндотоксинов в процессе производства инъекционных лекарственных средств.
Содержание бактериальныхэндотоксинов выражается в единицах эндотоксина (ЕЭ) Международного стандарта эндотоксина.
Определение содержания бактериальных эндотоксинов проводят с использованием реактива, представляющего собой лизат клеток крови (амебоцитов) мечехвоста Limulus polyphemus (ЛАЛ-реак-тив) или Tachypleus tridentatus (ТАЛ-реактив). В основе метода лежит способность амебоцитов мечехвоста специфически реагировать с эндотоксинами грамотрицательных бактерий (липополи-сахаридами, ЛПС).
В результате реакции с эндотоксином происходит помутнение прозрачной реакционной смеси и увеличение ее вязкости вплоть до формирования плотного геля, образование которого служит индикатором наличия в пробе бактериальныхэндотоксинов.
Проводимый таким образом анализ называется гель-тромб тест. Этот анализ позволяет количественно определить содержание бактериальных эндотоксинов в испытуемом препарате (количествен-
8