ФЕДЕРАЛЬНОЕ АГЕНТСТВО ПО ТЕХНИЧЕСКОМУ РЕГУЛИРОВАНИЮ И МЕТРОЛОГИИ
НАЦИОНАЛЬНЫЙ
СТАНДАРТ
РОССИЙСКОЙ
ФЕДЕРАЦИИ
СРЕДСТВА ЛЕКАРСТВЕННЫЕ ДЛЯ ЖИВОТНЫХУпаковка, маркировка, транспортирование и хранение
Издание официальное
Москва
Стандартинформ
2007
Предисловие
Цели и принципы стандартизации в Российской Федерации установлены Федеральным законом от 27 декабря 2002 г. № 184-ФЗ «О техническом регулировании», а правила применения национальных стандартов Российской Федерации — ГОСТ Р 1.0-2004 «Стандартизация в Российской Федерации. Основные положения»
Сведения о стандарте
1 РАЗРАБОТАН Федеральным государственным учреждением «Всероссийский государственный Центр качества и стандартизации лекарственных средств для животных и кормов» (ФГУ «ВГНКИ»)
2 ВНЕСЕН Техническим комитетом по стандартизации ТК 454 «Охрана жизни, здоровья животных и ветеринарно-санитарная безопасность продуктов животного происхождения и кормов»
3 УТВЕРЖДЕН И ВВЕДЕН В ДЕЙСТВИЕ Приказом Федерального агентства по техническому регулированию и метрологии от 27 декабря 2006 г. № 454-ст
4 ВВЕДЕН ВПЕРВЫЕ
Информация об изменениях к настоящему стандарту публикуется в ежегодно издаваемом информационном указателе «Национальные стандарты», а текст изменений и поправок — в ежемесячно издаваемых информационных указателях «Национальные стандарты». В случае пересмотра (замены) или отмены настоящего стандарта соответствующее уведомление будет опубликовано в ежемесячно издаваемом информационном указателе «Национальные стандарты». Соответствующая информация, уведомление и тексты размещаются также в информационной системе общего пользования — на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет
© Стандартинформ. 2007
Настоящий стандарт не может быть полностью или частично воспроизведен, тиражирован и распространен в качестве официального издания без разрешения Федерального агентства по техническому регулированию и метрологии
ГОСТ Р 52683-2006
Содержание
1 Область применения............................................1
2 Нормативные ссылки............................................1
3 Термины и определения..........................................2
4 Упаковка...................................................2
5 Маркировка.................................................4
6 Транспортирование.............................................7
7 Хранение..................................................7
Приложение А (рекомендуемое) Виды потребительской тары, укупорочные средства и методы
укупори ван ия.........................................8
Библиография................................................11
III
НАЦИОНАЛЬНЫЙ СТАНДАРТ РОССИЙСКОЙ ФЕДЕРАЦИИ
СРЕДСТВА ЛЕКАРСТВЕННЫЕ ДЛЯ ЖИВОТНЫХ Упаковка, маркировка, транспортирование и хранение
Medicine remedies for animals.
Packing, marking, transportation and storage
Дата введения — 2008—01—01
1 Область применения
Настоящий стандарт устанавливает общие требования к упаковке, маркировке, транспортированию и хранению лекарственных средств для животных (далее — лекарственные средства).
2 Нормативные ссылки
В настоящем стандарте использованы ссылки на следующие стандарты:
ГОСТ Р 51289-99 Ящики полимерные многооборотные. Общие технические условия ГОСТ Р 51720-2001 Мешки из полимерных пленок. Общие технические условия ГОСТ Р 52682-2006 Средства лекарственные для животных. Термины и определения ГОСТ 1341-97 Пергамент растительный. Технические условия ГОСТ 1760-86 Подпергамент. Технические условия
ГОСТ 2226-88 (ИСО 6590-1—83, ИСО 7023—83) Мешки бумажные. Технические условия ГОСТ 2228-81 Бумага мешочная. Технические условия
ГОСТ 2991-85 Ящики дощатые неразборные для грузов массой до 500 кг. Общие технические условия
ГОСТ 5037-97 Фляги металлические для молока и молочных продуктов. Технические условия ГОСТ 5541-2002 Средства укупорочные корковые. Общие технические условия ГОСТ 5556-81 Вата медицинская гигроскопическая. Технические условия ГОСТ 5959-80 Ящики из листовых древесных материалов неразборные для грузов массой до 200 кг. Общие технические условия
ГОСТ 6290-74 Бумага пачечная двухслойная для упаковывания папирос и сигарет. Технические условия
ГОСТ 6309-93 Нитки швейные хлопчатобумажные и синтетические. Технические условия
ГОСТ 7376-89 Картон гофрированный. Общие технические условия
ГОСТ 7625-86 Бумага этикеточная Технические условия
ГОСТ 7730-89 Пленка целлюлозная. Технические условия
ГОСТ 7933-89 Картон для потребительской тары. Общие технические условия
ГОСТ 8273-75 Бумага оберточная. Технические условия
ГОСТ 8828-89 Бумага-основа и бумага двухслойная водонепроницаемая упаковочная. Технические условия
ГОСТ 9094-89 Бумага для печати офсетная. Технические условия ГОСТ 9095-89 Бумага для печати типографская. Технические условия ГОСТ 9569-79 Бумага парафинированная. Технические условия
ГОСТ 10117.1-2001 Бутылки стеклянныедля пищевых жидкостей. Общие технические условия ГОСТ 10117.2-2001 Бутылки стеклянные для пищевых жидкостей. Типы, параметры и основные размеры
ГОСТ 10354-82 Пленка полиэтиленовая. Технические условия
ГОСТ 10700-97 Макулатура бумажная и картонная. Технические условия
Издание официальное
ГОСТ 10782-85 Бутылки стеклянные для крови, трансфузионных и инфузионных препаратов. Технические условия
ГОСТ 12301-81 Коробки из картона, бумаги и комбинированных материалов. Общие технические условия
ГОСТ 12303-80 Пачки из картона, бумаги и комбинированных материалов Общие технические условия
ГОСТ 12923-82 Алигнин медицинский. Технические условия
ГОСТ 13511-91 Ящики из гофрированного картона для пищевых продуктов, спичек, табачных изделий и моющих средств. Технические условия
ГОСТ 13512-91 Ящики из гофрированного картона для кондитерских изделий. Технические условия
ГОСТ 13513-86 Ящики из гофрированного картона для продукции мясной и молочной промышленности. Технические условия
ГОСТ 13516-86 Ящики из гофрированного картона для консервов, пресервов и пищевых жидкостей. Технические условия
ГОСТ 13841-95 Ящики из гофрированного картона для химической продукции. Технические
13950—91 Бочки стальные сварные и закатанные с гофрами на корпусе Технические усло-
условия ГОСТ
ВИЯ
ГОСТ 14192-96 Маркировка грузов
ГОСТ 14961-91 Нитки льняные и льняные с химическими волокнами. Технические условия ГОСТ 15150-69 Машины, приборы и другие технические изделия. Исполнения для различных климатических районов Категории, условия эксплуатации, хранения и транспортирования в части воздействия климатических факторов внешней среды
ГОСТ 15646-2002 Продукция, отправляемая в районы Крайнего Севера и приравненные к ним местности Упаковка, маркировка, транспортирование и хранение ГОСТ 16299-78 Упаковывание Термины и определения ГОСТ 16337-77 Полиэтилен высокого давления Технические условия ГОСТ 17308-88 Шпагаты. Технические условия ГОСТ 17527-2003 Упаковка. Термины и определения
ГОСТ 17811-78 Мешки полиэтиленовые для химической продукции. Технические условия
ГОСТ 18251-87 Лента клеевая на бумажной основе. Технические условия
ГОСТ 18510-87 Бумага писчая. Технические условия
ГОСТ 19360-74 Мешки-вкладыши пленочные. Общие технические условия.
ГОСТ 19433-88 Грузы опасные. Классификация и маркировка
ГОСТ 20435-75 Контейнер универсальный металлический закрытый номинальной массой брутто 3,0 т. Технические условия
ГОСТ 21444-75 Бумага мелованная. Технические условия
ГОСТ 25951-83 Пленка полиэтиленовая термоусадочная. Технические условия
Примечание — При пользовании настоящим стандартом целесообразно проверить действие ссылочных стандартов в информационной системе общего пользования — на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет или по ежегодно издаваемому информационному указателю «Национальные стандарты», который опубликован по состоянию на 1 января текущего года, и по соответствующим ежемесячно издаваемым информационным указателям, опубликованным в текущем году. Если ссылочный стандарт заменен (изменен), то при пользовании настоящим стандартом следует руководствоваться заменяющим (измененным) стандартом. Если ссылочный стандарт отменен без замены, то положение, в котором дана ссылка на него, применяется в части, не затрагивающей эту ссылку.
3 Термины и определения
В настоящем стандарте применены термины по ГОСТ Р 52682. ГОСТ 16299. ГОСТ 17527.
4 Упаковка
4.1 Потребительскую тару и укупорочные средства к ней следует выбирать в зависимости от свойств, назначения и количества лекарственного средства.
2
ГОСТ Р 52683-2006
4.2 Требования к упаковке конкретного лекарственного средства, упаковочным материалам, укупорочным средствам, методам и способам упаковывания устанавливают в документах на конкретную продукцию, утвержденных в установленном порядке, по которым она была произведена и может быть идентифицирована.
4.3 Материалы, применяемые для изготовления потребительской тары и укупорочных средств, должны обеспечивать сохранность продукции и должны быть разрешены к применению в установленном порядке.
4.4 Упаковку лекарственного средства в потребительскую тару проводят в количестве или объеме. предусмотренном документом на конкретное лекарственное средство
Пределы допускаемых отрицательных и положительных отклонений массы или объема лекарственного средства в одной упаковочной единице от номинального количества установлены в Государственной Фармакопее (1J и в документе, регламентирующем допустимые отклонения при промышленном фасовании лекарственных средств, утвержденном в установленном порядке
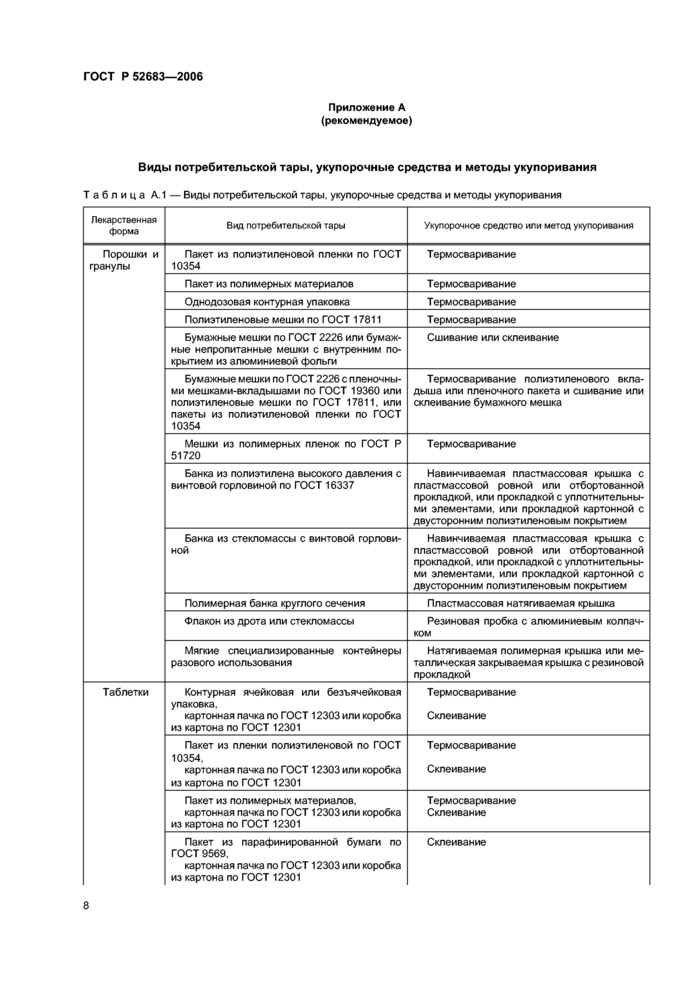
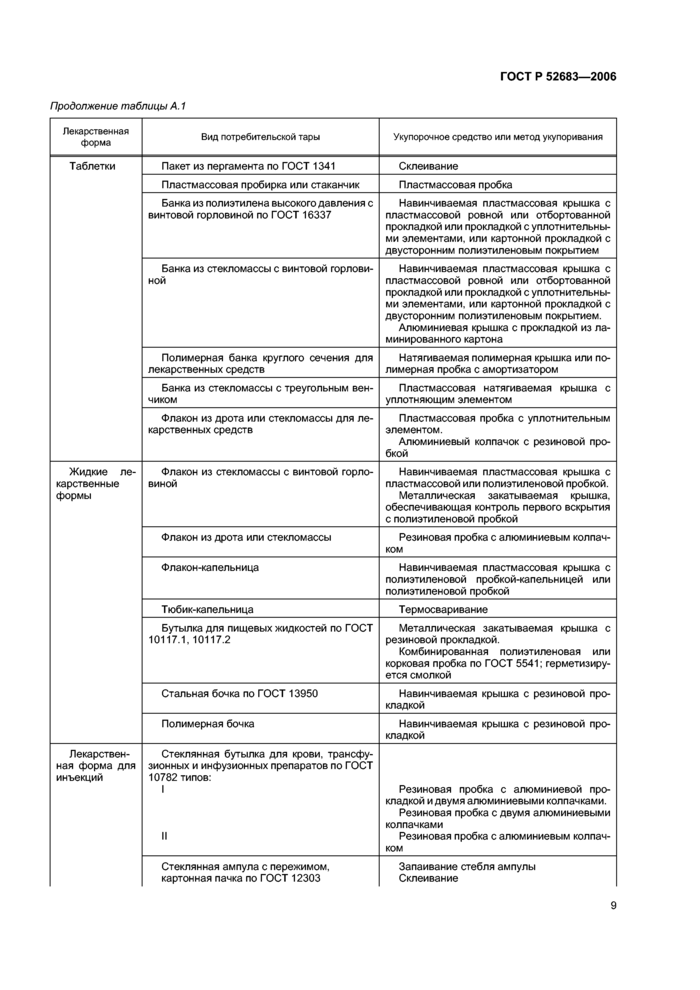
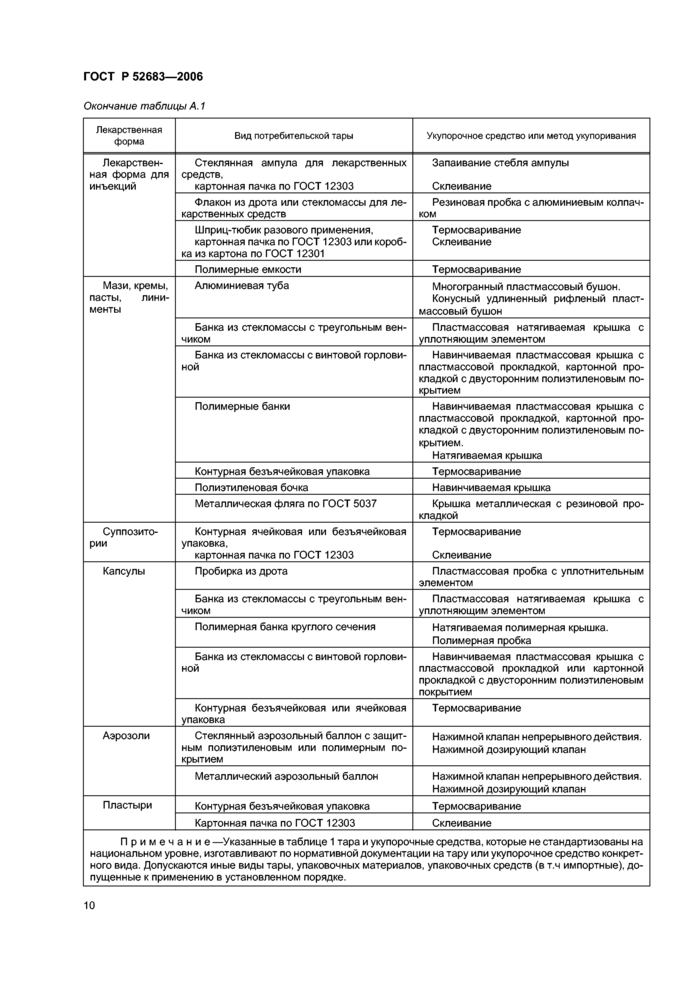
4.5 Рекомендуемые виды потребительской тары, укупорочные средства и методы укулоривания лекарственных средств приведены в приложении А.
4.6 Упаковка должна быть единой для каждой серии упаковываемых лекарственных средств.
4.7 Лекарственные средства, чувствительные к воздействию света, должны быть упакованы в светонепроницаемую тару.
4 8 Лекарственные средства, содержащие летучие, выветривающиеся, гигроскопические или окисляющиеся вещества, должны быть упакованы в банки или флаконы, укупоренные:
- навинчивающимися крышками в комплекте с пробками или прокладками с уплотнительными элементами;
- пробками с уплотнительными элементами;
- закатываемыми металлическими колпачками в комплекте с пробками или прокладками с уплотнительными элементами;
- закатываемыми металлическими крышками.
4.9 Каждое лекарственное средство, содержащее летучее вещество или обладающее запахом, должно быть упаковано отдельно от прочих лекарственных средств
4.10 При упаковывании таблеток, капсул в тару, не имеющую пробки с амортизаторами, следует укладывать уппотнители-амортизаторы.
Допускается применять медицинскую гигроскопическую вату по ГОСТ 5556 или чесальную вискозную ленту. Допускается упаковывание таблеток, драже и капсул без амортизаторов
4.11 Ампулы, флаконы, шприц-тюбики с лекарственными средствами для инъекций могут быть упакованы в контурную упаковку с последующей укладкой в картонную пачку или коробку
Допускается упаковывать ампулы в картонные коробки с перегородками или решетками из картона для потребительской тары марки хромэрзац по ГОСТ 7933. или гофрированным вкладышем из пачечной двухслойной бумаги по ГОСТ 6290.
При упаковывании ампул допускается применять в качестве амортизатора медицинский алигнин марки Б по ГОСТ 12923. при упаковывании ампул с хлорэтилом допускается применять медицинский алигнин марки А по ГОСТ 12923.
Допускается упаковывать лекарственные средства для инъекций в комплекте с растворителем в случаях, указанных в документе на лекарственное средство конкретного вида.
4.12 В каждую упаковку с ампулами должно быть вложено приспособление для вскрытия ампул.
4.13 Банки, пробирки, флаконы, бутылки из стекла или стекломассы, аэрозольные баллоны, алюминиевые тубы, контурные упаковки с лекарственными средствами следует упаковывать в картонные пачки.
Допускается упаковывать банки, пробирки, флаконы, бутылки из стекла или стекломассы, аэрозольные баллоны, алюминиевые тубы в картонные коробки с перегородками или решетками или в полиэтиленовую термоусадочную пленку типа В или М марки О или Т по ГОСТ 25951, без укладки в пачку. Допускается контурные упаковки укладывать в картонные коробки без укладки в пачку.
4.14 Швы полиэтиленовых мешков должны быть сварными, включая шов загрузочного отверстия Термосваривание должно обеспечивать герметичность упаковки. При визуальном осмотре наружная поверхность тары, применяемой для упаковывания, не должна быть загрязнена продукцией
4.15 Бумажные мешки должны быть зашиты машинным способом нитками по ГОСТ 14961 или ГОСТ 6309 или шпагатом по ГОСТ 17308. или другими хлопчатобумажными, льняными или синтетическими нитками, оставляя гребень по всей ширине мешка не менее 3 см.
Допускается склеивать открытые бумажные мешки клеевой лентой на бумажной основе по ГОСТ 18251.
3
4.16 Потребительская тара с лекарственными средствами должна быть упакована в групповую тару, в качестве которой используют картонные коробки или оберточную бумагу с прочностными показателями не ниже предусмотренных для оберточной бумаги марки В массой 1 м2от 50 до 70 г по ГОСТ 8273, или в полиэтиленовую термоусадочную пленку по ГОСТ 25951.
4.17 Групповая тара с лекарственными средствами должна быть склеена или обвязана.
Для склеивания групповой тары допускается применять:
- клеевую ленту на бумажной основе марки Б или В по ГОСТ 18251:
- полиэтиленовую ленту с липким слоем или гуммированную клеевую ленту;
- мелованную бумагу по ГОСТ 21444;
- оберточную бумагу марки А массой 1 м2 70 г по ГОСТ 8273 или другую по качеству не ниже указанной:
- мешочную бумагу марки М-70 по ГОСТ 2228;
- целлюлозную пленку по ГОСТ 7730 или другие виды лакированной целлюлозной пленки, технические характеристики которой должны быть не ниже указанных в ГОСТ 7730.
Требования, предъявляемые к склеиванию, должны быть указаны в документе на лекарственное средство конкретного вида, в соответствии с которым оно изготовлено.
Для обвязывания групповой тары следует применять материалы, обеспечивающие прочность упаковки При оклеивании групповой тары или обвязывании концы должны быть заклеены так. чтобы обеспечивать контроль вскрытия
Размеры групповой тары следует выбирать в соответствии с числом потребительских упаковочных единиц.
4.18 Каждая единица упаковки любого вида групповой тары должна быть снабжена этикеткой.
4.19 Лекарственные средства в потребительской или групповой таре при транспортировании упаковывают в транспортную тару — ящики из листовых древесн ых материалов по Г ОСТ 5959 или дощатые по ГОСТ 2991. или из полимерных материалов по ГОСТ Р 51289. или ящики из гофрированного картона поГОСТ 13511 — ГОСТ 13513. ГОСТ 13516. ГОСТ 13841. или другие виды транспортной тары, обеспечивающие сохранность лекарственных средств.
Допускается применение ящиков из гофрированного картона, бывших в употреблении, при отсутствии повреждений и после удаления маркировки, не относящейся к упаковываемым лекарственным средствам.
Допускается лекарственные средства, упакованные в групповую тару (коробки, термоусадочную пленку и т.д ), транспортировать без укладки в транспортную тару
При перевозке морским транспортом картонные коробки и пачки должны быть упакованы в полиэтиленовые пакеты с последующим термосвариванием
4.20 Внутренняя поверхность дощатых ящиков или ящиков из листовых древесных материалов должна быть выстлана оберточной бумагой марки Д массой 1м2 50 г по ГОСТ 8273 или растительным пергаментом марки Б по ГОСТ 1341, или подпергаментом марки П массой 1м2 53 г по ГОСТ 1760. или упаковочной бумагой марки В-80 массой 1 м2 220 г по ГОСТ 8828. или полиэтиленовой пленкой толщиной от 0,08 до 0.1 мм по ГОСТ 10354.
4.21 При упаковывании лекарственных средств свободное пространство в ящиках должно быть заполнено мягким уплотнительным материалом, исключающим их перемещение
В качестве уплотнительного материала допускается применять:
- медицинский алигнин по ГОСТ 12923;
- бумажную и картонную макулатуру по ГОСТ 10700;
- стружку из пористых эластичных полимерных материалов;
- оберточную бумагу по ГОСТ 8273;
- гофрированный картон по ГОСТ 7376.
4.22 Масса брутто одной единицы транспортной тары с лекарственным средством — не более
20 кг.
5 Маркировка
5.1 Маркировка потребительской тары с лекарственным средством должна быть единой для каждой серии упакованных лекарственных средств.
5.2 На каждую единицу потребительской тары с лекарственным средством (банку, флакон, тубу, пачку, коробку, пачку с ампулами и т. д ). на этикетку или непосредственно на поверхность тары любым способом должна быть нанесена четкая и легкочитаемая следующая информация:
4
ГОСТ Р 52683-2006
- наименование и адрес организации-производителя;
- товарный знак организации-производителя (при наличии);
- торговое название лекарственного средства и международное непатентованное название (если оно имеется или не совпадает с названием лекарственного средства);
- лекарственная форма;
- количество лекарственного средства в единице упаковки (в весовых, объемных или количественных единицах);
- концентрация или содержание действующего (действующих) вещества (веществ) (в весовых, объемных или относительных величинах);
- активность лекарственного средства [для биопрепаратов, антибиотиков (вединицах действия));
- номер государственной регистрации;
- номер серии и дата изготовления (месяц, год). Допускается номер серии и дату изготовления обозначать слитно. При этом последние четыре цифры в номере обозначают месяц и год изготовления лекарственного средства Цифры, предшествующие последним четырем, являются производственным номером серии;
- срок годности (месяц, год);
- условия хранения;
- надпись «Для животных»;
- способ применения;
- меры предосторожности при применении лекарственного средства:
- информация о подтверждении соответствия;
- обозначение документа, требованиям которого соответствует лекарственное средство для животных.
5.2.1 Если организация-производитель изготовляет лекарственное средство «балк-продукт». предназначенное для последующего фасования или изготовления лекарственных форм, в маркировке потребительской тары дополнительно указывают:
- наименование, адрес и товарный знак (при наличии) организации-производителя лекарственного средства «балк-продукт»;
- надпись «Упаковано».
Номер серии упакованного в потребительскую тару лекарственного средства присваивает организация-производитель. осуществившая фасование в потребительскую тару.
Дату изготовления и срок годности исчисляют от даты изготовления организацией-производите-лем лекарственного средства «балк-продукт».
5.2.2 Если организация-производитель осуществляет только упаковку лекарственных средств, на упаковке дополнительно указывают:
- наименование и адрес организации-производителя, осуществившей упаковку:
- надпись «Упаковано».
5.2.3 При изготовлении лекарственных средств «на заказ» дополнительно указывают наименование. адрес и товарный знак организации, по заказу которой произведено лекарственное средство.
5.3 Допускается на ампулах, а также тюбиках-капельницах, флаконах вместимостью не более 5 мл указывать только:
- наименование организации-производителя:
- торговое название лекарственного средства:
- его концентрацию или активность:
- объем или массу лекарственного средства;
- срок годности;
• номер серии.
5.4 В маркировке комплекта антибиотика с растворителем на пачке, коробке следует указывать номер серии антибиотика и номер серии растворителя, а также срок годности лекарственного средства, входящего в комплект, с наименьшим сроком годности.
5.5 В маркировке многодозовых стерильных лекарственных средств дополнительно указывают срок годности лекарственного средства после первого вскрытия упаковки
5.6 Предупредительные надписи («Капельно». «Перед употреблением взбалтывать» и т д .) в маркировке лекарственного средства необходимо указывать, если они оговорены в документе на лекарственное средство конкретного вида
5.7 Сыворотки поступают в обращение с указанием, из крови, плазмы крови, органов, тканей какого животного они получены, вакцины — с указанием питательной среды, использованной для размножения вирусов и бактерий.
5
5 8 В маркировку лекарственных средств, зарегистрированных как стерильные, включают надпись «Стерильно». Для инъекционных лекарственных средств следует указывать способ введения: «Внутривенно». «Внутримышечно». «Подкожно». «Внутримышечно и подкожно». Если инъекционное лекарственное средство может вводиться всеми способами, то указывают «Для инъекций».
5.9 Наркотические лекарственные средства должны иметь надпись «Наркотическое».
5.10 Психотропные лекарственные средства должны иметь надпись «Психотропное».
5.11 Сильнодействующие лекарственные средства должны иметь надпись «Сильнодействующее».
5.12 Гомеопатические лекарственные средства должны иметь надпись «Гомеопатическое».
5.13 В маркировку лекарственных средств, полученных из растительного сырья, включают надпись «Продукция прошла радиационный контроль».
5.14 Лекарственные средства, предназначенные для оценки их эффективности, имеют надпись «Для клинических исследований».
5.15 В маркировку лекарственных средств, полученных из генетически модифицированного сырья, включают одну из следующих надписей: «Генетически модифицированные». «На основе генетически модифицированных источников». «Содержат компоненты, полученные из генетически модифицированных источников».
5.16 В маркировку лекарственных средств, предназначенных исключительно для экспорта, включают надпись «Только для экспорта».
5.17 На упаковку лекарственных средств в потребительской таре наносят штриховой код международной системы нумерации EAN (при наличии)
Штриховой код наносят типографским способом на этикетку или непосредственно на потребительскую тару (пачку, пакет, тубу и т д ).
Допускается наносить штриховой код на отдельную этикетку, дополнительно наклеиваемую на потребительскую тару.
5.18 На этикетке групповой тары или непосредственно на поверхности групповой тары помимо данных, перечисленных в 5.2. помещают сведения о числе потребительских упаковок в единице групповой тары
5.19 Этикетки изготовляют из этикеточной бумаги марки А или В по ГОСТ 7625. или мелованной бумаги марки О по ГОСТ 21444. или офсетной бумаги № 1 или № 2 массой 1 м2 от 60 до 70 г марок А. Б. В по ГОСТ 9094. или писчей бумаги по ГОСТ 18510, или другой бумаги по качеству не ниже указанной Допускается применять этикетки с липкой основой.
5.20 Краска, применяемая для нанесения маркировки, должна быть водостойкой, не липкой, не стираемой
5.21 Оформление всех элементов упаковки одного лекарственного средства должно иметь единое шрифтовое, композиционное и цветовое решение Все тексты, помещаемые на этикетке, должны быть четкими, контрастными, легкочитаемыми.
5.22 Лекарственное средство, упакованное в потребительскую тару, должно быть снабжено инструкцией по применению.
В групповую тару вкладывают инструкцию по применению лекарственного средства в количестве, предусмотренном в документе на лекарственное средство конкретного вида.
Инструкция по применению лекарственного средства должна быть напечатана на типографской бумаге №1 или №2 массой 1 м2 40 г по ГОСТ 9095 или писчей бумаге №2 массой 1 м2 63 г по ГОСТ 18510. или офсетной бумаге № 1 или № 2 массой 60—70 г марок А. Б. В по ГОСТ 9094. или другой бумаге по качеству не ниже указанной.
Если размеры пачки, коробки допускают, то содержание инструкции по применению наносят на поверхность потребительской тары.
5.23 При упаковывании лекарственных средств в ящики или термоусадочную пленку в каждую единицу транспортной тары помещают упаковочный лист с указанием:
- наименования организации-производителя;
- торгового названия лекарственного средства;
- номера серии;
- числа упаковочных единиц в ящике;
- фамилии или номера упаковщика.
5.24 На этикетке транспортной тары или непосредственно на поверхности транспортной тары указывают:
- наименование и адрес организации-производителя;
- товарный знак организации-производителя (при наличии);
6
ГОСТ Р 52683-2006
- торговое название лекарственного средства;
- номер серии;
- срок годности;
• надпись «Для животных»;
- число упаковочных единиц в транспортной таре
5.25 Транспортная маркировка лекарственных средств должна соответствовать требованиям Г ОСТ 14192 с нанесением манипуляционных надписей и знаков опасности по ГОСТ 19433. которые указывают в документе на лекарственное средство конкретного вида.
5.26 Совмещение транспортной маркировки и маркировки с данными об упакованной продукции на одной стороне транспортной тары не допускается. Исключение составляет маркировка мешков, на которых маркировку, содержащую данные об упакованной продукции, наносят под транспортной маркировкой. Допускается наносить маркировку на середину бумажного мешка или на бумажные ярлыки согласно ГОСТ 14192 .
6 Транспортирование
6.1 Транспортируют лекарственные средства в закрытых транспортных средствах и контейнерах по ГОСТ 20435 всеми видами транспорта в соответствии с правилами перевозок, действующими на соответствующем виде транспорта, и дополнительными требованиями, указанными в документе на лекарственное средство конкретного вида
6.2 Транспортирование лекарственных средств в районы Крайнего Севера и приравненные к ним местности осуществляют в соответствии с требованиями ГОСТ 15846.
7 Хранение
7.1 Хранение лекарственных средств осуществляют с соблюдением условий, соответствующих группе Л ГОСТ 15150. и дополнительных требований, указанных в документе на лекарственное средство конкретного вида.
7.2 Хранение лекарственных средств, относящихся к спискам А и Б [2]. проводят в соответствии с правилами хранения, учета, отпуска и транспортирования ядовитых, наркотических и сильнодействующих лекарственных средств, утвержденными в установленном порядке.
7.3 Хранение взрывоопасных и легковоспламеняющихся лекарственных средств проводят в отдельном помещении в соответствии с установленными требованиями противопожарной безопасности
7.4 Хранят лекарственные средства в сухих, чистых и вентилируемых помещениях
7.5 Лекарственные средства в групповой или транспортной таре следует хранить на стеллажах или поддонах в штабелях, установленных на твердом основании, обеспечивающем равновесие
Допустимая высота штабеля — два-три яруса поддонов с тарой, установленной при условии сохранения устойчивого равновесия Между отдельными стеллажами и штабелями должны быть проходы. обеспечивающие свободное передвижение при укладывании упакованной продукции, отборе проб и других работах.
7 .6 Не допускается хранение лекарственных средствдля животных совместно с ядохимикатами
7.7 Срок годности и условия хранения устанавливает организация-производитель в документе на лекарственное средство конкретного вида
Температурный режим хранения допускается записывать с учетом нижнего и верхнего пределов или только верхнего предела
7