ГОСТ Р ИСО 14708-7-2016
Имплантаты для хирургии. Активные имплантируемые медицинские изделия. Часть 7. Частные требования к системам кохлеарной имплантации
Распространяется на активные имплантируемые медицинские изделия, предназначенные для лечения нарушений слуха посредством электростимуляции слуховых путей.
Идентичен ISO 14708-7:2013
Оглавление
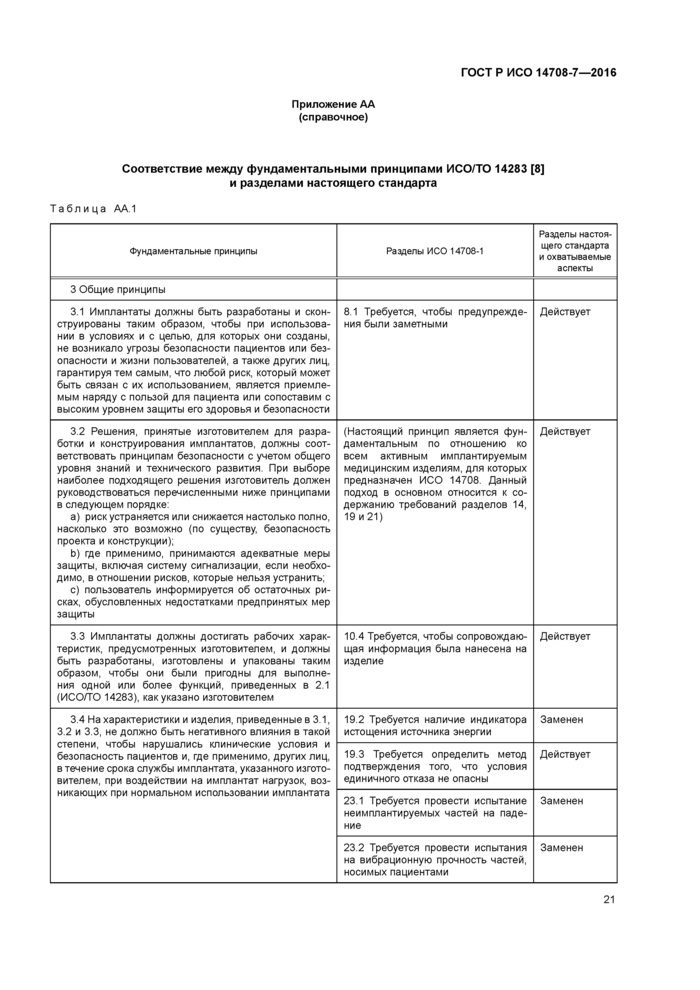
1 Область применения
2 Нормативные ссылки
3 Термины и определения
4 Обозначения и сокращения
5 Общие требования к неимплантируемым частям
6 Осмотр и измерение
7 Общие требования к упаковке
8 Общие требования к маркировке активных имплантируемых медицинских изделий
9 Маркировка на товарной упаковке
10 Конструкция товарной упаковки
11 Маркировка на стерильном пакете
12 Конструкция одноразовой упаковки
13 Маркировка активных имплантируемых медицинских изделий
14 Защита от непреднамеренных биологических воздействий, вызванных активным имплантируемым медицинским изделием
15 Защита пациента или пользователя от вреда, вызванного внешними физическими особенностями активного имплантируемого медицинского изделия
16 Защита пациента от вреда, вызванного электрическим током
17 Защита пациента от вреда, вызванного тепловыделениями
18 Защита от ионизирующего излучения, выделяемого или испускаемого активным имплантируемым медицинским изделием
19 Защита от непреднамеренных воздействий, вызванных изделием
20 Защита изделия от повреждений, вызванных применением наружных дефибрилляторов
21 Защита изделия от изменений, вызванных электрическими полями высокой энергии, воздействующими непосредственно на пациента
22 Защита активного имплантируемого медицинского изделия от изменений, вызванных применением других видов лечения
23 Защита активного имплантируемого медицинского изделия от воздействия механических сил. .
24 Защита активного имплантируемого медицинского изделия от повреждений, вызванных электростатическим разрядом
25 Защита активного имплантируемого медицинского изделия от повреждений, вызванных изменениями атмосферного давления
26 Защита активного имплантируемого медицинского изделия от повреждений, вызванных изменениями температуры
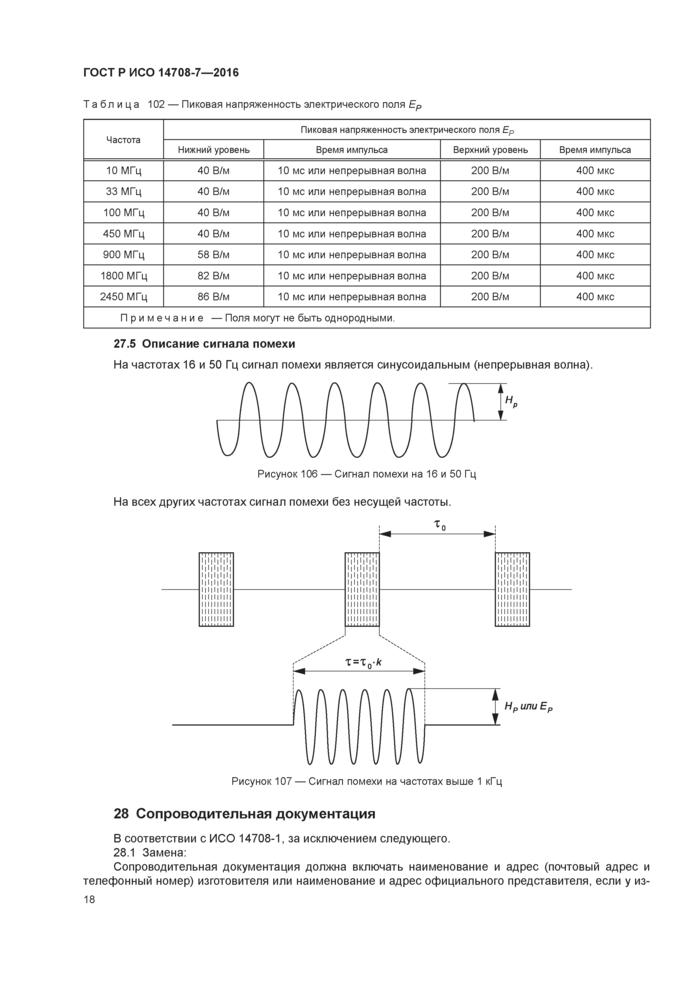
27 Защита активного имплантируемого медицинского изделия от электромагнитного неионизирующего излучения
28 Сопроводительная документация
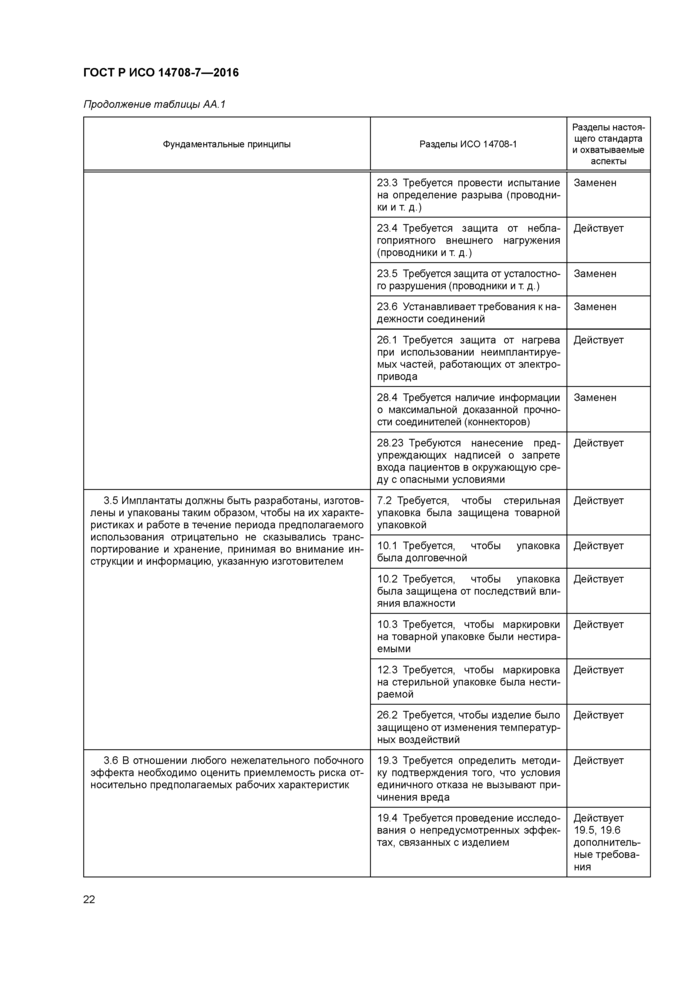
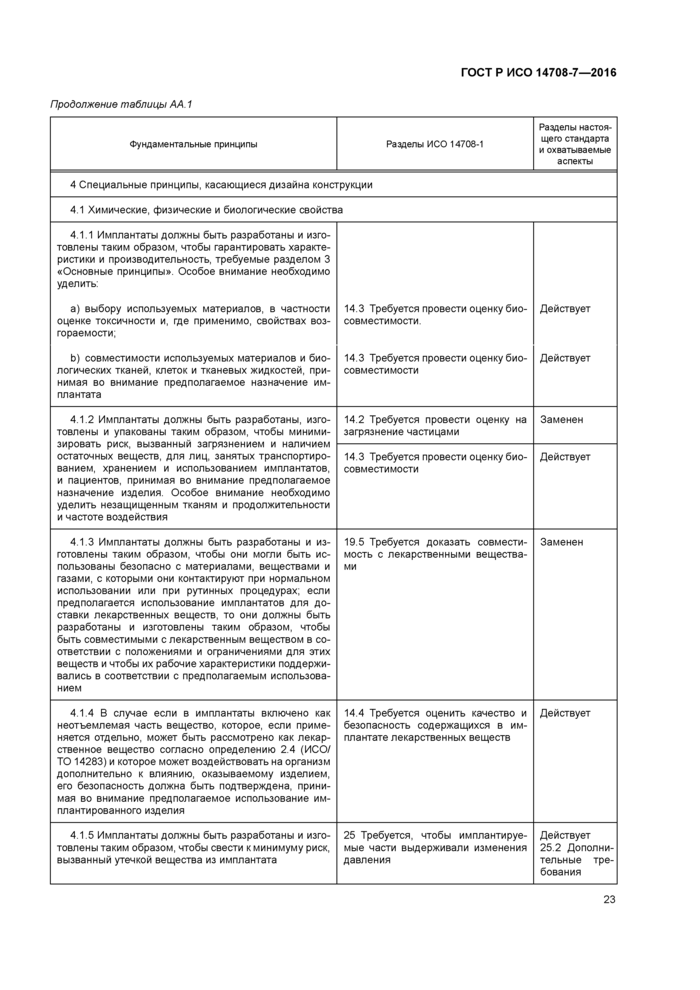
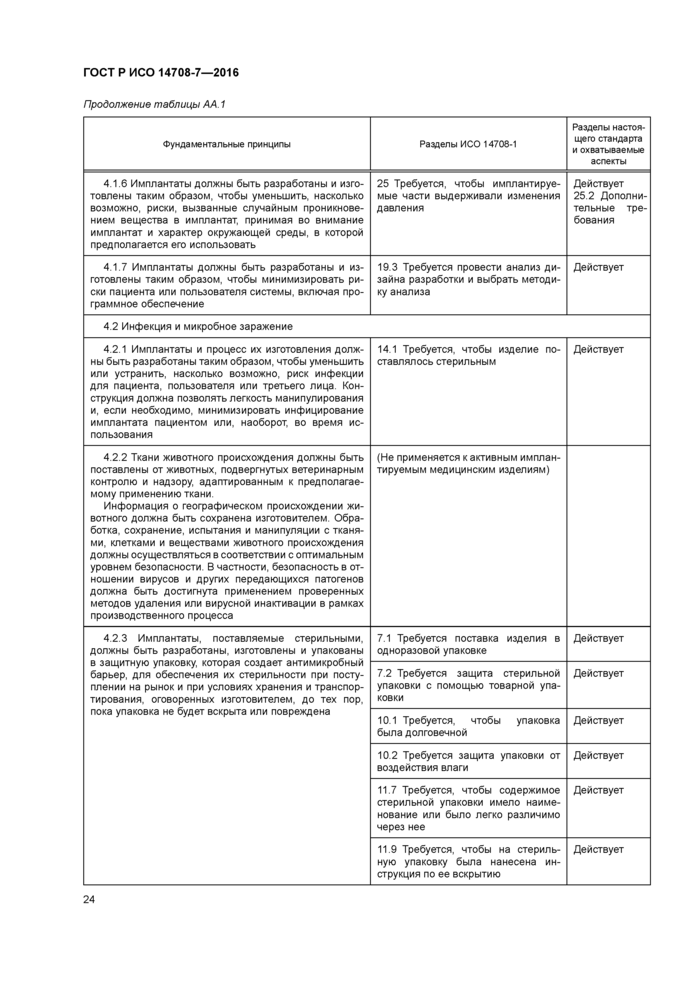
Приложение АА (справочное) Соответствие между фундаментальными принципами ИСО/ТО 14283 [8] и разделами настоящего стандарта
Приложение ВВ (справочное) Связь между разделами настоящего стандарта и основными принципами, перечисленными в приложении АА
Приложение СС (справочное) Примечания к ЕС 45502-2-3 (основание для настоящего стандарта)
Приложение DD (справочное) Примечания к теоретическому моделированию для определения соответствия разделу 27
Приложение ЕЕ (справочное) Примечания к измерениям электромагнитных помех для определения соответствия разделу 27
Приложение ДА (справочное) Сведения о соответствии ссылочных международных стандартов национальным и действующим в этом качестве межгосударственным стандартам
Библиография
58 страниц
| Дата введения | 01.10.2017 |
|---|---|
| Добавлен в базу | 01.02.2017 |
| Актуализация | 01.01.2021 |
Этот ГОСТ находится в:
- Раздел Экология
Организации:
| 21.10.2016 | Утвержден | Федеральное агентство по техническому регулированию и метрологии | 1489-ст |
|---|---|---|---|
| Разработан | ООО НТЦ МЕДИТЭКС | ||
| Издан | Стандартинформ | 2016 г. |
Implants for surgery. Active implantable medical devices. Part 7. Particular requirements for cochlear implant systems
ГОСТ 30630.1.9-2002Методы испытаний на стойкость к механическим внешним воздействующим факторам машин, приборов и других технических изделий. Испытания на воздействие случайной широкополосной вибрации с использованием цифровой системы управления испытаниями. Заменен на ГОСТ 30630.1.9-2015.- ГОСТ ISO 14971-2011 Изделия медицинские. Применение менеджмента риска к медицинским изделиям
- ГОСТ ISO 10993-1-2011 Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 1. Оценка и исследования
- ГОСТ Р ИСО 14708-1-2012 Имплантаты хирургические. Активные имплантируемые медицинские изделия. Часть 1. Общие требования к безопасности, маркировке и информации, предоставляемой изготовителем
- ГОСТ Р МЭК 60601-1-2-2014 Изделия медицинские электрические. Часть 1-2. Общие требования безопасности с учетом основных функциональных характеристик. Параллельный стандарт. Электромагнитная совместимость. Требования и испытания
- ГОСТ Р МЭК 62304-2013 Изделия медицинские. Программное обеспечение. Процессы жизненного цикла
- ГОСТ Р МЭК 60601-1-6-2014 Изделия медицинские электрические. Часть 1-6. Общие требования безопасности с учетом основных функциональных характеристик. Дополнительный стандарт. Эксплуатационная пригодность
- ГОСТ Р ИСО 14155-2014 Клинические исследования. Надлежащая клиническая практика
- Показать все
Чтобы бесплатно скачать этот документ в формате PDF, поддержите наш сайт и нажмите кнопку:

стр. 1

стр. 2

стр. 3

стр. 4

стр. 5

стр. 6

стр. 7

стр. 8

стр. 9

стр. 10

стр. 11

стр. 12

стр. 13

стр. 14
стр. 15

стр. 16
стр. 17

стр. 18

стр. 19

стр. 20
стр. 21
стр. 22

стр. 23

стр. 24
стр. 25
стр. 26
стр. 27
стр. 28
стр. 29
стр. 30
ФЕДЕРАЛЬНОЕ АГЕНТСТВО ПО ТЕХНИЧЕСКОМУ РЕГУЛИРОВАНИЮ И МЕТРОЛОГИИ
НАЦИОНАЛЬНЫЙ
СТАНДАРТ
РОССИЙСКОЙ
ФЕДЕРАЦИИ
ИМПЛАНТАТЫ ДЛЯ ХИРУРГИИАктивные имплантируемые медицинские изделия
Часть 7
Частные требования к системам кохлеарной имплантации
(ISO 14708-7:2013, ЮТ)
Издание официальное
Москва
Стандартинформ
2016
Предисловие
1 ПОДГОТОВЛЕН Обществом с ограниченной ответственностью «Научно-технический центр «МЕДИТЭКС» (ООО «НТЦ «МЕДИТЭКС») на основе собственного перевода на русский язык англоязычной версии стандарта, указанного в пункте 4
2 ВНЕСЕН Техническим комитетом по стандартизации ТК 011 «Медицинские приборы, аппараты и оборудование»
3 УТВЕРЖДЕН И ВВЕДЕН В ДЕЙСТВИЕ Приказом Федерального агентства по техническому регулированию и метрологии от 21 октября 2016 г № 1489-ст
4 Настоящий стандарт идентичен международному стандарту ИСО 14708-7:2013 «Имплантаты для хирургии. Активные имплантируемые медицинские изделия. Часть 7. Частные требования к системам кохлеарной имплантации» (ISO 14708-7:2013 «Implants for surgery— Active implantable medical devices — Pari 7: Particular requirements for cochlear implant systems». IDT).
При применении настоящего стандарта рекомендуется использовать вместо ссылочных международных стандартов соответствующие им национальные стандарты Российской Федерации и действующие в этом качестве межгосударственные стандарты, сведения о которых приведены в дополнительном приложении ДА
5 ВВЕДЕН ВПЕРВЫЕ
Правила применения настоящего стандарта установлены в статье 26 Федерального закона от 29 июня 2015 г. № 162-ФЗ «О стандартизации в Российской Федерации». Информация об изменениях к настоящему стандарту публикуется в ежегодном (по состоянию на 1 января текущего года) информационном указателе «Национальные стандарты», а официальный текст изменений и поправок — в ежемесячном информационном указателе «Национальные стандарты» В случае пересмотра (замены) или отмены настоящего документа соответствующее уведомление будет опубликовано в ближайшем выпуске информационного указателя «Национальные стандарты». Соответствующая информация, уведомление и тексты размещаются также в информационной системе общего пользования — на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет (www.gost.ru)
© Стандартинформ. 2016
Настоящий стандарт не может быть полностью или частично воспроизведен, тиражирован и распространен в качестве официального издания без разрешения Федерального агентства по техническому регулированию и метрологии
II
Соответствие должно быть подтверждено информацией, представленной изготовителем, в которой указано, что безопасность физических характеристик проверена соответствующими методами.
16 Защита пациента от вреда, вызванного электрическим током
161 Замена:
Электрические звуковые входные сигналы в НЕИМПЛАНТИРУЕМЫХ ЧАСТЯХ ИМПЛАНТИРУЕМОЙ СИСТЕМЫ должны соответствовать требованиям электробезопасности слухового аппарата согласно МЭК 60118-6 Другие электрические входы или выходы НЕИМПЛАНТИРУЕМЫХ ЧАСТЕЙ ИМПЛАНТИРУЕМОЙ СИСТЕМЫ, связывающие их с питающей электрической сетью или изделием, работающим от сети, не удовлетворяющие требованиям изоляции МЭК 60601-1. должны содержать разделительное устройство, которое соответствует применимым пунктам в части изоляции МЭК 60601-1 (разделительное устройство согласно определению МЭК 60601-1:2006. подраздел 16.5).
Примечание — Разделительное устройство не требуется, если одиночное изделие работает от батареи
Соответствие проверяется по МЭК 60601-1 (если применимо) путем анализа документации, предоставленной изготовителем.
16.2 Замена:
Имплантируемые части ИМПЛАНТИРУЕМОЙ СИСТЕМЫ в контакте с телом пациента должны быть электрически нейтральными, за исключением использования по целевому назначению. Во время использования изделия необходимо исключить в любом из проводящих путей утечку постоянного тока, превышающую 0.1 мкА.
Соответствие проверяют в ходе проверки испытательных процедур и на основе результатов, предоставленных изготовителем.
16.3 По ИСО 14708-1.
17 Защита пациента от вреда, вызванного тепловыделениями
17.1 По ИСО 14708-1.
17.2 Настоящий подпункт будет проработан в следующих изданиях.
18 Защита от ионизирующего излучения, выделяемого или испускаемогоактивным имплантируемым медицинским изделием
18.1 По ИСО 14708-1.
18 2 По ИСО 14708-1.
18.3 По ИСО 14708-1.
19 Защита от непреднамеренных воздействий, вызванных изделием
Примечание — См также 2820
191 По ИСО 14708-1.
19.2 Замена:
Если имплантируемая часть ИМПЛАНТИРУЕМОЙ СИСТЕМЫ включает в себя батарею, изготовитель должен предусмотреть индикатор, который заблаговременно предупреждает врача и пользователя о низком заряде изделия.
Соответствие подтверждается контролем проведенного изготовителем анализа конструкции с необходимыми расчетами и данными испытаний.
19.3 По ИСО 14708-1.
19 4 По ИСО 14708-1. за исключением следующего.
Замена оценки:
Побочные эффекты и преимущества изделия определяются на основе современной медицинской практики с применением аналогичных изделий или в ходе клинических исследований в соответствии с ИСО 14155.
7
Дополнительные подпункты:
19.5 Физическая, биологическая и геометрическая целостность имплантируемых частей ИМПЛАНТИРУЕМОЙ СИСТЕМЫ не должна нарушаться при замене на изделие того же изготовителя или удалении. Это необходимо учитывать в конструкции изделия.
Соответствие подтверждают анализом представленного изготовителем проекта, по возможности подтвержденного соответствующими испытаниями и клиническими данными, в том числе постпродажного контроля в части замены изделий.
19.6 Корпус имплантируемого СТИМУЛЯТОРА ИМПЛАНТИРУЕМОЙ СИСТЕМЫ при реальном использовании находится в контакте с внутренней средой организма пациента, поэтому должен быть герметичным, чтобы жидкость не могла проникнуть в корпус СТИМУЛЯТОРА.
Метод испытания. Испытания на мапые и большие течи проводят на герметичном корпусе СТИМУЛЯТОРА ИМПЛАНТИРУЕМОЙ СИСТЕМЫ в соответствии с ЕН 13185 и ЕН 1593. Если используются методы из группы А стандарта ЕН 13185, то испытание на большие течи не требуется: если используются методы группы В. то сначала необходимо провести испытания на малые течи, затем — на большие.
Примечание — Изготовитель должен провести необходимые испытания для проверки герметичности на этапе производства
Соответствие подтверждается контролем процедур проведения испытаний и предоставленных изготовителем результатов. Интенсивность протечки изделия не должна превышать 5 10'1 Па м3/с для испытаний на малые течи и без потока пузырьков или двух и более пузырьков в том же месте корпуса СТИМУЛЯТОРА при испытании на большие течи.
20 Защита изделия от повреждений, вызванных применением наружныхдефибрилляторов
Примечание —См также 28 12.
20.1 Пункт ИСО 14708-1 не применяется для настоящего стандарта.
20.2 По ИСО 14708-1.
21 Защита изделия от изменений, вызванных электрическими полями высокой энергии, воздействующими непосредственно на пациента
Примечание —См также 28 12 и 28 13
21.1 Замена:
Имплантируемая часть ИМПЛАНТИРУЕМОЙ СИСТЕМЫ должна быть сконструирована так. чтобы исключить повреждение изделия длительным воздействием высокочастотного тока от электрохирургического оборудования (электрохирургия), проходящего через пациента. Это условие обязательно для соблюдения, если ИМПЛАНТИРУЕМАЯ СИСТЕМА не размещена непосредственно между электродом для рассечения и возвратным электродом (земля) (см. также требование для предупреждения 28.13).
Методика испытания. Необходимо использовать сигнальный генератор с полным выходным сопротивлением 50 Ом (R1). Частота испытательного сигнала синусоиды составляет 500 кГц, размах напряжения тестового сигнала разомкнутого контура равен 20 В.
ИМПЛАНТИРУЕМАЯ СИСТЕМА должна быть выключена. Каждый выход имплантируемой части ИМПЛАНТИРУЕМОЙ СИСТЕМЫ необходимо соединить через резистор (R) 4.7 кОм с общей точкой, связанной с выходом сигнального генератора (см. рисунок 102). ЭЛЕКТРОД СРАВНЕНИЯ имплантируемой части ИМПЛАНТИРУЕМОЙ СИСТЕМЫ нужно соединить через резистор 100 Ом (R3) с землей сигнального генератора.
Необходимо использовать 10 тестовых импульсов длительностью 1 с с перерывом 5 с.
Соответствие подтверждается, если после выполнения тестовых процедур и перезапуска характеристики ИМПЛАНТИРУЕМОЙ СИСТЕМЫ будут соответствовать заявленным изготовителем спецификациям.
21.2 Настоящий пункт будет проработан в следующих изданиях.
8
|
R2 = 4.7 кОм |
|
Рисунок 102 — Испытательный стенд для проверки |
22 Защита активного имплантируемого медицинского изделия от изменений, вызванных применением других видов лечения
Примечание —См также 28 12,28 14 и 28 15
22.2 По ИСО 14708-1. раздел 22.
Дополнительные подпункты:
22.2 Изготовитель должен идентифицировать безопасность имплантируемых частей ИМПЛАНТИРУЕМОЙ СИСТЕМЫ при проведении магнитно-резонансной томографии (МРТ) (см. 28.8). указать (см. 28.12) условия (в том числе конкретные напряженности поля), в которых была проверена безопасность использования МРТ, перечислить риски размагничивания и искажения изображения, а также привести инструкции для безопасного проведения МРТ исследования, если оно допустимо.
Риски для пациента с ИМПЛАНТИРУЕМОЙ СИСТЕМОЙ во время MPT-исследования можно сгруппировать по следующим категориям: усилие, создаваемое в магнитном поле, тепловыделение, случайный выходной сигнал изделия и повреждения имплантата. Каждый из этих факторов должен быть проверен следующим образом:
a) Сила
Имплантируемая часть ИМПЛАНТИРУЕМОЙ СИСТЕМЫ не должна наносить пациенту вред путем воздействия механических сил. которые могут возникнуть во время МРТ-сканирования.
Методика испытания. Силу рассчитывают по напряженности магнитного поля установки МРТ. магнитным свойствам ферромагнитных или парамагнитных материалов, входящих в состав имплантируемой части, силе любого внутреннего магнита и геометрии имплантируемой части, содержащей магнит. Также силу можно измерить.
Соответствие подтверждается, если максимальная сила в случае наихудшей ориентации будет ниже 10 Н или не будет выявлено смещение имплантата или магнита.
b) Тепловыделение
Имплантируемая часть ИМПЛАНТИРУЕМОЙ СИСТЕМЫ не должна выделять излишнее количество тепла во время процедуры МРТ
Методика испытания. Необходимо выбрать два одинаковых закрытых пластиковых контейнера объемом, достаточным для погружения всей имплантируемой части ИМПЛАНТИРУЕМОЙ СИСТЕМЫ в раствор. Объем раствора NaCI равен (3 ± 0.3) объемам имплантируемой части. Общий объем имплантата и раствора соли в одном контейнере должен быть идентичен объему раствора в другом контейнере Имплантируемую часть ИМПЛАНТИРУЕМОЙ СИСТЕМЫ необходимо поместить в контейнер на 24 ч при температуре, аналогичной месту проведения процедуры МРТ. Оба контейнера заполняют 9 г/л раствора NaCI. находившимся в течение предыдущих 24 ч в том же помещении. Температура раствора NaCI каждого контейнера регистрируется с помощью цифрового термометра с точностью 0.1 °С. Не- 1
обходимо также замерить температуру в помещении. Оба контейнера помещают в аппарат для проведения МРТ в месте, предполагающем максимальную мощность радиочастотного излучения. Проводят испытательную процедуру MPT-сканирования, представляющую наихудший случай клинического исследования (наиболее высокая степень поглощения), длительностью не менее 15 мин. Немедленно после завершения сканирования контейнеры убирают из камеры МРТ и снова регистрируют температуры каждого контейнера. Также можно использовать стандарт ASTM F2182 (American Society for Testing and Materials — американское общество испытаний и материалов) для испытания повышения температуры имплантата и проводника.
Соответствие подтверждается, если разница температур контейнеров или повышение температуры на имплантате или наконечнике электрода составляет менее 2 °С.
c) Случайный выходной сигнал
Имплантируемая часть ИМПЛАНТИРУЕМОЙ СИСТЕМЫ не должна генерировать вредный для пациента выходной сигнал во время процедуры МРТ
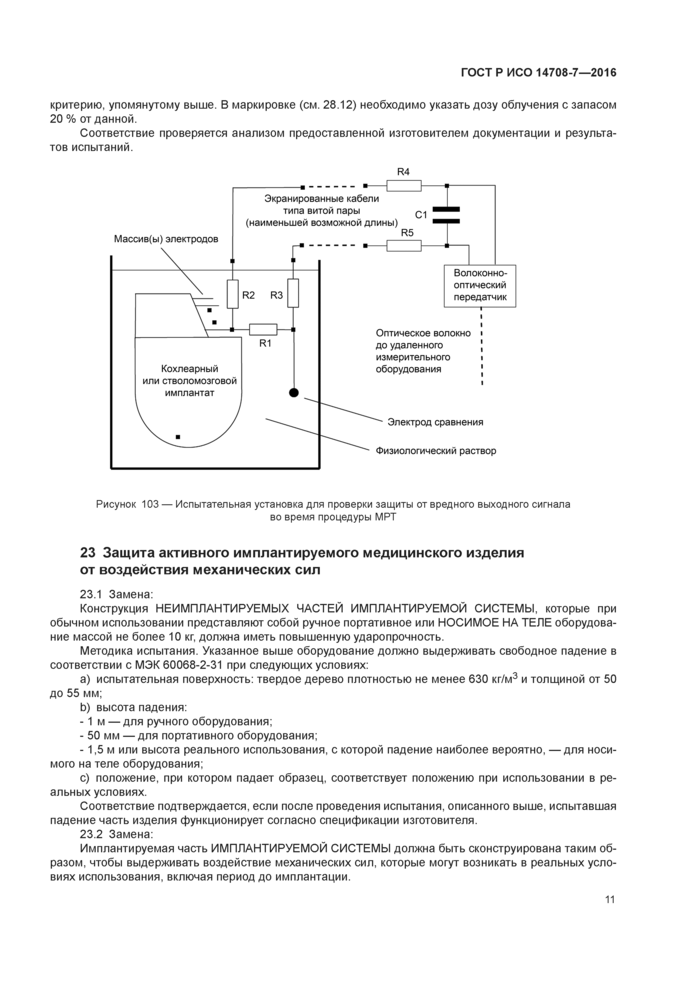
Методика испытания. Имплантируемую часть ИМПЛАНТИРУЕМОЙ СИСТЕМЫ помещают в аппарат МРТ. Необходимо проверить две схемы включения ИМПЛАНТИРУЕМОЙ СИСТЕМЫ: первая — ИМПЛАНТИРУЕМАЯ СИСТЕМА имеет дополнительный измерительный резистор R1. подключенный последовательно с ЭЛЕКТРОДОМ СРАВНЕНИЯ, с доступом к обоим концам R1, вторая — имплантируемая система с доступом к напряжению питания имплантата. Приемопередающая волоконно-оптическая схема и осциллограф подключаются к резистору R1. как показано на рисунке 103. Для этого испытания необходимо использовать экранированный кабель типа витой пары и пассивный фильтр нижних частот. Рекомендованные резисторы: R1 = 10 кОм. R2 = R3 = 22 кОм. Эти три резистора должны быть смонтированы в область менее 1 см2. Фильтр нижних частот формируется резисторами R2—R5 и конденсатором С1. При определении значения R4 и R5 необходимо принять во внимание входное полное сопротивление волоконно-оптического элемента. Частота среза составляет около 10 кГц. Все компоненты должны быть сконструированы с использованием технологии поверхностного монтажа и сделаны из немагнитных материалов. Необходимо использовать измерительное оборудование, которое не влияет на МРТ. В противном случае осциллограф следует размещать за пределами помещения для проведения МРТ Имплантируемую часть ИМПЛАНТИРУЕМОЙ СИСТЕМЫ, включая ЭЛЕКТРОДНЫЙ МАССИВ и ЭЛЕКТРОД СРАВНЕНИЯ, помещают в контейнер, заполненный солевым раствором 9 г/л или гелеобразным фантомным материалом с подобной проводимостью, в положение, характерное для имплантируемого изделия. В ходе испытания моделируется самое сложное сканирование на МРТ. Выходной заряд определяется по напряжению на измерительном резисторе.
Соответствие подтверждается, если заряд за фазу не превысит 10 нКл.
d) Повреждение имплантата
Во время сканирования МРТ не допускается повреждение имплантируемой части ИМПЛАНТИРУЕМОЙ СИСТЕМЫ
Методика испытания. Данное испытание применяют для каждого значения напряженности магнитного поля, определенного изготовителем имплантата как безопасное при MPT-сканировании. Испытательный образец имплантируемой части ИМПЛАНТИРУЕМОЙ СИСТЕМЫ полностью погружают в неметалпический контейнер, заполненный 9 г/л раствора NaCI. Для проведения самого сложного сканирования (согласно описанию в перечислении Ь)] контейнер размещают в центре аппарата МРТ
Соответствие подтверждается, если после сканирования изделие будет соответствовать спецификациям изготовителя. Уменьшение силы внутреннего магнита является приемлемым, если изготовитель обеспечивает альтернативный метод фиксации и указывает соответствующую информацию в маркировке изделия (см. 28.12).
22.3 Имплантируемая часть ИМПЛАНТИРУЕМОЙ СИСТЕМЫ должна выдержать уровни терапевтического ионизирующего излучения, определенные изготовителем имплантата.
Методика испытания. Три образца имплантируемой части ИМПЛАНТИРУЕМОЙ СИСТЕМЫ облучают с помощью фотонного излучения дозой 5 Гр до максимальной накопленной дозы, определенной изготовителем. Облучение необходимо проводить с интервалом 24 ч. по крайней мере четыре раза в неделю. После каждой процедуры изделие должно включаться в реальных клинических условиях. Перед каждым облучением амплитуду ВЫХОДНОГО СИГНАЛА следует проверять согласно 6.1 и 6 2. Пока амплитуда выходного сигнала каждого образца остается в пределах 10 % своего исходного значения перед первым облучением, применяют следующую дозу облучения. Изготовитель должен указать среднюю дозу для трех образцов, при которой ВЫХОДНОЙ СИГНАЛ на последнем испытании отвечал
Ю
критерию, упомянутому выше. В маркировке (см. 28.12) необходимо указать дозу облучения с запасом 20 % от данной.
Соответствие проверяется анализом предоставленной изготовителем документации и результатов испытаний.
|
R4 |
|
Рисунок 103 — Испытательная установка для проверки защиты от вредного выходного сигнала во время процедуры МРТ |
23 Защита активного имплантируемого медицинского изделия от воздействия механических сил
23.1 Замена:
Конструкция НЕИМПЛАНТИРУЕМЫХ ЧАСТЕЙ ИМПЛАНТИРУЕМОЙ СИСТЕМЫ, которые при обычном использовании представляют собой ручное портативное или НОСИМОЕ НА ТЕЛЕ оборудование массой не более 10 кг. должна иметь повышенную ударопрочность.
Методика испытания. Указанное выше оборудование должно выдерживать свободное падение в соответствии с МЭК 60068-2-31 при следующих условиях:
a) испытательная поверхность: твердое дерево плотностью не менее 630 кг/м3 и толщиной от 50 до 55 мм;
b) высота падения:
- 1 м — для ручного оборудования;
- 50 мм — для портативного оборудования;
-1.5 м или высота реального использования, с которой падение наиболее вероятно. — для носимого на теле оборудования;
c) положение, при котором падает образец, соответствует положению при использовании в реальных условиях.
Соответствие подтверждается, если после проведения испытания, описанного выше, испытавшая падение часть изделия функционирует согласно спецификации изготовителя.
23.2 Замена;
Имплантируемая часть ИМПЛАНТИРУЕМОЙ СИСТЕМЫ должна быть сконструирована таким образом. чтобы выдерживать воздействие механических сил, которые могут возникать в реальных условиях использования, включая период до имплантации.
11
Методика испытания. Имплантируемую часть ИМПЛАНТИРУЕМОЙ СИСТЕМЫ устанавливают в соответствии с рекомендациями МЭК 60068-2-47 на испытательном оборудовании для оценки вибрационных воздействий в соответствии с МЭК 60068-2-64. тест Fh. при следующих условиях:
a) частотный диапазон: от 5 до 550 Гц;
b) спектральная плотность мощности: 0.7 (м/с^/Гц;
c) форма спектральной плотности мощности: плоская горизонтальная от 5 до 500 Гц;
d) продолжительность тестирования: 30 мин по каждой из трех взаимно перпендикулярных осей.
Соответствие подтверждается, если после проведения испытания значения характеристик имплантируемой системы соответствуют спецификации изготовителя.
23.3 Замена:
Имплантируемые ПРОВОДНИКИ, которые находятся за пределами СТИМУЛЯТОРА, должны выдерживать силы натяжения, возникающие во время или после имплантации, без разрыва проводника и ухудшения функциональной электрической изоляции.
Для проведения испытаний необходимы два образца:
- имплантируемая часть в том же состоянии, в котором она доставляется заказчику (образец А). Если необходимо, проводники перед испытанием можно соединить в соответствии с инструкцией изготовителя;
- имплантируемый проводник без СТИМУЛЯТОРА (образец В).
Методика испытания. Необходимо использовать контейнер с раствором NaCI 9 r/л при температуре (37 ± 5) °С. контрольный прибор для измерения натяжения и вольтметр или осциллограф. Продолжительность нахождения образцов в контейнере — минимум 10 дней. Непосредственно перед испытанием проводник необходимо промыть в дистиллированной или деионизированой воде и затем вытереть насухо.
Изготовитель должен определить тот участок ПРОВОДНИКА, который при имплантации может подвергнуться растяжению, и предусмотреть соответствующий метод фиксации ПРОВОДНИКА, включая растянутую часть.
a) Методика испытаний для образца А:
Образец А подключают одним зажимом к стимулятору или к блоку соединения, если он используется. Другой зажим необходимо присоединить к ДИСТАЛЬНОЙ части ПРОВОДНИКА, который подвергается растяжению. Затем замеряют расстояние между точками крепления.
ПРОВОДНИК подвергают растяжению минимум на 15 мм или силе растяжения минимум 1 Н. в зависимости от того, что наступит раньше. Растяжение производится в течение как минимум одной минуты до момента снятия нагрузки. Так необходимо проверить каждый ПРОВОДНИК. Затем образец как минимум на 1 ч погружается в ванну перед повторным испытанием.
Необходимо проверить отсутствие разрыва электрической цепи каждого проводника (испытание на обрыв цепи) и изоляции (испытание на короткое замыкание) между каждой парой ПРОВОДНИКОВ (если это возможно).
Соответствие подтверждается, если испытание на образце А не выявило постоянное функциональное повреждение (например, отсутствие обрыва цепи или короткого замыкания).
b) Методика испытания изоляции образца В:
Образец В следует так же испытать на растяжение, как и образец А. Отличие в том, что оба конца проводника необходимо зафиксировать. После испытания на растяжение изоляция должна быть подвергнута испытательному напряжению. Испытательный сигнал представляет собой меандр частотой 1 кГц с размахом напряжения в два раза больше, чем размах выходного напряжения ИМПЛАНТИРУЕМОЙ СИСТЕМЫ. Испытательный сигнал следует подавать минимум в течение 15 с между каждой комбинацией электропроводящих пар в проводнике. Измеряют полное сопротивление между каждой парой.
Соответствие подтверждается, если не будет выявлено повреждений проводника в результате испытания на растяжение и сопротивление между каждой парой проводников превысит 100 кОм.
23.4 По ИСО 14708-1.
23.5 Замена:
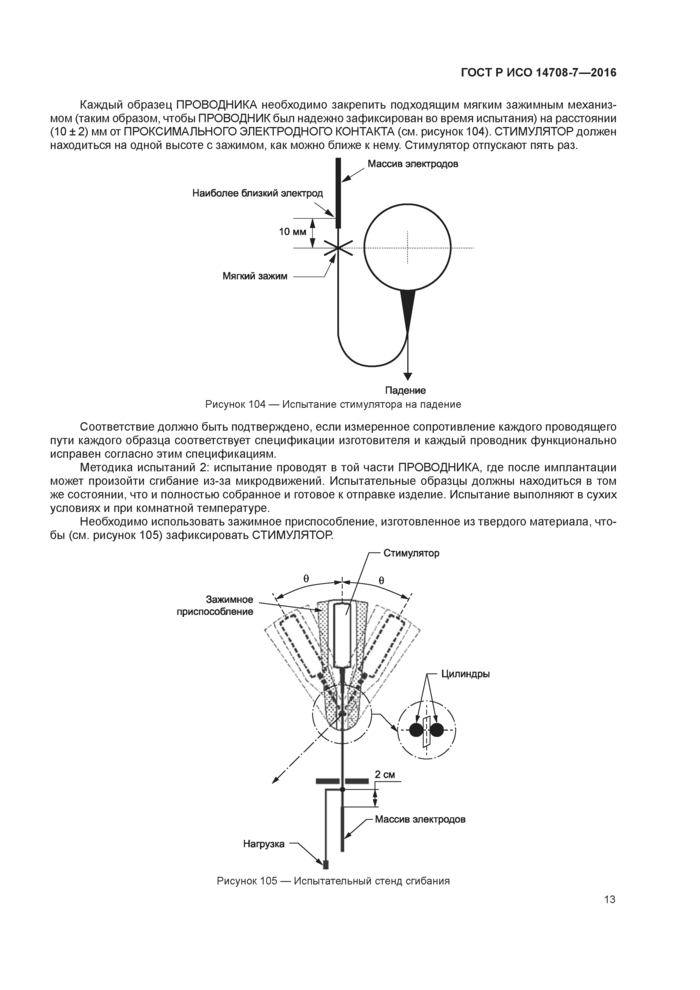
ПРОВОДНИКИ электродов должны выдержать без излома любого проводника испытание на изгиб. который может возникнуть во время и после имплантации. Необходимо проверить три образца методиками испытаний 1 и 2.
Методика испытаний 1: испытательные образцы должны быть предоставлены на испытание в том виде, в котором они поставляются заказчику. Испытания выполняются в сухих условиях и при комнатной температуре.
12
Содержание
1 Область применения..................................................................1
2 Нормативные ссылки..................................................................1
3 Термины и определения...............................................................2
4 Обозначения и сокращения............................................................3
5 Общие требования к неимплантируемым частям...........................................3
6 Осмотр и измерение..................................................................3
7 Общие требования к упаковке..........................................................4
8 Общие требования к маркировке активных имплантируемых медицинских изделий..............4
9 Маркировка на товарной упаковке.......................................................4
10 Конструкция товарной упаковки........................................................5
11 Маркировка на стерильном пакете......................................................5
12 Конструкция одноразовой упаковки.....................................................5
13 Маркировка активных имплантируемых медицинских изделий...............................6
14 Защита от непреднамеренных биологических воздействий, вызванных активным
имплантируемым медицинским изделием...............................................6
15 Защита пациента или пользователя от вреда, вызванного внешними физическими особенностями
активного имплантируемого медицинского изделия........................................6
16 Защита пациента от вреда, вызванного электрическим током...............................7
17 Защита пациента от вреда, вызванного тепловыделениями.................................7
18 Защита от ионизирующего излучения, выделяемого или испускаемого активным имплантируемым
медицинским изделием...............................................................7
19 Защита от непреднамеренных воздействий, вызванных изделием...........................7
20 Защита изделия от повреждений, вызванных применением наружных дефибрилляторов........8
21 Защита изделия от изменений, вызванных электрическими полями высокой энергии,
воздействующими непосредственно на пациента.........................................8
22 Защита активного имплантируемого медицинского изделия от изменений, вызванных
применением других видов лечения....................................................9
23 Защита активного имплантируемого медицинского изделия от воздействия механических сил ... 11
24 Защита активного имплантируемого медицинского изделия от повреждений, вызванных
электростатическим разрядом........................................................15
25 Защита активного имплантируемого медицинского изделия от повреждений, вызванных
изменениями атмосферного давления.................................................16
26 Защита активного имплантируемого медицинского изделия от повреждений, вызванных
изменениями температуры...........................................................16
27 Защита активного имплантируемого медицинского изделия от электромагнитного
неионизирующего излучения.........................................................16
28 Сопроводительная документация.....................................................18
Приложение АА (справочное) Соответствие между Фундаментальными принципами ИСО/ТО 14283
(8) и разделами настоящего стандарта.....................................21
Приложение ВВ (справочное) Связь между разделами настоящего стандарта и основными
принципами, перечисленными в приложении АА.............................36
Приложение СС (справочное) Примечания к ЕС 45502-2-3 (основание для настоящего стандарта) .37
Приложение DD (справочное) Примечания к теоретическому моделированию для определения
соответствия разделу 27................................................ 44
Приложение ЕЕ (справочное) Примечания к измерениям электромагнитных помех для определения
соответствия разделу 27.................................................46
Приложение ДА (справочное) Сведения о соответствии ссылочных международных стандартов
национальным и действующим в этом качестве межгосударственным стандартам .49
Библиография........................................................................51
Введение
Настоящий стандарт определяет частные требования к АКТИВНЫМ ИМПЛАНТИРУЕМЫМ МЕДИЦИНСКИМ ИЗДЕЛИЯМ, предназначенным для лечения ухудшения слуха посредством электростимуляции (например, системы кохлеарной или слуховой стволомозговой имплантации) в целях обеспечения безопасности использования как для пациентов, так и для специалистов
СИСТЕМЫ КОХЛЕАРНОЙ ИМПЛАНТАЦИИ и СИСТЕМЫ СЛУХОВОЙ СТВОЛ О МОЗГОВОЙ ИМПЛАНТАЦИИ являются активными имплантируемыми МЕДИЦИНСКИМИ ИЗДЕЛИЯМИ и состоят из имплантируемых и НЕИМПЛАНТИРУЕМЫХ ЧАСТЕЙ (внешние части). Источник питания изделия может быть как внешним, так и внутренним (внутренняя батарея). Имплантируемая система предназначена для восстановления слуха посредством электростимуляции слуховых путей. Внешне или внутренне обработанная акустическая информация преобразовывается в сигналы электростимуляции, передающиеся через один или несколько электродов. Рабочие параметры изделия могут быть скорректированы через неимплантируемые принадлежности.
Действие настоящего стандарта распространяется на все части ИМПЛАНТИРУЕМЫХ СИСТЕМ, включая принадлежности.
Требования стандарта дополняют или изменяют требования ИСО 14708-1 «Имплантаты хирургические. Активные имплантируемые медицинские изделия. Часть 1. Общие требования к безопасности, маркировке и информации, предоставляемой изготовителем».
Дополнительные рисунки и таблицы к ИСО 14708-1 пронумерованы начиная со 101; дополнительные приложения обозначены буквами АА, ВВ и т. д.
Термины, определенные в разделе 3 настоящего стандарта, набраны прописными буквами. Если термин используется в ином значении, он набран строчными буквами.
IV
НАЦИОНАЛЬНЫЙ СТАНДАРТ РОССИЙСКОЙ ФЕДЕРАЦИИ
ИМПЛАНТАТЫ ДЛЯ ХИРУРГИИ Активные имплантируемые медицинские изделия Часть 7
Частные требования к системам кохлеарной имплантации
Implants for surgery Active implantable medical devices Part 7. Particular requirements for cochlear implant systems
Дата введения — 2017—10—01
1 Область применения
Настоящий стандарт распространяется на АКТИВНЫЕ ИМПЛАНТИРУЕМЫЕ МЕДИЦИНСКИЕ ИЗДЕЛИЯ, предназначенные для лечения нарушений слуха посредством электростимуляции слуховых путей. Настоящий стандарт не распространяется на изделия, используемые для лечения нарушений слуха не посредством электростимуляции.
Методы испытаний, приведенные в настоящем стандарте, являются типовыми для оценки соответствия образцов изделий.
Настоящий стандарт также распространяется на НЕИМПЛАНТИРУЕМЫЕ ЧАСТИ и принадлежности систем кохлеарной имплантации (см. примечание).
Электрические характеристики ИМПЛАНТИРУЕМОЙ ЧАСТИ определяются либо методом, регламентированным настоящим стандартом, либо другим, не менее точным методом. В случае спорной ситуации применяется метод настоящего стандарта.
Примечание — Активное имплантируемое медицинское изделие может быть как отдельным устройством. так и набором устройств с одной или более принадлежностями Не все из этих компонентов должны быть полностью или частично имплантированы, но при этом необходимо определить требования к неимплантируемым частям и принадлежностям, если они могут повлиять на безопасность или функциональные характеристики имплантируемой части
2 Нормативные ссылки
В настоящем стандарте использованы нормативные ссылки на стандарты и другие нормативные документы, которые необходимо учитывать при его использовании. Для датированных ссылок применяют только указанные издания. Для недатированных ссылок применяют самые последние издания (включая любые изменения и поправки).
ISO 10993-1, Biological evaluation of medical devices — Part 1: Evaluation and testing within a risk management process (Биологическая оценка медицинских устройств — Часть 1. Оценка и проверка в процессе управления рисками)
ISO 11607-1. Packaging for terminally sterilized medical devices — Part 1: Requirements for materials, sterile barrier systems and packaging systems (Упаковка медицинских изделий, подлежащих финишной стерилизации. Часть 1. Требования к материалам, барьерным системам для стерилизации и упаковочным системам)
ISO 14155, Clinical investigation of medical devices for human subjects — Good clinical practice (Клинические исследования медицинских изделий для людей. Надлежащая клиническая практика)
ISO 14971. Medical devices — Application of risk management to medical devices (Изделия медицинские. Применение менеджмента риска к медицинским изделиям)
Издание официальное
IEC 60068-2-27. Environmental testing — Part 2-27: Tests — Test Ea and guidance: Shock (Испытания на воздействие внешних факторов. Часть 2-27. Испытания. Тестирование Еа и руководство: Удар) IEC 60068-2-31. Environmental testing — Part 2-31: Tests—Test Ec: Rough handling shocks, primarily for equipment-type specimens (Испытания на воздействие внешних факторов. Часть 2-31. Испытания. Испытание Ес: Воздействия при грубом обращении, в основном, с образцами аппаратуры)
IEC 60068-2-47, Environmental testing — Part 2-47: Test — Mounting of specimens for vibration, impact and similar dynamic tests (Испытания на воздействие внешних факторов. Часть 2-47. Монтаж эпементов, аппаратуры и других изделий для испытаний на вибрацию, удар и подобных динамических испытаний) IEC 60068-2-64. Environmental testing — Part 2-64: Tests — Test Fh: Vibration, broadband random and guidance (Испытания на воздействие внешних факторов. Часть 2-64 Испытание Fh. Широкополосная случайная вибрация (цифровое управление) и руководство)
IEC 60068-2-75. Environmental testing — Part 2-75: Tests — Test Eh: Hammer tests (Испытания на воздействие внешних факторов. Часть 2-75. Испытание Eh: Ударные испытания)
IEC 60118-6. Hearing aids — Part 6: Characteristics of electrical input circuits for hearing aids (Аппараты слуховые. Часть 6. Характеристики входных электрических цепей слуховых аппаратов)
IEC 60601-1:2006. Medical electrical equipment — Part 1: General requirements for basic safety and essential performance (Изделия медицинские электрические. Часть 1. Общие требования безопасности с учетом основных функциональных характеристик)
IEC 60601-1-2, Medical electrical equipment — Part 1-2: General requirements for basic safety and essential perfoonance — Collateral standard: Electromagnetic compatibility — Requirements and tests (Изделия медицинские электрические. Часть 1-2. Общие требования безопасности с учетом основных функциональных характеристик. Параллельный стандарт. Электромагнитная совместимость. Требования и испытания)
IEC 61000-4-2, Electromagnetic compatibility (EMC) — Part 4-2: Testing and measurement techniques — Electrostatic discharge immunity test (Электромагнитная совместимость. Часть 4-2. Методики испытаний и измерений. Испытание на невосприимчивость к электростатическому разряду)
IEC 62304, Medical device software — Software life cycle processes (Изделия медицинские. Программное обеспечение. Процессы жизненного цикла)
EN 1593, Non-destructive testing — Leak testing — Bubble emission techniques (Испытание на прочность — Испытание на герметичность — Пузырьковые методы эмиссии)
EN 13185, Non-destojctive testing — Leak testing — Tracer gas method (Испытание на прочность — Испытание на герметичность — Проверка герметичности с использованием пробного газа)
3 Термины и определения
В настоящем стандарте применены термины по ИСО 14708-1. а также следующие термины с соответствующими определениями:
3.3.1 система кохлеарной имплантации (cochlear implant system; CIS): Активное имплантируемое медицинское изделие, включающее в себя имплантируемые и НЕИМПЛАНТИРУЕМЫЕ ЧАСТИ, позволяющее компенсировать потерю слуха посредством электрической стимуляции улитки внутреннего уха.
3.3.2 система слуховой стволомозговой имплантации (auditory brainstem implant system: BIS): АКТИВНОЕ ИМПЛАНТИРУЕМОЕ МЕДИЦИНСКОЕ ИЗДЕЛИЕ, включающее в себя имплантируемые и НЕИМПЛАНТИРУЕМЫЕ ЧАСТИ, позволяющее компенсировать потерю слуха путем электрической стимуляции слуховых центров ствола головного мозга.
3.3.3 имплантируемая система (implant system): СИСТЕМА КОХЛЕАРНОЙ ИМПЛАНТАЦИИ или СИСТЕМА СЛУХОВОЙ СТВОЛОМОЗГОВОЙ ИМПЛАНТАЦИИ.
3.3.4 неимплантируемая часть (non-implantable part): Внешняя часть ИМПЛАНТИРУЕМОЙ СИСТЕМЫ.
Примечание — Например, речевой процессор, микрофон, катушка передатчика или источник питания
3.3.5 стимулятор (stimulator): Имплантируемая часть ИМПЛАНТИРУЕМОЙ СИСТЕМЫ, содержащая электронную схему для электростимуляции.
3.3.6 переносная часть (body-worn): НЕИМПЛАНТИРУЕМАЯ ЧАСТЬ ИМПЛАНТИРУЕМОЙ СИСТЕМЫ. переносимая на теле пациента (например, на поясе или на уровне уха).
2
3.5.1 электродный контакт (electrode contact): Часть изделия, электрический проводник, разработанный для формирования интерфейса с внутренними тканями тела пациента или жидкостью в организме.
3.5.2 электродный массив (electrode array): ДИСТАЛЬНАЯ часть проводника, содержащего более одного электродного контакта.
3.5.3 электрод сравнения (reference electrode): Электрически проводящая часть, разработанная для прохождения обратного электрического тока стимуляции.
3.5.4 дистальный (distal): Расположенный дальше от места расположения СТИМУЛЯТОРА.
3.5.5 проксимальный (proximal): Расположенный ближе к месту расположения СТИМУЛЯТОРА.
3.9.1 обозначение модели (model designation): Наименование и/или комбинация букв и чисел, используемых изготовителем для различения изделий по функциям или типам.
3.9.2 серийный номер (serial number): Уникальная комбинация букв и/или цифр, выбранных изготовителем для различения изделий с одинаковым ОБОЗНАЧЕНИЕМ МОДЕЛИ друг от друга.
3.20.1 выходной сигнал (output signal): Аналоговый или импульсный электрический выходной сигнал ИМПЛАНТИРУЕМОЙ СИСТЕМЫ для стимуляции слуховых путей.
3.20.2 импульс (pulse): Определенный электрический ВЫХОДНОЙ СИГНАЛ (напряжения или тока) с заданными амплитудой и длительностью.
3.20.3 бифазный импульс (biphasic pulse): ИМПУЛЬС, имеющий и отрицательные, и положительные фазы.
3.22.1 срок годности (use-before-date): Дата, после которой изготовитель не рекомендует ИМПЛАНТИРОВАТЬ СИСТЕМУ.
3 22.2 магнит (magnet): Компонент, который создает внешний магнитный поток.
4 Обозначения и сокращения
В настоящем стандарте не определены специальные требования к обозначениям и сокращениям. Это не ограничивает использование обозначений, определенных в других стандартах или в сопроводительной документации.
5 Общие требования к неимплантируемым частям
5.1 Применяют соответствующий раздел стандарта ИСО 14708-1.
5.2 Замена:
Программное обеспечение АКТИВНОГО ИМПЛАНТИРУЕМОГО МЕДИЦИНСКОГО ИЗДЕЛИЯ или программное обеспечение, попадающее под это определение, должно быть разработано и утверждено в соответствии с жизненным циклом изделия согласно МЭК 62304.
6 Осмотр и измерение
Если в настоящем стандарте упоминается проверка документации по анализу конструкции, предоставленной изготовителем, необходимо также провести проверку файла менеджмента риска согласно ИСО 14971.
6.1 Измерение характеристик выходного сигнала
Измерение требуется проводить с имплантируемой частью ИМПЛАНТИРУЕМОЙ СИСТЕМЫ при температуре (37 ± 2) °С. ИМПЛАНТИРУЕМАЯ СИСТЕМА должна быть настроена на использование максимального числа выходов, и каждый выход следует запрограммировать на максимальное значение (амплитуды и длительности импульса). Входной сигнал, эквивалентный уровню звукового давления 70 дБ, должен быть подан на вход микрофона. Если это применимо, то связь через кожу должна осуществляться на расстоянии (5 ± 1) мм. Если ИМПЛАНТИРУЕМАЯ СИСТЕМА обеспечивает различные выходные сигналы, то каждый необходимо измерить и описать отдельно. Для упрощения соединения испытательный образец может быть собран частично. Принимая во внимание все ошибки, погрешность измерений не должна превышать 5 %.
6.2 Измерение амплитуды выходного сигнала и длительности импульса
Каждый выход представленного образца ИМПЛАНТИРУЕМОЙ СИСТЕМЫ необходимо соединить с нагрузочным сопротивлением, равным 1 кОм (±1 %) (см. рисунок 101), а систему настроить согласно 6.1. Осциллограф необходимо настроить таким образом, чтобы отобразить весь выходной сигнал с максимальным разрешением. Измерение проводят на пиках ВЫХОДНЫХ СИГНАЛОВ. Каждый выход поочередно подключают к осциллографу для измерения амплитуды и длительности импульсов. Фиксируют среднее значение амплитуды и длительности импульса, а также их диапазон, результат выражают в мкА и мкс.
6.3 Точность измерения полного сопротивления
Если ИМПЛАНТИРУЕМАЯ СИСТЕМА позволяет измерить полное сопротивление (с помощью дистанционных или прямых измерений), изготовитель должен определить точность измерения полного сопротивления нагрузки 10 кОм. В местах, где имплантируемая система позволяет измерить полное сопротивление (с помощью дистанционных или прямых измерений), изготовитель должен установить точность его измерения для нагрузочного сопротивления, равного 10 кОм. Условия измерений при этом аналогичны обычным условиям клинической практики. Измерить следует каждый выходной сигнал (см. рисунок 101). Точность измерения полного сопротивления выражают в процентах.
Земля соединена с внешним электродом сравнения, если он используется Рисунок 101 — Измерение амплитуды выходного сигнала и полного сопротивления нагрузки
7 Общие требования к упаковке
7.1 По ИСО 14708-1.
7.2 По ИСО 14708-1.
8 Общие требования к маркировке активных имплантируемых медицинских изделий
8.1 По ИСО 14708-1.
8.2 По ИСО 14708-1.
9 Маркировка на товарной упаковке
9.1 По ИСО 14708-1.
9.2 По ИСО 14708-1, за исключением следующего.
Замена:
На ТОВАРНОЙ УПАКОВКЕ должны быть указаны наименование и адрес изготовителя, как минимум город и страна. На ТОВАРНОЙ УПАКОВКЕ должны быть указаны наименование и адрес официального представителя, если у изготовителя нет зарегистрированного места осуществления хозяйственной деятельности на территории Российской Федерации.
Соответствие проверяют в ходе осмотра.
9.3 Замена:
Если ИМПЛАНТИРУЕМАЯ СИСТЕМА поставляется в виде упакованных сборочных узлов, на каждой индивидуальной ТОВАРНОЙ УПАКОВКЕ нужно указать содержимое, номер модели или детали, а также номер партии или серии, если он есть.
Соответствие проверяют в ходе осмотра.
9.4 По ИСО 14708-1.
9.5 По ИСО 14708-1.
9.6 По ИСО 14708-1.
9.7 Замена:
На ТОВАРНОЙ УПАКОВКЕ имплантируемых частей АКТИВНОГО ИМПЛАНТИРУЕМОГО МЕДИЦИНСКОГО ИЗДЕЛИЯ также необходимо указать СРОК ГОДНОСТИ согласно 9.6.
Соответствие проверяют в ходе осмотра.
9.8 По ИСО 14708-1.
9.9 По ИСО 14708-1.
9.10 По ИСО 14708-1.
9.11 По ИСО 14708-1.
9.12 Дополнительный подпункт: Если имплантируемая система поставляется в виде упакованных сборочных узлов, на каждой индивидуальной товарной упаковке необходимо указать содержимое, номер модели или детали, а также номер партии или серии, если он есть.
Соответствие проверяют в ходе осмотра.
10 Конструкция товарной упаковки
10.1 По ИСО 14708-1.
10.2 По ИСО 14708-1.
10.3 По ИСО 14708-1.
Примечание — Сменные этикетки, содержащие дополнительные данные помимо информации, определенной в разделе 9, не могут тестироваться методом, описанным в 10 3
11 Маркировка на стерильном пакете
11.1 По ИСО 14708-1.
11.2 По ИСО 14708-1.
11.3 По ИСО 14708-1.
11.4 По ИСО 14708-1.
11.5 По ИСО 14708-1.
11.6 По ИСО 14708-1.
11.7 По ИСО 14708-1.
11.8 По ИСО 14708-1.
11.9 По ИСО 14708-1.
11.10 По ИСО 14708-1.
Примечание — Требования настоящего подпункта можно выполнить с использованием общепринятого обозначения
12 Конструкция одноразовой упаковки
12.1 По ИСО 14708-1. за исключением следующего.
Замена:
ОДНОРАЗОВАЯ УПАКОВКА должна соответствовать ИСО 11607-1
5
Соответствие проверяют в ходе осмотра изделия и анализа документации, предоставленной изготовителем.
12.2 По ИСО 14708-1.
12.3 По ИСО 14708-1.
13 Маркировка активных имплантируемых медицинских изделий
13.1 По ИСО 14708-1.
13.2 По ИСО 14708-1.
13.3 Замена:
В случае необходимости имплантируемые части ИМПЛАНТИРУЕМОЙ СИСТЕМЫ должны быть однозначно идентифицируемы (особенно обозначение модели) без хирургического вмешательства.
Соответствие должно быть подтверждено в ходе осмотра в порядке, установленном изготовителем в инструкции по применению (см. 28.6).
13.4 По ИСО 14708-1.
14 Защита от непреднамеренных биологических воздействий, вызванныхактивным имплантируемым медицинским изделием
14.1 По ИСО 14708-1.
14.2 Замена:
Любая имплантируемая часть АКТИВНОГО ИМПЛАНТИРУЕМОГО МЕДИЦИНСКОГО ИЗДЕЛИЯ, которая при реальном использовании контактирует с жидкими средами организма человека, должна быть проверена на выделение твердых частиц в приемлемом количестве.
Методика испытаний. Имплантируемую часть ИМПЛАНТИРУЕМОЙ СИСТЕМЫ асептически извлекают из ОДНОРАЗОВОЙ УПАКОВКИ. Имплантируемую часть погружают в нейтральном стеклянном контейнере в инъекционный раствор соли 9 r/л. Объем солевого раствора должен быть примерно в (5 ± 0.5) раз больше численного значения площади поверхности имплантируемой части, выраженной в квадратных сантиметрах. Контейнер накрывают стеклянной пластиной и оставляют при температуре примерно (37 ± 2) °С на 8—18 ч. периодически встряхивая. Затем готовят контрольный раствор аналогичного объема с солью из той же партии, поддерживают те же условия, что и в контейнере с образцом. Образцы жидкости из обычного и контрольного контейнеров сравнивают, применяя аппаратуру для измерения размеров частиц, работающую по принципу оптического затенения (метод V.5.7.1 Европейской Фармакопеи) или по принципу электрического зондирования (см. принцип Культера. приложение XIII из Британской Фармакопеи).
Среднее число частиц, выделяющихся из образца, по отношению к контрольному образцу не должно превышать 100 частиц/мл для частиц размерами более 5.0 мкм и 5 частиц/мл для частиц размерами более 25 мкм.
14.3 Замена:
По ИСО 14708-1 и ИСО 10993-1.
14.4 По ИСО 14708-1.
15 Защита пациента или пользователя от вреда, вызванного внешнимифизическими особенностями активного имплантируемого медицинскогоизделия
изделия
15.1 По ИСО 14708-1.
15.2 Замена:
Не допускается наличие в имплантируемых частях ИМПЛАНТИРУЕМОЙ СИСТЕМЫ конструктивных особенностей, таких как острые углы или края, которые могут вызвать чрезмерную реакцию или воспаление, помимо вызванных непосредственно процедурой имплантации, также недопустимо наличие грубых поверхностей, если это не обусловлено необходимостью обеспечения правильного функционирования изделия.
6
1