ФЕДЕРАЛЬНОЕ АГЕНТСТВО ПО ТЕХНИЧЕСКОМУ РЕГУЛИРОВАНИЮ И МЕТРОЛОГИИ
НАЦИОНАЛЬНЫЙ
СТАНДАРТ
РОССИЙСКОЙ
ФЕДЕРАЦИИ
Информатизация здоровья
ИДЕНТИФИКАЦИЯ ЛЕКАРСТВЕННЫХ СРЕДСТВ.
Элементы данных и структуры для уникальной идентификации и обмена информацией о регистрируемых лекарственных средствах
ISO 11615:2012 Health informatics — Identification of medicinal products —
Data elements and structures for the unique identification and exchange of regulated medicinal product information (IDT)
Издание официальное
Предисловие
1 ПОДГОТОВЛЕН Федеральным государственным бюджетным учреждением «Центральный научно-исследовательский институт организации и информатизации здравоохранения» Министерства здравоохранения Российской Федерации (ФБГУ «ЦНИИОИЗ» Минздрава) и обществом с ограниченной ответственностью «Корпоративные электронные системы» на основе собственного аутентичного перевода на русский язык международного документа, указанного в пункте 4
2 ВНЕСЕН Техническим комитетом по стандартизации ТК 468 «Информатизация здоровья» при ЦНИИОИЗ Минздрава — постоянным представителем ИСО ТК 215
3 УТВЕРЖДЕН И ВВЕДЕН В ДЕЙСТВИЕ Приказом Федерального агентства по техническому регулированию и метрологии от 17 ноября 2014 г. № 1621-ст
4 Настоящий стандарт идентичен международному стандарту ИСО 11615:2014 Информатизация здоровья. Идентификация лекарственных средств. Элементы данных и структуры для уникальной идентификации и обмена информацией о регистрируемых лекарственных средствах (ISO 11615:2012 «Health informatics — Identification of medicinal products — Data elements and structures for unique identification and exchange of regulated medicinal product information»).
Наименование настоящего стандарта изменено относительно наименования указанного международного стандарта для приведения в соответствие с ГОСТ Р 1.5-2004 (пункт 3.5).
При применении настоящего стандарта рекомендуется использовать вместо ссылочных международных стандартов и документов соответствующие им национальные стандарты Российской Федерации. сведения о которых приведены в справочном приложении ДА
5 ВВЕДЕН ВПЕРВЫЕ
Правила применения настоящего стандарта установлены в ГОСТ Р 1.0-2012 (раздел 8). Информация об изменениях к настоящему стандарту публикуется в ежегодном (по состоянию на 1 января текущего года) информационном указателе «Национальные стандарты», а официальный текст изменений и поправок — в ежемесячном информационном указателе «Национальные стандарты». В случае пересмотра (замены) или отмены настоящего стандарта соответствующее уведомление будет опубликовано в ближайшем выпуске ежемесячного информационного указателя «Национальные стандарты». Соответствующая информация, уведомление и тексты размещаются также в информационной системе общего пользования — на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет (www gost.ru)
© Стандартинформ. 2015
Настоящий стандарт не может быть полностью или частично воспроизведен, тиражирован и распространен в качестве официального издания без разрешения Федерального агентства по техническому регулированию и метрологии
ГОСТ РИСО 11615—2014
...1 ...1 ...2 ...2 10 . 11 11 .14 .14 15 .15 .16 .18 .18 .19 .19 .20 .20 .21 .21 .22 .27 .32 .34
.35
43
.47
.50
.57
.57
.57
.58
.58
.59
.59
.59
.59
.61
.63
.65
.65
.66
.67
.67
.68
Содержание
1 Область применения...........................................................................................................
2 Нормативные ссылки...........................................................................................................
3 Термины, определения и сокращения...............................................................................
3.1 Термины и определения...............................................................................................
3.2 Сокращения...................................................................................................................
4 Требования...........................................................................................................................
4.1 Понятия, необходимые для уникальной идентификации лекарственных средств............
5 Описание принципов и методов информационного моделирования........................................
5.1 Общие положения...................................................................................................................
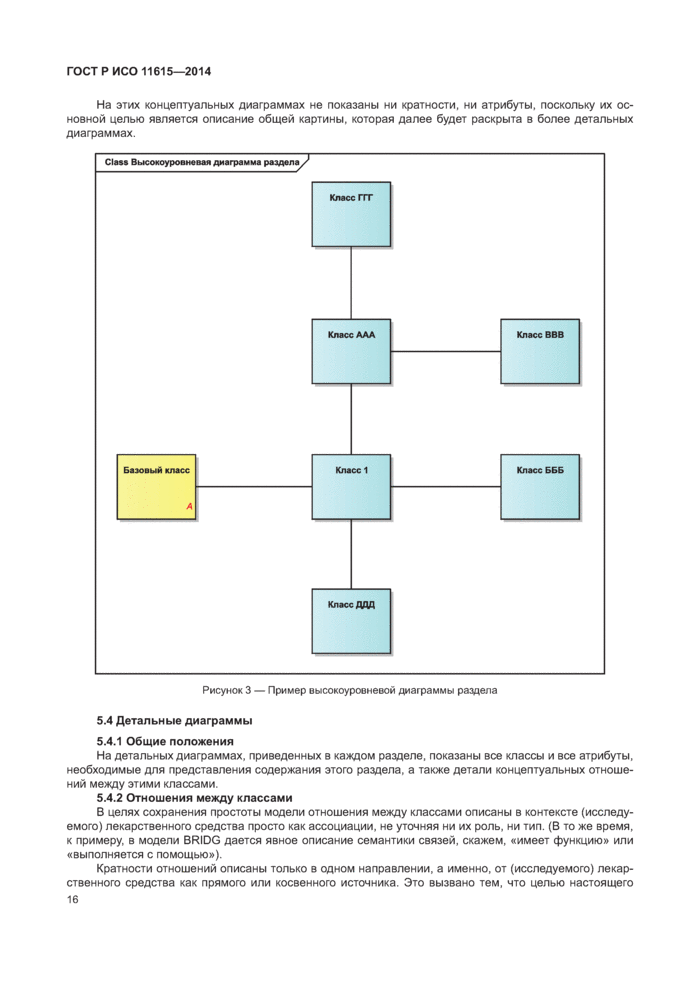
5.2 Концептуальные обзорные диаграммы.................................................................................
5.3 Высокоуровневые диаграммы разделов...............................................................................
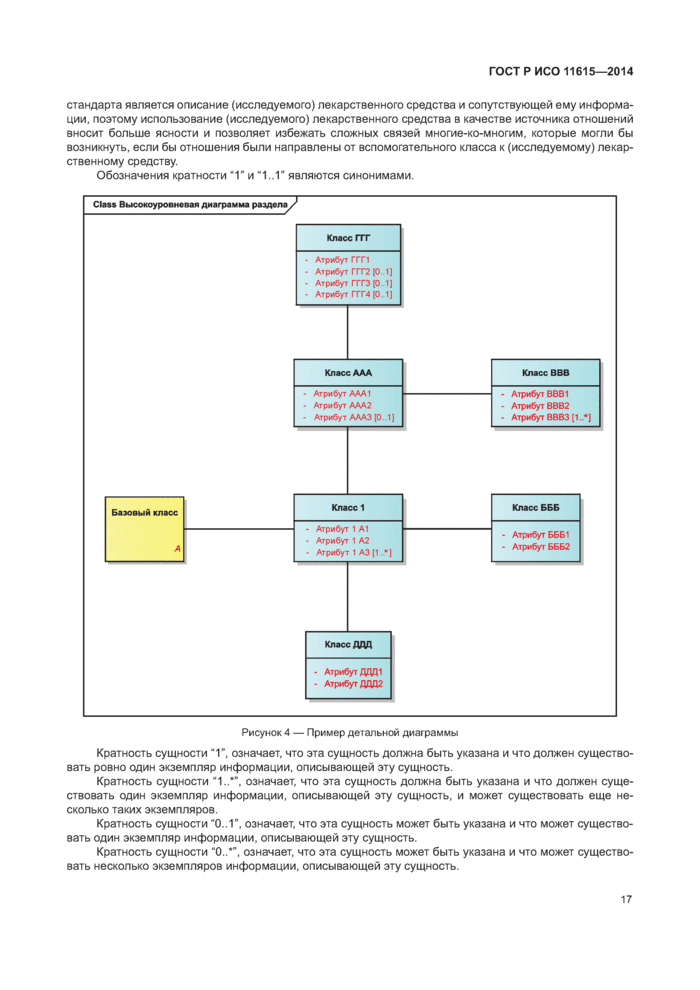
5.4 Детальные диаграммы............................................................................................................
6 Идентифицирующие характеристики зарегистрированных лекарственных средств..............
6.1 Первичные идентификаторы..................................................................................................
6.2 Идентификатор лекарственного средства (MPID)................................................................
6.3 Идентификатор упакованного лекарственного средства (PCID)...............................
6.4 Идентификатор серии лекарственного средства (BAID 1)........................................
6.5 Идентификатор серии лекарственного средства (BAID 2)........................................
7 Информация о зарегистрированном лекарственном средстве.......................................
7.1 Обзор информации о зарегистрированном лекарственном средстве......................
7.2 Лекарственное средство...............................................................................................
7.3 Регистрация лекарственного средства........................................................................
7.4 Организация..................................................................................................................
7.5 Производитель/предприятие........................................................................................
7.6 Упакованное лекарственное средство, включая произведенный продукт
и медицинское изделие.................................................................................................
7.7 Ингредиент, субстанция и активность..........................................................................
7.8 Лекарственный препарат и медицинское изделие.....................................................
7.9 Фармакологические свойства.......................................................................................
8 Идентифицирующие характеристики исследуемых лекарственных средств.................
8.1 Общие положения.........................................................................................................
8.2 Первичные идентификаторы........................................................................................
8.3 Идентификатор исследуемого лекарственного средства (IMPID).............................
8.4 Идентификатор упакованного исследуемого лекарственного средства (IPCID)......
8.5 Идентификатор серии исследуемого лекарственного средства (IBAID 1)...............
8.6 Идентификатор серии исследуемого лекарственного средства (1ВАЮ_2)...............
9 Информация об исследуемом лекарственном средстве.................................................
9.1 Обзор информации об исследуемом лекарственном средстве................................
9.2 Исследуемое лекарственное средство........................................................................
9.3 Разрешение на проведение клинического исследования..........................................
9.4 Производитель/предприятие........................................................................................
9.5 Упакованное исследуемое лекарственное средство..................................................
9.6 Лекарственный препарат..............................................................................................
9.7 Ингредиент.....................................................................................................................
9.8 Фармакологические свойства.......................................................................................
Приложение А (справочное) Полная информационная модель верхнего уровня
о зарегистрированных лекарственных средствах......................................
Приложение В (справочное) Полная подробная информационная модель
о зарегистрированных лекарственных средствах (см. вкладку)
Приложение С (справочное) Полная информационная модель верхнего уровня
об исследуемых лекарственных средствах................................................
Приложение D (справочное) Полная подробная информационная модель об исследуемых лекарственных средствах (см. вкладку)
Приложение Е (справочное) Рабочий пример в табличной форме...........................................................70
Приложение F (справочное) Списки классов и атрибутов.........................................................................80
Приложение G (справочное) Пример реализации информации о лекарственном средстве..................93
Приложение ДА (справочное) Сведения о соответствии ссылочных международных стандартов
и документов национальным стандартам Российской Федерации.............................100
Библиография..............................................................................................................................................101
IV
ГОСТ Р ИСО 11615-2014
Введение
Настоящий стандарт разработан в связи с широкой мировой потребностью в международной гармонизации описаний лекарственных средств. Он является одним из пяти стандартов, образующих базис уникальной идентификации лекарственных средств. В эту группу стандартов входят:
ISO 11615, Health informatics — Identification of medicinal products — Data elements and structures for the unique identification and exchange of regulated medicinal product information (Информатизация здоровья. Идентификация лекарственных средств. Элементы данных и структуры для уникальной идентификации и обмена информацией о регистрируемых лекарственных средствах):
ISO 11616, Health informatics — Identification of medicinal products — Data elements and structures for the unique identification and exchange of regulated pharmaceutical product information (Информатизация здоровья. Идентификация лекарственных средств. Элементы данных и структуры для уникальной идентификации и обмена информацией о регистрируемых лекарственных препаратах):
ISO 11238, Health informatics — Identification of medicinal products — Data elements and structures for the unique identification and exchange of regulated information on substances (Информатизация здоровья. Идентификация лекарственных средств. Элементы данных и структуры для уникальной идентификации и обмена информацией о регистрируемых фармацевтических субстанциях);
ISO 11239, Health informatics — Identification of medicinal products — Data elements and structures for the unique identification and exchange of regulated information on pharmaceutical dose forms, units of presentation, routes of administration and packaging (Информатизация здоровья. Идентификация лекарственных средств. Элементы данных и структуры для уникальной идентификации и обмена информацией о регистрируемых формах дозировки, единицах представления, способах введения и упаковке):
ISO 11240, Health informatics — Identification of medicinal products — Data elements and structures for the unique identification and exchange of units of measurement (Информатизация здоровья. Идентификация лекарственных средств. Элементы данных и структуры для уникальной идентификации и обмена информацией о единицах измерения).
Эти стандарты идентификации лекарственных средств (IDMP — Identification of Medicinal Products) предназначены для поддержки деятельности органов контроля обращения лекарственных средств во всем мире, включая контроль за исследованием лекарственных средств, регистрацией лекарственных средств, управление их жизненным циклом, а также контроль рисков и фармаконадзор.
Для достижения основных целей контроля обращения лекарственных средств и фармаконадзора необходимо обеспечивать надежный, качественный и согласованный обмен информацией о лекарственных средствах. Поэтому стандарты IDMP регламентируют как минимум следующий обмен данными:
- между органами контроля;
- от фармацевтической фирмы органу контроля;
- от спонсора клинического исследования органу контроля;
- от органа контроля другим участникам обращения лекарственных средств;
- от органа контроля международным источникам данных.
Соответствующие спецификации сообщений, обеспечивающих указанный выше обмен данными, являются составной частью стандартов IDMP.
Уникальные идентификаторы, присвоенные в соответствии со стандартами IDMP, предназначены для использования в тех приложениях, которым необходима надежная идентификация и отслеживание применения лекарственных средств.
Для различных целей и разных условий в стандартах информатизации здоровья, фармации и контроля лекарственных средств используется большое число разных понятий. В настоящем стандарте приведены те термины и определения понятий, которые предназначены для уникальной идентификации регистрируемых лекарственных средств, описания их свойств и передачи соответствующей информации.
Термины и определения, принятые в настоящем стандарте, предназначены для облегчения интерпретации и применения юридических и нормативных требований, но они не должны превалировать над юридически обязывающими документами. В случае сомнения или потенциального конфликта должны применяться термины и определения, принятые в юридически обязывающих документах.
Настоящий стандарт разработан совместное Общей моделью продукции (Common Product Model) организации HL7. Предполагается, что для специфицированного в нем обмена информацией между участниками обращения лекарственных средств будут использоваться сообщения стандарта HL7 V3.
V
В контексте обмена регистрационными данными настоящий стандарт имеет двоякое назначение: -определить элементы и структуры данных, а также отношения между элементами данных, необходимых для уникальной и уверенной идентификации лекарственных средств, предназначенных для лечения человека;
- задать определения терминов, используемых для описания всех элементов данных, необходимых для уникальной и уверенной идентификации лекарственных средств для применения человеком.
Кроме того, для обеспечения успешного обмена сопутствующей информацией в настоящий стандарт включены ссылки, необходимые для использования других стандартов группы ЮМР и стандартов обмена данными.
VI
ГОСТ РИСО 11615—2014
НАЦИОНАЛЬНЫЙ СТАНДАРТ РОССИЙСКОЙ ФЕДЕРАЦИИ
Информатизация здоровья
ИДЕНТИФИКАЦИЯ ЛЕКАРСТВЕННЫХ СРЕДСТВ.
Элементы данных и структуры для уникальной идентификации и обмена информацией о регистрируемых лекарственных средствах
Health informatics. Identification of medicinal products. Data elements and structures for the unique identification and exchange of regulated medicinal product information
Дата введения — 2015—10—01
1 Область применения
В настоящем стандарте описаны определения и понятия, а также элементы данных и их структурные отношения, необходимые для уникальной идентификации и детального описания лекарственных средств.
Стандарты, перечисленные во введении, в своей совокупности представляют собой информационную модель, предназначенную для описания характеристик и уникальной идентификации регистрируемых лекарственных средств для применения человеком в течение всего их жизненного цикла, то есть по мере необходимости от разработки до регистрации, проведения пострегистрационных исследований. обновления или снятия с рынка.
Кроме того, для обеспечения возможности успешного обмена информацией, связанной с уникальной идентификацией и характеристиками лекарственных средств, в настоящем стандарте описан контекст применения других стандартов обмена данными группы IDMP.
2 Нормативные ссылки
Для применения настоящего стандарта необходимы следующие ссылочные документы. Для датированных ссылок применяют только указанное издание ссылочного документа, для недатированных ссылок применяют последнее издание ссылочного документа (включая все его изменения).
ИСО 639-2 Коды для представления названий языков. Часть 2. Трехбуквенный код (ISO 639-2, Codes for the representation of names of languages — Part 2: Alpha-3 code)
ИСО 3166-1 Коды для представления названий стран и единиц их административно-территориального деления. Часть 1. Коды стран (ISO 3166-1, Codes for the representation of names of countries and their subdivisions — Part 1: Country codes)
ИСО 8601 Элементы данных и форматы для обмена информацией. Обмен информацией. Представление дат и времени (ISO 8601, Data elements and interchange formats — Information interchange — Representation of dates and times)
ИСО 11616 (Информатизация здоровья. Идентификация лекарственных средств. Элементы данных и структуры для уникальной идентификации и обмена информацией о регистрируемых лекарственных препаратах (ISO 11616, Health informatics — Identification of medicinal products — Data elements and structures for the unique identification and exchange of regulated pharmaceutical product information)
ИСО 11238 Информатизация здоровья Идентификация лекарственных средств. Элементы данных и структуры для уникальной идентификации и обмена информацией о регистрируемых фармацевтических субстанциях (ISO 11238. Health informatics — Identification of medicinal products — Data elements and structures for the unique identification and exchange of regulated information on substances)
Издание официальное
ИСО 11239 Информатизация здоровья. Идентификация лекарственных средств. Элементы данных и структуры для уникальной идентификации и обмена информацией о регистрируемых формах дозировки, единицах представления, способах введения и упаковке (ISO 11239, Health informatics — Identification of medicinal products — Data elements and structures for the unique identification and exchange of regulated information on pharmaceutical dose forms, units of presentation, routes of administration and packaging)
ИСО 11240 Информатизация здоровья. Идентификация лекарственных средств. Элементы данных и структуры для уникальной идентификации и обмена информацией о единицах измерения (ISO 11240, Health informatics — Identification of medicinal products — Data elements and structures for the unique identification and exchange of units of measurement)
ИСО 21090 Информатизация здоровья. Гармонизированные типы данных для обмена информацией (ISO 21090, Health informatics — Harmonized data types for information interchange)
ИСО/МЭК 5218 Информационные технологии. Коды для представления пола человека (ISO/IEC 5218, Information technology — Codes for the representation of human sexes)
3 Термины, определения и сокращения
3.1 Термины и определения
Для целей настоящего стандарта используются следующие термины и определения.
3.1.1 применяемая дозированная форма (administrable dose form): Применяемая дозированная лекарственная форма, полученная в результате всех необходимых преобразований произведенной дозированной формы.
Примеры — Раствор для инъекций, таблетка для приема внутрь, твердая капсула с порошком для ингаляции.
Примечание — Применяемая дозированная форма идентична произведенной дозированной форме в случаях, когда произведенный продукт не преобразуется (то есть когда он является лекарственным препаратом).
3.1.2 устройство для применения лекарственного средства (administration device): Устройство, предназначенное для правильного применения лекарственного средства
Примеры — Аппликатор, оральный шприц.
Примечание —Устройство для применения может быть принадлежностью первичной упаковки или ее крышки.
(ENV 12610:1997]
3.1.3 аллергены (allergens, materials of concern): Ингредиенты устройства, способные вызвать гиперчувствительность первого типа или аллергическую реакцию у лиц с предрасположенностью к атопии.
Пример— Латекс.
3.1.4 дата разрешения (authorization date): Дата выдачи разрешения на фармацевтическую деятельность уполномоченным органом.
Пример — Дата регистрации лекарственного средства, разрешающей его гражданский оборот.
3.1.5 процедура регистрации лекарственного препарата (authorization procedure, marketing authorization procedure): Формальная процедура, выполняемая уполномоченным органом при регистрации лекарственного средства, внесении изменений в регистрационное досье, подтверждении или отмене регистрации.
Пример — Отмена регистрации в связи с выявлением риска применения лекарственного препарата, превышающего его эффективность.
Примечание — Английские термины authorization procedure и marketing authorization procedure являются синонимами.
3.1.6 состояние регистрации (authorization status): Текущее состояние регистрации лекарственного средства.
2
ГОСТ РИСО 11615—2014
Примеры — Действует, приостановлена, истек срок действия, отменена.
3.1.7 серия (batch): Количество лекарственного средства, произведенное в результате одного технологического цикла его производителем.
3.1.8 номер серии (batch number): Идентификатор, присвоенный в определенный момент времени конкретной серии лекарственного средства, произведенного в результате одного технологического цикла.
3.1.9 характеристика (characteristic): Абстракция свойства объекта.
3.1.10 клиническое испытание (clinical trial), клиническое исследование (clinical study): Изучение лечебных, фармакологических и/или фармакодинамических свойств исследуемого лекарственного препарата в процессе его применения у человека, идентификация нежелательных реакций организма человека на применение лекарственного препарата, изучение процессов всасывания, распределения, изменения и выведения исследуемого лекарственного препарата в целях получения доказательств его безопасности и эффективности.
Примечание — Термины ««клиническое испытание» и «клиническое исследование» являются синонимами.
3.1.11 разрешение на проведение клинического исследования (clinical tnal authonzation): Разрешение на проведение клинического исследования, выдаваемое уполномоченным органом в рамках его юрисдикции.
3.1.12 комбинированная лекарственная дозированная форма (combined pharmaceutical dose form): Единый термин, описывающий два или более произведенных продукта, которые специальным образом комбинируются для получения одного лекарственного препарата. В это описание включается информация о дозированной форме каждого произведенного продукта и о применяемой дозированной форме лекарственного препарата.
Пример — Порошок и его растворитель при изготовлении раствора для инъекций. Лекарственное средство представляет собой два произведенных продукта: растворяемый порошок и его растворитель. Лекарственный препарат, изготовленный из этих двух компонентов, представляет собой инъекционный раствор: комбинированной лекарственной дозированной формой является «порошок и растворитель для инъекционного раствора».
3.1.13 непатентованное наименование лекарственного средства (common name, generic name): Международное непатентованное наименование, рекомендованное Всемирной организацией здравоохранения: если таковое отсутствует, то непатентованное наименование, рекомендованное уполномоченным органом в своей юрисдикции.
[Резолюция 46 Всемирной ассамблеи здравоохранения «WHA46.19 Непатентованные названия для фармацевтических веществ»]
3.1.14 понятие (concept): Единица знания, представленная в словесной форме как совокупность признаков.
3.1.15 упаковка (container): Изделие, являющееся частью лекарственного средства и предназначенное для содержания, идентификации или транспортировки компонентов лекарственного средства.
3.1.16 нормативный словарь (controlled vocabulary): Конечное множество допустимых значений элемента данных.
Примечание — Допустимыми значениями могут быть коды, текст или числа.
[CDISC Clinical Research Glossary V8.0. 2009)
3.1.17 тип данных (datatype): Множество различных значений, характеризуемое их свойствами, и набор операций над этими значениями.
[ISO 11404:2007. определение 3.12]
3.1.18 организация оптовой торговли (distnbutor): Организация, обладающая лицензией на приобретение. хранение, поставку или экспорт лекарственных средств, исключая розничную торговлю.
Примечание — Это определение относится также к поставке лекарственных средств дру1им организациям оптовой торговли.
3.1.19 доза (dose): Определенное количество лекарственного средства, принимаемое однократно или через заданные интервалы времени.
3.1.20 дозированная форма (dose form, dosage form), дозированная лекарственная форма (pharmaceutical dose form): Материальное проявление лекарственного средства, содержащего фармацевтические субстанции и/или вспомогательные вещества, которое должно быть применено к пациенту.
3
ГОСТ Р ИСО 11615-2014
Примечания
1 Дозированная форма и дозированная лекарственная форма являются синонимами.
2 Термин «дозированная лекарственная форма» может примениться как к применяемой дозированной лекарственной форме, так и к произведенной дозированной лекарственной форме.
3.1.21 глобальный номер предмета торговли (Global Trade Item Number1): номер GTIN. присваиваемый международной ассоциацией GS1 и обеспечивающий уникальную идентификацию предметов. подлежащих продаже (например, лекарственных препаратов, медицинских изделий), для применения в цепях поставок.
Примечание — Номер GTIN используется для идентификации любого товара, о котором надо получить заранее подготовленную информацию, и который может иметь определенную цену, быть заказанным или включенным в счет в конкретном звене цепи поставок. Номера GTIN могут состоять из 8. 12.13 или 14 цифр.
3.1.22 идентификатор (identifier, ID): Описание, достаточное для выделения объекта в конкретных условиях.
Примечания
1 В контексте настоящею стандарта идентификатор представляет собой список идентифицирующих характеристик, которые в совокупности однозначно идентифицируют лекарственное средство, лекарственный препарат, фармацевтическую субстанцию, контролируемую субстанцию, путь введения, дозированную лекарственную форму или любой друюй элемент, который необходимо однозначно идентифицировать.
2 Адаптированное определение из стандарта ENV 12610:1997.
3.1.23 первичная упаковка (immediate container, immediate packaging): Упаковка лекарственного средства или препарата, имеющая с ним непосредственный контакт.
Примеры — Ампула, флакон, предварительно заполненный шприц, банка, блистер.
Примечания
1 Первичная упаковка может быть вложена в устройство применения лекарственного средства или в тару либо интегрирована с ними.
2 Роль первичной упаковки может выполняться дозированной лекарственной формой. Примером может служить капсула с порошком для ингаляции. В этом случае капсула не является упаковкой.
3 Альтернативное совместимое определение первичной упаковки ('immediate packaging’) приведено в Директиве 92/27/ЕЕС.
4 Адаптированное определение из стандарта ENV 12610:1997
3.1.24 ингредиент (ingredient): Материал, использованный при изготовлении лекарственного средства или препарата.
Примечание — Ингредиент является составной частью лекарственного средства, сам по себе или в сочетании с другими ингредиентами. Ингредиент является также компонентом лекарственного препарата. Ингредиент эквивалентен детально описанной субстанции; субстанция выполняет роль ингредиента в произведенном продукте.
3.1.25 международное непатентованное наименование, МНН (international non-proprietary name. INN): Официальное непатентованное наименование фармацевтической субстанции, присвоенное Всемирной организацией здравоохранения.
3.1.26 промежуточная упаковка (intermediate packaging): Упаковка между внешней упаковкой и первичной упаковкой.
3.1.27 торговое наименование лекарственного средства (invented name): Торговое наименование лекарственного средства, присвоенное его разработчиком и зарегистрированное органом регистрации в пределах его юрисдикции.
Примечание — Термины «invented пате» и «trade пате» являются синонимами.
3.1.28 исследуемое лекарственное средство (Investigational Medicinal Product): Лекарственная форма активной субстанции или плацебо, используемые в клиническом исследовании. К исследуемым лекарственным средствам относятся также новые комбинации зарегистрированных ранее лекарственных препаратов; лекарственные препараты, произведенные в других лекарственных формах, в новой дозировке; лекарственные препараты, используемые для показаний, не включенных в регистрационное удостоверение; лекарственные препараты, исследуемые в целях получения дополнительной информации.
1 В ИСО 11615—2012 приведено ошибочное наименование «Global Trade Identification Number».
4