ГОСТ Р ИСО 10993-6-2009
Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 6. Исследования местного действия после имплантации
Устанавливает методы исследования местного действия после имплантации материалов, предназначенных для использования в медицинских изделиях. Стандарт применим к следующим материалам: - твердые монолитные и биостабильные; - деградируемые и (или) резорбируемые (рассасывающиеся); - пористые материалы, жидкости, пасты и порошкообразные. Стандарт применим к медицинским изделиям, используемым местно по клиническим показаниям, для оценки реакции окружающих тканей при возможном нарушении целостности изделия.
- Заменяет ГОСТ Р ИСО 10993.6-99 «Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 6. Исследование местного действия после имплантации» ИУС 8-2010
Идентичен ISO 10993-6:2007
Оглавление
1 Область применения
2 Нормативные ссылки
3 Термины и определения
4 Основные положения об имплантационных методах исследования
4.1 Общие сведения
4.2 Подготовка объектов исследования для имплантации
5 Методы исследования, основные аспекты
5.1 Природа тканей в области имплантации образцов
5.2 Вид экспериментального животного
5.3 Продолжительность эксперимента
5.4 Условия хирургического вмешательства и эксперимента
5.5 Оценка результатов
6 Отчет об исследовании
Приложение А (справочное) Общие положения о влиянии сроков имплантации и тканевой реакции на процессы деградации и резорбции материалов
Приложение В (обязательное) Методы имплантации в подкожную ткань
Приложение С (обязательное) Метод имплантации в мышечную ткань
Приложение D (обязательное) Метод имплантации в костную ткань
Приложение Е (справочное) Примеры оценки местного биологического действия материалов после имплантации
Приложение F (справочное) Сведения о соответствии национальных стандартов Российской Федерации ссылочным международным стандартам
Библиография
23 страницы
| Дата введения | 01.09.2010 |
|---|---|
| Добавлен в базу | 01.09.2013 |
| Завершение срока действия | 01.01.2013 |
| Актуализация | 01.01.2021 |
Этот ГОСТ находится в:
- Раздел Экология
- Раздел Электроэнергия
Организации:
| 02.12.2009 | Утвержден | Федеральное агентство по техническому регулированию и метрологии | 543-ст |
|---|---|---|---|
| Разработан | АНО ИМБИИТ | ||
| Издан | Стандартинформ | 2010 г. |
Medical devices. Biological evaluation of medical devices. Part 6. Tests for local effects after implantation
ГОСТ Р ИСО 10993.12-99Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 12. Приготовление проб и стандартные образцы. Заменен на ГОСТ Р ИСО 10993-12-2009.ГОСТ Р ИСО 10993.16-99Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 16. Моделирование и исследование токсикокинетики продуктов деструкции и вымывания. Заменен на ГОСТ Р ИСО 10993-16-2009.ГОСТ Р ИСО 10993.11-99Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 11. Исследование общетоксического действия. Заменен на ГОСТ Р ИСО 10993-11-2009.ГОСТ Р ИСО 10993.1-99Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 1. Оценка и исследования. Заменен на ГОСТ Р ИСО 10993-1-2009.- ГОСТ Р ИСО 10993-2-2009 Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 2. Требования к обращению с животными
- Показать все
Чтобы бесплатно скачать этот документ в формате PDF, поддержите наш сайт и нажмите кнопку:

стр. 1

стр. 2

стр. 3

стр. 4

стр. 5

стр. 6

стр. 7

стр. 8
стр. 9

стр. 10

стр. 11

стр. 12

стр. 13

стр. 14

стр. 15

стр. 16
стр. 17

стр. 18

стр. 19

стр. 20

стр. 21

стр. 22

стр. 23
ГОСТ Р исо
10993-6-
2009
ФЕДЕРАЛЬНОЕ АГЕНТСТВО ПО ТЕХНИЧЕСКОМУ РЕГУЛИРОВАНИЮ И МЕТРОЛОГИИ
НАЦИОНАЛЬНЫЙ
СТАНДАРТ
РОССИЙСКОЙ
ФЕДЕРАЦИИ
ИЗДЕЛИЯ МЕДИЦИНСКИЕ ОЦЕНКА БИОЛОГИЧЕСКОГО ДЕЙСТВИЯ МЕДИЦИНСКИХ ИЗДЕЛИЙ
Часть 6
Исследования местного действия после имплантации
ISO 10993-6:2007
Biological evaluation of medical devices — Part 6: Tests for local effects after
implantation
(IDT)
Издание официальное
Предисловие
Цели и принципы стандартизации в Российской Федерации установлены Федеральным законом от 27 декабря 2002 г. № 184-ФЗ «О техническом регулировании», а правила применения национальных стандартов Российской Федерации — ГОСТ Р 1.0-2004 «Стандартизация в Российской Федерации. Основные положения»
Сведения о стандарте
1 ПОДГОТОВЛЕН Автономной некоммерческой организацией «Институт медико-биологических исследований и технологий» (АНО «ИМБИИТ»)
2 ВНЕСЕН Техническим комитетом по стандартизации ТК 422 «Оценка биологического действия медицинских изделий»
3 УТВЕРЖДЕН И ВВЕДЕН В ДЕЙСТВИЕ Приказом Федерального агентства по техническому регулированию и метрологии от 2 декабря 2009 г. № 543-ст
4 Настоящий стандарт идентичен международному стандарту ИСО 10993-6:2007 «Оценка биологического действия медицинских изделий. Часть 6. Исследования местного действия после имплантации» (ISO 10993-6:2007 «Biological evaluation of medical devices —Part 6: Tests for local effects after implantation»).
При применении настоящего стандарта рекомендуется использовать вместо ссылочных международных стандартов соответствующие им национальные стандарты Российской Федерации, сведения о которых приведены в дополнительном приложении F
5 ВЗАМЕН ГОСТ Р ИСО 10993.6-99
Информация об изменениях к настоящему стандарту публикуется в ежегодно издаваемом информационном указателе «Национальные стандарты», а текст изменений и поправок — в ежемесячно издаваемых информационных указателях «Национальные стандарты». В случае пересмотра (замены) или отмены настоящего стандарта соответствующее уведомление будет опубликовано в ежемесячно издаваемом информационном указателе «Национальные стандарты». Соответствующая информация, уведомление и тексты размещаются также в информационной системе общего пользования — на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет
© Стандартинформ, 2010
Настоящий стандарт не может быть полностью или частично воспроизведен, тиражирован и распространен в качестве официального издания без разрешения Федерального агентства по техническому регулированию и метрологии
Содержание
1 Область применения...........................................
2 Нормативные ссылки...........................................
3 Термины и определения.........................................
4 Основные положения об имплантационных методах исследования..................
4.1 Общие сведения...........................................
4.2 Подготовка объектов исследования для имплантации.......................
5 Методы исследования, основные аспекты...............................
5.1 Природа тканей в области имплантации образцов........................
5.2 Вид экспериментального животного................................
5.3 Продолжительность эксперимента.................................
5.4 Условия хирургического вмешательства и эксперимента.....................
5.5 Оценка результатов.........................................
6 Отчет об исследовании.........................................
Приложение А (справочное) Общие положения о влиянии сроков имплантации и тканевой реакции
на процессы деградации и резорбции материалов....................
Приложение В (обязательное) Методы имплантации в подкожную ткань................
Приложение С (обязательное) Метод имплантации в мышечную ткань................
Приложение D (обязательное) Метод имплантации в костную ткань..................
Приложение Е (справочное) Примеры оценки местного биологического действия материалов после
имплантации........................................
Приложение F (справочное) Сведения о соответствии национальных стандартов Российской
Федерации ссылочным международным стандартам..................
Библиография................................................
Введение
Соблюдение положений стандартов серии ИСО 10993 «Оценка биологического действия медицинских изделий» позволит обеспечить системный подход к исследованию биологического действия медицинских изделий.
Целью этих стандартов не является безусловное закрепление единообразных методов исследований и испытаний за группами однородных медицинских изделий в соответствии с принятой классификацией их по виду и длительности контакта с организмом человека. Поэтому планирование и проведение исследований и испытаний должны осуществлять специалисты, имеющие соответствующую подготовку и опыт в области санитарно-химической, токсикологической и биологической оценок медицинских изделий.
Стандарты серии ИСО 10993 являются руководящими документами для прогнозирования и исследования биологического действия медицинских изделий на стадии выбора материалов, предназначенных для их изготовления, а также для исследований готовых изделий.
В серию ИСО 10993 входят следующие части под общим названием «Оценка биологического действия медицинских изделий»:
Часть 1 — Оценка и исследования;
Часть 2 — Требования к обращению с животными;
Часть 3 — Исследования генотоксичности, канцерогенности и токсического действия на репродуктивную функцию;
Часть 4 — Исследования изделий, взаимодействующих с кровью;
Часть 5 — Исследование на цитотоксичность: методы in vitro;
Часть 6 — Исследования местного действия после имплантации;
Часть 7 — Остаточное содержание этиленоксида после стерилизации;
Часть 9 — Основные принципы идентификации и количественного определения потенциальных продуктов деградации:
Часть 10 — Исследование раздражающего и сенсибилизирующего действия;
Часть 11 — Исследование общетоксического действия;
Часть 12 — Приготовление проб и стандартные образцы;
Часть 13 — Идентификация и количественное определение продуктов деградации полимерных медицинских изделий;
Часть 14 — Идентификация и количественное определение продуктов деградации изделий из керамики;
Часть 15 — Идентификация и количественное определение продуктов деградации изделий из металлов и сплавов:
Часть 16 — Моделирование и исследование токсикокинетики продуктов деградации и вымывания;
Часть 17 — Установление пороговых значений для вымываемых веществ;
Часть 18 — Исследование химических свойств материалов;
Часть 19 — Исследование физико-химических, морфологических и топографических свойств материалов;
Часть 20 — Принципы и методы исследования иммунотоксичесхого действия медицинских изделий.
В настоящем стандарте представлены методы исследования местного действия после имплантации. используемые для оценки материалов и медицинских изделий, в том числе стоматологического назначения, по виду и длительности контакта соответствующих ИСО 10993-1.
Использование методик имплантации in vivo для исследования биологической реакции тканей на изучаемый материал позволяет оценивать такие материалы, которые невозможно оценить, используя другие методы исследования.
При выборе методов исследования изучаемого материала исследователь должен учитывать его предполагаемое применение, а также рекомендации, содержащиеся в ИСО 10993-1.
НАЦИОНАЛЬНЫЙ СТАНДАРТ РОССИЙСКОЙ ФЕДЕРАЦИИ
ИЗДЕЛИЯ МЕДИЦИНСКИЕ ОЦЕНКА БИОЛОГИЧЕСКОГО ДЕЙСТВИЯ МЕДИЦИНСКИХ ИЗДЕЛИЙ
Часть 6
Исследования местного действия после имплантации
Medical devices. Biological evaluation оf medical devices.
Part 6. Tests for local effects after implantation
Дата введения — 2010—09—01
1 Область применения
Настоящий стандарт устанавливает методы исследования местного действия после имплантации материалов, предназначенных для использования в медицинских изделиях.
Настоящий стандарт применим к следующим материалам:
- твердые монолитные и биостабильные:
- деградируемые и (или) резорбируемые (рассасывающиеся);
- пористые материалы, жидкости, пасты и порошкообразные.
Исследуемые образцы имплантируют в участки тела и ткани животного, которые пригодны для оценки биологической безопасности материала. Предлагаемые имплантационные методы не предназначены для оценки механических или функциональных свойств материалов. Настоящий стандарт применим к медицинским изделиям, используемым местно по клиническим показаниям, для оценки реакции окружающих тканей при возможном нарушении целостности изделия.
Местное действие оценивают, сравнивая реакцию ткани, вызванную исследуемым материалом, с аналогичной реакцией для контрольных образов из материалов, используемых в медицинских изделиях. биологическая безопасность и возможность клинического применения которых ранее установлена.
Задачами рассматриваемых методов исследования являются характеристика и динамика реакции тканей после имплантации медицинских изделий/биоматериалов, включая конечный результат процессов интеграции материала в окружающую ткань или его биодеградацию/резорбцию. В частности, для деградируемого/резорбируемого материала должно быть описано влияние процессов деградации на реакцию окружающих тканей.
Настоящий стандарт не касается исследований системной токсичности, канцерогенности. терато-генности или мутагенности. Тем не менее, проведение имплантации образцов в течение длительного периода времени для оценки их местного биологического действия может помочь выявить некоторые из вышеперечисленных отрицательных проявлений общего биологического действия.
2 Нормативные ссылки
В настоящем стандарте использованы нормативные ссылки на следующие стандарты:
ИСО 10993-1:2003 Оценка биологического действия медицинских изделий. Часть 1. Оценка и исследования
ИСО 10993-2 Оценка биологичесхого действия медицинских изделий. Часть 2. Требования к обращению с животными
ИСО 10993-11 Оценка биологического действия медицинских изделий. Часть 11. Исследования общетоксического действия
ИСО 10993-12 Оценка биологического действия медицинских изделий. Часть 12. Приготовление проб и стандартные образцы
Издание официальное
ИСО 10993-16 Оценка биологического действия медицинских изделий. Часть 16. Моделирование и исследование токсикокинетики продуктов деградации и вымывания
3 Термины и определения
В настоящем стандарте применены термины по ИСО 10993-1, ИСО 10993-2, ИСО 10993-12, ИСО 10993-16, а также следующие термины с соответствующими определениями:
3.1 деградация: Разрушение материала.
[ИСО 10993-9, подраздел 3.1)
3.2 продукты деградации: Продукты деградации материала, которые образовываются в результате разрыва химических связей или разрушения материала.
[ИСО 10993-16, подраздел 3.1)
3.3 биоматериал: Материал, контактирующий с биологическими средами живого организма при проведении исследований, лечении, восстановлении или замещении функций тканей или органов.
4 Основные положения об имплантационных методах исследования
4.1 Общие сведения
Важно детально планировать условия проведения исследований, чтобы полученные данные были сопоставимы для всех проведенных экспериментов и для каждого животного (см. ИСО 10993-2, ИСО 10993-11 и ИСО 10993-16).
Все исследования на животных должны проводиться в помещениях, разрешенных для этих целей компетентными национальными учреждениями и соответствующих требованиям обращения с лабораторными животными. Эти исследования должны соответствовать международным стандартам проведения лабораторных исследований или другим известным системам контроля качества, соответствующим требованиям ИСО 10993-2.
Условия этого подраздела прилагаются к методам исследований, изложенным в приложениях В, С
hD.
4.2 Подготовка объектов исследования для имплантации
Исследуемые и контрольные образцы готовят к исследованию в соответствии с ИСО 10993-12. Место имплантации и форму образца обосновывают и вносят в отчет. Виды образцов для имплантации в разные ткани описаны в приложениях В. С и D. Физико-химические характеристики имплантируемых образов (такие как форма, плотность, твердость, свойства поверхности), влияющие на характер тканевого ответа, должны быть документированы и учтены при анализе полученных результатов.
Каждый имплантируемый образец должен быть изготовлен, очищен и подвергнут стерилизационной обработке в соответствии с технологией, используемой для конечного изделия, что отмечают в документации. После окончательной подготовки и стерилизации с имплантатами работают с особой осторожностью в асептических условиях для того, чтобы не допустить повреждение или контаминацию до или во время имплантации.
Материалы, используемые как матриксы (каркасы) для медицинской продукции в тканевой инженерии, не следует исследовать вместе с популяциями клеток, так как иммунная реакция клеток животного на клеточную составляющую такой продукции и реакция самих клеток при введении их животному могут мешать исследованию местной реакции ткани.
Компоненты композитных материалов (например, пломбировочных материалов и стоматологических цементов) можно смешивать и оставлять отверждаться до имплантации. Однако материалы, которые используются в изделиях после их полимеризации in situ, должны также использоваться при введении в место имплантации. Для исследования конкретного вида возможно использование особой процедуры подготовки образцов. Процедура подготовки образцов должна быть обоснована и документирована.
Немонолитные образцы, включая порошки, для исследования их местного действия после имплантации могут находиться в трубках, открытых с двух концов (см. ИСО 10993-12, перечень материалов для исследования их в трубках). Исследуемый образец готовят в соответствии с инструкциями изготовителя и наполняют им трубку до верхнего края с особой осторожностью, чтобы исследуемый материал не попал на внешнюю поверхность трубки. Если контакт исследуемого материала с внешней поверхностью трубки произошел, то данный образец не имплантируют. Не допускается попадание воздуха в трубку. На поверхности исследуемого материала на концах трубки, а также на концах самой трубки не должно быть шероховатостей.
Примечание 1 — Общепринято использовать трубки из полиэтилена (ПЭ). полипропилена (ПП) или политетрафторэтилена (ПТФЭ). Трубки из ПЭ могут деформироваться при автоклавировании. Трубки изПТФЭ плохо поддаются разрезанию с помощью микротома, поэтому их заменяют трубками из ПЭ или ПП тех же размеров в случаях. когда трубки оставляют в блоках ткани для приготовления гистологических срезов.
Местную реакцию тканей, вызванную исследуемым материалом, оценивают в сравнении с реакцией для сходных контрольных образов из материалов, используемых в медицинских изделиях, биологическая безопасность и возможность клинического применения которых установлена.
Примечание 2 — Для дальнейших действий см. ИСО 10993-12.
Физико-химические свойства, такие как размеры, форма и. особенно, состояние поверхности контрольного и исследуемого образцов, должны быть, по возможности, одинаковыми. Разница в свойствах контрольного и исследуемого образцов должна быть обоснована и документирована. Если исследуемый материал заключен в трубку, то контрольный образец должен быть изготовлен из того же материала. что и трубка, диаметром, равным внешнему диаметру трубки. Выбор контрольного образца в виде трубки или стержня должен быть обоснован и документирован.
5 Методы исследования, основные аспекты
5.1 Природа тканей в области имплантации образцов
Исследуемый образец имплантируется в ткань, наиболее отвечающую области клинического применения материала. Должны быть обоснованы и документированы число образцов, вид ткани в зоне имплантации и место имплантации. Перечень методов исследований для различных мест имплантации приведен в приложениях В. С и D. Если выбраны другие места имплантации, то необходимо придерживаться основных научных положений для методов, изложенных в приложениях В. С и D. а также обосновать данный выбор.
Примечание 1 — Используемые методы для некоторых специфических стоматологических изделий см. в ИСО 7405.
Для биодеградируемых/биорезорбируемых материалов место имплантации и окончания эксперимента отмечают удобным для идентификации способом. Рекомендуется использовать устойчивый и нетравматичный способ маркировки кожи или (и) маркировочный шаблон на месте имплантации образца. В некоторых случаях может быть использован отрицательный контрольный образец как маркер места имплантации. В исключительных случаях возможно проведение хирургической операции без имплантации образца, чтобы оценить влияние самой процедуры на реакцию тканей, что должно быть обосновано.
Примечание 2 — В качестве маркеров для обозначения мест имплантации биорезорбируемых образцов могут быть использованы нерассасывающиеся шовные нити или красители кожи.
5.2 Вид экспериментального животного
Все аспекты ухода за животными и их содержанием должны соответствовать положениям ИСО 10993-2. Как правило, предпочтительнее мелкие лабораторные животные, такие как мыши, крысы, хомяки и кролики.
Применение крупных животных возможно при исследовании некоторых биоматериалов, но это требует научного обоснования.
При выборе вида лабораторных животных в соответствии с положениями ИСО 10993-2 учитывают размеры имплантируемых образцов, число имплантатов на одно животное, предполагаемую длительность эксперимента с учетом продолжительности жизни животного, а также потенциально возможные различия биологической реакции твердых и мягких тканей на имплантацию материала.
Кратковременные исследования обычно проводят на мелких грызунах или кроликах. Для длительных экспериментов используют мелких грызунов, кроликов, собак, овец. коз. свиней и других подходящих животных с относительно большой продолжительностью жизни.
Перед началом исследований деградирующих материалов на животных необходимо рассмотреть имеющуюся информацию по деградации материалов в условиях in vitro. Для деградирующих материалов перед началом исследования на крупных животных должно быть предусмотрено проведение предварительных экспериментов на грызунах для предварительной оценки скорости деградации образца.
Образцы исследуемого и контрольного материалов имплантируют в одинаковых условиях животным одного вида, одного возраста, пола и породы в соответствующие анатомические участки. Число и размеры образцов, имплантируемых каждому животному, зависят от размера животного и анатомичес-
3
кого положения имплантата. При возможности образцы исследуемого и контрольного материалов должны быть имплантированы одному животному.
5.3 Продолжительность эксперимента
При выборе длительности имплантации образца следует исходить либо из времени его функционирования в клинической практике, либо эксперимент должен продолжаться до или после достижения устойчивой фазы биологической реакции.
Для биостабильных материалов время кратковременной имплантации в норме составляет от 1 до 4 недель, продолжительность длительных экспериментов превышает 12 недель. Местная биологическая реакция тканей на имплантируемый материал зависит как от свойств материала, так и от травмы, вызванной хирургическим вмешательством. Конфигурация ткани вокруг имплантата изменяется за время. прошедшее после имплантации. В течение первых двух недель после имплантации реакция тканей обусловлена самой процедурой хирургического вмешательства, которую трудно отделить от реакции на имплантируемый материал. В мышечной и соединительной тканях, в зависимости от вида животных и сложности хирургической операции, устойчивая фаза относительно популяции клеток наблюдается через 9 — 12 недель после имплантации. Имплантация в костную ткань может потребовать более длительных периодов наблюдения.
Длительность исследования имплантируемых деградируемых/резорбируемых образцов зависит от времени/скорости их деградации. В приложении А приведена основная информация для такого вида материалов. Перед началом исследований деградируемых материалов на животных и выбором продолжительности эксперимента необходимо оценить время деградации образца. Это может быть проведено в условиях in vitro в реальном масштабе времени, при ускоренных испытаниях или. в некоторых случаях, рассчитано с помощью математического моделирования.
Местную реакцию тканей оценивают для нескольких стадий (фаз) процесса деструкции имплантатов:
- фаза отсутствия или минимальной деградации образца, как правило, от 1 до 12 недель после его имплантации:
- фаза обнаружения достоверной деградации образца:
- фаза достижения устойчивой биологической реакции, связанной либо с восстановлением нормальной структуры тканей, либо с полной деградацией образца.
При отсутствии полной деградации/рассасывания образцов или восстановлении нормальной структуры и функции тканей необходимо получение дополнительных данных, позволяющих характеризовать местную реакцию тканей после имплантации.
Примечание — При проведении экспериментов в условиях in vivo необходимы продолжи тел ьные исследования. иногда более 1 года. Может потребоваться дополнительное число животных для увеличения сроков имплантации в случаях, когда процесс деградации образца не завершился в ожидаемый исследователями период времени.
Несмотря на то что настоящий стандарт не включает в себя вопросы системной токсичности, рассматриваемые в ИСО 10993-11. рекомендуется учитывать информацию, получаемую при проведении исследований настоящего стандарта, относящуюся к системной токсичности.
По окончании каждой стадии эксперимента животных умерщвляют, руководствуясь положениями ИСО 10993-2. В некоторых специальных случаях можно использовать общую анестезию для извлечения образов, что должно быть обосновано и документировано.
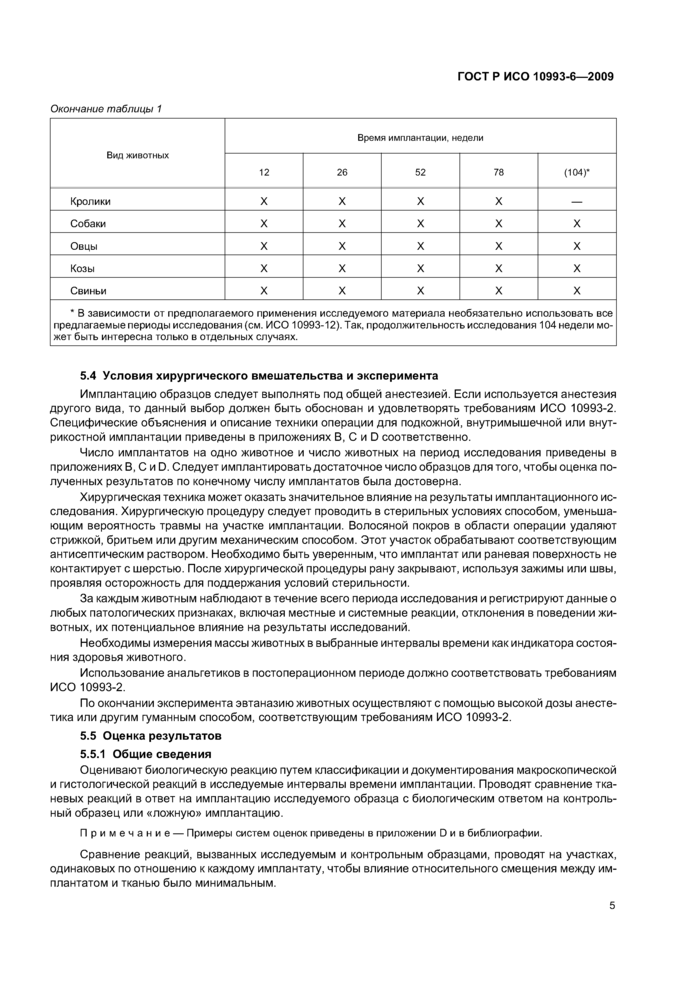
Продолжительность исследования при длительной имплантации в зависимости от вида животного приведена в таблице 1.
|
Таблица 1 — Выбор продолжи тельное ги имплантации при длительных исследованиях | |||||||||||||||||||||||
| |||||||||||||||||||||||
|
4 | |||||||||||||||||||||||
|
Окончание таблицы 1 | |||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||
|
* В зависимости от предполагаемого применения исследуемого материала необязательно использовать все предлагаемые периоды исследования (см. ИСО 10993-12). Так. продолжительность исследования 104 недели может быть интересна только в отдельных случаях. | |||||||||||||||||||||||||||||||||||||||||
5.4 Условия хирургического вмешательства и эксперимента
Имплантацию образцов следует выполнять под общей анестезией. Если используется анестезия другого вида, то данный выбор должен быть обоснован и удовлетворять требованиям ИСО 10993-2. Специфические объяснения и описание техники операции для подкожной, внутримышечной или внутрикостной имплантации приведены в приложениях В. С и D соответственно.
Число имплантатов на одно животное и число животных на период исследования приведены в приложениях В. С и D. Следует имплантировать достаточное число образцов для того, чтобы оценка полученных результатов по конечному числу имплантатов была достоверна.
Хирургическая техника может оказать значительное влияние на результаты имплантационного исследования. Хирургическую процедуру следует проводить в стерильных условиях способом, уменьшающим вероятность травмы на участке имплантации. Волосяной покров в области операции удаляют стрижкой, бритьем или другим механическим способом. Этот участок обрабатывают соответствующим антисептическим раствором. Необходимо быть уверенным, что имплантат или раневая поверхность не контактирует с шерстью. После хирургической процедуры рану закрывают, используя зажимы или швы. проявляя осторожность для поддержания условий стерильности.
За каждым животным наблюдают в течение всего периода исследования и регистрируют данные о любых патологических признаках, включая местные и системные реакции, отклонения в поведении животных. их потенциальное влияние на результаты исследований.
Необходимы измерения массы животных в выбранные интервалы времени как индикатора состояния здоровья животного.
Использование анальгетиков в постоперационном периоде должно соответствовать требованиям ИСО 10993-2.
По окончании эксперимента эвтаназию животных осуществляют с помощью высокой дозы анестетика или другим гуманным способом, соответствующим требованиям ИСО 10993-2.
5.5 Оценка результатов
5.5.1 Общие сведения
Оценивают биологическую реакцию путем классификации и документирования макроскопической и гистологической реакций в исследуемые интервалы времени имплантации. Проводят сравнение тканевых реакций в ответ на имплантацию исследуемого образца с биологическим ответом на контрольный образец или «ложную» имплантацию.
Примечание — Примеры систем оценок приведены в приложении D и в библиографии.
Сравнение реакций, вызванных исследуемым и контрольным образцами, проводят на участках, одинаковых по отношению к каждому имплантату, чтобы влияние относительного смещения между имплантатом и тканью было минимальным.
5
Для образцов цилиндрической формы выбирают их среднюю часть. Для имплантатов цилиндрической формы с прорезями — центральные части между прорезями, а также между плоскими поверхностями имплантата.
При окончании каждого исследования число образцов, необходимых для дальнейших исследований, должно соответствовать требованиям приложений В. С и D. Образцы для анализа должны быть получены. по крайней мере, от трех животных.
5.5.2 Макроскопическое исследование
Исследуют возможные изменения нормальной структуры ткани каждого участка имплантации с помощью оптической линзы. Оценивают также состояние региональных лимфатических узлов ТИпеу (32]. Регистрируют вид и степень проявления обнаруженных реакций ткани, такие как гематомы, отеки, образование рубцов и (или) другие выраженные отклонения. Отмечают наличие, форму и локализацию имплантата, включая возможные остатки деградируемого материала. Для документирования необходимо фотографировать места имплантации.
В дополнение к осмотру участков имплантации следует обратить внимание на состояние здоровья животного или его реакцию на имплантат, для полного анализа проводят вскрытие трупа.
5.5.3 Извлечение имплантата и подготовка образцов тканей
После гуманной эвтаназии животного вырезают имплантат вместе с достаточным количеством окружающей его ткани для оценки местной тканевой реакции. Если имплантируемый образец невозможно обнаружить (деградируемый/резорбируемый материал), то образец нормальной ткани вырезают вокруг отмеченного места имплантации на расстоянии нескольких миллиметров. При исследовании биостабильных имплантатов необходимо осуществить забор лимфатических узлов, служащих индикаторами патологических процессов. При исследовании биодеградируемых имплантатов также необходим забор лимфатических узлов для возможного обнаружения в них продуктов деструкции материалов.
Примечание — Необходимо заметить, что у некоторых видов животных не всегда удается обнаружить лимфатические узлы.
При обнаружении отклонений в здоровье животного, выраженных патологических процессов или в случае, если протоколом эксперимента предусмотрена оценка системной токсичности, возможен забор других внутренних органов.
Для проведения гистологических исследований вырезанные участки ткани обрабатывают по принятой стандартной схеме: фиксация, размельчение, приготовление блоков, изготовление срезов и их окраска. В отчет записывают расположение имплантата, число срезов и их форму.
При использовании традиционных методик выделенный образец ткани с имплантатом вскрывают до или после обработки консервантом и регистрируют в отчете состояние поверхности имплантата и окружающих его тканей. Необходимо соблюдать особую осторожность, чтобы не повредить ткани, прилежащие к поверхности имплантата.
При исследовании поверхности раздела имплантата и ткани предпочтительно применять твердый пластик для формирования блоков образца ткани с имплантатом in situ. Для приготовления гистологических срезов используют соответствующие методики.
Необходимо продемонстрировать, что методика подготовки блоков с использованием пластика не вызывает значительных изменений структуры ткани, прилегающей к поверхности имплантата.
Примечани е — Для «мягких» имплантатов в мягких тканях подготовку образцов для гистологического анализа следует проводить без удаления имплантата.
5.5.4 Микроскопические исследования
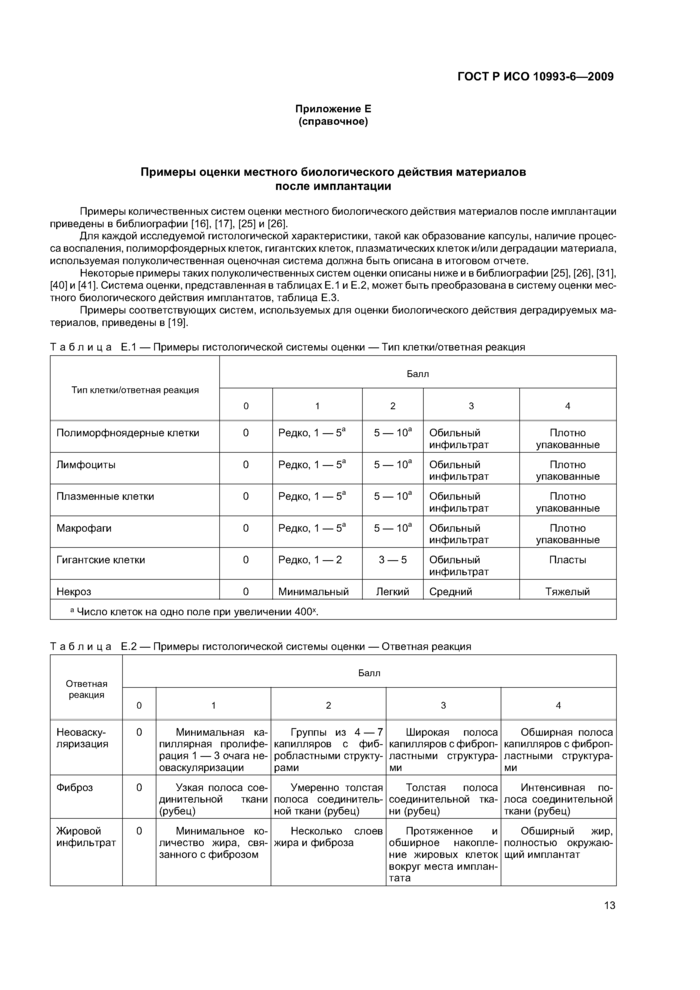
Система баллов, применяемая для оценки гистологических исследований, должна учитывать степень местной реакции ткани по области ее распространения либо количественно (например, в микрометрах). либо полуколичественно (см. приложение Е). Регистрируют ориентацию имплантата в срезе, число срезов и геометрию среза.
Оценивают и регистрируют следующие параметры биологической реакции:
- степень фиброзаУтолщину фиброзной капсулы (в микрометрах) и воспаления;
- дегенерацию, определяемую изменениями в морфологии ткани;
- число и распределение клеток, характеризующих воспалительный процесс в срезах ткани, таких как полиморфоядерные нейтрофилы, лимфоциты, плазматические клетки, эозинофилы, макрофаги и многоядерные клетки, в зависимости от расстояния от границы раздела имплантат/ткань;
- наличие, степень и тип некроза ткани;
6