“УТВЕРЖДАЮ”
Генеральный директор ООО “Слектр-М”
В.В. Додонов
ОПРЕДЕЛЕНИЯ ТОКСИЧНОСТИ ПРОБ ПОЧВ, ДОННЫХ ОТЛОЖЕНИЙ И ОСАДКОВ СТОЧНЫХ ВОД ЭКСПРЕСС - МЕТОДОМ С ПРИМЕНЕНИЕМ ПРИБОРА СЕРИИ «БИОТЕСТЕР»
ФР. 1.39.2015.19243
(взамен ФР.1.31.2005.01 882(ред. 2010 г.)
ТОКСИКОЛОГИЧЕСКИЕ МЕТОДЫ КОНТРОЛЯ
МЕТОДИКА
ОПРЕДЕЛЕНИЯ ТОКСИЧНОСТИ ПРОБ ПОЧВ, ДОННЫХ ОТЛОЖЕНИЙ И ОСАДКОВ СТОЧНЫХ ВОД ЭКСПРЕСС - МЕТОДОМ С ПРИМЕНЕНИЕМ ПРИБОРА СЕРИИ «БИОТЕСТЕР»
ПНДФТ 16.2:2.2-98 (ред.2015г.)2015
2
Право тиражирования и реализации принадлежит разработчику.
Настоящее издание методики введено взамен предыдущего издания 2010 г. и действует до выхода нового издания.
Разработчик: ООО ‘"Спектр-М”
Адрес: 191167, г. Санкт-Петербург, а/я 86
т/факс (812) 232-39-42 E-mail - info@biotester.ru
3
СОДЕРЖАНИЕ
НАЗНАЧЕНИЕ И ОБЛАСТЬ ПРИМЕНЕНИЯ.................................................5
1. ПРИНЦИП МЕТОДА.....................................................................................5
2. МЕТРОЛОГИЧЕСКИЕ ХАРАКТЕРИСТИКИ МЕТОДИКИ......................6
3. СРЕДСТВА ИЗМЕРЕНИЙ, ВСПОМОГАТЕЛЬНЫЕ УСТРОЙСТВА,
ПОСУДА, РЕАКТИВЫ, МАТЕРИАЛЫ...........................................................7
4. УСЛОВИЯ БЕЗОПАСНОГО ПРОВЕДЕНИЯ РАБОТ................................8
5. ТРЕБОВАНИЯ К КВАЛИФИКАЦИИ ОПЕРАТОРОВ...............................9
6. УСЛОВИЯ ВЫПОЛНЕНИЯ ИЗМЕРЕНИЙ.................................................9
7. ПОДГОТОВКА К ВЫПОЛНЕНИЮ ИЗМЕРЕНИЯ...................................9
8. ПРОВЕДЕНИЕ АНАЛИЗА.........................................................................11
9. ОБРАБОТКА И ОФОРМЛЕНИЕ РЕЗУЛЬТАТОВ....................................13
10. ОЦЕНКА ПРИЕМЛЕМОСТИ РЕЗУЛЬТАТОВ ИЗМЕРЕНИЙ..............13
ПРИЛОЖЕНИЕ А (справочное).....................................................................15
ХАРАКТЕРИСТИКА ТЕСТ-ОБЪЕКТА.........................................................15
ПРИЛОЖЕНИЕ Б (обязательное)...................................................................16
ВЫРАЩИВАНИЕ КУЛЬТУРЫ.......................................................................16
ПРИЛОЖЕНИЕ В (обязательное)..................................................................18
ПОДГОТОВКА ИНФУЗОРИЙ К АНАЛИЗУ................................................18
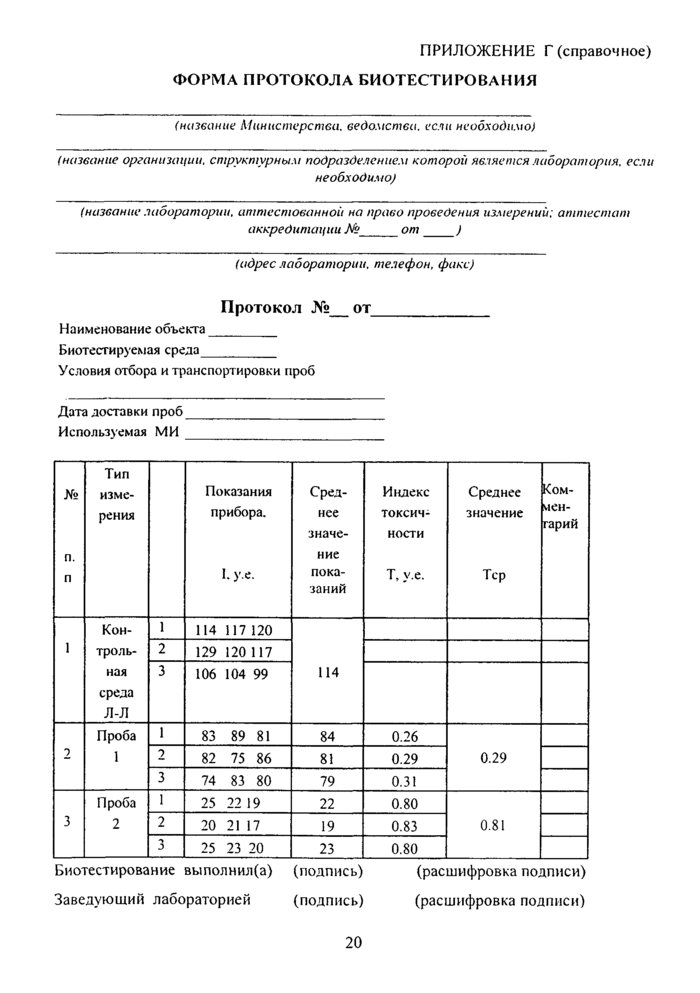
ПРИЛОЖЕНИЕ Г (справочное)......................................................................20
ФОРМА ПРОТОКОЛА БИОТЕСТИРОВАНИЯ............................................20
4
НАЗНАЧЕНИЕ И ОБЛАСТЬ ПРИМЕНЕНИЯ
Настоящий документ устанавливает методику определения токсичности водных вытяжек из почвы, донных отложений, осадков сточных вод с использованием в качестве тест-объекта инфузорий •— Paramecium caudatum (в дальнейшем инфузории).
Параметры поведенческой реакции инфузорий определяются с помощью приборов серии “Биотестер” (Биотестер, Биотестер-2, Биотес гср-2м, Биотестер-С и др.)
1. ПРИНЦИП МЕТОДА
1.1. Метод определения токсичности основан на способности тест-объекта реагировать на присутствие в водных вытяжках из почвы, донных отложений и осадков сточных вод веществ, представляющих опасность для их жизнедеятельности, и направленно перемещаться по градиенту концентраций (в направлении изменения концентрации) этих веществ (хемотаксическая реакция), избегая их вредного воздействия.
Хемотаксическая реакция реализуется при условии наличия стабильного во времени градиента концентраций химических веществ. Подобный градиент создается путем наслоения в вертикальной кювете (пробирке) на взвесь инфузорий в загустителе испытуемой жидкости (см. п. 8.1). При этом в измерительной кювете образуется стабильная граница раздела, сохраняемая в течение всего времени биотестирования. Эта граница не препятствует свободному перемещению инфузорий в предпочтительном для них направлении и при этом предотвращает перемешивание жидкостей из нижней и верхней зон. После создания в кювете двух зон в течение 30 минут происходит перераспределение инфузорий по зонам. Важная особенность поведенческой реакции инфузорий — массовое перемещение организмов в верхние слои жидкости. В случае, если анализируемая проба не содержит токсических веществ, в кювете будет наблюдаться концентрирование клеток инфузорий в верхней зоне. Наличие в анализируемой пробе токсических веществ приводит к иному характеру перераспределения инфузорий в кювете, а именно: чем выше токсичность пробы, тем меньшая доля инфузорий перемещается в верхнюю зону (анализируемую пробу).
1.2. Критерием токсического действия является значимое различие в числе клеток инфузорий, наблюдаемых в верхней зоне кюветы в пробе, не содержащей токсических веществ - (контроль), по сравнению с этим показателем, наблюдаемым в анализируемой пробе — (опыт).
1.3. Количественная оценка параметра тест-реакции, характеризующего токсическое действие, производится путем расчета соотношения числа клеток инфузорий, наблюдаемых в контрольной и анализируемой пробах
(согласно п. 9.1), и выражается в виде безразмерной величины — индекса токсичности (Т).
2. МЕТРОЛОГИЧЕСКИЕ ХАРАКТЕРИСТИКИ МЕТОДИКИ
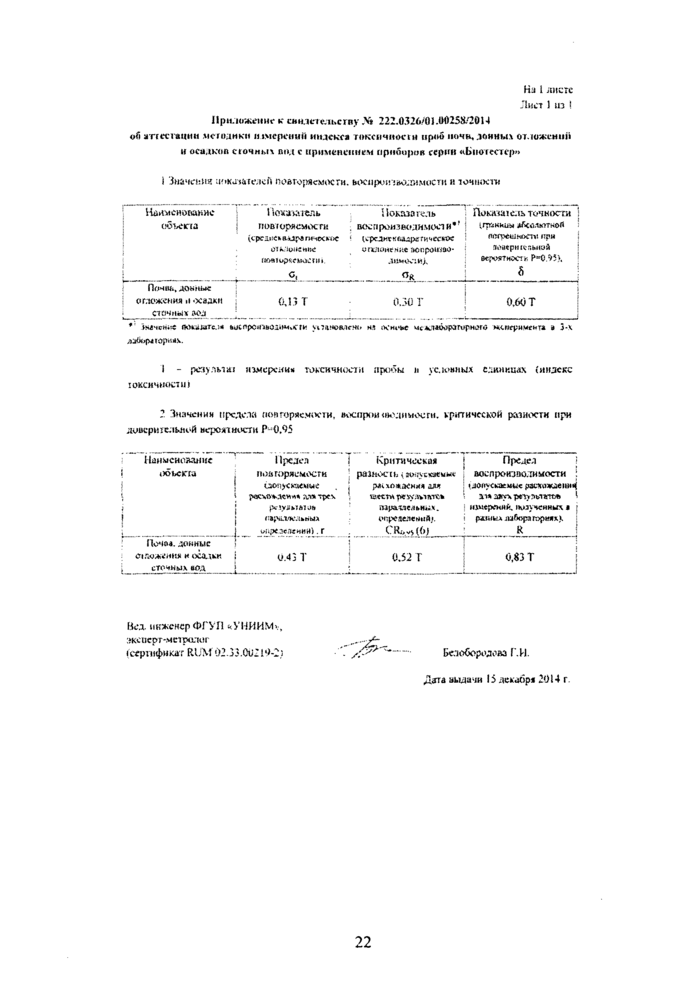
2.1. Методика обеспечивает получение результатов с погрешностью, не превышающей значений, приведенных в таблице 1.
Таблица 1
|
Наименова
ние
объекта |
Показатель
повторяемости
(среднее
квадратическое
отклонение
повторяемости). |
Показатель
воспроиз
водимости
(среднее
квадратическое
отклонение
воспро
изводимости),
CTR |
Показатель точности (границы абсолютной погрешности при доверительной вероятности Р = 0, 95),
5 |
|
Почва,
донные
отложения,
осадки
сточных
вод |
0,13 Т |
0,30 Т |
0,60 т |
Т - результат определения (измерения) токсичности пробы в условных единицах (индекс токсичности).
2.2. За результат токсикологического анализа (Т) принимают среднее арифметическое значение результатов 3-х параллельных определений, расхождение между которыми не превосходит значений норматива оперативного контроля повторяемости (г), приведенных в таблице 2.
2.3. Расхождения между результатами токсикологического анализа, полученными в двух лабораториях, не должно превышать предела воспроизводимости (R). При выполнении этого условия приемлемы оба результата, и в качестве окончательного может быть использовано их общее среднее значение. Значения предела воспроизводимости (R) приведены в таблице 2.
При превышении предела воспроизводимости могут быть использованы методы оценки приемлемости согласно раздела 5 ГОСТ Р ИСО 5725-6-2002.
6
|
Значения предела повторяемости.
Таблица 2
воспроизводимости, критической |
|
Предел повторяемости (допускаемые расхождения для трех результатов параллельных определений),
Г |
Критическая разность (допускаемые расхождения для шести результатов параллельных определений),
CRo.95 (6) |
Предел воспроизводимости (допускаемые расхождения для двух результатов измерений, полученные в разных лабораториях),
R |
|
0,43 Т |
0,52 Т |
0,83 Т |
|
2.4. Качество тест-культуры определяется следующими показателями:
— порог чувствительности к модельному токсиканту (CuS04x5H;>C)) — 0,01 мг/дм3;
— диапазон реагирования на модельный токсикант находится в пределах 0,01-1,0 мг/дм3.
3. СРЕДСТВА ИЗМЕРЕНИЙ, ВСПОМОГАТЕЛЬНЫЕ УСТРОЙСТВА, ПОСУДА, РЕАКТИВЫ, МАТЕРИАЛЫ
— прибор серии «Биотестер», например, Биотестер-2м (№46149-10 в Государственном реестре средств измерений);
— весы лабораторные II класса точности, предел взвешивания Ю0г, дискретность отсчета 1 мг по ГОСТ Р 53228;
— весы лабораторные IIII класса точности, предел взвешивания 1200г, дискретность отсчета 1г по ГОСТ Р 53228;
— микроскоп бинокулярный с увеличением 10-5-50;
— термометр жидкостный стеклянный 0-50°С с ценой деления шкалы 1°С по ГОСТ 28498;
— часы сигнальные;
— пипетки вместимостью 1, 2, 5, 10 см3 тип 3 по ГОСТ 29228;
— колбы мерные 2-25-2; 2-50-2; 2-100-2; 2-500-2; 2-1000-2 по ГОСТ 1770;
— цилиндры 3-100-2, 3-250-2 по ГОСТ 1770;
— аппарат для встряхивания жидкости в лабораторной посуде АВУ-1 ТУ 64-1-1081;
— баня водяная объемом воды от 1 л, точность установки температуры 5°С, температуры воды от 80°С;
— ступка 6, пестик 3 по ГОСТ 9147;
— холодильник бытовой, обеспечивающий поддержание температуры
7
(8 ± 4)°C;
— мельница шаровая лабораторная барабанная МШЛ-1П(С) по ТУ 4846-042-11114244-2010;
— шпатели металлические но ГОСТ 19126;
— посуда для культивирования из химически инертного материала, например, химические стаканы, стаканчики для взвешивания, конические широкогорлые колбы, чашки Петри по ГОС!' 25336;
— лабораторные стаканы Н-2-100; В-2-100 по ГОСТ 25336;
— банки широкогорлые из стекла с притертыми или винтовыми пробками вместимостью 500-1000 см3 для отбора и хранения проб;
— вода дистиллированная по ГОСТ 6709;
— натрий хлористый по ГОСТ 4233;
— калий хлористый по ГОСТ 4234;
— кальций хлористый 2-водный;
— магний сернокислый 7-водный по ГОСТ 4523;
— натрий углекислый кислый по ГОСТ 4201;
— медь сернокислая (II) 5-водная по ГОСТ 4165;
— поливиниловый спирт ПВС — марка 11/2, высший сорт по ГОСТ 10779;
— фильтры бумажные обеззоленные (красная, белая ленты) по ТУ 6-09-1678;
— дрожжи хлебопекарные прессованные по ГОСТ 54731.
Все используемые реактивы должны быть марки х.ч. или ч.д.а.
Возможно применение иных средств измерения, вспомогательного
оборудования, технических средств, посуды, и реактивов с характеристиками не хуже, чем у вышеуказанных.
4. УСЛОВИЯ БЕЗОПАСНОГО ПРОВЕДЕНИЯ РАБОТ
4.1. Требования электробезопасности при работе с электроустановками соответствуют ГОСТ 12.1.019.
4.2. Специалисты, выполняющие анализы, должны пройти обучение безопасности труда по ГОСТ 12.0.004.
4.3. Помещение лаборатории должно соответствовать требованиям пожарной безопасности по ГОСТ 12.1.004 и иметь средства пожаротушения по ГОСТ 12.4.009.
4.4. Специальных мер по охране окружающей среды при использовании приборов серии «Биотестер» не требуется, так как составляющие нс содержат ртути и других материалов, опасных для человека и окружающей среды при хранении, транспортировке и использовании прибора. Инфузории-туфельки не имеют форм, опасных для человека и окружающей среды.
8
4.5. При работе с химическими веществами соблюдают требования безопасности по ГОСТ 12.1.007 и методические рекомендации ПИЛ Ф
12.13.1.
4.6. При пробоподготовке загрязненных грунтов, почв, осадков сточных вол пользуются средствами индивидуальной защиты по ГОСТ 12.4.016, ГОСТ 12.4.020.
5. ТРЕБОВАНИЯ К КВАЛИФИКАЦИИ ОПЕРАТОРОВ
Определение токсичности по настоящей методике выполняет лаборант со средним профессиональным образованием, имеющий опыт работы не менее 1 года в химико-аналитической, биологической или близкой по профилю лаборатории.
6. УСЛОВИЯ ВЫПОЛНЕНИЯ ИЗМЕРЕНИЙ
(+ 15 -*■ +28)°С; не более 80% (при 25°С); (84- 106,7)кПа (630 - 800)мм рт.ст.; (220 ± 22) В;
(50 ± 1)Гц.
Помещение не должно содержать токсичных паров и газов. Измерения проводят в следующих условиях:
Температура окружающего воздуха Относительная влажность воздуха Атмосферное давление
Напряжение питающей сети Частота питающей сети
7. ПОДГОТОВКА К ВЫПОЛНЕНИЮ ИЗМЕРЕНИЯ
7.1. Отбор и хранение проб Общие процедуры отбора проб определены в следующих документах: ГОСТ 17.4.3.01-83 "Охрана природы. Почвы. Общие требования к отбору проб”
ГОСТ 17.4.4.02-84 “Охрана природы. Почвы. Методы отбора и подготовки проб для химического, бактериологического, гельминтологического анализа”
ГОСТ 17.1.5.01-80 “Охрана природы. Гидросфера. Общие требования к отбору проб донных отложений водных объектов для анализа на загрязненность”
ПНД Ф 12.1:2:2.2:2.3:3.2-03 "Отбор проб почв, грунтов, донных отложений, илов, осадков сточных вод, шламов промышленных сточных вод, отходов производства и потребления”
Пробы почв, донных отложений, осадков сточных вод. поступившие в лабораторию на исследование, должны быть документально оформлены и маркированы. Сопроводительными документами являются описание проб, даты и времени отбора. Маркировка проб осуществляется в произвольной форме, но с обязательным занесением обозначений в лабораторный журнал.
Хранить пробу можно в холодильнике при температуре (8±4)°С не более одной недели в банке с притертой или плотно завинченной крышкой.
7.2. Подготовка пробы
Донные отложения, почвы, осадки массой не менее I кг помещают в чистую сухую посуду, высушивают до воздушно-сухого состояния, разрыхляют и перемешивают металлическим шпателем. Выбирают произвольными порциями, но нс более 100 г каждая с промежуточным перемешиванием, массу не менее 0,5 кг. помещают в фарфоровую ступку и размельчают вручную до размеров фракций не более 10 мм. Измельчение пробы в ступке допускается удобными для оператора порциями. Неизмельчаемые фракции более 10 мм удаляют, оставшуюся часть пробы перемешивают и измельчают в шаровой мельнице (100 об/мин 10
мин).
Берут навеску измельченной пробы не менее 30 г (на весах II класса точности) и на 1 часть добавляют 4 части дистиллированной воды. Экстрагирование ведут в течение 2-х часов на аппарате для встряхивания жидкости. После 30-минутного отстаивания надосадочная жидкость фильтруется через бумажный фильтр (красная лента).
Далее к 9 см' полученного экстракта добавляют 1 см* концентрата среды Лозина-Лозинского по п. 7.3. Полученную жидкость используют для проведения анализа.
7.3. Приготовление взвеси клеток инфузорий и растворов
7.3.1 .Используется взвесь клеток инфузорий, полученная путем выращивания тест-объекта в определенных условиях (см. приложение Б), отмытая от продуктов метаболизма и корма (см. приложение В) и доведенная до рабочей концентрации (плотности) (1000 ± 500) кл/см*.
7.3.2.Среда для культивирования и разбавления - среда Лозина-Лозинского (в дальнейшем Л-Л) готовится на дистиллированной воде. Возможно использование водопроводной воды, которая должна быть соответствующим образом обработана (дехлорирована отстаиванием в течении 5-10 суток), или иной заведомо нетоксичной воды (но не дистиллят!).
Для приготовления концентрата среды Л-Л в 1дм* воды растворяют следующие соли: NaCl — 1,0 г. КС1 — 0,1 г, MgS04 — 0,1 г, СаСЬ— 0,1 г, NaHCCb — 0.2 г. Такой раствор можно хранить в холодильнике до 7 суток при температуре (8 ± 4)°С. Для работы используется среда Л-Л, полученная десятикратным разбавлением водой исходного концентрата. Разбавленная среда Л-Л не хранится. Разбавляющая среда и среда для культивирования должны быть идентичны и обеспечивать выживаемость инфузории в течение 5 суток.
10