СТБ EN 14152-2012
Продукты пищевые. Определение витамина В2 методом высокоэффективной жидкостной хроматографии (ВЭЖХ)
Купить СТБ EN 14152-2012 — бумажный документ с голограммой и синими печатями. подробнее
Цена на этот документ пока неизвестна. Нажмите кнопку "Купить" и сделайте заказ, и мы пришлем вам цену.
Распространяем нормативную документацию с 1999 года. Пробиваем чеки, платим налоги, принимаем к оплате все законные формы платежей без дополнительных процентов. Наши клиенты защищены Законом. ООО "ЦНТИ Нормоконтроль"
Наши цены ниже, чем в других местах, потому что мы работаем напрямую с поставщиками документов.
Способы доставки
- Срочная курьерская доставка (1-3 дня)
- Курьерская доставка (7 дней)
- Самовывоз из московского офиса
- Почта РФ
Устанавливает метод определения витамина В2 в пищевых продуктах с помощью высокоэффективной жидкостной хроматографии (ВЭЖХ). Определение витамина В2 осуществляется посредством измерения рибофлавина
Оглавление
1 Область применения
2 Нормативные ссылки
3 Сущность метода
4 Реактивы
5 Аппаратура
6 Методика
7 Вычисление
8 Точность результатов испытаний
9 Протокол испытаний
Приложение A (справочное) Пример хроматограммы высокоэффективной жидкостной хроматографии
Приложение B (справочное) Точность данных
Приложение C (справочное) Альтернативные системы высокоэффективной жидкостной хроматографии
Библиография
| Дата введения | 01.07.2012 |
|---|---|
| Добавлен в базу | 01.01.2019 |
| Актуализация | 01.01.2021 |
Организации:
| 18.01.2012 | Утвержден | Госстандарт Республики Беларусь | 4 |
|---|---|---|---|
| Разработан | Научно-производственное республиканское УП БелГИСС | ||
| Издан | БелГИСС | 2012 г. |
Foodstuffs. Determination of vitamin B2 by HPLC
Чтобы бесплатно скачать этот документ в формате PDF, поддержите наш сайт и нажмите кнопку:

стр. 1

стр. 2

стр. 3

стр. 4

стр. 5

стр. 6

стр. 7

стр. 8

стр. 9
стр. 10
стр. 11
стр. 12

стр. 13

стр. 14
ГОСУДАРСТВЕННЫЙ СТАНДАРТ РЕСПУБЛИКИ БЕЛАРУСЬ
ПРОДУКТЫ ПИЩЕВЫЕ
Определение витамина В2 методом высокоэффективной жидкостной хроматографии (ВЭЖХ)
ПРАДУКТЫ ХАРЧОВЫЯ
Вызначэнне в1тамшу В2 метадам высокаэфектыунай вадкаснай храматаграфм (ВЭВХ)
(EN 14152:2003, ЮТ)
Издание официальное
Г осстандарт Минск
(SB
УДК 664:543.645.5:543.544.5.068.7(083.74)(476) МКС 67.050 КП 06 ЮТ
Ключевые слова: продукты пищевые, определение, витамин В2, высокоэффективная жидкостная хроматография
Предисловие
Цели, основные принципы, положения по государственному регулированию и управлению в области технического нормирования и стандартизации установлены Законом Республики Беларусь «О техническом нормировании и стандартизации».
1 ПОДГОТОВЛЕН научно-производственным республиканским унитарным предприятием «Белорусский государственный институт стандартизации и сертификации» (БелГИСС)
ВНЕСЕН Госстандартом Республики Беларусь
2 УТВЕРЖДЕН И ВВЕДЕН В ДЕЙСТВИЕ постановлением Госстандарта Республики Беларусь от 18 января 2012 г. № 4
3 Настоящий стандарт идентичен европейскому стандарту EN 14152:2003 Foodstuffs - Determination of vitamin B2 by HPLC [Продукты пищевые. Определение витамина В2 методом высокоэффективной жидкостной хроматографии (ВЭЖХ)], включая поправку АС:2005.
Европейский стандарт разработан техническим комитетом CEN/TC 275 «Анализ пищевых продуктов. Горизонтальные методы» Европейского комитета по стандартизации (CEN).
Перевод с английского языка (еп).
Официальные экземпляры европейского стандарта, на основе которого подготовлен настоящий государственный стандарт, и стандарта, на который дана ссылка, имеются в Национальном фонде ТИПА.
Степень соответствия - идентичная (ЮТ)
4 ВВЕДЕН ВПЕРВЫЕ
© Госстандарт, 2012
Настоящий стандарт не может быть воспроизведен, тиражирован и распространен в качестве официального издания без разрешения Госстандарта Республики Беларусь
Издан на русском языке
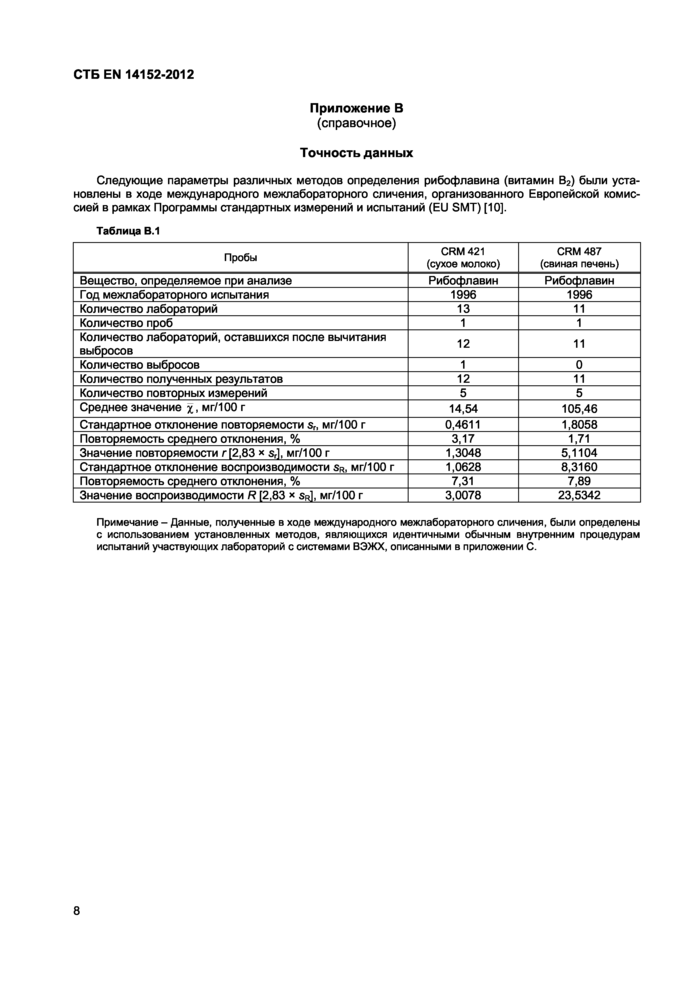
Приложение В
(справочное)
Точность данных
Следующие параметры различных методов определения рибофлавина (витамин В2) были установлены в ходе международного межлабораторного сличения, организованного Европейской комиссией в рамках Программы стандартных измерений и испытаний (EU SMT) [10].
|
Таблица В.1 | ||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||
|
Примечание - Данные, полученные в ходе международного межлабораторного сличения, были определены с использованием установленных методов, являющихся идентичными обычным внутренним процедурам испытаний участвующих лабораторий с системами ВЭЖХ, описанными в приложении С. |
8
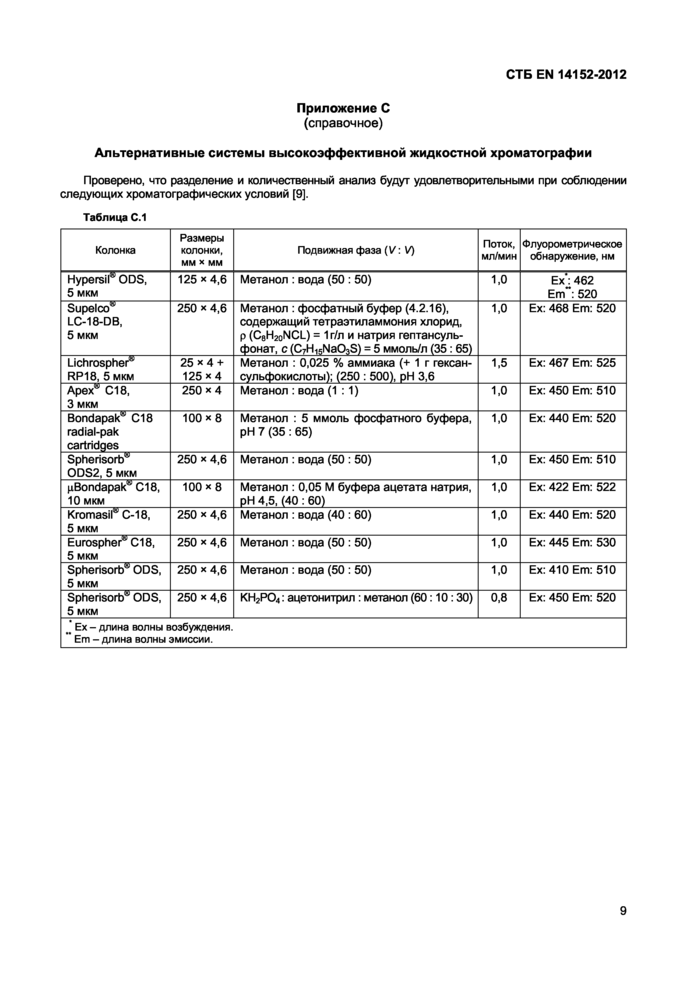
Приложение С
(справочное)
Альтернативные системы высокоэффективной жидкостной хроматографии
Проверено, что разделение и количественный анализ будут удовлетворительными при соблюдении следующих хроматографических условий [9].
|
Таблица С.1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
9
СТБ EN 14152-2012
Библиография
[1] Lumbley, I.D. and Wiggins, R.A.: Determination of riboflavin and flavin mononucleotide in foodstuffs using high-performance liquid chromatography and a column-enrichment tecgnique. Analyst 106, 1981, 1103-1108
(Определение рибофлавина и флавин-мононуклеотида в пищевых продуктах)
[2] Finglas, Р. М. and Faulks, R.M: Critical review of HPLC methods for the determination of thiamin, riboflavin and niacin in food. J. Micronutr. Anal. 3, 1987, 251 - 283
(Критический обзор методов ВЭЖХ для определения тиамина, рибофлавина и ниацина в пищевых продуктах)
[3] Ball, G.F.M, in G.F.M Ball (Изд.): Water-Soluble Vitamin Assays in Food Analysis. Elsevier Applied Science. London, 1994, 237 - 246
(Химические анализы растворимых в воде витаминов при анализе пищевых продуктов)
[4] Hasselmann, С., Franck, D., Grimm, Р., Diop, Р.А. and Soules, C.: High-performance liquid chromatographic analysis of thiamin and riboflavin in dietic foods. J. Micronutr. Anal. 5, 1989, 269 - 279 (Высокоэффективный хроматографический анализ тиамина и рибофлавина в диетических пищевых продуктах)
[5] Ollilainen, V., Mattila Р., Varo, Р., Koivistoinen, Р. and Huttunen, J.: The HPLC determination of total riboflavin in foods. J. Micronutr. Anal. 8, 1990, 199 - 207
(Определение методом ВЭЖХ общего содержания рибофлавина в пищевых продуктах)
[6] Hagg, М. and Kumpulainen, J.: Thiamin and riboflavin contents in domestic and imported cereal products in Finland. J. Food Comp. Anal. 6, 1993, 299 - 306
(Содержание тиамина и рибофлавина в отечественных и импортируемых в Финляндию крупяных продуктов)
[7] Hagg, М.: Effect of various commercially available enzymes in the liquid chromatographic determination with external standardization of thiamin and riboflavin in foods. J. AOAC Int. 77, 1994, 681 - 686
(Эффект различных, имеющихся в продаже ферментов, в жидкостном хроматографическом определении при внешней стандартизации тиамина и рибофлавина в пищевых продуктах)
[8] Eitenmiller, R. R. and Landen, W. О.: Vitamin Analysis for the Health and Food Sciences. CRC Press, Boca Raton, London, New York, Washington, D.C., 1999, 299-337
(Анализ витаминов для валеологии и науки о продуктах питания)
[9] European Pharmacopoeia (Европейская Фармакопея) 1997:1997:0292. Riboflavin 1442 - 1443 (Рибофлавин)
[10] Finglas, Р. М., Scott, К. J., Witthoft, С. М., van den Berg, Н. and de Froidmont-Gortz, I.: The certification of the mass fractions of vitamins in four reference materials: Wholemeal flour (CRM 121), milk powder (CRM 421), lyophilised mixed vegetables (CRM 485) and lyophilised pig’s liver (CRM 487). EUR-report 18320, Office for Official Publications of the European Communities, Luxembourg, 1999
[Сертификация массовых долей витаминов в четырех эталонных материалах: муке из цельного зерна (CRM 121), сухом молоке (CRM 421), лиофилизированной овощной смеси (CRM 485) и лиофилизированной свиной печени (CRM 487)]
[11] NDAW, S., Bergaenzle, М., Aoude-Wemer, D., Hasselmann, С: Extraction procedures for the liquid chromatography determination of thiamine, riboflavin and vitamin B6 in foodstuffs. Food Chemistry 71, 2000, 129-138
(Процедуры экстракции для определения методом жидкостной хроматографии тиамина, рибофлавина и витамина В6 в пищевых продуктах)
10
Ответственный за выпуск В. Л. Гуревич
Сдано в набор 16.02.2012. Подписано в печать 05.03.2012. Формат бумаги 60x84/8. Бумага офсетная. Гарнитура Arial. Печать ризографическая. Уел. печ. л. 1,62 Уч.-изд. л. 0,70 Тираж экз. Заказ
Издатель и полиграфическое исполнение: Научно-производственное республиканское унитарное предприятие «Белорусский государственный институт стандартизации и сертификации» (БелГИСС) ЛИ № 02330/0552843 от 08.04.2009. ул. Мележа, 3, комн. 406, 220113, Минск.
СТБ EN 14152-2012
Содержание
1 Область применения..............................................................................................................................1
2 Нормативные ссылки.............................................................................................................................1
3 Сущность метода....................................................................................................................................1
4 Реактивы..................................................................................................................................................1
5 Аппаратура..............................................................................................................................................3
6 Методика.................................................................................................................................................3
7 Вычисление.............................................................................................................................................5
8 Точность результатов испытаний.........................................................................................................5
9 Протокол испытаний...............................................................................................................................6
Приложение А (справочное) Пример хроматограммы высокоэффективной жидкостной
хроматографии.................................................................................................................7
Приложение В (справочное) Точность данных.......................................................................................8
Приложение С (справочное) Альтернативные системы высокоэффективной жидкостной
хроматографии.................................................................................................................9
Библиография..........................................................................................................................................10
ГОСУДАРСТВЕННЫЙ СТАНДАРТ РЕСПУБЛИКИ БЕЛАРУСЬ
ПРОДУКТЫ ПИЩЕВЫЕ Определение витамина В методом высокоэффективной жидкостной хроматографии (ВЭЖХ)
ПРАДУКТЫ ХАРЧОВЫЯ Вызначэнне в1тамшу В метадам высокаэфектыунай вадкаснай храматаграфм (ВЭВХ)
Foodstuffs Determination of vitamin B2 by HPLCДата введения 2012-07-01
1 Область применения
Настоящий стандарт устанавливает метод определения витамина В2 в пищевых продуктах с помощью высокоэффективной жидкостной хроматографии (ВЭЖХ). Определение витамина В2 осуществляется посредством измерения рибофлавина.
2 Нормативные ссылки
Для применения настоящего стандарта необходим следующий ссылочный документ. Для недатированных ссылок применяют последнее издание ссылочного документа (включая все его изменения).
EN ISO 3696:1995 Вода для лабораторного анализа. Технические требования и методы испытаний (ISO 3696:1987)
3 Сущность метода
Рибофлавин определяют в растворе пробы методом ВЭЖХ с флуоресцентным детектированием после проведения кислотного гидролиза пробы и ферментативной обработки в целях дефосфорилирования [1] - [6].
4 Реактивы
4.1 Общие положения
В ходе анализа используют только реактивы признанной аналитической чистоты и воду не ниже первой степени чистоты в соответствии с EN ISO 3696 или бидистиллированную воду.
4.2 Химические реактивы и растворы
4.2.1 Метанол для ВЭЖХ, массовая доля w (СН3ОН) > 99,8 %.
4.2.2 Тригидрат уксуснокислого натрия, w (CH3C00Na-3H20) = 99 %.
4.2.3 Раствор уксуснокислого натрия, с (СН3С001Ма-ЗН20) = 0,1 моль/л.
4.2.4 Раствор ацетата натрия, с (СН3С001Ма-ЗН20) = 2,5 моль/л.
4.2.5 Ледяная уксусная кислота, w (СН3СООН) = 99,8 %.
4.2.6 Раствор уксусной кислоты, с (СН3СООН) = 0,02 моль/л.
4.2.7 Соляная кислота, w (HCI) = 36 %.
4.2.8 Соляная кислота, с (HCI) = 0,1 моль/л.
4.2.9 Соляная кислота, с (HCI) = 0,01 моль/л.
4.2.10 Серная кислота, с (H2S04) = 0,05 моль/л.
4.2.11 Натрия гидроксид, w(NaOH) = 99 %.
4.2.12 Раствор натрия гидроксида, о (NaOH) = 0,5 моль/л.
Издание официальное
4.2.13 Оксид фосфора (V), w(P205) = 98 %.
4.2.14 Фермент для дефосфорилирования, способный гидролизовать связанный рибофлавин из пищевых продуктов 1>.
4.2.15 Подвижные фазы ВЭЖХ
Примеры соответствующих смесей с объемными долями метанола (4.2.1) от 10 % до 50 % в воде или использования фосфатного или ацетатного буфера представлены в приложении С. Также представлен вариант использования ион-парных реагентов.
4.2.16 Фосфатный буфер (pH 3,5), с (КН Р04) = 9,0 ммоль/л.
4.2.17 Тетраэтиламмония хлорид, w (C8H20NCI) = 98 %.4.2.18 Натрия гептансульфонат, w(C7H15Na03S) = 98 %.4.3 Стандартные вещества4.3.1 Рибофлавин, w (C17H20N4O6) = 98 %.
4.3 Стандартные вещества4.3.1 Рибофлавин, w (C17H20N4O6) = 98 %.
Витамин В2 в качестве рибофлавина может быть получен от различных поставщиков. Чистота стандартного рибофлавина может быть различной. Поэтому необходимо определять концентрацию калибровочного раствора методом ультрафиолетовой (УФ) спектрометрии (см. проверку концентрации 4.4.3).
4.3.2 Рибофлавин-5'-фосфат натрия
Соль рибофлавин-5'-фосфат натрия, w (Ci7H20N4NaOgP) = 95 %; для качественных целей.
4.4 Исходные растворы4.4.1 Меры предосторожности
Витамин В2 является очень чувствительным к свету. Необходимо защитить витамин В2 и соответствующие растворы в течение всей процедуры подготовки образца с помощью посуды из темного стекла.
4.4.2 Стандартный исходный раствор рибофлавина, р (C17H20N4O6) =100 мкг/мл.
50 мг предварительно высушенного путем хранения в темноте в эксикаторе под вакуумом и/или оксидом фосфора (V) (4.2.13) стандартного вещества рибофлавина (4.3.1) взвешивают с точностью до миллиграмма и растворяют в 500 мл разбавленной уксусной кислоты (4.2.6), используя мерные колбы из темного стекла. Этот раствор можно хранить в течение 2 мес при температуре 4 °С в темном помещении.
Рибофлавин является труднорастворимым. Чтобы облегчить растворение рибофлавина, его подогревают в 300 мл разбавленной уксусной кислоты (4.2.6) в мерной колбе вместимостью 500 мл на водяной бане с постоянным помешиванием до полного растворения, затем раствор охлаждают и объем доводят до метки разбавленной уксусной кислотой (4.2.6). В качестве альтернативы добавляют 5 мл раствора гидроксида натрия (4.2.12) в стандартное вещество в мерную колбу вместимостью 500 мл. По причине нестабильности в щелочных растворах сразу же после растворения добавляют 1,5 мл ледяной уксусной кислоты и объем доводят до метки разбавленной уксусной кислотой (4.2.6) или другой соответствующей кислотой. Следует проверять (4.4.3) концентрацию свежеприготовленного и при необходимости также хранившегося раствора.
4.4.3 Проверка концентрации
20 мл исходного раствора рибофлавина (4.4.2) смешивают с 3,5 мл раствора уксуснокислого натрия (4.2.3) в мерной колбе вместимостью 200 мл и объем доводят до метки водой. Для подготовки холостого раствора 20 мл уксусной кислоты (4.2.6) смешивают с 3,5 мл уксуснокислого натрия в мерной колбе вместимостью 200 мл и объем доводят до метки водой. Эти растворы используют для спектрометрического измерения.
Измеряют оптическую плотность раствора рибофлавина при длине волны 444 нм, используя спектрометр (5.1) в кювете с длиной оптического пути 1 см относительно холостого раствора. Рассчитывают массовую концентрацию исходного раствора рибофлавина (4.4.2) р, мкг/мл, по формуле
11 Примером подходящего фермента для дефосфорилирования является Така-диастаза № Т00040, изготовитель Pfalz & Bauer, Waterbury, СТ 06708, USA. Эта информация приводится для удобства пользователей настоящего стандарта и не является рекламой CEN указанного продукта. Эквивалентные продукты могут использоваться, если они могут привести к таким же результатам.
СТБ EN 14152-2012
_ А44 х 101 х 10 (1)
Р 328 К
где А444 - величина поглощающей способности раствора при длине волны 444 нм;
328 - коэффициент поглощающей способности Е,* рибофлавина (в ацетатном буфере, pH 3,8)
при 444 нм (см. [9]);
10 - коэффициент разбавления.
4.5 Стандартные растворы
4.5.1 Стандартный раствор, р (C17H20N4O6) =10 мкг/мл.
Готовят разведение 1 : 10 исходного раствора рибофлавина (4.4.2). Переносят пипеткой 10 мл исходного раствора рибофлавина (4.4.2) в мерную колбу из коричневого стекла вместимостью 100 мл и объем доводят до метки разбавленной уксусной кислотой (4.2.6). Раствор используют свежеприготовленным.
4.5.2 Стандартный анализируемый раствор, р (C17H2oN406) = от 0,1 до 1 мг/мл.
Переносят пипеткой от 1,0 до 10,0 мл стандартного раствора (4.5.1) в мерную колбу из темного стекла вместимостью 100 мл и объем доводят до метки подвижной фазой (4.2.15). Раствор используют свежеприготовленным.
5 Аппаратура
Используют стандартное лабораторное оборудование, стеклянную посуду и следующее:
5.1 УФ-спектрометр
УФ-спектометр, пригодный для измерения поглощения при заданных длинах волн с соответствующими кюветами, например длиной 1 см.
5.2 Автоклав или нагревательный прибор
Запарник-автоклав или варочный аппарат, работающий под давлением, со считывающим устройством давления или температуры, электронагревательный прибор или водяная баня.
5.3 Система для высокоэффективной жидкостной хроматографии (ВЭЖХ)
Система для ВЭЖХ состоит из насоса, устройства ввода проб, флуоресцентного детектора с длиной волны возбуждения 468 нм и эмиссии 520 нм, а также устройства для обработки данных (интегратора).
5.4 Колонка для ВЭЖХ
Аналитическая колонка для обращенно-фазовой хроматографии диаметром от 4,0 до 4,6 мм, длиной от 100 до 250 мм, размер частиц от 3 до 10 мкм.
Можно использовать другие размеры частиц и колонок вместо указанных в настоящем стандарте. Параметры разделения должны быть адаптированы к таким материалам, чтобы гарантировать эквивалентные результаты.
Другие системы (см. приложение С) также могут использоваться при условии, что достигается удовлетворительное отделение рибофлавина от других экстрактивных веществ.
5.5 Фильтровальное устройство
Подходит мембранный фильтр с размером пор 0,45 мкм.
Фильтрация подвижной фазы, а также раствора анализируемой пробы через мембранный фильтр до использования или ввода проб увеличит срок службы колонок.
6 Методика
6.1 Меры предосторожности
Витамин В2 является очень чувствительным к свету. Необходимо предпринимать меры, чтобы защитить витамин В2 и соответствующие растворы в течение всей процедуры подготовки образца с помощью посуды из темного стекла. 2
6.2 Подготовка анализируемой пробы
Гомогенизируют анализируемую пробу. Твердые продукты измельчают в соответствующей мельнице и перемешивают. Чтобы не подвергать пробу воздействию высокой температуры в течение длительного времени, должны быть приняты такие меры, как предварительное охлаждение.
6.3 Подготовка раствора анализируемой пробы6.3.1 Экстракция пробы
В конической колбе взвешивают от 2 до 10 г анализируемой пробы с точностью до миллиграмма. Добавляют от 50 до 200 мл соляной кислоты (4.2.8) или серной кислоты (4.2.10). Уровень pH раствора не должен быть выше уровня 2,0. Накрывают колбу предметным стеклом и автоклавируют навеску при температуре 121 °С в течение 30 мин или нагревают ее при температуре 100 °С в течение 60 мин. Примечание - Исследования, проводимые Европейским бюро стандартов, показали, что можно применять обширный диапазон условий для кислотного гидролиза (температура от 95 °С до 130 °С, время от 15 до 60 мин). Чем выше температура, тем короче должно быть время. Тем не менее длительное нагревание рибофлавина и рибофлавина-5'-фосфата натрия может вызвать потери. Испытания показали, что, в частности для шоколадных пищевых продуктов, экстракция ухудшается, если значение pH раствора выше 2.
6.3.2 Ферментативная обработка
После охлаждения до комнатной температуры pH экстракта доводят до оптимального уровня для используемого фермента раствором ацетата натрия (4.2.4) и добавляют подходящее количество фермента для дефосфорилирования (4.2.14). Выдерживают смесь при оптимальной температуре в течение оптимального времени для используемого фермента. После охлаждения до комнатной температуры переливают раствор в защищенную от света мерную колбу, используя разбавленную уксусную кислоту (4.2.6), и доводят до заданного объема VE.
Для каждого используемого фермента необходимо установить оптимальный уровень pH, оптимальное время и температуру выдержки.
Чтобы обеспечить оптимальное дефосфорилирование, ферментативный этап следует проверить на пробах с известным содержанием соответствующих фосфатов витамина В2 или с искусственно добавленным рибофлавин-5'-фосфатом натрия (4.3.2) и веществом, похожим по типу на вещество анализируемой пробы. Данное вещество должно быть сертифицировано эталонным веществом.
Если для дефосфорилирования используют Така-диастазу, количество рибофлавина, внесенное с ферментом, следует учитывать при расчете результата.
Примечание 1 - Для определения точности результатов испытаний, указанных в настоящем стандарте, для дефосфорилирования использовали Така-диастазу при следующих условиях. Уровень pH экстракта довели до pH = 4,0 раствором ацетата натрия (4.2.4) и добавили 100 мг Така-диастазы на грамм пробы. Смесь выдерживали при температуре от 37 °С до 46 °С в течение от 16 до 24 ч.
Примечание 2 - Дефосфорилирование может зависеть от состава пробы и используемого фермента (смеси) [7], [10] и [11].
6.3.3 Раствор анализируемой пробы
При необходимости разбавляют аликвоту Va из чистого экстракта до заданного объема раствора пробы, пропускают через фильтровальную бумагу или мембранный фильтр 0,45 мкм. Чтобы получить прозрачный раствор, используют центрифугирование на подходящем д уровне. Из чистого фильтрата разбавляют аликвоту VA до заданного объема Vрастворителем, совместимым с системой элюирования ВЭЖХ, например 1,0 мл экстракта (6.3.2) разбавляют 1,0 мл метанола (4.2.1). Это и является раствором анализируемой пробы для анализа ВЭЖХ.
6.4 Идентификация
Идентифицируют рибофлавин путем сравнения времени удержания пиков на хроматограммах, полученных для раствора анализируемой пробы и для стандартного раствора. Идентификацию пика можно также выполнить, добавив стандартные вещества в раствор анализируемой пробы.
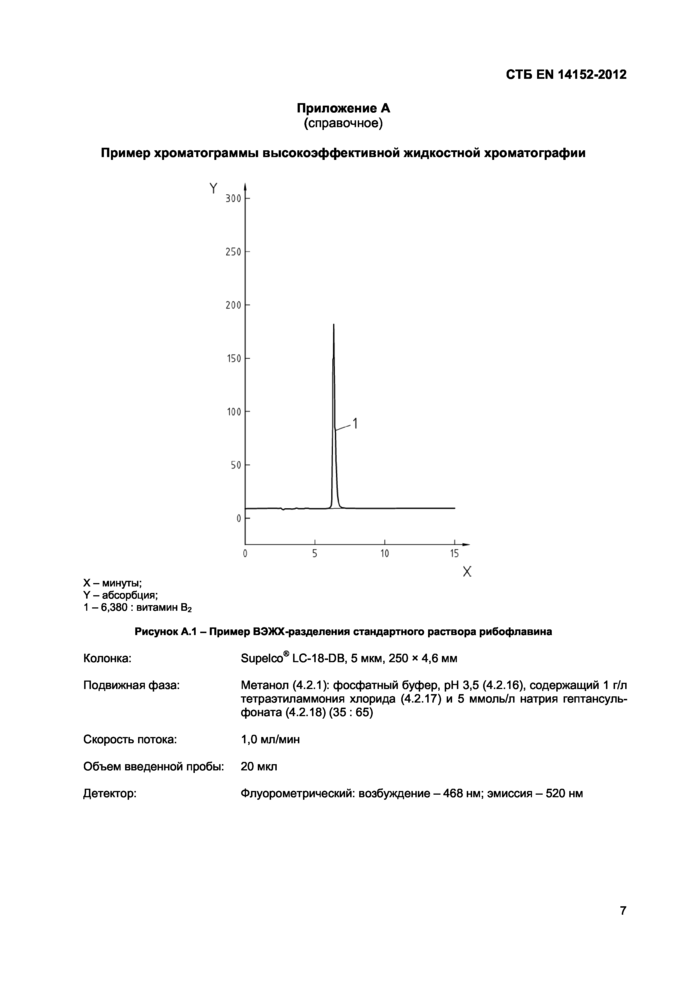
Примечание - Разделение и количественный анализ выполняют при соблюдении следующих экспериментальных условий (см. также рисунок А.1 и приложение С по условиям для альтернативных вариантов ВЭЖХ).
Колонка: Supelco® LC-18-DB, 5 мкм, 250 х 4,6 мм
Подвижная фаза: Метанол (4.2.1): фосфатный буфер pH 3,5 (4.2.16), содержащий 1 г/л
тетраэтиламмония хлорид (4.2.17) и 5 ммоль/л натрия гептансульфоната (4.2.18) (35:65) 1
СТБ EN 14152-2012
Скорость потока: 1,0 мл/мин
Объем введенной пробы: 20 мкп
Детектор: Флуорометрический: возбуждение - 468 нм и эмиссия - 520 нм.
6.5 Определение
В систему ВЭЖХ вводят равные соответствующие объемы (до 100 мкл) стандартного анализируемого раствора (4.5.2), а также раствора анализируемой пробы (6.3.3). Для того чтобы выполнить количественное определение методом внешней калибровки, интегрируют площади пиков или определяют высоты пиков и результаты сравнивают с соответствующими значениями стандартного раствора.
Проверяют линейность калибровки.
7 Вычисление
Вычисление выполняют по калибровочной кривой или используют соответствующие программы интегратора или следующую упрощенную процедуру. Рассчитывают массовую долю витамина В2 w, мг/100 г пробы, по формуле
w =
V Р-УУЕ
AST msVAA 000
•100-
тЕ ■Е ms
(2)
где As -площадь или высота пика рибофлавина, полученного при хроматографировании раствора анализируемой пробы (6.3.3), в единицах площади или высоты;
р - массовая концентрация рибофлавина в стандартном анализируемом растворе (4.5.2), мкг/мл;
V - общий объем конечного раствора анализируемой пробы (6.3.3), мл;
VE - объем экстракта пробы (6.3.2), мл;
ASt -площадь или высота пика рибофлавина, полученного при хроматографировании стандартного анализируемого раствора (4.5.2), в единицах площади или высоты;
ms - масса пробы, г;
VA - объем аликвоты, используемый для конечного разбавления (6.3.3), мл;
1000 - коэффициент преобразования микрограммов в миллиграммы;
100 - коэффициент преобразования массовой доли на 100 г;
тЕ - масса фермента, используемого в анализе, г;
Е - массовая доля рибофлавина, присутствующего в ферменте, мг/100 г.
8 Точность результатов испытаний
8.1 Общие положения
Точность данных различных методов ВЭЖХ для определения рибофлавина была установлена в 1996 г. в ходе международных сравнительных исследований на образцах сухого молока (CRM 421) и лиофилизированной свиной печени (CRM 487) в рамках Программы стандартных измерений и испытаний, организованных Европейской комиссией. Полученная статистическая информация представлена в приложении В. Данные, полученные из этих сравнительных исследований, могут быть применимы для анализа диапазона концентраций и матриц проб, кроме тех, которые даны в приложении В.
8.2 Повторяемость
Абсолютная разность между двумя отдельными результатами испытаний, полученными на идентичном анализируемом материале одним оператором, использующим одно и то же оборудование в течение самого короткого промежутка времени, практически возможного, не должна превышать предел повторяемости г более чем в 5 % случаев.
|
Значения для рибофлавина: Сухое молоко |
Х= 14,54 мг/100 г |
г= 1,3048 мг/100 |
|
Свиная печень |
Х= 105,46 мг/100 г |
г= 5,1104 мг/100 |
5
8.3 Воспроизводимость
Абсолютная разность между двумя отдельными результатами испытаний, полученными на идентичном материале двумя лабораториями, не должна превышать предел воспроизводимости R более чем в 5 % случаев. Значения для рибофлавина:
Сухое молоко
X = 14,54 мг/100 г R = 3,0078 мг/100 г
Свиная печень
X = 105,46 мг/100 г R = 23,5342 мг/100 г
9 Протокол испытаний
Протокол испытаний должен содержать следующие данные:
a) фамилию, имя, отчество и подпись ответственного лаборанта;
b) всю информацию, необходимую для полной идентификации пробы;
c) ссылку на настоящий стандарт или используемый метод;
d) дату и методику отбора проб (если известна);
e) дату испытания;
f) результаты испытания и единицы, в которых выражаются результаты;
д) любые особенности, которые наблюдались в ходе проведения испытания; h) любые операции, не установленные в методе или рассматриваемые как дополнительные, которые могут повлиять на результаты.
6
СТБ EN 14152-2012Приложение А
(справочное)
X
Пример хроматограммы высокоэффективной жидкостной хроматографии
X - минуты;
Y - абсорбция;
1 - 6,380 : витамин В2
Рисунок А.1 - Пример ВЭЖХ-разделения стандартного раствора рибофлавина
Колонка: Supelco® LC-18-DB, 5 мкм, 250 * 4,6 мм
Подвижная фаза: Метанол (4.2.1): фосфатный буфер, pH 3,5 (4.2.16), содержащий 1 г/л
тетраэтиламмония хлорида (4.2.17) и 5 ммоль/л натрия гептансуль-фоната (4.2.18) (35 : 65)
Скорость потока: 1,0 мл/мин
Объем введенной пробы: 20 мкл
Детектор: Флуорометрический: возбуждение - 468 нм; эмиссия - 520 нм
7
1
2