Приказ 429н
Об утверждении профессионального стандарта "Специалист по промышленной фармации в области обеспечения качества лекарственных средств"
Купить Приказ 429н — бумажный документ с голограммой и синими печатями. подробнее
Цена на этот документ пока неизвестна. Нажмите кнопку "Купить" и сделайте заказ, и мы пришлем вам цену.
Распространяем нормативную документацию с 1999 года. Пробиваем чеки, платим налоги, принимаем к оплате все законные формы платежей без дополнительных процентов. Наши клиенты защищены Законом. ООО "ЦНТИ Нормоконтроль"
Наши цены ниже, чем в других местах, потому что мы работаем напрямую с поставщиками документов.
Способы доставки
- Срочная курьерская доставка (1-3 дня)
- Курьерская доставка (7 дней)
- Самовывоз из московского офиса
- Почта РФ
Зарегистрировано в Минюсте РФ 20 июля 2017 г. Регистрационный № 47480
Оглавление
Профессиональный стандарт. Специалист по промышленной фармации в области обеспечения качества лекарственных средств
I. Общие сведения
II. Описание трудовых функций, входящих в профессиональный стандарт (функциональная карта вида профессиональной деятельности)
III. Характеристика обобщенных трудовых функций
3.1. Обобщенная трудовая функция. Ведение работ, связанных с фармацевтической системой качества производства лекарственных средств
3.2. Обобщенная трудовая функция. Управление работами фармацевтической системы качества производства лекарственных средств
IV. Сведения об организациях - разработчиках профессионального стандарта
4.1. Ответственная организация-разработчик
4.2. Наименования организаций-разработчиков
| Дата введения | 01.08.2017 |
|---|---|
| Добавлен в базу | 01.01.2018 |
| Актуализация | 01.01.2021 |
Этот документ находится в:
- Раздел Экология
- Раздел 11 ЗДРАВООХРАНЕНИЕ
- Раздел 11.120 Фармацевтика
- Раздел 11 ЗДРАВООХРАНЕНИЕ
Организации:
| 22.05.2017 | Утвержден | Министерство труда и социальной защиты РФ | 429н |
|---|---|---|---|
| Издан | Официальный интернет-портал правовой информации (www.pravo.gov.ru) | от 21.07.2017 г. № 0001201707210016 |
- Приказ 302н Об утверждении перечней вредных и (или) опасных производственных факторов и работ, при выполнении которых проводятся обязательные предварительные и периодические медицинские осмотры (обследования), и Порядка проведения обязательных предварительных и периодических медицинских осмотров (обследований) работников, занятых на тяжелых работах и на работах с вредными и (или) опасными условиями труда
- ОК 016-94 Общероссийский классификатор профессий рабочих, должностей служащих и тарифных разрядов
- Правила разработки и утверждения профессиональных стандартов
Чтобы бесплатно скачать этот документ в формате PDF, поддержите наш сайт и нажмите кнопку:

стр. 1

стр. 2
стр. 3
стр. 4
стр. 5
стр. 6

стр. 7
стр. 8
стр. 9

стр. 10

стр. 11
стр. 12
стр. 13
стр. 14
стр. 15
стр. 16
стр. 17
стр. 18

стр. 19

стр. 20
|
Willw |
МИИИОТРСТГО кчткиии r«C!!(!CK0i! ♦Р.ТГ?А1!Н1'1
ЗАРЕГИСТРИРОВАНО
Регистрационный .Yx
от 2(/%.
от
МИНИСТЕРСТВО ГРУДА И СОЦИАЛЬНОЙ ШЦ111Ы РОССИЙСКОЙ ФЕДЕРАЦИИ
(Минтруд России)
22 u/aj> (20/7г
ПРИКАЗ
* 4?Sjl
Москва
Об утверждении профессионального стандарта «Специалист по промышленной фармации в области обеспечения качества лекарственных средств»
В соответствии с пунктом 16 Правил разработки и утверждения профессиональных стандартов, утвержденных постановлением Правительства Российской Федерации от 22 января 2013 г. №23 (Собрание законодательства Российской Федерации, 2013, № 4, ст. 293; 2014, № 39, ст. 5266; 2016, № 21, ст. 3002), приказываю:
Утвердить прилагаемый профессиональный стандарт «Специалист по промышленной фармации в области обеспечения качества лекарственных средств».
Министр
УТВЕРЖДЕН приказом Министерства труда и социальной защиты Российской Федерации от «&» агги* 2017 г. Xs VtiJ,
Специалист по промышленной фармации в области обеспечения качества
лекарственных средств
1031
Регистрационный номер
Содержание
ПРОФЕССИОНАЛЬНЫЙ СТАНДАРТ
I. Общие сведения........................................................................................................................................1
II. Описание трудовых функций, входящих в профессиональный стандарт (функциональная карта
вида профессиональной деятельности).....................................................................................................2
III. Характеристика обобщенных трудовых функций..............................................................................3
3.1. Обобщенная трудовая функция «Ведение работ, связанных с фармацевтической системой
качества производства лекарственных средств».................................................................................3
3.2. Обобщенная трудовая функция «Управление работами фармацевтической системы
качества производства лекарственных средств».................................................................................9
IV. Сведения об организациях - разрабогчиках профессионального стандарта................................19
|
Код |
I. Общие сведения
Дсм1ельность по обеспечению качества и выпуска в обращение промышленно произведенных лекарственных средств (синтетических, биологических, иммунобиологических, биотехнологических, генотерапевтических, радиофармацевгических, гомеопатических, природного происхождения и
медицинских газов)_
(наименование вида профессиональной деятельности)
Основная цель вида профессиональной деятельности:
Организация, проведение работ и управление работами по фармацевтической системе качества, включая оформление разрешения о выпуске в обращение лекарственных средств
|
Группа занятий: | ||||||||||||
|
Отнесение к видам экономической деятельности:
21.1 Производство фармацевтических субстанций
21.2 Производство лекарственных препаратов и материалов, применяемых в
| медицинских целях_______________
46.46 Торговля оптовая фармацевтической продукцией
52.10 Деятельность по складированию и хранению
72.1 Научные исследования и разработки в области естественных и технических наук
(код ОКВЭД2) (наименование вила экономической деятельности)
10
|
Дополнительные характеристики | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
11 | |||||||
|
|
3.2.1. Трудовая функция | ||||||||||||
|
| ||||||||||||
|
Организация процессов документооборота фармацевтической качества лекарственных средств__ системы |
Оргашзация мониторинга выполнения корректирующих и предупреждающих
Организация процессов расследований по отклонениям, несоответствиям, рекламациям по качеству в соответствии с установленными процедурами Организация проведения процессов анатиза рисков для качества лекарственных средств
действий на фармацевтическом производстве_________
Оценка и мониторинг любых изменений фармацевтической системы качества в соответствии с установленными требованиями___________I
Организация аудитов качества (самоинспскций) фармацевтического производства, конграктных производителей, поставщиков исходного сырья и упаковочных материалов
Подготовка предложений для анатиза и систематизации информации в области фармацевтического качества и фармацевтического производства
Необходимые
умения
Управление процессами отзыва с рынка несоответствующей продукции
фармацевтической системы качества на
Проводить аудит качества (самоинспекцию) фармацевтического производства, контрактных производителей, поставщиков исходного сырья и упаковочных I материалов___
фармацевтической системы качества
Применять междисциплинарный подход при анализе рисков по качеству
Производить анализ состояния фармацевтическом производстве Разрабатывать бизнес-процессы фармацевтического производства
Вести переговоры, делегировать полномочия, осуществлять взаимодействие с персоналом других подразделений
Производить анализ причин отклонений и несоответствий, анализ рисков для качества готовой продукции
Производить анализ отчетов (обзоров) по качеству лекарственных средств Разрабатывать предложения по улучшению деятельности по качеству, составлять планы работ и осуществлять их контроль_____
|
12 | |||||||||||||||||
|
|
3.2.2. Трудовая функция | ||||||||||||
|
| ||||||||||
|
Контроль выполнения установленных требований к помещениям и | оборудованию фармацевтического производства и их обслуживанию Контроль соответствующих условий хранения и транспортировки . лекарственных средств |
|
13 | |||||||||||||||||||||||
|
14
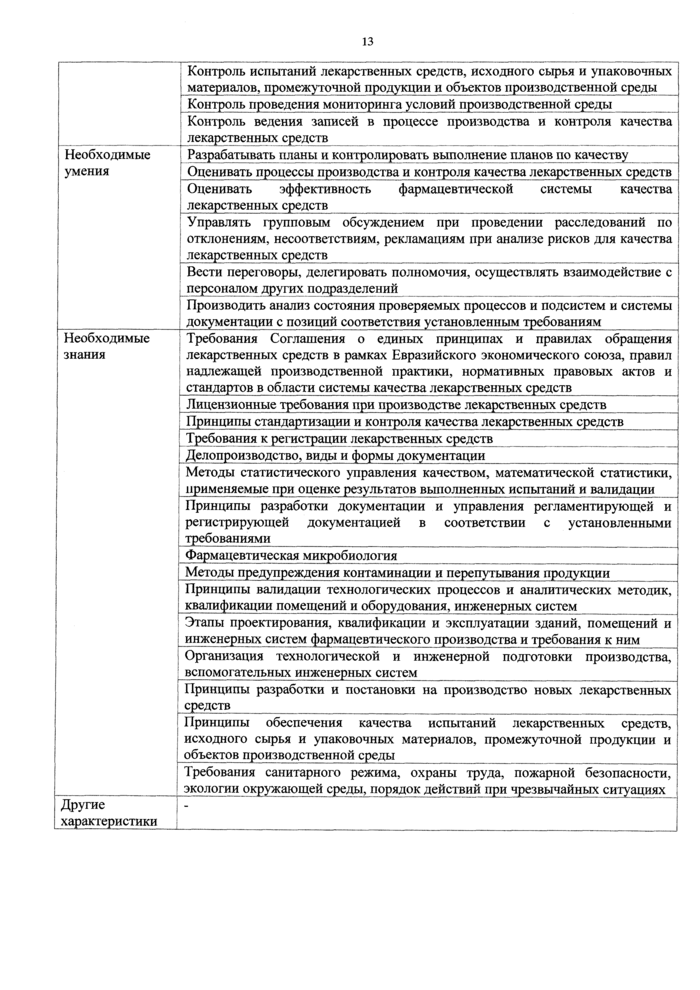
3.23. Трудовая функция
|
Наименование |
Организация работы персонала подразделений по обеспечению |
Код |
В/03.7 |
Уровень (подуровень) |
7 |
|
качества лекарственных средств |
квалификации |
Происхождение „ У Заимствовано из
трудовой функции [ *'1яи№ИЛ оригинала
Код Регистрационный номер
оригинала профессионального
стандарта
|
Трудовые действия |
Планирование потребности в персонале подразделений по обеспечению качества |
|
Организация обучения и оценки знаний персонала подразделений по обеспечению качества | |
|
Подбор и адаптация персонала подразделений по обеспечению качества (в : части своих полномочий) | |
|
Распределение задач и работ между персоналом подразделения, контроль их выполнения | |
|
Организация регулярных медицинских профилактических осмотров персонала подразделений по обеспечению качества | |
|
Оценка условий труда (в части своих полномочий) | |
|
Необходимые умения |
Оценивать потребность в персонале подразделений по обеспечению качества |
|
Оценивать профессионально-квалификационный уровень персонала подразделений по обеспечению качества | |
|
Разрабатывать мероприятия по адаптации персонала | |
|
Согласовывать должностные инструкции персонала подразделений по обеспечению качества | |
|
11ланировать и определять формы и методы обучения персонала | |
|
Разрабатывать систему эффективной мотивации персонала подразделений по обеспечению качества | |
|
Предупреждать конфликтные ситуации | |
|
Анализировать и оценивать деятельность персонала подразделения на конкретных участках работы | |
|
Вести переговоры, делегировать полномочия, осуществлять взаимодействие с 1 со грудниками других подразделений | |
|
Осуществлять контроль соблюдения персоналом санитарных правил, требований охраны труда правил внутреннего трудового распорядка | |
|
Необходимые знания |
Трудовое законодательство Российской Федерации |
|
Локальные акты по направлениям деятельности | |
|
Виды стимулирования персонала | |
|
Калровый менеджмент | |
|
Нормы делового общения и культуры, профессиональной психологии, этики и деонтологии | |
|
Санитарно-гигиенические требования к помещениям и персоналу | |
|
Виды, правила и периодичность прохождения медосмотров | |
|
Требования к отчетной документации, структура и состав отчетной документации по кадрам | |
|
Требования надлежащей производственной практики, нормативных правовых актов и стандартов в области системы качества лекарственных средств в отношении персонала |
|
15 | ||||
|
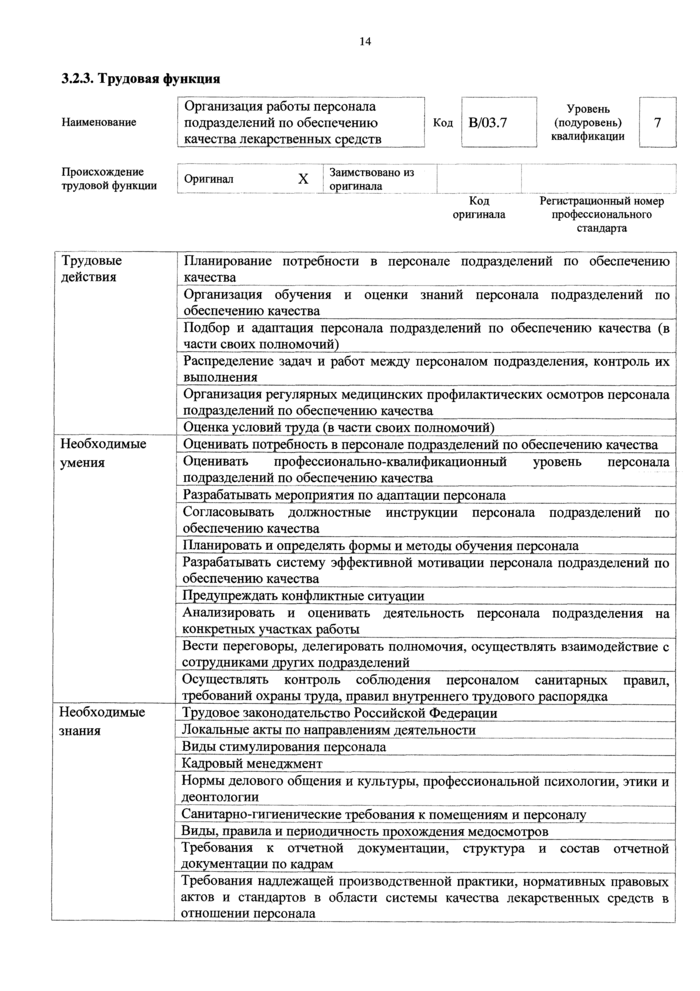
3.2.4. Трудовая функция
|
Организация, планирование и совершенствование фармацевтической системы качества производства лекарственных средств |
Код |
В/04.7 |
Уровень (подуровень) квалификации |
7 |
Наименование
Происхождение „ Y Заимствовано из
трудовой функции нал оригинала
Код Регистрационный номер
орипшала профессионального
стандарта
|
Трудовые действия |
Организация и контроль работы по обеспечению функционирования фармацевтической системы качества лекарственных средств |
|
Утверждение документов фармацевтической системы качества | |
|
Организация мониторинга объектов и процессов фармацевтического производства | |
|
Организация подготовки фармацевтического производства к проведению внешних инспекций и аудитов, в том числе по соблюдению установленных требований | |
|
Мониторинг эффективности фармацевтической системы качества лекарственных средств | |
|
Мониторинг соответствия фармацевтического производства установленным требованиям | |
|
Организация и проведение совещаний по качеству | |
|
Мониторинг и утверждение контрактных производителей, поставщиков исходного сырья и упаковочных материалов | |
|
Разработка планов повышения эффективности фармацевтического производства, устранения брака в организации | |
|
Согласование (утверждение) документов фармацевтической системы качества Информирование персонала о фармацевтической системе качества лекарственных средств | |
|
Разработка и утверждение процессов по улучшению качества готовой продукции и снижению ее себестоимости | |
|
Организация работ по изучению и внедрению научно-техническиэГ] достижений, передового отечественного и зарубежного опыта по i производству лекарственных средств | |
|
Необходимые умения |
Разрабатывать процессы фармацевтической системы качссгва |
|
Анализировать состояние процессов и подсистем фармацевтической системы качества на соответствие усыновленным гребованиям | |
|
Оценивать эффективность фармацевтической системы качества! лекарственных средств | |
|
Производить анализ отчетов (обзоров) по качеству лекарственных средств | |
|
Оценивать эффективность мероприятий по обеспечению и улучшению качества | |
|
Принимать решение о повторной обработке или повторном использовании |
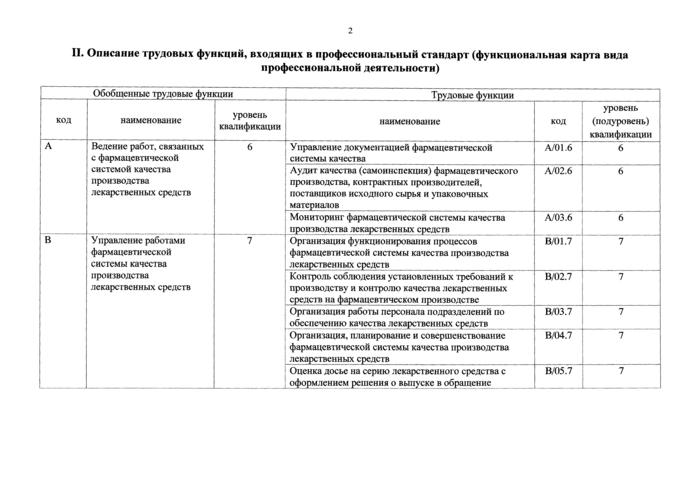
II. Описание трудовых функций, входящих в профессиональный стандарт (функциональная карта вида
профессиональной деятельности)
|
Обобщенные трудовые функции |
1 | |||
|
наименование |
уровень квалификации -- |
ншвеиоммие |
КОД |
уровень (подуровень) квалификации |
|
Ведение работ, связанных с фармацевтической |
6 |
Управление Документацией фармацевтической системы качества |
А/01.6 |
6 |
|
системой качества производства лекарственных средств |
Лудит качества (сачоинспскиия) фармацевтического производства, контрактных производителей, поставщиков исходного сырья и упаковочных материалов |
А/02.6 |
6 | |
|
Мониторинг фармацевтической системы качества производства лекарственных средств |
Л/03.6 |
6 | ||
|
Управление работами фармацевтической системы качества |
7 |
Организация функционирования процессов (фармацевтической системы качества производства лекарственных средств |
ВЛ)1.7 |
7 |
|
производства лекарственных средств |
Контроль соблюдения установленных требований к производству и контролю качества лекарственных средств на фармацевтическом производстве |
BU2.7 | ||
|
Организация работы персонала подразделений но обеспечению качества лекарственных средств |
B.D3.7 |
7 | ||
|
Организация, планирование и совершенствование фармацевтической системы качества производства лекарственных средств |
ВЛМ.7 |
7 | ||
|
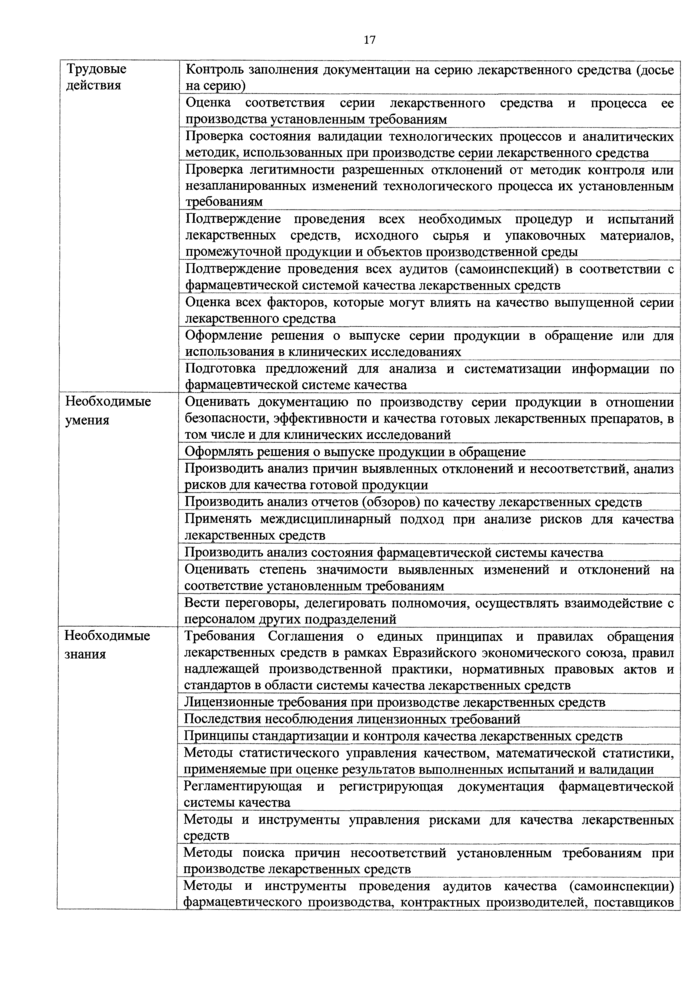
Оценка досье на серию лекарственного средства с оформлением решения о выпуске в обращение |
ВЮ5.7 |
7 | ||
3
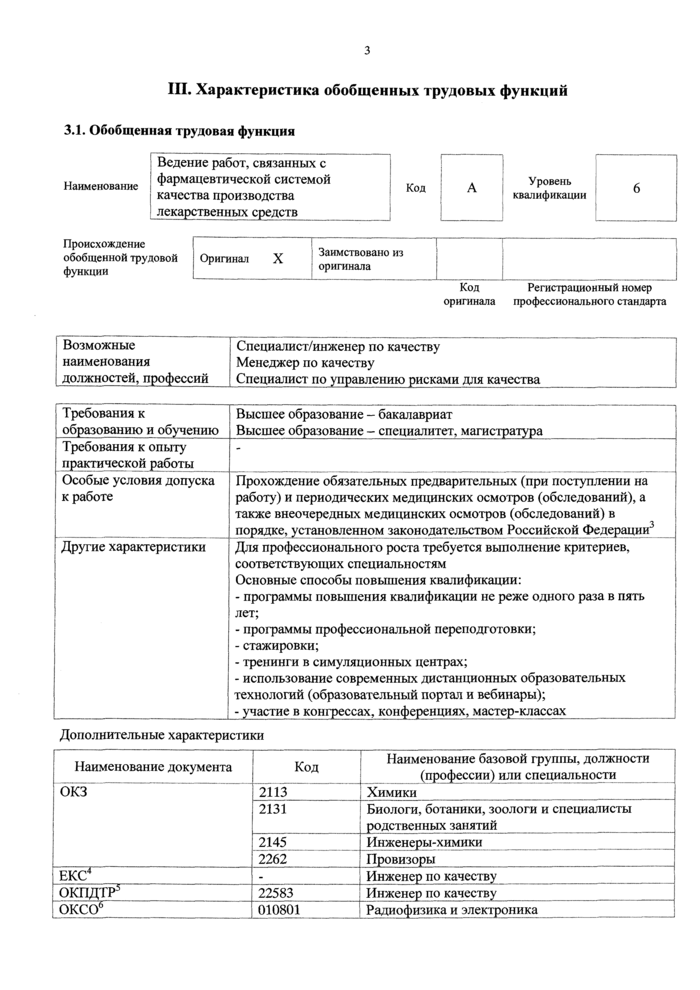
III. Характеристика обобщенных трудовых функций
• Возможные
Специалист/инженер по качеству
наименования
Менеджер по качеству
должностей, профессий
Специалист по управлению рисками для качества
|
• Возможные |
Специалист/инженер по качеству | |
|
наименования |
Менеджер по качеству | |
|
должностей, профессий |
Специалист по управлению рисками для качества |
3.1. Обобщенная трудовая функция
|
Наименование |
|
|
Происхождение обобщенной трудовой функции |
Оригинал X |
Заимствовано из оригинала | ||
|
Код оригинала |
Регистрационный номер профессионального стандарта |
|
Требования к образованию и обучению |
Высшее образование - бакалавриат Высшее образование - спсциалитет, магистратура |
|
Требования к опыту практической работы | |
|
Особые условия допуска к работе |
Прохождение обязательных предварительных (при поступлении на работу) и периодических медицинских осмотров (обследований), а также внеочередных медицинских осмотров (обследований) в порядке, установленном законодательством Российской Федерации3 |
|
Другие характеристики — ■ |
Для профессионального роста требуется выполнение критериев, соответствующих специальностям Основные способы повышения квалификации: - программы повышения квалификации не реже одного раза в пять лет; - программы профессиональной переподготовки; - стажировки; - тренинги в симуляционных центрах; - использование современных дистанционных образовательных технологий (образовательный портал и вебинары); - участие в конгрессах, конференциях, мастер-классах |
|
Дополнительные характеристики | |||||||||||||||||||||
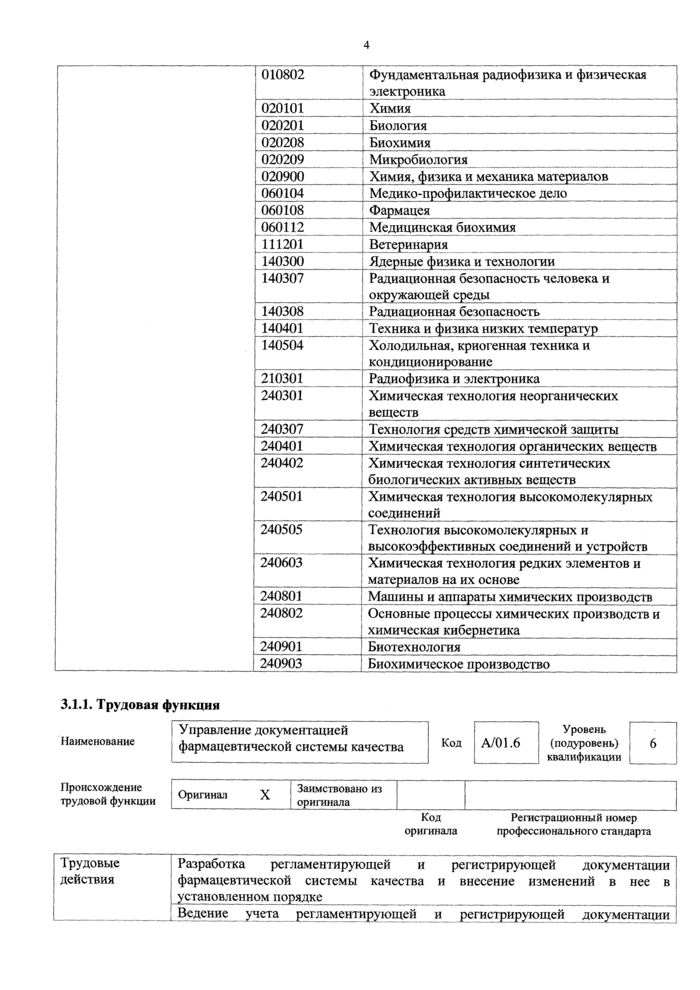
|
|
4 | ||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||
|
240501 Химическая технология высокомолекулярных _[соединений___ |
Технология высокомолекулярных и » высокоэффективных соединений и устройств ; Химическая технология редких элементов и
240505
240603
240801
материалов на их основе____
|
химическая кибернетика | ||
|
240901 |
Биотехнология | |
|
240903 |
Биохимическое производство |
| Машины и аппараты химических производств 240802 Основные процессы химических производств и
|
3.1.1. Трудовая функции | ||||||||||||
|
|
Происхождение трудовой функции |
Оригинал X Заимствовано из оригинала | ||
|
Код оригинала |
Регистрационный номер профессионального стандарта | ||
|
Трудовые действия |
Разработка регламентирующей и регистрирующей документации фармацевтической системы качества и внесение изменений в нее в установленном порядке | ||
|
Ведение учета регламентирующей и регистрирующей документации | |||
|
5 | |||||||||||||||||||||||||
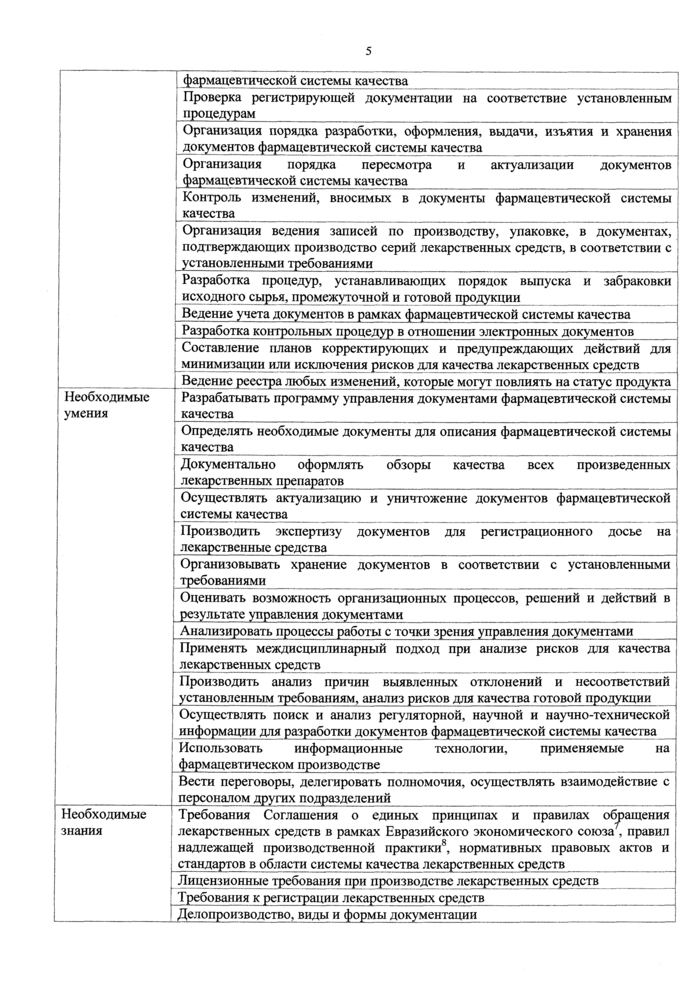
|
|
6 | ||||||||
|
|
3.1.2. Трудовая функция | |||||||||||||||||||||
| |||||||||||||||||||||
|
оригинала профессионального стандарта | |||||||||||||||||||||
|
Трудовые действия , |
Разработка документов для проведения аудитов качества (самоинспекции) I фармацевтического производства, контрактных производителей, поставщиков исходного сырья и упаковочных материалов на соответствие установленным требованиям |
|
Проведение анализа регламентирующей и регистрирующей документации по j аудиту (самоинспекции) фармацевтического производства, контрактных производителей, поставщиков исходного сырья и упаковочных материалов | |
|
Проведение опросов персонала проверяемого подразделения/организации на знание установленных требований Анализ действий и процедур проверяемого подразделения/организации на соответствие установленным требованиям | |
|
Определение значимости выявленных отклонений и несоответствий в фармацевтической системе качества с учетом риска причинения вреда здоровью пациента | |
|
Разработка программы корректирующих и предупреждающих действий по ; результатам аудита (самоинспекции) | |
|
Оформление отчета о проведении аудита (самоинспекции) и согласование его с^ проверяемым подразделением/организацией Разработка рекомендаций по необходимым корректирующим и предупреждающим действиям для фармацевтической системы качества | |
|
j_ | |
|
Необходимые ; умения |
Производить анализ состояния фармацевтической системы качества с позиций рисков для качества лекарственных средств |
|
Определять необходимость и частоту проведения аудитов (самоинспекций) Оценивать предложенные коррелирующие и предупреждающие действия для |
|
7 | |||||||||||||||||||||||||
|
|
3.13. Трудовая функция | ||||||||||||
|
|
Происхождение трудовой функции |
Оригинал X |
Заимствовано из оригинала | ||
|
Код оригинала |
Регистрационный номер профессионального стандарта | |||
|
Трудовые действия |
Проверка выполнения персоналом требований регламентирующей документации фармацевтической системы качества лекарственных средств | |||
|
Проверка функционирования процессов фармацевтической системы качества лекарственных средств | ||||
|
__________________ |
Проверка выполнения требований надлежащей производственной практики контрактными организациями (субподрядчиками) | |||
|
8 | ||||||||||||||||||||||||||||
|
9
3.2. Обобщенная трудовая функция
|
Наименование |
Управление работами фармацевтической системы качества |
Код |
В |
Уровень квалификации |
7 |
|
производства лекарственных средств |
| ||||||||
|
Код Регистрационный номер оригинала профессионального стандарта |
|
Возможные |
Ведущий специалист |
|
наименования |
Главный специалист по качеству |
|
должностей, профессий |
Начальник отдела обеспечения качества |
|
Руководитель службы качества | |
|
Руководитель управления (департамента) качества | |
|
Уполномоченное лицо | |
|
Главное уполномоченное лицо |
|
Требования к образованию и обучению |
Высшее образование - бакалавриат Высшее образование - специалитет, магистратура |
|
Требования к опыту практической работы |
Не менее пяти лет работы по специа!ьности при нашчии высшего образования по программам бакалавриата Не менее двух лет работы по специальности при наличии высшего образования по программам магистратуры, специалитета Для лиц, ответственных за производство, качество и маркировку, и уполномоченных лиц - в соответствии с требованиями законодательства и нормативных правовых актов Российской Федерации |
|
Особые условия допуска к работе |
Прохождение обязательных предварительных (при поступлении на работу) и периодических медицинских осмотров (обследований), а также внеочередных медицинских осмотров (обследований) в порядке, установленном законодательством Российской Федерации |
|
Для лиц, ответственных за производство, качество и маркировку -документ о повышении квалификации не реже одного раза в пять лет Для уполномоченных лиц - документ о повышении квалификации не реже одного раза в пять лет, аттестация в качестве уполномоченного лица производителя лекарственных средств для медицинского применения | |
|
Другие характеристики ---- - ■ ----- . 1 |
Для профессионального роста требуется выполнение критериев, соответствующих специальностям Основные способы повышения квазификации: - программы повышения квазификации не реже одного раза в пять лет; - программы профессиональной переподготовки; - стажировки; - тренинги в симуляционных центрах; - использование современных дистанционных образовательных технологий (образовательный портаз и вебинары); - участие в конгрессах, конференциях, мастер-классах |