МУК 3.2.988-00
Профилактика паразитарных болезней. Методы санитарно-паразитологической экспертизы рыбы, моллюсков, ракообразных, земноводных, пресмыкающихся и продуктов их переработки
Купить МУК 3.2.988-00 — бумажный документ с голограммой и синими печатями. подробнее
Распространяем нормативную документацию с 1999 года. Пробиваем чеки, платим налоги, принимаем к оплате все законные формы платежей без дополнительных процентов. Наши клиенты защищены Законом. ООО "ЦНТИ Нормоконтроль"
Наши цены ниже, чем в других местах, потому что мы работаем напрямую с поставщиками документов.
Способы доставки
- Срочная курьерская доставка (1-3 дня)
- Курьерская доставка (7 дней)
- Самовывоз из московского офиса
- Почта РФ
Методические указания предназначены для применения в аккредитованных (или аттестованных, или лицензированных) лабораториях (в т.ч. контрольно-производственных) и лабораториях учреждений государственной санитарно-эпидемиологической и ветеринарной служб Российской Федерации, осуществляющих контроль качества гидробионтов и продуктов их переработки на соответствие СанПиН 2.3.2.560-96 и 3.2.569-96, а также научных учреждений, занимающихся изучением паразитарных болезней.
Оглавление
Предисловие
1. Область применения и общие положения
2. Отбор, хранение и подготовка к анализу проб гидробионтов и продуктов их переработки
2.1. Отбор, хранение и подготовка к анализу проб гидробионтов при оценке и контроле паразитологического состояния районов промысла (биотопов)
2.2. Хранение и подготовка к анализу рыбной продукции при лабораторном исследовании на производстве, при сертификации, инспекционном контроле
3. Методы паразитологического исследования гидробионтов и продуктов их переработки
3.1. Принципиальные подходы и выбор метода исследования гидробионтов и продуктов их переработки
3.2. Методика неполного гельминтологического исследования рыбы
3.3. Методика неполного гельминтологического исследования земноводных и пресмыкающихся
3.4. Методика неполного гельминтологического исследования беспозвоночных
4. Методы дифференциальной диагностики личинок гельминтов
4.1. Дифференциальная диагностика личинок цестод
4.2. Дифференциальная диагностика метацеркарий трематод
4.3. Дифференциальная диагностика личинок нематод
4.4. Дифференциальная диагностика личинок скребней
5. Методы установления жизнеспособности личинок гельминтов
5.1. По морфологическим признакам и двигательной активности
5.2. Метод электрического стимулирования (с использованием постоянного электрического тока)
5.3. Метод химического воздействия (с использованием химических раздражителей)
5.4. Метод флюоресценции (с использованием ультрафиолетового света)
5.5. Метод окрашивания (с использованием красителей)
5.6. Метод биологической пробы
6. Методы фиксации и хранения паразитов
7. Регистрация результатов исследований рыбной продукции
8. Аппаратура, материалы, лабораторная посуда и реактивы
8.1. Аппаратура и инструментарий
8.2. Лабораторная посуда и материалы
8.3. Реактивы
| Дата введения | 01.01.2001 |
|---|---|
| Добавлен в базу | 01.02.2017 |
| Актуализация | 01.01.2021 |
Этот документ находится в:
Организации:
| 25.10.2000 | Утвержден | Главный государственный санитарный врач РФ | |
|---|---|---|---|
| Издан | ИНТЕРСЭН | 2006 г. |
- ГОСТ 7631-85 Рыба, морские млекопитающие, морские беспозвоночные и продукты их переработки. Правила приемки, органолептические методы оценки качества, методы отбора проб для лабораторных испытаний
ГОСТ Р 8.563-96Государственная система обеспечения единства измерений. Методики выполнения измерений. Заменен на ГОСТ Р 8.563-2009.- СанПиН 3.2.569-96 Профилактика паразитарных болезней на территории Российской Федерации
- ПР 50.3.002-95 Типовой порядок обращения с образцами, используемыми при проведении обязательной сертификации продукции
- СП 1.2.731-99 Безопасность работы с микроорганизмами III - IV групп патогенности и гельминтами
- СанПиН 2.3.2.560-96 Гигиенические требования к качеству и безопасности продовольственного сырья и пищевых продуктов
- Показать все
Чтобы бесплатно скачать этот документ в формате PDF, поддержите наш сайт и нажмите кнопку:

стр. 1

стр. 2

стр. 3

стр. 4

стр. 5

стр. 6

стр. 7

стр. 8
стр. 9
стр. 10
стр. 11

стр. 12

стр. 13

стр. 14

стр. 15

стр. 16
стр. 17
стр. 18
стр. 19
стр. 20
стр. 21
стр. 22

стр. 23
стр. 24
стр. 25

стр. 26
стр. 27
стр. 28
стр. 29

стр. 30
Федеральная служба по надзору в сфере защиты прав потребителей и благополучия человека
ПРОТИВОЭПИДЕМИЧЕСКИЕМЕРОПРИЯТИЯ
Сборник официальных документов
Том I
Редакторы и составители:
Академик РАМН, профессор Г.Г. Онищенко Академик РАМН, профессор Б.Л. Черкасский
Москва
«ИНТЕРСЭН*
2006
ББК51.9 УДК 614.4 (083)
П83
1183 Противоэпидемические мероприятия. Том 1 Санитарные правила и методические документы, н 2 томах. /Редакторы и составители: Г.Г. Онищенко, Б.Л. Черкасский. -М.. «ИНТЕРСЭН*. 2006. - с. 1216
ISBN 5-89834-091-2 ISBN 5-89834-095-5
Сборник содержит основные действующие на территории Российской Федерации правила н методические документы, регламентирующие деятельность по борьбе и профилактике инфекционных (паразитарных) болезней, предназначен для работников службы Роспотребнадзора, а также представляет интерес для специалистов многих других ведомств и областей знания.
ББК51.9
ISBN 5-89834-091-2
Набор, верстка Антипина Н.А.
Печ. л. 76,0
Подписано в печать 10.01.06
Зак. 2761
Формат 70x100/16
Тираж 1000
Отпечет «но а ОАО «Можайский полиграфический комбинат» 143200. г. Можайск, ул Мира. 93.
С«И11ТЕРСЭ11».
2006
Продолжит* таблицы
|
1 |
2 |
3 |
4 |
5 |
6 |
|
1 •4 1 t I |
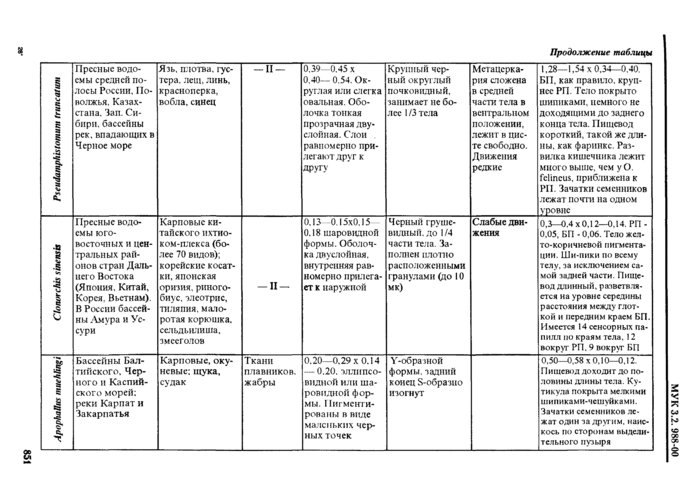
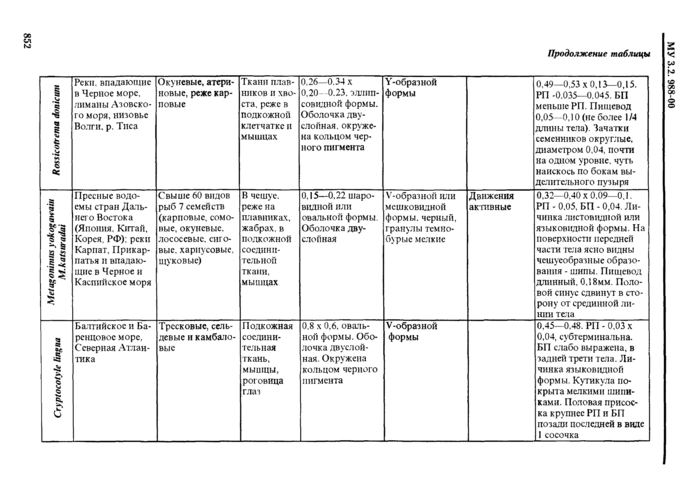
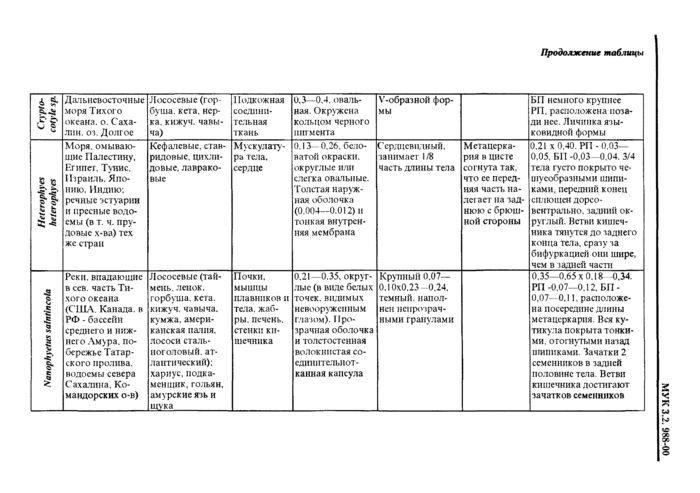
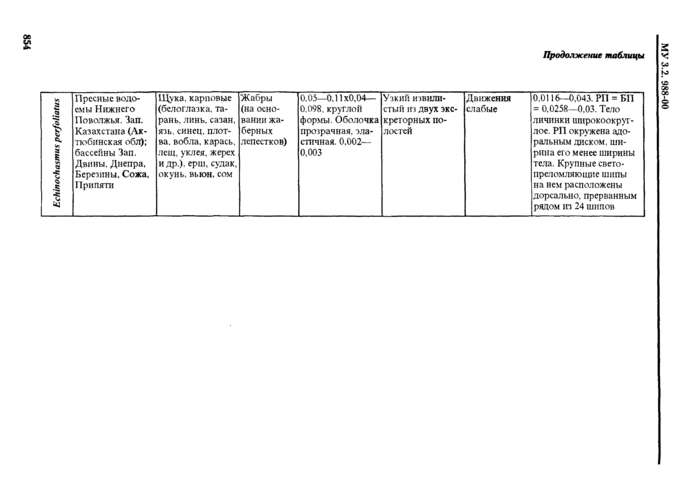
Европа и Азия В РФ чаше всею встречается в дельте Волш. Приморье. на Сахалине |
Земноводные (лягушка озерная, прудовая) Пресмыкающиеся (уж водяной, уж обыкновенный. полоты) |
У лягушек • в мышцах (чаше в бедрах), в полости тела, между петлями кишечника. во внутренних органах У imci) в подкожной клетчатке. полости тела, мускулатуре, межмышечной соединительной ткани |
Обычно бет капсул, у змей ннотла в тонких капсулах па кишечнике ИЛИ ПОДКОЖНО |
Личинки молочно-белого цвета. Длина от 5 мм до 30 см н более, в зависимости от возраста и степени сокращения личинки. Выделенный ит хозяина олсроцсрконд хлрактерту-ется присутствием на теле углов сокращения. чередующихся с расслаб-ленными участками тем В сокращенных участках тело широкое и плоское, с глубокими поперечными склалкамм. в расслабленных участках • уткое и лишстпюс складчатости. Передний конец тела обычно сокращен сильнее других участков. С кодеке небольшой, от тела нс обособлен. втянут внутрь и обычно повернут в сторону. Ботрии значительно короче, чем v других дифидлоботри-КЛ (0.2—0.4 мм) |
• Мышечную ткань острым скальпелем разрезают на пластинки тол ши ной до 5 мм. которые затем раздвигают и просматривают в падающем свете невооруженным глазом. Разрезы можно делать как поперек, так и вдоль мышечных волокон. Делая разрезы мускулатуры и встречая вес толще крупных личинок или капсулы с личинками (величиной около 1 см и более), нужно извлечь несколько экземпляров паразитов целиком для определения вида.
• Выделенных личинок следует поместить в чашку Петри или часовое стекло с физиологическим раствором
• При исследовании тихоокеанских лососей, кунджп и сахалинского тайменя на наличие плероцеркоидов Diphyllobothrium luxi (D. kiebanorskii) разрезы проводят поперек мышечных волокон всей дорсальной части тела, большинство личинок локализуется между жировым и спинным плавниками.
3.2.11.2. Метод исследования мышечной ткани на просвет. Используется также для выявления личинок нематод, цестод, скребней. Для применения этого метода необходимо изготовить специальное приспособление - столик с прозрачной крышкой (размером не менее 40 х 40 см, лучше из молочного или матового стекла) н подсветкой снизу. Можно пользоваться столиком микроскопа типа МБС с нижней подсветкой.
• Мышечную ткань рыбы (или филе) острым скальпелем или ножом нарезают на пластинки толщиной не более 2 -3 см.
• Куски мышц помещают на верхнюю крышку столика и просматривают. Яркость подсветки и толщина ломтиков в зависимости от степени просвечиваемости мяса конкретного вида рыбы устанавливается опытным путем.
• Обнаруженных личинок гельминтов выделяют из мышечных тканей рыбы с помощью препаровальных игл.
• Выделенных личинок помещают в чашку Петри или часовое стекло с физиологическим раство|юм.
3.2.11.3. Компрессорный метод
3.2.11.3.1. Метод применяется в основном для выявления метацеркарпи трематод. Это очень мелкие, незаметные или малозаметные невооруженным глазам объекты, поэтому для их обнаружения и дифференциации видовой принадлежности необходимы спецназьные микроскопические исследования. Используют метод при просмотре* мышечной ткани и внутренних органон рыб. а также мышечной ткани ракообразных. Возможно его использование при исследовании внутренних органон рыб па наличие личинок нематод и цестод.
3.2.11.3.2. Целесообразно компрессорному исследованию подвергать органы и участки мышечной ткани наиболее вероятной локализации метанеркарий (табл. 2)
3.2.11.3.3. Участок тела наиболее вероятной локализации метацеркарпи освобождают от чешуи. затем скальпелем надрезают кожу по средней линии спины и двумя надрезами от первого надреза до боковой линии выделяют участок средней трети спины. Кожу с вычлененного участка поднимают пинцетом и с помощью скальпеля отделяют ее гак, чтобы подкожная клетчатка осталась на поверхности мышц. Острым скальпелем соскабливают или срезают тонкие пластинки поверхностного слоя мышц, толщиной не более 2-3 мм, размещают их на нижнем стекле компрессо-рия, накрывают другим стеклом н сдавливают их. Наиболее удобно использовать компрессорные стекла, нарезанные из обычного оконного стекла с краями, обработанными наждаком. Размеры стекол 6-8 х 12-15 см, нижнее стекло немного больше верхнего, толщина 3-5 мм. Срезы просматривают с помощью микроскопа типа МБС. используя увеличение в 16-48 раз (окуляр 8х. 12х,объектив 2х, 4х). Для уточнения диагноза кусочки тканей с личинками переносят на предметные стекла, накрывают покровными и исследуют при большем увеличении (например, объектив 8х. 10х, окуляр 7х или 10х, бинокулярная насадка 1,5х) с помощью микроскопа типа Биолам, Бимам.
При обнаружении личинок можно ограничиться просмотром мышц с одной стороны тела. При отсутствии личинок необходимо просмотреть срез и с другой стороны. При исследовании молоди рыб длиной до 20-25 мм их компрессуют целиком. Более крупных сеголеток распластывают на две половинки и просматривают в компрессории со стороны разреза, не снимая кожи и не освобождая от чешуи.
Подсыхающие срезы, препараты увлажняют водой или физиологическим раствором из пипетки.
845
3.2.11.4. Метод переваривания в искусственном желудочном соке Необходимые реактивы и оборудование (дополнительно): 1. Химические реактивы: пепсин: концентрированная НС1; NaCl; дистиллированная вода,.
2. Весы с набором разновесов или весы электронные
3. Шпатели (лопаточки) металлические, стеклянные, деревянные
4. Воронки стеклянные разных размеров
5. Мерные цилиндры (0.5- 0,25 л)
6. Банки стеклянные с притертой пробкой для хранения реактивов (0.1, 0.25, 0,5 л)
7. Банки стеклянные (или колбы) для дистиллированной воды емкостью 1-2 л
8. Набор стеклянных мерных пипеток (от 1 до 10 мл)
9. Химические стаканы “ 10. Покровные стекла
11. Ситечки с ячеей 1 х 1 мм
12. Термостат
13. Холодильник
3.2.11.4.1. В специальных целях при необходимости выделения личинок из тканей гидробн-онтов (для дифференциации видовом принадлежности, получения материала для контрольной биологической пробы, при низкой интенсивности инвазии или для се подсчета) используется метод переваривания. Он также более эффективен при исследовании продуктов переработки гид-робиоитов (фарша, пресервов). В основном используется для выделения мстацсркарий трематод, реже личинок нематод.
3.2.11.4.2. Метод основан на том. что в кислой среде метацеркарий освобождаются от наружной оболочки, а окружающая их мышечная ткань переваривается в искусственном желудочном соке.
3.2.11.4.3. При/omoaienue искусственного желудочного сока. На 1000 мл дистиллированной воды (при ее отсутствии можно использовать кипяченую остывшую до темнс|>атуры 37- 38’ С водоп|юводную волу) добавляют 7 г пепсина, 9.0 г поваренной соли (SaCD и 10 мл концентрированной соляной кислоты (IIC1).
3.2.11.4.4. Для выделения метацеркарий трематод берут подкожную мышечную ткань (до 0,5 см), а мелких личинок нематод -нею мышечную ткань. Ее отделяют oi кожи, измельчают ножом или в мясорубке (при выделении личинок нанофистуса используют дополнительно и почки). Затем ее заливают н соотношении 1:10 приготовленным искусственным желудочным соком (1 часть фарша и 10 частей искусственного желудочного сока). Пробу помещают в термостат на 3 ч при температуре 36-37 *С. после чего содержимое фильтруют в стеклянные цилиндры через металлический фильтр с размером ячеек lx 1 мм или однослойный бинт. Через 15 20 мин верхний слой желудочною сока с переваренной мышечной тканью сливают, а осадок переносят в чашку Петри (или глубокое* часовое стекло) и микрогкопируют. Для лучшего отделения личинок в чашку Петри наливают физиологический раствор, делают несколько круговых движений, в результате которых метацеркарий концентрируются в центре чашки Петри (часового стекла), а излишки физраствора с остатками мышечной ткани удаляют пипеткой. Процедуру повторяют до полного исчезновения остатков не переваренной мышечной ткани.
Эффективность метода переваривания, в сравнении с компрессорным, в 1.5 раза выше. Мс-тацеркарни трематод, выделенные этим способом из свежей рыбы, сохраняют свою структуру и жизнеспособность в физрастворе в течение 10-24 ч при температуре 20- 25 *С и 5-7 дней при температуре 1-4 ’С и могут быть использованы для биопробы.
3.2.12. Заранее подготовленную чешую (2.1.6) исследуют с использованием микроскопа МБС (увеличение 16 48 раз. окуляр 8х, 12х, объектив 2х,4х) в небольшом количестве воды на наличие метацеркарий Afetagonimus yokogauai. Metagonimus katsuradai.
3.3. Методика неполного гельминтологического исследования земноводных и пресмыкающихся
33.1. Процедура м порядок исследования земноводных и пресмыкающихся аналогичны таковым при инспектировании рыбы. Исследуют полость тела, органы и ткани, включая мускулатуру.
3.4. Методика неполного гельминтологического исследования беспозвоночных
ЗАЛ. Двустворчатые моллюски.
846
3.4.1.1. Для раскрытия раковины тонкий нож или скальпель вводят между створками и разрезают мускул-замы кате ль. Из открытой раковины, надрезав мантию в передней ее части, сливают мантийную жидкость. Между одной из створок и прилегающей к ней мантийной складкой вводится плоская ручка скальпеля. Двигая ее по краю створки вперед и назад, сначала отделяют край мантии, прикрепленный к створке, затем передний и задний мускулы-замыкатели (аддукторы). На следующем этапе отделяют мантию и аддукторы от другой створки, после чего раковина легко удаляется.
У гребешков и устриц аддуктор один и находится в середине тела, несколько ближе к заднему краю.
3.4.1.2. Вынутое из раковины тело моллюска помешают в кювету (или чашку Петри) с водой. Осматривают мантию и просвечивающие в спинной части тела через полупрозрачную кожу - внутренние органы: печень, лежащую непосредственно позади переднего аддуктора или на спинной стороне нал аддуктором (у гребешков и устриц), перикардий и граничащие с задним аддуктором почки. Обнаруженных личинок нематод извлекают препаровальной иглой.
3.4.1.3. Мантийные складки отрезают и просматривают на просвет (п. 3.2.11.2) или компрсс-сорно (п. 3.2.11.3). Затем отрезают и осматривают жабры.
3.4.1.4. Отн репаро вы вают гонады, залегающие в спинной части ноги. Они расчленены и слагаются из многочисленных мелких долек, окружающих петлю кишечника. Гонады исследуют компрессорным способом. Здесь наиболее вероятно обнаружение личинок Echinocephalus sinensis и Sulcascaris sulcata. Затем выделяют пищеварительную систему н исследуют таким же образом.
3.4.1.5. Аддукторы и ногу нс следуют так же. как мускулатуру у рыб (и. 3.2.11). Аддуктор гребешков - место наиболее вероятной локализации Sulcascaris sulcata.
3.4.1.6. Выявленных личинок помещают в чашку Петри или часовое стекло с физиологическим раствором для дальнейшего определения вида пара ш га.
3.4.2. Головоногие моллюски. У кальмаров и каракатиц разрезается мантия на брюшной стороне. Разрез делают ножницами ши скальпелем но срединной линии, начиная от края мантии, до основания плавника. При этом стараются не повредить чернильный мешок. У осьминогов, кроме того, разрезают мускулистую продольную перегородку, открывая доступ в мантийную полость. Отгибают стенки мантии и осматривают внутренности. Последовательно отделяют жабры, гонады. пищеварительную систему. Ннут|>сшп1с органы исследуют комнрсссорно. Особое внимание обращают па гонаду, где возможно обнаружение личинок нематод рода Anisakis. Освобожденную от внутренних органов мантию исследуют аналогично мышечной ткани рыб - на просвет (и. 3.2.11.2) или методом параллельных разрезов (п. 3.2.111). На внугрсчшей стороне мантии, в пленках встречаются личинки нематод родов Anisakis и Contracaecum.
3.4.3. Ракообразные.
3.4.3.1. При инспектировании пресноводных крабов и раков на наличие метацеркарпй па-рагониммл в первую очередь исследуют мышцы грудного отдела и сердце, как места наиболее вероятной локализации личинок (до 90 % случаев). Для этого у ракообразных ножницами срезают карапакс, затем с помощью скальпеля вырезают мышцы грудного отдела. Используя компрессорный метод (н. 3.2.11.3), ми крое копиру ют при увеличении в 16-48 раз (окуляр 8х, 12х, объектив 2х, 4х). Из задней части грудного отдела вычленяют сердце и исследуют таким же образом.
3.4.3.2. С боковых сторон головогруди срезают жабры и исследуют компрессорио в небольшом количестве воды.
3.4.3.3. Для выделения мяса из абдомена, последний отрезают от груди и ножницами разрезают панцирь от верхнего края «шейки» до тельсона (хвостового веера). Конечности (у крабов и раков) разрезают на части (поперек) вблизи кожистых суставов, одновременно раз|)сзаи хитиновую пластинку, прикрепленную к суставу. Панцирные трубки разрезают вдоль и извлекают мясо. Клешню разбивают резким и сильным ударом деревянного молотка. Всю мышечную ткань просматривают в компрсссории.
3.4.3.4. Всю выделенную мышечную ткань можно исследовать методом переваривания в искусственном желудочном г оке (п. 3.2.11.4).
847
4. Методы дифференциальной диагностики личинок гельминтов
Необходимые реактивы и оборудование:
1. Химические реактивы: физиологический раствор: жидкость для просветления нематод (1 часть дистиллированной воды + 1 часть концентрированной молочной кислоты + 1 часть глицерина)
2. Предметные стекла
3. Большие предметные стекла (6-8 х 12-15 см, толщиной 2- 4 мм)
4. Покровные стекла
5. Чашки Петри
6. Часовые стекла
7. Пинцеты ратных размеров (анатомические, хирургически, глазные)
8. Препаровальные иглы разной толщины
9. Пипетки стеклянные (пастеровские)
10. Резиновые груши
11. Бинокулярный микроскоп типа МБС
12. Луна
13. Осветитель для бшкжуляра любой марки
14. Световой микроскоп типа Бмолам, Бимам
15. Осветитель к микроскопу любой марки
16. Окуляр-микрометр для светового микроскопа
17. Окуляр-микрометр для бинокулярного микроскопа
18. Объект-микрометр
Для определения видовой принадлежности личинок гельминтов необходимо исследование с применением оптических средств.
Извлеченных из рыб. моллюсков, ракообразных, земноводных и пресмыкающихся плеро-неркоидов, личинок нематод, скребней, отделенных от тканей метацеркарпй или включения, которые могут быть приняты за паразитов (в том числе ммцнетированных или инкапсулированных) помещают на предметное стекло в каплю воды или физиологического раствора, накрывают покровным стеклом и исследуют сначала пол малым (в 56 150 раза, окуляр 7х, 10х, объектив 8х.10х, бинокулярная насадка 1,5х). а затем пол большим (в 140 600 раз. окуляр 7х,10х. объектив 20х. 40х, бинокулярная насадка 1,5х) увеличением микроскопа.
Дифференциальная диагностика нематод требует предвари тельного выдерживания личинок в просветляющей жидкости. Крупных личинок с плотной кутикулой просветляют до двух-трех дней (личинки сем. Anisakidae), мелких с тонкой кутикулой - не менее 3-5 ч.
Для провеления необходимых измерений личинок, отдельных их частей или органов следует пользоваться окуляром-микрометром (окуляром, с установленной в его фокальной плоскости прозрачной пластинкой с линейкой длиной в 1 см с делениями, соответствующими 0,1 мм). Цена деления шкалы при использовании разных объективов меняется и вычисляется с помощью объект-микрометра - препарата, представляющего собой нанесенную на стекло шкалу с ценой деления 0,01 мм. Если п» делений изображения объект-микрометра но величине соответствует п делениям окулярной шкалы, точное значение увеличения объектива (Ь) будет равно b - 10 п/m. При измерении объектов наблюдают, в пределах скольких делений п окулярной шкалы располагается изображение измеряемого элемента, и размер его (а) подсчитываю! по формуле: а - 0.1 n/m.
В случае, если исследователь не может установить видовую принадлежность личинок гельминтов, паразитов следует поместить в фиксатор (см. раздел 6) и направить на консультацию в базовые (головные в системах сертификации или СИД К*) испытательные лаборатории (центры), аккредитованные в установленном порядке или в профильные научно-исследоватсльскнс институты.
4.1. Дифференциальная диагностика личинок цестод
4.1.1. Цестоды, заражение человека которыми происходит при употреблении в пищу необез-зараженной рыбной гцюдукиии. относятся к семейству Diphyllobothriidae.
В пресноводных, проходных и морских рыбах, а также земноводных и пресмыкающихся паразитирует личиночная стадия лентецов - плероцеркоид, имеющий вид нерасчлененного мягкого червя (складки на теле могут создавать вид ложной сегментации), слегка уплощенного в дорзо-
848
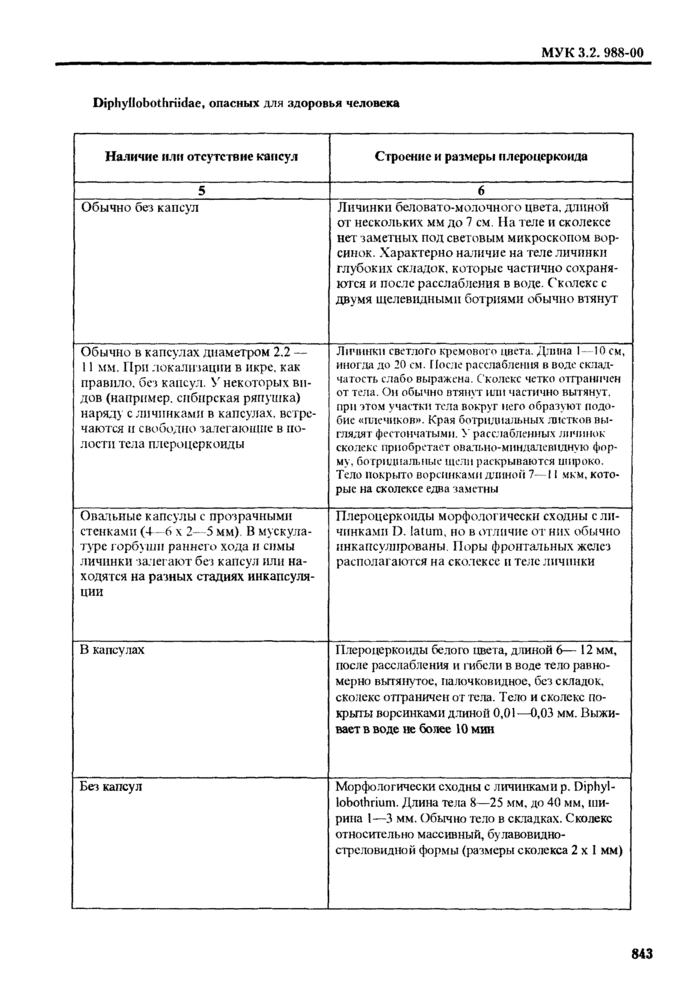
вентральном направлении, молочно-белого или кремового цвета. Головной конец (сколскс) не имеет крючьев или других подобных образований, но имеет две щелевилные присоски (ботрии) -органы прикрепления. Длина тела личинки колеблется от 1 -2 мм до 10 и более сантиметров. Установить наличие у личинки сколекса с ботриями необходимо, так как за илсроцеркоида могут быть приняты их фрагменты или фрагменты других цсстод.
У живых, только что извлеченных из свежей рыбы плсроцеркои-дов, сколекс втянут (инва-гинирован) или частично втянут, но при помещении их в теплую воду сколекс вытягивается, то сокращаясь, то расслабляясь. На вытянутом сколексе становятся заметными ботрии.
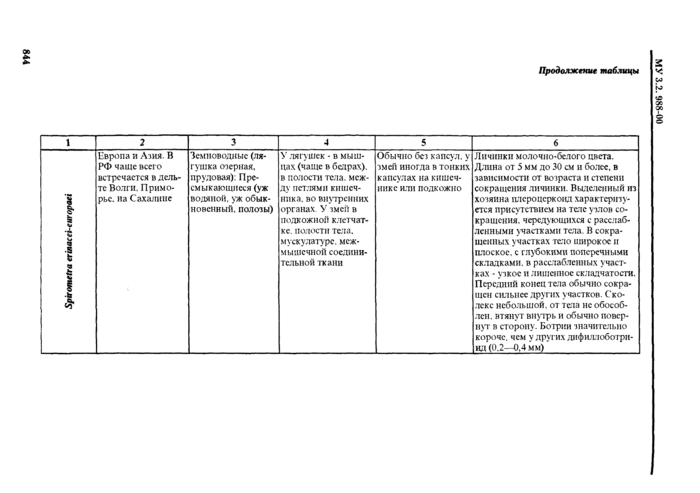
4.1.2. Половозрелые формы гельминтов р. Diphyllobothrium встречаются в кишечнике морских и наземных млекопитающих, рыбоядных птиц. У человека могут паразитировать DiphyUobothrium latum, Diphyllobothrium dendriticum и Diphyllobothrium luxi (D. klebanovskii). Diphyllobothrium ditremum - паразит рыбоядных птиц - также может приживаться у человека, но половой зрелости не достигает и яиц не выделяет, медицинское значение его невелико. Отмечаются случаи паразитировании у человека лентецов рода Dyplogonoporus (Г), fukuokaensis зарегистрирован у человека в Японии), заражение которыми происходит от необеззараженнмх морских и проходных рыб. Плероцеркоиды рода Dy/dogonofiorus морфологически сходны с таковыми рода Diphyllobothrium.
Случаи сиарганоза человека, вызываемого Spirometra erinacei-europaci, встречаются спорадически к России и странах Юго-Восточной Азии, реже на других континентах (в Австралии и Америке распространены другие виды Spirometra). Плероцеркоиды (спарганумы) рода Spirometra у человека не развиваются до взрослой стадии. Их окончательные хозяева - домашние и дикие плотоядные (сем. Собачьи, Кошачьи).
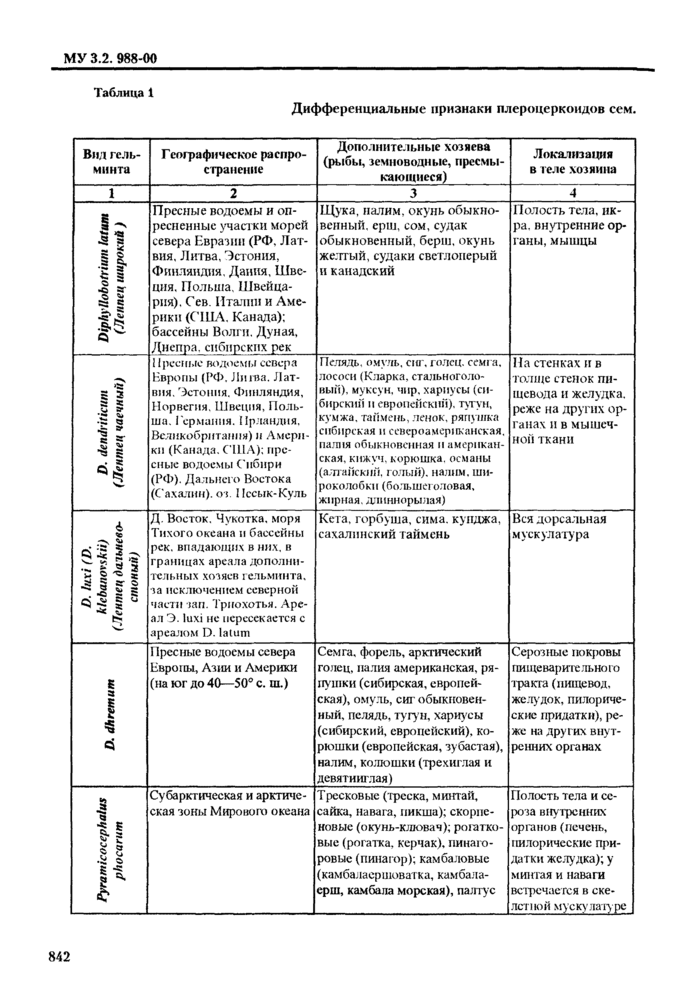
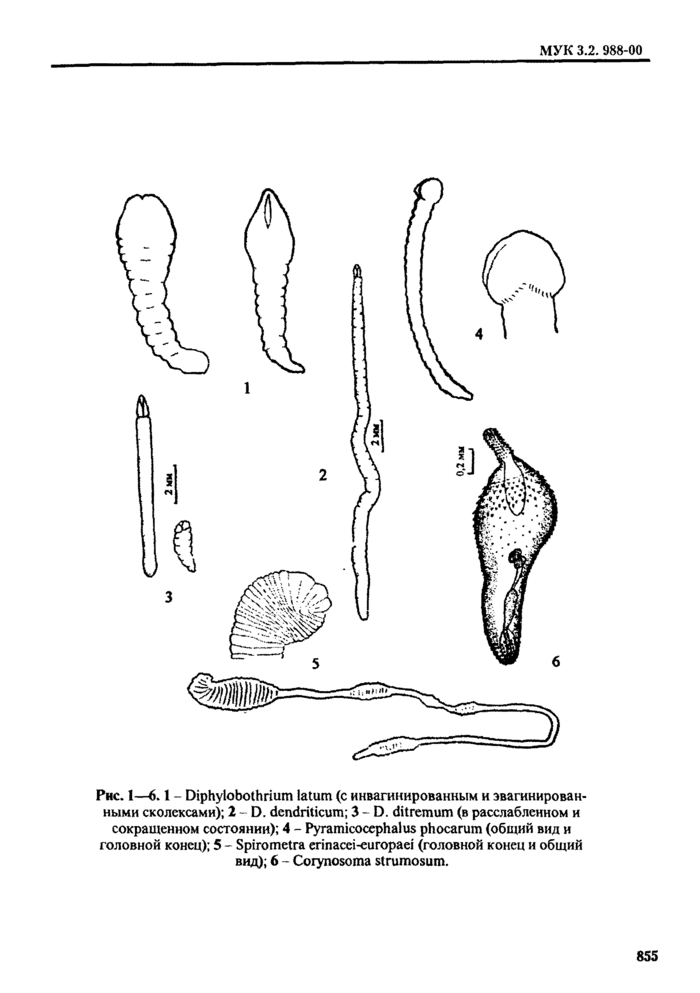
4.1.3. При определении видов плероцеркоидов используют морфологические признаки, характер локализации личинок (капсул с личинками), состав дополнительных хозяев, географическое распространение (см. табл. 1, рис. 1-5).
Кроме того, при исследовании свежей и охлажденной рыбы имеет значение такой признак, как срок выживания личинок в пресной воде. Так, развитые иле|Юцерконды Diphyllobothrium latum и Diphyllolxithrium luxi(D. klebanovskii) выживают в воде около суток и более. Dtphyllofxithnum dendriticum - до 2,5 ч (мелкие - не более 1 ч). a Diphyllobothrium ditremum (по локализации инкапсулированных личинок сходного с Diphyllobothrium dendriticum) - не более 10 мин.
Спарганумы Spirometra erinacei-enivpaei с ненои|)ежлснны.ч те-гумептом выживают в водопроводной воде более суток, в физиологическом растворе - до 8-13 дней.
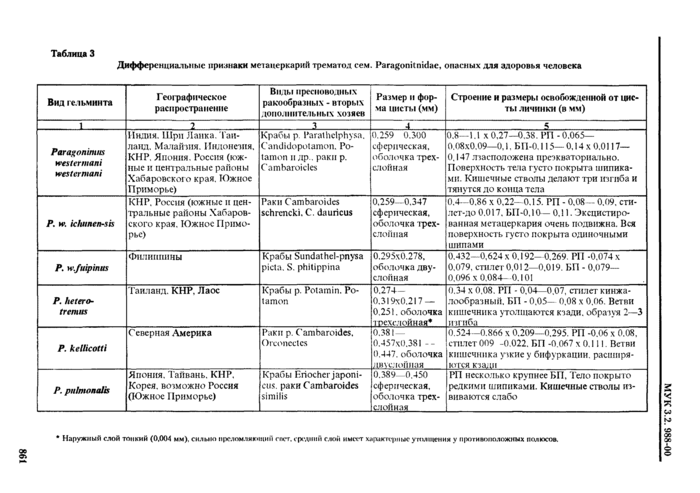
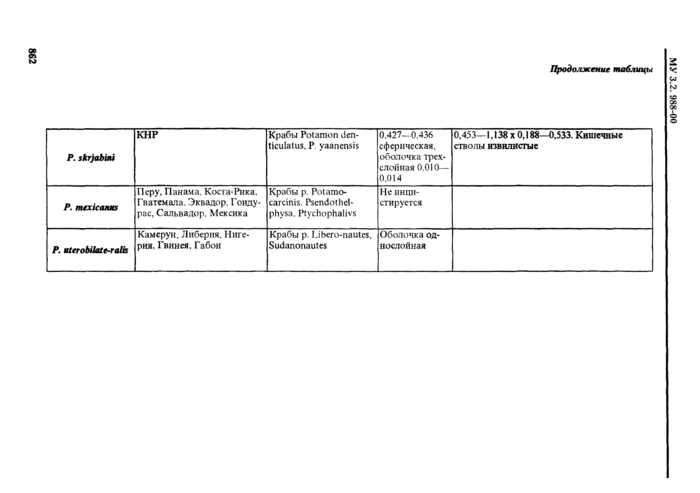
4.2. Дифференциальная диагностика метацеркарий трематод
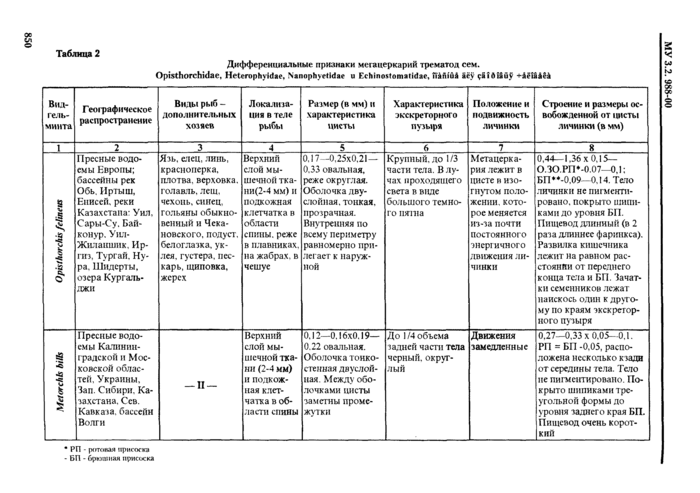
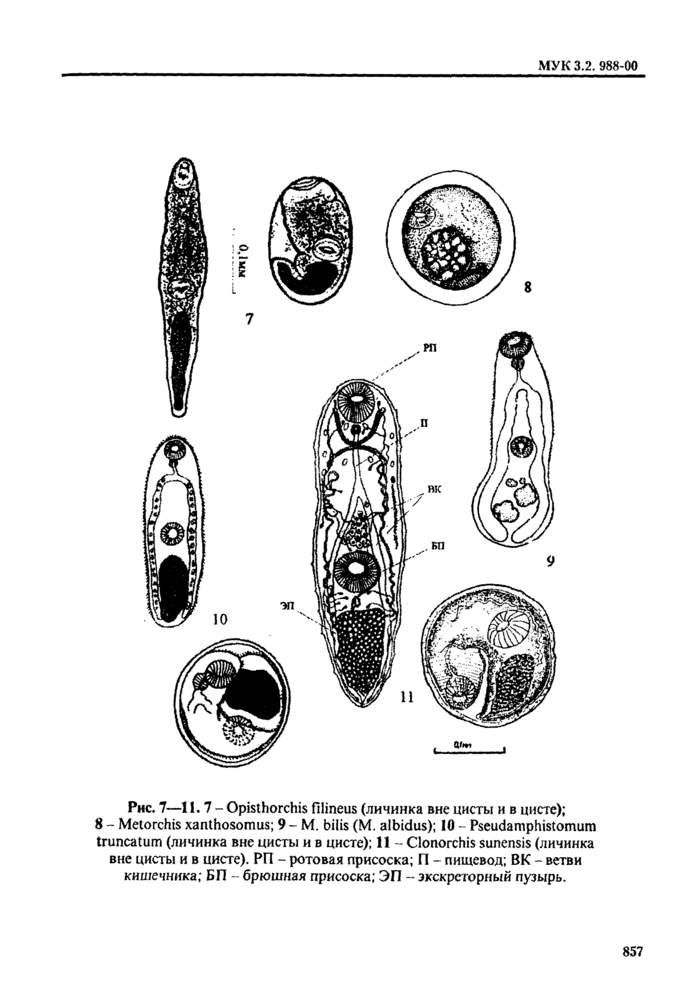
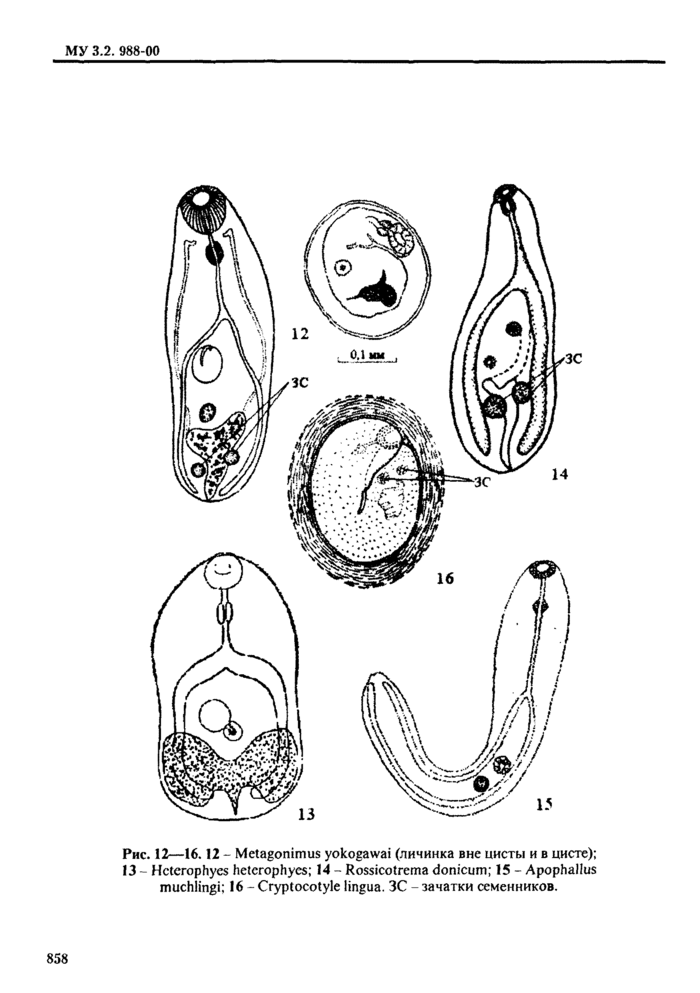
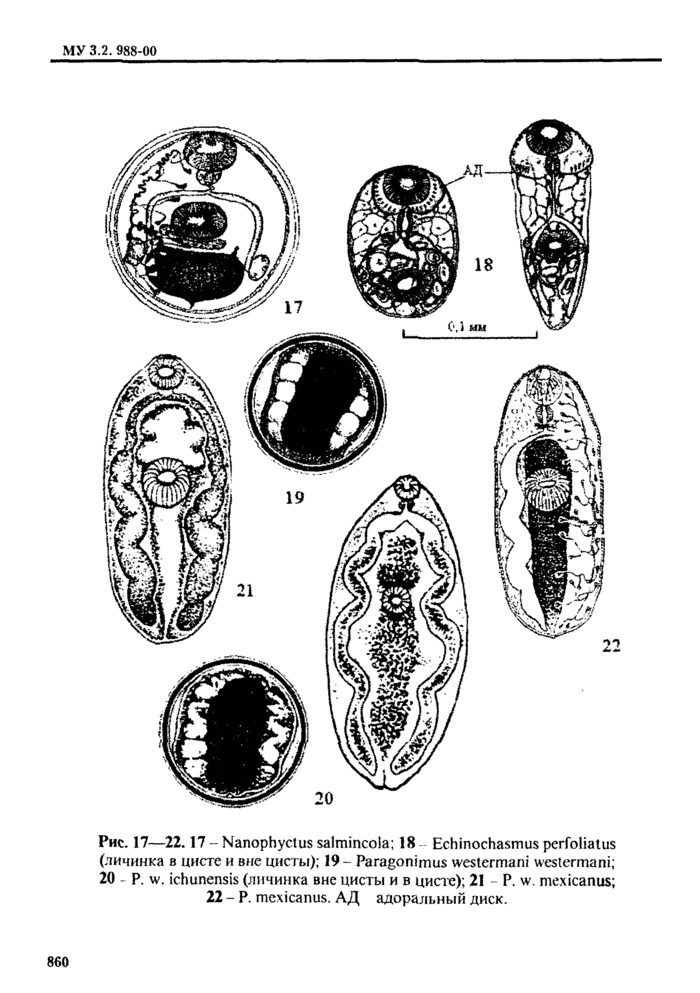
4.2.1. Трематоды - наиболее распространенные паразиты морских и пресноводных рыб. Подавляющее их большинство не опасно для здоровья человек;». Метанеркарии трематод * возбудители заболевании человека - относя гея к 5 семействам: Opisthorchidae, Heterophyidae, Nanophyetidae, Echinostomatidae и Paragonimidae.
При определении семейства и вида трематод в первую очередь ориентируются на размер и форму цисты, характер ее оболочек; положение личинки в цисте ( подвижность* *) и ее строение, в т. ч. размер, цвет и форму экскреторного пузыря; круг дополнительных хозяев и локализацию в теле рыбы или ракообразных (см. табл. 2. 3). Все опасные для здоровья человека метанеркарии, встречающиеся в рыбе, заключены в цисты. Размеры цист не превышают 1 мм. Поэтому обнаруженные в рыбе более крупные или свободные, не инцистированные метанеркарии не нуждаются в дальнейшем исследовании.
Мстацеркарнн сеМ.Paragonimidae могут быть как в цистах, гак и свободными.
Определение трематод до вида но строению цисты возможно только при достаточном навыке исследователя. В противном случае для уточнения видовой принадлежности трематод целесообразно извлечь метацеркарию из цисты.
* СНЛК • сеть наблюдения и лабораторного контроля. 20
* В тех случаях, ког да для метанеркарии характерна подвижность кнутри аисты, ее можно наблюдать не только в еосженылоплатой рыбе, но и п течение нескольких дней после. Полнижность может мм-станаплинатмя и после н|К)мо|К1ЖИ1ыння рыбной н|юдукнии. недостаточного но нрсмсни для гибели личинки, при повышении температуры до 37 *С.
28-2761
849ПРЕДИСЛОВИЕ
Данное издание представляет собой сборник документов, которые регламентируют противоэпидемическую деятельность в России.
В течение последних лет был утвержден ряд новых Санитарных правил и норм, методических указаний и нормативов. Кроме того, значительная часть документов была пересмотрена и скорректирована в соответствии с новыми научными данными. международными требованиями и новыми законами, направленными на обеспечение санитарно-эпидемиологического благополучия населения.
При отборе материалов для настоящего сборника составители учитывали наиболее полную информацию о нормативной и методической базе официальных документов департамента Госсанэпиднадзора министерства здравоохранения и социального развития России.
Сборник предназначен, в первую очередь, для работников санитарно-эпидемиологического сектора службы Р<х:нотре6надзора, а также представляет интерес для специалистов самых разных ведомств и областей знания:
- ветеринарной службы,
- МЧС,
- органов охраны природы,
- кафедр,
- научно-исследовательских институтов,
- аналитических центров,
- региональных и местных органов управления, принимающих решения в области обеспечения санитарно-эпидемиологического благополучия населения и др.
Документы в сборнике расположены по принципу: от наиболее общих и важных к частным, а также по группам инфекционных болезней в зависимости от механизма передачи их возбудителей. Кроме того, представлены документы, касающиеся специальных разделов противоэпидемической деятельности, таких как Н|юфилактика внутрибольничных инфекций, санитарно-эпидемиологическая охрана территории, вакцинопрофилактика и др.
Составители и редакторы сборника выражают искреннюю благодарность всем коллегам, которые принимали участие в разработке и совершенствовании документов по обеспечению санитарно-эпидемиологического благополучия населения.
3
УТВЕРЖДАЮ
Главный государственный санитарный врач Российской Федерации - Первый заместитель министра злрав<х>хранения Российской Федерации
Г.Г. Онищенко
25 октября 2000 г.
Дата введения: 1 января 2001 г.
3.2. ПРОФИЛАКТИКА ПАРАЗИТАРНЫХ БОЛЕЗНЕЙ МЕТОДЫ САНИТАРНО-ПАРАЗИТОЛОГИЧЕСКОЙ ЭКСПЕРТИЗЫ РЫБЫ, МОЛЛЮСКОВ, РАКООБРАЗНЫХ, ЗЕМНОВОДНЫХ, ПРЕСМЫКАЮЩИХСЯ И ПРОДУКТОВ ИХ ПЕРЕРАБОТКИ
Методические указания МУК 3.2. 988-00
1. Область применения и общие положения
1.1. Настоящие методические указания устанавливают методы санитарно-паразитологической экспертизы рыбы и нерыбных объектов промысла (моллюсков, ракообразных, земноводных, пресмыкающихся), а также продуктов их переработки (далее по тексту -рыбная продукция).
1.2. Методические указания предназначены для применении в аккредитованных (или аттестованных, или лицензированных) лабораториях (в ч.ч. контра(ьно-произволивенных) и лабо|ха-торних учреждений государственной санитарно-эпидемиологической и ветеринаркой служб Российской Федерации, осуществляющих контрать качества гидробионтов и продуктов их лерсра-ботки на соответс твие Сак Пи И 2.3.2.560-96 и 3.2.569-96. а также научных учреждений, занимающихся изучением паразитарных батезней.
Специалисты лаборггормй должны пройти подготовку в заявленной области аккредитации (аттестации. лнцсн.н1ропанпя), владел» мстраюгическп аггестованными методиками и методами. утверждениыхш или допущенными к применению Госстандартом и госсаизннлслужбой России и соответствующих требованиям ГОСТа Р 8.563 96 «Методики выполнения измерений».
13. Среди всех классов паразитов (простейшие, ракообразные, гельминты и др.), встречаю-щихся в рыбе и других гндробионтах, опасными для здоровья человека являются только личинки гельминтов: цестод. трематод, нематод и скребнем. К наиболее социально значимым и широко распространенным заболеваниям, передающимся через рыбу и друтх гплробпонгов. относятся описторхоз. днфиллоботришы и эндемичные для Дальнего Востока России ме-тагонимоз. нано* фистоз и клонорхоз. Определенную опасность для здоровья люден могут представлять гельминты. приживающиеся, но не развивающиеся до взрослой сталии у человека (использующие сто в качестве резерву арного хозяина), что затрудняет диагностику заболевания. Это спирометра, гиа-тостомы.болбозомы. коринозомы н некоторые виды анизакид и нарагоннмид. Заражение человека пирамикоцефалусаыи. анофаллами. кринтокотилюсами происходит крайне редко. Друтх гельминтов (мсторхисов, нсевдамфисто.мумов. гетерофиссов, эхинохазмугов и др.) можно отнести к паразитам. спорадически встречающимся у человека на определенных территориях.
1.4. Обгя'ктачи исследований являются промысловые пресноводные и морские рыбы, моллюски, ракообразные. ;<емноводные, пресмыкающиеся и продукты их переработки.
1.5. Потенциальную опасность для здоровья человека представляют только живые личинки гельминтов. В связи с этим, при паразитологическом инспектировании гилробионтон и продуктов их переработки следует определить жизнеспособность выявленных плероцеркоилов. мета* перкарин, а кантелл и личинок нематод (см. раздел 5).
1.6. При исследовании гил|юбионтов и продуктов их переработки следует соблюдать режим работы с инвазионным материалом, регламентированный санитарными правилами 1.2.731-99 «Безопасность работы с микроорганизмами III-IV групп патогенности и гельминтами».
837
2. Отбор, хранение и подготовка к анализу проб гидробионтов и продуктов их переработки
Отбор и объем проб рыбы, моллюсков, ракообразных, земноводных, пресмыкающихся и продуктов их переработки для исследования на соответствие требованиям безопасности для здоровья человека по паразитарным показателям осуществляется в соответствии с требованиями:
• ГОСТа 7631 85 « Рыба, морские млекопитающие, морские беспозвоночные и продукты их переработки. Правила приемки, ор-ганолептические методы оценки качества, методы отбора проб для лабораторных испытаний»:
• Изменений №2 к ГОСТу 7631-85 (п. 1.2), утвержденному Постановлением Госстандарта СССР от 25.10.89 №3195;
• Сан Пи! 1а 3.2.569 96 «Профилактика паразитарных болезней на территории Российской Федерации», приложение 3, п. 6.2 (при лабораторном контроле рыбной продукции) и и. и. 15.12, 15.13 (при оценке и контроле паразитологического состояния районов промысла (биотопов);
• правил по сертификации «Типовой порядок обращения с образцами, используемыми при проведении обязательной сертификации. ПР 50.3.002 95».
2.1. Отбор, хранение и подготовка к анализу проб гидробионтов при оценке и контроле паразитологического состояния районов промысла (биотопов)
Необходимые /*>активы и оборудование:
1. Химические реактивы: глицерин; эфир или хлороформ
2. Кюветы эмалированные
3. Чашки Петри
4. Пинцеты хирургические и глазные
5. Препаровальные иглы
6. Химические стаканы
7. Кастрюли эмалп|юванные
8. Электроплитка
9. Холодильник
10. Весы с набором разновесов или весы электронные
11. Сантиметр или линейка
12. Марля, вата
13. Фильтровальная бумага
2.1.1. При оценке паразитологического состояния водоема (района промысла) следует начинать исследовать виды гндробнонгов, наиболее подверженные заражению. Так, наилучшмми инди-ка тора ми неблагополучия водоема в отношении инвазии личинками опнеторхнеов является язь, далее по убывающей • елец, линь и т д (см. табл. 2). а в отношении Diphyllobothrium latum - щука и налим (см. табл. 1).
Для исследования на наличие метацеркарий Opisthorrhis felineus и плсроцеркопдов О latum целесообразнее отбирать рыб старших возрастов, т. к. личинки паразитов живут несколько лет, и их число увеличивается с возрастом рыб. Метацеркарий Metorchis bilis (albidus) чаше встречаются у сеголеток и рыб младших возрастов, a Echinochasmus/terfoliatus - преимущественно у мальков.
2.1.2. До начала исследования рыбы, моллюсков, ракообразных, земноводных и пресмыкающихся следует точно определить видовую принадлежность исследуемого экземпляра и, руководствуясь табл. 1 -4 и и. 4.4 настоящего документа и табл. 9 СаиПиНа 3.2.569- 96 (прилож. 3), определить, потенциальными носителями каких видов гельминтов, опасных для здоровья человека, он является.
Следует помнит!., что один и тот же вил пгавоночного или беспозвоночного может служить дополнительным или резервуарным (факультативным) хозяином для нескольких видов гельминтов.
2.1.3. Сохранять свежевыловленную рыбу и нерыбных промысловых гидробионтов до исследования следует в охлажденном состоянии (в холодильнике), не допуская кристаллизации, либо в слегка подвяленном на воздухе виде не более 3- 5 дней.
2.1.4. Перед исследованием рыбу (или нерыбный объект промысла) отмывают от слизи, протирают. взвешивают, измеряют длину и делают в журнале записи, касающиеся учета исследований (раздел 7).
838
МУК 3.2. 988-00
2.1.5. Для определения возраста у рыб с циклоидной чешуей последнюю берут с переднебоковой поверхности выше боковой линии в количестве 15-20 крупных чешуек. У рыб с ктеноид-ной чешуей, а также с голой кожей берут отолиты или колючий шин грудного плавника.
2.1.6. Для исследования на наличие мстацсркарий Metagommus yokogawai и Meragonimus katsuradai отбирают по 20 чешуек из разных частей тела рыбы в спинной области, у карася - вдоль боковой линии. Крупные чешуйки (у сазанов, карасей) перед исследованием просветляют в течение 15-20 мин в 50 %-ном растворе глицерина.
2.1.7. Перед исследованием живых раков и крабов рекомендуется поместить в кипящую воду на 0.5-1,5 мин (в зависимости от размеров ракообразных) до прекращения движения или усыпить их эфиром (пли хлороформом).
2.2. Хранение и подготовка к анализу рыбной продукции при лабораторном исследовании на производстве, при сертификации, инспекционном контроле
2.2.1. Сохранять свежих или охлажденных гилробионтов и продукты их разделки до исследования следует в холодильнике при температуре 2-4*С. Замороженная рыбопродукция (сырье, полуфабрикаты и готовые изделия) до исследования хранится при температуре и в условиях согласно нормативно-технической документации на нее.
2.2.2. Непосредственно перед исследованием мороженую рыбную продукцию размораживают до температуры не ниже 0 *С в толще тела рыбы, моллюсков, ракообразных, земноводных, пресмыкающихся н продуктов их переработки. Живых ракообразных усыпляют (см. и. 2.1.8).
2.2.3. При исследовании вяленой, соленой н копченой рыбы ее предварительно вымачивают в течение суток до размятения мышц, меняя воду каждые 4-6 ч.
2.2.4. Соленую икру (зернистую, паюсную, ястыковую) выдерживают в воде в течение 2-3 ч. Другие виды рыбной н|>олукцш1 (пресервы, жареная рыба, фарш и tip.) специальной подготовки не требуют и сох|>аняются в холодильнике до начата исследования.
2.2.5.0 видовой принадлежности исследуемого образна судят но документам, сопровождающим пробу. При поступлении гилробионтов в виде, позволяющем п|юизвести видовое определение. следует его уточнить.
3. Методы паразитологического исследования гилробионтов и продуктов их переработки
Необходимые реактивы и оборудование:
1. Химические реактивы: физиологический раствор
2. Предметные стекла
3. Большие предметные стекла (6-8 х 12-15 см. толщиной 3- 5 мм) или компрессорнй
4. Кюветы эмалированные
5. Деревянная доска
6. Чашки Петри
7. Часовые стекла
8. Пинцеты разных размеров (хирургические, анатомические, глазные)
9. Ножницы
10. Скальпели
11. Препаровальные иглы разной толщины
12. Пипетки стеклянные (пастеровские)
13. Резиновые груши
14. Фильтронатьная бумага
15. Марля, вата
16. Лупа
17. Бинокулярный микроскоп типа МБС
18. Осветитель для бинокуляра любой марки
19. Световой мнк|К)ско11 тина Биолам, Бимам
20. Осветитель к микроскопу любой марки
21. Деревянный молоток
839
3.1. Принципиальные подходы и выбор метода исследования гидробионтов и продуктов их переработки
3.1.1. Ирм исследовании рыбной продукции используют два основных подхода:
1) выявление личинок гельминтов, видимых невооруженным глазом (плероцеркоиды. акан-теллы, личинки нематод размером > 2 мм), путем тщательного осмотра всех органов, полостей и тканей промежуточных (или резервуарных) хозяев;
2) выявление личинок гельминтов, плохо или не видимых невооруженным глазом (в основном метацеркарий трематод и мелких нематод), путем исследования органов и тканей - мест наиболее вероятной их локализации, с использованием оптических средств. Уточнение видовой принадлежности личинок гельминтов в обоих случаях ведется с применением световых микроскопов типа МБС, Биолам или др.
3.1.2. Порядок исследования и необходимость проведения всех или только отдельных его этапов зависит от вида (видов) гельминта, встречающегося в исследуемом гидробионте, типичной локализации личинок в нем (таблицы 1-4. пункты 4.4.1,4.4.2) и вида продукции.
3.1.2.1. При паразитологическом исследовании свсжевмловленной и охлажденной рыбы на наличие нсстод. нематод и скребней необходимо проводить практически весь предложенный ниже комплекс исследований (и.и. 3.2.1-3.2.7, 3.2.11). При поиске плероцеркоидов Diphyllobothrium dendriticum и акантелл рода ВоПхюошаосновное внимание обратить на рекомендации в пункте 3.2.4.
Diphyllobothrium luxi (D. klebanovskii) - в пункте 3.2.11.1, Gnathostoma hispidum и Gnathostoma spinitferum - в пунктах 3.2.11.3- 3.2.11.4.
I la наличие метацеркарий большинства видов трематод - исследуют только верхний слой мышечной ткани и подкожную клетчатку в области спинных мыши (и. 3.2.11.3). Для обнаружения метацеркарий Mefagonirnus yokogawai и Mctagonimus karsuradni в первую очередь исследуют чешую (и. 3.2.12). tchinochasmus ре г folia t us жабры (и. 3.2.9), Apophallus muhlmgi и Rossicotrema dunicum • ткани плавников (и. 3.2.8). Nanophyetus salmincoia - почки (п. 3.2.7).
3.1.2.2. Мороженую, соленую, прямую, маринованную, вяленую, сушеную и конченую рыбную продукцию после предварительной подготовки (и. и. 2.2.2. 2.2.3) исследуют по методике неполного гельминтологического вскрытия, приведенной ниже (п.п. 3.2-3.4). При обнаружении личинок гельминтов следует определить их жизнеспособность (раздел 5).
3.1.2.3. Такие продукты переработки рыбы, как пресервы, фарш, жареная или заливная рыба, предварительно осматривают, а затем исследуют компрессорным мегодом (и. 3.2.11.3) или методом переваривания в искусственном желудочном соке (п. 3.2.11.4).
3.1.2.4. Рыбу потрошеную обезглавленную, разделанную на тушку, спинку, кусок и филе, лапки земноводных, мышечные ткани и мантию двустворчатых моллюсков, а также мантию головоногих в зависимости от целей паразитологического инспектирования (вида гельминта) исследуют но одной из предложенных методик исследования мускулатуры (п. 3.2.11).
3.1.2.5. Икру (гонады), как свежую, так и продукты ее переработки, исследуют в соответствии с пунктом 3.2.6.■
3.1.2.6. Молоки (семенники) тщательно осматривают снаружи на наличие полостных паразитов. Внутри молок опасных для здоровья человека паразитов нет.
3.2. Методика неполного гелычинтологического исследования рыбы
3.2.1. Рыбу вскрывают в большой эмалированной кювете или на широкой гладкой доске. Прежде всего, проводят наружный осмотр рыбы для выявления личинок, просвечивающих через кожу, извлекают их препаровальной иглой.
3.2.2. Затем вырезают левую стенку полости тела и открывают доступ к последней. Для этого, повернув рыбу брюхом кверху, делают короткий надрез вперед от анального отверстия, куда затем вводят тупой конец ножниц и разрезают рыбу вдоль срединной линии брюшка до угла нижней челюсти. Делают дугообразный надрез, вырезают левую брюшную стенку, отделяют се. Рыбу кладут на правый бок. При внимательном осмотре полости тела и внутренних органов могут быть обнаружены свободно лежащие или под серозной, или в капсулах личинки цсстод, нематод, скребней, видимые невооруженным глазом.
3.2.3.1{вкладывают лигатуры на кишечник близ анального отверстия и на пищевод в его началь-
840
ном отделе, чтобы содержимое пищеварительного тракта не вышло наружу. Затем извлекают внутренние органы. Вырезают яичники (икру) или семенники (молоки), помещая их в отдельные чашки Петри, и просматривают. Осмафниают плавательный пузырь снаружи и внутри. Вырезают и осматривают сердце, а также сердечную полость. Компрессорным способом исследуют содержимое, оставшееся в полости тела. Последнюю протирают марлевой салфеткой, соскабливают брюшину.
3.2.4. Затем отпрепаровывают комплекс органов пищеварительной системы. В первую очередь выделяют желчный пузырь, лежащий на поверхности печени, так, чтобы его содержимое (в том числе и паразиты) не залило остальные внутренние органы. Затем выделяют пищеварительный тракт, печень, селезенку, поджелудочную железу. Эти органы отделяют друг от друга и от окружающей их жировой ткани и осматривают. Жировую ткань разрезают на тонкие пластинки толщиной окаю 3 мм или исследуют компрессорное между стеклами на темном фоне или в нплупронодящем свете.
Исследуют освобожденный от жировой ткани пищеварительный тракт, отыскивая личинок в капсулах на его поверхности или просвечивающих через серозные покровы (Diphyllobothrium dendriticum, Diphyllobothrium latum. Dioctophyme renale, Eustrongy tides exicisus, Corynosoma strumosum, Corynosoma semerse, Bolbasamacaenoforme, личинки сем. Anisakidae). Пилорические придатки (развитые у налима, сиговых, лососевых) расправляют и осматривают снаружи (h/ramicocephalus phocarum). Стенки желудка и пищевода после наружного осмотра исследуют под бинокулярной лупой, подбирая степень увеличения в зависимости от объекта.
3.2.5. При наружном осмотре печени невооруженным глазом можно заметить плероцеркои-ды цестод (Diphyllobothrium latum. Pyramicocephalus phocarum, Eustrongylides exicisus) и личинки аниза-кнд. Поджелудочную железу, селезенку, печень осматривают снаружи и также разрезают на пластинки толщиной окаю 3 мм.
3.2.6. У яичника разрезают оболочку, содержимое соскабливают и компрессуют. Здесь часто встречаются плсроцеркопды Diphyllobothrium latum. Компрессорным методом удобно просматривать лишь мелкую икру. При исследовании крупных икринок следует разбирать их препаровальными иглами в чашке Петри с небольшим добавлением воды.
Соленую икру (зернистую, паюсную, я стыковую) после пред картельной подготовки (п. 2.2.4) исследуют таким же способом. При исследовании семенников (молок) тщательно просматривают их поверхность.
3.2.7. Последними из внутренних органов исследуют почки, лежащие вдоль позвоночника. Так как ткань ночек очень рыхлая, обычно не удастся выделить их целиком. Их соскабливают и но частям исследуют компрессорным способом, добавляя несколько капель воды. Почки - орган наиболее вероятной локализации мета-перкарин Nano/thyetus salmincola.
3.2.8. Отрезают плавники п просматривают их с использованием микроскопа МБС при увеличении 16-48 (окуляр 8х, 12х, объектив 2х. 4х) раз в небольшом количестве воды. Здесь могут быть заметны в виде маленьких черных точек пигментированные цисты А/юр/ial/us muhlingi и Rossicotrema donicum, а также метаперкарии Metagonimus yokogatnai и Metagonimus katsuradai. Мышцы плавников исследуют компрессорным способом (3.2.11.3).
3.2.9. Снимают жаберную крышку и ножницами вырезают все жаберные дуги. Их по очереди рассматривают в чашке Петри под бииокуляром. перебирая лепестки препаровальными иглами и. следя за тем, чтобы они были покрыты водой. Затем от|н*зают от дуги лепестки у их основания и. разбирая препаровальными иглами, выявляют паразитов, оставшихся незамеченными. На жабрах можно обнаружить метаперкарии Echinochasmus perfoliatus, Metagonimus yokogawai, Metagonimus katsuradai, Nanophyetus salmincola, Opisthorchis felineus.
3.2.10. После просмотра внутренних органов с рыбы снимают кожу в направлении от головы к хвосту, подрезая се ножницами и оттягивая хирургическим пинцетом или рукой. Осматривают внутреннюю сторону кожи, а часть мышц, отделившихся с кожей, разрезают на пластинки или соскабливают и компрессуют.
3.2.11. Метод исследования мускулатуры выбирается в зависимости от целей паразитологи-ческого контроля (вида гельминта).
3.2.11.1. Метод па/ншельпых раз/м>.юа. Метод применяется для обнаружения н мышечной ткани рыбы личинок гельминтов, видимых без использования увеличительных приборов (цестод, нематод, скребней).
841
|
Дифференциальные признаки плероцеркоидов сем. Таблица 1 | ||||||||||||||||||||||||||||
|
842
|
Diphyllobothriidae, опасных для здоровья человека | ||||||||||||||
|