Федеральная служба по надзору в сфере защиты прав потребителей и благополучия человека
4.2. БИОЛОГИЧЕСКИЕ И МИКРОБИОЛОГИЧЕСКИЕ ФАКТОРЫ
Методы санитарно-микробиологического и санитарно-паразитологического анализа прибрежных вод морей в местах водопользования населения
Методические указания МУ 4.2.2959-11
ББК 51.9 М54
М54 Методы санитарно-микробиологического и санитарно-паразитологического анализа прибрежных вод морей в местах водопользования населения: Методические указания.—М.: Федеральный центр гигиены и эпидемиологии Роспотребнадзора. —114 с.
1. Разработаны Управлением Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека по Краснодарскому краю (В. П. Клиндухов, П. Н. Николаевич); Федеральным государственным учреждением здравоохранения «Центр гигиены и эпидемиологии в Краснодарском крае» (В. В. Пархоменко, Е. П. Лаврик, Л. И. Щербина) под редакцией ГОУ ВПО «Кубанский государственный университет» (Г. А. Ле-щева); Федеральным государственным бюджетным учреждением «Научно-исследовательский институт экологии человека и гигиены окружающей среды» им. А. Н. Сысина Министерства здравоохранения и социального развития Российской Федерации (А. Е. Недачин, Т. 3. Артемова, Е. К. Гипп, Р. А. Дмитриева, Т. В. Доскина, А В. Загайнова, Н. Н. Буторина, В. А. Долгин, Т. Н. Максимкина); Федеральным государственным учреждением науки Федеральным научным центром гигиены им. Ф. Ф. Эрисмана Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека (Г. М. Трухина, Н. Н. Мойсеенко); Институтом медицинской паразитологии и тропической медицины им. Е. И. Марциновского ГОУ ВПО Первого МГМУ им. И. М. Сеченова (В. П. Сергиев, А. И. Чернышенко, |Г. И. Новосильцев!, Е. А. Черникова, Н. А Турбабина).
2. Утверждены Руководителем Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека, Главным государственным санитарным врачом Российской Федерации Г. Г. Онищенко 29 июля 2011 г.
3. Введены в действие 29 июля 2011 г.
ББК 51.9
Роспотребнадзор, 2011
Федеральный центр гигиены и эпидемиологии Роспотребнадзора, 2011
МУК 4.2.2959-11
метром пор 25,0 и 67—70 мкм для паразитологических исследований.
31. Облучатель бактерицидный.
32. Оптический стандарт мутности на 10 ед.
33. Часы сигнальные или песочные на 2, 3, 5 мин.
34. Макропористое стекло марки МПС 1000 ВГХ.
35. Набор для концентрирования с помощью пакетов с адсорбентом.
36. Ионообменная смола (Анионит АВ 17-8).
37. Набор для сбора и концентрирования вирусов из питьевой воды в системе децентрализованного хозяйственно-бытового водоснабжения, поверхностных и сточных вод.
38. Дозаторы пипеточные полуавтоматические переменного объема 0,5—10 мкл; 40—200 мкл; 200—1000 мкл с наконечниками.
39. Горелки газовые или спиртовки.
40. Петли бактериологические.
41. Пинцеты для работы с мембранными фильтрами.
42. Штативы для пробирок.
43. Емкости эмалированные.
44. Пробки различных размеров: силиконовые, резиновые и другие, выдерживающие стерилизацию сухим жаром и автоклавированием.
45. Вата хлопковая медицинская гигроскопическая.
46. Марля медицинская.
47. Маркеры водостойкие.
48. Резиновые перчатки.
49. Шпагат.
50. Бумага плотная для упаковки посуды.
51. Штативы для пробирок 0,6 и 1,5 мл.
52. Планшеты пластиковые для культивирования культур тканей.
53. Батометр с устройством для закрепления стерильных емкостей.
54. Батометр специальный для отбора проб с разных глубин.
Примечание.
11. Для экспресс-анализа индикаторных и патогенных микроорганизмов в воде может использоваться микробиологический анализатор «БакТрак-4300» в соответствии с МУК 4.2.1111 —02 «Использование метода измерения электрического сопротивления (импеданса) для санитарно-микробиологического исследования питьевой воды».
2. Для идентификации выделенных культур допускается применение автоматических микробиологических анализаторов (например, VITEK 2 Compact - методические рекомендации № 02.032—08).
11
Калий хлористый
Калий фосфорно-кислый однозамещенный
Калий фосфорно-кислый двузамещенный 3-водный
Калия гидроокись
Калия сульфат
Калий йодистый
Калий азотно-кислый (нитрат калия) Кислота соляная
Кислота ортофосфорная Кислота борная
Натрий хлористый Натрий гидрат окиси
Натрий фосфорно-кислый трехзамещенный
Натрий серноватисто-кислый (тиосульфат натрия) 5-водный
Натрий двууглекислый
Фосфат натрий-аммония двузамещенный, 4-водный
Натрий сернисто-кислый пиро (метабисульфит)
Натрий пировиноградно-кислый (пируват)
Спирт этиловый ректификованный медицинский
Активированный уголь
Агар микробиологический
D-глюкоза
L-лактоза
Мальтоза Sigma (Германия) D-маннит
L- аргинин гидрохлорид (Германия)
Пептон сухой ферментативный
для бактериологических целей ГОСТ 13805-76
Дрожжевой экстракт ГОСТ 171-81
Трифенилтетразолий хлорид ТУ 6-09-3838—78
Тетраметил-п-фенилендиамин гидрохлорид (TEMED)
Диметил-п-фенилендиамин дигидрохлорид а-нафтол
Пара-диметиламинобензальдегид Амиловый спирт
Триптофан (США)
Азид-натрия (Германия)
Глицерин
Кальций углекислый Бриллиантовый зеленый Бромтимоловый синий спирторастворимый Кристаллический фиолетовый
сертификат
78-1683233;
Йод кристаллический
Барий хлористый Магний хлористый кристаллический
6-водный ГОСТ 4209-77
Сульфат магния ГОСТ 21458-75
Тетратианат калия ТУ 6-09-3838—78
Калийная соль б-кетоглютаровой кислоты (Россия) а-кетоглютаровая кислота (Россия)
Глицин, Biotechnology Grade > 99 % (Amresco, США)
13
МУК 4.2.2959-11
Пирофосфат железа растворимый ГОСТ 4147-74
или
ГОСТ 342-77
Буферный угольно-дрожжевой агар
Глицин, Biotechnology Grade > 99% (Amresco, США)
L-цистеин (Япония)
Пирофосфат железа растворимый (Sigma, США)
Полимиксин В сульфат 500000 ед. (Германия)
Циклогексимид (Германия)
ACES-буфер (1Ч-2-ацетамидо-2-аминоэтан-сульфанильная кислота)
Вода дистиллированная ГОСТ 6709-72
Приборы мембранного фильтрования для санитарногельминтологического исследования мосркой воды:
1) вакуумные фильтровальные установки типа ПВФ-142, ПВФ-35, ПВФ-47;
2) напорного фильтрования типа ПНФ, УППВ.
Приборы порошкового фильтрования:
1) напорного фильтрования — типа ПробоКонг и его модификации;
2) отборник флотанта фильтрующий типа «ОФФ-25»:
— лабораторная центрифуга типа ОПН-3, ОПН-8, ЦЛС-31М, ОС-6М со сменным ротором или другие марки с аналогичными параметрами, обеспечивающие 1500—3 000 об./мин, позволяющие центрифугировать пробы воды в центрифужных пробирках объемом от 10 мл;
— ареометры с пределами измерения от 1,000 до 1,400 кг/м3;
— световые микроскопы отечественные типа МИКМЕД-2 (вариант 2) и других фирм, оснащенные окулярами с увеличением 10х (дополнительно могут быть 7 и 5х), объективами 10, 40, ЮОх. Окуляр-микрометр и объект-микрометр;
— мембранные фильтры для фильтрования воды на основе ацетатов целлюлозы типа МФАС-СПА с размерами пор от 1,5 до 3,0 мкм, МФАС-СПА-4 с размерами пор от 2,5 до 4,5 мкм или прозрачные аналитические трековые мембраны ATM на основе по-лиэтилентерефталата с размерами пор от 1,0 до 5,0 и более мкм. Диаметр фильтровальных дисков 25, 35, 47, 70 и до 142 мкм, в за-
МУК 4.2.2959-11
висимости от диаметра фритты фильтродержателя используемого фильтровального оборудования;
— предфильтры — капроновая сетка с ячейками 60—70 мкм;
— ёмкости для отбора проб воды из нейтрального материала, пригодные для обеззараживания (широкогорлые стеклянные или пластиковые флаконы емкостью 100—500 мл с притертыми или завинчивающимися крышками, металлические или пластиковые канистры емкостью 10—25 л, стеклянные бутыли, фляги молочные металлические, эмалированные бидоны и др.);
— лабораторный вортекс, лабораторный ротатор;
— лотки эмалированные, металлические, эмалированные кастрюли, ведра;
— предметные стекла;
— часы песочные на 3—5 мин, часы сигнальные или электронный таймер;
— кисти акварельные широкие (мягкие или полужесткие).
5. Оборудование и расходные материалы для ПЦР
ЗОНА 1. Выделение ДНК/РНК из образцов
1. Ламинарный бокс (например, «БАВп-01-«Ламинар-С»-1,2», «Ламинарные системы», Россия, класс биологической безопасности II, тип А).
2. Вортекс (например, «ТЭТА-2», «Биоком», Россия).
3. Набор электронных или механических дозаторов переменного объема (например, «Ленпипет», Россия).
4. Одноразовые полипропиленовые завинчивающиеся или плотно закрывающиеся микропробирки объемом 1,5 мл (например, «Axygen», США).
5. Одноразовые наконечники для дозаторов с аэрозольным барьером до 200 мкл и до 1000 мкл (например, «Axygen», США).
6. Штативы для наконечников (например, «Axygen», США) и микропробирок объемом 1,5 мл (например, «ИнтерЛабСервис», Россия).
7. Холодильник от 2 до 8 °С.
8. Отдельный халат и одноразовые перчатки.
9. Ёмкость с дезинфицирующим раствором.
15
МУК 4.2.2959-11
При использовании комплекта реагентов «РИБО-преп»
1. Термостат для пробирок типа «Эппендорф» от 25 до 100 °С (например, «ТЕРМО 24-15», «Биоком», Россия).
2. Микроцентрифуга для пробирок типа «Эппендорф» до 16 тыс. об./мин (например, «MiniSpin», «Eppendorf», Германия).
3. Вакуумный отсасыватель медицинский с колбой-ловушкой для удаления надосадочной жидкости (например, «ОМ-1», г. Ульяновск, Россия).
4. Одноразовые наконечники для дозаторов переменного объема до 200 мкл (например, «Axygen», США).
При использовании комплекта реагентов «МАГНО-сорб»
1. Термостат для пробирок объемом 5 мл, диаметром 12 мм от 25 до 100 °С (например, «BioerTechnology», Китай).
2. Термостат для пробирок типа «Эппендорф» от 25 до 100 °С (например, «ТЕРМО 24-15», «Биоком», Россия).
3. Магнитный штатив для пробирок типа «Эппендорф» на 1,5 мл (например, «Promega», США).
4. Магнитный штатив для пробирок на 5 мл, диаметр 12 мм (например, «Promega», США).
5. Вакуумный отсасыватель медицинский с колбой-ловушкой для удаления надосадочной жидкости (например, «ОМ-1», г. Ульяновск, Россия).
6. Одноразовые полипропиленовые завинчивающиеся или плотно закрывающиеся микропробирки объемом 1,5 мл (например, «Axygen», США).
7. Одноразовые полипропиленовые или полистирольные пробирки объемом до 5 мл диаметром 12 мм, круглодонные (например, «Axygen», США).
8. Одноразовые полипропиленовые крышки для пробирок объемом до 5 мл диаметром 12 мм (например, «Axygen», США).
9. Электронный или механический дозатор переменного объема с возможностью дозирования от 1000 до 5 000 мкл (например, «Ленпипет», Россия).
10. Одноразовые наконечники для дозаторов переменного объема до 200 мкл, до 1000 мкл и до 5 000 мкл (например, «Axygen», США).
ЗОНА 2. Проведение реакции обратной транскришщи,
ПЦР и гибридизационно-флуоресцентной детекции продуктов ПЦР-амплификации
1. ПЦР-бокс (например, «БАВ-ПЦР-«Ламинар-С», «Ламинарные системы», Россия).
16
МУК 4.2.2959-11
2. Вортекс (например, «ТЭТА-2», «Биоком», Россия).
3. Набор электронных или автоматических дозаторов переменного объема (например, «Ленпипет», Россия).
4. Одноразовые наконечники с аэрозольным барьером до 200 мкл (например, «Axygen», США).
5. Штативы для наконечников (например, «Axygen», США) и микропробирок на 0,5 (0,2) мл (например, «ИнтерЛабСервис», Россия).
6. Холодильник от 2 до 8 °С с морозильной камерой не выше -16 °С.
7. Отдельный халат и одноразовые перчатки.
8. Ёмкость с крышкой для дезинфицирующего раствора.
При использовании комплектов реагентов «ПЦР-комплект» вариант 100-FRTF, «ПЦР-комплект» вариант 50-FRTF
1. Амплификатор роторного типа, например, «Rotor-Gene» 3000 или 6000 («CorbettResearch», Австралия) или амплификатор планшетного типа, например, «iQ5» («BioRad», США), «МхЗОООР» («Stratagene», США) или эквивалентные.
2. Одноразовые полипропиленовые пробирки для ПЦР:
а) на 0,2 мл (плоская крышка, нестрипованные) (например, «Axygen», США) для постановки в ротор на 36 пробирок — для приборов для ПЦР в реальном времени с детекцией через дно пробирки (например, «Rotor-Gene»);
б) на 0,2 мл (куполообразная крышка) (например, «Axygen», США) — для приборов для ПЦР в реальном времени с детекцией через крышку (например, «1Q5», «МхЗОООР»).
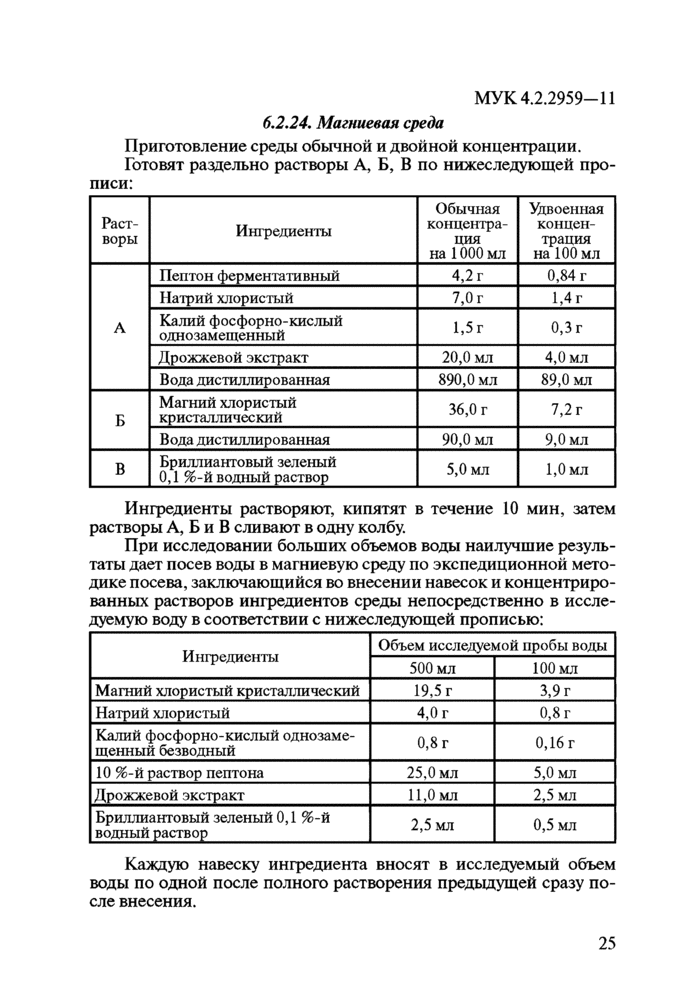
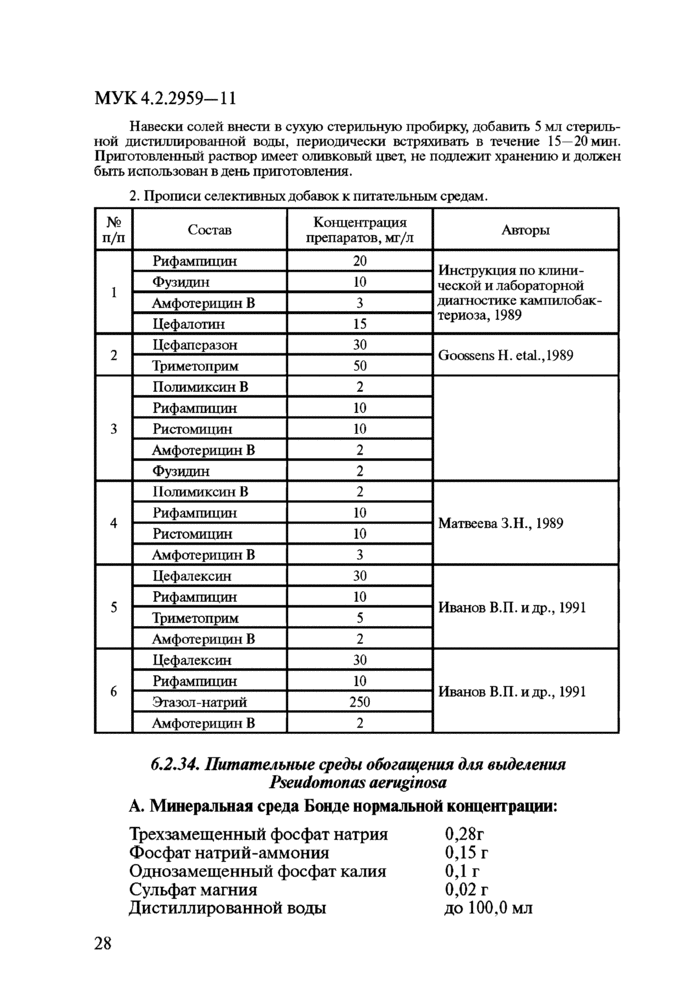
6. Питательные среды и тест-культуры6.1. Общие требования
При выполнении микробиологического анализа следует отдавать предпочтение стандартизованным сухим питательным средам промышленного производства. При использовании промышленных сухих питательных сред следует соблюдать способ приготовления, применения и сроки хранения, указанные изготовителем.
Вновь приобретенная партия питательных сред должна пройти контроль качества в соответствии с МУК 4.2.2316—08 «Методы контроля бактериологических питательных сред».
Для приготовления растворов, реактивов и питательных сред применяют дистиллированную воду, отвечающую требованиям ГОСТ 6709-72.
Питательные среды готовят в посуде из инертного материала.
17
МУК 4.2.2959-11
6.2. Растворы для разбавлений и питательные среды
6.2.1. Солевой (физиологический) раствор
В 1 л дистиллированной воды растворяют 8,5 г хлорида натрия, устанавливают pH с расчетом, чтобы после стерилизации РН = 7 ,0 + 0,1. Разливают во флаконы, стерилизуют при температуре (120 + 2) °С 15 мин. Разливают мерно непосредственно перед посевом.
Срок хранения — до 1 месяца при комнатной температуре.
6.2.2. Пептонный раствор
В 1 л дистиллированной воды растворяют при кипячении 1 г пептона. Устанавливают pH с расчетом, чтобы после стерилизации pH = 7,0 ±0,1. Разливают во флаконы. Стерилизуют при температуре (120 ± 2) °С 20 мин. Разливают мерно непосредственно перед посевом.
Срок хранения — до 1 месяца при комнатной температуре.
6.2.3. Пептонно-солевой раствор
В 1 л дистиллированной воды растворяют при кипячении 8,5 г хлорида натрия и 1 г пептона. Устанавливают pH с расчетом, чтобы после стерилизации pH = 7,0 ± 0,1. Стерилизуют при температуре (120 ± 2) °С 20 мин. Разливают мерно непосредственно перед посевом.
Срок хранения — до 1 месяца при комнатной температуре.
6.2.4. Питательный бульон
Готовят из сухого препарата промышленного производства по способу, указанному производителем.
6.2.5. Питательный агар
Готовят из сухого препарата промышленного производства по способу, указанному на этикетке.
Питательный агар не допускается выдерживать в расплавленном состоянии более 8 ч. Оставшийся неиспользованным агар повторному расплавлению не подлежит.
Питательный агар для определения колифагов прямым методом при посеве 20 мл пробы на чашку Петри готовят, увеличивая навеску сухого препарата на 10—15 % от прописи. Разливают в емкости, автоклавируют при температуре (120 ± 2) °С 20 мин.
Полужидкий питательный агар готовят с использованием одной трети навески сухого препарата, указанной на этикетке. Разливают в пробирки и автоклавируют при температуре (120 ± 2) °С 20 мин.
МУК 4.2.2959-11
Питательный агар со стрептомицином готовят из расчета содержания 100 мкг стрептомицина на 1 мл питательного агара, приготовленного по стандартной прописи. Стерильно на стерильной дистиллированной воде готовят раствор стрептомицина в концентрации 10 мг на 1 мл. В готовый питательный агар, отмеренный по объему и остуженный до температуры 45—49 °С, вносят приготовленный стерильный раствор стрептомицина из расчета 0,1 мл на 10 мл питательного агара. Разливают в пробирки для приготовления скошенного агара. Срок хранения питательного агара со стрептомицином не более 2 недель. Повторное расплавление питательной среды со стрептомицином запрещается.
6.2.6. Фуксин-сульфитная среда Эндо
Готовят из сухого препарата по способу, указанному производителем.
Готовую среду охлаждают до 60—70 °С и разливают в чашки Петри.
Если после застывания на поверхности среды заметны следы влаги, чашки перед посевом необходимо подсушить. Срок хранения чашек со средой не более 3—5 суток в темноте, если производителем не оговорены другие сроки.
6.2.7. Лактозный агар с тергитолом- 7 и ТТХ
Готовят из сухого препарата по способу, указанному на этикетке. Готовую среду охлаждают на водяной бане до 45—50 °С и добавляют приготовленного на стерильной дистиллированной воде 5 мл 0,05 %-го водного раствора ТТХ на 100 мл основной среды. Хорошо перемешивают и разливают в чашки слоем не менее 5 мм. Раствор ТТХ и питательная среда устойчивы в течение недели при температуре 2—8 °С в защищенном от света месте.
6.2.8. Хромокульт колиформ агар
Готовят из сухого препарата по способу, указанному на этикетке. Нагревают на кипящей водяной бане, периодически помешивая, до полного растворения в течение 35 мин. Не автоклавировать, не перегревать. Готовую среду охлаждают до 45—50 °С и разливают в чашки Петри. Питательная среда устойчива в течение 2 недель при температуре 2—8 °С в защищенном от света месте. Для предотвращения от высыхания поместить чашки со средой в пластиковые мешки.
6.2.9. Лактозо-пептонная среда
Растворяют при нагревании в 1 л дистиллированной воды 10 г пептона, 5 г натрия хлористого, 5 г лактозы. После растворения ингредиентов и остывания среды до комнатной температуры до-
19
МУК 4.2.2959-11
бавляют индикатор (2 мл 1,6 %-го спиртового раствора бромтимо-лового синего), устанавливают pH (7,4—7,6), разливают по 10 мл в пробирки.
Для приготовления концентрированной лактозопептонной среды все ингредиенты, кроме воды, увеличивают в 10 раз, разливают по 1 мл в пробирки и по 10 мл во флаконы.
Готовую среду стерилизуют при (112 +2) °С 12 мин.
6.2.10. Питательные среды для подтверждения способности ферментировать лактозу до кислоты и газа и образовывать индол
6.2.10.1. Полужидкая среда с лактозой из сухого препарата Готовят по способу, указанному производителем.
Срок хранения не более 2 недель при комнатной температуре. В холодильнике не хранить.
Посев производят уколом до дна пробирки. При образовании кислоты цвет питательной среды изменяется в соответствии с использованным индикатором. При газообразовании газ скапливается или по уколу, или на поверхности, или в толще среды появляются разрывы. При инкубации посевов более 5 ч газ может улетучиться. В таких случаях на присутствие газа указывают оставшиеся в толще среды «карманы» — потемнения среды на месте бывшего пузырька газа.
6.2.10.2. Жидкая лактозо-пептонная среда Готовят в соответствии с п. 6.2.9 с добавлением 1 мл 1,6 %-го спиртового раствора бромтимолового синего на 1 л среды, разливают по 3—5 мл в пробирки с поплавком или комочком ваты.
6.2.10.3. СИБ-лактоза Готовят по прописи производителя.
Примечание. При выборе среды для подтверждения ферментации углеводов целесообразно использовать полужидкие среды, которые позволяют улавливать небольшое количество газа и на ранних стадиях ферментации, что повышает чувствительность метода и скорость получения ответа через 4—6 ч.
6.2.10.4. Лактозньш бульон с борной кислотой
Растворяют в 1 л дистиллированной воды: 10 г пептона; 12,2 г калия фосфорнокислого двузамещенного (безводного); 4,1 г калия фосфорно-кислого однозамещенного (безводного); 3,2 г борной кислоты; 5 г лактозы. После растворения всех ингредиентов при нагревании среду остужают до комнатной температуры и разливают по 5 мл в пробирки с поплавками или комочками ваты, стерилизуют при (112 + 2) °С 12 мин. Срок хранения не более 2 недель.
МУК 4.2.2959-11Содержание
1. Область применения..............................7
2. Нормативо-методические документы...................8
3. Оборудование и расходные материалы по микробиологии.......9
4. Реагенты и реактивы для микробиологии и паразитологии......12
5. Оборудование и расходные материалы для ПЦР............15
6. Питательные среды и тест-культуры...................17
7. Внутренний контроль качества микробиологических
исследований..................................31
8. Подготовка посуды и материалов.....................31
8.1. Общие требования к подготовке лабораторной посуды
для анализа.................................31
8.2. Требования к емкостям для отбора проб.............32
8.3. Инактивация дезинфектантов....................33
9. Отбор хранение и транспортирование проб морской воды......34
9.1. Общие требования к отбору проб морской воды.........34
9.2. Отбор, хранение и транспортирование проб для санитарномикробиологических исследований...................35
9.3. Отбор, хранение и транспортирование проб для санитарно-
вирусологических исследований.....................36
9.4. Отбор, хранение и транспортирование проб для санитарнопаразитологических исследований ...................37
9.4.1. Общие требования к отбору проб..............37
9.4.2. Хранение и транспортирование проб............38
10. Показатели, обязательные для лабораторного, в том числе
производственного, контроля морской воды................38
10.1. Методы санитарно-бактериологического исследования проб
морской воды................................38
10.1.1. Метод прямого посева....................39
10.1.2. Метод мембранной фильтрации..............39
10.1.3. Титрационный метод....................40
10.2. Определение общих колиформных бактерий..........41
10.2.1. Обнаружение общих колиформных бактерий методом мембранной фильтрации.................42
3
МУК 4.2.2959-11
Примечание. Каждую новую партию борной кислоты следует испытывать: при выращивании Е. coli при температуре 44 °С среда дает положительную реакцию -помутнение и газ.
6.2.10.5. Среда с триптофаном
10 г ферментативного пептона, 5 г хлористого натрия, 1 г триптофана растворяют в 1 л дистиллированной воды, устанавливают pH 7,2, разливают в стерильные пробирки и автоклавируют при (120 + 2) °С в течение 20 мин.
6.2.11. Реактивы для оксидазного теста
Вариант 1.
Раствор 1 %-й водный тетраметил-п-фенилендиамина гидрохлорида. Готовят перед употреблением.
Вариант 2.
Реактив № 1. Раствор 1 %-й спиртовой а-нафтола.
Реактив №2. Раствор 1 %-й водный диметил-п-фенилен-диамина дигидрохлорида.
Растворы сохраняют в темных флаконах с притертыми пробками: 1-й — до одного месяца, 2-й — до одной недели. Перед употреблением к 2,5 частям первого раствора добавляют 7,5 частей второго раствора.
Могут быть использованы коммерческие тест-системы для постановки оксидазного теста (СИБ-оксидаза или аналоги).
Каждую новую партию и периодически раз в месяц реактивы или тест-системы на оксидазу следует испытывать с тест-культурами микроорганизмов, дающих положительную (Ps. aeruginosa, Ps.fluorescens) и отрицательную (Е. со И) оксидазную реакцию.
Примечание. Перечисленные реактивы являются канцерогенными. Работупо приготовлению реактивов следует выполнять в вытяжном шкафу, используя защитные перчатки и избегая контакта реактива с кожей.
6.2.12. Триптонный агар с желчью и Х-глюкуронидом
Готовят из сухого препарата по способу, указанному на этикетке. Разливают в емкости, стерилизуют при температуре (120 ± 2) °С 15 мин. Готовую среду охлаждают до 45—50 °С и разливают в чашки Петри. Питательная среда устойчива в течение 4 недель при температуре 2—8 °С в защищенном от света месте. Для предотвращения от высыхания поместить чашки со средой в пластиковые мешки.
6.2.13. Реактив Ковача
Растворяют 5 г пара-диметиламинобензальдегида в 75 мл амилового спирта на водяной бане при 60 °С. Затем медленно добавляют 25 мл концентрированной соляной кислоты. Приблизительно
МУК 4.2.2959-11
10.2.2. Обнаружение общих колиформных бактерий титрационным методом.......................47
10.3. Обнаружение Е. coli.........................48
10.3.1. Классический метод определения Е. coli
мембранным методом........................48
10.3.2. Метод определения Е. coli с использованием
лактозного бульона с борной кислотой..............49
10.3.3. Ускоренный метод определения Е. coli
с использованием хромокульт колиформ агара.........49
10.3.4. Ускоренный метод определения Е. coli
на триптонном агаре с желчью и Х-глюкуронидом.......49
10.3.5. Обнаружение Е. со И титрационным методом......49
10.4. Определение энтерококков....................50
10.4.1. Обнаружение энтерококков методом мембранной
фильтрации..............................50
10.4.2. Обнаружение энтерококков титрационным
методом................................51
10.4.3. Упрощенный метод определения энтерококков.....52
10.5. Обнаружение стафилококков методом мембранной
фильтрации.................................52
10.6. Обнаружение колифагов......................53
10.6.1. Определение колифагов прямым методом........53
10.6.2. Ведение эталонных культур колифага MS-2
штамма 3254 Е. coli K12F+ Strr....................56
11. Дополнительные показатели.......................58
11.1. Обнаружение возбудителей кишечных инфекционных
заболеваний.................................58
11.1.1. Качественный метод.....................58
11.1.2. Количественный метод...................59
11.1.3. Определение шигелл....................60
11.2. Обнаружение Pseudomonas aeruginosa...............60
11.3. Обнаружение Campylobacter jejuni методом
мембранной фильтрации.........................63
12. Санитарно-вирусологическое исследование проб
морской воды...................................66
12.1. Методы концентрирования вирусов с использованием
ионнообменных смол...........................66
12.2. Двухэтапный метод концентрирования вирусов (сорбция на ионообменной смоле и осаждение
с помощью сульфата аммония)......................67
12.3. Метод концентрирования вирусов с использованием
набора для концентрации вирусов из воды с помощью ловушечного устройства..........................69
4
МУК 4.2.2959-11
12.4. Метод концентрирования вирусов с использованием
серно-кислого алюминия.........................71
12.5. Методы выделения энтеровирусов в культурах клеток.....71
12.6. Выявление РНК кишечных вирусов (гепатит А, ротавирусы, энтеровирусы, норовирусы, астравирусы)
методом ПЦР с этапом обратной транскрипции...........76
12.6.1. Постановка ПЦР с использованием
электрофоретического метода...................76
12.6.2. Постановка ПЦР с системой детекции флуоресцентного сигнала в режиме реального времени ... .16
13. Санитарно-паразитологическое исследование
морской воды...................................84
13.1. Методы санитарно-паразитологического исследования
проб морской воды и их концентратов.................84
13.1.1. Метод порошковой фильтрации..............84
13.1.2. Флотационный метод исследования...........86
13.1.3. Метод последовательной фильтрации через систему
прозрачных аналитических трековых мембран (ATM).....88
13.1.3.1. Исследование на яйца, личинки гельминтов
и цисты лямблий.........................88
13.1.3.2. Исследование на ооцисты криптоспоридий . . . . 89
13.1.4. Исследование воды на цисты лямблий и ооцисты криптоспоридий методом иммуномагнитного разделения
и мечения флуоресцирующими антителами (IMS).......90
13.1.5. Обнаружение цистных форм криптоспоридий и лямблий в морской воде методом полимеразной
цепной реакции (ПЦР).......................96
13.1.5.1. Проведение анализа ПЦР..............100
13.1.5.1.1. Выделение ДНК с помощью набора
Diatom DNA Prep 100/200................. 100
13.1.5.1.2. Амплификация.................101
13.1.5.1.3. Проведение электрофореза в агарозном
геле..............................102
13.1.5.1.4. Проведение электрофореза..........103
13.2. Идентификация выявленных возбудителей кишечных
паразитарных болезней.........................103
13.3. Визуальная оценка вероятной жизнеспособности цист
патогенных простейших кишечника и яиц гельминтов......105
Приложение 1. Требования к составу морской воды по санитарно-микробиологическим и паразитологическим показателям в контрольных створах и местах водопользования населения................................107
5МУК 4.2.2959-11
Приложение 2. Лабораторный контроль морской
воды в пунктах охраняемых районов акватории.........108
Приложение 3. Расчет наиболее вероятного числа
бактерий в морской воде.......................109
Приложение 4. Расчет наиболее вероятного числа
колифагов в морской воде......................112
Приложение 5. Алгоритм экспрессного теста определения оксидазной активности с реактивом тетраметил-п-
фенилендиамин гидрохлорид....................113
Приложение 6. Алгоритм экспрессного теста определения оксидазной активности с реактивом димети-п-фенилендиамин дигидрохлорид...................114
6
МУК 4.2.2959-11
УТВЕРЖДАЮ
Руководитель Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека, Главный государственный санитарный врач Российской Федерации
Г. Г. Онищенко
29 июля 2011 г.
Дата введения: с момента утверждения 4.2. БИОЛОГИЧЕСКИЕ И МИКРОБИОЛОГИЧЕСКИЕ ФАКТОРЫ
Методы санитарно-микробиологического и санитарно-паразитологического анализа прибрежных вод морей в местах водопользования населенияМетодические указания МУК 4.2.2959-111. Область применения
1.1. Настоящие методические указания (далее — МУК) устанавливают методы санитарно-микробиологического и санитарнопаразитологического анализа качества прибрежных вод морей в соответствии с санитарно-эпидемиологическими требованиями к охране прибрежных вод морей от загрязнения в местах водопользования населения (СанПиН 2.1.5. 2582—10).
1.2. Методические указания предназначены для индивидуальных предпринимателей, юридических лиц, деятельность которых может привести к загрязнению воды морей и оказать неблагоприятное влияние на здоровье населения, а также для органов, уполномоченных осуществлять государственный санитарно-эпидемиологический надзор за качеством прибрежных вод морей.
1.3. Производственный контроль состава и свойств сточных вод и морской воды в контрольных пунктах охраняемых районов обеспечивается водопользователями самостоятельно либо с привлечением аккредитованной на данный вид деятельности лаборатории.
1.4. Санитарно-микробиологический и санитарно-паразито-логический анализ проб прибрежных вод морей осуществляется в соответствии с СанПиН 2.1.5.2582—10 по основным показателям: общие колиформные бактерии, Е. coti, энтерококки, стафи-
7
МУК 4.2.2959-11
лококки и колифаги; дополнительным показателям: возбудители кишечных инфекционных заболеваний (сальмонеллы и шигеллы), Pseudomonas aeruginosa, Legionella pneumophila, Campylobacter jejuni, вирусы (энтеровирусы, ротавирусы, вирусы гепатита А); показателям, определяемым в период начала купального сезона, максимальной антропогенной нагрузки и по эпидемическим показаниям: жизнеспособные яйца гельминтов (аскарид, власоглавов, токсокар, фасциол), цисты патогенных кишечных простейших, ооцисты криптоспоридий.
2. Нормативно-методические документы
В настоящих методических указаниях использованы ссылки на следующие нормативно - методические документы:
1. СанПиН 2.1.5.2582—10 «Гигиенические требования к охране прибрежных вод морей от загрязнения в местах водопользования населения».
2. СП 1.3.2322—08 «Безопасность работы с микроорганизмами III—IV групп патогенности (опасности) и возбудителями паразитарных болезней».
3. МУК 4.2.2316—08 «Методы контроля бактериологических питательных сред».
4. МУК 4.2.1018—01 «Санитарно-микробиологический анализ питьевой воды».
5. МУК 4.2.2314—08 «Методы санитарно-паразитологического анализа воды».
6. МУК 4.2.2321—08 «Методы определения бактерий рода Campylobacter в пищевых продуктах».
7. МУК 4.2.2029—05 «Санитарно-вирусологический контроль водных объектов».
8. МУК 4.2.1884—04 «Санитарно-микробиологический и санитарно-паразитологический анализ воды поверхностных водных объектов».
9. МУ 1.3.2569—09 «Организация работы лабораторий, использующих методы амплификации НК при работе с материалом, содержащим микроорганизмы I—IV групп патогенности».
10. МУ 2.1.4.1057—01 «Организация внутреннего контроля качества санитарно-микробиологических исследований воды».
11. ГОСТ Р 53415-2009 «Вода. Отбор проб для микробиологического анализа воды».
12. ГОСТ Р 51592-2000 «Вода. Общие требования к отбору проб».
13. ГОСТ 6709-72 «Вода дистиллированная. Технические условия».
МУК 4.2.2959-11
14. ГОСТ 26670-91 «Методы культивирования микроорганизмов».
15. ГОСТ Р 52426-2005 «Вода питьевая. Обнаружение и количественный учет Escherichia coli и колиформных бактерий. Часть 1. Метод мембранной фильтрации».
16. МР 24 ФЦ/513 «Определение колиформных бактерий и Е. coli с использованием хромогенных и флюорогенных индикаторных сред производства компании «Merck» (Германия)».
17. МР «Обнаружение и идентификация Pseudomonas aeruginosa в объектах окружающей среды (пищевых продуктах, воде, сточных жидкостях)».
18. МР 96/225 «Контроль качества и безопасности минеральных вод по химическим и микробиологическим показателям».
19. МР 01/15702-8—34 «Микробиологическая диагностика кампилобактериоза. Методические рекомендации».
20. ПНД Ф 12.15.1—08 «Методические указания по отбору проб для анализа сточных вод».
3. Оборудование, расходные материалы для работ по микробиологии и паразитологии
1. Приборы для мембранной фильтрации под вакуумом с диаметром фильтрующей поверхности 35 или 47 мм и устройства для создания разрежения (0,5—1,0) атм. типа ПВФ-142, ОФФ-25, «ПробоКонг-СЭС-МЗ», ПВФ-142ВБ, ПМФ-70, АФ 142 «К», «Н».
2. Водяная баня или термостат для температурного режима 45—49 °С (для питательных сред).
3. Термостаты, поддерживающие рабочую температуру (37 ± 1)°С, (44 ± 0,5) °С, (50 + 1) °С.
4. Стерилизатор суховоздушный.
5. Термометр ртутный с диапазоном измерения от 0 до 200 °С с ценой деления шкалы 1 °С.
6. Термометр ртутный с диапазоном измерения от 0 до 50 °С с ценой деления шкалы 0,5 °С.
7. Логгеры (мониторинг температуры в термостате).
8. Термометр спиртовой с диапазоном измерения от —50 до 50 °С с ценой деления шкалы 1 °С для измерения температуры в холодильниках.
9. Стерилизатор паровой, режим работы от 0 до 2,5 кгс/см3.
10. Ламинарный бокс для культуры клеток (класс не ниже 2-го).
11. Центрифуга лабораторная рефрижераторная WKH-1VH.
12. Микроцентрифуга для пробирок со скоростью вращения 10000—16000 об./мин.
9
МУК 4.2.2959-11
13. Нагревательный прибор для варки питательных сред либо магнитные мешалки с подогревом до 300 °С.
14. Микроскоп стереоскопический, обеспечивающий увеличение от 305 до 119х, с полем зрения 39—1,9 мм.
15. Инвертированный микроскоп для просмотра флаконов с культурами клеток при анализе на энтеровирусы.
16. Микроскоп биологический, обеспечивающий увеличение от 84 до 1350х.
17. Весы лабораторные общего назначения 4-го класса точности, с пределом взвешивания до 1000 г, допустимая погрешность не более 0,1 г по ГОСТ 24104-80.
18. Микроскоп биологический, обеспечивающий увеличение от 84 до 1350х.
19. Весы лабораторные общего назначения 4-го класса точности, с пределом взвешивания до 200 г, допустимая погрешность не более 0,02 г.
20. PH-метр, обеспечивающий измерение с погрешностью до
0,01.
21. Дистиллятор, обеспечивающий качество дистиллированной воды, отвечающий ГОСТ 6709-72.
22. С02 инкубатор, обеспечивающий температуру до 50 °С.
23. Холодильники бытовые электрические с температурой в камере 4—6 °С.
24. Низкотемпературный морозильник с температурой в камере —70 °С.
25. Иммуноферментный анализатор (ИФА).
26. Стерильный фильтрующий материал для микробиологических целей (мембранные фильтры, аналитические трековые мембраны и другие фильтрующие материалы с диаметром пор не более 0,45 мкм и размером диска 35 или 47 мм), проверенной ранее партии или другие фильтрующие мембраны с аналогичной способностью фильтрации, разрешенные к применению в установленном порядке.
27. Мембрана микропористая капроновая (ММК, диаметр пор 0,2 мкм).
28. Мембрана для концентрирования вирусов из воды типа ФМНЦ - 0,2 мкм.
29. Мембранные фильтры для паразитологических исследований с размерами пор 1,5—3,0 мкм, размерами пор 2,4—4,5 мкм, трековые микрофильтрационные мембраны с диаметром пор 1,0— 3,05 мкм.
30. Трековые микрофильтрационные мембраны (ATM) с диаметром пор 5,0 и 2,5 мкм и префильтр (капроновая сетка) с диа-