МУ 1918-78
Методические указания по определению этефона (кампозана М) и его производных (гидрела, дигидрела) в яблоках, огурцах, томатах, семенах хлопка и хлопковом масле методом газожидкостной хроматографии
Купить МУ 1918-78 — бумажный документ с голограммой и синими печатями. подробнее
Распространяем нормативную документацию с 1999 года. Пробиваем чеки, платим налоги, принимаем к оплате все законные формы платежей без дополнительных процентов. Наши клиенты защищены Законом. ООО "ЦНТИ Нормоконтроль"
Наши цены ниже, чем в других местах, потому что мы работаем напрямую с поставщиками документов.
Способы доставки
- Срочная курьерская доставка (1-3 дня)
- Курьерская доставка (7 дней)
- Самовывоз из московского офиса
- Почта РФ
Методические указания предназначены для специалистов контрольно-токсикологических лабораторий, санитарно-эпидемиологических станций, осуществляющих контроль за применением регуляторов роста растений, и научно-исследовательских лабораторий, занимающихся определением микроколичеств регуляторов роста при разработке технологий их применения.
Оглавление
1 Краткая характеристика препаратов
2 Методика определения
2.1 Основные положения
2.2 Реактивы и растворы
2.3 Приборы и посуда
2.4 Проведение определения
3 Требования безопасности
Приложения
| Дата введения | 01.01.2021 |
|---|---|
| Добавлен в базу | 01.02.2017 |
| Актуализация | 01.01.2021 |
Этот документ находится в:
Организации:
| 27.09.1978 | Утвержден | Заместитель Главного государственного санитарного врача CCCР | |
|---|---|---|---|
| Разработан | ВНИИХСЗР | ||
| Издан | Агропромиздат | 1986 г. |
- ГОСТ 4233-77 Реактивы. Натрий хлористый. Технические условия
- ГОСТ 1770-74 Посуда мерная лабораторная стеклянная. Цилиндры, мензурки, колбы, пробирки. Общие технические условия
- ГОСТ 22300-76 Реактивы. Эфиры этиловый и бутиловый уксусной кислоты. Технические условия
- ГОСТ 2603-79 Реактивы. Ацетон. Технические условия
- ГОСТ 3118-77 Реактивы. Кислота соляная. Технические условия
- ГОСТ 4166-76 Реактивы. Натрий сернокислый. Технические условия
- ГОСТ 4197-74 Реактивы. Натрий азотисто-кислый. Технические условия
- ГОСТ 6691-77 Реактивы. Карбамид. Технические условия
- ГОСТ 6995-77 Реактивы. Метанол-яд. Технические условия
- ГОСТ 20292-74 Приборы мерные лабораторные стеклянные. Бюретки, пипетки. Технические условия
- ГОСТ 10394-72 Стаканы и колбы стеклянные лабораторные. Технические условия
- ГОСТ 10515-75 Пробирки стеклянные. Технические условия
- Показать все
Чтобы бесплатно скачать этот документ в формате PDF, поддержите наш сайт и нажмите кнопку:

стр. 1

стр. 2

стр. 3

стр. 4

стр. 5

стр. 6

стр. 7

стр. 8

стр. 9

стр. 10

стр. 11

стр. 12

стр. 13

стр. 14
стр. 15
стр. 16
стр. 17
стр. 18
стр. 19
стр. 20

стр. 21
ГОСУДАРСТВЕННЫЙ АГРОПРОМЫШЛЕННЫЙ КОМИТЕТ СССР
Государственная комиссия по химическим средствам борьбы с вредителями, болезнями растений и сорнякам? МОСКОВСКАЯ ОРДЕНА ЛЕНИНА И ОРДЕНА ТРУДОВОГО КРАСНОГО ЗНАМЕНИ СЕЛЬСКОХОЗЯЙСТВЕННАЯ АКАДЕМИЯ ИМЕНИ К. А. ТИМИРЯЗЕВА
ЦЕНТРАЛЬНЫЙ ИНСТИТУТ АГРОХИМИЧЕСКОГО ОБСЛУЖИВАНИЯ СЕЛЬСКОГО ХОЗЯЙСТВА
МЕТОДИЧЕСКИЕ УКАЗАНИЯ ПО ОПРЕДЕЛЕНИЮ МИКРОКОЛИЧЕСТВ РЕГУЛЯТОРОВ РОСТА В РАСТИТЕЛЬНОЙ ПРОДУКЦИИ И ОБЪЕКТАХ ОКРУЖАЮЩЕЙ СРЕДЫ
(Часть 1)
МОСКВА АГРОПРОМИЗДАТ 1986
ГОСУДАРСТВЕННЫЙ АГРОПРОМЫШЛЕННЫЙ КОМИТЕТ СССР Государственная комиссия по химическим средствам борьбы с вредителями, болезнями растений и сорняками
МОСКОВСКАЯ ОРДЕНА ЛЕНИНА И ОРДЕНА ТРУДОВОГО КРАСНОГО ЗНАМЕНИ СЕЛЬСКОХОЗЯЙСТВЕННАЯ АКАДЕМИЯ ИМЕНИ К: А. ТИМИРЯЗЕВА
ЦЕНТРАЛЬНЫЙ ИНСТИТУТ АГРОХИМИЧЕСКОГО ОБСЛУЖИВАНИЯ СЕЛЬСКОГО ХОЗЯЙСТВА
МЕТОДИЧЕСКИЕ УКАЗАНИЯ ПО ОПРЕДЕЛЕНИЮ МИКРОКОЛИЧЕСТВ РЕГУЛЯТОРОВ РОСТА В РАСТИТЕЛЬНОЙ ПРОДУКЦИИ И ОБЪЕКТАХ ОКРУЖАЮЩЕЙ СРЕДЫ
(Часть 1)
МОСКВА АГРОПРОМИЗДАТ 1986
Мерные колбы на 100 мл, ГОСТ 1770-74.
Микрошприцы на 10 мкл, МШ-10.
2.4. Проведение определения
В яблоках. 10 г измельченных яблок помещают в коническую колбу на 250 мл, добавляют 20 г безводного сернокислого натрия и 70 мл метанола для извлечения этефона или смеси метанола и ацетона (1:1) для извлечения гидрела или дигидрела. Смесь встряхивают в течение 30 мин на механическом встряхивателе. Экстракт фильтруют в круглодонную колбу и повторяют экстракцию растворителем в том же количестве в течение 30 мин. К объединенному экстракту добавляют 0,5 мл 10%-ного раствора соляной кислоты в метаноле и отгоняют растворитель на ротационном вакуумном испарителе при температуре бани 35°С до объема 5— 10 мл. К остатку приливают эфирный раствор диазометана до появления постоянного желтого цвета. Обычно требуется 10—13 мл свежеприготовленного раствора метилирующего реагента. Колбу слабо закрывают корковой пробкой и оставляют в покое на 15—20 мин. Избыток диазометана отгоняют на ротационном испарителе без нагревания. Остаток (10 мл) переносят количественно метанолом в делительную воронку на 100 мл. Полученный объем вдвое разбавляют дистиллированной водой, прибавляют 5 г хлористого натрия и 20 мл гексана. Несколько секунд смесь энергично встряхивают.
Дают слоям разделиться, нижний слой переносят в делительную воронку, а верхний гексановый слой отбрасывают.
Метиловый эфир хлорэтилфосфоновой кислоты экстрагируют из водной фазы этилацетатом порциями 20 мл и два раза по 10 мл. Этилацетатный экстракт сушат безводным сульфатом натрия в течение 10—20 мин,
фильтруют в грушевидную колбу на 50 мл и отгоняют растворитель на ротационном вакуумном испарителе при температуре бани 30—35°С до объема 1—1,5 мл. Остаток количественно переносят в градуированную пробирку и доводят объем до 5 мл этилацетатом. В хроматограф вводят 3 мкл полученного раствора. Если раствор до хроматографирования должен стоять более одного часа, необходимо держать его в холодильнике.
В огурцах, томатах. К 10 г измельченного образца добавляют 100 г безводного сернокислого натрия и 70 мл соответствующего экстрагента. Экстракцию про-
Ю
водят так же, как и для яблок. Экстракт сушат над 30 г безводного сульфата натрия, фильтруют в колбу прибора для отгонки растворителя, добавляют 0,5 мл 10%-ного раствора соляной кислоты в метаноле и отгоняют растворитель до объема 10 мл. Метилирование проводят по схеме, описанной выше. После удаления избытка диазометана остаток количественно метанолом переносят в делительную воронку, разбавляют вдвое водой, добавляют 5 г хлористого натрия и 20 мл гексана. Смесь энергично встряхивают, дают слоям разделиться, нижний водный слой переносят в другую делительную воронку, а гексановый слой отбрасывают. Эту операцию гексаном проводят еще дважды, порциями по 10 мл. Метиловый эфир хлорэтилфосфоновой кислоты экстрагируют из водной фазы этилацетатом порциями 20 мл и два раза по 10 мл. Далее все операции проводят, как указано выше для яблок.
В семенах хлопчатника. Навеску размолотых семян (10 г) помещают в круглодонную колбу на 500 мл и заливают 100 мл смеси метанола с ацетоном (1 : 1). Содержимое колбы встряхивают в течение 30 мин на механическом встряхивателе. Экстракт фильтруют через бумажный фильтр в круглодонную колбу. Экстракцию проводят еще два раза тем же растворителем порциями по 100 мл. К объединенному экстракту добавляют 0,5 мл 10%-ного раствора соляной кислоты в метаноле и отгоняют растворитель с помощью ротационного вакуумного испарителя до объема 15—20 мл. Колбу с экстрактом помещают в испаритель холодильника на 5—6 ч, предварительно закрыв пробкой.
Охлажденный раствор фильтруют через бумажный фильтр, который содержит 5 г безводного сернокислого натрия. Стенки колбы обмывают охлажденным метанолом, который также пропускают через фильтр. В фильтрат добавляют 25 мл высушенного этилового эфира, содержимое колбы тщательно перемешивают. Через несколько минут к фильтрату снова добавляют 15 мл этилового эфира. Выпавший белый осадок отфильтровывают через бумажный фильтр. Фильтрат упаривают до объема 10 мл. К раствору приливают 2 мл абсолютного метилового спирта и 25 мл свежеприготовленного диазометана. Неплотно закрыв колбу корковой пробкой, оставляют раствор на 20—30 мин. Затем отгоняют избыток диазометана на ротационном вакуумном испарителе
11
без обогрева колбы. Остаток (10 мл) переносят количественно метанолом в делительную воронку и далее очистку проводят по схеме, описанной для яблок.
В хлопковом масле. Навеску масла (10 г) помещают в делительную воронку на 100 мл. Производные этефона из масла экстрагируют 30 мл этилового спирта три раза. Объединенный спиртовой экстракт помещают в круглодонную колбу на 200 мл и отгоняют растворитель до объема 15—20 мл с помощью ротационного вакуумного испарителя, предварительно добавив в него 0,5 мл 10%-ного раствора соляной кислоты в метаноле. Колбу с экстрактом помещают в испаритель холодильника на 5—6 ч и далее проводят все операции, описанные для семян хлопка.
Условия хроматографирования. Хроматограф Цвет-106 с тррмоионным детектором. Скорость протяжки ленты самописца 0,33 см/мин. Рабочая шкала электрометра 10-10“10А. Стеклянная колонка длиной 1 м и внутренним диаметром 3,5 мм, заполненная хромо-сорбом W (100—120 меш..), промытым кислотой и си-ланизированным ДМХС, с 5% SE-30.
Температура колонки 110°С, испарителя 140°С.
Скорость газа-носителя азота — 40, водорода — 18— 20, воздуха — 180—200 мл/мин. Время удерживания эфира в этих условиях 2 мин 15 с.
В хроматограф вводят 3 мкл раствора.
Линейность детектирования сохраняется в пределах 1—20 нг.
Количественное определение проводят методом соотношения со стандартами по высоте пиков.
2.5. Обработка результатов анализа
Содержание действующего вещества в анализируемой пробе вычисляют по формуле
/-* — Нрп * Сет * У
Нст-Уа-А ’
где С — содержание 2-хлорэтилфосфоновой кислоты в пробе, мг/кг; Нрп — высота пика анализируемой пробы, мм; НСт — высота пика стандарта, ум; Сст — содержание анализируемого вещества в стандарте, нг; У — объем конечного раствора, из которого отбирают пробу для хроматографирования (5 мл), мл; Уа —• объем аликвоты, которую вводят в хроматограф (3 мкл), мкл; А —• навеска анализируемого образца (10 г), г.
Альтернативная колонка — стеклянная, длиной 120 см и внутренним диаметром 3 мм, заполнена хро-
12
матоном N—AW—HMDS (0,16—0,20 мм) с 10% поли-пропиленгликоль адипата.
Температура колонки 170°С, испарителя 200°С.
Скорость газа-носителя азота — 75, водорода — 18—20, воздуха — 200 мл/мин. Время удержания эфира в этих условиях 2 мин 45 с.
Приготовление стандартов для сравнения с рабочей пробой. В грушевидные колбы вносят различное количество стандартных растворов этефона (гидрела, дигид-рела) из разведения 10 мкг/мл. Растворы доводят до 2 мл метанолом, приливают 5—6 мл эфирного раствора диазометана и, закрыв пробкой, оставляют на 15 мин в покое. Избыток диазометана отгоняют на роторном испарителе без нагрева, остаток переносят метанолом в делительную воронку, в 2 раза разбавляют водой, добавляют 5 г хлористого натрия и экстрагируют эфир хлорэтилфосфоновой кислоты этилацетатом порциями 20 мл и два раза по 10 мл. Объединенный экстракт сушат над безводным сернокислым натрием, фильтруют в грушевидную колбу на 50 мл и отгоняют растворитель на роторном испарителе при температуре бани 30—35°С до объема 1—1,5 мл. Остаток количественно переносят в градуированную пробирку и доводит объем раствора до 5 мл этилацетатом. В хроматограф вводят 3 мкл полученного раствора.
3. ТРЕБОВАНИЯ БЕЗОПАСНОСТИ
При работе с этиловым эфиром необходимо соблюдать правила безопасности. Перегонку эфира вести на водяной бане. В помещении не должен быть открытый огонь! Отгонять эфир полностью запрещается, Так как в колбе остаются взрывоопасные перекисные соединения. Соблюдать меры безопасности при работе с нитро-зометилмочевиной и диазометаном. Работу необходимо проводить под тягой в перчатках.
13
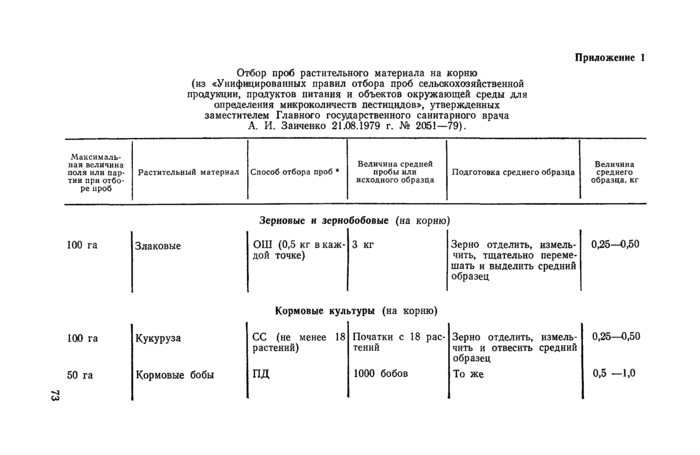
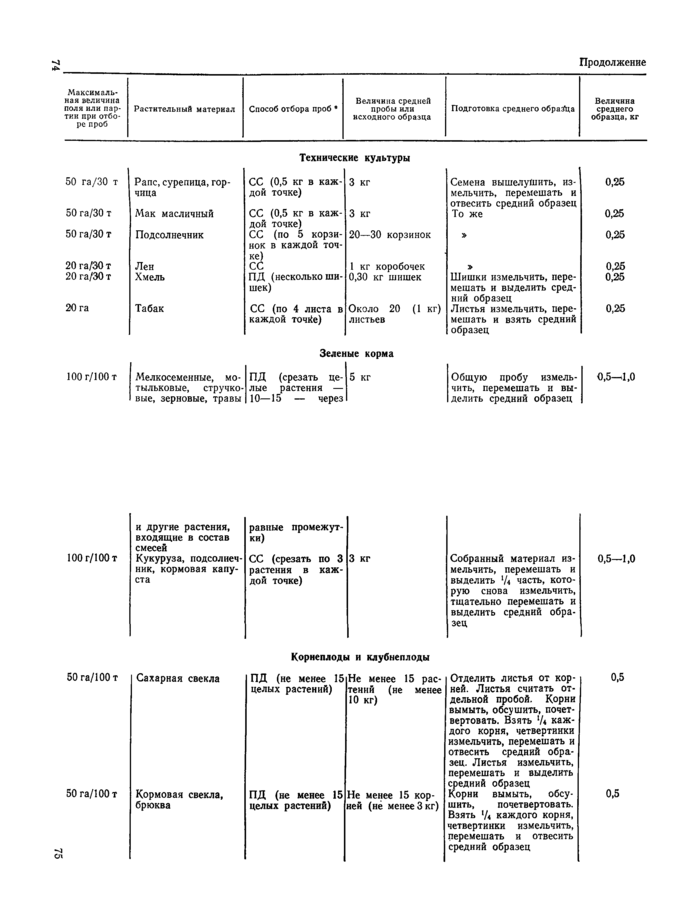
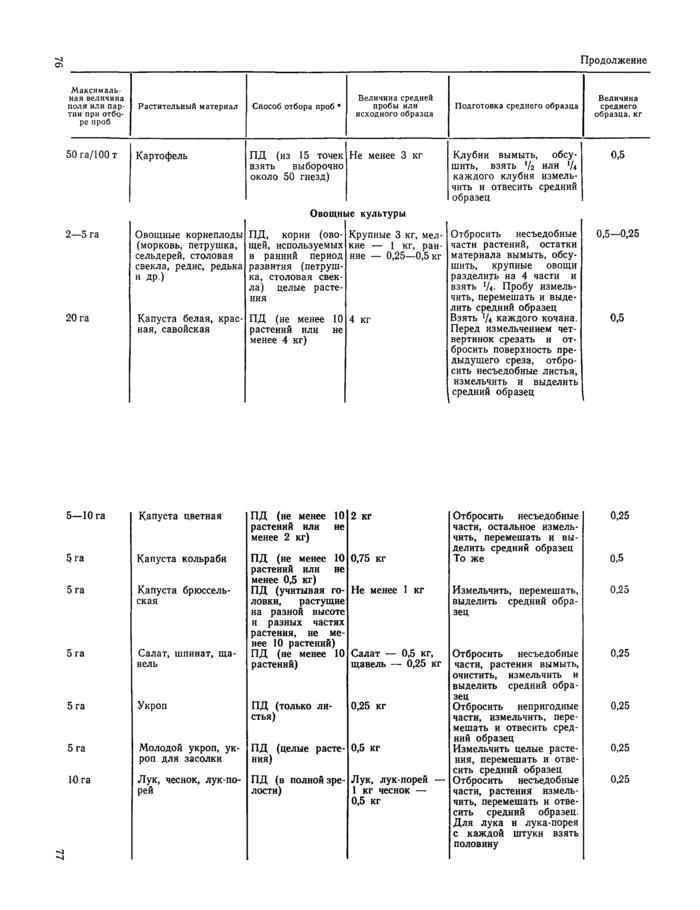
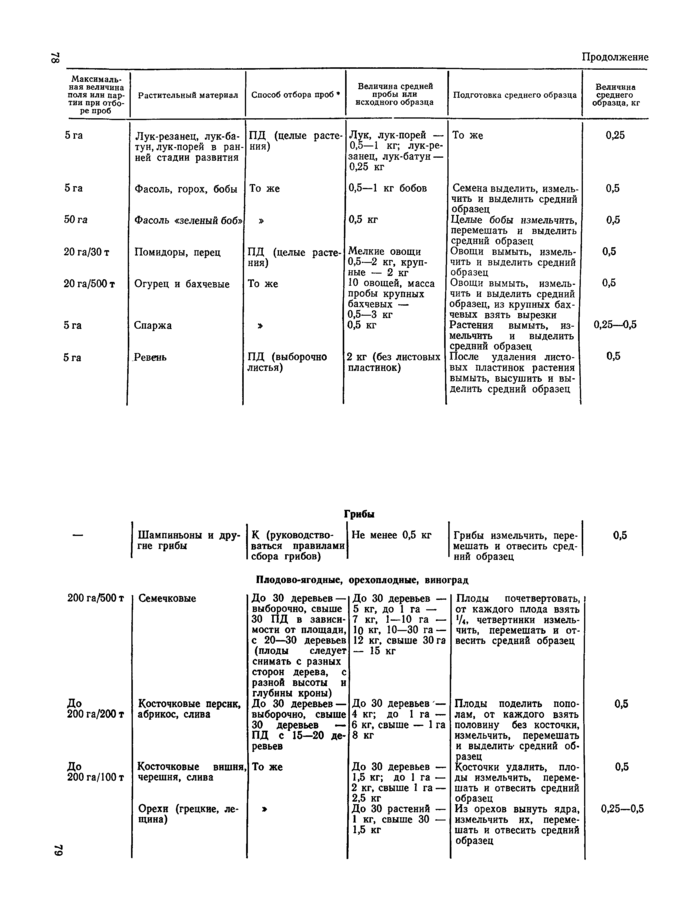
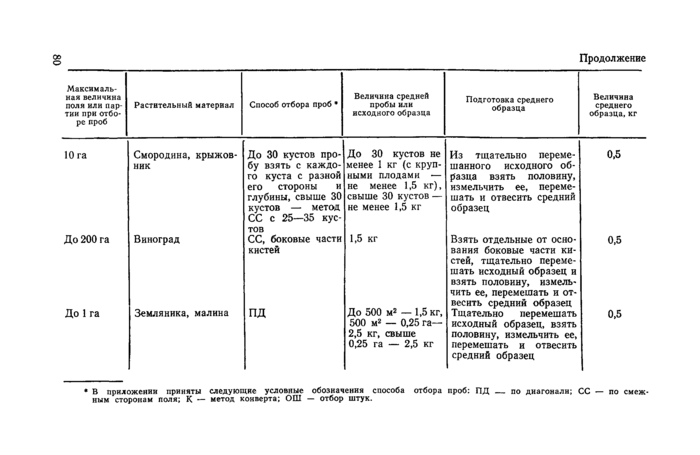
Приложение 1
Отбор проб растительного материала на корню (из «Унифицированных правил отбора проб сельскохозяйственной продукции, продуктов питания и объектов окружающей среды для определения микроколичеств пестицидов», утвержденных заместителем Главного государственного санитарного врача А. И. Зайченко 21ЛШ979 г. № 2051—79).
| ||||||||||||
|
Зерновые и зернобобовые (на корню) |
| ||||||||||||||||||
|
Кормовые культуры (на корню) |
100 га Кукуруза
50 га Кормовые бобы
СС (не менее 18 растений)
ПД
Початки с 18 рас- Зерно отделить, измель-тений чить и отвесить средний
образец
1000 бобов
То же
0,26—0,50
0,5 —1,0
УДК 632.95.028(0.83.131)
Методические указания по определению микроколичеств регуляторов роста в растительной продукции и объектах окружающей среды (под ред. кандидата сельскохозяйственных наук И. /О Бли-новского и доктора биологических наук В. Ф. Ладонина) включают разработки ВНИИ гигиены и токсикологии пестицидов, полимерных и пластических масс и его филиала (г. Ереван), Московской сельскохозяйственной академии имени К. А. Тимирязева, ВНИИ химических средств защиты растений, Института физиологии растений АН СССР, Института физиологии растений АН УССР, Научно-исследовательского зонального института садоводства Нечерноземной полосы, Московского государственного университета имени М. В. Ломоносова, Новосибирского института органической химии СО АН СССР, Узбекского НИИ санитарии, гигиены и профзаболеваний.
Методические указания одобрены лабораторным советом при Главном санитарно-эпидемиологическом управлении Министерства здравоохранения СССР и утверждены заместителем Главного государственного санитарного врача СССР в качестве официальных.
Методические указания предназначены для специалистов контрольно-токсикологических лабораторий, санитарно-эпидемиологических станций, осуществляющих контроль за применением регуляторов роста растений, и научно-исследовательских лабораторий, занимающихся определением микроколичеств регуляторов роста при разработке технологий их применения.
Члены редколлегии: Ю. А. Бунятян, М. А. Клисенко, М. И. Л у-нее, С. В. Лопат ко.
Методические указания по определению микроколичеств регуляторов роста в растительной продукции и объектах окружающей среды (часть 1)
Зав. редакцией А. Я- Рогачева Редактор Р. А. Антипина Технический редактор Е. Э. Пчурова Корректор Н. Я. Туманова
Сдано в набор 24.05.85. Подписано к печати. 06.02.86. Т03074.
Формат 84х 1087э2. Бумага тип. № 3. Гарнитура литературная. Печать высокая. Уел. печ. л. 4,2. Уч.-изд. л. 4,63. Уел. кр.-отт. 4,41.
Тираж 5000 экз. Заказ № 3322. Бесплатно.
Ордена Трудового Красного Знамени ВО «Агропромиздат> 107807, ГСП, Москва, Б-53, ул. Садовая-Спасская, 18.
170000, г. Калинин, Студенческий пер., 28.
Обл. типография.
© Государственный агропромышленный комитет СССР, 1986
Успехи, достигнутые в последние годы в области разработки теоретических основ и практического использования регуляторов роста и развития растений, определили их как самостоятельное и перспективное направление химизации земледелия.
В настоящее время применение синтетических регуляторов роста (химического, микробного или растительного происхождения) в целях повышения урожайности, устойчивости к неблагоприятным факторам внешней среды, качества и сохранности продукции становится важным звеном в технологиях возделывания многих сельг скохозяйственных культур.
Разработанная в нашей стране целевая комплексная научно-техническая программа создания и широкого внедрения регуляторов роста растений, обеспечивающих повышение урожайности и качества сельскохозяйственных культур, нацеливает усилия химиков и биологов на поиск и создание препаратов, действующих на такие важнейшие процессы жизнедеятельности растений, как рост стебля (повышение устойчивости к полеганию, устранение перерастания рассады, ограничение крон многолетних растений и кустарников, увеличение биомассы и др.); плодоношение (ускорение у многолетних культур, повышение завязываемости и др.); устойчивость к стрессовым воздействиям (засухе, низким температурам, переувлажнению); рост корней (стимуляция при размножении черенками, рассадой, пересадке растений и др.); созревание (ускорение или замедление); накопление и распределение ассимилятов (повышение интенсивности фотосинтеза, усиление оттока ассимилятов к зерновкам, плодам); опадение плодов и листьев (облегчение механизированной уборки и дефолиация); покой (повышение лежкости при хранении или стимуляции прорастания); сексуализация (регулирование пола растений в сторону увеличения женских или мужских цветков); рост и дифференциация тканей (при размножении оздоровленного посадочного материала и в селекции).
При всем многообразии действия регуляторы роста и развития растений могут быть определены как вещества, которые влияют на жизненные процессы растений, не оказывая токсического действия, и не являются источником питания (в отличие от пестицидов и удобрений).
Большинство регуляторов роста в зависимости от культуры, времени и норм применения имеет многоцелевое назначение. Так, этиленпродуценты могут использоваться для торможения роста стебля (рожь, ячмень), стимулирования плодоношения (яблоня), ускорения созревания (вишня, томат), повышения лежкости (картофель, свекла), сдвига пола (огурец, плодовые культуры, хлопчатник), образования отделительного слоя (облегчение механизированной уборки и дефолиация).
3
Широкий спектр действия регуляторов роста предполагает постоянное расширение сферы их применения в растениеводстве. При этом увеличивается потенциальная опасность загрязнения имц сельскохозяйственной продукции и объектов окружающей среды. Постановлением Совета Министров СССР о дополнительных мерах но усилению контроля за применением в народном хозяйстве пестицидов и регуляторов роста растений в целях недопущения вредного воздействия их на здоровье населения предложено ужесточить требования к применению в народном хозяйстве пестицидов и регуляторов роста растений, усилить контроль за соблюдением установленных правил хранения, транспортировки и применения их, разработать и осуществить дополнительные мероприятия по предотвращению загрязнения окружающей природной среды пестицидами, регуляторами роста растений и основными токсичными продуктами их разложения исходя из необходимости охраны здоровья населения.
В настоящие указания включены методы определения микроколичеств регуляторов роста растений, уже разрешенных для применения в сельском хозяйстве (или проходящих государственные испытания).
Учитывая важность отбора представительной пробы анализируемой растительной продукции, в указания включено извлечение из «Унифицированных правил отбора проб сельскохозяйственной продукции, продуктов питания и объектов окружающей среды для определения микроколичеств пестицидов», утвержденных Министерством здравоохранения СССР 21.08. 1979 г. (приложение 1).
Публикация подобных материалов будет осуществляться периодически, по мере внедрения в сельскохозяйственное производство новых регуляторов роста, разработки методов контроля за их применением и появления более совершенных и унифицированных методов определения микроколичеств препаратов в сельскохозяйственной продукции, кормах и объектах внешней среды.
ОПРЕДЕЛЕНИЕ МИКРОКОЛИЧЕСТВ РЕГУЛЯТОРОВ РОСТА В РАСТИТЕЛЬНОЙ ПРОДУКЦИИ, ВОДЕ И ПОЧВЕ
Утверждаю:
заместитель Главного государственного санитарного врача СССР
А. И. ЗАЙЧЕНКО 27.09. 1978 № 1918 — 78
Методические указания по определению этефона (кампозана М) и его производных (гидрела, дигидрела) в яблоках, огурцах, томатах, семенах хлопка и хлопковом масле методом газожидкостной хроматографии 1
1. КРАТКАЯ ХАРАКТЕРИСТИКА ПРЕПАРАТОВ
2-хлорэтилфосфоновая кислота (этефон) — действующее начало препаратов кампозаи М, этрел.
Структурная формула
0
II
С1—СН2—СН2—Р—он
1
он
Эмпирическая формула С2Н603С1Р. Молекулярная масса — 144,5.
Химически чистый этефон — твердое кристаллическое вещество белого цвета с температурой плавления 74—76°С. Гигроскопичен, быстро растворяется в гидрофильных растворителях, воде, спирте. В водных растворах при pH выше 3,5 разлагается.
Кампозан М разрешен для опытно-производственного применения на посевах озимой ржи и льна с целью повышения их устойчивости к полеганию, испытывается
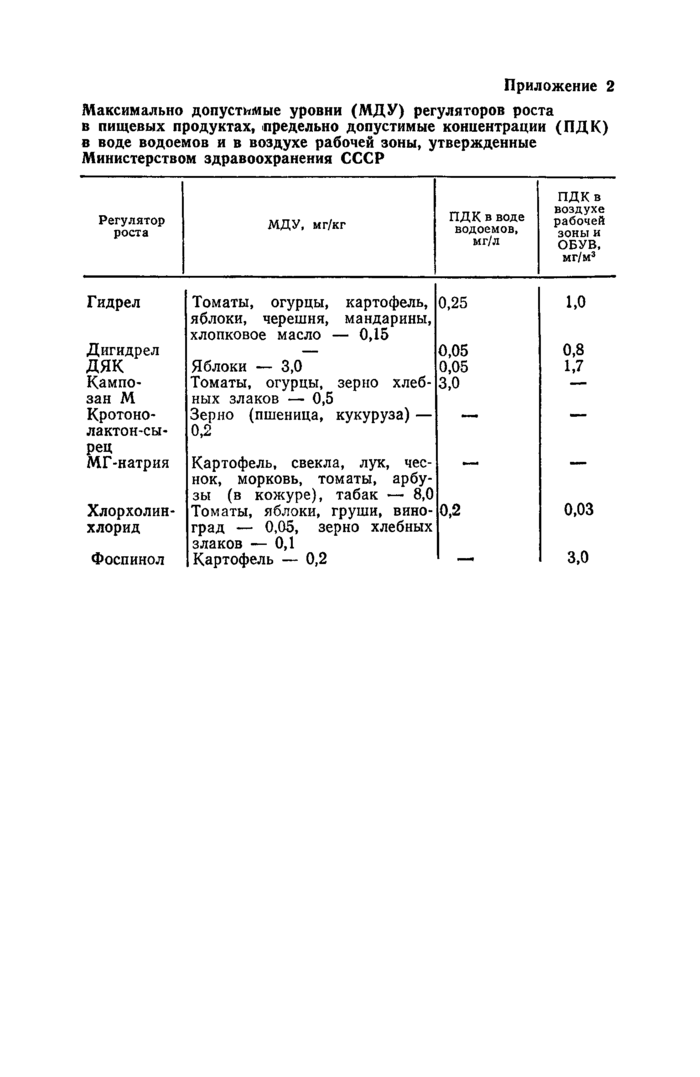
на плодовых и овощных культурах. Максимально допустимый уровень (МДУ) кампозана М в зерне хлебных злаков, томатах, огурцах — 0,5 мг/кг.
К производным этефона относятся гидрел и дигид-рел. Гидрел рекомендован для ускорения созревания томатов и повышения урожайности огурцов в открытом и защищенном грунте. Дигидрел испытывается на зерновых культурах.
Структурная формула г и д р е л а
р
(С1-СН2-СН2-Р_ОН]2- NH3-NH3 6“
Эмпирическая формула C4H16O6CI2P2N2. Молекулярная масса — 321,05.
Структурная формула дигидрела
[С1-СН2-СН2-Р -OH]2-N^3-n1h (СН3) 2
Эмпирическая формула СбН2о06С12Р2П2.
Молекулярная масса — 349,13.
Хорошо растворяются в воде и спиртах. В ацетоне могут разлагаться с отщеплением гидразина. ЛД50 гид-рела для крыс 2176 мг/кг, МДУ в пищевых продуктах 0,15 мг/кг, ПДК в воде водоемов 0,25 мг/л. ЛД50 дигидрела для крыс 3500 мг/кг, ПДК в воде водоемов 0,05 мг/л.
2. МЕТОДИКА ОПРЕДЕЛЕНИЯ
2.1. Основные положения
2.1.1. Принцип метода. Основан метод на извлечении этефона из анализируемого объекта метанолом, а производных этефона смесью метанола с ацетоном (1 : 1), этерификации с помощью диазометана, очистке экстракта перераспределением метилового эфира хлорэтилфосфоновой кислоты из водной фазы в этилацетат с последующим газохроматографическим определением с термоионным детектором.
2.1.2. Метрологическая характеристика метода. Предел обнаружения — 1 нг в 3 мкл хроматографируемой пробы.
Предел обнаружения — 0,15 мг/кг огурцов, томатов, яблок и 0,5 мг/кг семян хлопчатника и хлопкового масла.
Процент определения в огурцах, томатах, яблоках 72—93, в семенах хлопка и хлопковом масле 60—72.
Среднее значение определения стандартных количеств для овощей и фруктов 79,9%, семян хлопка и хлопкового масла 63,8%, стандартное отклонение (s) соответственно равно ±7,1 и ±4,9%, доверительный интервал среднего значения при Pops и п = 5 79,9±7,1 и 63,8±4,9%.
2.2. Реактивы и растворы
Метанол ч. д. а., ГОСТ 6995-77.
Этанол х. ч., ТУ 6-09-1710—77.
Ацетон х. ч., ГОСТ 2603-79.
Гексан х. ч., ТУ 6-09-3375—78.
Этиловый эфир (для наркоза) «Фармакопея СССР».
Этилацетат х. ч., ГОСТ 22300-76.
Соляная кислота х. ч., ГОСТ 3118-77, конц., 10%-ный раствор в метаноле.
Калий едкое оеч., ОСТ 6-01-301—74, чешуирован-ный, 50%-ный водный раствор.
Метиламин ч., ТУ 6-09-2088—72.
Мочевина ч. д. а., ГОСТ 6691-77.
Натрий азотистокислый х. ч., ГОСТ 4197-74.
Натрий металлический ч. д. а., ТУ 6-09-356—70.
Кальций хлористый плавленый ч., ГОСТ 4460-77.
Натрий хлористый х. ч., ГОСТ 4233-77.
Натрий сернокислый безводный х. ч., ГОСТ 4166-76.
Нитрозометилмочевина.
Диазометан, свежеприготовленный.
Стандартные растворы этефона, гидрела и дигидрела в метаноле или ацетоне (с содержанием соответственно 10 и 100 мкг/мл).
Получение абсолютного этилового эфира. Этиловый эфир сушат над безводным хлористым кальцием в течение нескольких дней (12 г СаС12 на 100 мл эфира). Эфир фильтруют в колбу для перегонки растворителей, туда же помещают мелконарезанные кусочки металлического натрия и перегоняют эфир в приемник, снабженный алонжем и хлоркальциевой трубкой.
Получение нитрозометилмочевины. Во взвешенную колбу на 1 л наливают 200 г (1,5М) 24%-ного водного раствора метиламина и добавляют концентрированную соляную кислоту до кислой реакции по метилроту (око-
7
ло 150 мл). Затем добавляют до 500 г дистиллированную воду и 300 г 5М мочевины. Полученный раствор осторожно кипятят с обратным холодильником при умеренном нагреве в течение 3 ч. Усиливают нагрев и кипятят энергично еще 15 мин. Раствор охлаждают до комнатной температуры и растворяют в нем 110 г 1,5М азотистокислого натрия. Охлаждают раствор до 0°С в смеси льда и хлористого натрия.
В 3-литровом стакане готовят смесь из 600 г льда и 100 г концентрированной серной кислоты. К раствору при охлаждении стакана в смеси льда и хлористого натрия медленно приливают при помешивании механической мешалкой холодный раствор метилмочевины и азотистокислого натрия. Температура раствора не должна подниматься выше 0°С. Нитрозометилмочевина всплывает на поверхность в виде кристаллов, их отфильтровывают и отсасывают под вакуумом, затем размешивают с 50 мл холодной воды до образования пасты и снова отсасывают.
Сушат кристаллы в вакуумном эксикаторе до постоянной массы. Выход — 105—115 г, или 66—72%. Хранить нитрозометилмочевину необходимо в темной склянке в холодильнике, так как под действием света и тепла она может взорваться.
Вещество ядовито! Избегать попадания на кожу!
Получение диазометана. Диазометан (т. кип. 24°С) взрывоопасен и очень ядовит. Целесообразно получать его только в растворах. Растворы даже на холоде устойчивы только в течение нескольких дней. Лучше всего их использовать свежеприготовленными.
Сосуд с диазометаном закрывают корковой пробкой и хранят в холодильнике. В круглодонную колбу на 500 мл помещают 30 мл 50%-ного водного раствора едкого калия и 100 мл абсолютированного этилового эфира. Смесь охлаждают льдом до 5°С, затем при взбалтывании через химическую воронку небольшими порциями добавляют 10,3 г (0,1М) нитрозометилмочевины. Колбу присоединяют к «обратному» холодильнику, противоположный конец которого снабжен алонжем, проходящим через резиновую или корковую пробку с двумя отверстиями и погруженным в 40 мл абсолютированного серного эфира, находящегося в конической колбе вместимостью 200 мл (рис. 1).
Приемная колба погружена в охлаждающую смесь
Рис. 1. Установка для получения диазометана (пояснения в тексте).
льда и соли. Реакционную колбу погружают в водяную баню, нагретую до 40°С, и перегоняют образующийся диазометан, время от времени взбалтывая колбу. Отгонку диазометана прекращают, как только дистиллят в холодильнике становится бесцветным. Обычно это наступает после того, как отогнаны 2/3 эфира. Ни в коем случае нельзя отгонять весь эфир! Оставшиеся на дне колбы перекисные соединения взрывоопасны!
2.3. Приборы и посуда Хроматограф Цвет-106 или аналогичный, снабженный термоионным детектором.
Стеклянные колонки длиной 1 м и внутренним диаметром 3,5 мм.
Механический встряхиватель, ТУ 64-1-1081—73. Делительные воронки на 100 мл, ГОСТ 8613-75. Ротационный вакуумный испаритель, ТУ 25-11-917—>
74.
Установка для получения диазометана (рис. 1). Колбы круглодонные на 500 мл со шлифом, ГОСТ 10394—72.
Колбы плоскодонные на 250 мл со шлифом, ГОСТ 10394-72.
Пробирки градуированные на 5 мл, ГОСТ 10515-75. Колбы грушевидные на 25 мл, ГОСТ 10394-72. Колбы конические на 100 мл, ГОСТ 10394-72. Мерные цилиндры, ГОСТ 1770-74.
9
Пипетки на 2, 5 и 10 мл, ГОСТ 20292-74.
2-3322
1
Методические указания Разработали Ф. Р. Мельцер, К. Ф. Новикова, Т. В. Алдонина (ВНИИХСЗР).
5