ГОСТ Р МЭК 62366-2013
Изделия медицинские. Проектирование медицинских изделий с учетом эксплуатационной пригодности
Купить ГОСТ Р МЭК 62366-2013 — бумажный документ с голограммой и синими печатями. подробнее
Распространяем нормативную документацию с 1999 года. Пробиваем чеки, платим налоги, принимаем к оплате все законные формы платежей без дополнительных процентов. Наши клиенты защищены Законом. ООО "ЦНТИ Нормоконтроль"
Наши цены ниже, чем в других местах, потому что мы работаем напрямую с поставщиками документов.
Способы доставки
- Срочная курьерская доставка (1-3 дня)
- Курьерская доставка (7 дней)
- Самовывоз из московского офиса
- Почта РФ
Устанавливает процесс, выполняемый изготовителем для анализа, определения, разработки, верификации и валидации эксплуатационной пригодности в части, имеющей отношение к безопасности медицинских изделий. Процесс проектирования с учетом эксплуатационной пригодности направлен на оценку и снижение рисков, вызванных проблемами с эксплуатационной пригодностью и связанных с корректной эксплуатацией/применением и ошибками эксплуатации/применения, т.е. с нормальной эксплуатацией/применением.
Идентичен IEC 62366(2007)
Оглавление
1 Область применения
2 Нормативные ссылки
3 Термины и определения
4 Основные положения
5 ПРОЦЕСС ПРОЕКТИРОВАНИЯ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ
6 ЭКСПЛУАТАЦИОННЫЙ ДОКУМЕНТ
7 Обучение и обучающие материалы
Приложение А (справочное) Общее руководство и обоснование
Приложение В (справочное) Категории действий ПОЛЬЗОВАТЕЛЯ
Приложение С (справочное) Примеры ОШИБОК ЭКСПЛУАТАЦИИ/ПРИМЕНЕНИЯ, НЕНОРМАЛЬНОЙ ЭКСПЛУАТАЦИИ/ПРИМЕНЕНИЯ и возможных причин
Приложение D (справочное) Руководство по ПРОЦЕССАМ ПРОЕКТИРОВАНИЯ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ
Приложение Е (справочное) Вопросы, которые можно использовать для определения характеристик МЕДИЦИНСКОГО ИЗДЕЛИЯ, связанных с ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТЬЮ, и которые могут оказать влияние на БЕЗОПАСНОСТЬ
Приложение F (справочное) Примеры возможных ОПАСНЫХ СИТУАЦИЙ, связанных с ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТЬЮ
Приложение G (справочное) Цели ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ. Наглядный пример для домашнего парентерального инфузионного насоса
Приложение Н (справочное) Образец спецификации ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ и ее входных данных
Приложение I (справочное) Рекомендуемый список литературы
Приложение J (справочное) Ссылки на основные принципы
Приложение ДА (справочное) Сведения о соответствии ссылочных международных стандартов национальным стандартам Российской Федерации
Библиография
Алфавитный указатель терминов
| Дата введения | 01.01.2015 |
|---|---|
| Добавлен в базу | 12.02.2016 |
| Актуализация | 01.01.2021 |
Этот ГОСТ находится в:
- Раздел Экология
- Раздел Электроэнергия
Организации:
| 28.10.2013 | Утвержден | Федеральное агентство по техническому регулированию и метрологии | 1224-ст |
|---|---|---|---|
| Разработан | ЗАО МЕДИ-ТЕСТ | ||
| Издан | Стандартинформ | 2015 г. |
Medical devices. Application of usability engineering to medical devices
Чтобы бесплатно скачать этот документ в формате PDF, поддержите наш сайт и нажмите кнопку:

стр. 1

стр. 2

стр. 3

стр. 4

стр. 5

стр. 6

стр. 7

стр. 8

стр. 9

стр. 10

стр. 11

стр. 12

стр. 13

стр. 14

стр. 15

стр. 16

стр. 17

стр. 18

стр. 19
стр. 20

стр. 21

стр. 22

стр. 23

стр. 24

стр. 25

стр. 26

стр. 27

стр. 28

стр. 29

стр. 30
ПО ТЕХНИЧЕСКОМУ РЕГУЛИРОВАНИЮ И МЕТРОЛОГИИ
ГОСТ Р мэк 62366—
2013
НАЦИОНАЛЬНЫЙ
СТАНДАРТ
РОССИЙСКОЙ
ФЕДЕРАЦИИ
ИЗДЕЛИЯ МЕДИЦИНСКИЕ
Проектирование медицинских изделий с учетом эксплуатационной пригодности
IEC 62366:2007
Medical devices — Application of usability engineering to medical devices
(IDT)
Издание официальное
|
Москва Стандартинформ 2015 |
Предисловие
1 ПОДГОТОВЛЕН Закрытым акционерным обществом «МЕДИТЕСТ» на основе собственного аутентичного перевода на русский язык международного стандарта, указанного в пункте 4
2 ВНЕСЕН Техническим комитетом по стандартизации ТК 436 «Управление качеством медицинских изделий»
3 УТВЕРЖДЕН И ВВЕДЕН В ДЕЙСТВИЕ Приказом Федерального агентства по техническому регулированию и метрологии от 28 октября 2013 г. № 1224-ст
4 Настоящий стандарт идентичен международному стандарту МЭК 62366:2007 «Медицинские изделия. Проектирование медицинских изделий с учетом эксплуатационной пригодности» (IEC 62366:2007 «Medical devices — Application of usability engineering to medical devices»).
При применении настоящего стандарта рекомендуется использовать вместо ссылочных международных стандартов соответствующие им национальные стандарты Российской Федерации, сведения о которых приведены в дополнительном приложении ДА
5 ВВЕДЕН ВПЕРВЫЕ
Правила применения настоящего стандарта установлены в ГОСТР 1.0— 2012 (раздел 8). Информация об изменениях к настоящему стандарту публикуется в ежегодном (по состоянию на 1 января текущего года) информационном указателе «Национальные стандарты», а официальный текст изменений и поправок—в ежемесячном информационном указателе «Национальные стандарты». В случае пересмотра (замены) или отмены настоящего стандарта соответствующее уведомление будет опубликовано в ближайшем выпуске ежемесячного информационного указателя «Национальные стандарты». Соответствующая информация, уведомление и тексты размещаются также в информационной системе общего пользования — на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет (www.gost.ru)
©Стандартинформ, 2015
Настоящий стандарт не может быть полностью или частично воспроизведен, тиражирован и распространен в качестве официального издания без разрешения Федерального агентства по техническому регулированию и метрологии
5.3* Идентификация ОПАСНОСТЕЙ и ОПАСНЫХ СИТУАЦИЙ, связанных с ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТЬЮ
5.3.1 Идентификация характеристик, относящихся к БЕЗОПАСНОСТИ
Идентификация характеристик, относящихся к БЕЗОПАСНОСТИ (часть анализа РИСКОВ), касающаяся ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ, должна быть проведена в соответствии с ИСО 14971. подраздел 4.2.
При идентификации характеристик, относящихся к БЕЗОПАСНОСТИ, следует учитывать следующее:
- спецификацию применения, включая профиль ПОЛЬЗОВАТЕЛЯ (ПОЛЬЗОВАТЕЛЕЙ) (см. 5.1) и
-часто используемые функции (см. 5.2).
Результаты данного определения характеристик, относящихся к БЕЗОПАСНОСТИ, должны быть зарегистрированы в ФАЙЛЕ ПРОЕКТИРОВАНИЯ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ.
Примечание 1 — См. также D.4.3. D.4.6.4. 0.5.2 и D.5.4 приложения О на предмет обсуждения методов. которые могут бьль полезными при определении характеристик, относящихся к БЕЗОПАСНОСТИ.
Примечание 2 — См. 4.3 на предмет изменения обьема ПРОЕКТИРОВАНИЯ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ.
Соответствие требованиям проверяют путем экспертизы ФАЙЛА ПРОЕКТИРОВАНИЯ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ.
5.3.2* Идентификация известных или прогнозируемых ОПАСНОСТЕЙ или ОПАСНЫХ СИТУАЦИЙ
ИЗГОТОВИТЕЛЬ должен идентифицировать известные или прогнозируемые ОПАСНОСТИ (как часть анализа рисков), относящиеся к ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ в соответствии с ИСО 14971, подраздел 4.3. Идентификация ОПАСНОСТЕЙ должна учитывать ОПАСНОСТИ для ПАЦИЕНТА. ПОЛЬЗОВАТЕЛЯ и других лиц (см. приложения Е и F).
Должны быть идентифицированы логично предсказуемые последовательности или комбинации событий, затрагивающие ПОЛЬЗОВАТЕЛЬСКИЙ ИНТЕРФЕЙС, которые могут привести к ОПАСНЫМ СИТУАЦИЯМ, связанным с МЕДИЦИНСКИМ ИЗДЕЛИЕМ. Должна быть определена ТЯЖЕСТЬ последующего возможного ВРЕДА.
При идентификации ОПАСНОСТЕЙ и ОПАСНЫХ СИТУАЦИЙ необходимо учитывать следующее:
- спецификацию применения, включая профиль ПОЛЬЗОВАТЕЛЯ(ЕЙ) (см. 5.1);
- * требования, относящиеся к поставленным задачам;
- * условия применения;
- информацию по ОПАСНОСТЯМ и ОПАСНЫМ СИТУАЦИЯМ, известную для существующих ОПАСНОСТЕЙ МЕДИЦИНСКИХ ИЗДЕЛИЙ сходного типа, если доступна;
- предварительный сценарий применения;
- возможные ОШИБКИ ЭКСПЛУАТАЦИИ/ПРИМЕНЕНИЯ (см. С.2 приложения С на предмет некоторых примеров вероятных ОШИБОК ЭКСПЛУАТАЦИИ/ПРИМЕНЕНИЯ):
- * ситуации, когда некорректная модель восприятия функционирования МЕДИЦИНСКОГО ИЗДЕЛИЯ может вызвать ОШИБКУ ЭКСПЛУАТАЦИИ/ПРИМЕНЕНИЯ. приводящую к ОПАСНЫМ СИТУАЦИЯМ;
- ’ результаты обзора ПОЛЬЗОВАТЕЛЬСКОГО ИНТЕРФЕЙСА (см. С.4 приложения С и D.2.2 приложения D).
Результаты идентификации ОПАСНОСТЕЙ. ОПАСНЫХ СИТУАЦИЙ и ТЯЖЕСТИ вреда должны быть зарегистрированы в ФАЙЛЕ ПРОЕКТИРОВАНИЯ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ.
Примечание 1 — См. также D.5.9. D.5.14, D.5.17 приложения D на предмет обсуждения методов, которые могут быть полезными при идентификации известных и прогнозируемых ОПАСНОСТЕЙ и ОПАСНЫХ СИТУАЦИЙ.
Примечание 2 — Идентификация ОПАСНОСТЕЙ и ОПАСНЫХ СИТУАЦИЙ для МЕДИЦИНСКИХ ИЗДЕЛИЙ или для общего типа изделий является входными данными для спецификации ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ, как требуется для ПРОЦЕССА ПРОЕКТИРОВАНИЯ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ.
Примечание 3 — При идентификации ОПАСНОСТЕЙ и ОПАСНЫХ СИТУАЦИЙ могут быть идентифицированы условия НЕНОРМАЛЬНОЙ ЭКСПЛУАТАЦИИ/ПРИМЕНЕНИЯ. См. также В.1 приложения В.
7
Примечание 4 — Оценка постпроизводсгвенной информации (послепродажное наблюдение) должна включать ЭКСПЛУАТАЦИОННУЮ ПРИГОДНОСТЬ (см. ИСО 14971, раздел 9).
Примечание 5 — См. 4.3 на предмет изменения объема ПРОЕКТИРОВАНИЯ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ.
Соответствие требованиям проверяют путем экспертизы ФАЙЛА ПРОЕКТИРОВАНИЯ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ.
5.4 ОСНОВНАЯ РАБОЧАЯ ФУНКЦИЯ
ИЗГОТОВИТЕЛЬ должен определить ОСНОВНЫЕ РАБОЧИЕ ФУНКЦИИ и зарегистрировать их в ФАЙЛЕ ПРОЕКТИРОВАНИЯ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ.
Входные параметры ОСНОВНЫХ РАБОЧИХ ФУНКЦИЙ должны учитывать следующее:
- часто используемые функции (см. 5.2) и
- функции, относящиеся к БЕЗОПАСНОСТИ МЕДИЦИНСКОГО ИЗДЕЛИЯ.
Примечание 1 — См. также D.5.7 приложения D на предмет обсуждения методов, которые могут быть полезными при определении ОСНОВНЫХ РАБОЧИХ ФУНКЦИЙ.
Примечание 2 — См. Н.2.2 приложения Н на предмет примеров ОСНОВНЫХ РАБОЧИХ ФУНКЦИЙ для гипотетического медицинского изделия.
Соответствие требованиям проверяют путем экспертизы ФАЙЛА ПРОЕКТИРОВАНИЯ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ.
5.5* Спецификация ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ
ИЗГОТОВИТЕЛЬ должен разработать спецификацию ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ. Спецификация ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ должна содержать:
- контролируемые требования для ВЕРИФИКАЦИИ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ;
- контролируемые требования для ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ ОСНОВНОЙ РАБОЧЕЙ ФУНКЦИИ, включая критерии определения достаточности УПРАВЛЕНИЯ РИСКАМИ, достигаемые при выполнении процедур ПРОЕКТИРОВАНИЯ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ.
Примечание 1 — Контролируемые требования для ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ ОСНОВНОЙ РАБОЧЕЙ ФУНКЦИИ могут быть выражены как цели ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ. Например, см. таблицы D.5 и D.6 приложения D и приложение G.
Примечание 2 — Критерии определения достаточности соответствуют критериям приемлемости РИСКА по ИСО 14971, подраздел 3.4. перечисление d).
Примечание 3 — Руководство по оценке достаточности средств УПРАВЛЕНИЯ РИСКАМИ можно найти в ИСО 14971, раздел D.4 приложения D.
Спецификация ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ должна быть зарегистрирована в ФАЙЛЕ ПРОЕКТИРОВАНИЯ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ. Спецификация ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ может быть включена в другие спецификации.
Входные данные для спецификации ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ должны включать следующее:
- спецификацию применения (см. 5.1):
- ОСНОВНУЮ РАБОЧУЮ ФУНКЦИЮ (см. 5.4);
-ОПАСНОСТИ и ОПАСНЫЕ СИТУАЦИИ, относящиеся к ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ
(см. 5.3);
- известные или прогнозируемые ОШИБКИ ЭКСПЛУАТАЦИИ/ПРИМЕНЕНИЯ. связанные с МЕДИЦИНСКИМ ИЗДЕЛИЕМ.
Спецификация ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ должна описывать по крайней мере:
a) сценарии использования, относящиеся к ОСНОВНОЙ РАБОЧЕЙ ФУНКЦИИ, включая;
1 )* частые сценарии использования;
2) разумно ожидаемый худший случай сценария использования;
b) требования к ПОЛЬЗОВАТЕЛЬСКОМУ ИНТЕРФЕЙСУ для ОСНОВНОЙ РАБОЧЕЙ ФУНКЦИИ, включая снижающие РИСК;
c) требования для определения, является ли ОСНОВНАЯ РАБОЧАЯ ФУНКЦИЯ легко понимаемой для ПОЛЬЗОВАТЕЛЯ.
8
Примечание 4 — См. также D.2.6. D.3.3 и D.4.4 приложения D на предмет руководства по подготовке спецификации ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ.
Примечание 5 — Спецификация ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ должна описывать контекст использования (см. обоснование в 5.3 и 0.4.1.2.4 приложения D).
Примечание 6 — См. приложение I на предмет примеров спецификации ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ для гипотетического МЕДИЦИНСКОГО ИЗДЕЛИЯ.
Примечание 7 — См. 4.3 на предмет изменения объема ПРОЕКТИРОВАНИЯ с УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ.
Соответствие требованиям проверяют путем экспертизы ФАЙЛА ПРОЕКТИРОВАНИЯ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ.
5.6 План ВАЛИДАЦИИ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ
ИЗГОТОВИТЕЛЬ должен подготовить и придерживаться плана ВАЛИДАЦИИ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ. План ВАЛИДАЦИИ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ должен предусматривать:
- любые методы, используемые для ВАЛИДАЦИИ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ ОСНОВНОЙ РАБОЧЕЙ ФУНКЦИИ:
- критерии определения успешности ВАЛИДАЦИИ ОСНОВНОЙ РАБОЧЕЙ ФУНКЦИИ, основываясь на спецификации ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ.
Примечание 1 — Контролируемые требования для ВАЛИДАЦИИ ОСНОВНОЙ РАБОЧЕЙ ФУНКЦИИ соответствуют критериям приемлемости РИСКА по ИСО 14971. подраздел 3.4. перечисление d);
-участие представителей предполагаемых ПОЛЬЗОВАТЕЛЕЙ.
Методы ВАЛИДАЦИИ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ могут быть количественными и качественными. ВАЛИДАЦИЯ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ может быть проведена в лабораторных условиях, в моделируемой окружающей среде или в реальной среде использования.
Примечание 2 — См. также D.4.4 и D.4.7.3 приложения D на предмет руководства по подготовке плана ВАЛИДАЦИИ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ.
Примечание 3 — ИЗГОТОВИТЕЛЬ должен использовать один или более методов ВАЛИДАЦИИ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ ОСНОВНОЙ РАБОЧЕЙ ФУНКЦИИ МЕДИЦИНСКОГО ИЗДЕЛИЯ в зависимости от предполагаемого использования. Примеры этих методов можно найти в 0.5.
Примечание 4 — Выводы, основанные на одном методе, могут быть недостаточными, например при клинической оценке может быть невозможно исследовать некоторые ситуации с высоким РИСКОМ.
План ВАЛИДАЦИИ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ должен рассматривать:
- частые сценарии использования и
- разумно ожидаемый худший случай сценария использования, которые определены в спецификации ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ.
Примечание 5 — См. 4.3 на предмет изменения обьема ПРОЕКТИРОВАНИЯ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ.
План ВАЛИДАЦИИ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ должен быть зарегистрирован в ФАЙЛЕ ПРОЕКТИРОВАНИЯ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ.^
Соответствие требованиям проверяют путем экспертизы ФАЙЛА ПРОЕКТИРОВАНИЯ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ.
5.7* Разработка и внедрение ПОЛЬЗОВАТЕЛЬСКОГО ИНТЕРФЕЙСА
ИЗГОТОВИТЕЛЬ должен разработать и внедрить ПОЛЬЗОВАТЕЛЬСКИЙ ИНТЕРФЕЙС, как описано в спецификации ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ, используя, если необходимо, методы и техники ПРОЕКТИРОВАНИЯ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ.
Примечание 1 — См. также D.4 и D.5 приложения D на предмет руководства по подготовке разработки и внедрения ПОЛЬЗОВАТЕЛЬСКОГО ИНТЕРФЕЙСА.
Примечание 2 — ИЗГОТОВИТЕЛЬ должен придерживаться итеративных методов проектирования и разработки. Проектирование и разработка с учетом ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ, включая ВАЛИДАЦИЮ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ, должны быть начаты как можно раньше и продолжаться в течение всего жизненного цикла разработки и развития МЕДИЦИНСКОГО ИЗДЕЛИЯ.
9
П р и м е ч а н и е 3—При рассмотрении параметров УПРАВЛЕНИЯ РИСКАМИ по ИСО 14971. подраздел 6.2. требуется, чтобы ИЗГОТОВИТЕЛЬ использовал одно или несколько действий, указанных ниже в порядке уменьшения приоритетности:
a) внутреннюю БЕЗОПАСНОСТЬ, обеспечиваемую конструкцией.
b) средства защиты, присутствующие в самом МЕДИЦИНСКОМ ИЗДЕЛИИ, или защитные меры, предусмотренные в ПРОЦЕССЕ его изготовления, например АВАРИЙНУЮ СИГНАЛИЗАЦИЮ;
c) информацию по БЕЗОПАСНОСТИ, например предупреждения в инструкции по эксплуатации, отображение контролируемых переменных, обучение и обучающие материалы, обслуживание элементов.
Соответствие требованиям данного подраздела следует рассмотреть при выполнении требований 5.8 и 5.9.
5.8* ВЕРИФИКАЦИЯ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ
ИЗГОТОВИТЕЛЬ должен ВЕРИФИЦИРОВАТЬ внедрение ПОЛЬЗОВАТЕЛЬСКОГО ИНТЕРФЕЙСА МЕДИЦИНСКОГО ИЗДЕЛИЯ как часть ПРОЦЕССА ВЕРИФИКАЦИИ проекта МЕДИЦИНСКОГО ИЗДЕЛИЯ в соответствии с требованиями спецификации ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ. Результаты ВЕРИФИКАЦИИ должны быть зарегистрированы в ФАЙЛЕ ПРОЕКТИРОВАНИЯ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ.
Примечание1 — См. также D.5.2. D.5.4. D.5.6. D.5.8 и D.5.15 приложения D на предмет руководства по ВЕРИФИКАЦИИ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ.
Примечание2 — См. 4.3 на предмет изменения ОБЪЕМА ПРОЕКТИРОВАНИЯ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ.
Соответствие требованиям проверяют путем экспертизы ФАЙЛА ПРОЕКТИРОВАНИЯ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ.
5.9* ВАЛИДАЦИЯ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ
ИЗГОТОВИТЕЛЬ должен ВАЛИДИРОВАТЬ ЭКСПЛУАТАЦИОННУЮ ПРИГОДНОСТЬ МЕДИЦИНСКОГО ИЗДЕЛИЯ в соответствии с планом ВАЛИДАЦИИ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ. Результаты должны быть зарегистрированы в ФАЙЛЕ ПРОЕКТИРОВАНИЯ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ.
Примечание 1 — См. также D.5.13 и D.5.15 приложения D на предмет руководства по проведению ВАЛИДАЦИИ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ.
Примечание 2 — ИСО 14971, подраздел 6.6, требует, чтобы были рассмотрены изменения проекта, связанные с ПРОЦЕССОМ ПРОЕКТИРОВАНИЯ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ, на предмет возникновения других ОПАСНОСТЕЙ и ОПАСНЫХ СИТУАЦИЙ.
Примечание 3 — Эксплуатационный документ является частью ПОЛЬЗОВАТЕЛЬСКОГО ИНТЕРФЕЙСА МЕДИЦИНСКОГО ИЗДЕЛИЯ, и на него направлены действия по ВАЛИДАЦИИ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ.
Примечание 4 — К ВАЛИДАЦИИ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ должны быть привлечены лица, которые не были непосредственно ответственны за проектирование ПОЛЬЗОВАТЕЛЬСКОГО ИНТЕРФЕЙСА.
Если не выполняются критерии допустимости, документированные в плане ВАЛИДАЦИИ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ:
-должны быть проведены дальнейшие действия по разработке и внедрению ПОЛЬЗОВАТЕЛЬСКОГО ИНТЕРФЕЙСА (см. 5.6); или
- если дальнейшее улучшение не представляется практически осуществимым. ИЗГОТОВИТЕЛЬ может собрать и проанализировать данные и литературу, чтобы установить, превышает ли ожидаемая медицинская польза при ПРЕДУСМОТРЕННОМ ПРИМЕНЕНИИ РИСКИ, вытекающие из проблем с ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТЬЮ. Если собранные доказательства не свидетельствуют о том. что медицинская польза превышает РИСК, то РИСК является недопустимым.
Примечание 5— Для выполнения данного этапа изготовитель должен оценить РИСК от проблем с ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТЬЮ.
10
Примечание 6 — Результаты ПРОЦЕССА ПРОЕКТИРОВАНИЯ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ следует использовать при оценке ОСТАТОЧНОГО РИСКА (см. ИСО 14971. подраздел 6.4).
Соответствие требованиям проверяют путем экспертизы ФАЙЛА ПРОЕКТИРОВАНИЯ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ.
6* ЭКСПЛУАТАЦИОННЫЙ ДОКУМЕНТ
При наличии ЭКСПЛУАТАЦИОННОГО ДОКУМЕНТА он должен содержать основную информацию по спецификации применения МЕДИЦИНСКОГО ИЗДЕЛИЯ (см. 5.1).
Примечание 1 — Основная информация по спецификации применения МЕДИЦИНСКОГО ИЗДЕЛИЯ в некоторых нормативных документах называется «заявление о предполагаемом применении*.
При наличии ЭКСПЛУАТАЦИОННОГО ДОКУМЕНТА он должен включать краткое описание МЕДИЦИНСКОГО ИЗДЕЛИЯ, которое содержит, если это применимо:
- принцип работы;
- существенные физические характеристики:
- существенные рабочие характеристики;
- предполагаемый профиль ПОЛЬЗОВАТЕЛЯ.
Примечание 2 — Важной целью данного описания является помощь ПОЛЬЗОВАТЕЛЮ в получении корректного понимания МЕДИЦИНСКОГО ИЗДЕЛИЯ (см. обоснование 5.3.2 и D.5.14.3 приложения D).
При наличии ЭКСПЛУАТАЦИОННОГО ДОКУМЕНТА он должен быть написан на уровне, соответствующем ПРОФИЛЮ ПОЛЬЗОВАТЕЛЯ.
Эксплуатационный документ может быть приведен в электронном виде. Если ЭКСПЛУАТАЦИОННЫЙ ДОКУМЕНТ приведен в электронном виде. ПРОЦЕСС ПРОЕКТИРОВАНИЯ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ должен включать рассмотрение вопроса, какая информация также должна быть выполнена на бумажном носителе или в качестве маркировки на самом МЕДИЦИНСКОМ ИЗДЕЛИИ.
Пример — Информация, относящаяся к работе в аварийных условиях.
Соответствие требованиям проверяют путем экспертизы ФАЙЛА ПРОЕКТИРОВАНИЯ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ.
7* Обучение и обучающие материалы
Если для безопасного и эффективного использования ОСНОВНОЙ РАБОЧЕЙ ФУНКЦИИ предполагаемым ПОЛЬЗОВАТЕЛЕМ требуется обучение на данном МЕДИЦИНСКОМ ИЗДЕЛИИ. ИЗГОТОВИТЕЛЬ должен сделать, по крайней мере, одно из следующего:
- предоставить материалы, необходимые для обучения;
- убедиться, что материалы, необходимые для обучения, доступны или
- обеспечить обучение.
Если требуется такое обучение, в ЭКСПЛУАТАЦИОННОМ ДОКУМЕНТЕ должны быть описаны параметры обучения и включены предполагаемая продолжительность и частота подобного обучения.
Если требуется такое обучение, обучение и обучающие материалы должны быть основаны на предполагаемом использовании и ПРОФИЛЕ(ПРОФИЛЯХ) ПОЛЬЗОВАТЕЛЕЙ.
Примечание 1 — Обучение на конкретном МЕДИЦИНСКОМ ИЗДЕЛИИ может использоваться для обеспечения знаний и навыков, необходимых для безопасного и эффективного использования МЕДИЦИНСКОГО ИЗДЕЛИЯ, выходящих за пределы знаний и навыков, определенных для предполагаемого ПРОФИЛЯ (ПРОФИЛЕЙ) ПОЛЬЗОВАТЕЛЕЙ.
Примечание 2 — См. МЭК 61258 (3).
Соответствие требованиям проверяют путем экспертизы ЭКСПЛУАТАЦИОННОЙ ДОКУМЕНТАЦИИ и ФАЙЛА ПРОЕКТИРОВАНИЯ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ.
11
Приложение А (справочное)
Общее руководство и обоснование
А.1 Введение
В настоящем приложении приведено обоснование требований настоящего стандарта. Его целью является обеспечение эффективного применения настоящего стандарта за счет объяснения причин требований и определений и обеспечение дополнительных руководящих указаний, если необходимо.
А.2 Обоснование требований отдельных разделов и подразделов
Раздел 1 — Область применения
Настоящий стандарт относится главным образом к ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ ПОЛЬЗОВАТЕЛЬСКОГО ИНТЕРФЕЙСА МЕДИЦИНСКОГО ИЗДЕЛИЯ. ЭКСПЛУАТАЦИОННАЯ ПРИГОДНОСТЬ обычно включает такие параметры, как удовлетворенность ПОЛЬЗОВАТЕЛЯ и ЭФФЕКТИВНОСТЬ, которые напрямую не связаны с ПОЛЬЗОВАТЕЛЬСКИМ ИНТЕРФЕЙСОМ МЕДИЦИНСКОГО ИЗДЕЛИЯ и его БЕЗОПАСНОСТЬЮ и не рассматриваются в настоящем стандарте. Примеры не рассматриваемых свойств изделия могут включать эстетичность изделия или значение потребляемой энергии.
В настоящем стандарте используется понятие ОШИБКИ ЭКСПЛУАТАЦИИ/ПРИМЕНЕНИЯ. Термин был выбран из более общеупотребительных терминов «ошибка пользователя» или «человеческая ошибка», т. к. не все ошибки, связанные с использованием МЕДИЦИНСКОГО ИЗДЕЛИЯ, являются результатом недосмотра или невнимательности со стороны ПОЛЬЗОВАТЕЛЯ МЕДИЦИНСКОГО ИЗДЕЛИЯ. Намного чаще ошибка применения является прямым следствием недостаточной разработки ПОЛЬЗОВАТЕЛЬСКОГО ИНТЕРФЕЙСА.
Некоторые проекты ПОЛЬЗОВАТЕЛЬСКОГО ИНТЕРФЕЙСА приводят к ОШИБКАМ ЭКСПЛУАТАЦИИ/ ПРИМЕНЕНИЯ из-за того, что они используют неинтуитивное или нелогичное отображение или управление. Последствия таких недостатков проекта часто проявляются только в аварийных или стрессовых ситуациях, в состоянии усталости или при редком использовании.
Область применения настоящего стандарта распространяется на использование МЕДИЦИНСКОГО ИЗДЕЛИЯ только в соответствии с инструкцией по эксплуатации, т. е. на нормальное применение. ПОЛЬЗОВАТЕЛЬ может совершать ОШИБКИ ЭКСПЛУАТАЦИИ/ПРИМЕНЕНИЯ (т. е. промахи, упущения и заблуждения) при попытке применения МЕДИЦИНСКОГО ИЗДЕЛИЯ в соответствии с инструкцией по эксплуатации. Так как ОШИБКИ ЭКСПЛУАТАЦИИ/ПРИМЕНЕНИЯ могут возникнуть при нормальном применении, в настоящем стандарте введены новое понятие и термин КОРРЕКТНАЯ ЭКСПЛУАТАЦИЯ/ПРИМЕНЕНИЕ для описания ситуации. когда ПОЛЬЗОВАТЕЛЬ следует инструкции по эксплуатации, не совершая ОШИБОК ЭКСПЛУАТАЦИИ/ПРИМЕНЕНИЯ.
МЕДИЦИНСКОЕ ИЗДЕЛИЕ может применяться таким образом, который не соответствует описанному в инструкции по эксплуатации. В рамках настоящего стандарта такое применение описывается как НЕНОРМАЛЬНАЯ ЭКСПЛУАТАЦИЯ/ПРИМЕНЕНИЕ. Хотя ПРОЦЕССЫ ПРОЕКТИРОВАНИЯ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ могут быть использованы для определения НЕНОРМАЛЬНОЙ ЭКСПЛУАТАЦИИ/ПРИМЕНЕНИЯ. в настоящем стандарте не требуется, чтобы ПРОЦЕССЫ ПРОЕКТИРОВАНИЯ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ применялись для оценки или снижения РИСКОВ, связанных с НЕНОРМАЛЬНОЙ ЭКСПЛУАТАЦИЕЙ/ПРИМЕНЕНИЕМ.
Область применения настоящего стандарта не включает принятие клинических решений, касающихся применения МЕДИЦИНСКОГО ИЗДЕЛИЯ. Решение о применении МЕДИЦИНСКОГО ИЗДЕЛИЯ в рамках конкретной клинической процедуры требует, чтобы ОПАСНЫЕ СИТУАЦИИ были уравновешены предполагаемой пользой от выполнения процедуры. Такие решения должны учитывать предполагаемое применение, рабочие характеристики и РИСКИ, связанные с МЕДИЦИНСКИМ ИЗДЕЛИЕМ, а также РИСКИ и пользу, связанные с клинической процедурой или деталями применения. Некоторые из этих решений могут быть приняты только квалифицированным медицинским персоналом, обладающим знаниями о состоянии здоровья конкретного ПАЦИЕНТА или собственном мнении ПАЦИЕНТА.
Определение 3.12 — НОРМАЛЬНАЯ ЭКСПЛУАТАЦИЯ/ПРИМЕНЕНИЕ
НОРМАЛЬНАЯ ЭКСПЛУАТАЦИЯ/ПРИМЕНЕНИЕ отличается от КОРРЕКТНОЙ ЭКСПЛУАТАЦИИ/ПРИМЕНЕНИЯ. т. к. ошибки ЭКСПЛУАТАЦИИ/ПРИМЕНЕНИЯ (т. е. промахи, упущения и заблуждения) могут возникать при попытке использования МЕДИЦИНСКОГО ИЗДЕЛИЯ в соответствии с его инструкцией по эксплуатации.
Содержание
1* Область применения...................................... 1
2 Нормативные ссылки....................................... 1
3 Термины и определения..................................... 1
4' Основные положения...................................... 4
5* ПРОЦЕСС ПРОЕКТИРОВАНИЯ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ...... 6
6'ЭКСПЛУАТАЦИОННЫЙ ДОКУМЕНТ............................... 11
V Обучение и обучающие материалы............................... 11
Приложение А (справочное) Общее руководство и обоснование................. 12
Приложение В (справочное) Категории действий ПОЛЬЗОВАТЕЛЯ................. 22
Приложение С (справочное) Примеры ОШИБОК ЭКСПЛУАТАЦИИ/ПРИМЕНЕНИЯ. НЕНОРМАЛЬНОЙ ЭКСПЛУАТАЦИИ/ПРИМЕНЕНИЯ и возможных причин............ 24
Приложение D (справочное) Руководство по ПРОЦЕССАМ ПРОЕКТИРОВАНИЯ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ........................ 27
Приложение Е (справочное) Вопросы, которые можно использовать для определения характеристик МЕДИЦИНСКОГО ИЗДЕЛИЯ, связанных с ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТЬЮ, и которые могут оказать влияние на БЕЗОПАСНОСТЬ.......... 48
Приложение F (справочное) Примеры возможных ОПАСНЫХ СИТУАЦИЙ, связанных с ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТЬЮ .......................... 51
Приложение G (справочное) Цели ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ. Наглядный пример для
домашнего парентерального инфузионного насоса................ 54
Приложение Н (справочное) Образец спецификации ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ и ее
входных данных.................................. 67
Приложение I (справочное) Рекомендуемый список литературы.................. 74
Приложение J (справочное) Ссылки на основные принципы.................... 79
Приложение ДА (справочное) Сведения о соответствии ссылочных международных стандартов
национальным стандартам Российской Федерации................ 80
Библиография........................................... 81
Алфавитный указатель терминов.................................. 84
III
Введение
Настоящий стандарт является прямым применением международного стандарта МЭК 62366:2007 «Изделия медицинские. Проектирование медицинских изделий с учетом эксплуатационной пригодности», подготовленного рабочей группой подкомитета 62А «Общие параметры электрического медицинского оборудования, используемого в медицинской практике» Технического комитета 62 «Электрическое медицинское оборудование в медицинской практике» и Техническим комитетом ИСО 210 «Управление качеством медицинских изделий».
В медицинской практике все чаще используются МЕДИЦИНСКИЕ ИЗДЕЛИЯ для наблюдения и лечения ПАЦИЕНТОВ. Все больший повод для беспокойства вызывают ОШИБКИ ЭКСПЛУАТАЦИИ/ПРИМЕНЕ-НИЯ, вызванные недостаточной ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТЬЮ МЕДИЦИНСКОГО ИЗДЕЛИЯ. Многие МЕДИЦИНСКИЕ ИЗДЕЛИЯ, разработанные без использования ПРОЦЕССОВ ПРОЕКТИРОВАНИЯ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ, являются не интуитивными, сложными для изучения и использования. Область здравоохранения развивается, в настоящее время все менее компетентные ПОЛЬЗОВАТЕЛИ, включая самих ПАЦИЕНТОВ, используют МЕДИЦИНСКИЕ ИЗДЕЛИЯ, а сами МЕДИЦИНСКИЕ ИЗДЕЛИЯ становятся все более сложными. В простых случаях ПОЛЬЗОВАТЕЛИ МЕДИЦИНСКИХ ИЗДЕЛИЙ могут справиться с неоднозначным, сложным для использования ПОЛЬЗОВАТЕЛЬСКИМ ИНТЕРФЕЙСОМ. Разработка пригодных МЕДИЦИНСКИХ ИЗДЕЛИЙ требует приложения значительных усилий, кроме того, многие организации занимаются ею на основании «здравого смысла». Разработка ПОЛЬЗОВАТЕЛЬСКОГО ИНТЕРФЕЙСА для достижения достаточного (безопасного) уровня ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ требует более высокого уровня квалификации, чем техническая реализация данного интерфейса.
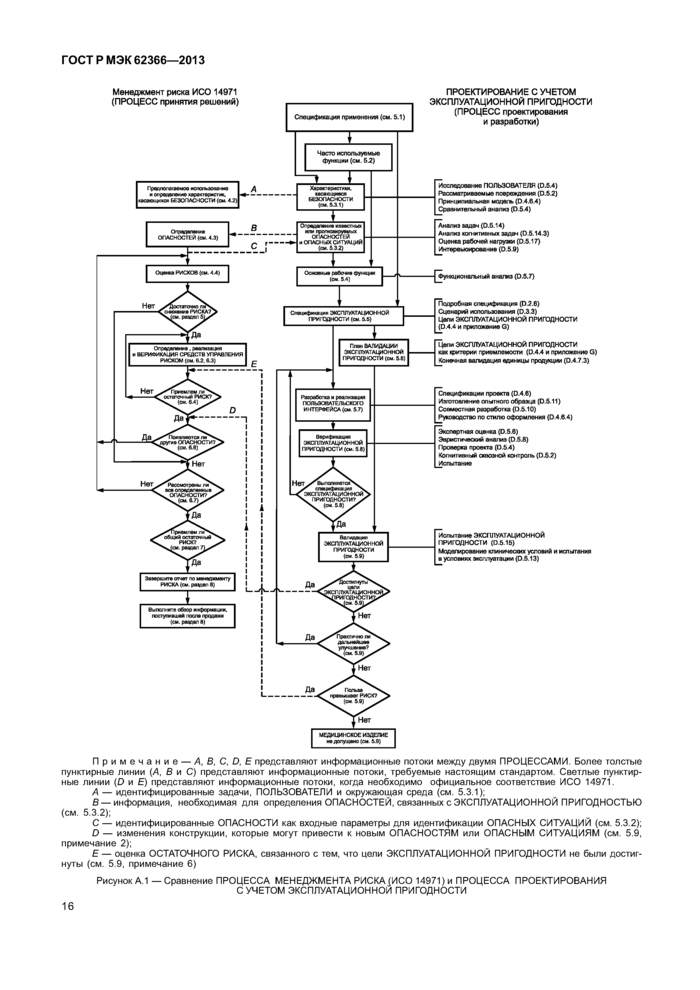
ПРОЦЕССЫ ПРОЕКТИРОВАНИЯ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ предназначены для достижения разумного уровня ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ, который в свою очередь предназначен для минимизации пользовательских ошибок и минимизации РИСКОВ, связанных с использованием. Некоторые, но не все, виды некорректного использования, поддаются контролю со стороны ИЗГОТОВИТЕЛЯ. Процедуры ПРОЕКТИРОВАНИЯ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ связаны с процедурами МЕНЕДЖМЕНТА РИСКА, как указано на рисунке А.1 приложения А.
Настоящий стандарт описывает процедуры ПРОЕКТИРОВАНИЯ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ и представляет собой руководство по применению и реализации процедур для обеспечения БЕЗОПАСНОСТИ МЕДИЦИНСКИХ ИЗДЕЛИЙ. Предполагается, что он будет полезен не только для ИЗГОТОВИТЕЛЕЙ МЕДИЦИНСКИХ ИЗДЕЛИЙ, но и для технических комитетов, ответственных за подготовку специальных стандартов на МЕДИЦИНСКИЕ ИЗДЕЛИЯ.
Пункты и подпункты, которые рассмотрены в приложении А. отмечены (*).
IV
НАЦИОНАЛЬНЫЙ СТАНДАРТ РОССИЙСКОЙ ФЕДЕРАЦИИ
ИЗДЕЛИЯ МЕДИЦИНСКИЕ Проектирование медицинских изделий с учетом эксплуатационной пригодности
Medical devices. Application of usability engineering to medical devices
Дата введения — 2015—01—01
V Область применения
Настоящий стандарт устанавливает ПРОЦЕСС, выполняемый ИЗГОТОВИТЕЛЕМ для анализа, определения. разработки. ВЕРИФИКАЦИИ и ВАЛИДАЦИИ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ в части, имеющей отношение к БЕЗОПАСНОСТИ МЕДИЦИНСКИХ ИЗДЕЛИЙ. ПРОЦЕСС ПРОЕКТИРОВАНИЯ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ направлен на оценку и снижение рисков, вызванных проблемами с ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТЬЮ и связанных с КОРРЕКТНОЙ ЭКСПЛУАТАЦИЕЙ/ПРИ-МЕНЕНИЕМ и ОШИБКАМИ ЭКСПЛУАТАЦИЙ/ПРИМЕНЕНИЯ, т. е. с НОРМАЛЬНОЙ ЭКСПЛУАТАЦИЕЙ/ ПРИМЕНЕНИЕМ. Настоящий стандарт может применяться для определения, но не оценки и снижения РИСКОВ, связанных с НЕНОРМАЛЬНОЙ ЭКСПЛУАТАЦИЕЙ/ПРИМЕНЕНИЕМ.
Примечание — В рамках настоящего стандарта ЭКСПЛУАТАЦИОННАЯ ПРИГОДНОСТЬ (см. 3.17) ограничена характеристиками ПОЛЬЗОВАТЕЛЬСКОГО ИНТЕРФЕЙСА.
Если выполняется ПРОЦЕСС ПРОЕКТИРОВАНИЯ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ. подробно описанный в настоящем стандарте, и достигается соответствие критериям приемлемости, зафиксированным в плане по ВАЛИДАЦИИ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ (см. 5.9), то ОСТАТОЧНЫЙ РИСК в соответствии с определением по ИСО 14971. связанный с ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТЬЮ МЕДИЦИНСКИХ ИЗДЕЛИЙ, считается приемлемым, если не будет приведено ОБЪЕКТИВНЫХ СВИДЕТЕЛЬСТВ обратного (см. 4.1.2).
Настоящий стандарт не применяется для принятия клинических решений, касающихся использования МЕДИЦИНСКИХ ИЗДЕЛИЙ.
2 Нормативные ссылки
В настоящем стандарте использована нормативная ссылка на следующий стандарт.
Примечание — Ссылки дли справок приведены в библиографии.
ИСО 14971:2007 Изделия медицинские. Применение менеджмента риска к медицинским изделиям (ISO 14971:2007. Medical devices — Application of risk management to medical devices)
3 Термины и определения
В настоящем стандарте применены термины по ИСО 14971, а также следующие термины с соответствующими определениями.
Примечание — Алфавитный указатель терминов приведен в конце настоящего стандарта.
Издание официальное
3.1 НЕНОРМАЛЬНАЯ ЭКСПЛУАТАЦИЯ/ПРИМЕНЕНИЕ (ABNORMAL USE): Преднамеренное действие или непреднамеренное бездействие ОТВЕТСТВЕННОЙ ОРГАНИЗАЦИИ или ПОЛЬЗОВАТЕЛЯ МЕДИЦИНСКОГО ИЗДЕЛИЯ, приводящее к невозможности принятия дальнейших рациональных мер по УПРАВЛЕНИЮ РИСКОМ, предусмотренных ИЗГОТОВИТЕЛЕМ.
Примечание 1 — См. также 4.1.3 и приложение В. Примеры приведены в приложении С.
Примечание 2— ПАЦИЕНТ также может быть ПОЛЬЗОВАТЕЛЕМ, например, если МЕДИЦИНСКОЕ ИЗДЕЛИЕ используется ПАЦИЕНТОМ дома.
3.2 ЭКСПЛУАТАЦИОННЫЙ ДОКУМЕНТ (ACCOMPANYING DOCUMENT): Документ, прилагаемый к МЕДИЦИНСКОМУ ИЗДЕЛИЮ и содержащий информацию для лиц. ответственных за установку, применение и техническое обслуживание МЕДИЦИНСКОГО ИЗДЕЛИЯ, или ПОЛЬЗОВАТЕЛЯ, особенно в отношении БЕЗОПАСНОСТИ.
[ИС014971:2007. определение 2.1J
3.3 ПРЕДЕЛ СРАБАТЫВАНИЯ СИГНАЛИЗАЦИИ (ALARM LIMIT): Предел, используемый в СИСТЕМЕ СИГНАЛИЗАЦИИ для определения условий СРАБАТЫВАНИЯ СИГНАЛИЗАЦИИ.
(МЭК60601-1-8:2006. определение 3.3)
Примечание — Данный термин используется только в примечаниях и справочных приложениях.
3.4 ОТКЛЮЧЕНИЕ СИГНАЛИЗАЦИИ (ALARM OFF): Состояние с определенной продолжительностью. при котором СИСТЕМА СИГНАЛИЗАЦИИ или часть СИСТЕМЫ СИГНАЛИЗАЦИИ не производят АВАРИЙНОГО СИГНАЛА.
[МЭК 60601-1-8:2006. определение 3.4)
Примечание — Данный термин используется только в примечаниях и справочных приложениях.
3.5 АВАРИЙНЫЙ СИГНАЛ (ALARM SIGNAL): Тил сигнала, производимого СИСТЕМОЙ СИГНАЛИЗАЦИИ для указания на наличие (или возникновение) аварийных условий.
[МЭК 60601-1-8:2006. определение 3.9)
Примечание — Данный термин используется только в примечаниях и справочных приложениях.
3.6 СИСТЕМА СИГНАЛИЗАЦИИ (ALARM SYSTEM): Части МЕДИЦИНСКОГО ИЗДЕЛИЯ, которые определяют аварийные условия и. если применимо, производят АВАРИЙНЫЙ СИГНАЛ.
[МЭК 60601-1-8:2006. определение 3.11)
Примечание — Данный термин используется только в примечаниях и справочных приложениях.
3.7 КОРРЕКТНАЯ ЭКСПЛУАТАЦИЯ/ПРИМЕНЕНИЕ (CORRECT USE): НОРМАЛЬНАЯ ЭКСПЛУАТАЦИЯ БЕЗ ОШИБОК ЭКСПЛУАТАЦИИ/ПРИМЕНЕНИЯ.
3.8 РЕЗУЛЬТАТИВНОСТЬ (EFFECTIVENESS): Степень точности и полноты, с которой ПОЛЬЗОВАТЕЛИ достигают определенных целей.
[ИСО 9241-11:1998. определение 3.2)
Примечание — «ЭФФЕКТИВНОСТЬ» и «клиническая ЭФФЕКТИВНОСТЬ» являются разными понятиями.
3.9 ЭФФЕКТИВНОСТЬ (EFFICIENCY): РЕЗУЛЬТАТИВНОСТЬ с учетом затраченных ресурсов.
3.10 ИНФОРМАЦИОННЫЙ СИГНАЛ (INFORMATION SIGNAL): Любой сигнал, который не является АВАРИЙНЫМ СИГНАЛОМ или напоминающим сигналом.
Пример 1 — Сигнал ЭКГ.
Пример 2 — Уровень Sp02.
Пример 3 — Индикатор включения рентгеновской установки.
[МЭК 60601-1-8:2006. определение 3.23)
Примечание — Данный термин используется только в примечаниях и справочных приложениях.
3.11 МЕДИЦИНСКОЕ ИЗДЕЛИЕ (MEDICAL DEVICE): Любой инструмент, аппарат, прибор, принадлежность, приспособление, имплантат, in vitro реагент или калибратор, программное обеспечение, материал или другие подобные или сопутствующие средства, предназначенные ИЗГОТОВИТЕЛЕМ для применения к человеку по отдельности или в сочетании друг с другом с целью (целями):
- профилактики, диагностики, мониторинга, лечения или облегчения заболеваний:
2
-диагностики, мониторинга, лечения, облегчения или компенсации последствий травмы;
- исследования, замещения, изменения или поддержания анатомического строения или физиологических ПРОЦЕССОВ;
- поддержания жизненно важных функций организма;
- управления зачатием;
-дезинфекции МЕДИЦИНСКИХ ИЗДЕЛИЙ;
- получения информации медицинского назначения посредством исследования in vitro проб, взятых из организма человека,
при условии, что их основное воздействие на организм человека не реализуется за счет фармакологических. иммунологических или метаболических средств, но их функционирование может поддерживаться такими средствами.
[ИС013485:2003. определение 3.7]
3.12* НОРМАЛЬНАЯ ЭКСПЛУАТАЦИЯ/ПРИМЕНЕНИЕ (NORMAL USE): Функционирование, включая текущий осмотр и оценку ПОЛЬЗОВАТЕЛЕМ, и подготовка в соответствии с инструкцией по эксплуатации или в соответствии с общепризнанной практикой для МЕДИЦИНСКИХ ИЗДЕЛИЙ, поставляемых без инструкции по эксплуатации.
(МЭК 60601-1:2005, определение 3.71)
Примечание 1— При НОРМАЛЬНОЙ ЭКСПЛУАТАЦИИ/ПРИМЕНЕНИИ могут возникать ОШИБКИ ЭКС-ПЛУАТАЦИИ/ПРИМЕНЕНИЯ.
Примечание 2 — МЕДИЦИНСКИЕ ИЗДЕЛИЯ, которые могут быть безопасно использованы без инструкции по эксплуатации, освобождены от необходимости иметь инструкцию по эксплуатации некоторыми полномочными органами с приведением обоснования.
3.13 ПАЦИЕНТ (PATIENT): Живое существо (человек), подвергающееся медицинской, хирургической или стоматологической процедуре.
[МЭК 60601-1:2005. определение 3.76)
3.14 ОСНОВНАЯ РАБОЧАЯ ФУНКЦИЯ (PRIMARY OPERATING FUNCTION): Функция, которая предполагает вмешательство пользователя и которая либо часто используется, либо относится к БЕЗОПАСНОСТИ МЕДИЦИНСКОГО ИЗДЕЛИЯ.
3.15 НАПОМИНАЮЩИЙ СИГНАЛ (REMINDER SIGNAL): Периодический сигнал, который напоминает ПОЛЬЗОВАТЕЛЮ, что АВАРИЙНЫЙ СИГНАЛ находится 8 состоянии инактивации.
(МЭК 60601 -1-8:2006, определение 3.34]
Примечание — Данный термин используется только в примечаниях и справочных приложениях.
3.16 ОТВЕТСТВЕННАЯ ОРГАНИЗАЦИЯ (RESPONSIBLE ORGANIZATION): Организация, ответственная за использование и обслуживание МЕДИЦИНСКОГО ИЗДЕЛИЯ или комбинации МЕДИЦИНСКИХ ИЗДЕЛИЙ.
Примечание 1 — ОТВЕТСТВЕННОЙ ОРГАНИЗАЦИЕЙ может быть, например, клиника, конкретный врач или неспециалист. При домашнем использовании ПАЦИЕНТОМ. ПОЛЬЗОВАТЕЛЕМ и ОТВЕТСТВЕННОЙ ОРГАНИЗАЦИЕЙ может быть одно и то же лицо.
Примечание 2 — Обучение и инструктаж включены в понятие «использование».
3.17* ЭКСПЛУАТАЦИОННАЯ ПРИГОДНОСТЬ (USABILITY): Характеристика ПОЛЬЗОВАТЕЛЬСКОГО ИНТЕРФЕЙСА, которая определяет РЕЗУЛЬТАТИВНОСТЬ. ЭФФЕКТИВНОСТЬ, простоту обучения пользователя и степень удовлетворенности ПОЛЬЗОВАТЕЛЯ.
3.18 ПРОЕКТИРОВАНИЕ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ (USABILITY ENGINEERING): Применение знаний о поведении, возможностях, ограничениях человека и других характеристиках. относящихся к конструкции инструментов, изделий, системам, задачам, операциям и окружающей среде, для достижения достаточной ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ.
3.19 ФАЙЛ ПРОЕКТИРОВАНИЯ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ (USABILITY ENGINEERING FILE): Комплект ЗАПИСЕЙ и других документов, созданных в ПРОЦЕССЕ ПРОЕКТИРОВАНИЯ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ.
3.20 СПЕЦИФИКАЦИЯ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ (USABILITY SPECIFICATION): Документация. определяющая требования к ПОЛЬЗОВАТЕЛЬСКОМУ ИНТЕРФЕЙСУ, касающиеся ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ.
3
3.21 ОШИБКА ЭКСПЛУАТАЦИИУПРИМЕНЕНИЯ (USE ERROR): Выполнение или невыполнение действия, приводящее к функционированию МЕДИЦИНСКОГО ИЗДЕЛИЯ, отличающемуся от предусмотренного ИЗГОТОВИТЕЛЕМ или ожидаемого ПОЛЬЗОВАТЕЛЕМ.
Примечание 1 — К ОШИБКАМ ЭКСПЛУАТАЦИИ/ПРИМЕНЕНИЯ относят промахи, упущения и заблуждения.
Примечание 2 — См. также приложения С и D. D.I.3.
Примечание 3 — Неадекватную физиологическую реакцию ПАЦИЕНТА саму по себе не относят к ОШИБКЕ ЭКСПЛУАТАЦИИ/ПРИМЕНЕНИЯ.
3.22 СЦЕНАРИЙ ИСПОЛЬЗОВАНИЯ (USE SCENARIO): Определенная последовательность событий и задач, выполняемых определенным ПОЛЬЗОВАТЕЛЕМ в определенной среде.
3.23* ПОЛЬЗОВАТЕЛЬ ( USER): Лицо, использующее МЕДИЦИНСКОЕ ИЗДЕЛИЕ, например, осуществляющее его эксплуатацию или обслуживание.
Примечание1 — Термин включает, по крайней мере, персонал, осуществляющий чистку, обслуживание и установку.
Примечание2 — ПАЦИЕНТЫ и другие неспециалисты также могут быть ПОЛЬЗОВАТЕЛЯМИ.
3.24* ПОЛЬЗОВАТЕЛЬСКИЙ ИНТЕРФЕЙС (USER INTERFACE): Средства, с помощью которых происходит взаимодействие ПОЛЬЗОВАТЕЛЯ и МЕДИЦИНСКОГО ИЗДЕЛИЯ.
[ANSI/AAMI/HE 74:2001. определение 3.24)
Примечание — ЭКСПЛУАТАЦИОННЫЙ ДОКУМЕНТ считается частью МЕДИЦИНСКОГО ИЗДЕЛИЯ и его ПОЛЬЗОВАТЕЛЬСКОГО ИНТЕРФЕЙСА.
3.25 ПРОФИЛЬ ПОЛЬЗОВАТЕЛЯ (USER PROFILE): Сводка данных об умственных, физических и демографических особенностях предполагаемой популяции ПОЛЬЗОВАТЕЛЕЙ, а также любых специальных характеристиках, которые могут повлиять на проектное решение, таких как профессиональные навыки и должностные требования.
3.26 ВАЛИДАЦИЯ (VALIDATION): Подтверждение посредством представления ОБЪЕКТИВНЫХ СВИДЕТЕЛЬСТВ того, что требования, предназначенные для конкретного использования или применения, выполнены.
Примечание 1 — Термин «ВАЛИДИРОВАН» используют для обозначения соответствующего статуса.
Примечание 2 — Условия применения могут быть реальными или смоделированными.
(ИСО 9000:2008, определение 3.8.5)
4* Основные положения
4.1 Общие требования
4.1.1* ПРОЦЕССЫ ПРОЕКТИРОВАНИЯ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ
ИЗГОТОВИТЕЛЬ должен разработать, задокументировать и поддерживать ПРОЦЕССЫ ПРОЕКТИРОВАНИЯ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ для обеспечения БЕЗОПАСНОСТИ ПАЦИЕНТА, ПОЛЬЗОВАТЕЛЯ и других лиц. связанной с ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТЬЮ. Процессы должны касаться взаимодействия ПОЛЬЗОВАТЕЛЯ с МЕДИЦИНСКИМ ИЗДЕЛИЕМ в соответствии с ЭКСПЛУАТАЦИОННЫМ ДОКУМЕНТОМ, включая, но не ограничиваясь, следующими:
- * транспортирование;
- * хранение;
- установка;
- эксплуатация;
- обслуживание и восстановление и
- утилизация.
Примечание— См. также приложение D. D.3.I.
Соответствие требованиям настоящего раздела достигается, если выполняются критерии соответствующих проверок и испытаний, предусмотренных настоящим стандартом.
4
ГОСТ РМЭК 62366—2013
4.1.2 Остаточный РИСК
Если применяются ПРОЦЕССЫ ПРОЕКТИРОВАНИЯ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ. описанные в настоящем стандарте, и достигается соответствие критериям приемлемости, описанным в плане ВАЛИДАЦИИ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ (см. 5.9). тогда в рамках ИСО 14971 ОСТАТОЧНЫЙ РИСК, связанный с ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТЬЮ МЕДИЦИНСКОГО ИЗДЕЛИЯ, должен считаться приемлемым, если не будет приведено ОБЪЕКТИВНЫХ СВИДЕТЕЛЬСТВ обратного.
Примечание 1 — Подобные ОБЪЕКТИВНЫЕ СВИДЕТЕЛЬСТВА могут быть получены позже на основании послепродажного наблюдения за МЕДИЦИНСКИМ ИЗДЕЛИЕМ.
Примечание 2 — В ИСО 14971, подраздел 6.6. требуется, чтобы были пересмотрены результаты изменения проекта в отношении ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ для определения, не возникают ли новые ОПАСНОСТИ И ОПАСНЫЕ СИТУАЦИИ.
Примечание 3 — В ИСО 14971. раздел 7. требуется, чтобы все ОПАСНЫЕ СИТУАЦИИ были учтены при оценке полного ОСТАТОЧНОГО РИСКА МЕДИЦИНСКОГО ИЗДЕЛИЯ, включая ОПАСНЫЕ СИТУАЦИИ, связанные С ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТЬЮ МЕДИЦИНСКОГО ИЗДЕЛИЯ.
Соответствие требованиям проверяют путем экспертизы ФАЙЛА ПРОЕКТИРОВАНИЯ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ.
4.1.3 Информация, касающаяся БЕЗОПАСНОСТИ
Если как средство УПРАВЛЕНИЯ РИСКАМИ используется информация, касающаяся БЕЗОПАСНОСТИ. ИЗГОТОВИТЕЛЬ должен использовать эту информацию в ПРОЦЕССЕ ПРОЕКТИРОВАНИЯ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ.
Пример 1 — Предупреждении или ограничении использовании, указанные в ЭКСПЛУАТАЦИОННОМ ДОКУМЕНТЕ.
Пример 2 — Маркировки.
Игнорирование данной информации, касающейся БЕЗОПАСНОСТИ, должно быть учтено любыми дальнейшими разумными средствами УПРАВЛЕНИЯ РИСКОМ. См. также приложение В.
Примечание1 — Информация, касающаяся БЕЗОПАСНОСТИ, является одним из элементов в иерархическом подходе к УПРАВЛЕНИЮ РИСКОМ, при котором ИЗГОТОВИТЕЛЬ использует одно или несколько действий. указанных ниже в порядке уменьшения приоритетности (см. ИСО 14971, подраздел 6.2):
a) внутреннюю БЕЗОПАСНОСТЬ, обеспечиваемую конструкцией;
b) средства защиты, имеющиеся в самом МЕДИЦИНСКОМ ИЗДЕЛИИ, или защитные меры, предусмотренные в ПРОЦЕССЕ его изготовления, например АВАРИЙНАЯ СИГНАЛИЗАЦИЯ;
c) информацию по БЕЗОПАСНОСТИ, например предупреждения в инструкции по эксплуатации, отображение контролируемых переменных, обучение и обучающие материалы, обслуживание элементов.
Примечание2 — Информация, касающаяся БЕЗОПАСНОСТИ, которую необходимо учитывать, может являться входом в ПРОЦЕСС ПРОЕКТИРОВАНИЯ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ (например, приведенная в некоторых других стандартах) или обнаруживаться во время ПРОЦЕССА ПРОЕКТИРОВАНИЯ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ.
Соответствие требованиям проверяют путем экспертизы ЭКСПЛУАТАЦИОННОГО ДОКУМЕНТА и ФАЙЛА ПРОЕКТИРОВАНИЯ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ.
4.2* ФАЙЛ ПРОЕКТИРОВАНИЯ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ
Результаты выполнения ПРОЦЕССА ПРОЕКТИРОВАНИЯ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ должны быть зарегистрированы в ФАЙЛЕ ПРОЕКТИРОВАНИЯ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ. Записи и другие документы, формирующие ФАЙЛ ПРОЕКТИРОВАНИЯ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ, могут являться частью других документов и ФАЙЛОВ.
Пример 1 — ФАЙЛ ИЗГОТОВИТЕЛЯ, касающийси конструкции изделии.
Пример 2 — ФАЙЛ МЕНЕДЖМЕНТА РИСКА.
Соответствие требованиям проверяют путем экспертизы ФАЙЛА ПРОЕКТИРОВАНИЯ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ.
5
4.3 Изменение объема ПРОЕКТИРОВАНИЯ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ
ПРОЦЕССЫ ПРОЕКТИРОВАНИЯ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ могут отличаться по виду и объему работ, основываясь на природе МЕДИЦИНСКОГО ИЗДЕЛИЯ, его предполагаемого ПОЛЬЗОВАТЕЛЯ и его предполагаемого использования (см. приложение D, D.3.2). В случае изменения конструкции МЕДИЦИНСКОГО ИЗДЕЛИЯ. ПРОЦЕССЫ ПРОЕКТИРОВАНИЯ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ могут быть расширены или уменьшены, основываясь на существенности изменений, определенной на основании результатов анализа РИСКОВ (см. приложение D. D.3.2.2).
Примечание 1 — ИЗГОТОВИТЕЛЬ может придерживаться итеративных методов разработки и развития. ПРОЕКТИРОВАНИЕ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ, включая ВАЛИДАЦИЮ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ, должно быть начато как можно раньше и продолжаться в течение всего жизненного цикла разработки и развития МЕДИЦИНСКОГО ИЗДЕЛИЯ.
Примечание 2 — В связи с итеративным характером процедур ПРОЕКТИРОВАНИЯ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ действия, описанные в разделе 5, могут проводиться в /тюбом удобном порядке (см. приложение D. D.2).
Соответствие требованиям проверяют путем экспертизы ФАЙЛА ПРОЕКТИРОВАНИЯ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ.
5* ПРОЦЕСС ПРОЕКТИРОВАНИЯ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ
5.1е Спецификация применения
ИЗГОТОВИТЕЛЬ должен определить применение МЕДИЦИНСКОГО ИЗДЕЛИЯ в ФАЙЛЕ ПРОЕКТИРОВАНИЯ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ.
Эта спецификация должна включать:
- предполагаемые медицинские показания.
Пример 1 — Обнаруживаемое, контролируемое, подвергающееся лечению, диагностике или предотвращению условие (условия) или заболевание (заболевания);
- предполагаемую популяцию ПАЦИЕНТОВ.
Пример 2 — Возраст.
Пример 3 — Вес.
Пример 4 — Состояние здоровья.
Пример 5 — Условия;
- предполагаемую часть тела или тип тканей, с которыми МЕДИЦИНСКОЕ ИЗДЕЛИЕ применяется или взаимодействует;
- предполагаемый профиль ПОЛЬЗОВАТЕЛЯ;
- предполагаемые условия использования.
Пример 6 — Окружающая среда, включая требования к гигиене.
Пример 7 — Частота использования.
Пример 8 — Положение.
Пример 9 — Мобильность;
- * принципы работы.
Примечание — Требования к отображению сводки по спецификации применения МЕДИЦИНСКОГО ИЗДЕЛИЯ в ЭКСПЛУАТАЦИОННОМ ДОКУМЕНТЕ приведены в разделе 6.
Соответствие требованиям проверяют путем экспертизы ФАЙЛА ПРОЕКТИРОВАНИЯ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ.
5.2* Часто используемые функции
ИЗГОТОВИТЕЛЬ должен определить часто используемые функции, которые включают взаимодействие ПОЛЬЗОВАТЕЛЯ с МЕДИЦИНСКИМ ИЗДЕЛИЕМ, и зафиксировать их в ФАЙЛЕ ПРОЕКТИРОВАНИЯ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ.
Соответствие требованиям проверяют путем экспертизы ФАЙЛА ПРОЕКТИРОВАНИЯ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ.
6