ГОСТ Р 58503-2019
Информатизация здоровья. Требования к системам ведения справочника лекарственных средств для здравоохранения
Купить ГОСТ Р 58503-2019 — бумажный документ с голограммой и синими печатями. подробнее
Цена на этот документ пока неизвестна. Нажмите кнопку "Купить" и сделайте заказ, и мы пришлем вам цену.
Распространяем нормативную документацию с 1999 года. Пробиваем чеки, платим налоги, принимаем к оплате все законные формы платежей без дополнительных процентов. Наши клиенты защищены Законом. ООО "ЦНТИ Нормоконтроль"
Наши цены ниже, чем в других местах, потому что мы работаем напрямую с поставщиками документов.
Способы доставки
- Срочная курьерская доставка (1-3 дня)
- Курьерская доставка (7 дней)
- Самовывоз из московского офиса
- Почта РФ
Определяет обязательные характеристики любой системы ведения СЛС, обеспечивающей варианты использования в здравоохранении.
В эти характеристики входят понятия, описывающие лекарственные средства, идентификаторы и отношения, образующие вид структуры, поддерживающей варианты использования.
Для поддержки вариантов использования система ведения СЛС должна удовлетворять следующим требованиям:
- быть максимально объемлющей и исчерпывающей: если она охватывает не все требуемые лекарственные средства, то другие системы не могут полностью опираться на систему ведения СЛС для получения необходимой информации, поэтому некоторый объем избыточности регистрации информации останется неизбежным;
- содержать информацию в виде единообразной и подходящей структуры, соответствующей стандартам ИСО ИДМП (как описано в стандарте) с подходящим уровнем детализации.
В область применения стандарта не входят:
- функционал медицинских, клинических и/или аптечных систем;
- другие виды содержания медицинских, клинических и/или аптечных систем, необходимые для поддержки всей деятельности поставщиков медицинской помощи, например:
- широкий круг знаний о лекарствах, который должен обрабатываться базами знаний о лекарствах и системами поддержки принятия решений,
- листы лекарственных назначений,
- указания по дозировке;
- в терминах препаратов:
- средства традиционной китайской медицины,
- медицинские изделия, например, устройства для применения лекарств [в стандарте особое внимание уделяется только устройствам, предназначенным для правильного введения лекарственных средств (см. ИСО 11615)],
- ветеринарные препараты.
Целью стандарта является предоставление набора функциональных требований к системам, использующим детальные сведения о лекарственных средствах и отношениях между ними с целью поддержки оказания медицинской помощи.
Идентичен ISO/TS 19256:2016
Оглавление
1 Область применения
2 Нормативные ссылки
3 Термины и определения
4 Сокращения
5 Граница между системами ведения СЛС и IDMP, вспомогательная информация для создания системы ведения СЛС и местная реализация
5.1 Граница между системами СЛС и IDMP
5.2 Граница между системами ведения СЛС и вспомогательной информацией для создания системы ведения СЛС
5.3 Граница между системами СЛС и местной реализацией
5.4 Содержание систем СЛС в терминах охвата лекарственных средств
5.5 Определение системы ведения справочника лекарственных средств (СЛС)
5.6 Преимущества стандарта
5.7 Целевые пользователи стандарта
6 Позиционирование систем ведения справочников лекарственных средств в здравоохранении
6.1 Исходные материалы для систем ведения СЛС
6.2 Варианты использования для требований к системе ведения СЛС
7 Функциональные требования к системам ведения СЛС
7.1 Введение
7.2 Цель системы ведения СЛС
7.3 Нормативные требования
7.4 Управление
7.5 Сопровождение
7.6 Локализация
Приложение А (справочное) Применение серии стандартов IDMP в контексте настоящего стандарта
Библиография
| Дата введения | 01.05.2020 |
|---|---|
| Добавлен в базу | 01.02.2020 |
| Актуализация | 01.01.2021 |
Этот ГОСТ находится в:
- Раздел Экология
Организации:
| 29.08.2019 | Утвержден | Федеральное агентство по техническому регулированию и метрологии | 573-ст |
|---|---|---|---|
| Разработан | ФГУП СТАНДАРТИНФОРМ | ||
| Издан | Стандартинформ | 2019 г. |
Health informatics. Requirements for management systems of medicines reference for health care
Чтобы бесплатно скачать этот документ в формате PDF, поддержите наш сайт и нажмите кнопку:

стр. 1

стр. 2

стр. 3

стр. 4

стр. 5

стр. 6

стр. 7

стр. 8

стр. 9

стр. 10

стр. 11

стр. 12

стр. 13

стр. 14

стр. 15

стр. 16

стр. 17
стр. 18

стр. 19

стр. 20

стр. 21

стр. 22

стр. 23

стр. 24

стр. 25

стр. 26

стр. 27

стр. 28

стр. 29

стр. 30
ФЕДЕРАЛЬНОЕ АГЕНТСТВО ПО ТЕХНИЧЕСКОМУ РЕГУЛИРОВАНИЮ И МЕТРОЛОГИИ
НАЦИОНАЛЬНЫЙ
СТАНДАРТ
РОССИЙСКОЙ
ФЕДЕРАЦИИ
ГОСТ Р 58503—2019/ISO/TS 19256:2016
ISO/TS 19256:2016
ИНФОРМАТИЗАЦИЯ ЗДОРОВЬЯТребования к системам ведения справочника лекарственных средств для здравоохранения
(ISO/TS 19256:2016, ЮТ)
Издание официальное
Москва
Стандартинформ
2019
Предисловие
1 ПОДГОТОВЛЕН Федеральным государственным унитарным предприятием «Российский научно-технический центр информации по стандартизации, метрологии и оценке соответствия» (ФГУП «СТАНДАРТИНФОРМ») на основе собственного перевода на русский язык англоязычной версии документа. указанного в пункте 4
2 ВНЕСЕН Техническим комитетом по стандартизации ТК 468 «Информатизация здоровья»
3 УТВЕРЖДЕН И ВВЕДЕН В ДЕЙСТВИЕ Приказом Федерального агентства по техническому регулированию и метрологии от 29 августа 2019 г. № 573-ст
4 Настоящий стандарт идентичен международному документу ISO/TS 19256:2016 «Информатизация здоровья. Требования к системам ведения справочника лекарственных средств для здравоохранения» (ISO/TS 19256:2016 «Health informatics — Requirements for medicinal product dictionary systems for health care», IDT)
5 ВВЕДЕН ВПЕРВЫЕ
Правипа применения настоящего стандарта установлены в статье 26 Федерального закона от 29 июня 2015 г. № 162-ФЗ «О стандартизации в Российской Федерации». Информация об изменениях к настоящему стандарту публикуется в ежегодном (по состоянию на 1 января текущего года) информационном указателе «Национальные стандарты», а официальный текст изменений и поправок — в ежемесячном информационном указателе «Национальные стандарты». В случае пересмотра (замены) или отмены настоящего стандарта соответствующее уведомление будет опубликовано в ближайшем выпуске ежемесячного информационного указателя «Национальные стандарты». Соответствующая информация, уведомление и тексты размещаются также в информационной системе общего пользования — на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет (www.gost.ru)
© ISO, 2016 — Все права сохраняются ©Стандартинформ, оформление. 2019
Настоящий стандарт не может быть полностью или частично воспроизведен, тиражирован и распространен в качестве официального издания без разрешения Федерального агентства по техническому регулированию и метрологии
и
идентификатор исследуемого лекарственного средства (Investigational Medicinal Product Identifier): Уникальный идентификатор, присвоенный исследуемому лекарственному средству в дополнение к любому имеющемуся идентификатору, назначенному уполномоченным органом по регистрации лекарственных средств в юрисдикции или спонсором клинического исследования.
Примечание 1 — Этот идентификатор предназначен для целей учета и для повышения безопасности пациента, поскольку с его помощью можно однозначно идентифицировать лекарственное средство по всему миру
(ИСО 11615:2012. пункт 3.1.31)
3.19 база знаний (knowledge database): Система, в которой знания по конкретной тематике сформулированы в виде набора декларативных утверждений. иерархической организации таких утверждений и отношений между декларативными утверждениями и которая служит основой для систем поддержки принятия решений.
3.20 _
владелец регистрационного удостоверения (marketing authorization holder): Организация, получившая регистрационное удостоверение лекарственного средства в какой-либо юрисдикции.
[ИСО 11615:2012, пункт 3.1.41)
3.21_
номер регистрационного удостоверения (marketing authorization number): Идентификатор, присвоенный лекарственному средству уполномоченным органом по регистрации лекарственных средств.
[ИСО 11615:2012, пункт 3.1.42)
3.22 лекарственные понятия (medication concepts): Формальные определения, описывающие лекарственные средства сточки зрения их характеристик и отношений с другими понятиями.
3.23 _
история лекарственных назначений (medication history): Регистрация характеристик назна-ченного/отпущенного/выдаваемого без рецепта лекарственного средства (идентификация, торговое название, тип, форма, количество, дозировка и пр ); такая история содержит сведения о лекарственных средствах, которые все еще принимаются, а также о лекарственных средствах, применение которых уже прекращено.
[IHE Pharmacy — Technical Framework Specification, с изменениями)
3.24_
лекарственное средство (medicinal product): Вещество или сочетание веществ, которые могут быть применены к людям (или животным) для лечения или профилактики заболеваний, с целью проведения медицинской диагностики или для восстановления, коррекции или изменения физиологических функций.
Примечание 1 — Лекарственное средство может содержать в себе один или более произведенных продуктов или один или более лекарственных препаратов
Примечание 2 — В определенных юрисдикциях лекарственное средство может также определяться как любое вещество или сочетание веществ, которые могут использоваться для постановки медицинского диагноза
Примечание 3 — Лекарственное средство MPID ХХХХ87456 Slaapdiep tablet/Slaapdiep20 mg tablets National имеет название, предназначенное для конкретной юрисдикции (номер кода приведен лишь в виде примера и не является реальным идентификатором)
[ИСО 11615:2012, пункт 3.1.49, с изменениями)
3.25 система ведения справочника лекарственных средств (Medicinal Product Dictionary System): Система, специально предназначенная для поддержки процессов назначения, отпуска и применения лекарств в системе здравоохранения, обеспечивая точное перечисление, описание и идентификацию лекарственных средств.
3.26 _
идентификатор лекарственного средства (Medicinal Product Identifier): Уникальный идентификатор. присвоенный лекарственному средству в дополнение к любому имеющемуся номеру регистрации. назначенному уполномоченным органом.
Примечание 1 — Этот идентификатор предназначен для целей учета и для повышения безопасности пациента, поскольку с его помощью можно однозначно идентифицировать лекарственное средство по всему миру
(ИСО 11615:2012, пункт 3.1.501
3.27_
идентификатор упаковки лекарственного средства (Medicinal Product Package Identifier): Уникальный идентификатор, присвоенный упакованному лекарственному средству в дополнение к любому имеющемуся номеру регистрации, назначенному уполномоченным органом по регулированию лекарственных средств в юрисдикции.
Примечание 1 — Этот идентификатор предназначен для целей учета и для повышения безопасности пациента, поскольку с его помощью можно однозначно идентифицировать лекарственное средство во всем мире
(ИСО 11615:2012. пункт 3.1.52]
328_
упакованное лекарственное средство (packaged medicinal product): Лекарственное средство в контейнере, являющемся частью упаковки и предназначенном для предоставления или продажи лекарственного средства.
(ИСО 11615:2012. пункт 3.1.57]
3.29 использование вне зарегистрированных показаний (off-label use): Применение лекарственного препарата по незарегистрированным показаниям, для незарегистрированной возрастной группы или в незарегистрированной дозировке либо с использованием незарегистрированного пути введения.
3.30 _
лекарственный препарат (pharmaceutical product): Качественная и количественная композиция лекарственного средства в дозированной форме, разрешенной к применению уполномоченным органом и указанной в соответствующих документах регистрационного досье.
Примечание 1 — Лекарственное средство может содержать один или несколько лекарственных препаратов
Примечание 2 — Во многих случаях лекарственный препарат идентичен произведенному продукту Однако есть примеры, когда произведенный продукт претерпевает преобразование до применения к пациенту (в качестве лекарственного препарата), и тогда он не тождественен лекарственному препарату
Примечание 3 — Например, лекарственный препарат PhPID L4M456897456123 Sweetopam 20mg tablet (номер кода приведен лишь в виде примера и не является реальным идентификатором)
(ИСО 11616:2012, пункт 3.1.19. с изменениями]
3.31 _
идентификатор лекарственного препарата (pharmaceutical product identifier): Глобальный уникальный идентификатор лекарственного препарата (препаратов).
(ИСО 11616:2012. пункт 3.1.22]
фармаконадзор (pharmacovigilance): Процесс и наука проведения мониторинга безопасности лекарств и принятия мер по снижению рисков и повышению эффективности применения лекарств. [ИСО 11615:2012, пункт 3.1.59, с изменениями]
3.33 назначение (prescribing): Процесс создания рецепта.
3.34 рецепт (prescription): Созданное уполномоченным медицинским работником указание отпускающему агенту о приготовлении и применении лекарственного средства или устройства применения, подлежащего приему или использованию субъектом медицинской помощи.
Примечание 1 — Рекомендуется избегать использования одиночного термина «рецепт», так как в разговорной речи он используется произвольно для обозначения одного из следующих терминов новое сообщение о назначении, комплекс назначений и отдельное назначение Кроме того, он используется для обозначения бланка рецепта Рекомендуется в необходимых случаях применять термины: комплекс назначений, назначение и новое сообщение о назначении
3.35 лекарственное средство, отпускаемое по рецепту (prescription product): Абстрактный уровень описания лекарственного средства, содержащий элементы прописи лекарства на общем уровне, необходимые для отпуска подходящего лекарства.
Пример — Аэрозоль Salbutamol, дозировка 100 мне 200 доз volumatic. Добавление «volumatic» отсутствует в лекарственном препарате, но оно необходимо в описании назначенного препарата, чтобы показать, что имеется в виду препарат с использованием спей сера «volumatic» (а не, к примеру, ингалятора «autohalor»).
Примечание 1 — Уровень абстракции, необходимый для общей прописи, может варьироваться в зависимости от условий оказания медицинской помощи
3.36 _
качество (quality): Степень, в которой все свойства и характеристики продукта, процесса или услуги удовлетворяют требованиям, исходящим из цели применения данного продукта, процесса или услуги.
[ИСО 9000:2015. пункт 3.6.2, с изменениями)
3.37_
референтная активность (reference activity): Активность субстанции и/или контролируемой субстанции, используемая в качестве эталона, по отношению к которому определяется активность исследуемого или зарегистрированного лекарственного средства.
Примечание 1 — Если активный ингредиент имеет форму соли или гидрата, то референтная активность может быть выражена в терминах активности базового вещества
[ИСО 11616:2012, пункт 3.1.26]
3.38_
путь введения (route of administration): Путь введения лекарственного препарата в тело или контакта с телом.
Примеры — Пероральный, внутривенный, в полость рта, в конъюнктивальный мешок глаза. [ИСО 11615:2012, пункт 3.1.73]
3.39_
безопасность (safety): Отсутствие недопустимого риска или опасности. [ИСО/МЭК Руководство 51, пункт 3.14, с изменениями]
активность [количественный состав] (strength [quantitative composition]): Содержание субстанции или контролируемой субстанции, выраженное в количественном виде на единицу дозы, на единицу массы или объема в соответствии с лекарственной формой.
Примечание 1 — В описании количественного состава субстанции (субстанций)/контролируемой субстанции для конечных эарегистрированных/исследуемых лекарственных средств, в зависимости от их лекарственных форм, необходимо указать массу или количество единиц биологической активности в расчете на единицу дозы или на единицу массы или объема для каждой субстанции или контролируемой субстанции
Примечание 2 — Субстанции или контролируемая субстанция, существующие в виде соединений или производных веществ, обязательно должны быть описаны количественно с указанием общей массы и, если это необходимо или уместно, массы активного компонента или компонентов молекулы
[ИСО 11616:2012. пункт 3.1.29]
3.41_
субстанция (substance): Любое вещество биологического, минерального или химического происхождения, способное к отдельному существованию и имеющее определенный состав.
Примечание 1 — Субстанции могут быть простыми, смешанными или принадлежать к одной из групп контролируемых субстанций Простые субстанции описываются с помощью минимально достаточного набора элементов данных, разделенных на пять типов химические вещества, белки, нуклеиновые кислоты, полимеры и структурно-разнородные субстанции Субстанция может представлять собой соль, сольват, свободную кислоту. свободное основание или смесь связанных компонентов, которые совместно выделены или синтезированы По возможности должны использоваться терминология и определяющие характеристики из фармакопейных статей Определяющие элементы зависят от типа субстанции
Примечание 2 — Отдельное существование означает способность субстанции существовать отдельно от любой другой субстанции Субстанции могут представлять собой хорошо определенные вещества, имеющие определенную химическую структуру, синтетические вещества (например, смеси изомеров), встречающиеся в природе смеси химических веществ, имеющих определенные молекулярные структуры (например, конъюгаты эстрогенов), вещества, произведенные из растений, животных, микроорганизмов или неорганического вещества. химическая структура которых может быть неизвестной или трудно определяемой Субстанция может представлять собой соль, сольват, свободную кислоту, свободное основание и смесь связанных компонентов, которые совместно выделены или синтезированы
[ИСО 11238:2012. пункт 2.1.58]
3.42 _
термин (term): Обозначение определенного понятия в специальном языке при помощи языковых выражений.
[ИСО 1087-1:2000. пункт 3.4.3. с изменениями]
3.43 _
терминологическая система (terminological system): Упорядоченная совокупность понятий, где каждое понятие обозначается терминами, словами или выражениями [ИСО/МЭК 11179-1:2015, пункт 3.2.25, с изменениями]
3.44_
единица измерения (unit of measurement): Действительная скалярная величина, определенная и принятая по соглашению, с которой можно сравнить любую другую величину того же рода и выразить их отношение в виде числа.
Примечание 1 — В зависимости от характера стандартной шкалы выражение единицы измерения может представлять либо физическую единицу измерения, связанную с системой величин (например, единицы СИ), либо произвольно определенную единицу измерения, которая может относиться к определенному стандартному образцу, методике измерения, мере материала или даже к их комбинациям
[ИСО 11239:2012, пункт 3.1.27]
единица представления (unit of representation): Дискретный исчисляемый объект, служащий для представления активности или количества лекарственного препарата либо произведенного продукта и используемый в тех случаях, когда активность или количество выражаются в терминах экземпляра этого объекта.
Пример 1 — Описание активности: спрей ксодержит 100 мкг в расчете на спрей» (единица представления = спрей).
Пример 2 — Описание количества: пузырек «содержит 100 мл в пузырьке» (единица представления = пузырек).
Примечание 1— Единица представления может иметь то же название, что и другой элемент нормативного словаря, например, базовая лекарственная форма или контейнер, но эти два понятия не эквивалентны и имеют в словаре разные уникальные идентификаторы терминов
[ИСО 11239:2012, пункт 3.1.28, с изменениями]
4 Сокращения
В настоящем стандарте применены следующие сокращения:
ADR — adverse drug reaction (нежелательная реакция. HP);
CDSS — clinical decision support system (система поддержки принятия клинических решений);
CEN — Comite Еигорёепле de Normalisation (Европейский комитет по стандартизации);
EHR — Electronic Health Record (электронная медицинская карта. ЭМК);
EHR-S FM — Electronic Health Record — System Functional Model (функциональная модель системы ведения электронных медицинских карт, ФМ СВ ЭМК);
HL7 — Health Level Seven;
ICSR — individual case safety report (извещение о нежелательной реакции. ИНР);
IDMP — identification of medicinal products (идентификация лекарственных средств);
ISO — International Organization for Standardization (Международная организация no стандартизации);
SPC — summary of product characteristics (общая характеристика лекарственного препарата. ОХЛП).
5 Граница между системами ведения СЛС и ЮМР, вспомогательная информация для создания системы ведения СЛС и местная реализация
5.1 Граница между системами СЛС и IDMP
Стандарты IDMP используются в процессах регистрации лекарственных средств в определенных юрисдикциях и максимально детализируют информацию о лекарственных средствах В системе ведения СЛС не требуется отражать все детали, указанные в стандартах ISO IDMP. В нее не включаются понятия или элементы IDMP. которые не поддерживают варианты использования, входящие в область применения настоящего стандарта. Кроме того, система ведения СЛС может добавлять понятия, характеристики и поля данных, необходимые для местных условий, например исторический идентификатор, необходимый для ведения истории лекарственных назначений пациента или для обеспечения анализа существующих тенденций. Описание взаимосвязи между системой СЛС и IDMP приведено в разделе 6.
5.2 Граница между системами ведения СЛС и вспомогательной информацией
для создания системы ведения СЛС
Кроме того, настоящий стандарт рассматривает систему ведения СЛС в том виде, как она предлагается сопровождающей организацией больницам, аптекам, поставщикам ПО и другим сторонам. Для сопровождения системы ведения СЛС может потребоваться вспомогательная информация, например
9
перечень субстанций, лекарственных форм и путей введения, содержащаяся в базах данных, которые указаны в руководствах по внедрению стандартов ISO IDMP. Эти перечни не входят в непосредственный состав системы ведения СЛС. но могут использоваться, чтобы задействовать данные понятия в системе ведения СЛС.
5.3 Граница между системами СЛС и местной реализацией
Систему ведения СЛС требуется каким-либо образом внедрить в медицинские, клинические и/или аптечные информационные системы, что приводит к местной реализации системы ведения СЛС. В зависимости от поддерживаемого варианта (вариантов) использования такая местная реализация может содержать части системы ведения СЛС. Местная реализация может рассматриваться как реализация функциональных требований к системе ведения СЛС при условии, что подмножество используемых функций точно соответствует функциям самой системы ведения СЛС и тем самым соответствует стандартам ISO IDMP. Местная реализация может использовать систему ведения СЛС следующим образом:
- она может содержать определенное подмножество информации о лекарствах, входящей в систему ведения СЛС;
- она может использовать определенную часть структуры (например, только часть системы, охватывающую лекарственные средства или препараты, но не упакованные лекарственные средства);
- если для определенного варианта использования необходим набор элементов, отличный от того, что определен в системе ведения СЛС, то при местной реализации можно применять дополнительные элементы, позволяющие создавать собственное представление определенного набора элементов. необходимое для конкретного варианта использования.
5.4 Содержание систем СЛС в терминах охвата лекарственных средств
В терминах охвата лекарственных средств система ведения СЛС должна содержать сведения обо всех зарегистрированных лекарственных средствах и может содержать сведения о лекарственных средствах, не подлежащих регистрации (включая экстемпоральные препараты). Реализации систем ведения СЛС должны более точно описывать, сведения о каких лекарственных средствах ими ведутся и насколько исчерпывающим является их список. Что касается зарегистрированных лекарственных средств, то для обеспечения гармонизации и возможного создания общего эталонного источника информации о регистрируемых лекарственных средствах все шире и шире будут использоваться стандарты ISO IDMP. Ведение и сопровожцение эталонного источника могут осуществляться консорциумом заинтересованных сторон, объединяющим, например, уполномоченные органы, производителей био/фармацевтических средств и другие организации, обеспечивающие ведение терминологии IDMP. Далее предполагается, что системе ведения СЛС также доступны все понятия, характеристики, отношения, модели данных, поля данных и содержание данных, описанные в стандартах IDMP. Пока стандарты ISO IDMP реализованы не полностью, в системе ведения СЛС. основанной на реализации IDMP. могут отсутствовать некоторые данные, не охваченные этой реализацией, но их может добавить организация по сопровождению системы ведения СЛС.
В части зарегистрированных лекарственных средств предполагается, что в распоряжении имеются идентификаторы, присвоенные в соответствии со стандартами ISO IDMP. Для лекарственных средств, охваченных стандартами IDMP. система ведения СЛС должна использовать идентификаторы, соответствующие стандартам IDMP. Для понятий, описанных этими стандартами, не рекомендуется создавать новые идентификаторы. Если лекарственные препараты не охвачены стандартами IDMP. но информацию о них требуется включить в систему ведения СЛС. то в качестве модели этой информации следует использовать элементы, описанные в стандартах IDMP Для лекарственных средств, не охваченных стандартами IDMP. могут потребоваться новые идентификаторы (например, идентификатор упаковки), особенно в тех случаях, когда 8 соответствующих стандартах IDMP отсутствуют необходимые идентифицирующие характеристики или понятия.
5.5 Определение системы ведения справочника лекарственных средств (СЛС)
С целью поддержки тех вариантов использования в области здравоохранения, где важную роль играют лекарства, система ведения СЛС обеспечивает единообразное представление понятий, описывающих лекарства (набор идентификаторов) с различными уровнями детализации, и значимых отношений между понятиями.
5.6 Преимущества стандарта
Потенциальное преимущество стандарта к системам ведения СЛС заключается в том, что функциональные требования к таким системам четко выражены и организованы в форме ключевых и вспомогательных разделов, а также в том. что описаны взаимосвязи между системами ведения СЛС и другими медицинскими информационными. Это позволяет определить, в какой мере системы ведения СЛС соответствуют требованиям, а также обеспечить их (непрерывное) развитие, сопровождение и отбор.
5.7 Целевые пользователи стандарта
Целевыми пользователями стандартов к системам ведения СЛС являются:
- разработчики систем.
- сопровождающий персонал.
- медицинские работники, несущие ответственность за применение ИКТ в своей организации, например за выбор, управление приложениями.
- те, кто отвечает за системы информатизации здоровья в своей сфере.
6 Позиционирование систем ведения справочников лекарственных средств в здравоохранении
6.1 Исходные материалы для систем ведения СЛС
Система ведения СЛС обеспечивает выполнение ряда функциональных требований к медицинским и клиническим информационными системам, где она используется. Система ведения СЛС также должна обеспечивать различные требования к информации о самих лекарственных средствах. Общая структура и иерархия функциональных требований к клиническим информационным системам взяты из международного стандарта Health Level 7 Electronic Health Record System Functional Model (EHR-S FM) (Функциональная модель системы ведения электронных медицинских карт, ФМ СВ ЭМК), а также из производных моделей и профилей. Кроме того. ФМ СВ ЭМК стимулирует применение функций, обеспечиваемых системой ведения СЛС. Функциональные требования к системам ведения СЛС организованы аналогичным образом. Для обеспечения идентификации подходящих разделов, заголовков, функций и критериев ФМ СВ ЭМК ключевые функции систем ведения СЛС должны быть идентифицированы и организованы в соответствии с процессами оказания медицинской помощи и клинической практики, а также с клиническими информационными системами. Однако данная работа не является частью настоящих Технических требований, за исключением тех случаев, когда указано информационное взаимодействие.
Система ведения СЛС существует не сама по себе, она является компонентом более крупной медицинской, клинической и/или аптечной информационной системы, относящимся к спецификациям системы поддержки медицинских решений, истории лекарственных назначений, синтаксиса указаний по дозировке. Таким образом, необходимо четко разграничить функции, выполняемые системой ведения СЛС. и функции, выполняемые медицинской/ клинической /аптечной информационной системой, системой поддержки медицинских решений, истории лекарственных назначений, синтаксиса указаний по дозировке.
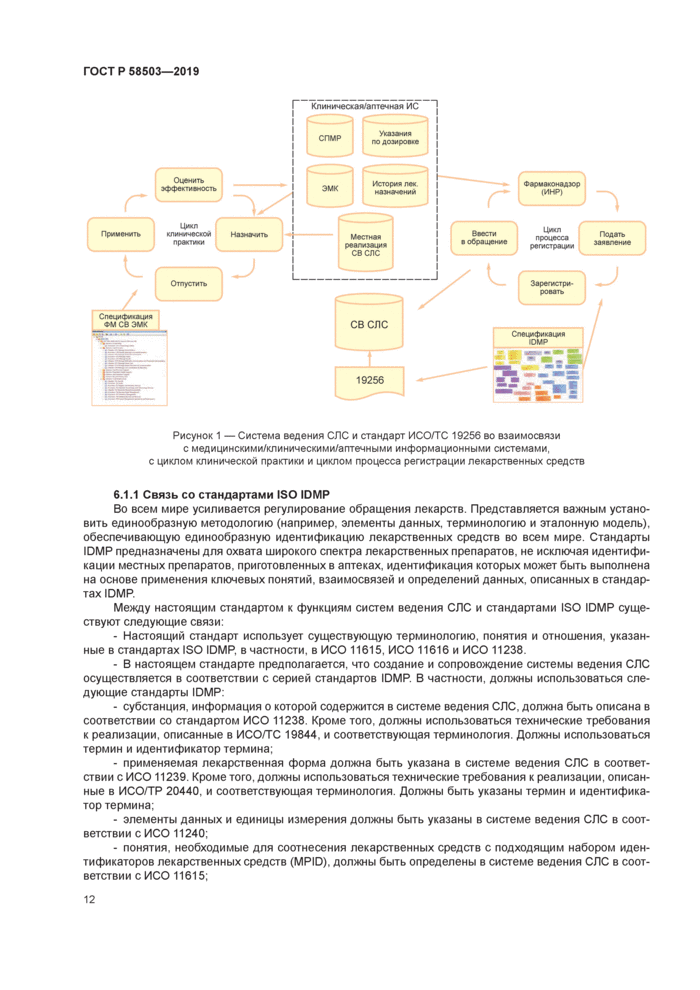
Обзор взаимосвязей между системой ведения СЛС. различными медицинскими, клиническими и/или аптечными системами, нормативными требованиями стандартов IDMP и ФМ СВ ЭМК показан на рисунке 1. не претендующем на отображение всех деталей или вариантов каждого компонента.
|
с медицинскими/клиническими/аптечными информационными системами, с циклом клинической практики и циклом процесса регистрации лекарственных средств |
6.1.1 Связь со стандартами ISO ЮМР
Во всем мире усиливается регулирование обращения лекарств. Представляется важным установить единообразную методологию (например, элементы данных, терминологию и эталонную модель), обеспечивающую единообразную идентификацию лекарственных средств во всем мире. Стандарты ЮМР предназначены для охвата широкого спектра лекарственных препаратов, не исключая идентификации местных препаратов, приготовленных в аптеках, идентификация которых может быть выполнена на основе применения ключевых понятий, взаимосвязей и определений данных, описанных в стандартах ЮМР.
Между настоящим стандартом к функциям систем ведения СЛС и стандартами ISO ЮМР существуют следующие связи:
- Настоящий стандарт использует существующую терминологию, понятия и отношения, указанные в стандартах ISO ЮМР. в частности, в ИСО 11615, ИСО 11616 и ИСО 11238.
- В настоящем стандарте предполагается, что создание и сопровождение системы ведения СЛС осуществляется в соответствии с серией стандартов ЮМР. В частности, должны использоваться следующие стандарты ЮМР:
- субстанция, информация о которой содержится в системе ведения СЛС. должна быть описана в соответствии со стандартом ИСО 11238. Кроме того, должны использоваться технические требования к реализации, описанные в ИСО/ТС 19844. и соответствующая терминология. Должны использоваться термин и идентификатор термина;
- применяемая лекарственная форма должна быть указана в системе ведения СЛС в соответствии с ИСО 11239. Кроме того, должны использоваться технические требования к реализации, описанные в ИСО/ТР 20440. и соответствующая терминология. Должны быть указаны термин и идентификатор термина:
- элементы данных и единицы измерения должны быть указаны в системе ведения СЛС в соответствии с ИСО 11240;
- понятия, необходимые для соотнесения лекарственных средств с подходящим набором идентификаторов лекарственных средств (МРЮ). должны быть определены в системе ведения СЛС в соответствии с ИСО 11615;
- понятия, необходимые для соотнесения лекарственных препаратов (зарегистрированных) с подходящим набором идентификаторов лекарственных препаратов (PhPID), должны быть определены в системе ведения СЛС в соответствии с ИСО 11616;
- система ведения СЛС должна обеспечивать поддержку систем электронных рецептов, соответствующих ИСО 17523;
- в системе ведения СЛС должны быть обеспечены ссылки на машиночитаемое кодирование идентификаторов упаковок лекарственных средств, описанное в ИСО/ТС 16791.
- Настоящий стандарт усиливает и ограничивает терминологию, понятия и отношения, определенные в стандартах ISO IDMP. в той мере, которая необходима для поддержки системой ведения СЛС вариантов использования в клинической практике, предусмотренных в настоящем документе. Подмножество понятий, определенных в ISO IDMP. включая отображение на идентификаторы, соответствующие ISO IDMP. ограничено поддержкой вариантов использования, описанных в настоящем стандарте. В настоящем стандарте предполагается, что различные пользователи систем ведения СЛС могут иметь различное представление содержащихся в них данных, т.е. просматривать большее или меньшее число характеристик лекарственных средств в зависимости от того, какая детализация требуется для поддержки их варианта использования.
- Предполагается, что вся совокупность стандартов IDMP. включая ключевые понятия, характеристики. отношения и модель данных, должна быть представлена в системе ведения СЛС для поддержки максимально возможного количества вариантов использования. Однако, поскольку вариант использования в клинической практике не требует того уровня специфичности, который предполагают стандарты IDMP. система ведения СЛС может содержать лишь подмножество релевантных понятий, характеристик и элементов данных ключевой модели данных IDMP. Во всех случаях, когда понятия, характеристики или элемента данных IDMP используются в системах ведения СЛС. они должны быть полностью совместимы и унифицированы с применимыми техническими требованиями, входящими в состав IDMP Для специфичных пользователей даже этого может быть слишком много, поэтому предлагается использовать разные представления полей данных для разных пользователей.
- Реализация понятий, характеристик, отношений и элементов данных, определенных в стандартах IDMP. в системе ведения СЛС описывается настоящим стандартом в следующих классифицирующих терминах. «Обязан» («Shall») — обязательные понятия. «Следует» («Should») — понятия, которые считаются полезными или важными для варианта использования. «Может» («Мау») — понятия, которые считаются необязательными. Поставщики систем ведения СЛС не должны создавать дополнительные идентификаторы, перекрывающие идентификаторы, соответствующие стандартам IDMP, уже определенные для тех лекарственных средств, которые охвачены стандартами IDMP. Однако для идентификации препаратов, не охваченных стандартами IDMP (например, экстемпоральных препаратов), следует использовать ключевые понятия, характеристики и элементы данных, определенные в стандартах IDMP
- Необходимо учитывать, что в различных юрисдикциях уже существуют системы ведения СЛС. которые, скорее всего, должны следовать местным требованиям и находятся под влиянием практических реализаций. Для таких ситуаций Технические требования предусматривают тип стратегии перехода к использованию положений ISO IDMP в системе ведения СЛС в полном объеме. Тем не менее. Технические условия также оставляют простор для дополнительных местных требований и информации о приготовленных местных лекарственных препаратах, на которые не распространяются какие-либо требования регистрации.
6.1.2 Связь с медицинскими/клиническими/аптечными информационными системами, системами поддержки принятия медицинских решений, электронными медицинскими картами и указаниями по дозировке
Система ведения СЛС или ее местная реализация является частью медицинской, клинической и/или аптечной информационной системы. Такая информационная система предоставляет различные функции и обрабатывает разные типы информации. С точки зрения применения системы ведения СЛС наиболее важными частями медицинской, клинической и/или аптечной информационной системы являются, помимо системы ведения СЛС, подсистема поддержки принятия медицинских решений, подсистема ведения электронных медицинских карт и подсистема, обеспечивающая указания по дозировке. Для назначения или отпуска правильного препарата медицинская/клиническая/аптечная информационная система использует систему ведения СЛС в целях идентификации лекарства, подлежащего назначению и отпуску, а также использует подсистему поддержки принятия медицинских решений, связанную с системой ведения СЛС. в сочетании с электронной медицинской картой пациента для проверки
безопасности и эффективности применения пекарства к этому конкретному пациенту. Указания по дозировке испопьзуются в медицинской/кпинической/аптечной информационной системе для описания дозировки, назначенной пациенту, и для проверки дозировки по данным, которыми располагает подсистема принятия медицинских решений.
6.1.3 Связь с ФМ СВ ЭМК
В качестве основы настоящего стандарта использовалась вышеупомянутая работа, проведенная организацией Health Level 7 International, а именно, Electronic Health Record System Functional Model (EHR-S FM) (функциональная модель системы ведения электронных медицинских карт, ФМ СВ ЭМК), второй выпуск которой содержит семь основных разделов функциональных требований к системам ведения электронных медицинских карт. Этот основной функционал представлен на рисунке 2 «Разделы ФМ СВ ЭМК». Каждый раздел, представленный особым цветом, содержит заголовки, функции и критерии соответствия.
Щ Общее (О)
Поддержка оказания медицинской помощи (CPS)
Административная поддержка (AS)
Оказание медицинской помощи (СР)
Поддержка здравоохранения населения (POP)
Инфраструктура ведения записей (RI) Инфраструктура доверия (TI)
Рисунок 2 — Разделы функциональной модели системы ведения электронных медицинских карт
Функциональные требования к системе ведения СЛС представлены с использованием того же подхода, что и в ФМ СВ ЭМК.
6.2 Варианты использования для требований к системе ведения СЛС
С учетом цели настоящего стандарта выделены и определены следующие варианты использования. Система ведения СЛС нацелена на минимальный набор вариантов использования, которые она может инициировать или обеспечивать, задавая требования к подходящему содержанию и структуре информации:
- назначение.
- отпуск.
- применение.
- ведение истории лекарственных назначений,
- согласование листа лекарственных назначений.
- заказ и цепочка поставки (логистика).
- анализ/статистика применения лекарственных средств, включая фармакоэпидемиологию.
- электронный обмен информацией о лекарственных средствах между системами здравоохранения и/или связанными системами.
- возмещение затрат на отпущенные лекарственные средства.
- клиническое исследование,
- ведение регистрационных журналов и прослеживание в целях безопасности пациента и общественного здоровья,
- фармаконадзор.
- обеспечение безопасности пациента с помощью привязки персональных данных к системе поддержки принятия решений по лекарственным назначениям,
- миграция.
Эти варианты использования более подробно описаны в следующих разделах.
6.2.1 Вариант использования «Назначение»
Основной вклад системы ведения СЛС в поддержку варианта использования «Назначение» заключается в возможности предоставления достаточно подробного описания лекарственного средства,
Содержание
1 Область применения.................................................................1
2 Нормативные ссылки.................................................................2
3 Термины и определения...............................................................2
4 Сокращения........................................................................9
5 Граница между системами ведения СЛС и IDMP, вспомогательная информация для создания
системы ведения СЛС и местная реализация..............................................9
5.1 Граница между системами СЛС и ЮМР..............................................9
5.2 Граница между системами ведения СЛС и вспомогательной информацией для создания
системы ведения СЛС................................................................9
5.3 Граница между системами СЛС и местной реализацией...............................10
5.4 Содержание систем СЛС в терминах охвата лекарственных средств.....................10
5.5 Определение системы ведения справочника лекарственных средств (СЛС)...............10
5.6 Преимущества стандарта.........................................................11
5.7 Целевые пользователи стандарта..................................................11
6 Позиционирование систем ведения справочников лекарственных средств в здравоохранении ... 11
6.1 Исходные материалы для систем ведения СЛС.......................................11
6.2 Варианты использования для требований к системе ведения СЛС.......................14
7 Функциональные требования к системам ведения СЛС....................................18
7.1 Введение ......................................................................18
7.2 Цель системы ведения СЛС.......................................................18
7.3 Нормативные требования.........................................................19
7.4 Управление....................................................................28
7.5 Сопровождение.................................................................29
7.6 Локализация....................................................................30
Приложение А (справочное) Применение серии стандартов ЮМР в контексте настоящего
стандарта..............................................................31
Библиография.......................................................................32
позволяющего при следующем действии или процессе (отпуск или применение) определить правильное лекарственное средство.
В зависимости от области использования может предоставляться следующая информация:
- продукт как таковой — фактически произведенный продукт (под торговым наименованием или без него) с указанием конкретной упаковки;
- описание лекарственного средства с некоторым обобщением, например, описание действующего вещества, лекарственной формы и активности без указания торгового наименования.
Во втором случае описание продукта может быть дано без указания лекарственной формы, активности или единиц представления. Оно может выглядеть очень похожим на перечень действующих веществ продукта, но концептуально является иным. Пациенту нельзя ввести «некое количество субстанции». ему можно ввести лекарственное средство, в состав которого входит эта субстанция.
6.2.2 Вариант использования «Отпуск»
Основной вклад системы ведения СЛС в поддержку варианта использования «Отпуск» заключается в возможности достаточно подробного описания лекарственного средства, позволяющего отпускающему лицу правильно выбрать фактически отпускаемый продукт.
В обоих вариантах использования — назначение и отпуск — местная реализация должна предоставлять какую-либо информацию о наличии лекарственных средств. Назначающее лицо не должно получать описания лекарственных средств, не доступных для отпуска: если же существуют какие-либо ограничения доступности, то они должны быть описаны. Отпускающее лицо должно подбирать для отпуска только имеющиеся в наличии лекарственные средства.
Примечание —Данное требование может быть распространено на предоставление назначающим лицам только формуляра и на предоставление отпускающим лицам информации о запасах с тем, чтобы каждый из них имел для выбора только определенный перечень лекарственных средств
6.2.3 Вариант использования «Применение лекарственного средства»
Вариант использования «Применение лекарственного средства» включает в себя применение заданной дозированной лекарственной формы (назначенного) лекарственного средства к пациенту, используя определенный способ применения через заданный путь введения, а также регистрацию совершения такого действия в определенную дату и время.
6.2.4 Вариант использования «Ведение истории лекарственных назначений»
По нескольким причинам полезно регистрировать сведения о лекарственных препаратах, которые пациент принимал ранее, например, чтобы знать, как долго пациент принимал препарат или какие препараты пациент пробовал принимать, но прекратил по каким-либо причинам.
6.2.5 Вариант использования «Согласование листа лекарственных назначений»
Когда несколько разных поставщиков медицинской помощи заполняют разные листы лекарственных назначений одному и тому же пациенту, необходимо, чтобы эти листы были согласованы, это позволит. например, в случае перевода определить, что пациент фактически принимает. Для облегчения согласования сведения о лекарствах должны быть представлены с одинаковой степенью детализации или. в случае представления с разной степенью детализации, должна иметься возможность преобразования к сопоставимой степени. Это необходимо для идентификации в листе лекарственных назначений совпадающих или недостающих лекарств.
6.2.6 Вариант использования «Заказ и цепочка поставки (логистика)»
Этот вариант использования включает в себя заказ лекарственных средств у поставщика, транспортировку. а также доставку и хранение в аптеке. Обычно такой процесс позвопяет осуществпять регистрацию действий и прослеживание лекарственных средств на различных этапах процесса логистики. Для этого лекарственному средству требуется, к примеру, идентификатор.
6.2.7 Вариант использования «Анализ/статистика применения лекарственных средств, включая фармакоэпидемиологию»
Примером аналитики в сфере фармакологии может служить ретроспективный анализ данных о применении лекарственного средства. Фармакоэпидемиология представляет собой изучение применения лекарственных препаратов и их эффективности для больших групп людей. Для сбора данных о применении препаратов на больших популяциях обязательно требуется объединение информации из многих источников Поэтому было бы целесообразно иметь гармонизированную систему ведения СЛС. у которой в структуре информации предусмотрены связи со стандартной фармакоэпидемиологической классификацией, например АТХ.
Предисловие к ИСО/ТС 19256
Международная организация по стандартизации (ИСО) — всемирная федерация национальных органов по стандартизации (комитеты — члены ИСО). Работа по подготовке международных стандартов обычно ведется через технические комитеты ИСО. Каждый комитет — член ИСО. проявляющий интерес к тематике, по которой учрежден технический комитет, имеет право быть представленным в этом комитете. Международные организации, государственные и негосударственные, имеющие связи с ИСО. также принимают участие в работе. ИСО тесно сотрудничает с Международной электротехнической комиссией (МЭК) по всем вопросам стандартизации в области электротехники.
Процедуры, используемые для разработки данного документа, и процедуры, предусмотренные для его дальнейшего ведения, описаны в Директивах ИСО/МЭК Часть 1. В частности, следует отметить различные критерии утверждения, требуемые для различных типов документов ИСО. Проект данного документа был разработан в соответствии с редакционными правилами Директив ИСО/МЭК. Часть 2. www.iso.org/direclives.
Необходимо обратить внимание на возможность того, что ряд элементов данного документа могут быть предметом патентных прав. Международная организация ИСО не должна нести ответственность за идентификацию таких прав, частично или полностью. Сведения о патентных правах, идентифицированных при разработке документа, будут указаны во Введении и/или в перечне полученных ИСО объявлениях о латентных правах (см. www.iso.org/patents).
Любое торговое название, использованное в данном документе, является информацией, предоставляемой для удобства пользователей, а не свидетельством в пользу того или иного товара или той или иной компании.
Пояснение значений конкретных терминов и выражений ИСО. относящихся к оценке соответствия, а также информацию о соблюдении Международной организацией ИСО принципов ВТО по техническим барьерам в торговле (ТБТ) см. по следующей гиперссылке (URL): Предисловие — Дополнительная информация.
За данный документ отвечает Технический комитет ИСО/ТК 215, Информатизация здоровья.
Введение
Настоящее введение охватывает следующие темы:
a) Что такое система ведения справочника лекарственных средств (СЛС)?
b) Каковы варианты использования и кто является заинтересованными сторонами?
c) В чем заключаются преимущества для различных заинтересованных сторон?
d) Каковы ключевые функциональные требования к системе ведения СЛС в сфере здравоохранения?
Основной целевой аудиторией являются операторы и разработчики систем СЛС. а также те. кто заключают договоры с такими операторами и разработчиками.
Целью систем ведения СЛС является предоставление различным сторонам в здравоохранении полного обзора доступных лекарственных средств таким образом, чтобы понятия (их элементы) и описания. а также идентификаторы лекарственных средств можно было использовать в целом ряду других медицинских информационных систем. Согласно настоящему стандарту, любая система ведения СЛС должна использовать глобальные уникальные идентификаторы, соответствующие стандартам ИДМП.
Лекарственные средства играют важную роль в здравоохранении. Существует большое количество (тысячи) лекарственных средств, и кахздое лекарственное средство имеет множество характеристик (свойств) — определяющих и не определяющих Разработка и применение лекарственных средств строго регулируются: в настоящее время структура информации о лекарственных средствах регламентируется стандартами ИСО ИДМП. Кроме того, в использовании лекарственных средств участвуют многие поставщики медицинской помощи, учреждения и предприятия. Кахадый из участников использует информационные системы, обеспечивающие хранение информации о лекарственных средствах и обмен этой информацией. Для этих информационных систем необходима система ведения СЛС, которая позволит точно и неизменно идентифицировать лекарственные понятия в форме (формах), соответствующей вариантам их использования.
Система ведения СЛС устанавливает единообразное представление понятий (наборов идентификаторов). описывающих лекарства с различными уровнями детализации и семантическими связями с целью поддержки частей нескольких процессов в здравоохранении, связанных с применением лекарств. Система ведения справочников лекарственных средств описана в настоящих Технических требованиях таким образом, чтобы понятия, идентификаторы и отношения образовывали вид структуры, поддерживающей варианты использования, в том числе каким образом такая структура поддерживает варианты использования и что для этого необходимо. Дополнительно дано описание системы ведения СЛС с точки зрения архитектуры ее интеграции с другими частями медицинских информационных систем.
Культурные различия в практике и предоставлении медицинской помощи, а также национальное законодательство требуют электронных систем ведения СЛС. отвечающих особым местным, региональным или национальным потребностям. Кахедая система ведения СЛС предназначена для поддержки определенного набора вариантов использования, что позволяет определить функциональные требования, которым такие системы должны обязательно соответствовать. Данные функциональные требования, в свою очередь, будут определять конкретный набор обобщенных представлений информации о лекарственных средствах, которые должны быть обязательно идентифицированы, определены и соотнесены друг с другом в пределах системы ведения СЛС. Каждое «лекарственное средство» в системе СЛС описывается в виде специфичного подмножества всех возмох<ных определяющих и не определяющих информационных элементов, которые все вместе позволяют поддерживать один или несколько конкретных вариантов использования Формальное определение понятий дается в виде их характеристик и связей с другими понятиями в соответствии со стандартами ИСО ИДМП. в частности. ИСО 11615, ИСО 11616 и ИСО 11238 Наличие связей между всеми записями, описывающими лекарственные средства, позволяет системе ведения СЛС обеспечивать интероперабельность различных вариантов использования, процессов, информационных систем, организаций и юрисдикций.
Лицами, которые могут быть заинтересованы в настоящем стандарте, являются поставщики медицинской помощи, в чьи обязанности входит выбор подходящих систем ведения СЛС. поставщики программного обеспечения, государственные органы, фармацевтические компании, предприятия оптовой торговли, плательщики, органы по контролю за лекарственными средствами, а также пациенты/ организации пациентов.
В целом настоящий стандарт способствует достижению следующих деловых целей:
- предоставить информацию разработчикам систем ведения СЛС. помогающую им создавать системы. в большей мере соответствующие стандартам ИСО ИДМП и отвечающие потребностям многих вариантов использования:
- обеспечить в системах ведения СЛС точное и согласованное использование понятий и терминов в соответствии со стандартами ИСО ИДМП;
- повысить степень гармонизации систем ведения СЛС во всем мире;
- снизить избыточность сбора и управления данными;
- обеспечить основу для будущих международных стандартов, способствующих интероперабельности вариантов использования лекарств, информационных систем и юрисдикций, участвующих в трансграничной медицинской помощи;
- понизить стоимость разработки и сопровождения систем ведения справочников лекарственных средств.
Настоящий стандарт частично основан на следующих терминологиях/базах данных:
- Австралийская лекарственная терминология АМТ;
- Справочник лекарств и медицинских изделий DM+D Национальной службы здравоохранения (NHS);
- База данных лекарственных препаратов Сингапура:
- Систематизированная номенклатура медицины — клиническая терминология (SNOMED СТ);
- Голландский G-Standaard от Z-Index (и Pharmabase от Healthbase) (NEN 7507);
- ИСО/ТР 22790 Информатизация здоровья. Функциональные характеристики систем поддержки назначений лекарств.
НАЦИОНАЛЬНЫЙ СТАНДАРТ РОССИЙСКОЙ ФЕДЕРАЦИИ
ИНФОРМАТИЗАЦИЯ ЗДОРОВЬЯ
Требования к системам ведения справочника лекарственных средств для здравоохранения
Hearth informatics Requirements for management systems of medicines reference for hearth care
Дата введения — 2020—05—01
1 Область применения
Настоящий стандарт определяет обязательные характеристики любой системы ведения СЛС, обеспечивающей варианты использования в здравоохранении.
В эти характеристики входят понятия, описывающие лекарственные средства, идентификаторы и отношения, образующие вид структуры, поддерживающей варианты использования.
Для поддержки вариантов использования система ведения СЛС должна удовлетворять следующим требованиям:
- быть максимально объемлющей и исчерпывающей: если она охватывает не все требуемые лекарственные средства, то другие системы не могут полностью опираться на систему ведения СЛС для получения необходимой информации, поэтому некоторый объем избыточности регистрации информации останется неизбежным;
- содержать информацию в виде единообразной и подходящей структуры, соответствующей стандартам ИСО ИДМП (как описано в настоящем стандарте) с подходящим уровнем детализации.
В область применения настоящего стандарта не входят:
- функционал медицинских, клинических и/или аптечных систем:
• другие виды содержания медицинских, клинических и/или аптечных систем, необходимые для поддержки всей деятельности поставщиков медицинской помощи, например:
- широкий круг знаний о лекарствах, который должен обрабатываться базами знаний о лекарствах и системами поддержки принятия решений,
• листы лекарственных назначений,
- указания по дозировке;
- в терминах препаратов:
- средства традиционной китайской медицины.
- медицинские изделия, например, устройства для применения лекарств (в настоящем стандарте особое внимание уделяется только устройствам, предназначенным для правильного введения лекарственных средств (см. ИСО 11615)],
Примечание — Устройство для применения лекарственного средства может быть неотъемлемой частью первичной упаковки или укупорки.
- ветеринарные препараты.
Целью настоящего стандарта является предоставление набора функциональных требований к системам, использующим детальные сведения о лекарственных средствах и отношениях между ними с целью поддержки оказания медицинской помощи.
Издание официальное
2 Нормативные ссылки
В настоящем стандарте использованы нормативные ссылки на следующие стандарты. Для датированных ссылок применяют только указанные издания. Для недатированных ссылок применяют последние издания (включая любые изменения к стандартам):
ISO 11615. Health informatics — Identification of medicinal products — Data elements and structures for the unique identification and exchange of regulated medicinal product information (Информатизация здоровья. Идентификация лекарственных средств. Элементы данных и структуры для уникальной идентификации и обмена информацией о регистрируемых лекарственных средствах)
ISO 11616. Health informatics — Identification of medicinal products — Data elements and structures for the unique identification and exchange of regulated pharmaceutical product information (Информатизация здоровья. Идентификация лекарственных средств. Элементы данных и структуры для уникальной идентификации и обмена информацией о регистрируемых лекарственных препаратах)
IS011238. Health informatics — Identification of medicinal products — Data elements and structures for the unique identification and exchange of regulated information on substances (Информатизация здоровья. Идентификация лекарственных средств. Элементы данных и структуры для уникальной идентификации и обмена информацией о регистрируемых фармацевтических субстанциях)
ISO 11239. Health informatics — Identification of medicinal products — Data elements and structures for the unique identification and exchange of regulated information on pharmaceutical dose forms, units of presentation, routes of administration and packaging (Информатизация здоровья. Идентификация лекарственных средств. Элементы данных и структуры для уникальной идентификации и обмена информацией о регистрируемых формах дозировки, единицах представления, путях введения и упаковке)
IS011240. Health informatics — Identification of medicinal products — Data elements and structures for the unique identification and exchange of units of measurement (Информатизация здоровья. Идентификация лекарственных средств. Элементы данных и структуры для уникальной идентификации и обмена информацией об единицах измерения)
ISO/TS 16791, Health informatics — Requirements for international machine-readable coding of medicinal product package identifiers (Информатизация здоровья. Требования к международному машиночитаемому кодированию идентификаторов упаковок лекарственных средств)
ISO 17523, Health informatics — Requirements for electronic prescriptions (Информатизация здоровья). Требования к электронным рецептам
3 Термины и определения
В настоящем стандарте применены термины с соответствующими определениями:
3.1 применение (administration): Действия по (самостоятельному) применению (назначенного) лекарственного средства пациентом с использованием способа введения через определенный путь введения, а также регистрация совершения такого действия в определенную дату и время.
3.2 _
способ применения (administration method): Общий способ, которым лекарственный препарат следует применять к пациенту.
Примеры — Аппликация, ингаляция, инъекция.
Примечание 1 — Способ применения — это общий термин, используемый для группировки связанных понятий о дозированных лекарственных формах и не предназначенный для описания точного способа или пути введения лекарственного средства
(ИСО 11239:2012, пункт 3.1.3)
3.3 _
устройство для применения лекарственного средства (administration device): Изделие, предназначенное для правильного применения лекарственного средства.
Примеры — Аппликатор, игла, оральный шприц.
Примечание 1 — Устройство для применения лекарственного средства может быть неотьемлемой частью первичной упаковки или укупорки
(ИСО 11239:2012, пункт 3.1.2, с изменениями]
34_
атрибут (attribute): Характеристика объекта или сущности.
Примечание 1 — В контексте настоящего стандарта конкретная характеристика элемента данных [ИСО/МЭК 11179-1:2015, пункт 3.1.1, С изменениями)
3.5 зарегистрированное средство (authorized product): Лекарственное средство, имеющее регистрационное удостоверение.
3.6 _
понятие (concept): Единица знаний, образованная уникальным сочетанием характеристик.
[ИСО 1087-1:2000, пункт 3.2.1, с изменениями)
3.7_
контекст (context): Связанные условия и ситуации, которые обеспечивают подходящее понимание и значение субъекта.
[ИСО/ТР 17119:2005. 2.4)
3.8_
данные (data): Поддающееся многократной интерпретации представление информации в формализованном виде, пригодном для передачи, интерпретации или обработки.
[ИСО/МЭК 2382:2015, пункт 2121272, с изменениями)
3.9_
отпуск лекарственных средств (dispensing): Процесс, в котором индивидуальный поставщик медицинской помощи принимает рецепт, оценивает рецепт, подбирает назначенное лекарственное средство и выдает данное лекарственное средство субъекту медицинской помощи или его представителю.
Примечание 1 — В большинстве случаев, но не всегда, таким индивидуальным поставщиком медицинской помощи является фармацевт
[IHE Pharmacy — Technical Framework Specification]
3.10 запись об отпуске лекарственного средства (dispense record): Запись об отпущенном лекарственном средстве и процессе отпуска.
Примечание 1 — Информация об отпущенном лекарственном средстве включает в себя идентификаторы. торговое название, тип, форму, количество и пр фактически отпущенного лекарственного средства Запись о процессе отпуска включает в себя сведения о способе доставки, дату отпуска, идентификацию получателя (если это не субъект медицинской помощи) и отпускающего лица. Также в такой записи может быть предусмотрена возможность регистрации комментариев при оценке рецептов
3.11 _
отпускающее лицо (dispenser): Медицинский работник, ответственный за предоставление / отпуск лекарственных средств по рецептам.
Примечание 1 — Отпускающим лицом обычно является фармацевт, но в соответствии с местной юрисдикцией им могут быть другие лица
[ИСО 21549-7:-, пункт 3.5. с изменениями]
3.12_
лекарственная форма (dose form): Физическая форма лекарственного средства, в котором содержатся действующее вещество (вещества) и/или вспомогательное вещество (вещества), предназначенные для передачи пациенту.
Примечание 1 —Дозированная лекарственная форма может обозначать вводимую лекарственную форму или упакованную лекарственную форму в зависимости от описываемого средства
(ИСО 11616:2012. пункт 3.1.10)
3.13_
электронная медицинская карта (Electronic Health Record). ЭМК, (EHR): Логическое представление информации о состоянии здоровья субьекта медицинской помощи или сопутствующей информации.
(ИСО 18308:2011. пункт 3.20. с изменениями)
3.14_
сущность (entity): Рассматриваемый конкретный или абстрактный предмет интереса, включая отношения между предметами.
(ИСО/МЭК 2382:2015. пункт 2120770)
3.15_
идентификаторы (identifiers): Последовательность символов, позволяющая однозначно идентифицировать что-либо, с чем она связана, в пределах заданного контекста.
(ИСО/МЭК 11179-1:2015. пункт 3.3.1. с изменениями)
3.16 первичная упаковка (immediate container): Непосредственная упаковка, в которой содержится произведенный продукт или лекарственный препарат и которая имеет с ним непосредственный контакт.
Примеры — Ампула, флакон, предварительно заполненный шприц, банка, блистер.
Примечание 1 — Первичная упаковка может быть вложена в устройство для применения или в укупорку либо интегрирована с ними.
Примечание 2 — Роль первичной упаковки может выполняться дозированной лекарственной формой Примером может служить капсула с порошком для ингаляции В этом случае капсула не является упаковкой
Примечание 3—Альтернативное совместимое определение первичной упаковки («immediate packaging») приведено в Директиве 92/27/ЕЕС.
3.17 _
исследуемое лекарственное средство (Investigational Medicinal Product): Лекарственная форма активной субстанции или плацебо, исследуемые или используемые в качестве контрольных в клиническом исследовании, включая лекарственные средства, имеющие регистрационное удостоверение, но используемые способом, отличным от зарегистрированной формы; используемые для показаний, не включенных в регистрационное удостоверение или используемые для получения дополнительной информации о зарегистрированной форме.
(ИСО 11615:2012, пункт 3.1.28)