ФЕДЕРАЛЬНОЕ АГЕНТСТВО ПО ТЕХНИЧЕСКОМУ РЕГУЛИРОВАНИЮ И МЕТРОЛОГИИ
НАЦИОНАЛЬНЫЙ
СТАНДАРТ
РОССИЙСКОЙ
ФЕДЕРАЦИИ
РУКОВОДСТВО ПО АУДИТУ СИСТЕМ МЕНЕДЖМЕНТА КАЧЕСТВА ИЗГОТОВИТЕЛЕЙ МЕДИЦИНСКИХ ИЗДЕЛИЙ НА СООТВЕТСТВИЕ РЕГУЛИРУЮЩИМ ТРЕБОВАНИЯМ
Часть 4
Аудит нескольких производственных площадок
GHTF/SG4/N83:2010 Guidelines for regulatory auditing of quality management systems of medical device manufacturers - Part 4: Multiple Site Auditing (MOD)
Издание официальное
Предисловие
1 ПОДГОТОВЛЕН Закрытым акционерным обществом «МЕДИ-ТЕСТ» на основе собственного аутентичного перевода на русский язык документа, указанного в пункте 4
2 ВНЕСЕН Техническим комитетом по стандартизации ТК 436 «Управление качеством медицинских изделий»
3 УТВЕРЖДЕН И ВВЕДЕН В ДЕЙСТВИЕ Приказом Федерального агентства по техническому регулированию и метрологии от 8 ноября 2013 г. № 1494-ст
4 Настоящий стандарт является модифицированным по отношению к международному документу Целевой группы по глобальной гармонизации (Global Harmonization Task Force - GHTF) GHTF/SG4/N83:2010 «Руководство по аудиту систем менеджмента качества изготовителей медицинских изделий на соответствие регулирующим требованиям. Часть 4. Аудит нескольких производственных площадок» (GHTF/SG4/N83:2010 «Guidelines for Regulatory Auditing of Quality Management Systems of Medical Device Manufacturers - Pari 4: Multiple Site Auditing») путем изменения его структуры в части исключения разделов 3 и 4 примененного оригинального документа, которые нецелесообразно применять в национальном стандарте в связи с требованиями к структуре национального стандарта Российской Федерации, установленными в ГОСТ Р 1.0. а также в связи с тем. что содержание данных разделов дублируется содержанием введения и раздела 1. Сравнение структуры настоящего стандарта со структурой указанного оригинального документа приведено в дополнительном приложении ДА.
Оригинальный текст аутентичного перевода измененных структурных элементов примененного документа GHTF и объяснение причин внесения технических отклонений приведены в дополнительном приложении ДБ.
Сведения о соответствии ссылочных национальных стандартов Российской Федерации международным стандартам, использованным в качестве ссылочных в примененном международном документе. приведены в дополнительном приложении ДВ
5 ВВЕДЕН ВПЕРВЫЕ
Правила применения настоящего стандарта установлены в ГОСТ Р 1.0-2012 (раздел 8). Информация об изменениях к настоящему стандарту публикуется в ежегодном (по состоянию на 1 января текущего года) информационном указателе «Национальные стандарты», а официальный текст изменений и поправок - в ежемесячном информационном указателе «Национальные стандарты». В случае пересмотра (замены) или отмены настоящего стандарта соответствующее уведомление будет опубликовано в ближайшем выпуске информационного указателя «Национальные стандарты». Соответствующая информация, уведомление и тексты размещаются также в информационной системе общего пользования - на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Инлюрнет (gost.ru)
© Стандартинформ. 2014
Настоящий стандарт не может быть полностью или частично воспроизведен, тиражирован и распространен в качестве официального издания без разрешения Федерального агентства по техническому регулированию и метрологии
ГОСТ P 55748—2013
Введение
Настоящий стандарт является руководством для регулирующих органов и аудиторских организаций. осуществляющих аудиты систем менеджмента качества изготовителей медицинских изделий с несколькими производственными площадками. Настоящий стандарт следует рассматривать совместно с ГОСТ Р 54882.
Потенциальные преимущества настоящего стандарта для регулирующих органов или аудиторских организаций включают в себя:
повышение результативности аудита системы менеджмента качества изготовителей медицинских изделий с несколькими производственными площадками;
сокращение времени проведения аудита аудиторской организацией и стоимости аудита; обеспечение руководящих принципов для первоначального аудита, инспекционных аудитов и специальных аудитов системы менеджмента качества изготовителей с несколькими производственными площадками.
Потенциальные выгоды для изготовителей медицинских изделий включают в себя:
- повышение результативности аудита системы менеджмента качества изготовителей с несколькими производственными площадками:
- сокращение времени проведения аудита и стоимости аудита для изготовителя;
- улучшение понимания процесса аудита системы менеджмента качества изготовителей с несколькими производственными площадками.
НАЦИОНАЛЬНЫЙ СТАНДАРТ РОССИЙСКОЙ ФЕДЕРАЦИИ
РУКОВОДСТВО ПО АУДИТУ СИСТЕМ МЕНЕДЖМЕНТА КАЧЕСТВА ИЗГОТОВИТЕЛЕЙ МЕДИЦИНСКИХ ИЗДЕЛИЙ НА СООТВЕТСТВИЕ РЕГУЛИРУЮЩИМ ТРЕБОВАНИЯМ
Часть 4
Аудит нескольких производственных площадок
Guidelines for regulatory auditing of quality management systems of medical device manufacturers Part 4
Multiple site auditing
Дата введения — 2015—01—01
1 Область применения
Настоящий стандарт является руководством для аудиторских организаций для планирования, организации, проведения, документирования, а также анализа программ аудита при проведении аудитов изготовителей медицинских изделий (см. 3.5) с несколькими производственными площадками, действующими в рамках той же системы менеджмента качества.
Настоящий стандарт не распространяется на изготовителей, включающих в себя несколько предприятий, соответствующих различным системам менеджмента качества. Отношения между этими предприятиями необходимо рассматривать как отношения между поставщиками, (см. ГОСТ Р 55747-2013 (GHTF/SG4/N842010)). Однако, если изготовитель имеет несколько предприятий с несколькими производственными площадками, действующими в рамках одной системы менеджмента качества, то настоящий стандарт может быть применен.
2 Нормативные ссылки
В настоящем стандарте использованы нормативные ссыпки на следующие стандарты: ГОСТ Р 54421-2011 Руководство по аудиту систем менеджмента качества изготовите-лей медицинских изделий на соответствие регулирующим требованиям Часть 1. Общие требования (GHTF/SG4/N28R4 2008. MOD)
ГОСТ Р 54882-2011 Руководство по аудиту систем менеджмента качества изготовителей медицинских изделий на соответствие регулирующим требованиям Часть 2. Стратегия аудита (GHTF/SG4/N30R20 2008. MOD)
ГОСТ Р 54881-2011 Руководство по аудиту систем менеджмента качества изготовителей медицинских изделий на соответствие регулирующим требованиям. Часть 3. Отчет о проведении аудита (GHTF/SG4/N33R16:2007. MOD)
ГОСТ Р 55747-2013 (GHTF/SG4/N84 2010) Руководство по аудиту систем менеджмента качества изготовителей медицинских изделий на соответствие регулирующим требованиям Часть 5 Аудит управления поставщиками
GHTF/SG1 /N055:2009 Определения терминов «производитель/ изготовитель», «официальный представитель», «дистрибьютор/оптовый продавец» и «импортер»
Примечание - При пользовании настоящим стандартом целесообразно проверить действие ссылочных стандартов в информационной системе общего пользования — на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет или по ежегодному информационному указателю «Национальные стандарты», который опубликован по состоянию на 1 января текущего года, и по выпускам ежемесячного информационного указателя «Национальные стандарты» за текущий год Если заменен ссылочный стандарт, на который дана недатированная ссылка, то рекомендуется использовать действующую версию этого стандарта с учетом всех внесенных в данную версию изменений Если заменен ссылочный стандарт. на который дана датированная ссылка, то рекомендуется использовать версию этого стандарта с указанным выше годом утверждения (принятия) Если после утверждения настоящего стандарта в ссылочный стандарт. на который дана датированная ссылка, внесено изменение, затрагивающее положение, на которое дана ссылка, то это положение рекомендуется применять без учета данного изменения Если ссылочный стандарт
Издание официальное
отменен без замены, то положение, в котором дана ссылка на него, рекомендуется применять в части, не затрагивающей эту ссылку
3 Термины и определения
В настоящем стандарте применены следующие термины с соответствующими определениями:
3.1 программа аудита (audit program): Совокупность одного или нескольких аудитов, запланированных на конкретный период времени и направленных на достижение конкретной цели (заимствовано из ГОСТ ISO 9000-201 1. п.3.9.2).
Примечание - Программа аудитов включает в себя всю деятельность, необходимую для планирования, организации и проведения аудитов
3.2 централизованные функции (centralized function): Функции системы менеджмента качества, применяемые к одной или нескольким производственным площадкам, но управляемые с одной производственной площадки (не обязательно с управляющей производственной площадки).
3.3 общие функции (common function): Функции системы менеджмента качества, которые установлены и применяются более, чем на одной производственной площадке.
3.4 управляющая производственная площадка (lead site): Производственная площадка с централизованной функцией, с помощью которой управляется система менеджмента качества применительно к производственным площадкам при условии непрерывного надзора и внутреннего аудита. Управляющая производственная площадка может потребовать у любой производственной площадки осуществления корректирующих мер. когда это необходимо. В случае необходимости это должно быть определено в официальном соглашении между управляющей производственной площадкой и другими производственными площадками.
3.5 изготовитель (manufacturer): Физическое или юридическое лицо, ответственное за проектирование. изготовление, упаковку и/или маркировку медицинского изделия, установку/монтаж или модификацию медицинского изделия перед введением его в обращение или вводом в эксплуатацию независимо от того, выполняет ли эти операции вышеупомянутое лицо или третья сторона от его имени (GHTF/SG1/N055).
3.6 изготовитель с несколькими производственными площадками (manufacturer with multiple sites): Изготовитель, который осуществляет деятельность в рамках одной и той же системы менеджмента качества на более чем одной производственной площадке.
3.7 производственная площадка (site): Место (идентифицированное одним адресом), где изготовитель осуществляет свою деятельность.
3.8 руководитель группы по аудиту (overall lead auditor): Аудитор, назначенный руководить аудитом (заимствовано из ГОСТ ISO 9000-2011. п.3.9.10. примечание 1).
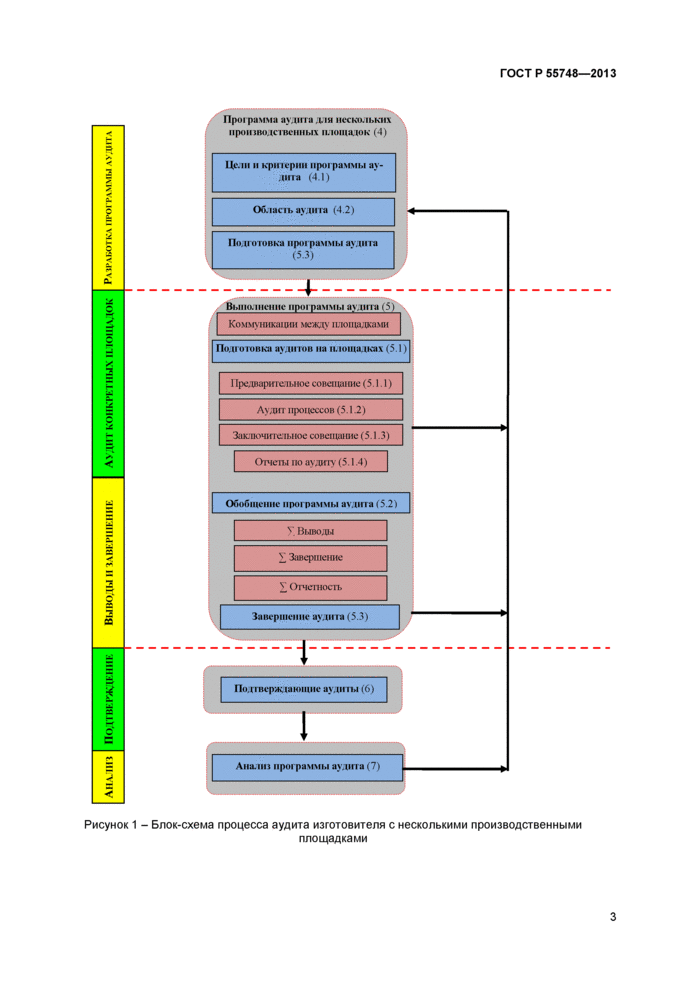
4 Программа аудита для изготовителей с несколькими производственными площадками
Аудиты нескольких производственных площадок применимы для изготовителей, чья деятельность подлежит аудиту, которые проводятся на разных производственных площадках и под руководством и контролем управляющей производственной площадки. В целях результативной координации деятельности по аудиту нескольких производственных площадок должна быть документально разработана программа аудита. При этом должен быть назначен главный аудитор.
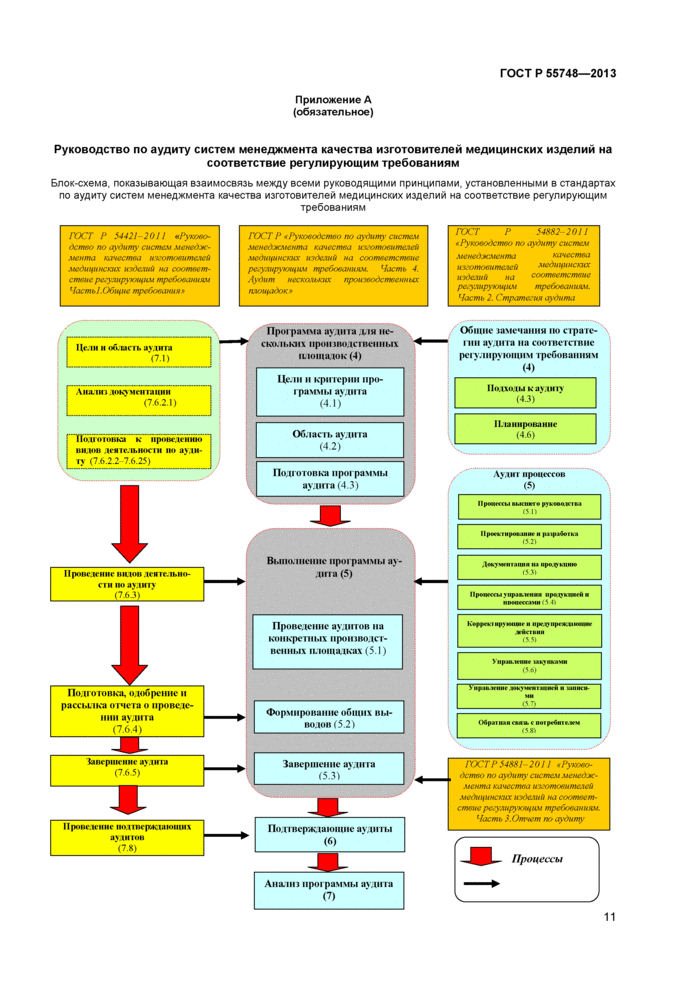
Настоящий стандарт дополняет ГОСТ Р 54421-201 1 (раздел 7) и ГОСТ Р 54882-2011 (п.п.4.3. 4.6 и раздел 5). связь между которыми приведена в приложении А.
2
All Villi ПОДТВКГ/КДКШ1К BlJKO.lN II lAliKPIIIKIIIIK АУДИТ KOlIkTKTIIIJX ПЛОЩАДОК I Рлтрлвотка ПРОГРАММЫ АУДИТА
11|>ш рамма аудита для нескольких НраИТВОДСТКСННЫХ ИЛОЩаДОК 14)
|
|
Цеди и крин-рни программы аудита (4.1) |
|
|
|
|
|
Область аудита (4.2) |
|
|
|
|
|
Подготовка npoi раммы av.niia
(5.3) |
----ГГДГГ--ГГ-
Bi.inaiiniiiu' iipoi раммы ауппа (3) Коммуникации между площадками
|
Под| отопка аудитов на площадках (5.1) |
|
|
|
|
|
11редваркгелыюе совещание (5 1.1) |
|
Аудит процессов (5.1.2) |
|
Заключнтс.тыюе совещание (5.1.3) |
|
|
Отмела но аудиту (5.1.4) |
|
|
|
Обобщение npoi раммы аудита (5.2) |
|
|
У Выводы |
Лна.1Н1 npoi раммы аудита (7)
Рисунок 1 - Блок-схема процесса аудита изготовителя с несколькими производственнымиплощадками
4.1 Цели и критерии программы аудита
Цели и критерии программы аудита нескольких производственных площадок должны быть определены таким образом, чтобы они демонстрировали соответствующий охват системы менеджмента качества изготовителя, (см. ГОСТ Р 54421-201 1. л.п.7.1 и 7.6.2). Программа аудита должна определять области взаимодействия площадок и распределение ответственности между различными производственными площадками, (см. ГОСТ Р 54421-2011, л.7.1).
4.1.1 Цели программы аудита
Программа аудита предназначена для:
определения соответствия системы менеджмента качества изготовителя применимым стандартам менеджмента качества и регулирующим требованиям. Правовые требования на разных площадках могут отличаться;
определения результативности внедренной системы менеджмента качества, избегая каждый раз избыточности аудитов централизованных функций;
определения возможностей изготовителя в результативном получении информации и анализа данных со всех производственных площадок, в том числе на управляющей производственной площадке, из таких источников, как анализ СМК со стороны руководства, жалобы, внутренние аудиты, корректирующие действия и т.д.
Для получения дополнительной информации о целях аудита см, ГОСТ Р 54421-2011, п.7.1.1.
4.1.2 Критерии программы аудита
Критерии программы аудита для нескольких производственных площадок должны включать: регулирующие требования, предъявляемые к управляющей производственной площадке и другим производственным площадкам;
качество процедур системы менеджмента качества, связанные с централизованными и общими функциями.
Для получения дополнительной информации по критериям аудита см. ГОСТ Р 54421-201 1, п.7.6.2.2.
4.2 Область аудита
Для того чтобы разработать программу аудита, которая подходит для всех площадок, в которых будут проведены аудиты, аудиторская организация должна получить достаточную информацию от изготовителя и определить:
систему менеджмента качества, подлежащую аудиту, включая производственные площадки. действующие в рамках этой системы менеджмента качества;
сложность и масштаб деятельности, охватываемой общей системой менеджмента качества.
лицо (лиц), ответственное(ых) за систему менеджмента качества; управляющую производственную площадку.
При определении взаимодействия и связи мехеду производственными площадками (в том числе управляющей производственной площадкой), а также деятельности конкретной производственной площадки и любых изменений на «местных» уровнях, следует, в том числе, обратить внимание: на совещания по анализу СМК со стороны руководства; деятельность, связанную с проведением внутреннего аудита; деятельность по проектированию: производственную деятельность (в том числе хранение); систему корректирующих и предупреждающих действий;
механизмы получения информации после ввода в обращение продукции и анализ данных;
оценку поставщиков;
систему управления документацией;
обратную связь с потребителем и анализ обратной связи.
Более подробная информация об аудите приведена в ГОСТ Р 54421-201 1, п.п. 7.1.2 и
7.6.2 2 и ГОСТ Р 54882-2011. п.4.6.
ГОСТ Р 55748-2013
4.3 Подготовка программы аудита
После того как в общей программе аудита были установлены цели и критерии, а система менеджмента качества, подлежащая аудиту, была охарактеризована, могут быть подготовлены и задокументированы программы аудита при общей координации со стороны главного аудитора.
4.3.1 Цели, критерии и область аудитов отдельных производственных площадок
В ГОСТ Р 54421. п.7.1 установлены руководящие принципы определения целей аудита, критерии и область аудита. Характеристика системы менеджмента качества, проверенной на предыдущих этапах, позволяет определить общий объём и сроки аудита, взаимодействие между площадками и виды деятельности при аудите. Объем индивидуальных аудитов производственных площадок должен быть определен на основе этой информации. Это не исключает комбинирование площадок и/или деятельности в конкретном аудите.
Как только объем каждого из индивидуальных аудитов производственных площадок установлен. критерии для каждого аудита могут быть разграничены. Критерии, вероятно, будут подмножеством общих критериев аудита.
Наконец, устанавливают цели аудита для индивидуальных аудитов производственных площадок. Цели должны включать:
проверку выполнения требований;
взаимодействие и результативность этого взаимодействия между производственными площадками (в том числе с управляющей производственной площадкой);
соответствие политики в области качества на всех производственных площадках.
Для получения дополнительной информации о целях аудита см. ГОСТ Р 54421-2011 п.
7.1.1.
4.3.2 Последовательность аудита
Последовательность (или порядок) аудитов, которые будут осуществлены в рамках программы аудита, должна быть заранее определена, исходя из необходимости оценки общих функций, а также их взаимосвязи. Общий используемый подход к проведению аудиту (например, «сверху вниз», сквозной. по технологической цепочке) будет оказывать значительное влияние на последовательность аудитов.
Программа аудита может сочетать несколько подходов к определению последовательности для аудита производственных ппощадок:
Управляющая производственная площадка, а затем другие производственные площадки
При таком подходе, аудиторская группа сначала проводит аудит управляющей производственной площадки (например, штаб-квартиры). После аудита управляющей производственной площадки будут проведены аудиты других производственных площадок. В зависимости от результатов аудита производственных площадок может возникнуть необходимость продолжения аудита на управляющей производственной площадке в рамках выполнения программы аудита.
Этот подход рекомендуется для первичной сертификации.
Производственные площадки, а затем управляющая производственная площадка
При таком подходе, аудиторская группа сначала проводит аудиты некоторых/ или всех производственных площадок, которые являются частью общей системы менеджмента качества После аудитов этих производственных площадок будет проведен аудит управляющей производственной площадки.
Этот подход рекомендуется, когда аудиторская группа хочет сосредоточиться на конкретном вопросе или процессе.
Одновременный аудит
При таком подходе различные аудиторские группы проводят аудит нескольких производственных площадок одновременно.
Такой подход может быть использован в особых случаях, когда требуется оперативный аудит системы менеджмента качества.
4.3.3 Определение потребности в ресурсах
Потребности в ресурсах для каждого отдельного аудита должны быть определены с учетом: роли главного аудитора в поддержании взаимосвязи; необходимой компетентности аудиторов; ответственности аудиторов;
количества человекодней аудита, требуемых на отдельную производственную площадку;
общих временных рамок для программы аудита;
необходимости привлечения технических экспертов и переводчиков;
требований к отчету по программе аудита.
5
Там. где это практически возможно, одна аудиторская группа должна проводить аудит всех производственных площадок для обеспечения преемственности. Когда это не представляется возможным. необходимо приложить усилия, чтобы один и тот же главный аудитор работал во всех аудиторских группах. Во время выполнения этих проверок регулярная связь между руководителями групп по аудиту может быть полезна для обеспечения согласованности в проведении аудита, а также для обнаружения потенциальных проблем и рисков среди производственных площадок.
Для получения дополнительной информации по определению компетенции аудиторской группы см. ГОСТ Р 54421-2011, п. 6.2.
4.3.4 Определение потребности в коммуникациях и отчетности
Аудиторская организация должна обеспечить непрерывность информации между аудиторскими группами в ходе аудита и на заключительном(ых) совещании(ях).
В рамках программы аудита должен быть разработан и задокументирован план коммуникаций. В плане коммуникаций следует принимать во внимание:
а) информацию, которую необходимо передавать между аудиторскими группами, осуществляющими аудит отдельных производственных площадок, а также руководством аудиторской организации, например:
1) подтверждение конкретной деятельности производственной площадки;
2) выводы аудита;
3) о ходе аудита:
4) о ресурсах, которые необходимы для будущих аудитов на основе текущих результатов;
b) связь в ходе индивидуальных аудитов производственных площадок и заключительного совещания(ий);
c) ограничение обсуждений с изготовителем конкретных результатов, отмеченных на каждой площадке во время осуществления аудита отдельных производственных площадок, без представления сводного заключения о соответствии системы менеджмента качества в целом;
d) подготовку и распространение индивидуальных и сводных отчетов;
e) анализ плана коммуникаций и его пересмотр по мере необходимости.
Результативное планирование коммуникаций обеспечивает решение ключевых проблем (например. взаимодействие между производственными площадками и т.д ). которые выявляются и решаются в ходе текущих и будущих аудитов.
Аудиторский(ие) отчет(ы) должен(ы) быть подготовлен(ы) в соответствии с рекомендациями, данными в ГОСТ Р 54881-201 1. Как минимум, отчет по программе аудита должен быть составлен таким образом, чтобы он включал оценку системы менеджмента качества в целом. Там. где производственные площадки, подвергающиеся аудиту, близки географически, функционально или объединены в одни временные рамки аудита, отчеты по этим аудитам могут быть объединены.
4.3.5 Завершение подготовки программы аудита
Программа аудита должна быть составлена таким образом, чтобы содержать всю вышеуказанную информацию и включать следующее:
- цели программы аудита, критерии и область аудита;
- последовательность аудитов:
- цели, область и критерии, а также ресурсы, необходимые для каждого индивидуального аудита;
план коммуникаций, включая требования к отчетности.
Подробности планов индивидуальных аудитов производственных площадок могут быть оставлены на усмотрение руководителя аудиторской группы или главного аудитора, если таковой имеется. Для дополнительной информации о планировании аудитов см. ГОСТ Р 54882-201 1. л. 4 6.
5 Выполнение программы аудита
В дополнение к видам деятельности по аудиту, установленным в ГОСТ Р 54421-201 1. л. 7.6, при проведении аудитов нескольких производственных площадок существует несколько ключевых факторов, требующих особого рассмотрения.
Как правило, более практично проводить аудит централизованных и общих функций, используя в первую очередь подход «сверху вниз».
Централизованные функции могут включать:
. логистическую систему (управление запасами, складирование, сбыт);
- закупки:
- работу с жалобами;
- документирование системы менеджмента качества (далее - СМК);
- информационно-технологические системы.
6
ГОСТ P 55748—2013
И наоборот, используя подход от продукта («снизу вверх»), можно нанести первый визит в проектный отдел, далее - на производство и в отдел сбыта.
Рекомендуется, чтобы промежуток между аудитами был как можно короче, чтобы информация и данные, полученные в разных местах, являлись актуальными и последовательными.
Аудиторские группы должны обмениваться отдельными наблюдениями, выявленными на других производственных площадках на соответствующих этапах в соответствии с программой аудита, (см. 4.3.4).
Основываясь на этих данных программы аудита следует пересматривать и изменять по мере необходимости.
Для конкретной производственной площадки и конкретной централизованной функции аудиторская группа должна:
оценить соответствие и результативность деятельности применительно к этой централизованной функции, за которую отвечает данная производственная площадка;
оценить соответствие и результативность процесса взаимосвязи с другими производственными площадками.
5.1 Аудит на конкретных производственных площадках
5.1.1 Предварительное совещание
Кроме того, как это определено в ГОСТ Р 54421-2011, л. 7.6.3.1, на совещании, посвященном началу аудита нескольких производственных площадок, необходимо учесть следующее: представить программу аудита для нескольких производственных площадок; объяснить, что аудит производственной площадки является одной из частей аудита нескольких производственных площадок;
подтвердить централизованные и общие функции;
• определить, кто является ответственным за функции, в том числе централизованные и общие.
5.1.2 Аудит подсистем
В дополнение к ГОСТ Р 54881-201 1 (раздел 5). следующие пункты могут служить в качестве руководства при аудите различных процессов менеджмента качества.
5.1.2.1 Подсистема высшего руководства
1) Определить, существуют ли какие-либо конкретные регулирующие требования, которые относятся к конкретной производственной площадке (производственные площадки, находящиеся в разных государствах/странах).
2) Убедиться, что связи между производственными площадками результативны.
3) Если совещания по анализу системы менеджмента качества со стороны руководства проводятся на корпоративном уровне, определить, как другие производственные площадки участвуют в формировании отчета по анализу системы менеджмента качества со стороны руководства.
4) Определить, кто присутствует на управляющей производственной площадке (и других производственных площадках) на совещаниях по анализу системы менеджмента качества со стороны руководства.
5) Определить, применяются ли при проведении внутренних аудитов специфические требования для каждой площадки. Если да. то следует установить, существует ли общий подход, используемый для всех производственных площадок.
6) Определить, является ли информация о результатах аудита доступной для всех производственных площадок.
5.1.2.2 Подсистема проектирования и разработки
1) Определить, на каких производственных площадках следуют одинаковым процедурам и методикам
2) Определить, как проекты передаются от подразделения, осуществляющего разработку проекта, на производственные площадки, осуществляющие производство
3) Убедиться, осуществляется ли разработка одной и той же продукции на нескольких производственная площадках Если да. то определить, как координируется эта деятельность и находится ли она под контролем.
5.1.2.3 Подсистема технической документации
1) Убедиться, что договоренности между производственными площадками для досту-па/управления документацией являются достаточными.
2) Убедиться, что управление изменениями документировано и является достаточным.
5.1.2.4 Подсистема производства и управления процессами
7