ГОСТ ISO 11607-1-2018
Упаковка для медицинских изделий, подлежащих финишной стерилизации. Часть 1. Требования к материалам, барьерным системам для стерилизации и упаковочным системам
Устанавливает требования к материалам, предварительно отформованным барьерным системам для стерилизации, барьерным системам для стерилизации и упаковочным системам, предназначенным для финишной стерилизации медицинских изделий до того, как они будут доставлены к месту их использования, а также описывает методы испытаний. Стандарт применяется для упаковывания медицинских изделий, подвергаемых финишной стерилизации как в промышленных условиях, так и в медицинских учреждениях, а также при стерилизации медицинских изделий непосредственно в барьерных системах. Настоящий стандарт не применим к упаковочным материалам и/или системам, внутри которых находятся контаминированные медицинские изделия в процессе их транспортирования до места повторной обработки или утилизации. Настоящий стандарт не распространяется на барьерные системы и упаковочные системы для медицинских изделий, которые изготовлены асептическим способом. Также может возникнуть необходимость в дополнительных требованиях к упаковке комплекса лекарство/изделие.
- Заменяет ГОСТ ISO 11607-2011 «Упаковка для медицинских изделий, подлежащих финишной стерилизации. Общие требования» ИУС 11-2018
Идентичен ISO 11607-1:2006
Оглавление
1 Область применения
2 Нормативные ссылки
3 Термины и определения
4 Общие требования
4.1 Общие условия
4.2 Системы качества
4.3 Отбор проб
4.4 Методы испытания
4.5 Документация
5 Материалы и предварительно отформованные барьерные системы для стерилизации
5.1 Общие требования
5.2 Свойства микробного барьера
5.3 Совместимость с процессом стерилизации
5.4 Совместимость с системой маркировки
5.5 Хранение и транспортирование
6 Конструктивные требования и требования к разработке упаковочных систем
6.1 Общие требования
6.2 Конструкция
6.3 Эксплуатационные испытания упаковочной системы
6.4 Испытание на стабильность характеристик
7 Предоставляемая информация
Приложение А (справочное) Руководство по упаковке медицинских изделий
Приложение В (справочное) Стандартные методы испытаний и процедуры, которые могут применять для демонстрации соответствия требованиям настоящего стандарта
Приложение С (обязательное) Метод испытания для определения сопротивления непроницаемых материалов прохождению воздуха
Приложение ДА (справочное) Сведения о соответствии ссылочных международных стандартов ссылочным межгосударственным стандартам
Библиография
34 страницы
| Дата введения | 01.04.2019 |
|---|---|
| Добавлен в базу | 01.01.2019 |
| Актуализация | 01.01.2021 |
Этот ГОСТ находится в:
- Раздел Экология
- Раздел 11 ЗДРАВООХРАНЕНИЕ
- Раздел Электроэнергия
- Раздел 11 ЗДРАВООХРАНЕНИЕ
Организации:
| 27.06.2018 | Утвержден | Межгосударственный Совет по стандартизации, метрологии и сертификации | 53-2018 |
|---|---|---|---|
| 30.08.2018 | Утвержден | Федеральное агентство по техническому регулированию и метрологии | 546-ст |
| Разработан | ФГУП СТАНДАРТИНФОРМ | ||
| Разработан | ООО Дюпон Наука и Технологии | ||
| Издан | Стандартинформ | 2018 г. |
Packaging for terminally sterilized medical devices. Part 1. Requirements for materials, sterile barrier systems and packaging systems
Чтобы бесплатно скачать этот документ в формате PDF, поддержите наш сайт и нажмите кнопку:

стр. 1

стр. 2

стр. 3

стр. 4

стр. 5

стр. 6

стр. 7

стр. 8

стр. 9

стр. 10

стр. 11

стр. 12

стр. 13

стр. 14

стр. 15

стр. 16

стр. 17

стр. 18
стр. 19
стр. 20
стр. 21
стр. 22
стр. 23
стр. 24
стр. 25
стр. 26
стр. 27

стр. 28

стр. 29

стр. 30
МЕЖГОСУДАРСТВЕННЫЙ СОВЕТ ПО СТАНДАРТИЗАЦИИ, МЕТРОЛОГИИ И СЕРТИФИКАЦИИ
(МГС)
INTERSTATE COUNCIL FOR STANDARDIZATION, METROLOGY AND CERTIFICATION
(ISC)
МЕЖГОСУДАРСТВЕННЫЙ
СТАНДАРТ
ГОСТ
ISO 11607-1— 2018
УПАКОВКА ДЛЯ МЕДИЦИНСКИХ ИЗДЕЛИЙ, ПОДЛЕЖАЩИХ ФИНИШНОЙ СТЕРИЛИЗАЦИИ
Часть 1
Требования к материалам, барьерным системам для стерилизации и упаковочным системам
(ISO 11607-1:2006+Amd.1:2014, IDT)
Издание официальное
|
Москва Стандартинформ 2018 |
Предисловие
Цели, основные принципы и основной порядок проведения работ по межгосударственной стандартизации установлены в ГОСТ 1.0-2015 «Межгосударственная система стандартизации. Основные положения» и ГОСТ 1.2-2015 «Межгосударственная система стандартизации. Стандарты межгосударственные, правила и рекомендации по межгосударственной стандартизации. Правила разработки, принятия, обновления и отмены»
Сведения о стандарте
1 ПОДГОТОВЛЕН Обществом с ограниченной ответственностью «Дюпон Наука и Технологии» (ООО «Дюпон Наука и Технологии») на основе официального перевода на русский язык англоязычной версии указанного в пункте 5 стандарта, который выполнен ФГУП «СТАНДАРТИНФОРМ»
2 ВНЕСЕН Федеральным агентством по техническому регулированию и метрологии
3 ПРИНЯТ Межгосударственным советом по стандартизации, метрологии и сертификации (протокол от 27 июня 2018 г. № 53-2018)
За принятие проголосовали:
|
Краткое наименование страны по МК (ИСО 3166) 004—97 |
Код страны по МК (ИСО 3166) 004—97 |
Сокращенное наименование национального органа по стандартизации |
|
Беларусь |
BY |
Госстандарт Республики Беларусь |
|
Казахстан |
KZ |
Госстандарт Республики Казахстан |
|
Россия |
RU |
Росстандарт |
|
Таджикистан |
TJ |
Таджикстандарт |
4 Приказом Федерального агентства по техническому регулированию и метрологии от 30 августа 2018 г. № 546-ст межгосударственный стандарт ГОСТ ISO 11607-1-2018 введен в действие в качестве национального стандарта Российской Федерации с 1 апреля 2019 г.
5 Настоящий стандарт идентичен международному стандарту ISO 11607-1:2006 «Упаковка для медицинских изделий, подлежащих финишной стерилизации. Часть 1. Требования к материалам, барьерным системам для стерилизации и упаковочным системам» («Packaging for terminally sterilized medical devices. Part 1. Requirements for materials, sterile barrier systems and packaging systems», IDT), включая изменение Amd.1:2014.
Изменения к настоящему стандарту, принятые после его официальной публикации, внесены в текст настоящего стандарта и выделены двойной вертикальной линией, расположенной на полях от соответствующего текста, а обозначение и год принятия изменения приведены в скобках после соответствующего текста.
Международный стандарт разработан Техническим комитетом ISO/TC 198 «Стерилизация медицинских изделий» Международной организации по стандартизации (ISO).
Официальные экземпляры международного стандарта, на основе которого подготовлен настоящий стандарт, и международные стандарты, на которые даны ссылки, имеются в Федеральном информационном фонде стандартов.
При применении настоящего стандарта рекомендуется использовать вместо ссылочных международных стандартов соответствующие им межгосударственные стандарты, сведения о которых приведены в дополнительном приложении ДА
6 ВЗАМЕН ГОСТ ISO 11607-2011
a) совместимость этих условий с предполагаемым использованием материала и/или барьерной системы для стерилизации;
b) сохранение эксплуатационных характеристик материала и/или барьерной системы для стерилизации.
5.1.4 Как минимум необходимо учитывать следующее:
a) температурный диапазон;
b) диапазон давления;
c) диапазон влажности;
d) максимальную скорость изменения вышеперечисленного, при возможности;
e) воздействие солнечного света или ультрафиолетового излучения;
f) чистоту;
д) бионагрузку;
h) электростатическую проводимость.
5.1.5 Источник, история и прослеживаемость всех материалов, особенно переработанных, должны быть известны и проконтролированы, чтобы гарантировать, что конечный продукт будет соответствовать требованиям настоящего стандарта.
Примечание — При действующих технологиях маловероятно, что в переработанных материалах может использоваться что-то другое кроме первичных производственных отходов, так как недостаточный контроль не позволяет безопасно применять другой переработанный материал в барьерных системах.
5.1.6 Необходимо оценить следующие свойства материала:
a) микробный барьер (см. 5.2);
b) биосовместимость и токсикологические признаки.
Примечание — Это обычно относится к материалам, находящимся в контакте с изделием. Руководство по биосовместимости дано в ISO 10993-1.
Необходимо оценить влияние стерилизации на биосовместимость;
c) физические и химические свойства;
d) совместимость с процессами формирования и склеивания;
е) совместимость с установленными процессами стерилизации (см. 5.3);
f) любые ограничения сроков годности при хранении до и после стерилизации.
5.1.7 Материалы, например оберточные, бумага, полимерная пленка, нетканый материал или многократно используемый волокнистый материал, должны соответствовать следующим общим требованиям:
a) материалы должны быть невыщелачивающимися и не иметь запаха в установленных условиях применения и в такой степени, чтобы это не повлияло ни на их характеристики, ни на их безопасность. Они также не должны негативно воздействовать на медицинские изделия, с которыми они контактируют.
Примечание — Для определения запаха не требуется применение стандартизованного метода испытания, так как неприятные запахи можно почувствовать;
b) в материалах не должно быть дыр, трещин, разрывов, морщин, складок или локализованных утолщений и/или утончений, способных ухудшить их функционирование;
c) плотность материалов (масса на единицу площади) должна соответствовать заданному значению;
d) материалы должны обнаруживать приемлемые уровни чистоты, наличие твердыхчастиц и пуха;
e) материалы должны соответствовать требованиям к заданным удельным или минимальным физическим свойствам, таким как прочность на растяжение, отклонение по толщине, сопротивление разрыву, воздухопроницаемость и прочность на продавливание;
f) материалы должны соответствовать заданным химическим свойствам (таким как величина pH, содержание хлоридов и сульфатов), чтобы удовлетворять требованиям, установленным к медицинским изделиям, упаковочным системам или процессам стерилизации;
д) материалы не должны содержать или выделять в достаточном количестве вещества, которые считаются токсичными и могут наносить вред здоровью до, в процессе или после стерилизации в условиях их применения.
5.1.8 В дополнение к требованиям, указанным в 5.1.1—5.1.7, материалы с адгезионным слоем должны соответствовать нижеперечисленным требованиям:
а) структура адгезионного слоя должна быть непрерывной, без пропусков и разрывов, которые могут быть причиной дефектов склеивания;
6
ГОСТ ISO 11607-1-2018
b) плотность нанесения клея должна соответствовать установленному значению;
c) материалы должны продемонстрировать минимальную установленную прочность клеевого слоя при склеивании с другим материалом в заданных условиях.
5.1.9 В дополнение к требованиям, указанным в 5.1.1—5.1.7 и, в случае применимости, 5.1.8, барьерные системы для стерилизации и отформованные барьерные системы должны соответствовать нижеприведенным требованиям:
a) материалы и компоненты, например покрытия, красящие или химические индикаторы, не должны негативно влиять на медицинское изделие в результате реакции, загрязнения и/или переноса до, во время или после процесса стерилизации;
b) при формировании склеиванием должны быть соблюдены требования к ширине и прочности клеевого слоя (прочность на разрыв и/или продавливание);
c) отслаивание упаковочного слоя при открывании упаковки должно быть непрерывным и однородным, без расслоения или разрыва материала, способного ухудшить асептические свойства упаковки и их представление при открывании.
Примечание 1 — Помимо требований к конструкции и форме бумажных пакетов и термосвариваемых саше и рулонов должны соблюдать требования, предъявляемые к их характеристикам.
Примечание 2 — Соблюдение максимальной прочности клеевого слоя может быть необходимо, если клеевые соединения будут открывать для презентации асептических свойств;
d) клеевые соединения и/или укупорочные средства должны обеспечивать барьер от проникновения микроорганизмов.
5.1.10 В дополнение к требованиям, указанным в 5.1.1—5.1.7, многоразовые упаковки должны соответствовать нижеприведенным требованиям:
a) каждая упаковка должна быть снабжена системой защиты от вскрытия, которая четко указывает на нарушение целостности укупорочного средства;
b) место прохождения стерилизующего агента должно обеспечивать барьер от проникновения микроорганизмов при выгрузке упаковки из стерилизатора, транспортировании и хранении (см. 5.2);
c) после формирования барьерной системы для стерилизации укупорочное средство должно обеспечивать барьер от проникновения микроорганизмов;
d) конструкция упаковки должна облегчить осмотр всех значимых частей;
e) перед каждым последующим применением необходимо установить критерии приемки для проведения визуального осмотра.
Примечание 1 — Помимо визуального контроля, являющегося наиболее общей процедурой, могут быть использованы и другие методы приемки;
f) отдельные компоненты упаковки одной модели должны быть или полностью взаимозаменяемы, или иметь конструкцию, в которой замена компонентов не предусмотрена.
Примечание 2 — Это требование к конструкции должно быть обозначено кодом или на ярлыке;
д) изготовитель должен указать методики обслуживания, чистки и способ контроля, текущего ремонта и замены компонентов.
Примечание 3 — Дополнительные руководства по применению многоразовой упаковки приведены в EN 868-8.
5.1.11 В дополнение к требованиям, указанным в 5.1.1—5.1.7 и, если применимо, в 5.1.8, многоразовые волокнистые материалы должны соответствовать нижеприведенным требованиям:
a) после восстановления материала и после каждого цикла стерилизации должны быть соблюдены требования к эксплуатационным характеристикам;
b) должны быть установлены и документально оформлены способы обработки с целью промывки и очистки.
Примечание — Это может быть визуальный контроль, другие методы испытания и критерии приемки упаковки для повторного применения;
c) способы обработки должны соответствовать тем, которые указаны на этикетке.
5.1.12 Для многоразовых барьерных систем, включая упаковки и волокнистые материалы, следует определить, ведет ли обработка в соответствии с указанными инструкциями к порче системы, что может ограничить срок ее полезного использования. В тех случаях, когда порча предсказуема, количество
7
циклов повторной обработки, которые может выдержать система, должно быть заявлено на этикетке продукта, или необходимо указать конец срока полезного использования.
5.2 Свойства микробного барьера
5.2.1 Непроницаемость материала следует определять в соответствии с приложением С.
Примечание — Свойства микробного барьера упаковочных материалов, применяемых в конструкции барьерных систем для стерилизации, являются очень важными для обеспечения целостности и безопасности продукта. Методы оценки свойств микробного барьера подразделяют на две категории: те, которые подходят для непроницаемых материалов, и те, которые подходят для пористых материалов.
5.2.2 Демонстрация непроницаемости материала должна удовлетворять требованию, предъявляемому к микробному барьеру.
5.2.3 Пористые материалы должны создавать достаточный микробный барьер от проникновения микроорганизмов, чтобы гарантировать целостность барьерной системы для стерилизации и безопасность продукта.
Примечание — Не существует универсального метода подтверждения свойств микробного барьера. Оценку свойств микробного барьера пористых материалов, как правило, проводят, подвергая образцы заражению спорами бактерий или микрочастиц из аэрозоля, при некоторой совокупности условий испытания, включающих скорость потока через материал, микробное заражение образца и продолжительность испытания. Свойства микробного барьера при заданных условиях определяют сравнением степени проникания бактерий или микрочастиц сквозь материал с первоначальным загрязнением. Данные валидированного метода физических испытаний, сопоставляемые с данными валидированного метода микробиологического заражения, считаются приемлемыми для определения свойств микробного барьера. Так как валидированные методы микробного заражения материалов и барьерных систем становятся доступными, они будут рассмотрены с целью включения в последующие редакции настоящего стандарта (за более подробной информацией обращайтесь к Sinclair и Tallentire 2002 [41], Tallentire и Sinclair 1998 [40], Scholia et. al 1995 [39] и Scholia et al. 2000 [38]).
5.3 Совместимость с процессом стерилизации
5.3.1 Необходимо продемонстрировать, что материалы и отформованные барьерные системы годятся для использования в процессе(ах) стерилизации и соответствуют параметрам цикла.
5.3.2 Совместимость стерилизации с процессом следует определять, используя стерилизатор, который спроектирован, сконструирован и работает в соответствии с требованиями определенных международных или европейских стандартов.
Примечание — Например, см. ISO 17665-1, ISO 11135, ISO 11137 (все части), ISO 14937; EN 285, EN 1422 или EN 14180. В настоящее время предпринимаются усилия по гармонизации этих международных и европейских стандартов.
(Изменение № 1,2014)
5.3.3 Необходимо оценить характеристики материалов, чтобы гарантировать их соответствие заданным пределам после того, как они были подвергнуты всем процессам стерилизации.
5.3.4 Процессы стерилизации могут включать многократное воздействие на систему одного и того же или разных процессов стерилизации.
5.3.5 При определении пригодности согласно установленному применению рассматривают материалы разного типа, которые имеются в наличии для текущих поставок.
5.3.6 Если упаковка продукта представляет собой сверток или упаковка многослойна, могут быть установлены разные пределы свойств материала для внутренних и внешних слоев.
5.3.7 Определение пригодности можно проводить одновременно с валидацией процессов стерилизации.
5.4 Совместимость с системой маркировки
Система маркировки должна:
a) оставаться неповрежденной и удобочитаемой до доставки упаковки к месту использования;
b) быть совместима с материалами, барьерной системой и медицинским изделием во время и после процессов стерилизации, соответствовать параметрам цикла и не должна оказывать негативного влияния на процесс стерилизации;
c) красители на отпечатанных или написанных этикетках не должны проникать в медицинское изделие или вступать в реакцию с упаковочным материалом и/или системой, не должны ухудшать ка-8
ГОСТ ISO 11607-1-2018
чество упаковочного материала и/или системы, а также изменять цвет до такой степени, чтобы было невозможно прочитать текст.
Примечание — Системы маркировки могут иметь разные формы, включая печать или надпись непосредственно на материале и/или барьерной системе, или этикетку, состоящую из другого слоя материала, прикрепляемого к поверхности материала и/или системы путем приклеивания, плавления или иным способом.
5.5 Хранение и транспортирование
5.5.1 Материалы и отформованные барьерные системы для стерилизации должны быть упакованы таким образом, чтобы обеспечить их защиту для сохранения эксплуатационных характеристик при транспортировании и хранении.
5.5.2 Материалы и отформованные барьерные системы подлежат транспортированию и хранению в таких условиях, которые гарантируют неизменность эксплуатационных характеристик в допустимых пределах (см. 5.1).
Этого можно достичь:
a) подтверждением сохранения характеристик в определенных изготовителем условиях хранения;
b) поддержанием условий хранения в заданных пределах.
6 Конструктивные требования и требования к разработке упаковочных систем
6.1 Общие требования
6.1.1 Упаковочная система должна иметь такую конструкцию, которая позволит минимизировать угрозу безопасности пользователя и пациента в специально предназначенных для этого условиях пользования.
6.1.2 Упаковочная система должна обеспечивать физическую защиту и сохранять целостность барьерной системы для стерилизации.
6.1.3 Барьерная система должна давать возможность стерилизовать продукт и быть совместимой с выбранными процессами стерилизации.
6.1.4 Барьерная система должна обеспечивать стерильность продукта вплоть до места ее использования или до истечения срока годности.
Примечание — См. также 6.4.1.
6.1.5 Целостность барьерной системы можно использовать как подтверждение сохранения стерильности продукта.
Примечание — См. ANSI/AAMI ST65:2008 и Hansen et al. 1995 [35]. Потеря стерильности финишной упаковки обусловлена воздействием событий, а не влиянием времени.
(Изменение № 1,2014)
6.1.6 Если для аналогичных медицинских изделий использована одна и та же упаковочная система, следует документально оформить обоснование для установления сходства и идентификации конфигурации упаковки при наихудших допустимых условиях применения. Как минимум следует использовать конфигурацию при наихудших допустимых условиях, чтобы определить соответствие настоящему стандарту.
Примечание — Например, сходство может быть установлено по разным размерам одного и того же продукта.
6.2 Конструкция
6.2.1 Следует документально оформить процедуры по конструированию и разработке упаковочных систем.
6.2.2 Барьерная система должна гарантировать предъявление продукта в асептическом виде.
6.2.3 При конструировании и разработке упаковочной системы учитывают многие факторы, но не ограничиваются только ими:
a) требования потребителя;
b) масса и конфигурация продукта;
c) наличие острых кромок или выступов;
d) потребность в физической или иной защите;
9
e) чувствительность продукта к конкретным опасностям, например к воздействию радиации, влаги, механическому удару, статическому разряду;
f) количество продуктов на упаковочную систему;
д) требования к маркировке упаковки;
h) ограничения, связанные с окружающей средой;
i) ограничения по сроку годности продукта;
j) среда распространения, обращения и хранения;
k) совместимость со стерилизацией и остаточные явления.
6.2.4 Необходимо идентифицировать и определить компоненты продукта и конструкции, составляющие укупорочное средство в сборе для прохождения потока жидкости. К ним относятся, но не ограничиваются только ими:
- материалы;
- отделочное покрытие;
- размеры компонентов;
- сборочные размеры (например, допуски на посадку с натягом).
6.2.5 Результаты процесса конструирования и разработки (см. 6.2.1, 6.2.3 и 6.2.4) должны быть зафиксированы, верифицированы и одобрены до запуска продукта в производство.
6.3 Эксплуатационные испытания упаковочной системы
6.3.1 Целостность барьерной системы должна быть продемонстрирована после стерилизации и последующих эксплуатационных испытаний.
6.3.2 Физические испытания совместно с испытанием свойств микробного барьера пористых упаковочных материалов могут применять для определения способности барьерной системы для стерилизации сохранять стерильность.
Примечание — Более подробную информацию по данной теме можно получить в документах ANSI/ AAMI ST65:2008 and Hansen et al. 1995 [35].
(Изменение № 1,2014)
6.3.3 Стандартные методы испытаний для оценки целостности барьерной системы более предпочтительны. Однако в отсутствие применимых валидированных методов испытания целостности барьерной системы рабочие характеристики микробного барьера могут быть установлены по результатам испытания свойств материалов для микробного барьера и целостности клеевых соединений и укупорочных средств.
6.3.4 Эксплуатационные испытания должны проводить на барьерной системе, применяемой в наихудших условиях, которая изготовлена в заданных производственных пределах формирования и склеивания упаковки и после воздействия на нее всех установленных процессов стерилизации.
Примечание — К установленным процессам стерилизации можно относить многократное воздействие одних и тех же или разных процессов стерилизации.
6.3.5 Упаковочная система должна обеспечивать адекватную защиту продукта от опасностей, возникающих при обращении с ним, транспортировании и хранении.
6.4 Испытание на стабильность характеристик
6.4.1 Испытание на стабильность характеристик должно продемонстрировать, что со временем барьерная система продолжает сохранять свою целостность.
6.4.2 Испытание на стабильность характеристик проводят, применяя процесс старения в реальном времени.
6.4.3 Испытание на стабильность характеристик с применением протоколов ускоренного старения необходимо рассматривать в качестве достаточного доказательства заявленного срока годности, пока не будут получены данные исследований процесса старения в реальном времени.
6.4.4 Испытание на старение в реальном времени и ускоренное старение следует проводить одновременно.
Примечание — Испытание на старение и эксплуатационные испытания — это самостоятельные испытания. При эксплуатационных испытаниях оценивают взаимодействие между упаковочной системой и продуктами в ответ на нагрузку, перенесенную в процессе производства и стерилизации, а также в результате обращения, хранения и поставки.
ГОСТ ISO 11607-1-2018
6.4.5 Если срок годности установлен на основе характеристик продукта, испытание на стабильность характеристик для определения этого срока следует проводить вместе с испытанием на стабильность характеристик упаковки.
6.4.6 При проведении испытаний на ускоренное старение необходимо дать документированное обоснование условий ускоренного старения и определить продолжительность выбранного метода испытания.
6.4.7 В случае подтверждения, что с течением времени продукт не вступает во взаимодействие с конкретной барьерной системой для стерилизации, ранее документально оформленных данных для испытания на стабильность характеристик будет достаточно для установления соответствия с 6.4.1.
7 Предоставляемая информация
7.1 В отношении материала, отформованной барьерной системы или барьерной системы для стерилизации следует предоставлять следующие данные:
- название или торговое наименование и адрес производителя или его уполномоченного представителя;
- тип, размер или марка;
- номер партии или другие средства прослеживаемости истории производства;
- предполагаемый(е) процесс(ы) стерилизации;
- срок годности, где это применимо;
- любые особые условия хранения, где это применимо;
- любые известные ограничения по обращению или использованию (например, условия окружающей среды), где это применимо;
- частота и характер технического обслуживания для материалов многоразового использования и/или отформованных барьерных систем;
- предназначены ли материалы и/или предварительно сформированная стерильная барьерная система для однократного или многократного использования;
- если в комплекте поставляются инструкции по применению, то в них должна быть указана дата выпуска или дата последних изменений.
(Изменение № 1,2014)
7.2 Если в соответствии с национальным или региональным законодательством требуется предоставление дополнительной информации относительно материалов, предварительно сформированной стерильной барьерной системы или стерильной барьерной системы, поставляемых на рынок медицинских услуг, то такая информация должна быть предоставлена.
(Изменение № 1,2014)
11
Приложение А (справочное)
Руководство по упаковке медицинских изделий
А.1 Факторы, влияющие на выбор материалов и конструкцию упаковочной системы
Особый характер медицинского изделия, намеченные методы стерилизации, предполагаемое использование, срок годности, транспортирование и хранение — все влияет на конструкцию упаковочной системы и выбор материала. На выбор соответствующих материалов для упаковочных систем, предназначенных для финишной стерилизации медицинских изделий, влияют взаимосвязи, приведенные на рисунке А. 1.
Рисунок А.1 — Взаимосвязи, влияющие на выбор соответствующих материалов для упаковочных систем, предназначенных для финишной стерилизации медицинских изделий
А.2 Процессы стерилизации и их анализ
А.2.1 Выбор процессов стерилизации включает, но не ограничивается только этим, этиленоксид (ЕО), гамма-облучение (у), электронный луч (е-пучок), пар и низкотемпературные окислительные процессы стерилизации. Если изделие предполагается стерилизовать этиленоксидом, паром или путем окислительных процессов, то для этого в барьерной системе имеется проницаемый компонент, который пропускает убивающие микроорганизмы, стерилизующие газы, которые затем выходят без значительных остаточных концентраций.
А.2.2 Если изделие предполагается стерилизовать облучением (у или е-пучком), проницаемый компонент может не понадобиться и барьерная система может быть изготовлена из полностью непроницаемых материалов. Изготовитель выбирает подходящие процессы стерилизации для каждого медицинского изделия, и их выбор зависит от нескольких факторов. Если изделие изготовлено из материалов, которые неустойчивы к облучению, то, как правило, применяют этиленоксид, пар и окислительные агенты. Альтернативно, если изделие имеет тенденцию накапливать высокие остаточные концентрации этиленоксида, то изготовитель изделия может выбрать процесс облучения.
А.З Барьерные системы для стерилизации
А.3.1 Барьерные системы для стерилизации медицинских изделий могут иметь много общих характеристик. Большинство имеют верхнюю и нижнюю перегородки и средства их соединения. В том случае, когда требуется легко отслаивающееся соединение, наносят клеящий герметик, позволяющий с помощью термоскпеивания соединять два слоя. Клеящий герметик, более известный как покрытие, традиционно наносят на проницаемую перегородку. В настоящее время многие пленки содержат клеящий герметик в качестве слоя(ев) пленочной конструкции. Там, где требуется сварное соединение, необходимо определить совместимость перегородок, что позволит проводить термоскпеивание или использовать другие методы, такие как ультразвуковая сварка.
А.З.2 Существуют много типов и видов барьерных систем для стерилизации, применяемых для упаковки стерильных медицинских изделий. Первый тип — это предварительно отформованный жесткий лоток со штампованной крышкой. Как правило, для формирования лотка применяют метод высокотемпературного формообразования или штамповку. Штампованная крышка может быть проницаемой или непроницаемой, а для термоскпеивания крышки с лотком имеется клеящий герметик.
Жесткие лотки со штампованной крышкой обычно применяются для тяжелых изделий большого профиля, таких как ортопедические имплантаты и кардиостимуляторы, а также комплекты хирургических инструментов.
А.3.3 Второй тип — это гибкие расслаивающиеся саше. Саше, как правило, состоит из пленки с одной стороны и пленки, бумаги или нетканого полотна с другой. Саше обычно поставляют в виде предварительно отформованных барьерных систем для стерилизации, в которых все клеевые швы уже заделаны, за исключением одного (обычно на дне). Он остается открытым, чтобы изделие можно было положить внутрь, и затем перед стерилизацией шов заделывают окончательно. Для огромного количества различных медицинских изделий саше исполь-
зуют в качестве барьерной системы для стерилизации, так как они выпускаются разных размеров. Обычно такие медицинские изделия легкие и имеют небольшой профиль. Саше могут поставлять с разными конструктивными деталями. (Например, они могут иметь боковые и донные складки для упаковки высоких профильных изделий.)
А.3.4 Третий тип — это пакеты для стерилизации. Пакет сконструирован из ординарного полотна пористой бумаги медицинского назначения, сложенного таким образом, чтобы получился длинный сверток с боковыми складками или без них. Сверток склеивают по всей длине двойным клеевым швом. Затем сверток отрезают до нужного размера и один конец запечатывают, наложив один шов или более. Для усиления укупорочного средства можно еще несколько раз свернуть пакет. Открытый конец обычно имеет язычок или вырез для захвата пальцами, чтобы пакет можно было легко открыть. Перед стерилизацией пакеты запечатывают окончательно.
А.3.5 К четвертому типу относится пакет, запечатываемый с помощью перегибаемой пополам этикетки. Первоначально пакет изготовлен с помощью сварного соединения двух непроницаемых, но совместимых пленочных полотен. Одно из полотен обычно смещено на несколько сантиметров. Вдоль этой смещенной области проводят термоскпеивание проницаемого материала с клеем. Впоследствии этот проницаемый материал может быть снят путем отслаивания, обеспечив доступ внутрь пакета. Пакет, запечатываемый с помощью этикетки, перегибаемой пополам, широко используют для громоздких изделий, таких как медицинские инструменты.
А.3.6 Пятый тип представляет собой процесс, известный как непрерывный способ упаковывания. Барьерные системы, изготовленные таким способом, могут выглядеть как саше, жесткие лотки с крышками или иметь мягкое пленочное тянутое или профилированное нижнее полотно на дне. При непрерывном способе упаковывания материалы для верхней и нижней перегородки помещают в фасовочно-укупорочную машину. Машина производит барьерную систему, формируя нижнее полотно, заполняет форму медицинским изделием, прикрывает верхним полотном и запечатывает барьерную систему.
А.3.7 Шестой тип — четырехстороннее сваривание. Это непрерывный процесс упаковывания, как упаковывание «флоу-пак». Для этого способа применяют ротационное оборудование для запечатывания. В процессе четырехстороннего сваривания нижнее и верхнее полотно помещают в машину. Изделие кладут на нижнее полотно. Накрывают верхним полотном и затем запечатывают с четырех сторон. Четырехстороннее сваривание применяется, например, для упаковывания перчаток и изделий для обработки ран.
А.3.8 Приведенный выше перечень барьерных систем для стерилизации является неполным. В качестве барьерных систем могут использовать и другие конструкции.
А.3.9 Для медицинских изделий со стерильным проводником жидкости могут применяться уникальные упаковочные системы для стерильных проводников жидкости, непосредственно присоединяемых к местам доступа к устройству. В их состав входят колпачки, пробки, крышки или средства укупорки иных конструкций для специальных устройств. В этих случаях первичный слой упаковки продукта может быть представлен одним из четырех видов упаковывания, описанных выше, но при этом не требуется обеспечение микробного барьера изделий.
А.3.10 В медицинских учреждениях обычно применяют барьерные системы для стерилизации в форме саше, рулонов, бумажных пакетов, стерилизационных свертков или многоразовых контейнеров.
А.3.11 Стерилизационные свертки применяют для обеспечения барьерной системы для многих изделий, подвергаемых стерилизации в медицинских учреждениях. Применяемый вместо термоскпеивания или клеящего шва способ свертывания и скручивания позволяет образовать извилистый канал, обеспечивающий стерильность. Как правило, изделия перед завертыванием и последующей стерилизацией находятся в формованном лотке для инструментов.
А.3.12 Многоразовые контейнеры изготавливают из металла или синтетических полимерных материалов, способных выдерживать многократное воздействие циклов стерилизации в больничных условиях. Эти контейнеры обычно имеют пригнанные верхние и нижние поверхности с прокладкой, обеспечивающей непроницаемый шов между двумя частями. Система вентиляции позволяет стерилизующему агенту поступать в контейнер и выходить из него. Конструкция вентиляционной системы и материалы, обеспечивающие микробную фильтрацию, могут изменяться. Изделия, стерилизуемые в контейнерах, могут подвергать предварительному кондиционированию или более длительному по времени воздействию стерилизующего агента, чтобы гарантировать завершение процесса стерилизации.
А.3.13 Финишная стерилизация и сохранение стерильности имеют большое значение для безопасности пациента независимо от оборудования, с помощью которого проводятся эти процессы. Настоящий стандарт содержит минимум требований к использованию упаковочных систем, которые обеспечивают соответствующие барьерные системы для стерилизации.
13
Приложение В (справочное)
Стандартные методы испытаний и процедуры, которые могут применять для демонстрации соответствия требованиям настоящего стандарта
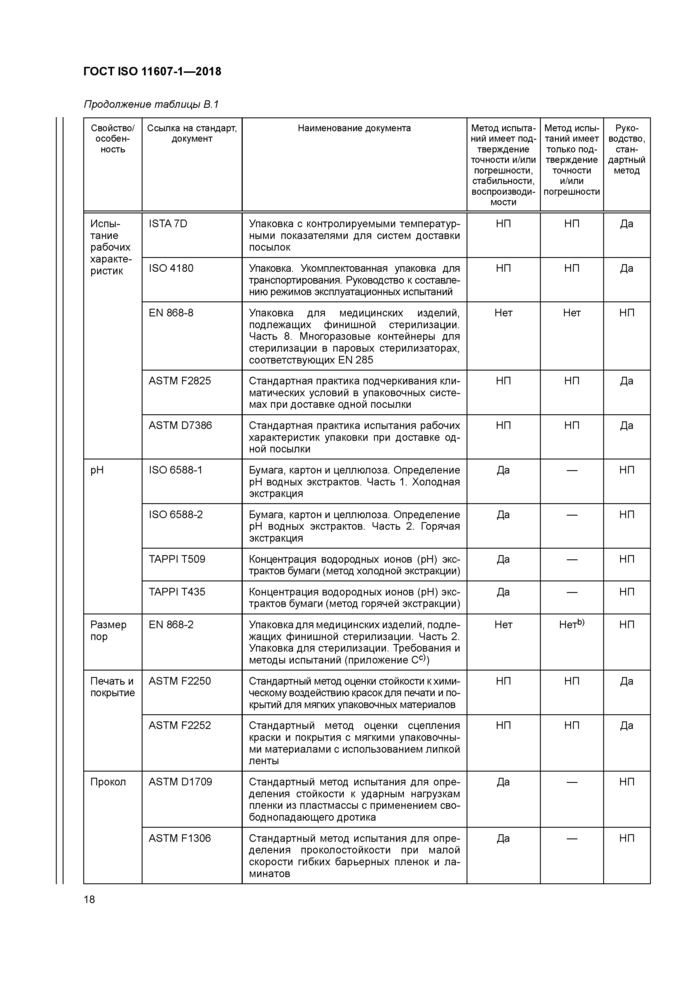
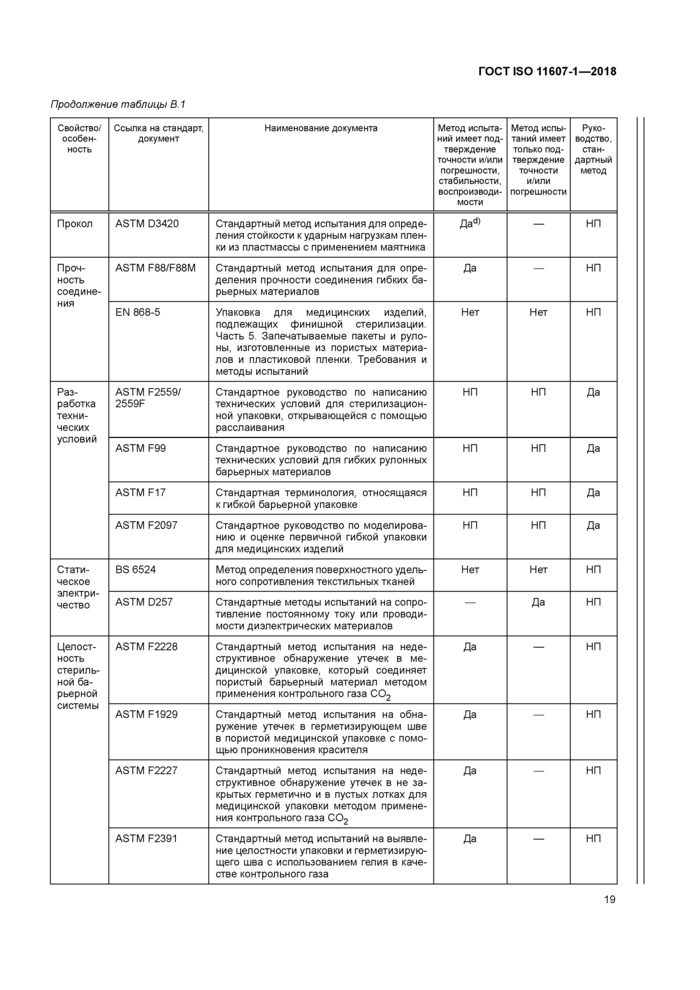
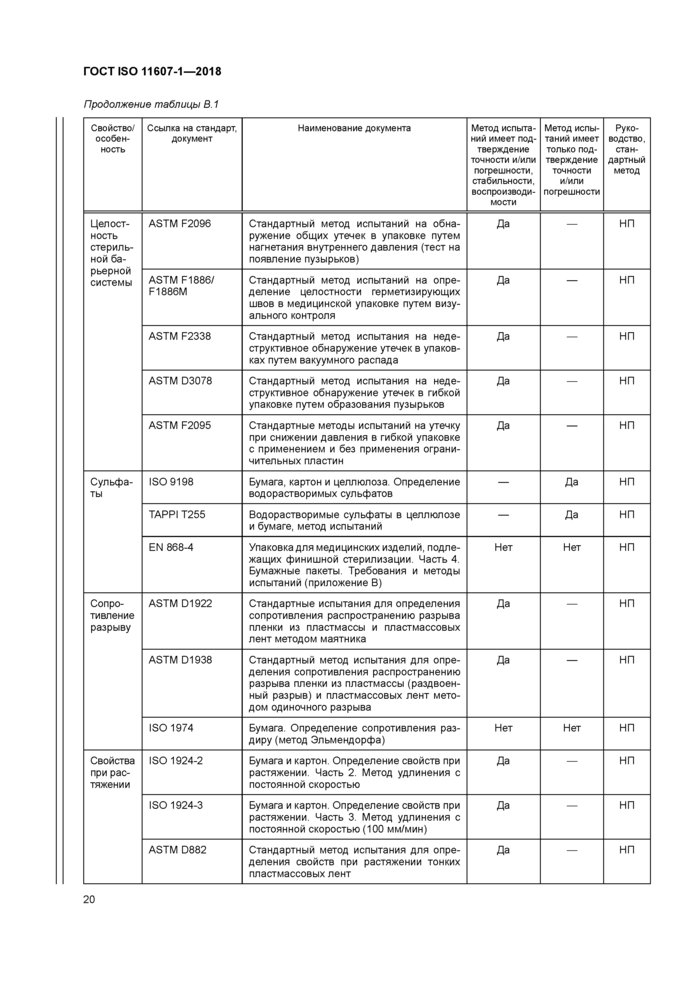
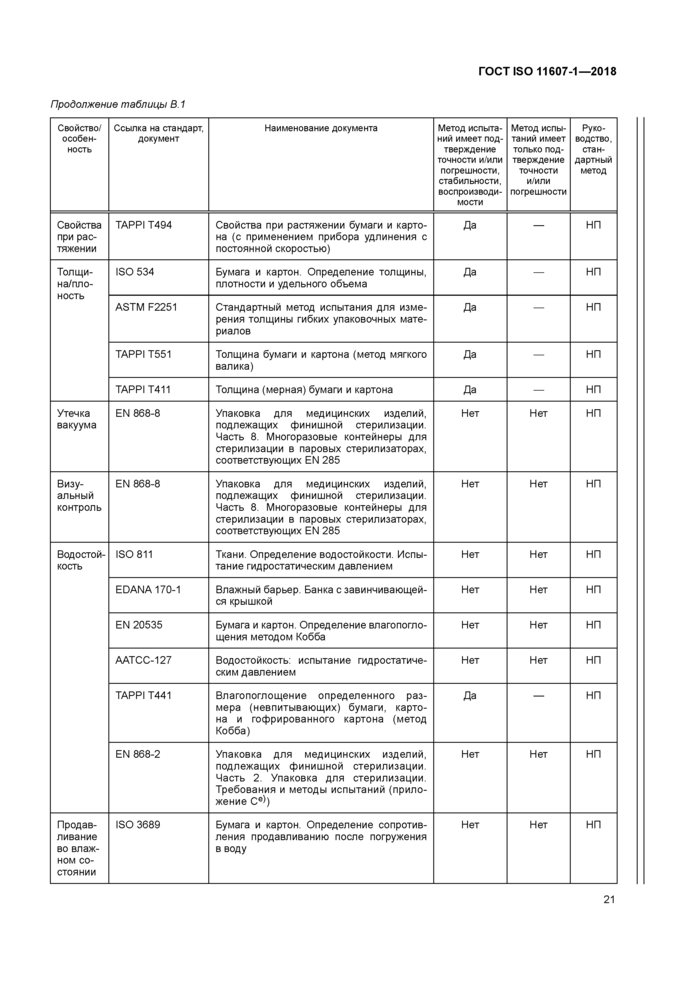
В.1 Общие требования
Следующие документы содержат положения, которые могут применять для демонстрации соответствия положениям настоящего стандарта. При применении методов испытаний и процессов, перечисленных в таблице В.1, необходимо обращать внимание на дату выпуска этих документов. Специальные требования по применению методов испытаний приведены в подразделе 4.4.
Критериями для включения методов испытаний и процессов, приведенных в таблице В.1, в данное приложение являются факты их назначения для включения и доступность для приобретения у организаций, разрабатывающих стандарты, торговых ассоциаций или национальных органов по стандартизации. Следовательно, раздел «Библиография» содержит перечень печатных изданий, которые содержат дополнительные методы испытаний. Данное приложение не является всеобъемлющим. Известно, что к моменту публикации будут разработаны новые методы испытаний.
(Изменение № 1, 2014)
В.2 Упаковочные материалы и отформованные барьерные системы для стерилизации
|
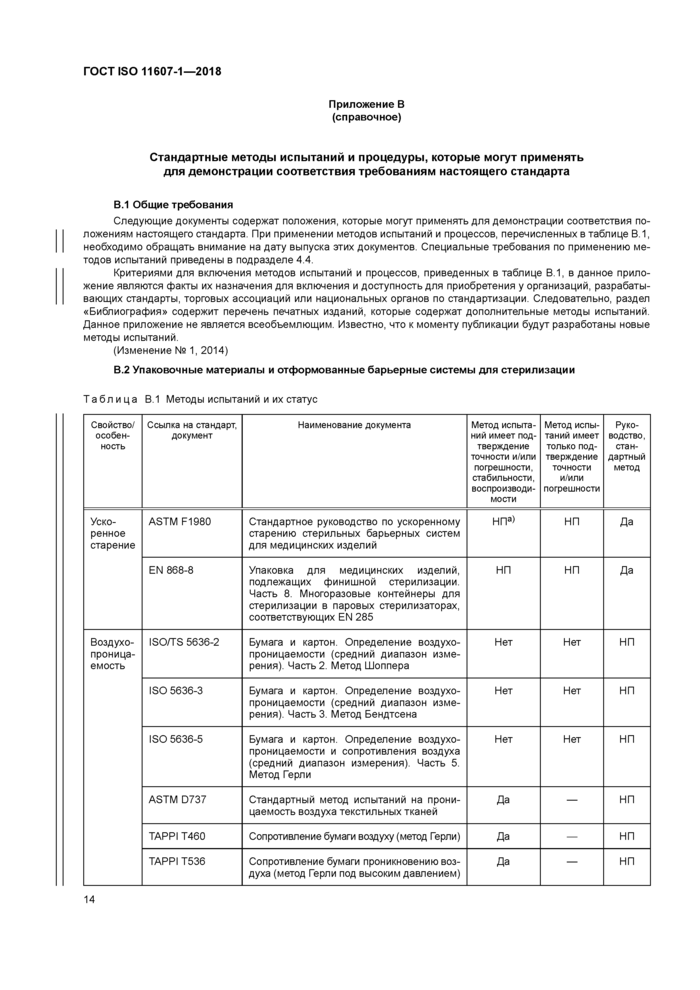
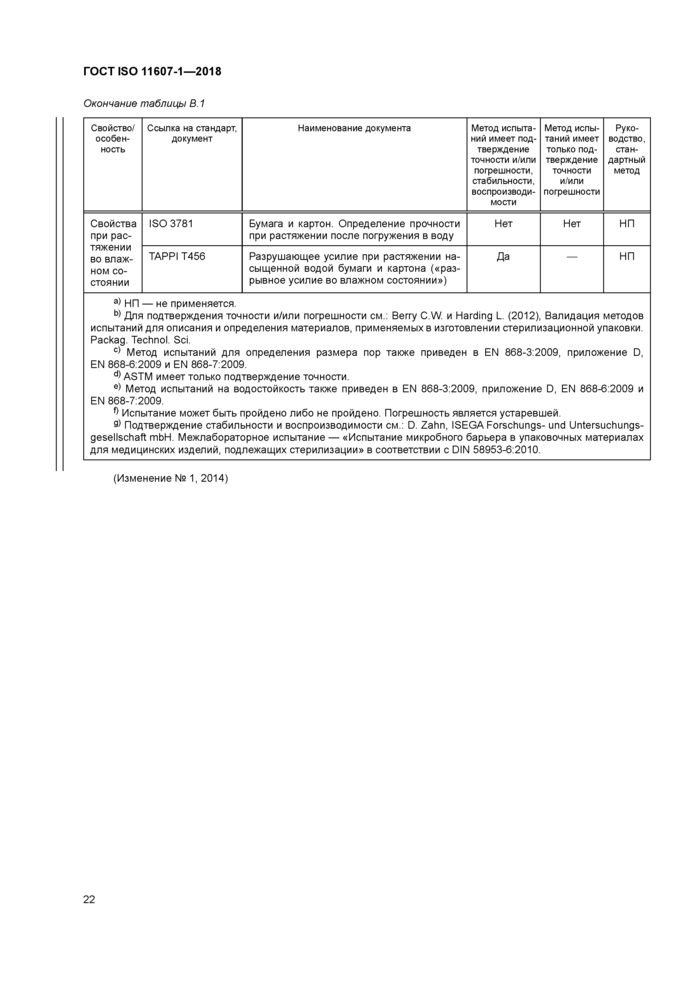
Таблица В.1 Методы испытаний и их статус | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
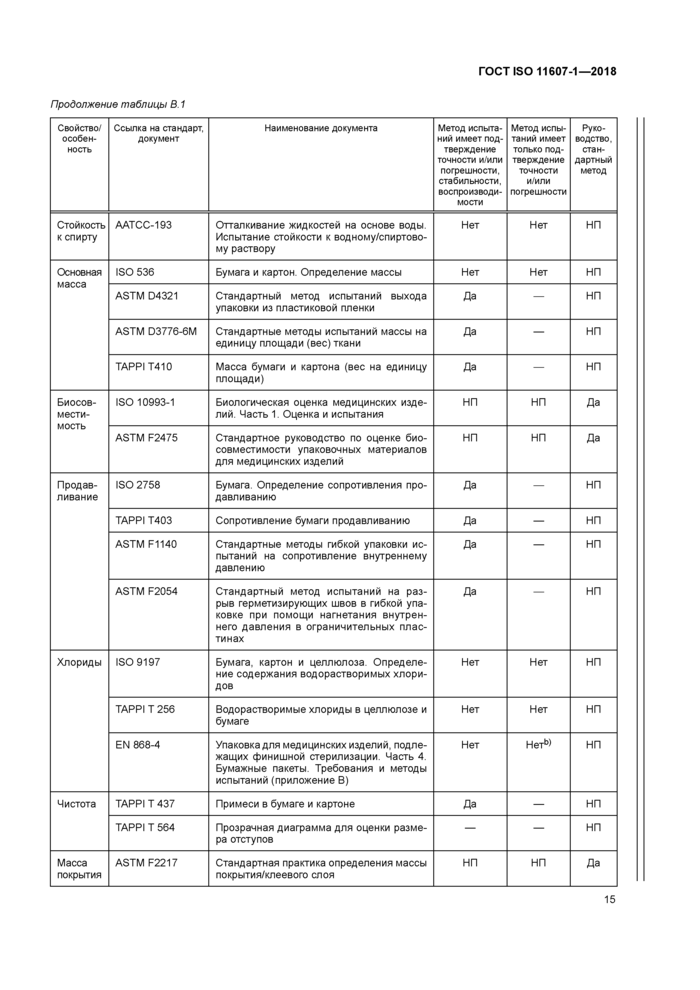
Продолжение таблицы В. 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
ГОСТ ISO 11607-1-2018
Информация об изменениях к настоящему стандарту публикуется в ежегодном информационном указателе «Национальные стандарты», а текст изменений и поправок — в ежемесячном информационном указателе «Национальные стандарты». В случае пересмотра (замены) или отмены настоящего стандарта соответствующее уведомление будет опубликовано в ежемесячном информационном указателе «Национальные стандарты». Соответствующая информация, уведомление и тексты размещаются также в информационной системе общего пользования — на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет (www.gost.ru)
© ISO, 2006 — Все права сохраняются © Стандартинформ, оформление, 2018
В Российской Федерации настоящий стандарт не может быть полностью или частично воспроизведен, тиражирован и распространен в качестве официального издания без разрешения Федерального агентства по техническому регулированию и метрологии
|
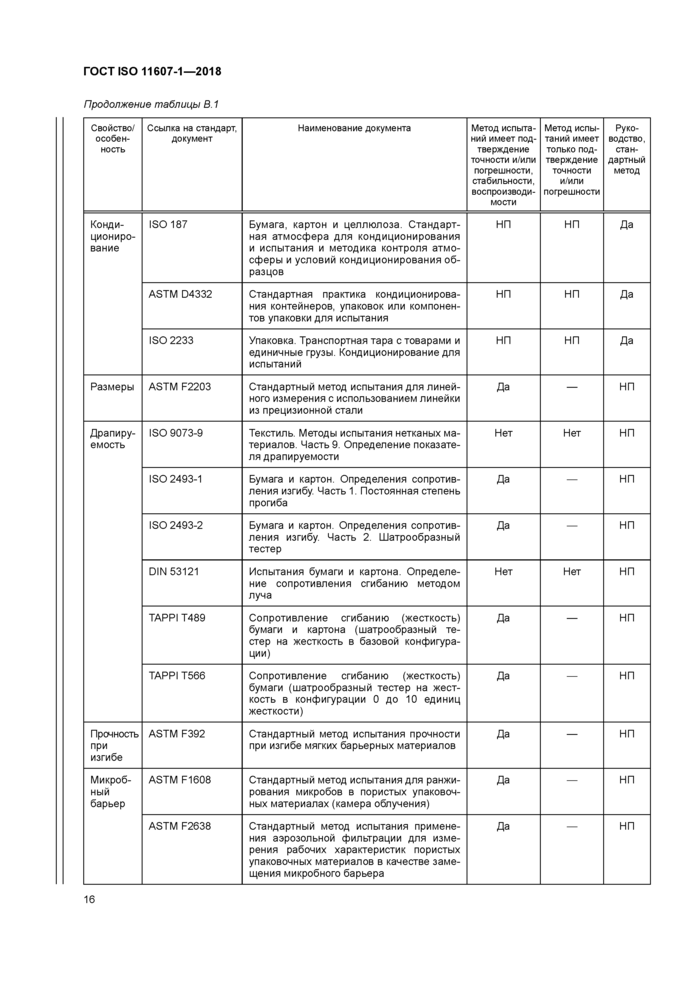
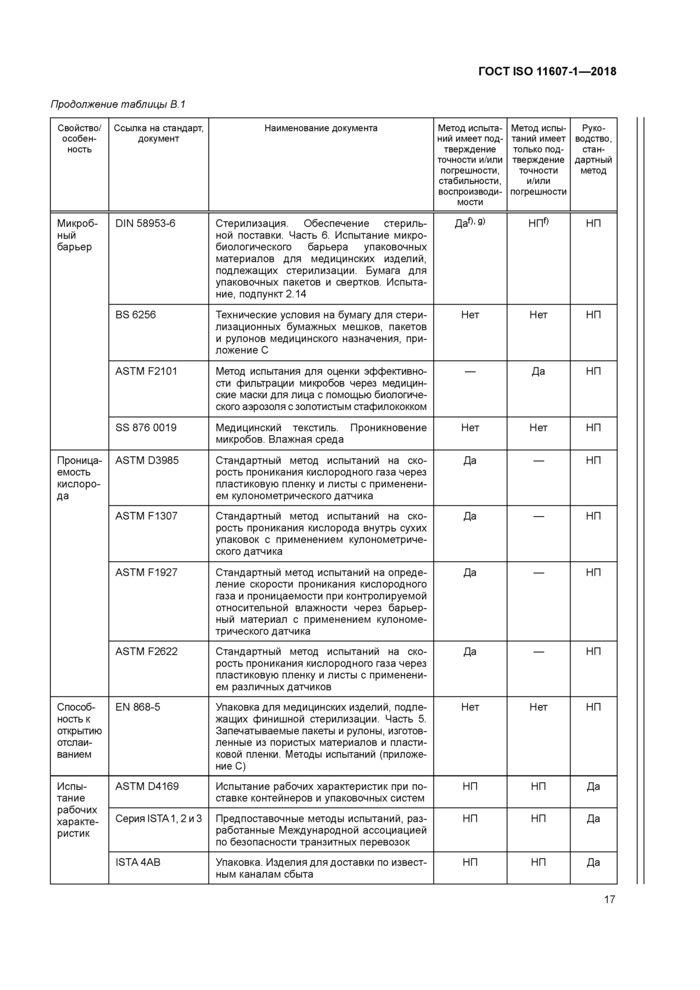
Продолжение таблицы В. 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Содержание
1 Область применения..................................................................1
2 Нормативные ссылки..................................................................1
3 Термины и определения...............................................................1
4 Общие требования...................................................................4
4.1 Общие условия...................................................................4
4.2 Системы качества.................................................................4
4.3 Отбор проб......................................................................5
4.4 Методы испытания................................................................5
4.5 Документация....................................................................5
5 Материалы и предварительно отформованные барьерные системы для стерилизации...........5
5.1 Общие требования................................................................5
5.2 Свойства микробного барьера......................................................8
5.3 Совместимость с процессом стерилизации............................................8
5.4 Совместимость с системой маркировки...............................................8
5.5 Хранение и транспортирование.....................................................9
6 Конструктивные требования и требования к разработке упаковочных систем...................9
6.1 Общие требования................................................................9
6.2 Конструкция......................................................................9
6.3 Эксплуатационные испытания упаковочной системы...................................10
6.4 Испытание на стабильность характеристик...........................................10
7 Предоставляемая информация........................................................11
Приложение А (справочное) Руководство по упаковке медицинских изделий....................12
Приложение В (справочное) Стандартные методы испытаний и процедуры, которые могут
применять для демонстрации соответствия требованиям настоящего стандарта .... 14 Приложение С (обязательное) Метод испытания для определения сопротивления
непроницаемых материалов прохождению воздуха............................23
Приложение ДА (справочное) Сведения о соответствии ссылочных международных стандартов
ссылочным межгосударственным стандартам................................24
Библиография........................................................................25
IV
ГОСТ ISO 11607-1-2018
Введение
Процесс конструирования и разработки упаковочных систем для финишной стерилизации медицинских изделий является сложным и ответственным этапом. Компоненты изделия и упаковочную систему следует сочетать таким образом, чтобы получить рациональный, безопасный и эффективный продукт, соответствующий своему назначению.
В настоящем стандарте установлены основные характеристики материалов и предварительно отформованных систем для их применения в упаковочных системах, предназначенных для финишной стерилизации медицинских изделий, а также рассматривается широкий диапазон потенциальных материалов, медицинских изделий, конструкций систем упаковки и методов стерилизации.
В ISO 11607-2 описаны требования к валидации процессов формирования, герметизации и сборки. Настоящий стандарт заменяет EN 868-1 и устанавливает общие требования ко всем упаковочным материалам, тогда как EN 868, части 2—10 — частные требования к целому ряду общеупотребительных материалов. Обе части ISO 11607 разработаны в соответствии с основополагающими требованиями европейских директив, касающихся медицинских изделий.
Действуют европейские стандарты, содержащие требования к конкретным материалам и предварительно отформованным барьерным системам для стерилизации, которые известны как стандарты серии EN 868. Настоящий стандарт разработан в качестве средства для демонстрации соблюдения основополагающих требований европейских директив, касающихся медицинских изделий.
Соответствие положениям EN 868 частей 2—10 может служить подтверждением соблюдения одного или более требований настоящего стандарта.
Системы упаковки медицинских изделий, подлежащих окончательной стерилизации, предназначены для стерилизации изделий, обеспечения их физической защиты, сохранения стерильности до места использования и соблюдения асептических свойств.
Особенности медицинского изделия, предполагаемые методы стерилизации, срок годности, транспортирование и хранение влияют на конструкцию упаковочной системы и выбор материала.
Одно из существенных препятствий для гармонизации — это терминология. Термины «упаковка», «конечная упаковка», «конечная тара», «первичная тара» и «первичная упаковка» трактуются по-разному в разных странах, и выбор одного из этих терминов как основы для гармонизации с настоящим стандартом явился барьером для успешного завершения разработки этого документа.
В результате введен термин «барьерная система для стерилизации» для описания минимальной упаковки, необходимой для выполнения особых требований, предъявляемых к медицинской упаковке, а именно: обеспечение условий для проведения стерилизации, создание приемлемого микробного барьера и соблюдение асептических свойств. «Защитная упаковка» предохраняет барьерную систему для стерилизации, и вместе они образуют упаковочную систему. «Предварительно отформованные барьерные системы» могут включать любые части этой системы, например саше, пакеты, запечатываемые с помощью этикетки, перегибаемой пополам, катушки для намотки упаковочной пленки, применяемые в больницах. Обзор барьерных систем для стерилизации представлен в приложении А.
Барьерная система важна для обеспечения безопасности медицинских изделий в процессе финишной стерилизации. Регламентирующие органы признают важную роль барьерных систем для стерилизации, рассматривая их как вспомогательное средство или компонент медицинского изделия.
Предварительно отформованные барьерные системы, которые закупают медицинские учреждения для использования в процессе внутренней стерилизации, признаются медицинскими изделиями во многих частях света.
(Изменение № 1,2014)
V
МЕЖГОСУДАРСТВЕННЫЙ СТАНДАРТУПАКОВКА ДЛЯ МЕДИЦИНСКИХ ИЗДЕЛИЙ, ПОДЛЕЖАЩИХ ФИНИШНОЙ СТЕРИЛИЗАЦИИЧасть 1Требования к материалам, барьерным системам для стерилизации и упаковочным системам
Часть 1Требования к материалам, барьерным системам для стерилизации и упаковочным системам
Packaging for terminally sterilized medical devices. Part 1. Requirements for materials, sterile barrier systems and packaging systems
Дата введения — 2019—04—01
1 Область применения
Настоящий стандарт устанавливает требования к материалам, предварительно отформованным барьерным системам для стерилизации, барьерным системам для стерилизации и упаковочным системам, предназначенным для финишной стерилизации медицинских изделий до того, как они будут доставлены к месту их использования, а также описывает методы испытаний.
Настоящий стандарт применяется для упаковывания медицинских изделий, подвергаемых финишной стерилизации как в промышленных условиях, так и в медицинских учреждениях, а также при стерилизации медицинских изделий непосредственно в барьерных системах.
Настоящий стандарт не применим к упаковочным материалам и/или системам, внутри которых находятся контаминированные медицинские изделия, в процессе их транспортирования до места повторной обработки или утилизации.
Настоящий стандарт не распространяется на барьерные системы и упаковочные системы для медицинских изделий, которые изготовлены асептическим способом. Также может возникнуть необходимость в дополнительных требованиях к упаковке комплекса «лекарство/изделие».
Настоящий стандарт не содержит требований к системе обеспечения качества для проведения контроля на всех стадиях производства.
(Изменение № 1,2014)
2 Нормативные ссылки
В настоящем стандарте использованы нормативные ссылки на следующие международные стандарты. Для датированных ссылок используют только указанную в ссылке редакцию. Для недатированных ссылок используют последнюю редакцию документа, на который дана ссылка, включая любые дополнения, изменения и поправки.
ISO 5636-5 Paper and board — Determination of air permeance and air resistance (medium range) — Part 5: Gurley method [Бумага и картон. Определение воздухопроницаемости и сопротивления воздуха (средний диапазон измерения). Часть 5. Метод Герли]
(Изменение № 1,2014)
3 Термины и определения
В настоящем стандарте применены следующие термины с соответствующими определениями:
3.1 асептическое представление (aseptic presentation): Внедрение и передача стерильного изделия с соблюдением условий и процедур, исключающих микробное заражение.
Издание официальное
3.2 _
бионагрузка (bioburden): Популяция жизнеспособных микроорганизмов на изделии или барьерной системе для стерилизации или внутри них.
[ISO/TS 11139:2006]
3.3 укупорочное средство (closure): Средство, используемое для укупоривания барьерной системы для стерилизации без применения клеевого соединения.
Примечание — Барьерную систему для стерилизации можно укупорить уплотнительными крышками многоразового применения или последовательным сгибанием упаковки до образования скрученного канала.
3.4 целостность укупорочного средства (closure integrity): Свойства герметизирующего средства, позволяющие ему препятствовать проникновению микроорганизмов в заданных условиях, которые охватывают процесс стерилизации, обработку, распределение, транспортирование и хранение.
(Изменение № 1,2014)
3.5 срок годности (expiry date): Указание даты (год и месяц), до наступления которой продукт следует использовать.
3.6 маркировка (labellig): Этикетка с письменным, печатным, электронным или графическим отображением данных, прикрепляемая к медицинскому изделию или упаковочной системе или прилагаемая в качестве сопроводительного документа.
Примечание — Маркировка содержит идентификацию, техническое описание и способ применения медицинского изделия, но исключает товаросопроводительные документы.
3.7 _
медицинское изделие (medical device): Любой инструмент, аппарат, прибор, машина, приспособление, имплант, реагент in vitro или калибратор, программные средства, материал или иное подобное изделие, предназначенное производителем для использования, отдельно или в сочетании, на людях для одной или нескольких определенных целей, как то:
-диагностика, предотвращение, мониторинг, лечение, облегчение заболевания,
-диагностика, мониторинг, лечение, облегчение или компенсация травмы,
- исследования, пересадка, модификация или поддержка органов или физиологического процесса,
- поддержание или обеспечение жизни,
- контроль зачатия,
- дезинфекция медицинских изделий,
- получение информации для медицинских целей посредством рассмотрения in vitro образцов, полученных из человеческого организма,
и которое не выполняет своего основного действия внутри или на человеческом теле с помощью фармакологических, иммунологических или метаболических средств, но функции которого могут быть поддержаны таковыми средствами.
[ISO 13485:2003]
Примечание — Это определение из ISO 13485:2003 разработано специальной комиссией по глобальной гармонизации (GHTF 2002).
3.8 микробный барьер (microbial barrier): Свойства герметизирующего средства, препятствующие проникновению микроорганизмов в заданных условиях, которые охватывают процесс стерилизации, обработку, распределение, транспортирование и хранение.
(Изменение № 1,2014)
3.9 упаковочный материал (packaging material): Любой материал, применяемый при изготовлении или укупоривании упаковочной системы.
3.10 _
упаковочная система (packaging system): Сочетание барьерной системы и защитной упаковки.
[ISO/TS 11139:2006]
3.11 _
предварительно сформированная барьерная система для стерилизации (preformed sterile barrier system): Барьерная система для стерилизации (см. 3.22), которая поставляется частично собранной для наполнения и окончательного закрытия или укупоривания.
Пример — Саше, бумажные пакеты и открытые многоразовые упаковки.
[ISO/TS 11139:2006]
3.12
продукт (product): Результат процесса.
[ISO 9000:2005]
Примечание — Для обеспечения стандартов стерилизации продукт является вещественным материалом; к нему относятся сырье, промежуточный продукт, сборочная единица и медико-санитарные товары.
[ISO/TS 11139:2006]
(Изменение № 1,2014)
3.13 защитная упаковка (protective packaging): Комбинация материалов, способствующая предотвращению повреждения стерильной барьерной системы и их содержимого с момента сборки и до места использования.
Примечание — Термин заимствован из ISO/TS 11139:2006.
3.14 повторно используемый материал (cycled material): Материал, полученный в процессе переработки отходов с целью придания им первоначальных свойств или для других целей.
3.15 повторяемость (repeatability): Точность соответствия между результатами последовательных измерений одного и того же определенного количества, подлежащего измерению (измеряемая величина), которое проводят в одних и тех же условиях.
Примечание 1 — Эти условия называют условиями повторяемости.
Примечание 2 — Условия повторяемости могут включать следующее:
- одну и ту же методику измерения;
- одного и того же эксперта;
- один и тот же измерительный инструмент, который используют в одних и тех же условиях;
- одно и то же место проведения измерения;
- повторение через короткий промежуток времени.
Примечание 3 — Повторяемость может быть выражена количественно на основании дисперсионных характеристик результатов.
Примечание 4 — Термин заимствован из Международного словаря основных и общих терминов в области метрологии, 1993, определение 3.6.
3.16 воспроизводимость (reproducibility): Точность соответствия между результатами измерений одного и того же определенного количества, подлежащего измерению (измеряемая величина), которое проводят в изменяющихся условиях.
Примечание 1 — Для обоснованного заявления воспроизводимости необходимы требования на изменение условий.
Примечание 2 — К изменяющимся условиям можно отнести:
- принцип измерения;
- метод измерения;
- смену эксперта;
- измерительный инструмент;
- стандартный образец;
- место проведения измерения;
-условия применения;
- время.
Примечание 3 — Воспроизводимость может быть выражена количественно на основании дисперсионных характеристик результатов.
Примечание 4 — Термин заимствован из Международного словаря основных и общих терминов в области метрологии, 1993, определение 3.7.
3
3.17 многоразовая упаковка (reusable container): Жесткая барьерная система для стерилизации, которую можно использовать многократно.
3.18 клеевое соединение (seal): Результат соединения поверхностей.
Примечание — Поверхности могут быть соединены с помощью клеев или термического плавления.
3.19 целостность клеевого соединения (seal integrity): Свойства клеевого соединения, позволяющие ему препятствовать проникновению микроорганизмов в заданных условиях, которые охватывают процесс стерилизации, обработку, распределение, транспортирование и хранение.
3.20 прочность клеевого соединения (seal strength): Механическая прочность клеевого соединения.
3.21
стерильность (sterile): Отсутствие жизнеспособных микроорганизмов.
[ISO/TS 11139:2006]
3.22 _
барьерная система для стерилизации (sterile barrier system): Минимальная упаковка, которая препятствует проникновению микроорганизмов и позволяет продемонстрировать асептические свойства продукта в месте его применения.
[ISO/TS 11139:2006]
3.23 стерильная упаковка для проводника жидкости (sterile fluid-path packaging): Система защитной оболочки для проводника жидкости и/или упаковки, предназначенная для обеспечения стерильности части медицинского изделия, контактирующей с жидкостями.
Примечание — Примером стерильной упаковки для проводника жидкости может служить внутренняя часть трубок для введения внутривенной жидкости.
3.24 совместимость со стерилизацией (sterilization compatibility): Свойства упаковочного материала и/или системы, позволяющие им выдерживать процесс стерилизации и обеспечивать достижение требуемых условий для стерилизации внутри упаковочной системы.
3.25 _
стерилизующий агент (sterilizing agent): Физическое или химическое вещество или комбинация веществ с достаточной микробоцидной активностью для достижения стерильности в заданных условиях.
[ISO/TS 11139:2006]
3.26 финишная стерилизация (terminal sterilization): Процесс, в результате которого стерилизуют продукт внутри барьерной системы для стерилизации.
3.27 срок полезного использования (useful life): Период времени, в течение которого удовлетворяются все требования к рабочим характеристикам.
3.28 валидация (validation): (Общее) Подтверждение путем исследований и обеспечение объективного свидетельства того, что конкретное требование к особому предполагаемому условию может быть выполнено.
Примечание — Это определение применимо к валидации методов испытания и конструкции.
3.29 валидация (validation): (Процесс) Документированная процедура получения, записи и интерпретации результатов, необходимых для подтверждения того, что процесс неизменно дает продукцию, соответствующую заданным требованиям.
Примечание — Термин адаптирован из ISO/TS 11139:2006.
4 Общие требования
4.1 Общие условия
Соответствие одному или более требованиям настоящего стандарта может быть продемонстрировано путем использования одной или более следующих частей серии EN 868-2—EN 868-10.
4.2 Системы качества
4.2.1 Действия, описанные в настоящем стандарте, следует выполнять в рамках официальной системы качества.
Примечание — ISO 9001 и ISO 13485 содержат требования к соответствующим системам качества. Дополнительные требования могут быть установлены конкретной страной или определенным регионом.
4
ГОСТ ISO 11607-1-2018
4.2.2 Не должно быть необходимости сертификации системы качества третьей стороной для выполнения требований настоящего стандарта.
4.2.3 Учреждения здравоохранения должны рассматривать использование системы качества, которая требуется в их стране или регионе.
(Изменение № 1,2014)
4.3 Отбор проб
Планы отбора проб, используемых для выбора и испытания упаковочных систем, должны быть применимы к системам упаковки, подлежащим оценке. Планы отбора проб должны быть статистически обоснованы.
Примечание — Примеры планов отбора проб приведены в ISO 2859-1 или ISO 186. Дополнительные планы отбора могут быть установлены теми странами или регионами, в которых проводят отбор проб.
4.4 Методы испытания
4.4.1 Все методы испытаний, применяемые для подтверждения соответствия настоящему стандарту, должны проходить валидацию, результаты которой следует оформлять документально.
Примечание — Приложение В содержит перечень соответствующих методов испытаний.
4.4.2 Валидация метода испытания должна продемонстрировать пригодность применяемого метода. Она включает следующие элементы:
- разработку обоснования для выбора соответствующих методов испытаний упаковочных систем;
- разработку критериев приемки.
Примечание — Прошло успешно/окончилось неудачей — вид критерия приемки:
- определение повторяемости метода испытания;
- определение воспроизводимости метода испытания;
- установление чувствительности метода для испытания целостности.
4.4.3 Если в методах испытания не установлено иное, образцы для испытания должны проходить кондиционирование при температуре (23 ± 1) °С и относительной влажности (50 ± 2) % в течение 24 ч минимум.
4.5 Документация
4.5.1 Подтверждение соответствия настоящему стандарту должно быть документально оформлено.
4.5.2 Все документы должны хранить установленный период времени. При определении срока хранения документов следует учитывать такие факторы, как требования регламентов, срок годности и прослеживаемость причин отказов медицинских изделий или барьерной системы для стерилизации.
4.5.3 В документы соответствия могут быть включены, но не ограничены этим, эксплуатационные данные, технические условия и результаты валидированных методов испытаний.
4.5.4 Электронные записи, электронные и собственноручные подписи, исполненные в электронных записях, которые способствуют валидации, производственный контроль или другие процессы принятия решений по качеству должны быть надежными.
5 Материалы и предварительно отформованные барьерные системы для стерилизации
5.1 Общие требования
5.1.1 Требования к материалам должны соответствовать тем, которые предъявляются к материалам, используемым в предварительно отформованных барьерных системах, а также в барьерных системах для стерилизации.
5.1.2 Требования, приведенные в 5.1, не являются полными. Материалы, имеющие характеристики, которые не указаны в 5.1, можно оценивать с помощью критериев эффективности, приведенных в разделе 6.
5.1.3 Условия, в соответствии с которыми производят и обрабатывают материал или отформованную барьерную систему, следует устанавливать, контролировать и регистрировать, если возможно, чтобы гарантировать:
5