ГОСТ ISO 10993-7-2016
Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 7. Остаточное содержание этиленоксида после стерилизации
Устанавливает допустимые предельные значения для остаточного количества этиленоксида (ЭО) и этиленхлоргидрина (ЭХГ) в индивидуальных медицинских изделиях, стерилизованных ЭО, методы измерения ЭО и ЭХГ и требования, в соответствии с которыми могут осуществлять выпуск изделий. Дополнительная информация, включая руководство и блок-схему, демонстрирующую применение настоящего стандарта, приведена в справочных приложениях.
- Заменяет ГОСТ ISO 10993-7-2011 «Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 7. Остаточное содержание этиленоксида после стерилизации» ИУС 4-2017
Идентичен ISO 10993-7:2008/Cor.1:2009
Оглавление
1 Область применения
2 Нормативные ссылки
3 Термины и определения
4 Основные требования
4.1 Общие положения
4.2 Категории изделий
4.3 Допустимые предельные значения
4.4 Определение остаточного содержания ЭО и ЭХГ
5 Выпуск продукции
5.1 Общие положения
5.2 Выпуск продукции без использования данных по кривым дегазации
5.3 Процедура выпуска продукции с использованием кривых дегазации
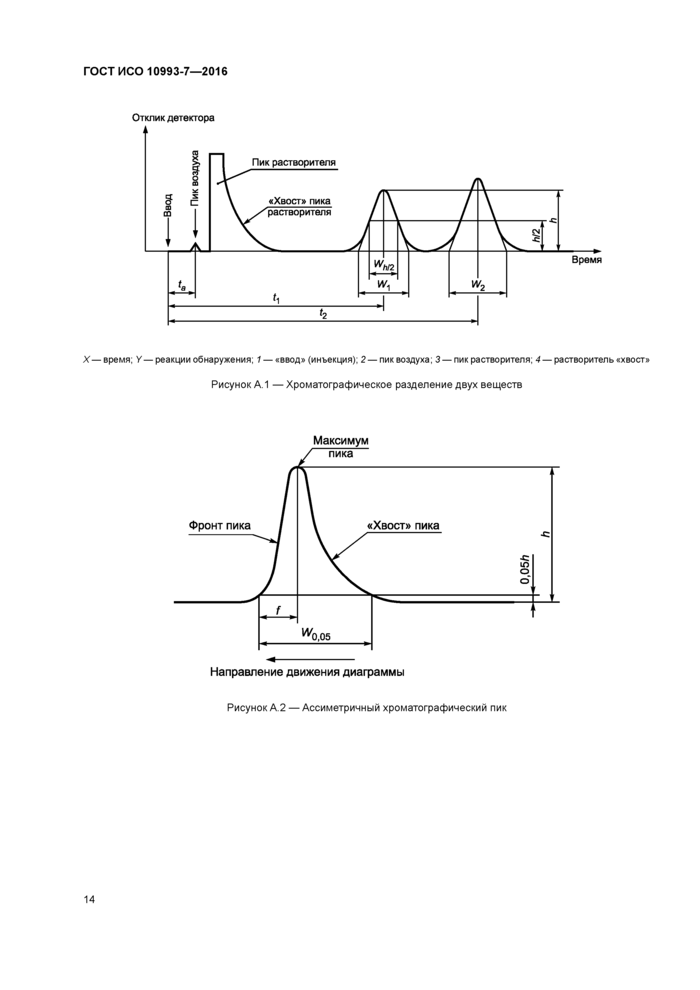
Приложение А (обязательное) Оценка хроматограмм, полученных методом газовой хроматографии
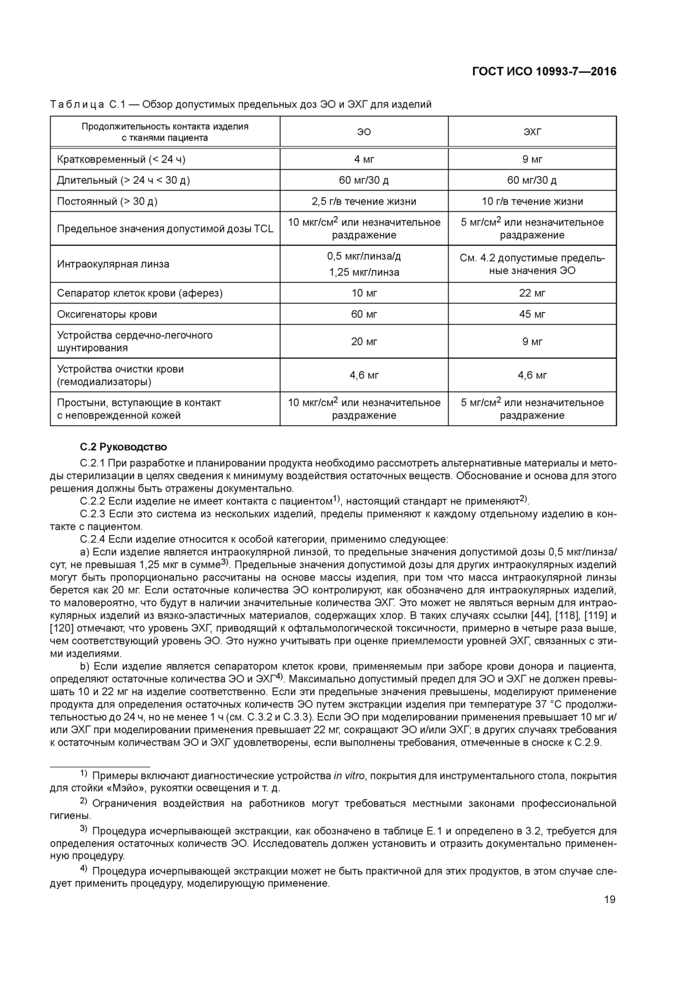
Приложение В (справочное) Газохроматографическое определение ЭО и ЭХГ
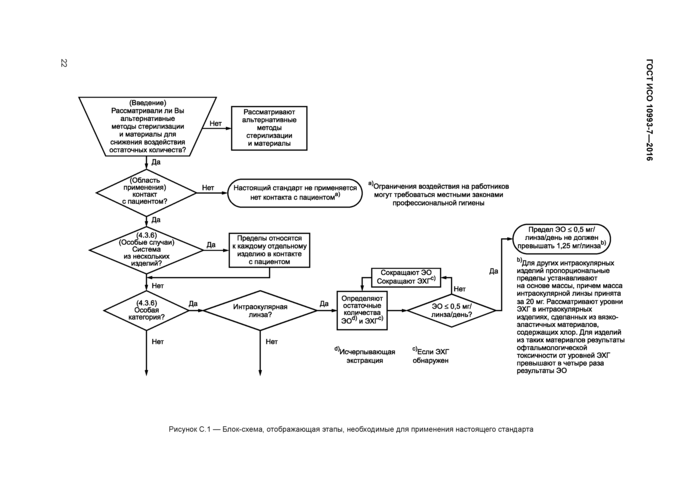
Приложение С (справочное) Блок-схема и руководство по применению настоящего стандарта для определения остаточных количеств этиленоксида и этиленхлоргидрина в медицинских изделиях
Приложение D (справочное) Факторы, влияющие на содержание остаточных веществ в изделии.
Приложение Е (справочное) Условия экстракции для определения остаточного содержания ЭО
Приложение F (справочное) Логическое обоснование введения предельных значений
Приложение G (справочное) Установление предельных значений для ЭО
Приложение Н (справочное) Установление допустимых пределов для ЭХГ
Приложение I (справочное) Установление допустимых пределов для ЭГ
Приложение J (справочное) Приготовление контрольных растворов ЭО и ЭХГ
Приложение К (справочное) Методы измерения остаточного содержания этиленоксида
Приложение ДА (справочное) Сведения о соответствии ссылочных международных стандартов межгосударственным стандартам
Библиография
78 страниц
| Дата введения | 01.10.2017 |
|---|---|
| Добавлен в базу | 01.02.2017 |
| Актуализация | 01.01.2021 |
Этот ГОСТ находится в:
- Раздел Экология
Организации:
| 25.10.2016 | Утвержден | Межгосударственный Совет по стандартизации, метрологии и сертификации | 92-П |
|---|---|---|---|
| 31.10.2016 | Утвержден | Федеральное агентство по техническому регулированию и метрологии | 1532-ст |
| Разработан | АНО ИМБИИТ | ||
| Издан | Стандартинформ | 2016 г. |
Medical devices. Biological evaluation of medical devices. Part 7. Ethylene oxide sterilization residuals
- ГОСТ ISO 10993-10-2011 Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 10. Исследования раздражающего и сенсибилизирующего действия
- ГОСТ ISO 10993-17-2011 Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 17. Установление пороговых значений для вымываемых веществ
ГОСТ ISO 10993-3-2011Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 3. Исследования генотоксичности, канцерогенности и токсического действия на репродуктивную функцию. Заменен на ГОСТ ISO 10993-3-2018.- ГОСТ ISO 10993-1-2011 Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 1. Оценка и исследования
- ГОСТ ISO 10993-12-2015 Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 12. Приготовление проб и контрольные образцы
- Показать все
Чтобы бесплатно скачать этот документ в формате PDF, поддержите наш сайт и нажмите кнопку:

стр. 1

стр. 2

стр. 3

стр. 4

стр. 5

стр. 6

стр. 7

стр. 8

стр. 9

стр. 10

стр. 11

стр. 12

стр. 13

стр. 14

стр. 15

стр. 16

стр. 17

стр. 18

стр. 19
стр. 20

стр. 21

стр. 22

стр. 23

стр. 24
стр. 25

стр. 26

стр. 27
стр. 28
стр. 29
стр. 30
МЕЖГОСУДАРСТВЕННЫЙ СОВЕТ ПО СТАНДАРТИЗАЦИИ. МЕТРОЛОГИИ И СЕРТИФИКАЦИИ
(МГС)
INTERSTATE COUNCIL FOR STANDARDIZATION. METROLOGY AND CERTIFICATION
(ISC)
МЕЖГОСУДАРСТВЕННЫЙ
СТАНДАРТ
ГОСТИСО 10993-7—2016ИЗДЕЛИЯ МЕДИЦИНСКИЕ. ОЦЕНКА БИОЛОГИЧЕСКОГО ДЕЙСТВИЯ МЕДИЦИНСКИХ ИЗДЕЛИЙ
Часть 7Остаточное содержание этиленоксида после стерилизации
2016ИЗДЕЛИЯ МЕДИЦИНСКИЕ. ОЦЕНКА БИОЛОГИЧЕСКОГО ДЕЙСТВИЯ МЕДИЦИНСКИХ ИЗДЕЛИЙ
Часть 7Остаточное содержание этиленоксида после стерилизации
(ISO 10993-7:2008/Сог.1:2009,
Biological evaluation of medical devices — Part 7:
Ethylene oxide sterilization residuals IDT)
Издание официальное
Москва Стандартинформ 201 в
Предисловие
Цели, основные принципы и основной порядок проведения работ по межгосударственной стандартизации установлены в ГОСТ 1.0-2015 «Межгосударственная система стандартизации. Основные положения» и ГОСТ 1.2-2015 «Межгосударственная система стандартизации. Стандарты межгосударственные. правила и рекомендации по межгосударственной стандартизации. Правила разработки, принятия, обновления и отмены»
Сведения о стандарте
1 ПОДГОТОВЛЕН Автономной некоммерческой организацией «Институт медико-биологических исследований и технологий (АНО «ИМБИИТ») на основе собственного перевода на русский язык англоязычной версии международного стандарта, указанного в пункте 5
2 ВНЕСЕН Федеральным агентством по техническому регулированию и метрологии
3 ПРИНЯТ Межгосударственным советом по стандартизации, метрологии и сертификации (протокол от 25 октября 2016 г. № 92-П)
|
За принятие проголосовали: | ||||||||||||||||||
|
4 Приказом Федерального агентства по техническому регулированию и метрологии от 31 октября 2016 г. № 1532-ст межгосударственный стандарт ГОСТ ISO 10993-7-2016 введен в действие в качестве национального стандарта Российской Федерации с 1 октября 2017 г.
5 Настоящий стандарт идентичен международному стандарту ISO 10993-7:2008/Сог. 1:2009 «Оценка биологического действия медицинских изделий. Часть 7. Остаточное содержание этиленок-сида после стерилизации» («Biological evaluation of medical devices — Part 7: Ethylene oxide sterilization residuals». IDT).
Наименование настоящего стандарта изменено относительно наименования указанного международного стандарта для увязки с наименованиями, принятыми в существующем комплексе межгосударственных стандартов.
При применении настоящего стандарта рекомендуется использовать вместо ссылочных международных стандартов соответствующие им межгосударственные стандарты, сведения о которых приведены в дополнительном приложении ДА
6 ВЗАМЕН ГОСТ ISO 10993-7-2011
Информация об изменениях к настоящему стандарту публикуется в ежегодном информационном указателе «Национальные стандарты», а текст изменений и поправок — в ежемесячном информационном указателе «Национальные стандарты». В случае пересмотра (замены) или отмены настоящего стандарта соответствующее уведомление будет опубликовано в ежемесячном информационном указателе «Национальные стандарты». Соответствующая информация, уведомление и тексты размещаются также в информационной системе общего пользования — на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет (www gost.ru)
©Стандартинформ. 2016
В Российской Федерации настоящий стандарт не может быть полностью или частично воспроизведен, тиражирован и распространен в качестве официального издания без разрешения Федерального агентства по техническому регулированию и метрологии
Образцы, предназначенные для анализа, должны оставаться в составе партии вплоть до дня проведения анализа или до забора и немедленной заморозки образцов Время между изъятием образца из зоны контролируемой дегазации и началом экстракции должно быть сведено к минимуму. Образцы герметично закрывают, перевозят и хранят в замороженном виде, если анализ откладывается. Образцы перевозят с сухим льдом с привлечением службы круглосуточной доставки. Сухой лед должен находиться в контейнере для перевозки в течение всего времени транспортирования и быть в наличии при вскрытии упаковки в лаборатории. Образцы для анализа могут быть отобраны непосредственно из партии изделий после соответствующего интервала дегазации и сразу помещены в емкость для анализа (флакон для хроматографических исследований), затем их герметично закрывают и затем перевозят в лабораторию для анализа В качестве альтернативы образцы могут быть экстрагированы, и жидкий экстракт отправлен в аналитическую лабораторию для анализа. Если экстрагирующей жидкостью является вода, то перевозку осуществляют таким образом, что жидкость содержится при пониженных температурах (< 10 вС) до прибытия Исследование проводят путем измерения степени гидролиза ЭО в ЭГ.
Анализируемые образцы помещают в вытяжной шкаф и освобождают от упаковки. Образцы готовят в соответствии с инструкцией по предварительной подготовке, указанной на этикетке изделия.
Экстракцию следует начинать, по возможности, сразу после того, как образец извлечен из упаковки или закончена предварительная подготовка.
4 4.3.2 Контрольный образец
Для того чтобы убедиться в отсутствии в веществе, составляющем основу образца, других компонентов со временем удерживания таким же. как и определяемые остаточные продукты, необходимо оценить контрольный образец, не подвергавшийся стерилизации, путем его экстракции с использованием тех же процедур, что и для образцов, стерилизованных ЭО. При наличии материалов, экстрагируемых из такого контрольного образца, для которых времена удерживания совпадают или близки к временам удерживания определяемых веществ, изменяют условия хроматографирования таким образом. чтобы отделить мешающие пики от анализируемого пика, или используют другую аналитическую методику.
4.4.4 Соотношение между размерами образца и жидкостью
Объем жидкости, используемой для извлечения остаточных количеств определяемых веществ из изделий или их представительных частей, должен быть таким, чтобы обеспечить максимальную эффективность экстракции при достаточной чувствительности определения анализируемых веществ в экстракте. Таким образом, материал и размер образца изделия обусловливают оптимальный объем модельной среды.
Таким образом, для максимального увеличения аналитической чувствительности необходимо использовать минимальное количество жидкости для экстракции в зависимости от требуемого метода экстракции и размера образца. Для изделий, изготовленных из материалов с высокими поглотительными свойствами, или для тех. экстракцию остаточных количеств из которых проводят методом заполнения. может потребоваться соотношение масса образца/объем модельной среды, отражающее повышенный объем жидкости. В любом случае соотношение масса образца/объем модельной среды не должно приводить к уменьшению чувствительности определения.
4.4.5 Время и условия экстракции
Задача экстракции из изделий состоит в извлечении максимального количества вредных веществ, которые могут оказать воздействие на пациента в процессе применения изделия: выход за сутки — для изделий кратковременного контакта; выход за сутки и за месяц — для изделий длительного контакта; выход за сутки, за месяц и на протяжении жизни —для изделий постоянного контакта. Как указано в приложениях Е и F. исчерпывающая экстракция, описанная ниже, явпяется полезным альтернативным методом для оценки изделий постоянного контакта, если учтены ограничения для более короткого периода применения.
4.4.6 Экстракция из изделий
4.4.6.1 Общее представление
Существуют два основных метода экстракции, которые используют для определения остаточного содержания ЭО после стерилизации в медицинских изделиях: экстракция, моделирующая условия применения в медицинской практике, являющаяся эталонным методом, и исчерпывающая экстракция, которая в ряде случаев является приемлемым альтернативным методом Выбор метода экстракции должен быть основан на предполагаемом способе применения изделия. Примеры рекомендуемых методов экстракции приведены в приложении К.
6
Выбранный метод экстракции должен учитывать предполагаемый способ применения изделия с учетом максимального воздействия на пациента, а не избран из-за скорости анализа или занижения реальных концентраций остаточных количеств веществ.
Температуру и время экстракции выбирают с учетом вида и длительности контакта пациента с изделием в соответствии с 4.2 и 4.3 (см. ISO 10993-12 для температур экстракции).
Исследователь должен быть готов к тому, что для некоторых изделий экстракция, моделирующая условия применения, может привести к относительно большим объемам элюирования. В таких случаях предел обнаружения для остаточного материала может значительно увеличиться до такой степени, что возможно несоответствие с настоящим стандартом.
Небольшие изделия экстрагируют в соответствующем контейнере. Когда изделие является слишком большим для экстракции полностью, может стать необходимым экстрагировать несколько репрезентативных порций компонентов изделия для обеспечения уверенности в полученных данных.
Эти репрезентативные порции выбирают одним из двух способов. Если используют несколько различных материалов, пропорция кахедого компонента, по сравнению с общей массой образца, должна соответствовать соотношению данного компонента с общей массой исследуемого изделия. В качестве альтернативы можно выбрать один из компонентов для исследования после оценки, демонстрирующей. что он представляет максимальный случай содержания остаточных веществ. Выбранный метод должен быть утвержденным.
4.4 6.2 Экстракция, моделирующая условия применения изделия в медицинской практике (эталонный метод)
Водная экстракция, моделирующая условия применения, является эталонным методом в том смысле, что это — единственный метод, который дает результаты, напрямую сравнимые с предельными содержаниями остаточных количеств веществ в соответствии с требованиями 4.3.
Эти предельные содержания выражены в дозах ЭО и ЭХГ, воздействующих на пациента.
Так как необходимо оценить остаточные количества веществ, воздействующих на пациента или пользователя в процессе применения изделия в нормальных условиях, требуются методы экстракции, моделирующие условия применения в медицинской практике. Экстракцию, моделирующую условия применения изделия, следует проводить с учетом максимального приближения к процессу применения.
Например, для многих парентеральных изделий или изделий, контактирующих с кровью, может быть использована водная экстрация путем заполнения или пропускания модельной среды через те пути, по которым протекает кровь или жидкость, там. где это возможно. Экстракцию из образцов проводят в течение времени, равного или превышающего максимальное время использования при однократном применении и при температуре, приближенной к максимальному реалистичному воздействию.
Для определения дозы ЭО и. где необходимо, ЭХГ, воздействующей на пациента или пользователя в течение времени применения изделия, используют метод водной экстракции, моделирующей условия применения
Примечание — Количества ЭО (или ЭХГ). выделенные путем экстракции, моделирующей условия применения, необязательно должны совпадать с их общим содержанием в изделии
Для извлечения остаточных количеств ЭО и ЭХГ (и ЭГ, если существует вероятность гидролиза ЭО) методом экстракции, моделирующей условия применения, в качестве модепьной среды обычно используют воду (92). Воду используют для экстрагирования остаточных количеств ЭО. а не для растворения материала самого образца. Если предполагается при проведении экстракции заполнение изделия водой, то это выполняют таким образом, чтобы не образовывалось воздушных пузырей Изделия, предназначенные для полного или частичного контакта с телом, экстрагируют при 37 °С (температура тела); изделия, не предназначенные для непосредственного контакта с телом (например, шприцы для подкожных инъекций), экстрагируют при 25 °С (комнатная температура) (см. ISO 10993-12). Если анализ проводят не сразу, экстракт сливают в емкость и герметично закрывают крышкой с уплотнительной прокладкой из политетрафторэтилена. Свободное пространство в емкости с любым раствором или экстрактом должно составлять менее 10 % общего объема. Экстракт можно хранить в холодильнике в течение нескольких суток (см. приложение F), но если использовали водную экстракцию, следует соблюдать осторожность, так как ЭО может превратиться в ЭГ или ЭХГ (или в оба продукта) в процессе экстракции, а также в период хранения экстракта (35). Исследователь должен оценить возможность такого превращения в месте проведения анализа при водной экстракции образца.
4.4 6.3 Исчерпывающая экстракция (приемлемый альтернативный метод)
4.4.6.3.1 Общее представление
Исчерпывающая экстракция представляет собой приемлемый альтернативный метод и может дать полезную информацию. Как правило, остаточные количества веществ, полученные этим методом, соответствуют дозе, большей или равной той. которую может получить пациент. Поскольку экстракция данного вида исключает возможность определения дозы в зависимости от времени, она не гарантирует, что масса остаточного количества ЭО не поступит к пациенту в первые 24 ч или 30 сут. воздействия. Однако если все допустимые предельные значения согласно 4.3 соблюдаются и показано, что остаточное содержание веществ укладывается в требования для изделий, подвергаемых исчерпывающей экстракции. нет необходимости проводить в дальнейшем экстракцию, моделирующую условия применения. Когда используют исчерпывающую экстракцию, обращают особое внимание на предельные значения, рассчитанные для первых 24 ч и 30 сут согласно 4.3. Методы исчерпывающей экстракции предназначены для определения полного содержания остаточных веществ в изделии. Для определения ЭО применяют методы экстракции, включающие в себя температурную экстракцию с последующим анализом равновесной паровой фазы, экстракцию растворителем, когда экстракт анализируют методом равновесной паровой фазы, прямым хроматографированием экстракта или путем получения бромгидрино-вого производного ЭО. которое определяют с использованием более чувствительного ГХ-детектора. такого как детектор захвата электронов.
4.4.6.3.2 Остаточное содержание ЭО
Для определения остаточного содержания ЭО методом исчерпывающей экстракции существует ряд модельных сред. Примером метода, в котором не используют модельную среду, является десорбция при повышенной температуре с последующим анализом равновесной паровой фазы, как описано в К.4.3 приложения К. При проведении анализа подобным образом методы с использованием равновесной паровой фазы считают исчерпывающими, поскольку они предназначены для выделения всех остаточных количеств ЭО в образце. Однако данным методам нельзя отдать предпочтение или они могут быть вообще невыполнимыми при анализе цельных крупных или сложных изделий. Выполняя анализы методом равновесной паровой фазы при определении остаточного содержания ЭО в полимерных материалах, таких как полиметилметакрилат, исследователь должен обратить особое внимание на то. чтобы обеспечить полное выделение ЭО.
Для методов жидкостной экстракции выбор подходящей модельной среды зависит от состава материала изделия и его фрагментов. Чтобы облегчить полное выделение ЭО из образца, в методе исчерпывающей экстракции предпочтение следует отдать жидкостям, которые растворяют материал образца, при условии, что данным методом в раствор не будут внесены мешающие вещества. Методы жидкостной экстракции в сочетании с анализом равновесной паровой фазы описаны в К.4.4 приложения К. Такие методы могут оказаться удобными для отделения ЭО от мешающих химических веществ, соэкстрагируемых из вещества, составляющего основу образца. Модельные среды, приведенные в В 3.2 приложения В. были оценены в ходе сравнительных межлабораторных исследований (112). (113) и (114). Аналитическая методика предписывает в случае использования метода исчерпывающей экстракции при первичном анализе исследуемого образца проводить более чем одну процедуру экстракции, чтобы убедиться в количественном извлечении. Для изделий, содержащих относительно малые количества остаточного ЭО. общепринятые методы могут не обеспечить экстракцию этих количеств даже после относительно продолжительной экстракции.
4.4.6.3.3 Остаточное содержание ЭХГ
Для экстракции остаточных количеств ЭХГ из медицинских изделий обычно используют воду, привлекая методы, схожие с ранее описанными для определения остаточного количества ЭО.
4.4.7 Результаты анализа и их интерпретация
4.4.7.1 Вычисление количества экстрагируемых остаточных веществ
Концентрацию остаточных веществ, обнаруженных в экстрактах. Се преобразовывают в количество. полученное пациентом, мг. Ма, как описано далее.
О)
Остаточные вещества, полученные экстракцией, моделирующей условия применения в медицинской практике, рассчитывают по следующей формуле:
Остаточные вещества, полученные исчерпывающей экстракцией, рассчитывают по следующей формуле:
■ <2)
где Md — остаточное количество в экстракте, мг; п — число экстракций;
Свп — количество ЭО. определенное по калибровочной кривой, мг/мл экстракта;
Ven — объем экстракта, мл. md — общая масса изделия, г; ms — масса образца, г.
Примечание — Это применимо только при экстракции порции изделия
4 4.7.2 Расчет средней действующей дозы Madd для сравнения с допустимыми значениями, представленными в 4.3
(3)
Для изделий постоянного контакта среднесуточную дозу Madd в миллиграммах в день рассчитывают по формуле
Мам ~ 2500'
где 2500 — продолжительность жизни, сут;
Md — остаточное количество в экстракте, мг.
Изделия постоянного контакта также должны соответствовать допустимым значениям, установленным для изделий длительного и кратковременного контакта.
Для изделий длительного контакта
30 '
где 30 — количество суток в месяце;
Md— остаточное количество в экстракте, мг.
Изделия длительного контакта также должны соответствовать допустимым значениям, установленным для изделий кратковременного контакта.
Для изделий кратковременного контакта
(5)
5 Выпуск продукции
5.1 Общие положения
Изделия соответствуют настоящему стандарту, если они отвечают требованиям по содержанию ЭО и. при необходимости. ЭХГ. Если имеются соответствующие экспериментальные данные по диффузионной кинетике остаточных веществ, изделия для оценки их качества можно сгруппировать по сходству материалов, процессу изготовления и применению (см. приложение D).
Для выпуска партий изделий, стерилизованных ЭО. используют один из методов, описанных в 5.2
9
5.2 Выпуск продукции без использования данных по кривым дегазации
Когда результаты по кривым дегазации изделий отсутствуют, изделия могут быть выпущены, если они соответствуют настоящему стандарту, а данные, полученные в результате исследований, проведенных по методикам, описанным в приложении К. соответствуют требованиям по содержанию ЭО и, при необходимости. ЭХГ, установленным в 4.3.
5.3 Процедура выпуска продукции с использованием кривых дегазации
Кривые дегазации используют для определения времени после стерилизации, необходимого для того, чтобы содержание остаточных веществ в изделиях или группах однородных изделий достигло значений, особенно в отношении значений ЭО. соответствующих требованиям 4,3. Изделия должны поставляться на рынок с учетом предварительно установленного времени после окончания стерилизации и условий, определяемых по экспериментальным кривым дегазации так. чтобы остаточные содержания ЭО в изделиях удовлетворяли требованиям 4.3. Далее в том же пара. Вопросы дегазации продукции, изложенные в приложении D. следует рассматривать на основе данных о качестве стерилизованных партий, которые хранились в условиях контролируемой дегазации или карантина в разные времена года, если температуры дегазации различались. Для получения экспериментальных данных при построении кривых дегазации необходимо учитывать повторную стерилизацию продукта и наличие других. находящихся рядом, изделий, стерилизованных ЭО.
Выпуск изделий, произведенных и стерилизованных в контролируемых условиях, как описано в ISO 11135-1. осуществляют, если собраны данные минимум от трех партий изделий, простерилизован-ных в разное время Миграция ЭО из большинства материалов и изделий протекает как кинетическая реакция первого порядка, то есть (1п[ЭО]) а (время после стерилизации). График зависимости натурального логарифма экспериментально определенной концентрации ЭО от времени, прошедшего после стерилизации, линейный. Выпуск изделий определен временем, прошедшим после стерилизации, соответствующим точке пересечения средней линии регрессии со значением максимально допустимого уровня содержания остаточных веществ Этот подход можно использовать для изделий, которые стерилизуются в количестве (число стерилизуемых партий), не достаточном для использования в методе, описанном ниже, или пока собираются данные по кривым дегазации. Возможно применение различных альтернативных методов; например, если кривые дегазации установлены, в результате чего образцы были исследованы, после того как были достигнуты предельные уровни остаточных веществ, интерполяция кривой дегазации может быть использована для установления выпуска продукта после стерилизации.
Использование для построения кривых дегазации регрессионного анализа данных, собранных в результате обработки достаточного числа временных точек, по меньшей мере, для трех партий изделий. обеспечивает выпуск изделий с допустимым содержанием остаточных веществ на прогнозируемом уровне Lp с доверительной вероятностью 95 %. Кривые времени — концентрация для изделий, выполненных из комбинации различных материалов, могут не соответствовать этой простой модели во всей рассматриваемой области и потребовать отдельного рассмотрения.
Прогнозируемый уровень Lp вычисляют по формулам:
где х0 — расчетное среднее значение времени выпуска изделия, соответствующее допустимому содержанию ЭО: у0 — значение логарифма допустимого содержания ЭО;
а — отрезок прямой линейной регрессии, полученной от графика In [ЕО] а время; b — угол наклона линии регрессии;
Lp — прогнозируемое предельное значение для одной единицы изделия;
Ю
— значение коэффициента Стьюдента при доверительной вероятности «с (л - 2) степенями свободы;
(S,,)2 — дисперсия линии регрессии для остаточных веществ; у„ — среднее значение логарифма ЭО; п — число измеряемых величин;
х, — индивидуальное время, прошедшее с момента стерилизации, при котором были проведены измерения;
х(1 — среднее время, прошедшее с момента стерилизации;
£(Х|- х(1)2 — сумма квадратов для х (время).
Все данные, используемые для выпуска медицинских изделий в соответствии с настоящим стандартом. должны быть получены в процессе экспериментов и анализов, выполненных по стандартизованным методикам.
При изменении условий стерилизации, перечисленных в приложении D. следует провести проверку содержания остаточных веществ в изделии. Если эта проверка показывает увеличение уровня остаточного содержания ЭО. чтобы убедиться в пригодности изделий, следует получить новые кривые дегазации остаточных веществ. Если эта проверка показывает снижение уровня остаточного содержания ЭО. нужно рассмотреть разработку новых кривых дегазации.
Примечание — Утверждение кривых дегазации обычно производят во время планового утверждения стерилизации в соответствии с ISO 11135-1.
11
Содержание
1 Область применения.................................................................1
2 Нормативные ссылки.................................................................1
3 Термины и определения...............................................................2
4 Основные требования................................................................2
4.1 Общие положения................................................................2
4.2 Категории изделий................................................................2
4.3 Допустимые предельные значения..................................................3
4 4 Определение остаточного содержания ЭО и ЭХГ......................................4
5 Выпуск продукции....................................................................9
5.1 Общие положения................................................................9
5.2 Выпуск продукции без использования данных по кривым дегазации......................10
5.3 Процедура выпуска продукции с использованием кривых дегазации......................10
Приложение А (обязательное) Оценка хроматограмм, полученных методом газовой
хроматографии..........................................................12
Приложение В (справочное) Газохроматографическое определение ЭО и ЭХГ..................15
Приложение С (справочное) Блок-схема и руководство по применению настоящего стандарта для определения остаточных количеств этиленоксида и этиленхлоргидрина
в медицинских изделиях..................................................18
Приложение D (справочное) Факторы, влияющие на содержание остаточных веществ в изделии.. .25 Приложение Е (справочное) Условия экстракции для определения остаточного содержания ЭО .. .26
Приложение F (справочное) Логическое обоснование введения предельных значений...........27
Приложение G (справочное) Установление предельных значений для ЭО......................30
Приложение Н (справочное) Установление допустимых пределов для ЭХГ.................... 44
Приложение I (справочное) Установление допустимых пределов для ЭГ.......................51
Приложение J (справочное) Приготовление контрольных растворов ЭО и ЭХГ..................54
Приложение К (справочное) Методы измерения остаточного содержания этиленоксида......... 56
Приложение ДА (справочное) Сведения о соответствии ссылочных международных стандартов
межгосударственным стандартам.........................................61
Библиография.......................................................................62
Введение
ИСО (Международная организация по стандартизации) является Всемирной федерацией национальных органов по стандартизации (органов-членов ИСО). Работу по подготовке международных стандартов проводят через ИСО технические комитеты. Каждый комитет-член, заинтересованный в деятельности, для которой был создан технический комитет, имеет право быть представленным в этом комитете. Международные организации, правительственные и неправительственные, имеющие связи с ИСО. также принимают участие в работе. ИСО тесно сотрудничает с Международной электротехнической комиссией (МЭК) по всем вопросам электротехнической стандартизации.
Международные стандарты проектируют в соответствии с правилами, приведенными в ИСО/МЭК Директивах, часть 2.
Основной задачей технических комитетов является подготовка международных стандартов. Проекты международных стандартов, принятые техническими комитетами, рассылают членам ИСО для голосования. Их опубликование в качестве международных стандартов требует одобрения не менее 75 % комитетов-членов, принимающих участие в голосовании.
Обращает на себя внимание то. что некоторые из элементов этого документа могут быть объектом прав на патент. ИСО не должна нести ответственность за идентификацию какого-либо или всех патентных прав.ISO 10993-7 был подготовлен техническим комитетом ISO/TC 194 «Биологическая оценка медицинских устройств».
Второе издание отменяет и заменяет первое издание (ISO 10993-7:1995). которое было технически пересмотрено.
В серию ISO 10993 входят следующие части под общим названием «Оценка биологического действия медицинских изделий»:
- часть 1 — Оценка и испытания в рамках процесса менеджмента риска;
- часть 2 — Требования к охране здоровья животных;
- часть 3 — Испытания на генотоксичность, канцерогенность и токсичность, влияющую на репродуктивность;
- часть 4 — Выбор испытаний, относящихся к взаимодействию с кровью;
- часть 5 — Испытания на цитотоксичность in vitro;
- часть 6 — Испытания для определения локальных эффектов после имплантации;
- часть 7 — Остаточное содержание этиленоксида после стерилизации;
- часть 9 — Структура идентификации и квантификации потенциальных продуктов разложения;
- часть 10 — Пробы на раздражение и аллергическую реакцию кожи;
- часть 11 — Испытания на системную токсичность;
- часть 12 — Приготовление проб и стандартные образцы;
- часть 13 — Идентификация и количественная оценка продуктов разложения в полимерных медицинских устройствах;
- часть 14 — Идентификация и количественная оценка продуктов разложения керамики;
- часть 15 — Идентификация и количественная оценка продуктов разложения металлов и сплавов;
- часть 16 — Концепция токсикокинетических исследований продуктов разложения и выщелачиваемых веществ;
- часть 17 — Установление допустимых пределов выщелачиваемых веществ;
- часть 18 — Определение химических характеристик материалов;
- часть 19 — Физико-химическая, морфологическая и топографическая характеристика материалов (технические требования);
- часть 20 — Принципы и методы исследования иммунотоксикологических испытаний медицинских изделий (технические требования).
Требования к разработке, утверждению и регулярному контролю процесса стерилизации эти-леноксидом для медицинских изделий приведены в международных стандартах, разработанных ISO/TC 198 Определенные требования, касающиеся медицинских изделий, для биологического тестирования. выбора испытаний и распределения изделий по категориям, приведены в различных международных стандартах, разработанных ISO/TC 194. Определенные требования для этиленоксида и других остаточных веществ процесса стерилизации были рассмотрены 180ЯС 194. Другие международные стандарты описывают специфические требования к биологическому тестированию конкретных продуктов.
IV
Во введении к ISO 11135-1:2007. при определении пригодности этиленоксида (ЭО) для стерилизации медицинских изделий, важно убедиться, что уровни остаточного ЭО. этиленхлоргидрина (ЭХО и этиленгликоля (ЭО представляют минимальный риск для пациента при нормальном использовании продукта. Таким образом, важно, чтобы во время планирования и разработки продукта рассматривалось применение альтернативных материалов и процессов стерилизации. Известно, что ЭО может вызывать различные биологические эффекты. При разработке настоящего стандарта учитывались эти эффекты, которые включают раздражение, повреждение органов, мутагенность и канцерогенность у человека и животных и влияние на репродуктивную функцию у животных. Также учитывались вредные эффекты ЭХГ и ЭГ. На практике для большинства изделий воздействие ЭО и ЭХГ значительно ниже, чем максимальные значения, обозначенные в настоящем стандарте.
Более того, при выборе стерилизации ЭО. вне зависимости от положений настоящего стандарта, воздействие остаточных количеств ЭО должно быть сведено к минимуму. Требования настоящего стандарта являются дополнением к биологической оценке и требованиям к испытаниям каждого отдельно созданного медицинского изделия, как обозначено в ISO 10993-1. Биологическая оценка и требования к испытаниям в сочетании с предельными значениями остаточных веществ процесса стерилизации ЭО формируют обоснование того, что изделие, стерилизованное ЭО. приемлемо для использования. Также обозначены максимальные доступные предельные значения остаточных веществ для ЭХГ. если он был обнаружен в медицинских изделиях, стерилизованных ЭО Местные эффекты (например, раздражение) также учитывались и включены в предел переносимого контакта (TCL). как представлено в п 4.3.5.2 и приложении G для допустимых значений ЭО и в л. 4.3.5.3 и приложении Н для допустимых значений ЭХГ.
V
МЕЖГОСУДАРСТВЕННЫЙ СТАНДАРТ
ИЗДЕЛИЯ МЕДИЦИНСКИЕ.
ОЦЕНКА БИОЛОГИЧЕСКОГО ДЕЙСТВИЯ МЕДИЦИНСКИХ ИЗДЕЛИЙ
Часть 7
Остаточное содержание этиленоксида после стерилизации
Medical devices Biological evaluation of medical devices Part 7. Ethylene oxide sterilization residuals
Дата введения — 2017—10—01
1 Область применения
Настоящий стандарт устанавливает допустимые предельные значения для остаточного количества этиленоксида (ЭО) и этиленхлортидрина (ЭХО в индивидуальных медицинских изделиях, стерилизованных ЭО. методы измерения ЭО и ЭХГ и требования, в соответствии с которыми могут осуществлять выпуск изделий. Дополнительная информация, включая руководство и блок-схему, демонстрирующую применение настоящего стандарта, приведена в справочных приложениях.
Стандарт не распространяется на изделия, стерилизованные ЭО. но не имеющие контакта с пациентом (например, диагностические устройства, использующиеся in vitro).
Примечание — Настоящий стандарт не устанавливает предельных значений для этиленгликоля(ЭГ)
2 Нормативные ссылки
Следующие документы необходимы для применения данного стандарта.
При датированной ссылке применимо только указанное издание. При ссылке без даты применимо последнее издание указанного документа, включая все поправки:
ISO 10993-1 Biological evaluation of medical devices — Part 1: Evaluation and testing within a risk management process (Оценка биологического действия медицинских изделий. Часть 1. Оценка и испытания в рамках процесса менеджмента риска)
ISO 10993-3 Biological evaluation of medical devices — Part 3: Tests for genotoxicity. carcinogenicity and reproductive toxicity (Оценка биологического действия медицинских изделий. Часть 3. Испытания на генотоксичность, канцерогенность и токсичность влияющую на репродуктивность)
ISO 10993-10 Biological evaluation of medical devices — Part 10: Tests for irritation and delayed-type hypersensitivity (Оценка биологического действия медицинских изделий. Часть 10. Пробы на раздражение и аллергическую реакцию кожи)
ISO 10993-12 Biological evaluation of medical devices — Part 12: Sample preparation and reference materials (Биологическая оценка медицинских изделий. Часть 12. Приготовление проб и стандартные образцы)
ISO 10993-17 Biological evaluation of medical devices — Part 17: Establishment of allowable limits for leachable substances. (Оценка биологического действия медицинских изделий. Часть 17. Установление допустимых пределов выщелачиваемых веществ)
Издание официальное
3 Термины и определения
В настоящем стандарте применены термины по ISO 10993-1, ISO 10993-17, а также следующие термины с соответствующими определениями:
3.1 экстракция, моделирующая условия применения изделий: Экстракция с использованием воды в качестве модельной среды, моделирующая реальные условия применения, выполняемая в соответствии с требованиями настоящего стандарта и позволяющая оценить остаточные количества ЭО и ЭХГ. воздействующие на пациента или пользователя изделий в процессе их применения по назначению.
3.2 исчерпывающая экстракция: Экстракция, выполняемая до тех пор, пока количество ЭО и ЭХГ в последующей порции модельной среды не будет составлять менее 10 % определенного при первой экстракции или пока не будет аналитически значимого увеличения в определяемых совокупных остаточных уровнях.
Примечание — Так как невозможно показать исчерпывающий характер при оценке остаточных количеств. определение исчерпывающей экстракции принимают в указанном выше виде
4 Основные требования
Примечание — Информация по источникам ограничений в настоящем стандарте, а также другая важная дополнительная информация и руководство к использованию настоящего стандарта приведены в справочных приложениях
4.1 Общие положения
В настоящем подразделе устанавливают максимально допустимые уровни остаточного содержания ЭО для отдельных изделий, стерилизованных ЭО. Как указано в предисловии к ISO 11135-1:2007, при определении пригодности ЭО для стерилизации медицинских изделий, важно убедиться, что уровни остаточного ЭО, ЭХГ и этиленгликоля (ЭГ) представляют минимальный риск для пациента при обычном использовании продукта. Более того, при избрании стерилизации ЭО. вне зависимости от положений настоящего стандарта, воздействие остаточных количеств ЭО должно быть сведено к минимуму. Регламентируют также максимальное содержание ЭХГ в тех случаях, когда его обнаруживают в медицинских изделиях, стерилизованных ЭО. Местные эффекты (например, раздражение) были учтены и включены в предел переносимого контакта (TCL). как обозначено в п. 4.3.5.2 и приложении G для ЭО и в n. 4.3.5.3 и приложении Н для ЭХГ. Для содержания ЭГ никакие ограничения не устанавливают, поскольку оценка степени риска (см. приложение I) показывает, что вычисленные допустимые уровни выше, чем те, которые могут появиться в медицинском изделии. Тем не менее существует потенциал острых гемодинамических и гемолитических эффектов после быстрого внутривенного введения гиперосмолярных соединений как ЭГ, Не ожидается, что стерилизация медицинских изделий ЭО приведет к образованию гиперосмолярных растворов. Методы для определения ЭО и ЭХГ приведены в 4 4
Требования, изложенные в настоящем стандарте, являются дополнением к программам биологических исследований, представленным в ISO 10993-1. При применении изделий, стерилизованных ЭО. следует обратить особое внимание на ISO 10993-3 и ISO 10993-10. При выполнении требований ISO 10993-1 следует учитывать остаточные количества ЭО в момент выпуска продукции для кахщого конкретного изделия.
Результаты биологической оценки изделия могут обусловить более жесткие, чем приведенные в
4,3 требования, предназначенные для учета системных реакций.
4.2 Категории изделий
Для установления максимальной суточной дозы ЭО и ЭХГ, которая может выделяться из изделия и воздействовать на пациента, изделие в зависимости от продолжительности контакта относят к определенной категории. Согласно ISO 10993-1, подразделу 5.3 изделия по продолжительности контакта относят к одной из трех категорий:
a) кратковременный контакт (А) — изделия, чье общее однократное, многократное или повторное использование не превышает 24 ч;
b) длительный контакт (В) — изделия, чье общее однократное, многократное или повторное использование может превысить 24 ч, но не более 30 сут;
2
с) постоянный контакт (С) — изделия, чье общее однократное, многократное или повторное использование превышает 30 сут.
Если материал или изделие могут быть отнесены более чем к одной категории по длительности контакта, следует выбирать более жесткие условия исследований. При многократном применении изделия для принятия решения, к какой категории следует отнести изделие, учитывают возможный кумулятивный эффект, принимая во внимание период времени между повторными применениями.
Примечание — В настоящем стандарте термин «многократное применение» означает применение одного и того же изделия более одного раза (например, картриджи для диализатора).
4.3 Допустимые предельные значения
4.3.1 Общие положения
Для каждого медицинского изделия максимально допустимые дозы ЭО и ЭХГ. которые воздействуют на пациента, не должны превышать значений, приведенных ниже для соответствующей категории. в которую изделие было отнесено в соответствии с 4.2.
Предельные значения для изделий постоянного и длительного контакта выражены в максимальной среднесуточной дозе. Для изделий, имеющих постоянный контакт, введены дополнительные ограничения для первых 24 ч и для первых 30 сут, а для изделий длительного контакта — для первых 24 ч. Эти ограничения устанавливают предельные значения ЭО и ЭХГ. которые могут воздействовать на пациента в ранние периоды времени. Если существуют данные, необходимо рассмотреть пропорциональное снижение пределов, если одновременно применяют несколько изделий с возможными остаточными веществами, или пропорциональное повышение, если изделие применяется только частично во время рассматриваемого периода. Эти сопутствующие факторы воздействия (CEF) и пропорциональные факторы воздействия (PEF) приведены в ISO 10993-17. Методика, которую использовали для установки допустимых предельных значений, описана в приложении G для ЭО. в приложении Н —для ЭХГ, а обоснование для рассмотрения установления допустимых пределов для ЭГ — в приложении I.
4.3.2 Допустимая доза при постоянном контакте изделия с поверхностью тканей пациента
Среднесуточная доза ЭО для пациента должна быть не более 0,1 мг/сут. Дополнительные требования к максимальной дозе ЭО должна быть не более:
- 4 мг — в течение первых 24 ч;
- 60 мг — в течение первых 30 сут;
- 2.5 г — в течение жизни.
Среднесуточная доза ЭХГ для пациента должна быть не более 0,4 мг/сут. Дополнительные требования к максимальной дозе ЭХГ должна быть не более:
- 9 мг — в течение первых 24 ч;
- 60 мг — в течение первых 30 сут;
- Юг — в течение жизни.
4.3.3 Допустимая доза при длительном контакте изделия с поверхностью тканей пациента
Среднесуточная доза ЭО для пациента должна быть не более 2 мг/день. Дополнительные требования к максимальной дозе ЭО должна быть не более:
- 4 мг — в течение первых 24 ч;
- 60 мг — в течение первых 30 сут.
Среднесуточная доза ЭХГ должна быть не более 2 мг/сут.
Дополнительные требования к максимальной дозе ЭХГ должна быть не более:
- 9 мг — в течение первых 24 ч;
- 60 мг — в течение первых 30 сут.
4.3.4 Допустимая доза при кратковременном контакте изделия с поверхностью тканей пациента
Среднесуточная доза ЭО для пациента должна быть не более 4 мг. Среднесуточная доза ЭХГ для пациента не должна превышать 9 мг.
4.3.5 Предельное значение допустимой дозы при контакте изделий и имплантатов с поверхностью тканей пациента
4.3.5.1 Общее представление
Предельное значение допустимой дозы (TCL) выражено в количестве микрограммов на квадратный сантиметр для ЭО и миллиграммов на квадратный сантиметр для ЭХГ. Единица квадратного сантиметра представляет собой площадь поверхности контакта пациент-изделие.
3
Примечание — Целью данного положения является предотвращение местного раздражения за счет выделения ЭО или ЭХГ из изделия
4.3.5.2 Предельное значение допустимой дозы для ЭО
Либо предельное значение допустимого контакта ЭО для изделий и имплантатов, входящих в контакт с поверхностью, не должен превышать 10 мкг/см2, либо должно быть продемонстрировано незначительное раздражение как обозначено в ISO 10993-10.
4.3.5.3 Предельное значение допустимой дозы для ЭХГ
Либо предельное значение допустимого контакта ЭХГ для изделий и имплантатов, входящих в контакт с поверхностью, не должен превышать 5 мг/см2, либо может быть выявлено незначительное раздражение, как обозначено в ISO 10993-10.
4.3.6 Особые случаи
Для систем, состоящих из нескольких изделий, предельные значения допустимой дозы следует рассчитывать отдельно для каждого изделия, входящего в контакт с пациентом.
Остаточное содержание ЭО в интраокулярных линзах должно быть не более 0,5 мкг ЭО на линзу в сутки и 1,25 мкг на линзу. Предельные значения допустимой дозы для других интраокулярных изделий устанавливают пропорционально массе изделия, причем масса интраокулярной линзы принята за 20 мг. Может понадобиться оценить приемлемость уровней ЭХГ в интраокулярных изделиях, сделанных из вязко-эластичных материалов, содержащих хлор, так как уровень ЭХГ. приводящий к офтальмологической токсичности, примерно в четыре раза выше, чем соответствующий уровень ЭО.
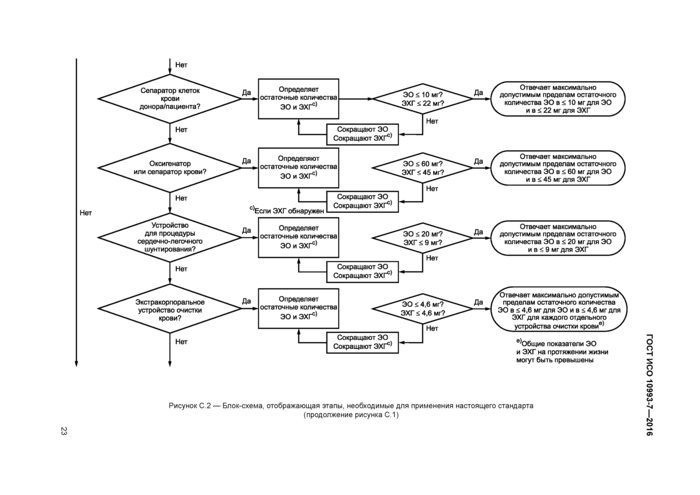
Для сепараторов клеток крови, используемых при заборе крови пациентов и доноров, максимальной допустимой дозой ЭО является 10 мг, а максимальная допустимая доза ЭХГ не должна превышать 22 мг.
Для оксигенаторов и сепараторов крови максимальной допустимой дозой ЭО для пациента является 60 мг, а максимальная допустимая доза ЭХГ не должна превышать 45 мг.
Для изделий, используемых в процедурах сердечно-легочного шунтирования, максимально допустимыми пределами являются 20 мг для ЭО и 9 мг для ЭХГ.
Для изделий, предназначенных для экстракорпоральной очистки крови, используют предельные содержания ЭО и ЭХГ из расчета 4.6 мг/изделие, но допустимая доза ЭО в течение всей жизни может быть превышена.
Для простыней, которые предназначены для контакта только с неповрежденной кожей, максимально допустимыми пределами являются предел переносимого контакта 10 мкг/см2 для ЭО и 5 мг/см2 для ЭХГ, или может быть выявлено незначительное раздражение, как обозначено в ISO 10993-10.
Примечание — Обоснование для определения предельного содержания ЭО для некоторых изделий, не соответствующих общим требованиям, представлено в приложении F
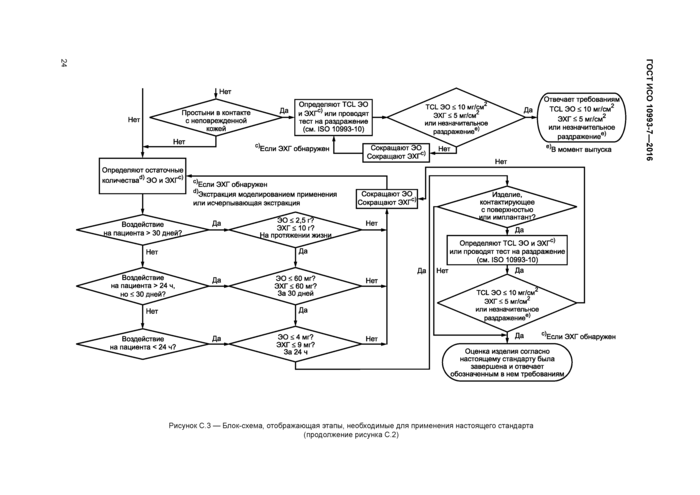
Блок-схема, предоставляющая руководство по применению настоящего стандарта к определению остаточного содержания ЭО в медицинских изделиях, представлена в приложении С.
4.4 Определение остаточного содержания ЭО и ЭХГ
4.4.1 Общие положения
4.4.1.1 Процедура
Метод определения остаточного содержания ЭО и ЭХГ для проверки соответствия требованиям, изложенным в 4,3. заключается в экстрагировании остаточных количеств из образцов, количественной оценке, определении контактной поверхности изделия, анализе и интерпретации полученных данных.
ОПАСНОСТЬ — Специалистам следует выполнять все работы, связанные с использованием химических реагентов и растворителей, необходимых для данных методов, под вытяжным шкафом в соответствующей защитной одежде, а также ознакомиться с информацией по безопасности материалов перед использованием каждого химического вещества. Работники здравоохранения, использующие медицинские изделия, стерилизованные ЭО, должны применять соответствующие меры предосторожности для защиты от воздействия остаточных количеств в соответствии с требованиями правил охраны труда и техники безопасности.
4.4.1.2 Этиленоксид
Это воспламеняющийся и высокоактивный газ. оказывающий раздражающее действие на поверхность тела. Обладает мутагенным действием при многих условиях, проявляет фетотоксичные и тератогенные свойства и может негативно влиять на тестикулярную функцию и повреждать многие системы 4
органов человека. При изучении канцерогенных свойств на животных ингаляционное воздействие вызывало неопластические изменения нескольких типов, включая лейкемию, опухоли мозга и молочной железы, в то время как прием внутрь и внутрикожное введение вызывали опухоли лишь в месте контакта. В одном исследовании сообщается о высоком уровне рака и смертности в некоторых субпопуляциях работников, оказавшихся под воздействием ЭО. Однако в нескольких подобных исследованиях не нашли такой корреляции (см. ссылки (177). (178) и (181)). В 1994 г. Международное агентство по изучению рака (IARC) классифицировало ЭО как человеческий канцероген (класс 1). основываясь в первую очередь на его механизме действия (см. ссылку (75)).
4.4.1.3 Этиленхлоргидрин
Это воспламеняющаяся жидкость, которая оказывает раздражающее действие на поверхность тела, вызывает острую токсичность и легко всасывается в кожу в количествах, оказывающих токсическое действие. Обладает слабым мутагенным действием, может вызывать фетотоксические и тератогенные изменения, повреждать различные органы, включая легкие, почки, центральную нервную систему и сердечно-сосудистую систему. Исследования канцерогенности на животных дали отрицательные результаты.
4.4.2 Определение остаточного содержания
Для определения остаточных количеств ЭО и. при необходимости. ЭХГ. воздействующих на пациента. необходимо использовать узаконенные методики экстракции и анализа.
Если по результатам анализов, проведенных по методикам, представленным в К 4 2 или К 4 7 приложения К. ЭХГ не обнаружен, в дальнейшем его определение не требуется.
Примечание — Многие методы газовой хроматографии (GC), применяющие капиллярную, а не наполненную колонку, произведут результаты ЭО. ЭХГ и ЭГ при одном анализе образца
Основным принципом выбора пригодных методов экстракции (п. 4 4 6) для количественного определения ЭО или. при необходимости. ЭХГ является оценка дозы, воздействующей на пациента, для того, чтобы показать соответствие требованиям, приведенным в 4.3.
Если обосновано, что остаточное содержание ЭО и ЭХГ. определяемое методом исчерпывающей экстракции, соответствует требованиям 4.3, экстракцию, моделирующую условия применения в медицинской практике, не проводят. При применении исчерпывающей экстракции обращают особое внимание на предельные значения для первых 24 ч и 30 сут в соответствии с 4.3.
Известно много аналитических методов для определения остаточного содержания ЭО после стерилизации; их обзоры представлены в Библиографии.
Однако большое разнообразие материалов и конструкторских решений при создании медицинских изделий в ряде случаев может вызвать трудности в определении остаточного содержания ЭО и ЭХГ методами, приведенными в Библиографии. Поэтому любой аналитически значимый метод (т. е. обеспечивающий достоверность, точность, линейность, чувствительность и селективность) может быть использован при условии, что он обоснован.
Приложение А содержит общие требования утверждения для методов газовой хроматографии.
4.4.3 Приготовление образцов и контроля
4.4.3.1 Приготовление образцов
Образцы, которые предназначены для определения остаточного содержания ЭО и ЭХГ. должны быть отобраны таким образом, чтобы они в достаточной степени отражали свойства изделия в целом. При отборе образцов следует обратить внимание на ряд факторов, указанных в приложении D. Так как многие из этих факторов влияют не только на первоначальные значения остаточных веществ во всех компонентах изделия, но и на скорость диссипации этих веществ, их также необходимо учитывать, начиная с забора образцов из готовой партии и предоставления в лабораторию для проведения анализа. Извлечение образцов изделий из готовой партии сразу после окончания цикла стерилизации и отправка их в лабораторию, находящуюся удаленно от места стерилизации, а также хранение отобранных образцов в лаборатории для последующего анализа могут нарушить корреляцию в содержании остаточных количеств ЭО и ЭХГ в отобранных образцах и в оставшихся в готовой партии. Более того, если образцы изделий из готовой партии не могут быть отобраны и доставлены таким образом, чтобы эффект дегазации был незначительным, проводят исследование для установления соответствия дегазации анализируемых образцов и изделий из партии в разное время года.
Следует контролировать или минимизировать влияние лабораторных условий на скорость дегазации образцов, которые отобраны из партии изделий (см. D.1.5 приложения D). При проведении анализа соблюдают меры безопасности для оператора и аналитика.
5