ГОСТ EN 15835-2013
Продукты пищевые. Определение охратоксина А в продуктах на зерновой основе для питания грудных детей и детей раннего возраста. Метод ВЭЖХ с применением иммуноаффинной колоночной очистки экстракта и флуориметрического детектирования
Купить ГОСТ EN 15835-2013 — бумажный документ с голограммой и синими печатями. подробнее
Распространяем нормативную документацию с 1999 года. Пробиваем чеки, платим налоги, принимаем к оплате все законные формы платежей без дополнительных процентов. Наши клиенты защищены Законом. ООО "ЦНТИ Нормоконтроль"
Наши цены ниже, чем в других местах, потому что мы работаем напрямую с поставщиками документов.
Способы доставки
- Срочная курьерская доставка (1-3 дня)
- Курьерская доставка (7 дней)
- Самовывоз из московского офиса
- Почта РФ
Устанавливает метод определения охратоксина А в продуктах на зерновой основе для питания грудных детей и детей раннего возраста с помощью высокоэффективной жидкостной хроматографии с применением очистки экстракта на колонке с иммуноаффинным сорбентом и флуориметрическим детектированием. Метод прошел валидацию путем межлабораторных испытаний проб, загрязненных охратоксином А естественным и искусственным путем, в диапазоне содержания от 0,050 мкг/кг до 0,217 мкг/кг. Подробная информация о валидации метода приведена в разделе 8 и в приложении В. Дополнительные исследования показали, что метод применим в отношении продуктов для детского питания на зерновой основе, в состав которых входят восемь различных типов злаковых культур, мед и какао при содержании охратоксина А до 3,540 мкг/кг.
Идентичен EN 15835:2010
Оглавление
1 Область применения
2 Нормативные ссылки
3 Сущность метода
4 Реактивы
5 Оборудование
6 Процедура проведения испытания
7 Анализ с помощью ВЭЖХ
8 Обработка результатов
9 Прецизионность
10 Протокол испытаний
Приложение А (справочное) Типичные хроматограммы
Приложение В (справочное) данные по прецизионности метода
Приложение С (справочное) Результаты внутрилабораторных испытаний
Библиография
| Дата введения | 01.07.2015 |
|---|---|
| Добавлен в базу | 01.02.2017 |
| Актуализация | 01.01.2021 |
Этот ГОСТ находится в:
Организации:
| 27.06.2013 | Утвержден | Межгосударственный Совет по стандартизации, метрологии и сертификации | 57-П |
|---|---|---|---|
| 22.11.2013 | Утвержден | Федеральное агентство по техническому регулированию и метрологии | 1707-ст |
| Разработан | ОАО ВНИИС | ||
| Разработан | ГНУ ВНИИКОП Россельхозакадемии | ||
| Издан | Стандартинформ | 2016 г. |
Foodstuffs. Determination of ochratoxin A in cereal based foods for infants and young children. HPLC method with immunoaffinity column cleanup and fluorescence detection
Чтобы бесплатно скачать этот документ в формате PDF, поддержите наш сайт и нажмите кнопку:

стр. 1

стр. 2

стр. 3

стр. 4

стр. 5

стр. 6

стр. 7

стр. 8

стр. 9

стр. 10
стр. 11

стр. 12

стр. 13
стр. 14
стр. 15
стр. 16
стр. 17

стр. 18

стр. 19
МЕЖГОСУДАРСТВЕННЫЙ СОВЕТ ПО СТАНДАРТИЗАЦИИ. МЕТРОЛОГИИ И СЕРТИФИКАЦИИ
(МГС)
INTERSTATE COUNCIL FOR STANDARDIZATION. METROLOGY AND CERTIFICATION
ГОСТ
EN 15835— 2013
(ISC)
МЕЖГОСУДАРСТВЕННЫЙ
СТАНДАРТ
ПРОДУКТЫ ПИЩЕВЫЕ
Определение охратоксина А в продуктах на зерновой основе для питания грудных детей и детей раннего возраста
Метод ВЭЖХ с применением иммуноаффинной колоночной очистки экстракта и флуориметрического детектирования
(EN 15835:2010, ЮТ)
Издание официальное
Москва
Стандартинформ
2016
Предисловие
Цели, основные принципы и основной порядок проведения работ по межгосударственной стандартизации установлены ГОСТ 1.0-92 «Межгосударственная система стандартизации. Основные положения» и ГОСТ 1.2-2009 «Межгосударственная система стандартизации. Стандарты межгосударственные, правила и рекомендации по межгосударственной стандартизации. Правила разработки, принятия, применения, обновления и отмены»
Сведения о стандарте
1 ПОДГОТОВЛЕН Открытым акционерным обществом «Всероссийский научно-исследовательский институт сертификации» (ОАО «ВНИИС») при участии специалистов Государственного научного учрехздения Всероссийского научно-исследовательского института консервной и овощесушильной промышленности Российской академии сельскохозяйственных наук (ГНУ ВНИИКОП Россельхозакадемии) на основе собственного аутентичного перевода на русский язык европейского регионального стандарта, указанного в пункте 4
2 ВНЕСЕН Федеральным агентством по техническому регулированию и метрологии (Росстандарт) (ТК 335)
3 ПРИНЯТ Межгосударственным советом по стандартизации, метрологии и сертификации (протокол от 27 июня 2013 г. № 57-П)
За принятие проголосовали:
|
Краткое наименование страны no МК (ИСО 3166) 004—97 |
Код страны по МК (ИСО 3166)004—97 |
Сокращенное наименование национального органа по стандартизации |
|
Армения |
AM |
Минэкономики Республики Армения |
|
Беларусь |
BY |
Госстандарт Республики Беларусь |
|
Киргизия |
KG |
Кыргызстандарт |
|
Молдова |
MD |
Молдова-Стандарт |
|
Россия |
RU |
Росстандарт |
|
Узбекистан |
UZ |
Уэста ндарт |
4 Настоящий стандарт идентичен европейскому региональному стандарту EN 15835:2010 Foodstuffs. Determination of ochratoxin A in cereal based foods for infants and young children. HPLC method with immunoaffinity column cleanup and fluorescence detection (Продукты пищевые Определение охратокси-на А в продуктах на зерновой основе для питания грудных детей и детей раннего возраста. Метод ВЭЖХ с применением иммуноаффинной колоночной очистки экстракта и флуориметрического детектирования).
Перевод с английского языка (ел)
Официальный экземпляр европейского регионального стандарта, на основе которого подготовлен настоящий межгосударственный стандарт, имеется в Федеральном агентстве по техническому регулированию и метрологии Российской Федерации.
Степень соответствия — идентичная (IDT)
5 Приказом Федерального агентства по техническому регулированию и метрологии от 22 ноября 2013 г. № 1707-ст межгосударственный стандарт ГОСТ EN 15835—2013 введен в действие в качестве национального стандарта Российской Федерации с 1 июля 2015 г.
6 ВВЕДЕН ВПЕРВЫЕ
Информация об изменениях к настоящему стандарту публикуется в ежегодном информационном указателе «Национальные стандарты», а текст изменений и поправок — в ежемесячном информационном указателе «Национальные стандарты». В случае пересмотра (замены) или отмены настоящего стандарта соответствующее уведомление будет опубликовано в ежемесячном информационном указателе «гНациональные стандарты». Соответствующая информация, уведомление и тексты размещаются также в информационной системе общего пользования — на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет
© Стандартинформ, 2016
В Российской Федерации настоящий стандарт не может быть полностью или частично воспроизведен. тиражирован и распространен в качестве официального издания без разрешения Федерального агентства по техническому регулированию и метрологии
7.2 Приготовление градуировочных растворов
Готовят пять градуировочных растворов, для чего во флаконы по 5.18 вносят стандартный раствор охратоксина А по 4.29 в объемах, указанных в таблице 2, с помощью автоматических пипеток по 5.17 или микрошприцев по 5.12 подходящей вместимости. Растворитель (смесь толуола и уксусной кислоты) выпаривают досуха в токе азота при комнатной температуре. В каждый флакон вносят 1 см3 смеси метанола и раствора уксусной кислоты по 4 21. флакон укупоривают, содержимое перемешивают с использованием миксера типа Вортекс. Диапазон массовых концентраций охратоксина А в приготовленных растворах соответствует диапазону его содержания в пробе от 0.021 до 0.320 мкг/кг при соблюдении условий данного метода.
Градуировочные растворы следует предохранять от воздействия света и хранить в морозильной камере при температуре около минус 18 °С.
Диапазон вариации площади пика охратоксина А при анализе одного и того же градуировочного раствора в течение короткого промежутка времени не должен превышать ± 3 % среднего значения.
|
Таблица 2 — Приготовление градуировочных растворов | ||||||||||||||||||||||||
| ||||||||||||||||||||||||
|
Примечание — Если массовая концентрация охратоксина А в анализируемом растворе пробы превышает верхнюю границу диапазона градуировки, допускается построение градуировочного графика в другом диапазоне массовых концентраций охратоксина А В качестве альтернативы раствор пробы для хроматографического анализа разбавляют до получения в нем массовой концентрации охратоксина А. находящейся в пределах диапазона градуировки |
7.3 Построение градуировочного графика
Градуировку осуществляют ежедневно перед проведением испытаний, для чего проводят хроматографический анализ градуировочных растворов, приготовленных по 7.2. при объеме инжекции 50 мм3. При построении градуировочного графика в системе координат откладывают значения массы охратоксина А в нанограммах, против соответствующих значений площади пика. Полученный график проверяют на соответствие требованиям линейности.
7.4 Определение охратоксина А в растворе пробы
Проводят хроматографический анализ растворов проб при объеме инжекции 50 мм3 при тех же условиях, как и при анализе градуировочных растворов.
7.5 Идентификация пика аналита
Пик охратоксина А на хроматограмме раствора анализируемой пробы идентифицируют по совпадению его времени удерживания с временем удерживания пика охратоксина А на хроматограммах градуировочных растворов. Необходимо, чтобы массовая концентрация охратоксина А в растворе пробы находилась в границах диапазона градуировки. Если массовая концентрация охратоксина А в растворе пробы превышает верхнюю границу диапазона градуировки, допускается построение градуировочного графика в другом диапазоне. В качестве альтернативы раствор пробы разбавляют до получения в нем массовой концентрации охратоксина А в пределах диапазона градуировки. Разбавление раствора пробы учитывают во всех последующих расчетах.
rOCTEN 15835—2013
8 Обработка результатов
По градуировочному графику определяют массу охратоксина А в нанограммах в инжектированной аликвоте раствора пробы.
(2)
Содержание охратоксина А в пробе wota, мкг/кг. рассчитывают по формуле
V2V4Vsmt
где та —
Ъ-
V3-
^4-
масса охратоксина А в инжектированной аликвоте раствора пробы, соответствующая площади пика охратоксина А на хроматограмме раствора пробы, нг;
объем метил-третбутилового эфира, использованный для экстракции, см3 (V, = 100 см3); объем аликвоты эфирного экстракта, отобранной для выпаривания и лерерастворения в смеси фосфатно-хлоридного буферного раствора с метанолом, см3 (V2 = 75 см3); объем смеси фосфатно-хлоридного буферного раствора с метанолом, в котором перерас-творена аликвота эфирного экстракта, см3 (1/3 = 40 см3);
V's-
объем аликвоты экстракта, лерерастворенного в фосфатно-хлоридном буферном растворе с метанолом, отобранной для очистки на иммуноаффинной колонке, см3 (V4 = 30 см3); объем приготовленного раствора пробы для хроматографического анализа, мм3 (У5 = 300 мм3);
ms
объем инжекции раствора пробы для хроматографического анализа, мм3 (Уб = 50 мм3); масса пробы для анализа, г (т5 = 25 г).
9 Презиционность
9.1 Общие положения
Подробности межлабораторных испытаний по определению прецизионности метода приведены в таблице В.1. Значения метрологических характеристик, полученные в результате межлабораторных испытаний, могут быть не применимы к другим содержаниям аналита и другим типам матриц, чем те. что указаны в приложении В.
9.2 Повторяемость
Абсолютное расхождение между результатами двух независимых единичных испытаний, полученными одним методом на идентичном объекте испытаний в одной лаборатории одним оператором с использованием одного оборудования в течение короткого промежутка времени, не должно превышать предел повторяемости г более чем в 5 % случаев.
Значения предела повторяемости для продуктов для детского питания на зерновой основе равны:
х = 0.023 мкг/кг (холостая проба);
х = 0.050 мкг/кг, г = 0,066 мкг/кг (проба, загрязненная естественным путем);
х = 0.093 мкг/кг. г= 0.047 мкг/кг (искусственно загрязненная проба);
х = 0.096 мкг/кг, г = 0,122 мкг/кг (проба, загрязненная естественным путем);
х = 0.217 мкг/кг, г= 0.218 мкг/кг (проба, загрязненная естественным путем).
9.3 Воспроизводимость
Абсолютное расхождение мехщу результатами двух единичных испытаний, полученными одним методом на идентичном объекте испытаний в разных лабораториях разными операторами с использованием разного оборудования не должно превышать предел воспроизводимости R более чем в 5 % случаев.
9
rOCTEN 15835—2013
Значения предела воспроизводимости для продуктов для детского питания на зерновой основе равны:
х = 0,023 мкг/кг (холостая проба):
х = 0,050 мкг/кг, R = 0,089 мкг/кг (проба, загрязненная естественным путем); х = 0,093 мкг/кг. R = 0.076 мкг/кг (искусственно загрязненная проба); х = 0,096 мкг/кг, R - 0.122 мкг/кг (проба, загрязненная естественным путем); х = 0,217 мкг/кг. R = 0.273 мкг/кг (проба, загрязненная естественным путем).
10 Протокол испытаний
Протокол испытаний должен содержать, как минимум, следующие сведения:
a) всю информацию, необходимую для идентификации пробы;
b) ссылку на настоящий стандарт;
c) дату и время отбора пробы (если известны);
d) дату поступления пробы в лабораторию;
e) дату проведения испытания;
О результаты испытания с указанием единиц измерения;
д) все особенности, наблюдавшиеся при проведении испытания;
h) все операции, не оговоренные в методе или рассматриваемые как необязательные, которые могли повлиять на результат испытания.
Ю
rOCTEN 15835—2013
Приложение A (справочное)
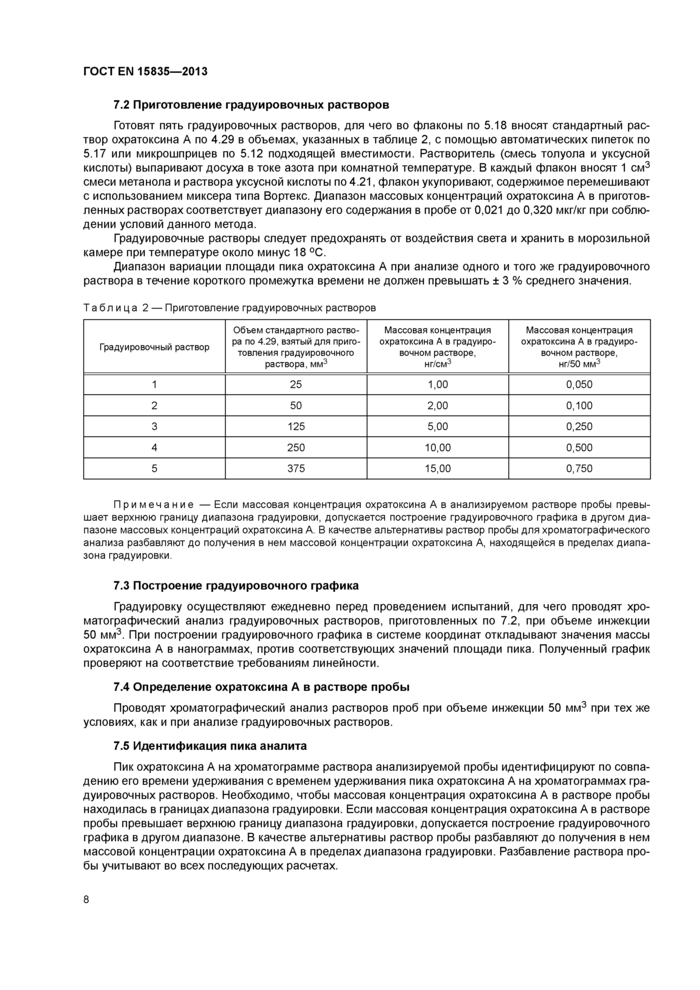
Типичные хроматограммы
|
Аналитический сигнал, мВ |
Рисунок А.1 — Хроматограмма пробы продукта для детского питания на зерновой основе, загрязненной охратоксином А естественным путем. Содержание охратоксмна А 0,191 мкг/кг Хроматограмма получена при межлабораторных испытаниях.
Условия хроматографического анализа — по 7 1, градиентное элюирование
|
Аналитический сигнал. мВ |
Рисунок А.2 — Хроматограмма пробы продукта для детского питания на зерновой основе, искусственно загрязненной охратоксином А. Содержание охратоксина А 0.290 мкг/кг. Хроматограмма получена при внутрилабораторных испытаниях. Условия хроматографического анализа: подвижная фаза — смесь метанола с уксусной кислотой массовой долей 9 % в объемном соотношении 60:40, иэократическое элюирование
11
Приложение В (справочное)
Данные по прецизионности метода
Приведенные в таблице В 1 данные получены в результате межлабораторных испытаний, организованных в рамках Программы по стандартизации, измерениям и испытаниям Европейского сообщества в соответствии с ИСО 5725-2 (1), ИСО 5725-4 (2) и ИСО 5725-6 (3) Для этих испытаний использованы пробы продуктов для детского питания на зерновой основе, загрязненные охратоксином А как естественным, так и искусственным путем [5].
|
Таблица В1 — Данные по прецизионности методики | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
rOCTEN 15835—2013
Приложение С (справочное)
Результаты внутрилабораторных испытаний
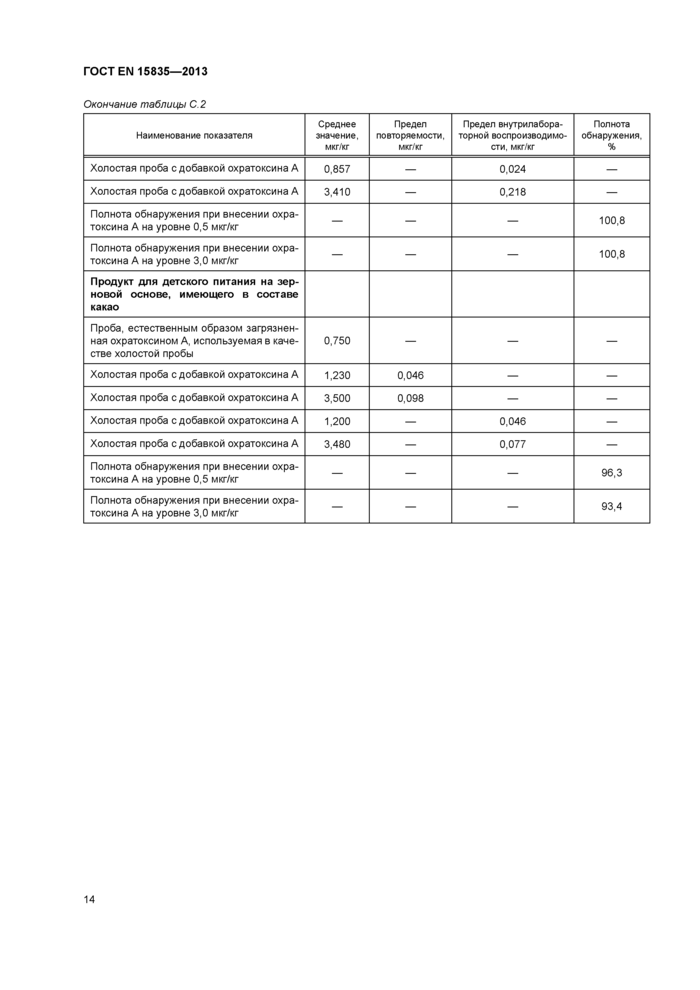
Приведенные в таблице С 1 данные получены в результате внутрилабораторных испытаний методики при ее разработке в рамках проекта SMT-CT96-2045 при Программе по стандартизации, измерениям и испытаниям Европейского сообщества (четвертый этап) Данные таблицы С 2 получены при внутрилабораторных испытаниях, организованных Centro Nacional de Alimentacion, Испания Объектами испытаний являлись взятые из торговой сети пробы трех видов продуктов для детского питания на зерновой основе, имеющие в своем составе соответственно восемь различных видов злаков, мед и какао (6).
|
Таблица С 1 — Предел количественного определения (наименьшее содержание охратоксина А. при котором проведена валидация методики) | ||||||||||
|
|
Таблица С 2 — Данные по прецизионности методики по результатам внутрилабораторных испытаний | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
ГОСТ EN 15835—2013
Содержание
1 Область применения.................................................................1
2 Нормативные ссылки.................................................................1
3 Сущность метода....................................................................2
4 Реактивы...........................................................................2
5 Оборудование.......................................................................5
6 Процедура проведения испытания......................................................6
7 Анализ с помощью ВЭЖХ.............................................................7
8 Обработка результатов...............................................................9
9 Прецизионность.....................................................................9
10 Протокол испытаний................................................................10
Приложение А (справочное) Типичные хроматограммы.....................................11
Приложение В (справочное) Данные по прецизионности метода..............................12
Приложение С (справочное) Результаты внутрилабораторных испытаний......................13
Библиография.......................................................................15
III
МЕЖГОСУДАРСТВЕННЫЙ СТАНДАРТ
ПРОДУКТЫ ПИЩЕВЫЕ
Определение охратоксина А в продуктах на зерновой основе для питания грудных детей и детей раннего возраста
Метод ВЭЖХ с применением иммуноаффинной колоночной очистки экстракта и флуориметрического детектирования
Foodstuffs Determination of ochratoxm A in cereal based foods for infants and young children HPLC method with immunoaffinity column cleanup and fluorescence detection
Дата введения — 2015—07—01
1 Область применения
Настоящий стандарт устанавливает метод определения охратоксина А в продуктах на зерновой основе для питания грудных детей и детей раннего возраста с помощью высокоэффективной жидкостной хроматографии (ВЭЖХ) с применением очистки экстракта на колонке с иммуноаффинным сорбентом и флуориметрическим детектированием. Метод прошел валидацию путем межлабораторных испытаний проб, загрязненных охратоксином А естественным и искусственным путем, в диапазоне содержания от 0.050 до 0,217 мкг/кг. Подробная информация о валидации метода приведена в разделе 8 и в приложении В. Дополнительные исследования показали, что метод применим в отношении продуктов для детского питания на зерновой основе, в состав которых входят восемь различных типов злаковых культур, мед и какао при содержании охратоксина А до 3,540 мкг/кг (см. приложение С и [6]).
ПРЕДУПРЕЖДЕНИЕ — Применение настоящего стандарта предусматривает использование опасных веществ, материалов, процедур и оборудования. В задачи настоящего стандарта не входит решение проблем. связанных с обеспечением безопасности при его применении. Ответственность за принятие надлежащих мер предосторожности и соблюдение правил техники безопасности лежит на пользователе настоящего стандарта.
2 Нормативные ссылки
Приведенные ниже ссылочные нормативные документы являются обязательными для применения настоящего стандарта. Датированные ссылки предполагают возможность использования только указанного издания документа. В случае недатированных ссылок используют последнее издание документа. включая все дополнения.
EN ISO 3696:1995. Water for analytical laboratory use — Specification and test methods (ISO 3696:1987) (Вода для лабораторного анализа. Технические требования и методы испытаний (ISO 3696:1987)].
Издание официальное
3 Сущность метода
Анализируемую пробу экстрагируют метил-третбутиловым эфиром после добавления смешанного раствора фосфорной кислоты молярной концентрации 0.5 моль/дм3 и хлористого натрия молярной концентрации 2 моль/дм3. Экстракт выпаривают и перерастворяют в шеей метанола с фосфат но-хлорид-ным буферным раствором. После удаления липофильных компонентов гексаном экстракт пропускают через колонку с иммуноаффинным сорбентом, содержащим антитела, специфичные к охратоксину А. Охратоксин А элюируют с колонки метанолом и определяют с помощью ВЭЖХ с детектированием по флуоресценции, для усиления которой применяют послеколоночную дериватизацию аммиаком.
Примечание — В некоторых исследованиях показана возможность использования ВЭЖХ без послеколо-ночной дериватизации аммиаком, однако чувствительность определения при этом, как минимум, в два раза ниже В этом случае необходимо использовать другие параметры флуориметрического детектирования (длину волны возбуждения 333 нм. длину волны эмиссии 460 нм).
4 Реактивы
4.1 Общие положения
Для проведения анализа при отсутствии особо оговоренных условий используют только реактивы гарантированной аналитической чистоты и воду не ниже первой степени чистоты по EN ISO 3696:1995. Используемые растворители по степени чистоты должны быть пригодны для применения в анализе с помощью ВЭЖХ. Допускается использовать доступные для приобретения готовые растворы при условии. что их характеристики не отличаются от приведенных ниже.
ПРЕДУПРЕЖДЕНИЕ —Утилизацию отработанных растворителей проводят в соответствии с требованиями законодательства по охране окружающей среды. Способы обезвреживания отработанных реактивов приведены в материалах Международного агентства по исследованию рака (IARC) [4].
4.2 Гелий газообразный очищенный сжатый.
4.3 Азот.
4.4 Натрий фосфорнокислый двухзамещенный безводный (Na2HP04) или гидратированный (Na2HP04 • 12Н20).
4.5 Калий хлористый.
4.6 Калий фосфорнокислый однозамещенный.
4.7 Натрий хлористый.
4.8 Натрия гидроксид.
4.9 Аммония гидроксид, водный раствор массовой долей w (NH4OH) = 25 % (реактив для лосле-колоночной дериватизации).
Перед использованием раствор дегазируют с применением дегазатора по 5.21.7.
4.10 Кислота соляная, раствор массовой долей w(HCI) = 37 % (по результатам ацидиметрического анализа).
4.11 Кислота фосфорная, раствор массовой долей wO^PO^ = 85 %.
4.12 Кислота соляная, раствор молярной концентрации с(НС1) = 0,1 моль/дм3
Раствор готовят разбавлением 8,28 см3 раствора соляной кислоты по 4.10 водой до 1 дм3.
4.13 Натрия гидроксид, раствор молярной концентрации c(NaOH) = 0,1 моль/дм3
Раствор готовят растворением 4 г гидроксида натрия по 4.8 в 1 дм3 воды.
4.14 Раствор фосфатно-хлоридный буферный молярной концентрации хлористого натрия
c(NaCI) = 120 ммоль/дм3, хлористого калия с(КС1) = 2,7 ммоль/дм3, фосфатного буфера
с(1\1а2НР04 + КН2Р04) = 10 ммоль/дм3, pH 7,4
Растворяют 8.0 г хлористого натрия по 4.7, 1,2 г безводного двухзамещенного фосфорнокислого натрия (или 2.9 г гидратированного двухзамещенного фосфорнокислого натрия (Na2HP04 12Н20)] по 4 4, 0,2 г однозамещенного фосфорнокислого калия по 4 6 и 0,2 г хлористого калия по 4 5 в 900 см3 воды.
2
rOCTEN 15835—2013
Значение pH приготовленного раствора доводят до 7.4 ед. pH путем добавления раствора соляной кислоты по 4.12. либо раствора гидроксида натрия по 4.13, после чего объем раствора доводят водой до 1 дм3. В качестве альтернативы допускается использовать доступный для приобретения готовый раствор с аналогичными характеристиками.
4.15 Смешанный раствор фосфорной кислоты концентрации 0,5 моль/дм3 и хлористого
натрия молярной концентрации 2 моль/дм3
Растворяют 118 г хлористого натрия по 4.7 примерно в 900 см3 воды. К раствору добавляют 33 см3 фосфорной кислоты по 4.11, объем полученного раствора доводят водой до 1 дм3.
4.16 Кислота уксусная ледяная массовой долей w (СН3СООН) i 99.7 %.
4.17 Кислота уксусная, раствор объемной долей 9 %
Смешивают 90 см3 уксусной кислоты по 4.16 и 910 см3 воды.
4.18 Гексан.
ПРЕДУПРЕЖДЕНИЕ — Гексан является легковоспламеняющимся веществом. Все операции, предполагающие использование этого растворителя, должны проводиться в вытяжном шкафу. Длительный контакт с этим реактивом может привести к серьезным последствиям для здоровья.
4.19 Метанол для градиентной ВЭЖХ.
4.20 Толуол.
4.21 Смесь метанола и раствора уксусной кислоты
Смешивают 72 объемных части метанола по 4.19 с 18 частями раствора уксусной кислоты по 4.17.
4.22 Метил-третбутиловый эфир.
ПРЕДУПРЕЖДЕНИЕ — Метил-третбутиловый эфир является взрывоопасным реактивом, поэтому экстракцию проб следует проводить с использованием взрывобезопасного блендера, помещенного в вытяжной шкаф. Центрифугирование экстрактов следует проводить при пониженных температурах (от 4 °С до 8 °С).
4.23 Смесь толуола и уксусной кислоты
Смешивают толуол по 4 20 с ледяной уксусной кислотой по 4.16 в обьемном соотношении 99:1.
4.24 Подвижная фаза А для ВЭЖХ
Раствор уксусной кислоты по 4.17.
4.25 Подвижная фаза В для ВЭЖХ
Метанол по 4.19.
Подвижные фазы дегазируют, например с использованием гелия по 4.2. Гелий барботируют через подвижные фазы в резервуарах со скоростью от 50 до 100 см3/мин. В качестве альтернативы возможно также использование вакуумного дегазатора.
4.26 Колонка с иммуноаффинным сорбентом
Для проведения испытания пригодна колонка с иммуноаффинным сорбентом, содержащим иммобилизованные антитела, специфичные в отношении охратоксина А. имеющая сорбционную емкость по охратоксину Ане менее 100 нг и обеспечивающая полноту обнаружения не менее 85% при внесении в нее 3 нг охратоксина А в растворе, состоящем из 15 объемных частей метанола по 4 19 и 85 объемных частей фосфатно-хлоридного буферного раствора по 4.14.
4.27 Охратоксин А кристаллический или в виде ампульного препарата в пленочной форме.
ПРЕДУПРЕЖДЕНИЕ — Охратоксин А является сильным нсфротоксином с иммунотоксичсскими. тератогенными и, предположительно, генотоксическими свойствами. Международное агентство по исследованию рака характеризует охратоксин А как потенциальный канцероген для человека (группа 2В). Все работы, связанные с подготовкой пробы и приготовлением стандартных растворов, должны проводиться в вытяжном шкафу с использованием защитной одежды, перчаток и защитных очков.
4.28 Охратоксин А, основной раствор
Готовят основной раствор охратоксина А номинальной массовой концентрации 10 мкг/см3 в смеси толуола и уксусной кислоты по 4 23.
Ап** М100
г/Ь
(1)
Pot* =
Для определения точного значения массовой концентрации охратоксина А в основном растворе регистрируют его оптическую плотность в диапазоне длин волн от 300 нм до 370 нм с интервалом 5 нм в кварцевой кювете длиной оптического пути 1 см с использованием спектрофотометра по 5.22. В качестве раствора сравнения используют смешанный растворитель по 4 23. По полученному спектру определяют длину волны, соответствующую максимальной оптической плотности. Массовую концентрацию охратоксина A. pota. мкг/см3. рассчитывают по формуле
где Дтах — максимальное значение оптической плотности в данном диапазоне длин волн (в данном случае при 333 нм);
М — молярная масса охратоксина А. г/моль (М = 403,8 г/моль);
с — молярный коэффициент поглощения охратоксина А в смешанном растворителе по 4.23.
м2/моль, (с = 544 м2/моль); b — длина оптического пути кюветы, см.
Основной раствор хранят при температуре около минус 18 °С. Перед использованием раствор выдерживают до достижения комнатной температуры. При указанных условиях хранения срок годности раствора составляет 12 мес. При хранении основного раствора более 6 мес перед его использованием проверяют соответствие фактической массовой концентрации охратоксина А ранее установленному значению.
4.29 Охратоксин А, стандартный раствор
Пипеткой отбирают порцию основного раствора по 4 28. содержащую точно 400 нг охратоксина А. и помещают ее в мерную колбу вместимостью 10 см3 по 5.13, объем содержимого в колбе доводят до метки смесью толуола с уксусной кислотой по 4.23. содержимое колбы тщательно перемешивают. Массовая концентрация охратоксина А в полученном стандартном растворе составляет 40 нг/см3.
Раствор хранят при температуре около минус 18 °С. Перед использованием раствор выдерживают до достижения комнатной температуры. При указанных условиях хранения срок годности раствора составляет 12 мес. При хранении раствора более 6 мес перед его использованием проверяют соответствие фактической массовой концентрации охратоксина А ранее установленному значению.
4.30 Охратоксин А, раствор для искусственного загрязнения проб при контроле полноты
обнаружения
Пипеткой отбирают порцию основного раствора по 4 28. содержащую точно 2500 нг охратоксина А. и помещают ее в мерную колбу вместимостью 50 см3 по 5.13. объем содержимого в колбе доводят до метки смесью толуола с уксусной кислотой по 4.23. содержимое колбы тщательно перемешивают. Массовая концентрация охратоксина А в полученном растворе составляет 50 нг/см3.
Раствор хранят при температуре около минус 18 °С. Перед использованием раствор выдерживают до достижения комнатной температуры. При указанных условиях хранения срок годности раствора составляет 12 мес. При хранении раствора более 6 мес перед его использованием проверяют соответствие фактической массовой концентрации охратоксина А ранее установленному значению.
4
TOCTEN 15835—2013
5 Оборудование
5.1 Общие положения
При проведении испытания используют общеупотребительные лабораторную посуду и оборудование. в частности перечисленные ниже.
5.2 Блендер высокоскоростной.
5.3 Весы аналитические, пригодные для взвешивания с точностью до 0,0001 г.
5.4 Весы лабораторные, пригодные для взвешивания с точностью до 0.1 г.
5.5 Устройство для вакуумной фильтрации многопозиционное, приспособленное для установки иммуноаффинных колонок (манифолд).
5.6 Бумага фильтровальная, пригодная для качественного анализа.
5.7 Бумага индикаторная для определения pH в диапазоне от 0 до 14.
5.8 Центрифуга лабораторная рефрижераторная, обеспечивающая центробежное ускорение 15300д и рабочую температуру 4 °С.
5.9 Стаканы центрифужные вместимостью 250 см3, снабженные винтовыми крышками, химически устойчивые к воздействию метил-третбутилового эфира и обеспечивающие отсутствие деформаций при центробежном ускорении 15300д.
5.10 Испаритель ротационный, снабженный водяной баней.
5.11 Корпусы от одноразовых медицинских шприцев для использования в качестве резервуаров вместимостью 5, 20 и 50 см3, запорные краны и приспособления для подсоединения иммуноаффинных колонок.
5.12 Микрошприцы вместимостью 25, 50,100, 500 и 1000 мм3.
5.13 Колбы мерные вместимостью 10. 50 и 1000 см3.
5.14 Насос вакуумный.
5.15 Колбы круглодонные вместимостью 100 см3.
5.16 Пипетки градуированные.
5.17 Пипетки автоматические вместимостью 100 и 1000 мм3, снабженные подходящими наконечниками.
5.18 Сосуды стеклянные, аналогичные сосудам для автосамплера газового хроматографа вместимостью около 1.8 см3, снабженные обжимными крышками.
5.19 Воронка делительная вместимостью 250 см3.
5.20 Устройство перемешивающее (миксер) типа Вортекс.
5.21 Система для ВЭЖХ в указанной ниже комплектации:
5.21.1 Инжектор, обеспечивающий объем ввода 50 мм3.
5.21.2 Резервуары для подвижной фазы и реактива для послеколоночной дериватизации.
5.21.3 Насос для подачи подвижной фазы, пригодный для работы в градиентном режиме, обеспечивающий скорость потока 1 см3/мин.
5.21.4 Детектор флуоориметрический. позволяющий проводить измерения при длинах волн возбуждения и эмиссии соответственно 390 и 440 нм.
5.21.5 Самописец, интегратор или компьютерная система обработки данных.
5.21.6 Колонка для ВЭЖХ аналитическая, длиной 25 см, внутренним диаметром 4.7 мм, заполненная обращенно-фазовым сорбентом, например, с привитыми октадецильными группами (ODS). диаметром частиц 5 мкм, обеспечивающая отделение пика охратоксина А от сопутствующих пиков матрицы пробы. Перекрывание пика охратоксина А другими пиками не должно превышать 10 % его высоты. Для предотвращения потери работоспособности аналитической колонки следует использовать защитную колонку, заполненную подходящим обращенно-фазовым сорбентом.
5.21.7 Дегазатор (применяется по выбору пользователя) для дегазации подвижных фаз по 4 24 и 4 25 и реактива для послеколоночной дериватизации по 4.9.
5.21 8 Термостат колонок, обеспечивающий рабочую температуру (50 ± 1) °С.
5.21.9 Система для послеколоночной дериватизации. состоящая из безпульсационного насоса, соединительного элемента для трех капилляров, имеющего нулевой мертвый объем, и реактора в виде капилляра из нержавеющей стали длиной 10 см и внутренним диаметром 0.25 мм.
5.22 Спектрофотометр, пригодный для измерений оптической плотности в ультрафиолетовой области спектра, в комплекте с кварцевыми кюветами.
5
6 Процедура проведения испытания
6.1 Экстракция
Перед отбором пробы для анализа лабораторную пробу тщательно перемешивают. 25 г пробы для анализа, взвешенной с точностью до 0.1 г. помещают в центрифужный стакан по 5.9. В стакан добавляют 100 см3 смешанного раствора фосфорной кислоты и хлористого натрия по 4 15. Содержимое стакана перемешивают с использованием миксера по 5.20. В стакан добавляют 50 см3 метил-трет-бутилового эфира по 4.22. Содержимое стакана гомогенизируют в течение 2 мин с использованием высокоскоростного блендера по 5.2. после чего центрифугируют в течение 10 мин при центробежном ускорении 15300 д с применением охлахщения приблизительно до 4 °С.
Верхний органический слой переносят в коническую колбу с пробкой или в мерный цилиндр. Осадок в центрифужном стакане экстрагируют новой порцией метил-третбутилового эфира объемом 50 см3, при этом содержимое стакана гомогенизируют в течение 2 мин и центрифугируют, как описано выше. Органические экстракты объединяют.
Аликвоту объединенного органического экстракта объемом 75 см3 помещают в круглодонную колбу по 5.15 и выпаривают на ротационном испарителе по 5.10 при температуре от 35 °С до 40 °С до прекращения дистилляции растворителя. Остаток в круглодонной колбе растворяют описанным ниже способом для получения раствора экстрактивных веществ в смеси 15 объемных частей метанола по 4.19 и 85 объемных частей фосфатно-хлоридного буферного раствора по 4.14. В колбу вносят порцию метанола объемом 3 см3, которой тщательно омывают внутреннюю поверхность колбы. Полученный метанольный экстракт переносят с помощью пастеровской пипетки в делительную воронку по 5.19. Процедуру ополаскивания колбы повторяют еще раз, используя новую порцию метанола объемом 3 см3. Метанольные экстракты объединяют в делительной воронке. Далее в делительную воронку вносят 34 см3 фосфатно-хлоридного буферного раствора по 4.14. содержимое воронки интенсивно встряхивают в течение 1 мин.
В делительную воронку вносят 50 см3 гексана по 4.18. содержимое воронки аккуратно встряхивают в течение 1 мин. После разделения слоев нижний слой переносят в другую делительную воронку, а верхний гексановый слой отбрасывают. Данную процедуру повторяют с использованием новой порции гексана объемом 50 см3. Нижний слой переносят в центрифужный стакан по 5.9 и центрифугируют в течение 10 мин при центробежном ускорении 15300дс применением охлахздения приблизительно до температуры 4 °С для отделения остатка жировых веществ. Водную фазу отделяют и фильтруют в мерный цилиндр через воронку с бумажным фильтром по 5.6.
Примечание — Следует избегать перемешивания водной и органической фаз Если полное отделение водной фазы затруднительно, отбирают пипеткой и фильтруют не менее 35 см3 водной фазы
6.2 Очистка экстракта на колонке с иммуноаффинным сорбентом
Иммуноаффинную колонку по 4 26 подсоединяют к вакуумному манифолду по 5.5. К колонке присоединяют резервуар вместимостью 50 см3 или 20 см3 по 5.11.
Перед кондиционированием колонку выдерживают до достижения ею комнатной температуры. Для кондиционирования в резервуар, присоединенный к верхнему концу колонки, вносят 20 см3 фосфатно-хлоридного буферного раствора по 4 14 и дают ему протечь через колонку под действием силы тяжести со скоростью от 2 до 3 см3/мин. Следует принять меры к тому, чтобы небольшое количество раствора (около 0.5 см3) осталось над колонкой до момента внесения раствора пробы.
Аликвоту экстракта, полученного по 6.1, объемом 30 см3 вносят в резервуар и пропускают через иммуноаффинную колонку. Скорость протока при этом не должна превышать 3 см3/мин. Экстракт пропускают под действием силы тяжести, либо создавая небольшое давление с помощью шприца, либо с применением небольшого разрежения.
ПРЕДУПРЕЖДЕНИЕ — При использовании вакуумного манифолда следует обращать особое внимание на предотвращение возрастания скорости протока через колонку до величины, при которой возможны потери определяемого вещества.
6
rOCTEN 15835—2013
6.3 Приготовление раствора пробы для хроматографического анализа
Колонку промывают, пропуская через нее 10 см3 воды. Далее отсоединяют резервуар и удаляют остаток воды на внутренней поверхности верхней части колонки с помощью фильтровальной бумаги или жгута из хлопковой ваты. Затем из колонки удаляют воду с помощью вакуума или путем продувания через нее воздуха шприцем в течение 1 мин.
К колонке присоединяют резервуар по 5.11 вместимостью 5 см3 и проводят элюирование охраток-сина А по следующей двухступенчатой процедуре:
- в резервуар вносят 4 см3 метанола и дают ему протечь через колонку. При появлении первой капли элюата закрывают запорный кран. По истечении 1 мин открывают кран и медленно элюируют охратоксин А в стеклянную пробирку;
- собирают элюат, элюирование заканчивают продуванием колонки воздухом до полного удаления из нее растворителя. Элюат выпаривают досуха в слабом токе азота (например, при давлении от 0,7 до 1.0 бар) при нагревании на водяной бане при температуре около 45 °С. Остаток после выпаривания растворяют в 300 мм3 смеси метанола и уксусной кислоты по 4 21. Полученный раствор пробы переносят в стеклянный сосуд по 5.18 или. если предполагается немедленное проведение ВЭЖХ-анализа. непосредственно в сосуд автосамплера.
6.4 Приготовление раствора пробы с добавкой аналита для контроля полноты
обнаружения
Порцию холостой пробы продукта для детского питания массой 25 г. измеренной с точностью до 0.1 г. помещают в центрифужный стакан по 5.9. На поверхность пробы наносят 40 мм3 раствора охра-токсина А по 4.30. после чего пробу выдерживают в вытяжном шкафу не менее 2 ч для удаления растворителя. Дальнейшие операции проводят в соответствии с 6.1.
7 Анализ с помощью ВЭЖХ
7.1 Условия хроматографического анализа
Приведенные ниже параметры обеспечивают удовлетворительное качество хроматографического анализа при использовании колонки по 5.21.6 и подвижных фаз А и В по 4 24 и 4 25:
|
Таблица 1— Условия градиентного элюирования | ||||||||||||||||||||||||
|
- температура термостата колонок, в том числе лредколонки — (50 ± 1) °С;
- объем инжекции — 50 мм3;
- температура автосамплера (применяется по выбору пользователя) — от 15 °С до 20 °С;
- скорость потока раствора гидроксида аммония по 4 9 — 0.2 см3/мин.
Примечания
1 Приемлемой альтернативой указанным условиям является анализ в изократическом режиме с использованием подвижной фазы, полученной смешиванием четырех объемных частей раствора уксусной кислоты по 4 17 и шести объемных частей метанола по 4 19 Градиентное элюирование более предпочтительно, поскольку оно продлевает срок службы колонки
2 Необходимо, чтобы значение pH элюента на выходе из детектора находилось в щелочной области (типичное значение pH около 9) Значение pH элюента контролируют с использованием индикаторной бумаги
3 Следует принимать меры по предотвращению распространения паров аммиака в воздухе, например, поместив в резервуар для сбора элюата насыщенный раствор лимонной кислоты
4 Условия ВЭЖХ-анализа. оговоренные в 7.1. обеспечивают полное отделение пика охратоксина А от небольшого пика, следующего непосредственно за ним
7