ГОСТ 8.450-81
Государственная система обеспечения единства измерений. Шкала окислительных потенциалов водных растворов
Купить ГОСТ 8.450-81 — бумажный документ с голограммой и синими печатями. подробнее
Распространяем нормативную документацию с 1999 года. Пробиваем чеки, платим налоги, принимаем к оплате все законные формы платежей без дополнительных процентов. Наши клиенты защищены Законом. ООО "ЦНТИ Нормоконтроль"
Наши цены ниже, чем в других местах, потому что мы работаем напрямую с поставщиками документов.
Способы доставки
- Срочная курьерская доставка (1-3 дня)
- Курьерская доставка (7 дней)
- Самовывоз из московского офиса
- Почта РФ
Распространяется на шкалу окислительных потенциалов водных растворов и устанавливает значения потенциалов окислительно-восстановительных систем в интервале минус 133 - плюс 1236 мВ при температуре 25 град.С. Диапазон температур шкалы - 5-95 град.С
| Дата введения | 01.01.1983 |
|---|---|
| Добавлен в базу | 01.09.2013 |
| Актуализация | 01.01.2021 |
Этот ГОСТ находится в:
- Раздел Экология
- Раздел 71 ХИМИЧЕСКАЯ ПРОМЫШЛЕННОСТЬ
- Раздел 71.040 Аналитическая химия
- Раздел 71 ХИМИЧЕСКАЯ ПРОМЫШЛЕННОСТЬ
- Раздел Электроэнергия
- Раздел 71 ХИМИЧЕСКАЯ ПРОМЫШЛЕННОСТЬ
- Раздел 71.040 Аналитическая химия
- Раздел 71 ХИМИЧЕСКАЯ ПРОМЫШЛЕННОСТЬ
Организации:
| 24.12.1981 | Утвержден | Госстандарт СССР | 5624 |
|---|
State system for ensuring the uniformity of measurements. Oxidation potentials scale for aqueous solutions
Чтобы бесплатно скачать этот документ в формате PDF, поддержите наш сайт и нажмите кнопку:

стр. 1

стр. 2

стр. 3

стр. 4
стр. 5

стр. 6
стр. 7
стр. 8
стр. 9

стр. 10
ГОСУДАРСТВЕННЫЙ СТАНДАРТ
СОЮЗА ССР
ГОСУДАРСТВЕННАЯ СИСТЕМА ОБЕСПЕЧЕНИЯ ЕДИНСТВА
ИЗМЕРЕНИИ
ШКАЛА ОКИСЛИТЕЛЬНЫХ ПОТЕНЦИАЛОВ ВОДНЫХ РАСТВОРОВГОСТ 8.450-81
Издание официальное
ГОСУДАРСТВЕННЫЙ КОМИТЕТ СССР ПО СТАНДАРТАМ
Москва
РАЗРАБОТАН Государственным комитетом СССР по стандартам ИСПОЛНИТЕЛИ
(руко-
Н. Г. Лордкипанидзе, И. И. Залюбовский, В. М. Мохов,
водители темы), Ж. П. Микадзе, М. И, Рубцов
Н. П. Комарь
ВНЕСЕН Государственным комитетом СССР по стандартам
Член Госстандарта Л. К. Исаев
УТВЕРЖДЕН И ВВЕДЕН В ДЕЙСТВИЕ Постановлением Государственного комитета СССР по стандартам от 24 декабря 1981 г. № 5624
УДК 543.257.1.085.089.6 : 006.354 Группа Т86
ГОСУДАРСТВЕННЫЙ СТАНДАРТ СОЮЗА ССР
Государственная система обеспечения единства
ГОСТ
8.450—81
измерений
ШКАЛА ОКИСЛИТЕЛЬНЫХ ПОТЕНЦИАЛОВ ВОДНЫХ РАСТВОРОВ
State system for ensuring the uniformity of measurements. Oxidation potentials scale for aqueous solutions
Постановлением Государственного комитета СССР по стандартам от 24 декабря 1981 г. № 5624 срок введения установлен
с 01.01 1983 г.
1. Настоящий стандарт распространяется на шкалу окислительных потенциалов водных растворов и устанавливает значения потенциалов окислительно-восстановительных систем в интервале минус 133 — плюс 1236 мВ при температуре 25 °С. Диапазон температур шкалы — 5—95 °С.
2. Растворы, воспроизводящие шкалу окислительных потенциалов, используют в качестве поверочных средств при настройке и поверке потенциометрических анализаторов жидкости и оксредмет-рических электродов.
3. Шкала окислительных потенциалов водных растворов основана на воспроизведении значений потенциалов растворов, указанных ниже.
Раствор 1. Раствор концентрацией относительно железоаммонийных квасцов с [NH4Fe(S04)2* 12НгО]=0,00182 моль/л, соли Мора с [(NH4)2Fe(S04)2'6H20] = 0,0182 моль/л, трилона Б с [CioHi408N2Na2*2H20] = 0)04 моль/л, ацетата натрия с [CH3COONaX ХЗН20] = 0,08 моль/л и серной кислоты с [H2S04]=0,02 моль/м.
Раствор 2. Раствор концентрацией относительно железоаммонийных квасцов с [NH4Fe(S04)2'12Н20] = 0,01 моль/л, соли Мора с [(NH4)2Fe(S04)2-6Н20]=0,01 моль/л, трилона Б с [CioHi4C>8N2Na2X Х2Н20] = 0,04 моль/л, ацетата натрия с [CH3COONa • ЗН20]= = 0,08 моль/л и серной кислоты с [H2S04] = 0,02 моль/л.
Издание официальное ★
Раствор 3. Раствор концентрацией относительно железоаммонийных квасцов с [NH4Fe(S04)2* 12Н2О] = 0,01818 моль/л, соли Мора с [(NH4)2Fe(SO4)2'6H2O]=0,00182 моль/л, трилона Б с [CioHi408N2Na2-2H20] = 0,04 моль/л, ацетата натрия с [CH3COONaX ХЗН20]=0,08 моль/л и серной кислоты с [H2S04]:==0,02 моль/л.
Перепечатка воспрещена
© Издательство стандартов, 1982
Стр. 2 ГОСТ 8.450-81
Раствор 4. Раствор концентрацией относительно тетраборно-кислого натрия с [Na2B407 • 10Н2О] = 0,0042 моль/л, калия фосфорнокислого однозамещенного с [КН2Р04]=0,0145 моль/л, натрия фосфорнокислого двузамещенного с [Na2HP04]=0,0145 моль/л, насыщенный хингидроном (Ci2Hio04).
Раствор 5. Раствор концентрацией относительно калия фосфорнокислого однозамещенного с [КН2РО4] = 0,25 моль/л и натрия фосфорнокислого двузамещенного с [Na2HP04] = 0,025 моль/л, насыщенный хингидроном (Ci2Hi0O4).
Раствор 6. Раствор концентрацией относительно калия железосинеродистого с [K3Fe(CN)6] = 0,0000909 моль/л, калия железистосинеродистого с [K4-Fe(CN) 6 *ЗН20]=0,000909 моль/л, калия фосфорнокислого однозамещенного с [КН2Р04] = 0,025 моль/л и натрия фосфорнокислого двузамещенного с [Na2HP04] = 0,025 моль/л.
Раствор 7. Раствор концентрацией относительно калия железо-синеродистого с [K3Fe(CN)6] = 0,00005 моль/л, калия железистосинеродистого с [K4Fe(CN)6-3H2O]=0,00005 моль/л, калия фосфорнокислого однозамещенного с [КН2РО4] — 0,025 моль/л, натрия фосфорнокислого двузамещенного с [Na2HP04]=0,025 моль/л.
Раствор 8. Раствор концентрацией относительно калия железосинеродистого с [K3Fe(CN)6}=0,05 моль/л, калия железистосинеродистого с [K4Fe(CN)6'3H20] = 0,05 моль/л, калия фосфорнокислого однозамещенного с [КН2Р04] = 0,025 моль/л, натрия фосфорнокислого двузамещенного с [Na2HP04] = 0,025 моль/л.
Раствор 9. Раствор концентрацией относительно калия железосинеродистого с [КзРе(СЫ)б] = 0,0909 моль/л, калия железистосинеродистого с [K4Fe(CN)6-3H2O]=0,00909 моль/л, калия фосфорнокислого однозамещенного с [КН2Р04]=0,025 моль/л, натрия фосфорнокислого двузамещенного с [Na2HP04] = 0,025 моль/л.
Раствор 10. Раствор концентрацией относительно калия тетраоксалата с [КН3С408-2Н20]=0,0175 моль/л, натрия тетраборнокис-лого с [Na2B402* ЮН20] = 0,0065 моль/л, насыщенный хингидроном (С12Н10О4).
Раствор 11. Раствор концентрацией относительно калия тетраоксалата с [КНзС408-2Н20]=0,05 моль/л, насыщенный хингидроном (Ci2Hi0O4).
Раствор 12. Раствор концентрацией относительно железоаммонийных квасцов с [NH4Fe(S04)2-12Н20]==0,05 моль/л, соли Мора с [(NH4)2Fe(S04)2*6H20] = 0,05 моль/л, серной кислоты с [H2S04]= = 0,05 моль/л.
Раствор 13. Раствор концентрацией относительно железоаммонийных квасцов с [NH4Fe(S04h- 12Н20] = 0,0909 моль/л, соли Мора с [(NH4)2-Fe(S04)2 • 6Н20] = 0,0091 моль/л, серной кислоты с [H2S04] = 0,05 моль/л.
Раствор 14. Раствор концентрацией относительно аммоний-цер-рисульфата с [(NH4)4Ce(S04)4-2H20] = 0,0005 моль/л, сульфата це-
ГОСТ 8.450-81 Стр. 3
рия с [Ce2(S04)3’4H20]=0,0025 моль/л, серной кислоты с [H2S04] = = 0,25 моль/л.
4. Состав и методика приготовления растворов, воспроизводящих значения шкалы окислительных потенциалов водных растворов, даны в справочном приложении.
5. Значения окислительных потенциалов водных растворов, указанных в п. 3, относительно хлорсеребряного насыщенного электрода сравнения, находящегося при температуре 20 °С, соответствуют указанным в таблице.
|
Примечание. Потенциал хлорсеребряного насыщенного электрода сравнения относительно нормального водородного электрода при температуре 20°С равен 202 мВ. Окислительный потенциал (мВ) при температуре раствора, °С | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
6. Среднее квадратическое отклонение при воспроизведении значений окислительного потенциала водных растворов составляет 3 мВ.
£■4
S:
К
о
*5
CU
О
£
у
о
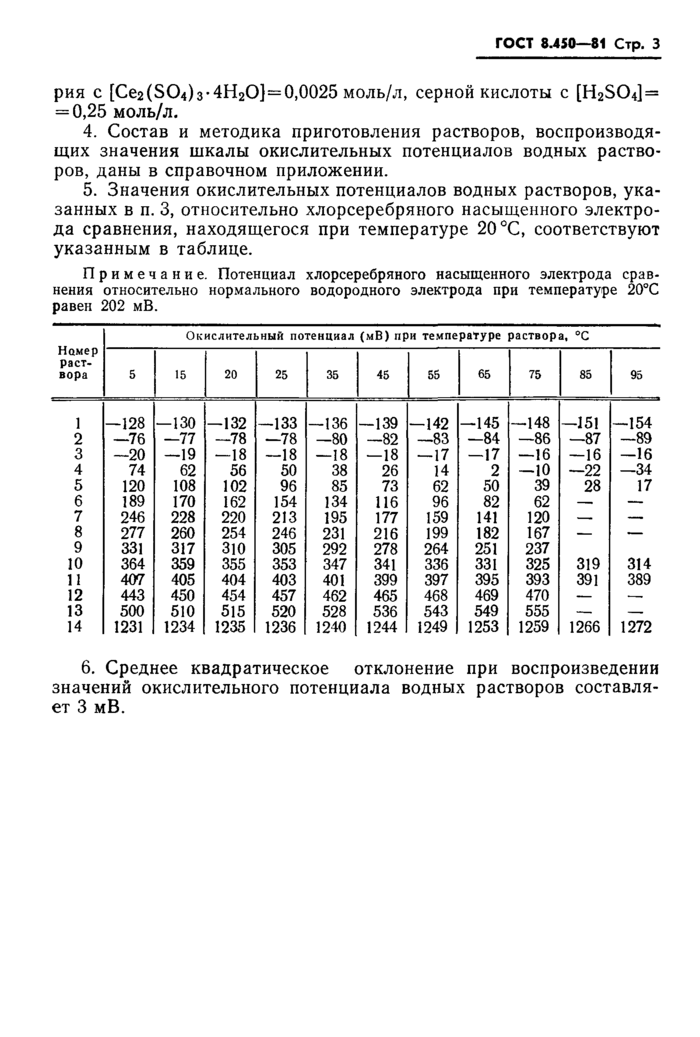
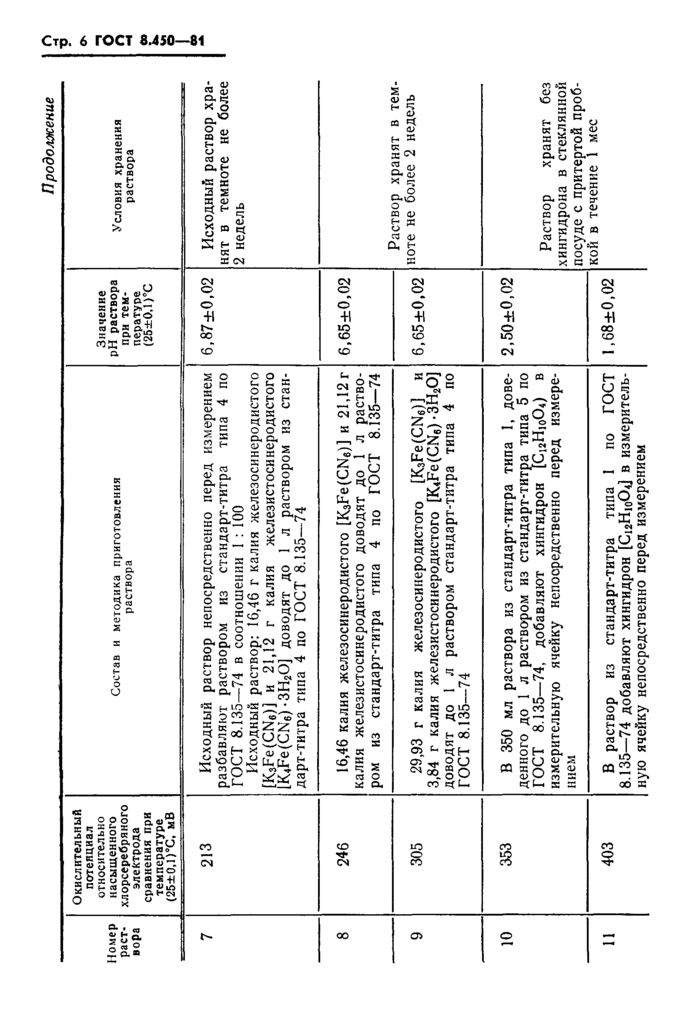
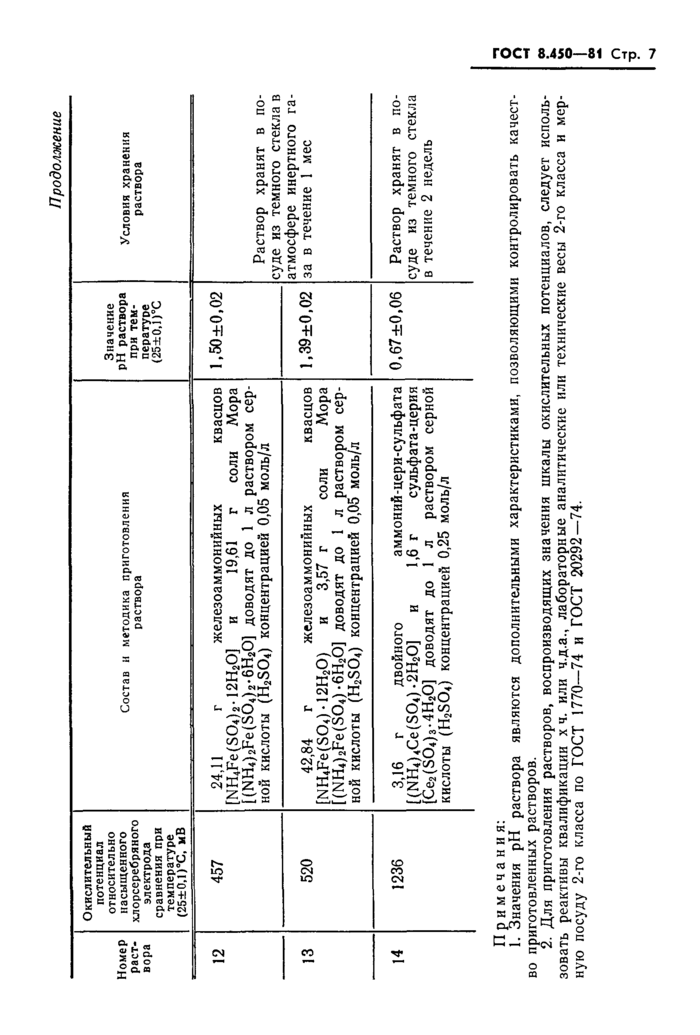
Состав и методика приготовления растворов, воспроизводящих шкалу окислительных потенциалов
водных растворов
«3
Я 31
33g
Has ■в it Я
щ
ё 5
о
и
О о
2 я * о, «о 2>0 g а
S 0
Я
а
3-
ая Н Я Я 0 0 Я Ч 0 0 0 а. о
„СО 0 « а * •
SF
& ч
я о
2 +| 2 л н О)
к
х
X
0
К я я о. О. о X 0
S^ia~
* о Я О.*** X £ 0 >.^1
2 о и но ; я _ я +1 s о. 5 а,Т|
в о.* а'М
corn
• о
* о Си Ч о >»
о
о
я
я н о я р-*к
Д CD
Н
»s
3 к
4
о
X Я Ф
Ф
н
Я О
В 'О
О
S
сз »я Я о о я о о х х <v & ч ч
к S Ь
о 2 х
ч
о
с
Си
о х
я
ь н О к Я ^
Си 03 О
си 2
X с
ф
ч
>»
со
О
О
+1
О
«о
со
А ®
2 «
CU
х v
Си Ч
о >>
ffi о н о
« С я
си5Я
■S I 8 §§s g-~
X ffl 0)
и <D
5 н Ч
К О
К VO
со
о
•ь
о
+1
о
ю
со
к
X
<и
0
о
ь
о
и
я
о.
X я
а
0 О X х х
si
0
2
0
Я
н
и
о
U
о ф 2
о а. о
х <и § ф s ч я
s
О е( Я X о а. а> <и с си
ф
2 си
S о
я
S о
о" о *0*
S3 X Н X о а*
03 Я .
йЙ *
Э ш
а.
а> ё « eg ф •§§ vo х §
2 к 2 ^
*=* •• *я
аИ °
§ я
Е- Я
ё S &э
о я н о о о
н 2 _ к о ч о я
*я
3
я
4
о
X Ф ш
S
со
со
из eg д ' I —
s&fi-L»
SS"*?
" § Й-2
я
* я
Л е? Я О зЯ О Я
О »s
g§
I *
5 я «д х о ч си о я си ч о
О
я
о
CJ
о
S
н
я о s
s _
Я о
gN О фЮ Ч с- СО
<и
Си
ф
ч
Й- ’Я
н о
к
я
CU _ Я Н ч
Ef Я
о я 1—<
я
^ Сн
ч о я о я я
*
оо
со
я
из
ч
а»
Е-
я я
Он £-
Ш О
s 2 « eg
s я ч я
я
г сз
4) сп
Я Я сд
я я о
я
*=3 ^ о о
S 9Я
о
i—1 я ге О & Я
ч 5 Х —
я О.Я ? «
■** я <d са О Я к
Ч sf я 3
я Ctf Е-
си Л я ч
со" £
о и о я я
ф Си Л о
О CQ Ч н о я си
^ ч 0*1 *4, *
Г.0 5 ^
§•£ £ £ о - с -
«2®?"“Ео$
о * вч О Ь СЯ ея Ч
£
CU СО »я я со о
I is
2 S о
S г: 2: в§ g
Я е
SL2 ? m
°о
“О ё
Н.О
CU'OS.HH £
н 2l4
о
я
я
я
X
S
я
сд
си
о
£
си о я
о »я
сд Я
си
S
и
я си о я
Е-
о я *
cu'tn
о
S t-i
S
я
2 СО
си
я
о
S
о
си
о
я
ъ- ■
о
я
си
о —
ф
о »я е£ аз
ЯП. О
SS£
..£30 си о я
оО
я
я
Си
н
я
а>
я
я
о
я
п,
сч
си
о
я
Е-
о
я
си
я
и
я
NH
о
и
я
а>
ч
я
г
о
я
еиясо
я
w |£i£
X д?
.о х "Ж, S я 5Я си О СД о Я.—I я
я
ч
о
н
аз
я
н
о
ч
о
»-ч
я
си
о
я
Е-4
о
я
00
t".
CN
ГОСТ 8.450—81 Стр. 5
Продолжение
к
В 3 о * « (0 о. 0.0 к П
• 4>
2 *
Он
и ф ft?
s §■
СО
0,*Я
a S 8
в <и й Ч н ^
о
к со <у 'ч <и н ч в о в о
о
5
л «
3е«
в о. о о о. a е< н в о £ 2 в
Он S
.в *
Я
в п Ч <и О о X о
S н
в
в
' 4)
В О О, Ч
в о ою
gS
о «
О О
в «
к VO
•в о
о Он
в с в
В в HJ
чо Л в н ^
О) О. •*
Н 4> __ У 1-м
• 4)
СО ф
О.Ч X о
Л 'О
о.
О а>
“ *
о
S.?j
•в £
Я S
* 4) Л
Ч Н е;
4>
О
X ffl Ч
4>
н В в
В<м
о
S
S
о
+1
со
s
о
+1
ic
со
см
о
о
+1
со
со
со
см
о
о
+1
со
оо
*
со
« 2, Он
в )=г <и
- o' <и
ё|°
2
* о
а, Я в о,
<~i гт* с О
К
К
X
4>
*5
са
о
н
о
U
я
а,
С СО
а со О х * s н
§1
а>
2
А
СО
н
и
о
О
<8 2 2 S4®
а «в £
Sgs
в!»
3 о §
*вй
о °
о
U
о о ь- в
2 к
в о.
« « ^ а S а>
SS
X
s “
§ к
ев
X 4> 4> В
53
9
ga-
ВО
я*н
4>io
HR
О В
а ’S н в
m * В о
Ч О _
_ 3 g-5. Я « S *
2,1 t- S
S Sh-
О о *0. гнО"'
« Ф00 ,я о.
S 4 S §
■ sg-s.
О ж N в S S О Во
а.
о
в
н
о
СО
а.
в
в
В да В "
в -Д 2 я
«3*5 * S О) ^ — о
ч
1 О
§Ь.
C4
.Q
Н в
и £-
О в U Н н
О Он_ к са нг
go
LO В о СО ьЕ
Q У N
5 « о
н д W-
2 s * °-Он * о о
н 2 а- и Я D<k h
н о 2- о ^ о С «о
о в в
4)
CQ СО
н
и
Ч
4)
а.
о
m
н
Он о
о со
§ °
СО
Н 5>> со О * ®
o*g u u ё
О
в в
9н «
199
£а»
S о
4) В В
В ^н
си ^
Он
си со
s £ со В
в н
Э В
о- 9"
£ В В S
о н
я o-ii
В со 4? Е* •■
£ в-
Й £
эв
О.
о м о в
со
н
4)
ST
О
со
о.
со
в
S
4)
В
В
а>
а.
4>
S
со
В
4
4)
Он
4)
В
О
в
5 «
в 9*
СО о
|х
Н £
О
СО
Н* Я в о
£ Ч н к
Он (_
со в ч в
о
о
S U-l f-' ГО
н н h rv^
о, о S
ffl СО S -Ч Он X
в
g
I
со о 12 в
в g£2 ч ^ -l со со , оо со ftfc OS о 5-Н о 4)
g OU *«g
в
S
в
4>
3
о
СО В Н 4> В
Н СО
2 о.
2 со я в
ira о
^ 4)
*55 о в
5 60 00 g
че|
-• S
« о
Я в
н
О Он
оos^iI £ 3 д * * §2«а
ЯГ^
^nLi
О со
ОН |
Й СО -
с °v« >>« Slju
О о '•—<
Ри О
д
в
5 во
со В В
у •- ч_/ а>
со О г, В Он
Он Ч О 4)
V^H —V О чи
_ _ц о S* S Ч с Ч со
S7T*' 1 в
°й «I s
^2 gx g.
оо н в
в
СО
н
о
X
н 2 в ч в
СО
m 5
О ’’О* со h-
о, I
1C
CQ ^2
оо
со
в
о
в
Ч н а> о о. 5
U Он
§*
си
в *—•
Я S Н
о g о о S
g g Я
о о
СО СО 2* О, Он^г
•Я ню Я о со Я в-ч чо°
О m
X " Ь
1
00
со
о
ю
со
О)
ю
1C
<о
Продолжение
к
Я
X
v
* л
Я Q,
а о
х в
к о X «0 ш о. о
5
>5
' ф
та ф
сх с;
X О а.'0 о ф
g в
о
га а>
•Я х
3 2 X ф
4 Е-о
X да О
S
Я
4 ф
5
а сч
S п
ф ^
н ч ф
и s
н Я
д CN
«а»
CUvo
О
га ф
В я
X ф
a S
я
со »я <1> о
о
я
X я ч
X
ф
_ н
СХ о
X
аз
cd СХ X
о о га н о cd
fr
ee
X
га
сх ч я
Сй й я
о
о
сх
С о #я ф о S н
СХ--1
ф
Н Ф
Я Й
СХЯ
В £
я
о Ф
н
ф
£я о «я о о
В X
га
<0
а
Hi
£ о
. - _ ч/ J*T1 »
О) о н fr- о
?! «в *. 5 +1 те о, я сх,л
я »в?Й
сод с в2. а
ч/ л • а*
к 2 в а
Я н <L>
|
сч |
CN |
(N |
CN |
сч |
|
о |
О |
О |
О |
о |
|
о |
О |
О |
О |
о |
|
+1 |
+1 |
+1 |
+1 |
+1 |
|
Г-. |
ю |
ю |
о |
ОО |
|
ОО |
со |
со |
ю |
со |
|
СО |
СО |
со |
CN |
£ 9
ф я я
Я TJ-
Ф
Н га ® в £ я
га с_ я
Ч cd Ф Q.
сх ь
9 я
Я н
§ |§
я S ..
ф Ч га я —■
cd
fr-
о о
U U,
о О н н о о я я Ч Ч га о о сх сх
ф ф
я я я я а а о о
га н Ф о
Я
cd
Н
о
я
г
о
сх
о
га
Е-
Ч Я У Ф га 5 - ф сх^; ч v
Ф sj
* ю — со
X
х ' ^
£*
oJ>
<N С^СО я
^ СО
Ч Ф
ф
сх
О О я
ф
я
я я я
ф
£2 3 я g
к я ч
cd
В в ООО
, я ч u ч н
со w ни ■ч« X R_q
«о
£§о
ф и Uh ь
со о?
1—1 О ~
О §
Ез
о Ч н о я
Н
CJ
аэ
я
fr-
cj
О
U
£ О
Л.О о 0-0,0
га га е—
Ф Tt*
cd t*-СХ I
га
н
о
cd
сх
«Я
3 о ве*
А « £ 4S 5
«55
§Sg
5 В £
О °
о
О о
* о. д
вс 2
§js
3£§
Я л л
Я CQ
а« s в а*
К НО Я «о
8 ЭЯ
я КО
я 2 +1
те <«£
&и2
ST'O
Q.e
—iE ^со ^
^ •. cd
0>®б s—'Z я
^ я о~*Г
fe о ^
2 и сх ho« й н ч * о я
g я га х Ч н
сх О Ф
9 в-я 2 s
о 2 о О з л га о о ф н *
Ч о н
й к g Я га 2
ф СХ
R | ^ Я я t"-
Ч — I
cd я I х я о «о
Ч Г<Л
г . ел
ф
ю
о
ч
Н
U
О
U
га • ш Ф СХ
__ ф
2 га
Я S 25
racj сх сх<—» Ф fr- я
н м V о о н сх я СХ S< Я
Cd я
с_ я я
X
ю-5 cd О
га
ч
ф
6-
я
сх
ф
2
га
я
cd я Я fr-
cd СХ н я
fr-»
н сх ее Ч я
cd fr-о
га Я
w _ сх н о а
ч
я
cd
н
о
S
ф
я я
ф
ее сх нО ф я S 2
м в
s.as
Я Ф
о в • СХЛ н Ч О Л я В cd и Я Ч Я « Я Я В cd X
«
ф
га
н
о
Ч
ф
сх
о
о
с
ф
я
X
fr-
я
fr-
|
о |
га |
|
(_ |
я |
|
о |
я |
|
н , о |
н |
|
я | |
|
Ч га | |
|
о |
сх |
|
ex fr- | |
|
ф |
я |
|
я |
н |
|
я ф о |
1 fr- сх |
|
н |
га |
|
о |
ч |
|
я |
я |
|
га |
га |
|
Ф |
fr- |
|
ч |
О |
|
ф | |
|
* |
га |
|
я | |
|
я | |
|
я ч |
2 |
|
га |
о |
|
X |
сх |
н
9
к
ч
га
_ „§й
о о
сх^ ч в
§ _Г,—.'Ф
^9,cd
§
»я •
S «''То S3
gzz: £■
я
ji ф ф л
s ‘У* Й.
СО
*Я н Ю
3 22
§§о6 С га g cd Н
iiou
S га r-v cd У СХЬ—
со
СЧ
я
я
о
о
га
Ф
ч
ф
*
R
Я
ч
cd
X
СО
ч*
<о
(N
со
о>
cd —
в н об
г 55
ф ССН
1~\ г л
озГ — О U
w оо §0
га чь
а
н
о
cd
СХ
4
5
S
СО
со
сх се
О VO
о о
cd
ч ^
^ ю
о”
Чао
О
U L-
о Н «О
$о
сен
Е< »Я ^ Ф
Я
я
9
>,
я
га
ч
ф
н
я
сх
ф
2
га
я
f-
о
Ю
О
со
со
fr-
о
ч
ф
сх
о
о
я
«И
9 я ч га я Ф VO Я
сх о .
О et >г
га х н т}< »я
0(4. а)
га I ег сх I я ю CQ 00 2 —: >» 00 Я
га
Я
со
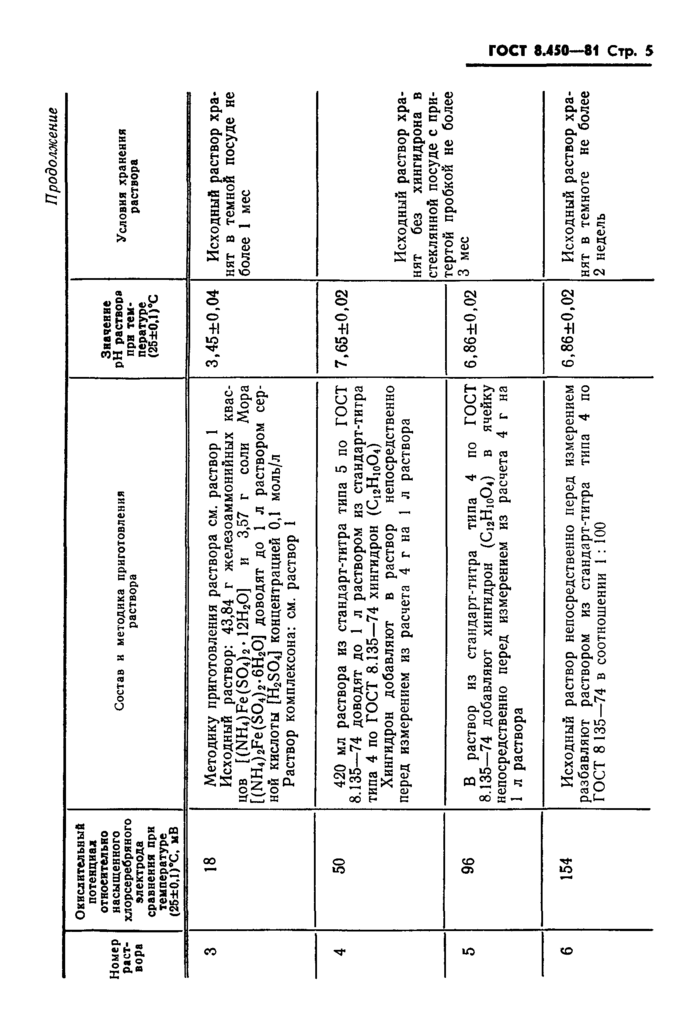
ГОСТ 8.450—81 Стр. 7
|
Продолжение |
03 |
во приготовленных растворов.
2. Для приготовления растворов, воспроизводящих значения шкалы окислительных потенциалов, следует использовать реактивы квалификации х ч. или ч.д.а., лабораторные аналитические или технические весы 2-го класса и мерную посуду 2-го класса по ГОСТ 1770-74 и ГОСТ 20292-74.
н о
D ЗГ 03
я
л н л ш о о-
S
«=; о
Он
н 33
о S3
53 2 S3
я 2 S3
1=3
о со со о с
к" 2 оз S3 S3 Н О S
Он
О) Е-S3 eg
Он
eg X
S3 2 а
33 0
ез
О)
н S3 33 «=3 о о о *=(
к о н
2 03 >=3 0 к
0 о, о 0 н а 0 Он
X " о. я
0 К Я S
<U *
s £ 53 Я
О,со