ВНМД 10-72/Росглавниистройпроект
Руководство по отбору и лабораторным исследованиям грунтов, грунтовых и поверхностных вод с целью определения их агрессивности и коррозийной активности
Купить ВНМД 10-72/Росглавниистройпроект — бумажный документ с голограммой и синими печатями. подробнее
Цена на этот документ пока неизвестна. Нажмите кнопку "Купить" и сделайте заказ, и мы пришлем вам цену.
Распространяем нормативную документацию с 1999 года. Пробиваем чеки, платим налоги, принимаем к оплате все законные формы платежей без дополнительных процентов. Наши клиенты защищены Законом. ООО "ЦНТИ Нормоконтроль"
Наши цены ниже, чем в других местах, потому что мы работаем напрямую с поставщиками документов.
Способы доставки
- Срочная курьерская доставка (1-3 дня)
- Курьерская доставка (7 дней)
- Самовывоз из московского офиса
- Почта РФ
Руководство предназначено для инженерно-технических работников трестов инженерно-строительных изысканий, проводящих определение агрессивности и коррозийной активности грунтов и вод при производстве изысканий. В руководстве указаны методы и техника проведения химических анализов с целью характеристики грунтов и вод как агрессивной среды при проектировании оснований зданий и сооружений, а также дорог
Оглавление
1 Химический состав подземных вод
Ионы щелочных металлов (Na + K)
Ионы щелочноземельных металлов Ca и Mg
Ионы хлора Cl
Ионы сульфатные
Карбидные и гидрокарбонатные ионы
2 Агрессивность воды
3 Отбор проб воды и подготовка к анализу
4 Химический анализ воды
Определение углекислоты
Определение кальцит—иона (Са)
Определение магний—иона (Mg)
Определение сульфат—иона
Определение Cl, SO4, Ca, Mg в темноокрашенных и мутных водах в водных вытяжках
Щелочность
Определение содержания ионов натрия и калия
Определение сухого остатка
Форма выражения результатов анализа и их контроль
5 Коррозийная активность грунтов и вод
Факторы коррозийности
Почвенная коррозия свинца
Почвенная коррозий алюминия
Почвенная коррозия железа
Почвенная коррозия меди
Почвенная коррозия цинка
Определение коррозийной активности грунтов, грунтовых и поверхностных вод
6 Определение содержания агрессивных компонентов в грунтах и водах
Подготовке грунта и приготовление водных вытяжек
Определение рН
Определение содержания хлор—ионов
Определение общей жесткости
Определение общего содержания ионов железа
Определение воднорастворимых органических веществ
Определение содержания нитрат—ионов
Приложение1. Характеристика исходных материалов
Приложение 2. Определение коррозийности железа методом "потери веса трубки"
Приложение 3. Оценка степени агрессивного воздействия воды—среды на бетон железобетонных конструкций в зависимости от вида конструкций, фильтрации грунта и плотности бетона
Приложение 4. Выражение концентрации раствора по весовому количеству растворенного вещества в единице объема раствора
Приложение 5. Таблицы для пересчета результатов анализа воды из весовой в эквивалентную форму
| Дата введения | 01.01.2021 |
|---|---|
| Добавлен в базу | 01.01.2019 |
| Актуализация | 01.01.2021 |
Этот документ находится в:
- Раздел Экология
- Раздел Строительство
Организации:
| 17.11.1972 | Утвержден | Госстрой РСФСР |
|---|---|---|
| Разработан | Росглавниистройпроект |
- СН 249-63* Инструкция по проектированию. Признаки и нормы агрессивности воды-среды для железобетонных и бетонных конструкций
- СНиП II-Г.3-62 Водоснабжение. Нормы проектирования
- СНиП II-Г.6-62 Канализация. Нормы проектирования
- ГОСТ 4796-49 Бетон гидротехнический. Признаки и нормы агрессивности воды-среды
Чтобы бесплатно скачать этот документ в формате PDF, поддержите наш сайт и нажмите кнопку:

стр. 1

стр. 2

стр. 3

стр. 4
стр. 5

стр. 6

стр. 7

стр. 8

стр. 9

стр. 10

стр. 11

стр. 12

стр. 13
стр. 14

стр. 15

стр. 16
стр. 17

стр. 18

стр. 19
стр. 20

стр. 21

стр. 22
стр. 23

стр. 24

стр. 25

стр. 26

стр. 27

стр. 28

стр. 29

стр. 30
ГОСУДАРСТВЕННЫЙ КОМИТЕТ СОВЕТА МИНИСТРОВ РСФСР ПО ДЕЛАМ СТРОИТЕЛЬСТВА (ГОССТРОЙ РСФСР/
РОСГЛАВН ИИС ТРОЙПРОЕКТ
РУКОВОДСТВО
по отбору и лабораторным исследованиям грунтов, грунтовых и поверхностных вод с дедыо определения их агрессивности и коррозийной активности
ВН МД-10-72
Росглавнаистройпроект
Москва - 1S72
ГОСУДАРСТВЕННЫЙ КОМИТЕТ СОВЕТА МИНИСТРОВ РСФСР ПО ДЕЛАМ СТРОИТЕЛЬСТВА (ГОССТРОЙ РСФСР)
РОСП1АВНИИСТРОЙПРОЕКТ
РУКОВОДСТВО
по отбору и лабораторным исследованиям грунтов, грунтовых и поверхностных вод с целью определения ях агрессивности в коррозийной актив*#Ьстн
ВНМД-10-72 Росглавниистробпроект
Утверждено
Главным Управлением научно-исследовательских и лроектно—конструкторских организаций и планирования проектно-изыскательских работ Госстроя РСФСР '17' i872 г.
Москва - 1872
коаном для Средней Азии) необходимо определение шелочвой агрессивности - содержание едких щелочей в г/л. Суммарное содержание ионов калия и натрия устанавливают расчетом с точностью, достаточной для практических лелей.
а. ОТБОР ПРОБ БОДЫ И ПОДГОТОВКА К АНАЛИЗУ
ЗЛ. Правильный отбор проб воды обеспечивает высокое качество исследований и надежность результатов анализа. Ошибки» возникающие вследствие неправильного отбора пробы, в дальнейшем исправить нельзя.
3.2. Пробы должны правильно отражать химический состав воды-среды. Для этого в процессе изысканий пробы следует отбирать и подвергать химическому анализу а раз вое время года» в том числе обязательно в меженный период. Если в течение года химический состав воды изменяется» используют денные за период» в течение которого агрессивность вод наибольшая.
3.3. Пробы воды должны характеризовать все водонос — ные горизонты, с которыми в дальнейшем возможно сопри -косновение бетонных и железобетонных конструкций.
3.4. В случае, если сооружения подвергаются действию сточных промышленных вод, следует получить данные об их химическом составе или произвести анализ в учесть их влияние при опенке агрессивности.
3.5. При опенке степени агрессивного воздействия воды-среды следует учитывать коэффициенты фильтрации грунтов.
Коэффициент фильтрации для различных грунтов (по Н.Н. Маслову)
практически во-донепрон ац аемые
весьма слабо водопроницаемые
слабо водопроницаемые
Глины, монолитные скальные
грунты.............. Б * 1.0
Суглинки, тяжелые супеси ... до 5-J0-
Супеся, слабо трещиноватые глинистые сланцы, песчаники, известняки ...... ........ до, 0^5
водопроницаемые
Пески тонко и мелкозернистые, трещиноватые скальные грунты . до 5
хорошо водопроницаемые
Лески среднезернистые, скальные грунты повышенной трещиноватости . ...... . ........ до 5°
сильно водопроницаемые
Гравелистые пески, галечники, сильно трещиноватые скальные грунты......... 300
10
Ко*Лфад!тят фальтрэдкн сршгегаяших ж сосружмп & ъл грунтов допускается прзизтатъ пи- сгсревочльш вахт
сн не старе-деден опытам яут&м жш сооруж^нш й&ходагсгз: в засшхкых грунтам- Б етях случаях следует отвоснта- святые, уплотненные (глчньь суглзЕ&я к cysecsi гругты к грузин слабо-фильтру юашх к несвязные, слабоуплотьевные (нестарые- 2 гравелистые) — и группе средне- а еиль1шфш1ьтрующ&х — •цо©ффШ№'-ант фальтранигн более &Л м/сут.
3.8, При отборе дробь? воды дедине быть Rcsnwesa всякая возможность ее загрязнения, Пэоед отбором-про5 па буровых схвая-ин необходимо прокзаестг откачну воды зяи «$>-
тание с уахш* расчетом, чтобы столб веды сменяйся несколько раз. Это особенно важно для определишь рзстдорзш&х газон; ари stou к^обходнмо исключить возможность смеддвза-иге воды с ъиздухом»
В воде буровых схвашш при продолжительном отсутствии откачай иногда обнаруживается большое чхолкчесхво за-к ясного железа чз*~аа взаимодействия воды с обса^ншш трубами, несмотря на то, что -о самом водоносном горизонте железо отсутствует^
Точно такс лез ъ дарабстлюздкх ходода&х часто обнаруживают значительное количзстдо азотной к зелоты, аммиака *$ органических соединений за счет &^гря задняя поверхностными стоками, в то время кик воде горизонта., питающего его, ш содержит ©тих вешастЕ.
ЗЛ, Для характеристики агрессивности воды открытого водоема иди водоносного горизонте следует ртбаретъ не менее двух проб кз различных мест*
3.8, ЛрСбде-воды- на анализ отбнрдюг особом л дробоот-бо рниж&м &~6ато ы&1 рзme, .а с поверхности малых глуби — бутылями,
3,0* Пробы отбирают бутылью сл&дуюзггде обрлзом. Бутыль закрывает пробкой, к которой нрихуеялек-шкур, и вставляют в тяжелую справу ипк к дай подвешивают груз на тросе {шнуре, веревке}, Проби можно отбирать шестом г при -крепленной ж нему бутылью. Бутыль погружается до замечен— mfi глубины, и заполняется водой доверху*
Перед закрытием бутыли пробкой верхний спой воды сливают тан, чтобы иод пробкой оставался небольшой слой воздуха {10-15 ми). Бутыль закрывают пробкой, обтирают сухим полотенцем а переворачивают вверх дном, следя ш тем, чтобы вниз не стекали капли воды* £сли пробка останется сухой, можно считать, что герметичность закупорки дойтегнута.
ЗЛО, Основным условием ерм отборе пробы должке быть чистота тары я. пробки, Сначала посуду моют ершом в мыльной горячей воде. Корковые пробки кипятит в дистиллировав-кой воде, резиновые - в однопроцентном растворе соды л ополаскивают несколько раз дистиллированной водой. Бутылки не— ■Род наполнением и пребхп перед закупоркой ополаскивают от-
11
бираемой водой не менее трех раз. Бутылки жзнгшд масла и керосина употреблять нельзя.
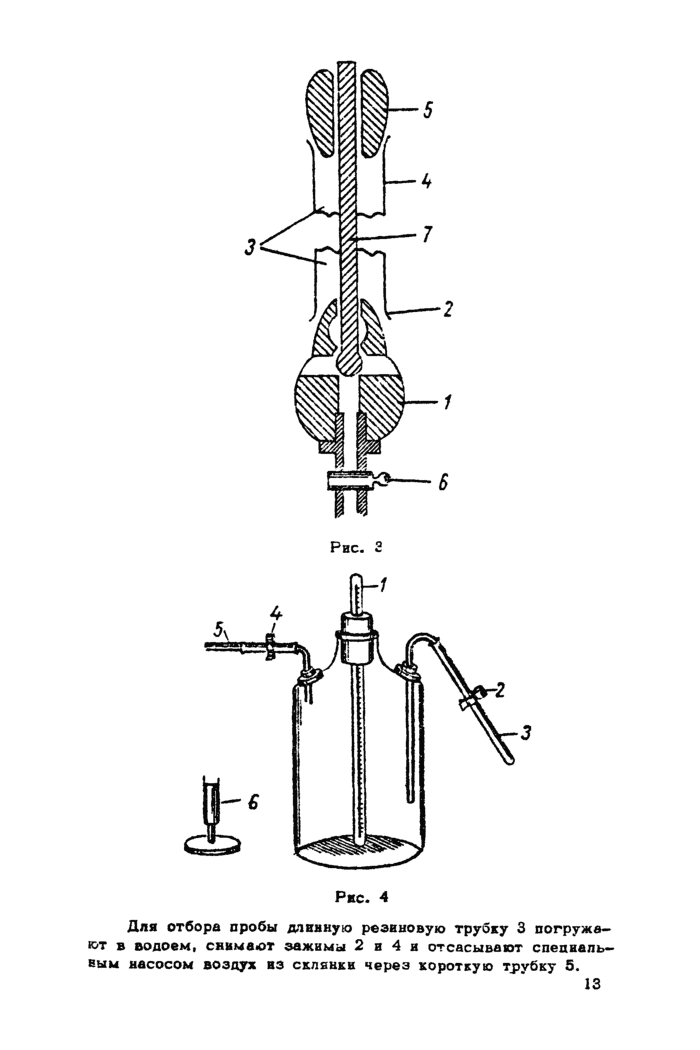
3.11. Если не требуется точного фиксирования глубины отбора пробы из колоша или открытого водоема, пробы можно брать обычным чисто вымытым и ополоснутым водой ведром. При этом ведро наполняется испытуемой водой доверху. Склянку для отбора пробы (рис. 2) заполняют водой сифоном из ведра* Один коней резиновой трубки опушен не дно ведра» а другой ховеп - на дно склянки.
Желательно пропустить через бутыль несколько объемов отбираемой воды при помощи той же труб/sr, опушенной до дна бутылки. Необходимо отбирать пробу г дую буты л к у отдельно (если их две-три), не допусхать я^*плавания аз одной бутылки в другую.
3.12» Для глубинных проб существуем несколько видов батометров—пробоотборников.
Простейший из них пробоотборник Е.В. Симонова (рис. 3), состоящий из груза 1 с краном 6, стального или чугунного пн-* линдра 3 с козырьком 2 внизу и воронкой 4 вверху.
Для отбора пробы груз 1 опускают в скважину (колодец, открытый водоем) на тонком тросе на нужную глубину.
Бо время опускания груза цилиндр 3 с пропущенным через него тросом 7 придерживается рукой. Затем цилиндр опускается. Свободно падая по тросу, он достигает груза, плотно насаживается на него благодаря резиновой прокладке и захватывает пробу воды с нужной глубины.
Чтобы частицы со стенок скважины попадали не в цилиндр при извлечении прибора на поверхность перед подъемом пробоотборника по тросу спускается пробка 5. Бода из прибора в склянку для отбора проб выливается через крав 6 с надетой на него резиновой трубкой.
Пробоотборники Е.Б. Симонова изготавливаются серийно диаметром 48 и 82 мм, емкостью соответственно 0,6 к 1,6 л.
3*13. Отбор пробы с поверхности в глубин, не превосходящих 12—15 м, можно производить при помощи псевдобатомет* ра.Верещагина (рис. 4).
12
|
Рис. |
Для отборе пробы длинную резиновую трубку 3 погружают в водоем, снимают зажимы 2 и 4 и отсасывают спепиаль-вым насосом воздух из склянки через короткую трубку 5.
13
Если псеадобатометр расцоасжен не более чам ьа 0(5м ьы-ше уровня воды* то его можно наполнить, высасывай воздух ртом* Вода через трубку 3 начинает заполнять склянку. Ког-да наберется нужное количество, зажим закрывают.
Первыми двумя порпкямн воды ополаскивают склянку.
Взятую пробу боды разливают по склянкам; для этого сначала снимают резиновую трубку 3, вместо нее присоединяют длинную стеклянную трубку при помощи другой резиновой трубка. Через полученный снфоя переливают воду в склянки, опуская коней сида-на до дна этих склянок.
Вместо трехгорлой .склянки в качестве псевдо батометра можно пользоваться одногорлой склянкой* пропустив обе ст^к— данные трубки (а если можно, то к термометр) через одну резиновую пробку.
3.14. Подавляющее большинство компонентов н свойств воды следует определять по возможности в только что отобранной пробе, чтобы избежать нарушения равновесие конов, потерн растворенных газов, разложения органических веществ, вызываемого деятельностью микроорганизмов я т.д. Поэтому следует принимать все меры для того-, чтобы сократить время между отбором пробы н ее анализом.
3-15. Очень быстро изменяется температура воды и pH, вследствие чего газы {кислород, двуокись углерода, сероводород, хлор/ могут улетучиться из пробы кдк вонзиться в ней {кислород, двуокись углерода).
3.16. Такие компоненты как углекислота, серочсдо род, нитраты, нитриты, аммоний а железо следует определить да месте отбора проб. Особенно это необходимо, если воды -богаты солями железа, марганца, кальция. Для кх определения отбирают отдельные пробы ш> 250 мд.
По ГОСТу 4011-48 - Воду для определения железе нельзя хранить более 30 минут. По ГОСТу 3020-47 - Воду для определения магния и кальция нельзя -хранить более четырех часов. По ГОСТу 4774-49 - Воду дяз определения натрия ч .ха-якя нельзя хранить более трех дней.. Беля зтого сделать нель* зя, прибегают к консервации неустойчивых компонентов.
3.17. ОкЕтсляемость и соединения азота консервируют добавлением б пробу (500 мл) 0,5 мл 25%-ного раствора сервон кислоты. Сероводород консервируют добавлением в пробу6—8 мл 10%-ного раствора -ацетата кадмия и 1-2 мл 50%-ногс раствора едкого натрия. Железо консервируют подкислением 3-5 мл ашетатно-буоеркого растворе, который готовят следующим образом:
а) 6S г 1 и растворе уксусно-кислого натрия растворяют в 500 мл воды;
б) 166,7 г 5,5 н ледяной уксусной кислоты растворяют в 50U мл воды.
Эти оба раствора смешивают. В консервируемую таким рбразом пробу добавляют несколько капель HCZ.
14
ЗД8, Для песесыляя с объекта в лабораторию 5уты7/к с пробами укладывают в ящики, имеющие перегородки я расположенные так, что каждая бутьшь помешается в нзолнро-’ ванное отделение. Промежутки между бутылями прокладывают мягкам магераалом {бумагой, войлоком, резиной и т,д.). Пробки бутылей следует тщательно укрепить. Просу воды следует предохранять, от замерзания.
ЗЛ8. Мутные воды необходимо после подкисления отстоять ь течение часа и спить в чистую посуду.
3.20. Нн консервация, не фиксация не обеспечивают постоянного состава пробы на неограниченное время. Целью этих
мероприятий является лишь сохранение соответствует его компонента без изменений на время перевозки. К анализу необходимо приступить в кратчайший срок.
3.21. Для обеспечения правильного отбора проб воды полевые подразделения (партии) следует снабдить памяткой ао отбору проб*
3.22. При поступлении проб ъ лабораторию ях регистоэ-
ру ют.
4. ХИМИЧЕСКИЙ АНАЛИЗ ВОДЫ
4.1. Химическому анализу воды предшествует определение ее физических свойств, которые определяются согласно ГОСТу 3351-46. К физическим свойствам воды относятся:температура, дзет, запах, мутность иле прозрачность.
4.2. Температуру определяют термометром на месте от* бором проб. Запах определяют сразу после вскрыт >*я бутылки. Различают задахн: болотный, гнилостный, ароматический й т.д. По мутности (прозрачности) различают воды прозрачные, слабо мутные, мутные.
Определение углекислоты СО*
4.3. Двуокись углерода - один еэ самых распоостраноь-ных газов, содержащихся в природных водах. Его количество колеблется от нескольких десятков мг/л (большинство поверхностных вод) до 2-3 г/л (углекислые минеральные источники). Вместе с тем иногда встречаются воды, в которых двуокись углерода отсутствует и вместо нее содержится карбонат - кон (pH этих вод превышает 8,3-8,4).
4»4,. Быстро меняющиеся компоненты анализа воды. характеризующие ее агрессивность, в основном свободную угяе-хислоту, другие растворимые газы, гидрокарбокаты и карбонаты (натрия, кальция, калня, магния), а также pH, следует определять на месте выхода воды, у .выработки.
4.5. Определение pH и растворенных газов, произведенное после транспортировки и хранении воды, характеризует нх значения для данной пробы, но ве характеризует воды в природных условиях. Внесение тех или иных поправок на хранение
15
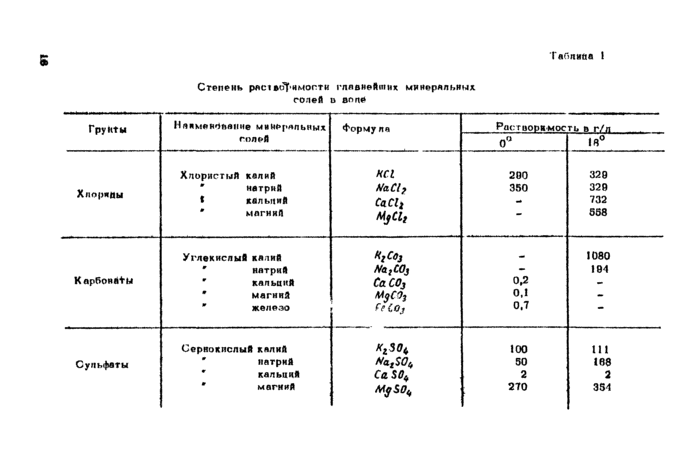
Табпийа 1
Степень ряшвсзТ’ИМопти главнейших минеральных солей в воле
|
Грунты |
Наяменднаиме минеральных |
Формула |
Растворимость в г/л | |
|
голей |
0° |
18° | ||
|
Хлористый калий |
НС1 |
200 |
320 | |
|
Хлорины |
* натрий * кальций |
ЫаС17 СаС1г |
350 |
320 732 |
|
' магний |
MjCli |
— |
558 | |
|
Углекислый кадий |
НгСо3 |
1080 | ||
|
' натрий |
ЫагС03 |
- |
104 | |
|
Карбонй+Ы |
г кальций |
СаС03 |
0,2 |
- |
|
* магний |
м3со3 |
0,1 |
- | |
|
" железо |
feCOj |
0,7 |
“ | |
|
Сернокислый калий |
Kt30b |
100 |
111 | |
|
Сульфаты |
* натрий |
§0% |
50 |
168 |
|
* кальций |
Ca S04 |
2 |
2 | |
|
' магний |
Mg S0q |
270 |
354 | |
пробы волы не обеспечит получение истинных данных. Искажение первоначального состава пря атом может быть так велико, что не позволят характеризовать агрессивные свойства воды* Различного рода габлнды в графики дают прибдн — же иные результаты*
Определение углекислоты н pH на месте выхода воды можно производить при помощи полевой лаборатории для анализа воды в пеших маршрутах (МЛАЗ) конструкции А,А. Резникова а И*Ю. Соколова.
4.6. Определение свободной углекислоты производится объемным» газометрическим н весовым методами, а также с помощью расчета*
4.7. При объемном методе определеане С02 производит
ся обязательно на месте после извлечения пробы на водоема. Объемный метод применяется для вод» содержащих не более 200 мг/л СО2 » не имеющих собственней окраски (вода не
должна содержать значительного количества гумусовых веществ), с жесткостью, не превышающей 10 мг/экв и обшей минерализацией не выше нескольких г/л.
4.8 Объемное определение основано на титровании раствора свободной углекислоты 0,02-0,05 И раствором NaOH или НлгЩ в присутствии фенолфталеина:
о/г+со2 —HCOf.
Конеп титрования должен быть при pH раст
вора 8,4, что устанавливается появлением не исчезающей в течение 5 минут слабо-розовой окраски.
4.8. Отбор воды производят сифоном. Некоторому количеству воды дают стечь через верх трубкн, и выливают воду
в колбу для титрования. Кончик трубки при этом должен находиться все время ниже уровня в колбе.
Склянка для титрования закрывается резиновой пробкой с двумя отверстиями - для бюретки в для трубки с краном.
Во время титрования кран, как правило, закрыт. Для получения точных результатов производят два определения - ориентировочное в окончательное*
Реактивы: 1. Натрий едкий 0,05// раствор (нормаль -кость раствора устанавливают по фенолфталеину).
2, Сегнетова соль, 30%-ный раствор. S0 г сегнетовой соли растворяют в 70 мл дистиллированной воды»
3. Фенолфталеин 0,1%-ный спиртовой раствор.
4*10. Ориентировочное определение. 8 склянку, содержащую 100 мл исследуемой воды, прибавляют 0,3-0,5 г мелко истертой сегнетозой соли (или 1 мл 30%-ного раствора этой соли) и i мл 0,1%-ного спиртового раствора фенолфталеина и титруют 0,05 И раствором NaOH до появления устойчивой слабо-розовой окраски ^,
Окончательное определение- В склянку отмеряют 0,05/7^ раствор NaOH в количестве, израсходованном на первое титрование, добавляют 1 мл 30%-ного раствора сегнетовой соли,
17
100 мл испытуемой воды, I мл 0,1%-ного раствора фенол фт а--лежня я догнтровьгвают раствором МаОН до слабо-розовой окраски, не исчезающей в течение 3-5 минут.
4.11. Содержание СО2 (в мг/я) вычисляют по формуле
4jH-bU-WQ0
V
где Yf — объем растворе NaOH, израсходованного на определение двуокиси углерода, м/л;
И — нормальность раствора NaOHl
V - объем исследуемой воды, взятой на одре деление, иг/ л; 44 - эквивалентный вес СО% для данной реакции.
4.12. Соотношения между формами угольной кислоты в при родных водах при различных значениях pH {в мгл) приведены
в табл. 2.
|
Таблица 2 Соотношение форм угольной кислоты | ||||||||||||||||||||||||||||||||||||
|
4ЛЗ^ CQ2 своб. может быть определена расчетным путем по количеству СО2 агресс., полученного экспериментально* по следующей формуле;
£0%свов. **£0%агрессия{[СаГ]^6 h
4.14. Под Агрессивной углекислотой понимают двуокись углерода, способную переводить в раствор зсарбонат кальция. Растворение карбоната кальция в воде, содержащей свободную СО%9 выражается уравнением:
Са С03 + HZ0 + С02 яс=дь- Са2** 2ИС0".
Этот процесс обратим и, следовательно, реакция до кон-аа ке идет, т.е- часть имеющейся в растворе двуокиси угле~ рода остается после реакции в свободном состоянии.
4Л5. Определенному, содержанию МСО^ъ воде, находящейся в равновесии с твердым Сй,С0& , соответствует строго определенное содержание свободной С0% (тв«л. 3). Если содержание С£?2 а воде меньше, чем нужно -для равновесия, то равновесие сдвинется влево и будет сопровождаться выделением из ©оды твердого СаСОj. Если же содержанке С02 в воде будет больше, чем нужно для равновесия, то равновесие сдвинется вправо и при соприкосновении такой воды с твердым Со, СО3 последний начнет растворяться. Процесс растворения будет продолжаться до тех пор, пока часть двуокиси углерода (углекислоты) не израсходуется и не наступит равновесие. Ту часть двуокиси углерода (углекислоты К которая идет на растворе-
1Й
ю
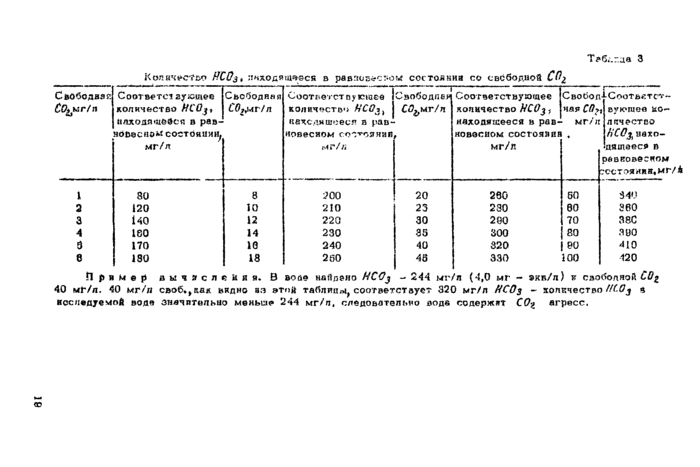
>б*.г_ца 3
|
Количество ЙСОзь хнхедящееся в равновесном состояния со свободной СО^ | ||||||||||||||||||||||||||||||||||||||||||||||||||
|
вуюшев количество НСО£ находящееся в оевковесном | |||||||||||||||||||||||||||||||||||||||||||||||||
340
360
38С
390
410
120
Приме;* вычисления* В воде найдено ЯССj - 244 мг/л (4,0 мг - экв/л) и свободной С0% 40 мЛ/л. 40 мг/л своб.^как видно аз этой таблицы^ соответствует 320 мг/л НС0$ - количество //C0j а Наследуемой воде Значительно меньше 244 мг/л, следовательно воде содержит CQ% агресс.
Настоящее руководство по химическим анализам грунтов п вода предназначено для кнженерно-тэхннческнх работников трестов инженерно-строительных изысканий, проводящих определение агрессивности в коррозийной активности грунтов л вод при производстве взысканий.
Применение руководства .должно способствовать унификя>-дие исследований и повышению качества проектирования. В руководстве указаны методы в техника проведения химических анализов с целью характеристики грунтов н вод как агрессивной среды при проектировании оснований зданзй и сооружений» а также дорог.
Руководство подготовлено в отделе нормативно—метоцопо. гическнх работ ЦТИСИЗд э соответствии с темт щгеским стлано м по разработке нормативно—методических материалов я ока* занию технической помощи территориальным трестам инженерно-строительных изысканий па 1872 г. Ру&оводстзе состарено инженером А.В, Дмитриевской. Редакторы: инженеры С.А. Акинине» и ДЛС. Прокофьев.
Центральный трест инжекерно-строитепызнх нзысьдвкй Отдел подсобных пронэводстэ ЦТИСИЗ Л—112238 подписано к печати 2Q/X1—1972 г.
Зак3?3 Объем 8,5 п.л. Цока ВО кос. Тир. 500
але углекислого кальция, называют агрессивной /гиежкслотой. Ties км образом» количество COz агресс. в воде может бгятъ опрсдаэлэво до р&стзсркмости углекислого кальция в этой воде, к, наоборот, по количеству агрессивной углекислоты мохь» ао вычислять р&стьоркмость С&€0$в данной воде.
4.16* Экспериментальное определение агресс. осно
вано не определении количества углекислого квльсня, лере ~ шедшего з раствор при взбалтывании исследуемой воды с порошком углекислого кальция.
4Л7. Ври прибавлении углекислого к&дьаая к аодэ, содержащей агрессивную углекислоту, происходит уветиченае адэ-дсчностн раствора:
СаЩ +СОг+НгО ~~*»СщЖб$)г >
4ЛЗ. Пробу веды Шуя направления в лабораторию отбирают в частую и сухую бутылку емкостью 0,25-0,5 л с хорошо подобранной резиновой пробкой. В бутылку всыпают S.-1G г химически чистого СаС03 . Бела не взнТа проба на об ш и &. анллжз7 то пробу волы для определенна гндрокароонат — ионе отбирают отдельно.
4Л8. Пробу воды, содержащую углекислый кальций, периодически взбалтывают в течение 5-6 дней по нескольку раз в день, после чего воду фильтруют. Фильтрат должен быть си-вершение прозрачным.
Затем аз фильтрата отбирают 100 мл раствора н тктру— ют 0;05-0,i Н соляной кислотой а присутствие андьагатора метилового оранжевого. Для вычисления результата нужно выполнить определение гидрок&рбоьат-кона в той же воде б*згз 'зарядки" карбонатом кадыхня.
Количество COz агресс, (в мг/rU для 100 мл взятой пробы воды рассчитывают по формуле:
х=(о.~5) Н‘21-10,
где GL ~ расход HCL на титрование IG0 мл фильтрата специальной пробы, мл;
5 — расход ИСЬ на титрование 100 мл исследуемой воды при определении гндрокарбоват- иона,, мл;
И - нормальность раствора МСТ*\ 22—экваа&леатяый вес COz для данной «реакции.
4U20. Вычисление количества COz агресс. можно прежз-водить по графикам, составленным Ф.Ф* Лаптевым, в хотошил учтены не только различные соотношения MCOg ж С0%
встречаемые в природных водах, но и ионная сала воды [SJ.
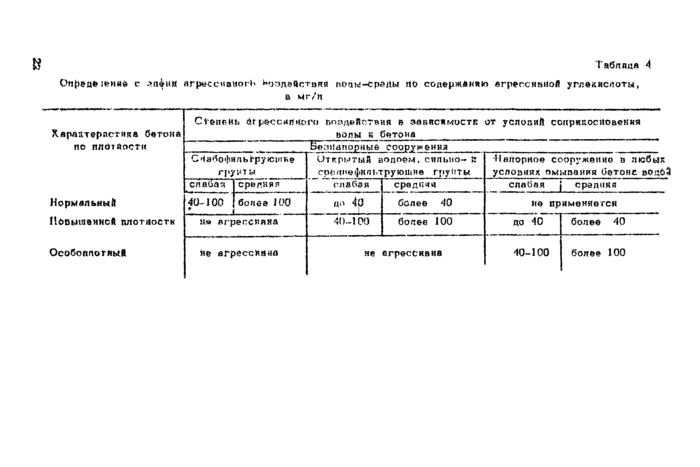
4^21» Степень агрессивности воздействия воды-среды аха бетон железобетонных конструкций в зависимости от вила ко:*-струхпшк* фильтрации грунта я плотности бетона согласно СИ 248-63 и СИ 262—67 з части углекислой егрессчвносги одена— влете я по показателям свободной углекислоты. Допускается производить оценку степени агрессивного воздействия .воды среды на бетон по содержали*) агрессивной, углекислоты в
20
1. ХИМИЧЕСКИЙ СОСТАВ ПОДЗЕМНЫХ ВОД
1.1. Количество и качество растворенных н взвешенных в воде веществ обуславливают физические свойства вод в их химический состав. Солевой состав вод очень изменчив как по общему содержанию растворенных веществ, так и по отношению различных вешеств между собой. Химические элементы в воде присутствуют в виде элементарных в сложных ионов.
IJ2. Подземные воды отличаются большим разнообразием по степени минерализации. Общая минерализация подземных вод колеблется в широких пределах — от слабоминерали-эованных до высокоминерализованных. Вода разделяется по минерализации на следующие группы: воды пресные с минерализацией менее 1 г/л, воды соленые с минерализацией от 1 до 50 г/л, рассолы с минерализацией более 50 г/л. Слабомв-аерализованные воды, залегающие обычно на небольшой глубине от поверхности, мало отличаются по химическому составу от среднего состава поверхностных вод, но все же их минерализация» как правило» более высокая. Эти воды содержат обычно больше свободной углекислоты н гидрокарбонатов, что связано с обогащением вод свободной углекислотой в поверхностных слоях грунта при инфильтрации этих вод.
В верхних слоях грунта, особенно в почвенном слое, конг иентрация свободной углекислоты (за счет жизнедеятельности организмов и процессов разложения органических вешеств) в десятки и сотни раз выше концентрации углекислоты в атмосферном воздухе. Химический состав воды изменяется во времени - в одних случаях быстро, в других медленно.
1.3. Величина общей минерализации в подземных водах колеблется в весьма широких пределах - от десятков мг/л до нескольких сотен г/л. Минерализация представляет собой весьма важную величину, дающую возможность судить об обшем гидрохимическом составе воды. Известно, что пресные воды содержат в числе преобладающих анионов гидрокарбонаты, а
катионов щелочно-земельные металлы. Пресные воды в ос-. зиом гидрокарбонатные, соленые - сульфатные, и рассолы минерализованы главным образом за счет хлоридов натрия н хлоридов кальция.
1.4. При изучении химического состава подземных вод необходимо учитывать одно из основных свойств природной воды - изменение ее режима, а вместе с этим и изменение химического состава воды во времени.
1.5. Особенно подвижными малоустойчивыми компонента — и являются водородные ионы и находящиеся в тесной связи с ши свободная углекислота, аммиак, азотная кислота. Из это-
свойства природной вощи следует, что для правильного суж-
3
дення о химическом составе природной воды недостаточно анализа одной пробы, а необходим анализ ряда проб, взятых в разное время года* Вместе с этим следует учитывать гидрологические и гидрогеологические условия района изысканий.
Кб* Различные, соли, образующиеся из главных ионов химического состава вод, NCL} Cd\ Мд, CLrS0^ } HC0jfC0jl SiOj, имеют неодинаковую растворимость, поэтому для разных по степени минерализации вод характерен свой особый химический состав. Для пресных вод характерными ионами являются $L0jf COjt НСО$ f эти ионы образуют слабоминерализован
ные соли с Ск и Мд .
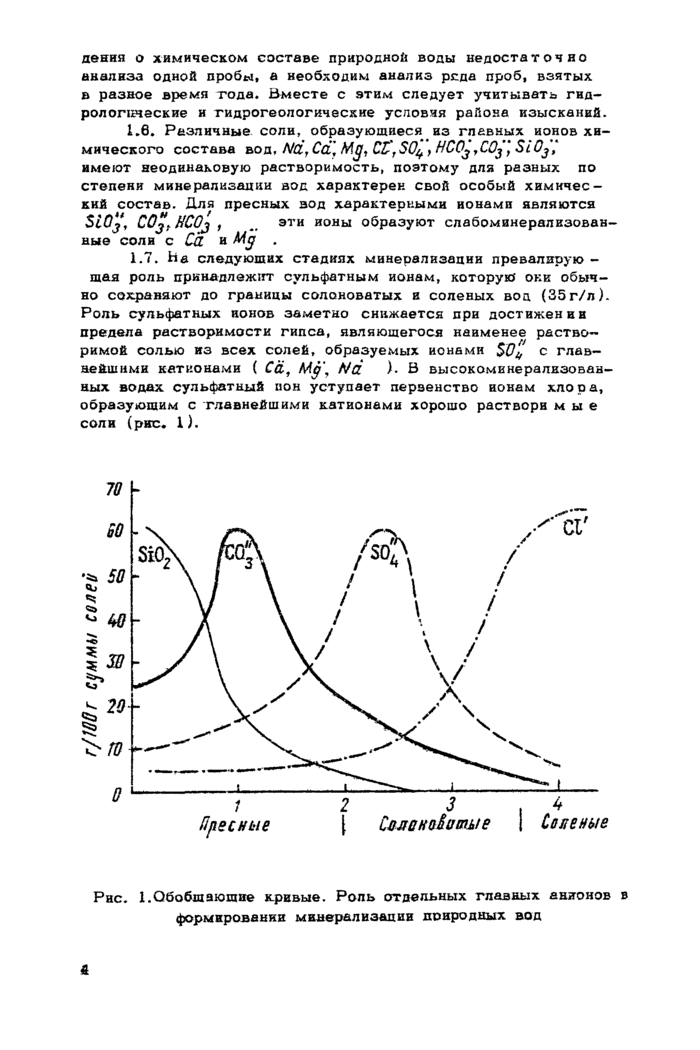
1.7* Ьа следующих стадиях минерализации превалирующая роль принадлежит сульфатным ионам, которую они обычно сохраняют до границы солоноватых и соленых вод (35г/л). Роль сульфатных ионов заметно снижается при достижении предела растворимости гипса, являющегося наименее растворимой солью из всех солей, образуемых ионами $0% с главнейшими катионами ( Мд\ Nd ). В высокоминерализованных водах сульфатный ион уступает первенство ионам хлора, образующим с главнейшими катионами хорошо раствори м ы е соли (рис* 1).
Рис* 1.Обобщающие кривые. Роль отдельных главных анионов в формировании минерализации природных вод
£
1.8. Из катионов наибольшее значение в формировании химических типов природных еод имеет кальций. С ростом минерализации относительное содержание Ctt быстро уменьшается* С& в природных водах редко превышает 1 г/л. обычно же его содержанке значительно ниже.
1.8. Магний присутствует почти во всех природных водах, но вместе с тем очень редко встречаются воды, в которых доминирует магний.
1.10. В водах низкой минерализации Nd чаще всего занимает третье место по концентрации. С повышением минерализации содержание NcL увеличивается и уже в водах, имеющих минерализацию несколько граммов на литр, /Va ъ большинстве случаев становится преобладающим катионом.
1Л1. Содержание кальция в подземных водах всегда независимо от их обшей минерализации значительно ниже содержания натрия.
1.12. Растворимость солей б воде зависит от их химического состава, температуры и давления. Хорошо растворимые соли - хлоридаые, мало растворимые - сульфатные и почта нерастворимые - карбонатные.
Растворимость хлористого натрия мало меняется от повышения температуры, растворимость же карбоната и сульфата натрия сально возрастает. У сульфата кальция, карбонатов кальция и магния с увеличением температуры растворимое т ь уменьшается.
Растворимость карбонатоЕ щелочных земель резко возрастает при увеличении в воде углекислого газа.
Ионы щелочных металлов (N& + H)
1.13. Из ионов щелочных металлов в подземных водах присутствуют главным образом ионы натрия и калия. Ионы натрия преобладают во всех подземных водах. Из-за большой растворимости солей натрия количество его резхо возрастает к
в высокомккерализованных водах натрий является обычно преобладающим среди остальных катионов, достигая -нередко десятков и сотен граммов на литр.
1.14. Источником натрия в подземных водах явля ю т с я горные породы особенно при выветривании алюмосилика т о в. Кроме того, натрий может переходить в растворы подземных вод благодаря обменным реакциям между породами, содержащими в своем составе адсорбированный (поглощенный) натрий, ь
водами, в которых присутствуют ионы кальпия.
Ионы щелочноземельных металлов Са ш Mif
*✓
1.15. Ионы кальция встречаются во всех подземных водах. Кальпий является главным катионом в пресных водах и уступает первые места натрию по мере роста минерализации под-
5
земных вод. Количество кальция в водах резко превышает 1 г/л и пять в особой группе вод, называемых хлор-кальцие** вымя, меняет достигать нескольких грамм на литр. Источником кальция в подземных водах служат различные карбонатные породы (известняки, доломиты и пр.), широко распространенные в земной коре, и сульфатные породы(гипсоангидрцд) 1*16* Магний, подобно кальцию, присутствует во всех подземных водах, тах как большая часть солей магния обладает хорошей растворимостью* Несмотря на это, общее содержание магния всегда меньше содержания натрия и ве встречаются подземные воды, в хоторых доминирующими катионами были бы ионы магния. Содержание ноне магния в подземных водах не превышает одного грамма на литр, реже нес -кольких десятков граммов на литр в высокоминералиэованных водах. Источником иона магния в подземных водах являются доломиты, мергели и продукты выветривания некоторых минералов (биотита, сливина и др.).
Иовы хлора ££'
1Д7. Ионы хлора присутствуют во всех подземных водах, причем относительная роль их в анионном составе воды и абсолютное содержание растут по мере увея^зняя минерализации воды* В пресных водах количество хг г; может бьлъ весьма малым, измеряясь миллиграммами на тогда ъ
высококонцентрированных подземных вода^ лодах некого -рых соляных озер содержание хлора мож^т „оходить до 200 г/ л Источником хлора в подземных водах являются водорастворимые хлористые соли, кроме того, продув * выветр^^ния некоторых горных пород, а также разложения бытовых отбросов*
Иовы сульфатные
К18. Ионы сульфатные (S^;) распространены повсеместно в подземных водах (за исключением некоторых вод нефтяных месторождений). В водах со значительной минерализацией содержание сульфатных ионов обычно ниже, чем ионов хлора, но в водах умеренно минерализованных и особенно пресных они являются преобладающими. Общее количество §0^ в подзем -ных водах может достипать нескольких граммов на литр, реже десятков граммов на литр. н
Источником накопления $0^ в подземных водах служит, главным образом/гипс. Кроме того, образуется за счет
процессов окисления самородной серы, различного рода сульфатов и сероводорода*
Карбонатные н гядоокарбонатные ноны
1*18. Ионы гидрохарбонатные ffCOj и карбонатные CQg характерны главным образом для пресных вод. Источником появления этих ионов в подземных водах служат преимуществен-
в
ко аарбонеты сельдиа и магниЕ, длфоко распространенные в земной tope. CdCC3 и MtfCOj трудно растворимы в вопе, но могут перейти в раствор в присутствии СО^ (свободной).Растворение карбонатов идет по схеме;
СаС03 + С0г +Нг0-~Са+2НС0'3 МдС03 + CDZ +HzO-*~M(j+2 ft СО у
1,20, Содержанке в водах №С03*, СС$ и СBz а о
обусловлено я согласно условиям химических равновесий зависит от величины pH раствора. Преобладающей формой в кислой среде (pH меньше 6) будет свободная СО2 jB среде нейтральной в слабощелочной (pH равно вда больше 7) совместно присутствуют свободная CQZ и ffCOj и, наконец, при ярковыраженкой шелочвой среде (pH больше 12) основной формой становится С0§ , тогда как количество свободной
COi резко уменьшается,
1.21„ Ту часть свободной СВ% г которая способна переводить карбонаты е раствор, называют агрессивной углекислотой. Углекислоту, поддерживающую НС03 з растворе, называют равновесной. Нередко условно называют НСО* полусвяз— ной углекислотой,a COj — связной углекислотой. НС0% сравнительно легко {например, при кипячении) разлагается с выделением CDg по следующей схеме:
2#caj —*~C0z + Hz0+CQ3.
В то же время разложить С0$ кипячением невозможно, поэтому считается, что СО2 ъ карбонатном ионе связан более прочно, чем в гндрокарбонатном, Таким образом, в подзем — ных водах углекислота может присутствовать в виде полусвяз-ной - HCL7j (ион гидрохарбонаткый) и связной С03 (нон карбонатный ).
1.22. Количество всех перечисленных форм опреде
ляется величиной pH. Поскольку наиболее частые значения pH для подземных вод лежат в интервале от 6 до 8,5, естественно, что преобладающими в подземных водах будут НСВ$ъ связная с ними равновесная, углекислота. Содержание ИСО$ в подземных водах составляет обычно десятки и сотни мг/п, не поднимаясь выше I г/л (исключением являются некоторые группы щелочных вод, где количество J/СОз может достигать десятков г/л). В то же время CQ3 для большинства подземных вод не характерен, содержится в них в ничтожном количестве иля деже отсутствует и только в сильно щелочных водах, имеющих pH больше 10, СО^ начинает преобладать среди всех форм угяеккслоты, измеряясь в высокомвнерализовав— ных водах сотнями и даже тысячами мг/л.
7
2. АГРЕССИВНОСТЬ ВОДЫ
2.1. Под агрессивные действием воды -среды подразумевается ее способность разрушать различные строительные материалы путем воздействия на них растворимыми солями и газами кли процессами выщелачивая ад.
2,2. Агрессивность волы—среды по отношению к бетонуасоот— аетствии с СН 249-63 делится на следующее виды: выше л ач нвающая, обшекиелотная. углекислая, магнезиальная/ сульфатная/
щелочная (содержание едких щелочей).
2*3. При оценке степени агрессивного воздействия воды-среды должны быть учтены условия соприкосновенна воды и бетона, вид грунта, и предполагаемая марка бетона. Окончательный выбор марки бетона к вида цемента обуславливается агрессивными свойствами воды. Для определения степени агрессивности воздействия воды-среды на железобетонные кон— струнцаи производится химический анализ воды. Результаты анализа при опенке агрессивности воды-среды сопоставляются с нормами агрессивности, приведенным; ^ СН 248-83 я СН 262-67.
2.4. Первые три вица агрессивности, ашше в п.2.2., зависят от карбонатного равновесия воды £. Г /к* шстъ ех авключается в растворении карбоната каяьцна t сегоне, соприкасающемся с водой. Практическое значение этого обетоягельст^ ва очень велико, так как разрушение зашк‘*чсго слоя бетона, имеющего основным компонентом карбонат кальция, ье только разрушает бетон, но к способствует выщелачиванию свободной извести и интенсифицирует сульфатную и магнезиальную агрессию.
2.5. Растворение СаСОj и вымывание из бетона свободной извести. Са(ОИ)г называется выщелачивающей агрессивностью. Этот процесс происходит в том случае, когда содержание НСО$ в воде так мало, что равновесное ему содержа -
ние С0% оказывается меньше того, которое должно быть (гхра данной температуре) в равновесии с С0% , содержащемся в окружающей среде.
Вода проявляет этот вид агрессивности при минимальном содержании НСО$ $ равном 0,4-1,5 мг/экв. в зависимости от сорта цемента,
2.6. Обшекислотная агрессивность обусловлена концентрацией ионов Н, т.е. величиной pH. По величине pH можно вычислить соотношение между раатичнымя формами углекислоты,
если известно общее ее содержание. Вода проявляет оошсккс-лотную агрессивность, если pH будет ниже 5.
2.7. Углекислая агрессивность характеризуется разрушением бетона вследствие растворения Са*С0$ под действием аг-
В
рзссявной углекислоты (той часта С02 , которая вступает
в р^аклдю с С&С03 )*
■2.8. Содержание С0% о природных водах колеблется в широких пределах от десятых долей до нескольких сотов мг/л* Наименьшее количество наблюдается в морях, наибольшее — в подземные водах. В реках и оаерах из-за постоянного выделения в атмосферу к потребления при фотосинтезе содержа-пае CQi редко превышает 20-S0 мг/я.
2,9. В природных водах углекислота содержится в виде молекулярно растворенной С0% ; в виде газа (около 88%) и в соединении с водой. С02+Н20жН2С03 (около 1%)«в также в виде производных - карбонат иона { ) и бшифбо-
аат иона {HCG$ ).
Между всеми этими формами устанавливается в воде подвижное химическое равновесие, которое определяется активной концентрацией ионов водорода pH в данной воде. Зная активность ионов водорода и общее содержание углекислоты* можно вычислить содержание каждой отдельной формы.
2Л0. Одновременно двуокись углерода, свободная углекислота и ее производные в воде не встречаются* Возможны следующие комбинация:
Н€03 + HZCQZ+CQZ\
HCQ3+CG3 .
Присутствие свободной углекислоты и двуокиси уг п е р с д а ( Н^СО?4* Сй% ) исключает наличие в воде карбонат ионов, так как последние переходит в бикарбонат — ионы по уравнению
С03+С&2 + Нг0 -*»2#Сд3.
2.11. Количество бикарбонатов соответствует определенному количеству так называемой разновеской С0% , которая
удерживает бикарбонат - ионы в растворе. Избыточное над равновесной количество углекислоты, способное растворять карбонат кальция, носит название агрессивной углекислоты.
2.12. Магнезиальная агрессивность возникает в зависимости от сорта цемента дри содержании Мд" от 750 мг/л и выше.
2.13. Сульфатная агрессивность связана с образованием в порах бетона сернокислых соединений ( CaSO^yMgSO^^aSQfy)-Эти соединения оказывают давление на стенки пор бетона, ослабляют, а иногда и полностью разрушают его. Сульфатная агрессивность имеет место при значительном содержании SO* (в судьфатостойккх цементах при содержании S0 4 от 4000 мг/л и выше, в обычных цементах от 250 мг/л н выше).
2.14. Согласно СП 262-67 для засушливых районов (в ос—
8