ГОСТ EN 12822-2014
Продукты пищевые. Определение содержания витамина Е (альфа-, бета-, гамма- и дельта-токоферолов) методом высокоэффективной жидкостной хроматографии
Купить ГОСТ EN 12822-2014 — бумажный документ с голограммой и синими печатями. подробнее
Распространяем нормативную документацию с 1999 года. Пробиваем чеки, платим налоги, принимаем к оплате все законные формы платежей без дополнительных процентов. Наши клиенты защищены Законом. ООО "ЦНТИ Нормоконтроль"
Наши цены ниже, чем в других местах, потому что мы работаем напрямую с поставщиками документов.
Способы доставки
- Срочная курьерская доставка (1-3 дня)
- Курьерская доставка (7 дней)
- Самовывоз из московского офиса
- Почта РФ
Устанавливает метод определения витамина Е в пищевых продуктах методом высокоэффективной жидкостной хроматографии (ВЭЖХ). Определение содержания витамина Е осуществляется путем определения альфа-, бета-, гамма- и дельта-токоферолов. Активность витамина Е может быть рассчитана исходя из содержания токоферолов путем применения соответствующих коэффициентов [1], [2], [3].
Идентичен EN 12822:2000
Оглавление
1 Область применения
2 Нормативные ссылки
3 Сущность метода
4 Реактивы
5 Аппаратура
6 Отбор проб
7 Проведение испытаний
8 Обработка результатов
9 Прецизионность
10 Протокол испытаний
Приложение А (справочное) Примеры хроматограмм
Приложение В (справочное) Данные по прецизионности
Приложение С (справочное) Варианты условий хроматографического анализа
Приложение ДА (справочное) Сведения о соответствии межгосударственных стандартов ссылочным европейским региональным стандартам
Библиография
| Дата введения | 01.01.2016 |
|---|---|
| Добавлен в базу | 21.05.2015 |
| Актуализация | 01.01.2021 |
Этот ГОСТ находится в:
- Раздел Экология
Организации:
| 30.05.2014 | Утвержден | Межгосударственный Совет по стандартизации, метрологии и сертификации | 67-П |
|---|---|---|---|
| 19.08.2014 | Утвержден | Федеральное агентство по техническому регулированию и метрологии | 900-ст |
| Разработан | ОАО ВНИИС | ||
| Издан | Стандартинформ | 2015 г. |
Foodstuffs. Determination of vitamin E (alpha-, beta-, gamma- and delta-tocopherols) content by high performance liquid chromatography
Чтобы бесплатно скачать этот документ в формате PDF, поддержите наш сайт и нажмите кнопку:

стр. 1

стр. 2

стр. 3

стр. 4

стр. 5

стр. 6

стр. 7

стр. 8

стр. 9

стр. 10
стр. 11
стр. 12
стр. 13
стр. 14

стр. 15

стр. 16
МЕЖГОСУДАРСТВЕННЫЙ СОВЕТ ПО СТАНДАРТИЗАЦИИ. МЕТРОЛОГИИ И СЕРТИФИКАЦИИ
(МГС)
INTERSTATE COUNCIL FOR STANDARDIZATION, METROLOGY AND CERTIFICATION
(ISC)
МЕЖГОСУДАРСТВЕННЫЙ
СТАНДАРТ
ПРОДУКТЫ ПИЩЕВЫЕОпределение содержания витамина Е (а-, р-, у и б-токоферолов) методом высокоэффективной жидкостной хроматографии
(EN 12822:2000, ЮТ)
ГОСТ
EN 12822— 2014
Издание официальное
Предисловие
Цели, основные принципы и основной порядок проведения работ по межгосударственной стандартизации установлены ГОСТ 1.0-92 «Межгосударственная система стандартизации. Основные положения» и ГОСТ 1.2-2009 «Межгосударственная система стандартизации. Стандарты межгосударственные. правила и рекомендации по межгосударственной стандартизации. Правила разработки, принятия, применения, обновления и отмены»
Сведения о стандарте
1 ПОДГОТОВЛЕН Открытым акционерным обществом «Всероссийский научно-исследовательский институт сертификации» (ОАО «ВНИИС») на основе аутентичного перевода на русский язык европейского регионального стандарта, указанного в пункте 4
2 ВНЕСЕН Федеральным агентством по техническому регулированию и метрологии (ТК 335)
3 ПРИНЯТ Межгосударственным советом по стандартизации, метрологии и сертификации (протокол от 30 мая 2014 г. № 67-П)
|
За принятие проголосовали: | |||||||||||||||||||||
|
4 Приказом Федерального агентства по техническому регулированию и метрологии от 19 августа 2014 г. № 900-ст межгосударственный стандарт ГОСТ EN 12822—2014 введен в действие в качестве национального стандарта Российской Федерации с 1 января 2016 г.
5 Настоящий стандарт идентичен европейскому региональному стандарту EN 12822:2000 Foodstuffs - Determination of vitamin E by high performance liquid chromatography - Measurement of a-. (K у and Mocopherols (Продукты пищевые. Определение витамина Е высокоэффективной жидкостной хроматографией. Измерение а-. (1-, у и ^токоферолов).
Перевод с немецкого языка (de).
Официальный экземпляр европейского регионального стандарта, на основе которого подготовлен настоящий межгосударственный стандарт, имеется в Федеральном агентстве по техническому регулированию и метрологии Российской Федерации.
Сведения о соответствии межгосударственных стандартов ссылочным европейским региональным стандартам приведены в дополнительном приложении ДА.
Степень соответствия - идентичная (IDT)
6 ВВЕДЕН ВПЕРВЫЕ
Информация об изменениях к настоящему стандарту публикуется в ежегодном информационном указателе «Национальные стандарты», а текст изменений и поправок - в ежемесячном информационном указателе «Национальные стандарты» В случае пересмотра (замены) или отмены настоящего стандарта соответствующее уведомление будет опубликовано в ежемесячном информационном указателе «Национальные стандарты». Соответствующая информация, уведомление и тексты размещаются также в информационной системе общего пользования - на официальном сайпю Федерального агентства по техническому регулированию и метрологии в сети Интернет
©Стандартинформ. 2015
В Российской Федерации настоящий стандарт не может быть полностью или частично воспроизведен. тиражирован и распространен в качестве официального издания без разрешения Федерального агентства по техническому регулированию и метрологии
ГОСТ EN 12822—2014
СТАНДАРТ
МЕЖГОСУДАРСТВЕННЫЙ
ПРОДУКТЫ ПИЩЕВЫЕ
Определение содержания витамина Е {а-, р-, у- и 6-токоферолов) методом высокоэффективной жидкостной хроматографии
Foodstuffs Determination of vitamin E (о-, P-, у- и 6-tocopherols) content by high performance liquid chromatography
Дата введения — 2016—01—01
1 Область применения
Настоящий стандарт устанавливает метод определения витамина Е в пищевых продуктах методом высокоэффективной жидкостной хроматографии (ВЭЖХ). Определение содержания витамина Е осуществляется путем определения а-, |Ц у- и 6-токоферолов. Активность витамина Е может быть рассчитана исходя из содержания токоферолов путем применения соответствующих коэффициентов [1). 12). [3).
2 Нормативные ссылки
Настоящий стандарт содержит следующие нормативные ссылки. Все последующие изменения документов, обозначенных датированными ссылками, допустимо использовать только после внесения соответствующих изменений в настоящий стандарт. В случае недатированных ссылок используют последнее издание документа, включая все изменения.
EN ISO 3696 Water for analytical laboratory use - Specification and test methods (ISO 3696:1987) (Вода для лабораторного анализа. Технические требования и методы испытаний)
EN ISO 5555 Animal and vegetable fats and oils. Sampling (ISO 5555:1991) (Жиры и масла животные и растительные. Отбор проб)
Примечание - При пользовании настоящим стандартом целесообразно проверить действие ссылочных стандартов в информационной системе общего пользования — на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет или по ежегодному информационному указателю «Национальные стандарты*, который опубликован по состоянию на 1 января текущего года, и по выпускам ежемесячного информационного указателя «Национальные стандарты» за текущий год Если ссылочный стандарт заменен (изменен), то при пользовании настоящим стандартом следует руководствоваться заменяющим (измененным) стандартом Если ссылочный стандарт отменен без замены, то положение, в котором дана ссылка на него, применяется в части, не затрагивающей эту ссылку
3 Сущность метода
Метод основан на определении а-, Щ у- и 6-токоферолов в растворе пробы высокоэффективной жидкостной хроматографией (ВЭЖХ) с фотометрическим (в ультрафиолетовой области) или. предпочтительнее, флуориметрическим детектированием. Для приготовления раствора пробы в большинстве случаев необходимо омыление материала пробы с последующей экстракцией анали-тов. Определяемые соединения идентифицируют по значениям времени удерживания и количественно определяют при помощи внешнего стандарта по результатам измерений значений площадей или высот пиков ([4] - [13]). Допускается использование метода внутреннего стандарта, если соответствующие тесты по полноте обнаружения подтверждают, что поведение внутреннего стандарта и аналитов в процессе анализа тохщественно.
4 Реактивы
Если не указано иное, то при анализе используют только реактивы гарантированной чистоты и воду, по крайней мере, степени чистоты 1 по EN ISO 3696
Издание официальное
4.1 Метанол.
4.2 Этанол абсолютный, объемная доля ф(С;Н5ОН) = 100 %.
4.3 Этанол. <р(С2Н5ОН) = 96 %.
4 4 Сульфат натрия, безводный.
4 5 Растворы гидроксида калия для омыления - водный раствор массовой концентрации (ЧКОН) = 50 г/100 см3 или 60 г/100 см' или водно-этанольный раствор р(КОН) = 28 r/100 см~' при объемном соотношении этанола и воды 9:1.
46 Антиоксиданты, такие как аскорбиновая кислота (АК), аскорбат натрия, пирогаллол, сульфид натрия (Na?S) или бутилокситолуол (ВНТ).
4.7 Растворители и экстрагенты, например диэтиловый эфир (не содержащий перекисей), дихлорметан. петролейный эфир (выкипающий от 40 °С до 60 ЭС). н-гексан. этилацетат или подходящая их смесь.
4.8 Подвижные фазы для ВЭЖХ
Примерами подходящих смесей (состав в объемных долях) являются: 3 % 1.4-диоксана или 0.5 % пропанола-2, или 3 % трет-бутилметилового эфира в н-гексане или н-гептане для нормальнофазовой хроматографии (НФ) или от 1 % до 10 % воды в метаноле для обращенно-фазовой хроматографии (ОФ).
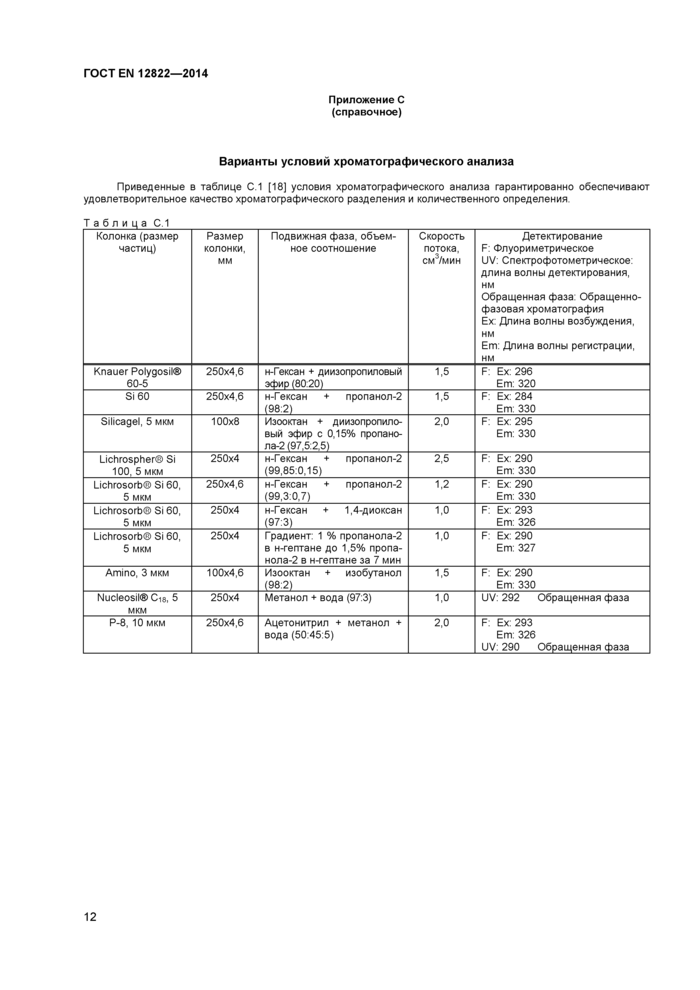
Относительно подвижных фаз для альтернативных систем для ВЭЖХ - см. приложение С.
4.9 Образцы сравнения
4.9.1 Общие положения
|К у- и 6-токоферолы поставляет фирма Merck1 2', а-токоферол доступен от различных поставщиков. Массовая доля основного вещества в образцах сравнения токоферолов может колебаться от 90 % до 100 %, поэтому необходимо определить массовую концентрацию градуировочного раствора спектрофотометрическим методом (см. 4.10.5).
4.9.2 а-токоферол. М(С^НмОг) - 430.7 r/моль. массовая доля основного вещества не менее 95 %. u-токоферилацетат М^Ь^Оэ) = 472,7 г/моль после омыления может также быть использован в качестве образца сравнения.
4.9.3 (1-токоферол, М(С:0Н4вО>) = 416.7 г/моль, массовая доля основного вещества не менее
90%.
4 9.4 у-токоферол. MfCjeHwOO = 416.7 г/моль, массовая доля основного вещества не менее
90%.
4 9.5 6-токоферол, М(С27Н460:) = 416,7 г/моль. массовая доля основного вещества не менее
90%.
4.10 Основные растворы
4.10.1 Основной раствора-токоферола
Взвешивают с точностью до 1 мг образец сравнения а-токоферола (4 9.2). например 10 мг, растворяют в определенном объеме, например 100 см3, подходящего растворителя, например н-гексана при использовании метода нормально-фазовой ВЭЖХ или метанола при использовании метода обращенно-фазовой ВЭЖХ.
4.10.2 Основной раствор (1-токоферола
Взвешивают с точностью до 1 мг образец сравнения (1-токоферола (4.9.3), например 10 мг. растворяют в определенном объеме, например 100 см3, подходящего растворителя, например н-гексана при использовании метода нормально-фазовой ВЭЖХ или метанола при использовании метода обращенно-фазовой ВЭЖХ
4.10.3 Основной раствор у-токоферола
Взвешивают с точностью до 1 мг образец сравнения у-токоферола (4.9.4). например 10 мг. растворяют в определенном объеме, например 100 см3, подходящего растворителя, например н-гексана при использовании метода нормально-фазовой ВЭЖХ или метанола при использовании метода обращенно-фазовой ВЭЖХ.
rOCTEN 12822—2014
4.10.4 Основной раствор 8-токоферола
Взвешивают с точностью до 1 мг образец сравнения 8-токоферола (4.9.5). например 10 мг. растворяют в определенном объеме, например 100 см3, подходящего растворителя, например н-гексана при использовании метода нормально-фазовой ВЭЖХ или метанола при использовании метода обращенно-фазовой ВЭЖХ.
4.10.5 Проверка концентрации и чистоты
Измеряют оптическую плотность основных растворов (4.10.1 - 4.10.4) при соответствующей длине волны (см. таблицу 1) на спектрофотометре, пригодном для проведения измерений в ультрафиолетовой области (5.1). Если в качестве растворителя используется н-гексан, то 10 см основного раствора помещают пипеткой в круглодонную колбу из темного стекла и отгоняют растворитель при пониженном давлении и температуре не выше 50 ®С с использованием ротационного испарителя (5.2). Остаток растворителя в колбе удаляют в токе азота, содержимое растворяют при перемешивании в 10 см3 метанола. Этот раствор используют для спектрофотометрических измерений.
Массовую концентрацию р. мкг/см3. соответствующего <х-. (К у- или 8-токоферола вычисляют по формуле:
_ АЛО4
Р- О)
*"ICN
где А - оптическая плотность основного раствора соответствующего токоферола;
Ei %
I см - коэффициент экстинкции соответствующего токоферола, приведенный в таблице 1.
|
г I •• Таблица 1- Примеры значений с-1 ^ | ||||||||||||||||||||
|
Дополнительно к полученному значению для а-токоферола при 292 нм следует также измерить
С I *•
оптическую плотность при 255 нм (в минимуме) и вычислить С!И при этой длине волны. Критерием
удовлетворительной чистоты образца сравнения является нахождение значения Ej в диапазоне от 6 до 8. в противном случае делают вывод о том. что произошло разложение вещества [14]. [15].
4.11 Градуировочные растворы
4.11.1 Градуировочный раствора-токоферола
10 см3 основного раствора а-токоферола (4.10.1) переносят пипеткой в мерную колбу вместимостью 100 см3 и разбавляют до метки подходящим растворителем (например, для нормально-фазовой хроматографии н-гексаном, для обращенно-фазовой - метанолом). Массовая концентрация градуировочного раствора а-токоферола должна быть от 1 до 10 мкг/см3. При использовании спектрофотометрического детектора следует использовать более концентрированный раствор.
Градуировочный раствор хранят в условиях защиты от света при температуре ниже 4 °С.
4.11.2 Градуировочный раствор смеси а-, р-, у- и 8-токоферолов
По 10 см3 каждого основного раствора (4.10) переносят пипеткой в мерную колбу вместимостью 100 см и разбавляют до метки подходящим растворителем (например, для нормально-фазовой хроматографии н-гексаном. для обращенно-фазовой - метанолом). Массовая концентрация канщого токоферола в градуировочном растворе должна быть от 1 до 10 мкг/см3.
Градуировочный раствор хранят в условиях защиты от света при температуре ниже 4 °С.
5 Аппаратура
При проведении испытаний используют стандартное лабораторное оборудование, в частности, следующее.
5.1 Спектрофотометр для ультрафиолетовой области, пригодный для измерений оптической плотности при заданных длинах волн, снабженный кварцевыми кюветами, например с толщиной слоя 1 см.
5.2 Ротационный испаритель, в комплекте с водяной баней и устройством для создания вакуума.
Примечание - Для сброса вакуума рекомендуется использовать азот,
5.3 Система для ВЭЖХ, состоящая из насоса, устройства для инжектирования проб, флуориметрического детектора (длина волны возбуждения 295 нм, длина волны регистрации 330 нм) и интегратора или системы обработки данных.
Допускается использование спектрофотометрического детектора, пригодного для проведения измерений при длине волны 292 нм. В этом случае градуировочные растворы и растворы проб должны быть более концентрированными. При использовании спектрофотометрического детектора вероятность помех со стороны матрицы пробы увеличивается.
5.4 Колонки для ВЭЖХ
Для проведения испытаний пригодны нормально-фазовые аналитические колонки, например внутреннего диаметра от 4,0 до 4,6 мм, длиной от 100 до 250 мм, заполненные силикагелем с размером частиц 5 мкм.
Допускается использование колонок других типоразмеров с другим размером частиц. При необходимости для достижения требуемой степени разделения пиков проводят корректировку условий хроматографического разделения.
Критерием применимости аналитических колонок является разделение определяемых аналитов до базовой линии.
Примерами подходящих сорбентов, доступных для приобретения, являются LiChrosorb® Si 60. Spherisorb® Si, Hypersil® Si и Lichrospher® 100 DIOL .
Могут также применяться аналитические колонки с обращенной фазой, например С18. с размером частиц 5 мкм, внутренним диаметром от 4,0 до 4,6 мм, длиной от 100 до 250 мм. Примерами подходящих обращенно-фазовых сорбентов являются Spherisorb® ODS и Hypersil ® ODS \ Большинство обращенно-фазовых сорбентов не разделяют (1- и у-токоферолы. Эти колонки, однако, могут использоваться для разделения а- и ^токоферолов.
5.5 Устройство для фильтрования, пригодное для установки фильтров большого и малого размеров для фильтрования подвижной фазы и растворов проб, например с диаметром пор 0.45 мкм.
Примечание - Как правило, фильтрование подвижной фазы и растворов проб через мембранный фильтр перед инжектированием продлевает срок жизни колонок
5.6 Фильтр для разделения фаз (применяется по выбору пользователя стандарта).
6 Отбор проб
Отбор проб проводят по EN ISO 5555. если данный стандарт применим.
7 Проведение испытаний
7.1 Подготовка пробы к испытаниям
Испытуемую пробу гомогенизируют. Грубые материалы размалывают в подходящей мельнице и тщательно перемешивают. Чтобы исключить длительное воздействие высоких температур, пробу охлаждают.
LiChrosorb© Si 60, Spherisorb® Si, Hypersil® Si, Lichrospher® 100, DIOL Spherisorb ® OOS и Hypersil ® OOS являются примерами коммерчески доступных продуктов Эта информация приведена для удобства пользователя и не является поддержкой указанных продуктов 4
rOCTEN 12822—2014
7.2 Приготовление раствора пробы
Примечание - Важно, чтобы растворы проб при хранении были защищены от света
7.2.1 Пробы растительных масел и жиров с низким содержанием влаги, содержащие неэтерифицированные токоферолы
7.2.1.1 Растительные масла и жиры (низкое содержание воды)
Изложенный ниже способ применим только к пробам, содержащим неэтерифицированные токоферолы. В противном случае испытания проводят по 7.2.2.
Подготовленную к испытаниям пробу массой 2 г, взвешенную с точностью до 0.1 мг, помещают в мерную колбу вместимостью 25 см3. Добавляют н-гексан или иной подходящий растворитель и растворяют в нем пробу. Обработка ультразвуком может ускорить процесс растворения. Доводят содержимое колбы до метки тем же растворителем. Подготовленный раствор пробы может быть использован только при анализе методом нормально-фазовой ВЭЖХ. При необходимости раствор пробы разбавляют тем же растворителем либо готовят новый раствор с использованием подготовленной к испытаниям пробы меньшей массы.
7.2.1.2 Маргарин, сливочное масло
При испытании маргарина и сливочного масла необходимо выделить жир из пробы. Это может быть достигнуто, например, путем смешивания пробы с безводным сульфатом натрия (4.4). добавления н-гексана (4.7) и обработки смеси в ультразвуковой бане. Нерастворившиеся вещества отфильтровывают и не менее двух раз промывают н-гексаном. Растворитель отгоняют на ротационном испарителе при пониженном давлении, остаток растворяют в определенном объеме н-гексана и анализируют методом нормально-фазовой хроматографии.
7.2.2 Прочие продукты
7.2.2.1 Омыление
Подготовленную к испытаниям пробу массой от 2 до 10 г омыляют с обратным холодильником, предпочтительно в атмосфере азота, добавляя при этом необходимое количество этанола (4.3) или метанола (4.1). воды, антиокислителя (4.6). такого как аскорбиновая кислота (АК). гидрохинон, пирогаллол или ВНТ и одного из растворов гидроксида калия (4.5). Спирты и антиокислители добавляют в пробу до добавления раствора гидроксида калия. Можно также добавить сульфид натрия для снижения каталитического эффекта следов металлов.
В таблице 2 приведены примеры подходящих количеств реактивов.
|
Таблица 2 | ||||||||||||||||
|
Обычно время омыления составляет от 15 до 40 мин при температуре от 80 °С до 100 °С.
Если по окончании омыления на поверхности охлажденной реакционной смеси присутствует жира или масло, то омыление продолжают после добавления дополнительного количества водно-этанольного раствора гидроксида калия.
7.2.2 2 Экстракция
Чтобы избежать образования эмульсии, раствор пробы после омыления разбавляют таким количеством воды, чтобы в полученном растворе объемное отношение спирта и воды составляло 1:1.
Экстрагируют токоферолы подходящим растворителем (4.7). Для обеспечения надлежащей полноты выделения у и б-токоферолов при использовании н-гексана в качестве экстрагента к нему должна быть добавлена определенная доля полярного растворителя. Для количественной экстракции токоферолов также применяют такие смеси растворителей, как, например, петролейный эфир с добавлением 20 % диэтилового эфира. Для выявления возможных потерь аналита контролируют полноту обнаружения токоферолов(16), (17).
Процедуру экстракции повторяют три-четыре раза, используя порции экстрагента объемом от 50 до 150 см3. Объединенные экстракты промывают водой до нейтральной реакции (два - четыре раза объемом от 50 до 150 см3). Экстракция может также быть осуществлена с использованием
5
патронов для твердофазной экстракции (например. Extrelut О1*) при условии, что содержание токоферолов не слишком мало и содержание жира составляет менее 10 % (18).
7.2.2.3 Концентрирование экстракта
Из экстракта удаляют растворитель путем дистилляции с применением ротационного испарителя (5.2) при пониженном давлении и температуре не выше 50 °С. Предварительно остающиеся следы воды удаляют путем осушения безводным сульфатом натрия (4.4) или отгонки азеотропа с абсолютным этанолом (4.2) или толуолом (4 6). Могут быть использованы другие равноценные способы удаления следов воды, такие как применение фильтра для разделения фаз. при условии, что они не оказывают негативного влияния на результаты испытаний.
7.2.2.4 Разбавление
Остаток растворяют в подвижной фазе (4 8) или в другом, совместимом с подвижной фазой растворителе, причем массовая концентрация отдельных токоферолов в полученном растворе пробы должна составлять от 1 до 10 мкг/см'.
7.3 Идентификация
Пики токоферолов на хроматограмме раствора пробы идентифицируют по совпадению значений времени удерживания со значениями времени удерживания пиков токоферолов на хроматограммах градуировочных растворов. В качестве альтернаты пики токоферолов на хроматограмме раствора пробы идентифицируют путем ее сопоставления с хроматограммой раствора пробы с добавкой градуировочных растворов.
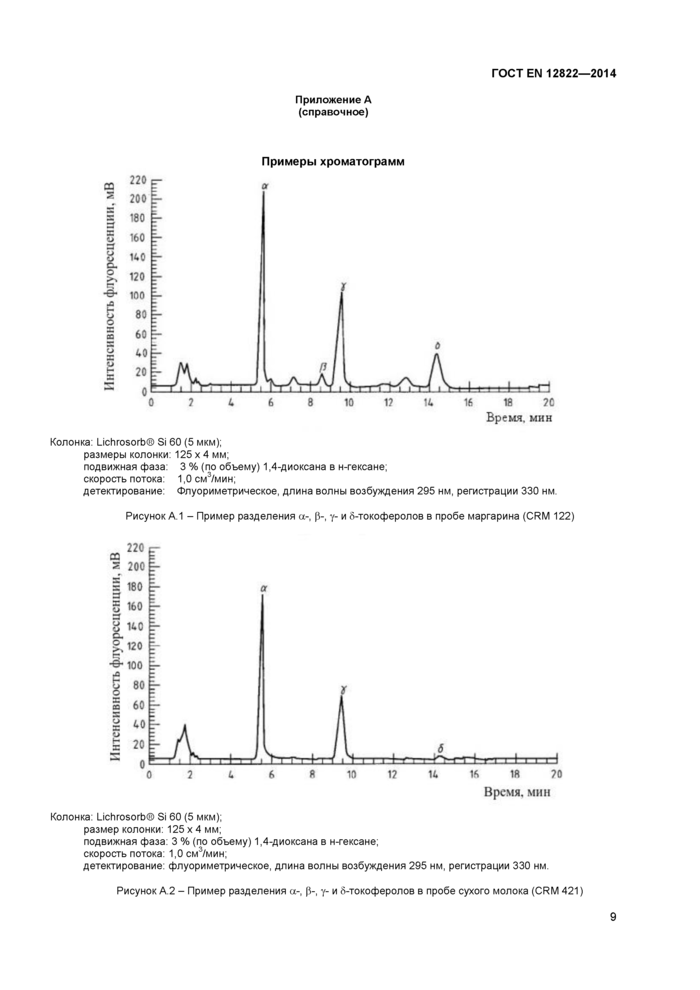
Примечание - Установлено, что разделение и количественное определение являются удовлетворительными при следующих хроматографических условиях (см также приложение А, рисунки А 1 и А2). Другие варианты условий хроматографического анализа приведены в таблице С 1 (приложение С)
Сорбент аналитической колонки: LiChrosortxS) Si 60. 5 мкм;
размеры колонки: 125 мм х 4 мм;
подвижная фаза: 3 % (по объему) 1,4-диоксана в н-гексане;
скорость потока подвижной фазы: 1.0 см3/мин;
объем инжекции: от 10 до 100 мм3;
условия детектирования: флуориметрическое детектирование при длинах волн возбуждения 295 нм и регистрация 330 нм.
7.4 Количественное определение
В ВЭЖХ-систему (5.3) инжектируют подходящие объемы (до 100 мм3) градуировочного раствора и раствора пробы. Количественное определение проводят путем соотнесения площади или высоты пика аналита на хроматограмме раствора пробы с аналогичными параметрами пика на хроматограмме градуировочного раствора.
Объемы инжекции раствора пробы и градуировочного раствора должны быть одинаковыми, в противном случае их учитывают при вычислении результата (см. раздел 8). Проверяют соблюдение требования проведения измерений в пинейной области градуировочной характеристики.
7.5 Число определений
Следует провести по меньшей мере два независимых определения.
8 Обработка результатов
Вычисление результатов проводят при помощи градуировочной характеристики либо путем применения соответствующей программы интегратора, либо применяют следующий упрощенный способ.
Массовую долю а-, |К у- или 6-токоферола р, мг/100 г пробы, вычисляют по формуле:
Р =
А,-с-У-У;
sr
lST
m-Vs -1000
•100
(2)
’ Extrelut© являются примером коммерчески доступного продукта Эта информация приведена для удобства пользователя и не является поддержкой указанных продуктов 6
ГОСТ EN 12822—2014
где As - площадь или высота пика а-. (К у- или 6-токоферола в растворе пробы;
ASr- площадь или высота пика |V-, у- или 6-токоферола в градуировочном растворе;
V- общий объем раствора пробы (7.2.1 или 7.2.2). см4;
с - массовая концентрация а-, |К у- или 6-токоферола в градуировочном растворе (4.11.1 и
4.11.2), мкг/см3;
т - масса пробы, г;
Vsr- объем инжекции градуировочного раствора, мм3;
Vs - объем инжекции раствора пробы, мм3;
1000 - множитель для пересчета мкг в мг;
100 - множитель для пересчета массовой доли на 100 г.
Результаты для а-. 0-, у- или 6-токоферола выражаются в мг/100 г пробы. При необходимости расчета активности витамина Е руководствуются (1]. [2]. (3).
9 Прецизионность
9.1 Общие положения
Данные по прецизионности различных вариантов определения а-токоферола методом ВЭЖХ были исследованы в ходе межлабораторных сравнительных испытаний, организованных в 1994 году Европейской комиссией по нормированию, измерениям и испытаниям на международном уровне [18] с использованием стандартных образцов маргарина (CRM 122) и сухого молока (CRM 421). Испытания привели к получению статистических результатов, представленных в приложении В Результаты, полученные при этих международных сравнительных испытаниях, могут быть не применимы к другим диапазонам содержаний определяемых соединений и иным матрицам по сравнению с приведенными в приложении В.
Данные по прецизионности для сухого молока и овсяной муки были установлены в соответствии с ИСО 5725:1986 [19] в ходе межлабораторных сличительных испытаний, организованных на национальном уровне институтом им. Макса фон Петтеркофера Федерального учреждения по здравоохранению (в настоящее время - Федеральный институт защиты здоровья потребителя и ветеринарной медицины) [20]. Результаты, полученные при этих сравнительных испытаниях, могут быть не применимы к другим диапазонам содержаний определяемых соединений и иным матрицам по сравнению с приведенными в приложении В
9.2 Повторяемость
|
Значения приведены ниже: Маргарин |
а-токоферол |
х = 24.09 мг/100 г. |
г- 2.765 мг/100 г. |
|
Сухое молоко |
а-токоферол |
х = 9.89 мг/100 г. |
г- 1.130 мг/100 г. |
|
Сухое молоко |
а-токоферол |
х= 10.2 мг/100 г. |
/-=0,853 мг/100 г; |
|
(V- токоферол |
х = 0.081 мг/100 г. |
г= 0.025 мг/100 г; | |
|
у- токоферол |
х = 1.989 мг/100 г. |
г =0,311 мг/100 г; | |
|
6- токоферол |
х = 0.280 мг/100 г. |
г- 0,082 мг/100 г. | |
|
Овсяная мука |
а-токоферол |
х = 0.279 мг/100 г. |
г =0.071 мг/100 г. |
|
Ц- токоферол |
х = 0,057 мг/100 г. |
г = 0,017 мг/100 г. |
Абсолютная разность между двумя единичными результатами испытаний, полученными одним исполнителем на идентичном исследуемом материале на одном и том же оборудовании в течение возможно короткого промежутка времени, может превышать предел повторяемости г не чаще чем в 5 % случаев. Предел повторяемости зависит от содержания определяемых соединений в пробе.
9.3 Воспроизводимость
Абсолютная разность между двумя единичными результатами, полученными в двух лабораториях на идентичном исследуемом материале, может превышать предел воспроизводимости R не чаще чем в 5 % случаев. Значения приведены ниже:
Маргарин а-токоферол х = 24.09 мг/100 г. R = 4.18 мг/100 г.
Сухое молоко а-токоферол х = 9.89 мг/100 г, R = 1.96 мг/100 г.
Сухое молоко а-токоферол х = 10.2 мг/100 г, R = 3.705 мг/100 г;
ГОСТ EN 12822—2014
| ||||||||||||||||||||
|
10 Протокол испытаний |
Протокол испытаний должен содержать, по меньшей мере, следующие сведения:
- всю информацию, необходимую для идентификации пробы;
- ссылку на настоящий стандарт или используемый метод;
- результаты испытаний с указанием единиц измерений, в которых выражен результат;
- дату и способ отбора проб (если он известен);
- дату поступления пробы;
- дату проведения испытаний;
- все особенности, наблюдавшиеся при проведении испытаний;
- любые применявшиеся операции, не оговоренные в методе или рассматриваемые как необязательные, которые могли повлиять на результат испытаний.
8
7
1
Эта информация приведена исключительно для удобства пользователя настоящего стандарта и не является поддержкой указанного поставщика со стороны CEN
2
3
4
' CRM - сертифицированный стандартный образец