Правила бактериологического исследования кормов
Купить бумажный документ с голограммой и синими печатями. подробнее
Цена на этот документ пока неизвестна. Нажмите кнопку "Купить" и сделайте заказ, и мы пришлем вам цену.
Распространяем нормативную документацию с 1999 года. Пробиваем чеки, платим налоги, принимаем к оплате все законные формы платежей без дополнительных процентов. Наши клиенты защищены Законом. ООО "ЦНТИ Нормоконтроль"
Наши цены ниже, чем в других местах, потому что мы работаем напрямую с поставщиками документов.
Способы доставки
- Срочная курьерская доставка (1-3 дня)
- Курьерская доставка (7 дней)
- Самовывоз из московского офиса
- Почта РФ
Правила регламентируют единые методы бактериологического исследования кормов животного и растительного происхождения, комбикормов и рыбной муки
Оглавление
1 Отбор проб и составление среднего образца
2 Методы бактериологического исследования
2.1 Определение общего количества микробных клеток
2.2 Исследования на сальмонеллы
2.3 Метод "двойного центрифугирования"
2.4 Люминесцентный метод обнаружения сальмонелл
2.5 Исследования на энтеропатогенные типы кишечной палочки
2.6 Исследования на анаэробы
3 Оценка кормов
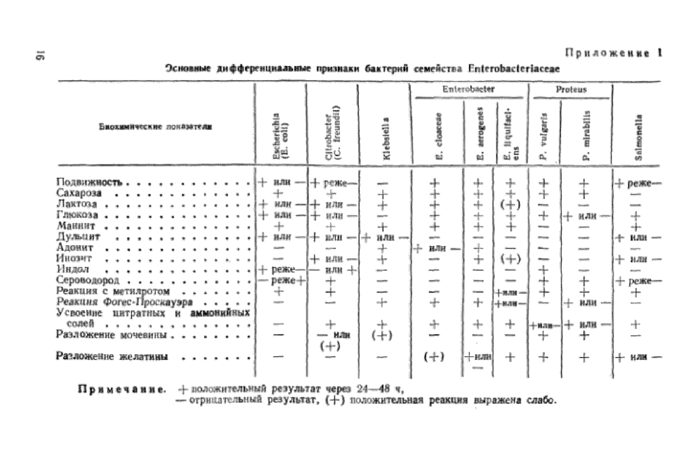
Приложение 1. Основные дифференциальные признаки бактерий семейства Enterobacteriaceae
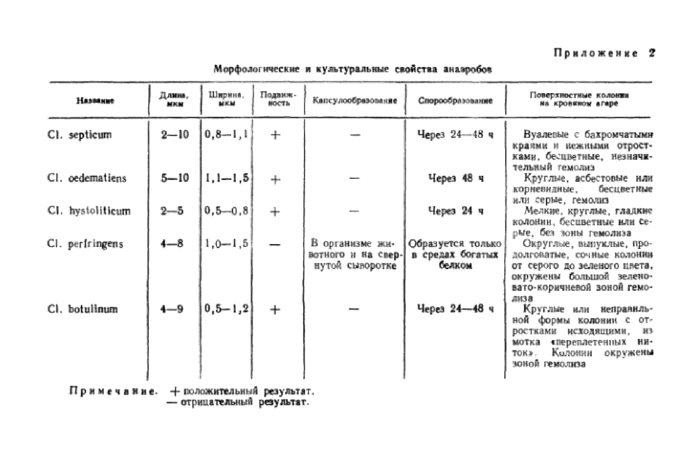
Приложение 2. Морфологические и культуральные свойства анаэробов
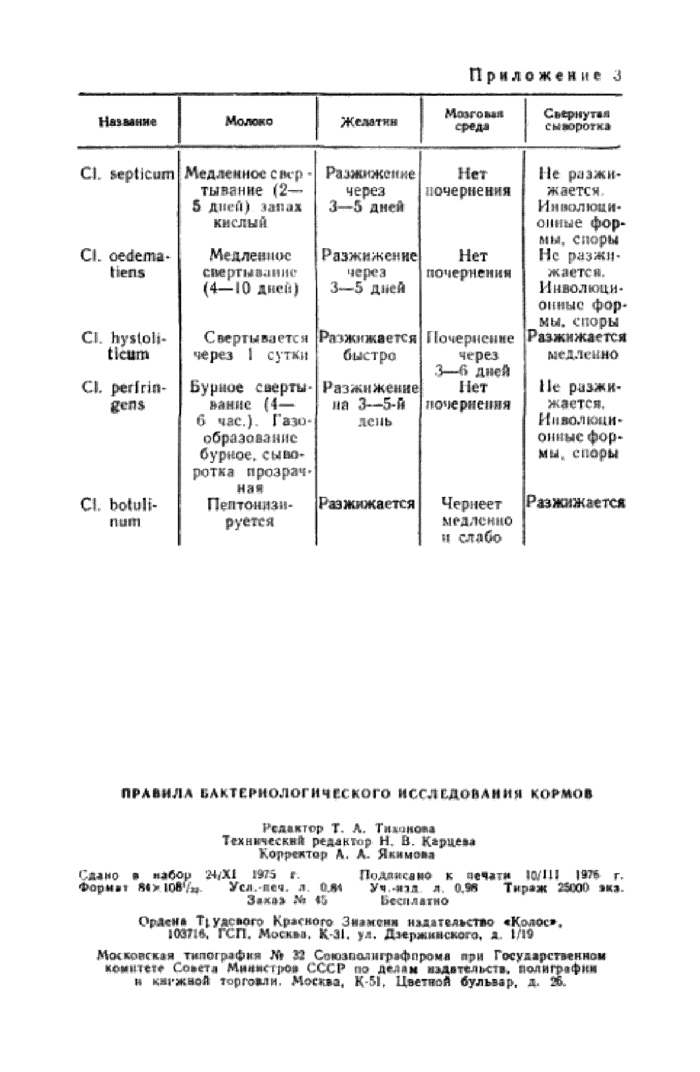
Приложение 3. Время разжижения
| Дата введения | 01.01.2021 |
|---|---|
| Добавлен в базу | 01.02.2017 |
| Актуализация | 01.01.2021 |
Этот документ находится в:
- Раздел Экология
- Раздел 65 СЕЛЬСКОЕ ХОЗЯЙСТВО
- Раздел 65.120 Корма для животных
- Раздел 65 СЕЛЬСКОЕ ХОЗЯЙСТВО
- Раздел Экология
- Раздел 11 ЗДРАВООХРАНЕНИЕ
- Раздел 11.220 Ветеринария
- Раздел 11 ЗДРАВООХРАНЕНИЕ
Организации:
| 10.06.1975 | Утвержден | Главное управление ветеринарии Министерства сельского хозяйства СССР | |
|---|---|---|---|
| Разработан | ВНИИ ветеринарной санитарии Минсельхоза СССР | ||
| Издан | Издательство Колос | 1976 г. |
Чтобы бесплатно скачать этот документ в формате PDF, поддержите наш сайт и нажмите кнопку:

стр. 1

стр. 2

стр. 3

стр. 4

стр. 5

стр. 6

стр. 7

стр. 8

стр. 9

стр. 10

стр. 11

стр. 12

стр. 13

стр. 14

стр. 15

стр. 16

стр. 17
стр. 18
стр. 19
стр. 20
МИНИСТЕРСТВО СЕЛЬСКОГО ХОЗЯЙСТВА СССР
ГЛАВНОЕ УПРАВЛЕНИЕ ВЕТЕРИНАРИИ
ПРАВИЛА бактериологического исследования кормов
МОСКВА «КОЛОС» 1976
Разработаны Всесоюзным научно-исследовательским институтом ветеринарной санитарии и сиециалистамн Главного управления ветеринарии МСХ СССР.
Утверждены Главным управлением ветеринарии МСХ СССР 10 нюни 1975 г.
& Мпистерство сельского хозяйства СССР, 1976
шечной палочки по О-антигену с целью установления энзоотических типов.
Для приготовления антигена каждую предназначенную для типизации суточную агаровую культуру (пробирка со скошенным агаром) смывают стерильным физиологическим раствором хлористого натрия, доводят суспензию бактерий до концентрации 5—6 млрд/мл и кипятят в водяной бане в течение 1 ч. Вода должна полностью закрывать уровень культуры в пробирках.
На чистое обезжиренное стекло наносят пастеровской пипеткой по капле каждой комплексной О-сыво-ротки, разведенной физиологическим раствором 1 :5, и по капле исследуемого антигена. Затем хорошо перемешивают стеклянной палочкой или петлей. Реакция протекает при комнатной температуре в течение 3 мин при покачивании стекла.
В том случае, когда антиген агглютинируется всеми комплексными сыворотками, его проверяют с физиологическим раствором для исключения самоагглютннацин. Самоагглютиннруюшие антигены для серотипнэации непригодны.
Антигены, давшие четко выраженную агглютинацию на стекле с комплексной коли сывороткой, исследуют в капельной реакции агглютинации с отдельными разведенными 1 :10 тнпоспецифическими сыворотками, входящими в состав комплексной сыворотки.
2.5.6. Если антиген из исследуемой культуры агглютинируется в капельной РА с одной или двумя-тремя мо-носыворотками, то его проверяют с этими же сыворотками в пробирочной РА, так как реакция на стекле имеет лишь ориентировочное значение.
Для постановки пробирочной РА типослсцнфичсскнс О-сыворотки, агглютинирующие антиген из исследуемой культуры в РА на стекле, разводят физиологическим раствором, начиная с 1 : 100 до предельного титра сыворотки, указанного на этикетке, и во все пробирки добавляют по 2 капли антигена (концентрация 5—6 млрд, бактериальных тел по бактерийному стандарту), приготовленного нз убитой нагреванием агаровой культуры обнаруженных бактерий.
Одновременно ставят контроля: I. Антиген 4- физиологический раствор (для исключения самоагглютина-ции) и 2. Сыворотка, разведенная 1 :100, без антигена (для исключения явления флоккуляции).
Штатив с пробирками встряхивают и ставят в термостат при 37® С на 12—16 ч, затем выдерживают при комнатной температуре 18—24 ч. Реакция учитывается при помощи лупы или агглютиноскоиа. Принадлежность к О-группе определяют по нанвысшему разведению тн-поспецифической агглютинирующей сыворотки, вызывающей агглютинацию антигена исследуемой культуры, которое должно быть не ниже половины предельного титра типоспецнфнческой сыворотки. Сыворотка и антиген в контроле не должны образовывать хлопьев.
2.5.7. Если все комплексные О-колисыворотки в капельной реахции не агглютинируют антиген из убитой нагреванием культуры, то готовят из этого штамма суспензию бактерий и автоклавируют ее при давлении пара 1 атм (120°) в течение 2 ч для разрушения термо-стабильного А-антигена. Автоклавированный антигея исследуют с сыворотками 08, 09, 0101 как указано » пункте 2.5.5.
2.6. Исследования на анаэробы
2.6.1. 50 г корма растирают в стерильной ступке с физиологическим раствором и засевают в несколько пробирок со средой Кнтт-Тароцци, молоком и по две чашки со средами Вильсон-Блера и кровяным агаром по Цейслеру. Для уничтожения вегетативных форм по одной пробирке с жидкими средами прогревают при температуре 80° С в течение 20 мин. Посевы помещают в термостат при температуре 37® С. Чашки должны находиться в специальных аппаратах для анаэробных культур или в эксикаторе, куда заранее вносят тот или иной поглотитель кислорода.
2.6.2. Результаты посевов регистрируют в первый же день. Почернение среды Вильсон-Блера в течение 1—3 ч после посева, свертывание молока с образованием ноздревато-губчатого сгустка и прозрачной сыворотки в течение 6 ч, а также быстрое начало роста на среде Китт-Тароцци (через 4—5 ч) при обильном газообразовании является характерным для клоетриднум перф-рингенс.
Рост клостридиум ботулинум, наблюдаемый обычно на 2—3-й день, характеризуется помутнением среды Китт-Тароцци, образованием осадка и запахом прогорклого масла.
При обнаружении роста на среде Китт-Таршши производят микроскопическое исследование и выделение чистой культуры посевом на 2—3 чашки с кровяным агаром по Цейслеру, которые выдерживают в анаэробных условиях при температуре 37° С в течение 24— 48 ч, после чего’просматривают рост в чашках и отбирают культуры, которые классифицируют по морфологическим и биохимическим свойствам, указанным в приложении 2 и 3.
Биологическую пробу проводят на морских свинках или белых мышах путем внутрибрюшинного заражения бульонной культурой. При положительном результате подопытные животные гибнут через 12—48 ч.
2.6.3. Для идентификации отдельных возбудителей или типов одного вида ставят опыт нейтрализации токсина специфической сывороткой. Для этого минимальную смертельную дозу культуры в смеси с 0.2—0.5 мл соответствующей тнпоспецифнческой сыворотки выдерживают в термостате 45 мин и вводят мышам внутрибрю-шинно. Для контроля испытуемую культуру или фильтрат вводят мышам без сыворотки. Вид и тип мнхроба определяют по выживаемости мышей, получивших соответствующую сыворотку.
2.6.4. При исследовании кормов на ботулизм (наличие токсинов) в качестве подопытных животных используют белых мышей. При этом могут быть применены два способа:
а) нейтрализация токсина противоботулиновой сывороткой (антитоксином). Корм предварительно растирают в ступке со стерильным физиологическим раствором (1:4) и настаивают в течение 1—2 часов при комнатной температуре. Настой центрифугируют н фильтруют через ватно-марлевый фильтр. К 0,5 мл фильтрата добавляют 0,2 мл поливалентной противоботулиновой сыворотки. Смесь выдерживают I ч при комнатной температуре, затем одному животному вводят подкожно 0,5 мл фильтрата, другому — смесь фильтрата с сывороткой в той же дозе.
Аналогичное испытание может быть проведено с 6—7-суточной культурой, выращенной на печеночном бульоне. В этом случае пастеровской пипеткой отсасывают верхний слой культуры, который фильтруют через ватно-марлевый фильтр. Далее поступают как указано выше;
11
б) разрушение токсина кипячением фильтрата. Фильтрат готовят как указано в подпункте «а» пункта 2.6.4. Одну половину фильтрата кипятят в течение 30 мин. Затем одному животному внутрибрюшинно вводят 0,5— 1,0 мл не кипяченого фильтрата, другому —в этой же дозе прокипяченного.
2.6.5. Положительным результатом биологической пробы по первому и второму способам, считают гибель мышей, наступившую как от фильтрата не обработанного лротивоботулиновой сывороткой, так и от фильтрата не подвергнутого кипячению.
3. ОЦЕНКА КОРМОВ
3.1. Комбикорма используют сельскохозяйственным животным при отрицательных результатах исследования на сальмонеллы, энтсропатогсиные типы кишечной палочки и токсипообразуюшие анаэробы при условии его соответствия другим показателям действующих стандартов.
3.2. Мясо-костную и рыбную муку используют сельскохозяйственным животным при общей бактериальной об-семененности не более 500 тыс. микробных тел в 1 г и отрицательных результатах исследования на сальмонеллы, энтеропатогенные типы кишечной палочки и протея, а также токеннообразующие анаэробы при условии соответствия другим показателям действующих стандартов.
3.3. При установлении в кормах анаэробных микроорганизмов и их токсинов такие <орма запрещается использовать животным без дополнительной термической обработки, которую проводят при температуре 120— 130° С в течение 2 ч. После стерилизации корма подвергают бактериологическому исследованию с постановкой биопробы на наличие анаэробов и их токсинов, и при
При обнаружении сальмонелл, энтеропатогенных типов кишечной палочки и протея корм запрещается использовать животным без дополнительной обработки. Вторичную стерилизацию проводят в соответствии с технологическими режимами производства этих кормов или же этот корм подвергается проварке при температуре не ниже 100^ С в течение 1 ч и дальнейшей обработке согласно установленному технологическому режиму приготовления кормов к скармливанию.
получении отрицательных результатов они могут быть использованы на кормовые цели. При положительных результатах исследования эти корма уничтожают.
3.4. Корма, производство которых связано с тепловой обработкой, имеющие бактериальную обсемененность свыше 500 тыс. микробных клеток в 1 г при отсутствии патогенных микроорганизмов, подлежат повторной стерилизации согласно технологическим инструкциям или могут быть направлены для производства гранулированных кормов с термической обработкой, а также проварке, как указано в п. 3.2. настоящих правил,
РЕЦЕПТЫ ОСНОВНЫХ ПИТАТЕЛЬНЫХ СРЕД I. Селенитовая срези
Олноэамешеиньгй кислый селеннстоквслый натрий (без
теллурит») NaHSeOj................ 4,0 Г
Пептон (чешский, венгерский или ГДР)’........ 5.0 г
Натрий фосфорнокислый дпузаисшенный (безводный)
NaHPQi...................... 7.0 г
Натрий фосфорнокислый одиозамеимкный (безводный)
NaH,PO,...................... 3,0 г
Лактоза............... 4,0 г
Вода дистиллированная ................ 1000 мл
К дистиллированной воде добавляют фосфаты, пептон и лактозу, растворяют их и стерилизуют при 112°С в течение 30 мин. Отдельно на стерильной дистиллированной воде готовят 10%-иый раствор кислого селенистокислого натрия, который добавляют к среде перед употреблением из расчета 0,4 мл на 10 мл среды. Готовая среда должна иметь pH 6,8—7,1.
2. Магниевая среда
а) Пептон...................... 4,2 г
Хлористый натрий ............ 7,0 г
Калий фосфорнокислый однозамещенный (безводный)
КН,РО,...................... 1.5 р
Дрожжевой экстракт......... 20,0 г
Вода дистиллированная................ 890 мл
Растворяют при кипении, затем добавляют растворы: б) и в).
б) Хлористый магний кристаллический......... 36,0 г
Вола дистиллированная .............. 90 0 мл
в) 0,1%-ный водный раствор бриллиантового зеленого 5,0 мл
Среду разливают в колбы и стерилизуют при 112° С 20 мин.
Дрожжевой экстракт. 1 кг прессованных пекарских дрожжей распределяют равномерно в 2 л дистиллиро-
13
ванной волы, прогревают в автоклаве при 100еС 30 мин и оставляют отстаиваться в холодильнике при +4—5аС в течение 4—6 суток. Мадосадочную жидкость разливают do флаконы по 50—100 мл. Па каждые 100 мл экстракта добавляют 1,25 мл 0,01%-ного водного раствора кристаллического фиолетового, вновь прогревают при 100' С 30 мин в автоклаве.
Примечание. Экстракт можно готовить из сухих дрожжей, при 5том на I кг сухих дрожжей необходимо брать 6 л дистиллированной воды. Готовый экстракт должен храниться в холодильнике.
3. ТрехсахариыЙ агар с мочевиной
1.0 г
1.0 г
Ч г
1.0 г 0,02 г
0,63 г 0,4—0,6 мл
На 100 мл питательного агара (pH 7,2—7,4) берут:
Лактозы
Сахарозы ..........
Глюкозы ........ .
Мече вины ..........
Соль Мора..........
Гипосульфита.........
Фенолового красного (фенолрота)
Все ингредиенты, кроме фенолрота, растворяют в небольшом количестве дистиллированной воды (10 мл) на водяной бане и вносят в расплавленный агар, фильтруют через марлю и доводят pH до 7,2—7,4. Затем добавляют фенолрот и разливают в пробирки по 5—6 мл. Стерилизуют в прогретом автоклаве при 0.5 атм.20мин.
4. Среда КОДА
Пептон ............ ........... 10,0 г
Л актом................ 10,0 г
Хлористый натрий...... 5,0 г
Алхилбензолсульфондт..... 12,0 г
Вромкреэоловый пурпурный (1:100) (водио-Спиртовый 1:1) 2,0 мл
Метиленовая синь (1:1000)..... 2,5 мл
Вода дистиллированная................ 1000 мл
Компоненты, за исключением красителей, растворяют в 1000 мл дистиллированной воды, доводят pH до 7,8—7,9 и кипятят 15—20 мин. после чего фильтруют через ватный фильтр и вносят растворы красителей. Разливают в пробирки и стерилизуют при 0,5 ати в течение 15—20 мин.
5. Среда Кггт-Тароцци
Печень быка, теленка, лошади, кролика или морской свинки режут на кусочки но 1—3 г, смешивают нх с
14
1. ОТБОР ПРОБ И СОСТАВЛЕНИЕ СРЕДНЕГО ОБРАЗЦА
1.1. Настоящие правила регламентируют единые методы бактериологического исследования кормов животного и растительного происхождения, комбикормов и рыбной муки.
1.2. Отбор проб для бактериологического исследования при наличии затаренной продукции проводят согласно следующей таблицы.
| ||||||||||||
|
Примечание. 1 мешок ж I упаковочной единице. |
1.3. При наличии незатаренной продукции пробы берут не менее чем из 20 мест однородной партии со всей площади насыпи. Пробы можно отбирать в том же количестве с периодическими интервалами при погрузке и выгрузке из транспортных средств и бункеров.
1.4. Однородной партиен считается количество корма, которое изготовляется по единой технологии в одну смену, затаренное в мешки или в незатаренном виде (насыпью) и доставленное одним видом транспорта.
1.5. Отбор проб проводят сухим, стерильным пробным щупом. После взятия проб от каждой партии пробный щуп очищают и дезинфицируют. Вес первичной пробы должен быть не менее 100 г.
1.6. Для бактериологического исследования от каждой партии корма составляют два средних образца весом не менее 500 г. Один из них направляют в лабораторию, а другой сохраняют на предприятии (хозяйстве) до окончания исследования.
I
1.7. Для упаковки средних образцов применяют стерильную пластмассовую или стеклянную тару.
1.8. Об отборе проб составляют акты в двух экземплярах. Акты должны содержать следующие данные: название предприятия (хозяйства), вид продукции, объем (вес) партия, вид упаковки (тары), дату изготовления, дату отбора проб.
2. МЕТОДЫ БАКТЕРИОЛОГИЧЕСКОГО ИССЛЕДОВАНИЯ
2.1. Определение общего количества микробных клеток
2.1.1. В стерильную пробирку помещают 1 г корма, взя
того из среднего образца (взятие корма для навссхи одноразовое), добавляют 9 мл физиологического раствора и тщательно встряхивают (получают разведение I : 10). Из полученной взвеси готовят последующие разведения (1 : 100, 1 : 1000. 1: 10000, 1 : 100000,
I : I 000000). После оседания взвешенных частиц из верхнего слоя жидкости делают посевы.
Для количественного учета микробного обсеменения в стерильные бактериологические чашки вносят по 1 мл каждого разведения и заливают 10—15 мл стерильного, расплавленного и охлажденного до температуры 44—45°С мясо-пептоннсго агара. Осторожно покачивая чашки, засеянный материал равномерно распределяют в агаре. После застывания среды чашки помещают (вверх дном) в термостат при температуре 37°С.
После 24—48-часового термостатирования проводят подсчет выросших колоний только в чашках, где содержатся не более 300 колоний. Результаты, полученные при подсчете колоний, умножают на разведения, суммируют и определяют количество микробов в 1 г корма.
Например, в одной чашке оказалось 200 колоний, в другой — 21 и третьей — 1. В эти чашки посев проводили из пробирок с разведениями соответственно 1 : 10000, 1 :100000, 1 : I 000 000. Следовательно, 1 г корма содержит
200 х 100004- 21 у 100 000-f 1 х I 000ООО
3 "
= 1,7 млн. микробных клеток.
2
2.2. Исследования на сальмонеллы
2.2.1. Метод последовательного обогащения. Навеску исследуемого материала 50—200 г (50 г от 10 и менее, 100 г от 10 до 100 и 200 г от 101 и выше упаковочных единиц) измельчают в стерильной фарфоровой ступке и помещают в колбу, содержащую среду предварительного обогащения (пептонная вода, МПБ с содержанием 5% маннита) при соотношении материала и среды 1 : 5.
Содержимое колбы тщательно перемешивают и помещают в термостат при температуре 37° С. Через 16—18 ч производят посевы на бактериологические чашки с твердыми дифференциально-диагностическими средами: висмут-сульфит агар, средой Плоскирева или Левина (по две чашки) и на две (по выбору) основные среды обогащения (селенитовый бульон, магниевую среду, среды Киллиана, Мюллера, Кауфмана) в соотношении 1 :5. Лучшими являются селенитовый бульон и магниевая среда.
После 16—18 ч выдерживания в термостате при 374С из обогатительных сред бактериологической петлей производят вторично посевы на чашки с твердыми дифференциально-диагностическими средами, которые помещают в термостат при 37° С.
Засеянные чашки просматривают через 16—24—-48ч.
На висмут-сульфит агаре S. typhi н S. paratyphi А растут в виде мелких, нежных, серовато-зеленых колоний с черным центром; S. cboieraesuis — в виде зеленых колоний. Колонии почти всех других сальмонелл значительно крупнее, темно-коричневого цвета с металлическим блеском, окруженные светлым ореолом, цвет участка среды под колонией черный.
На среде Плоскирева сальмонеллы растут в виде прозрачных или нежно-розовых колоний, на среде Левина — прозрачные, бледные, нежно-розовые или розовато-фиолетовые колонии.
В случае обнаружения колоний, подозрительных на сальмонеллы. 3- -5 из них засевают на комбинированную среду Ресселя или на двусахарный (лактоза, глюкоза) агар, а лучше на трехсахарный (лактоза, глюкоза, сахароза), «скошенный столбик» с мочевиной.
Высев колоний из чашек также делают на короткий пестрый ряд, включающий скошенный агар и среды Гнс-
3
са с лактозой, глюкозой и сахарозой, а также на бульон Хогтингера для определения индола и сероводорода (в этих целях под пробку пробирки с бульоном вкладывают специальные индикаторные бумажки). Для определения подвижности культуры производят посев уколом в полужидкий агар (0,3—0,5%).
На среду Ресселя и «скошенный столбик» посевы делают сначала штрихом на скошенной поверхности, а затем уколом в глубину столбика. При разложении лактозы косая поверхность окрашивается в синий цвет (при индикаторе ВР). При разложении одной глюкозы окрашивается только столбик среды и происходит разрыв агара со скоплением в нем пузырьков газа. При разложении мочеиииы в «скошенном столбике» окраска среды меняется на оранжевую при индикаторе ВР и на коричнево-фиолетовую при индикаторе тимоловый синий в сочетании с индикатором Андраде. Посевы выдерживают в термостате при температуре 37° С 16—18 ч.
Культуры, ферментирующие лактозу, глюкозу и сахарозу с образованием газа и расщепляющие мочевину, отбрасывают. Культуры, не ферментирующие лактозу и сахарозу и не расщепляющие мочевину, подлежат дальнейшему исследованию. Изучают морфологию культуры в мазке, окрашенном по Граму, и подвижность (в висячей или раздавленной капле или в полужидком агаре).
Культуры, представляющие грамотрицательные подвижные палочки, ферментирующие глюкозу с образованием газа, не ферментирующие лактозу и сахарозу, не разлагающие мочевину и не образующие индол, подвергаются серологическому исследованию — испытанию в реакции агглютинации на предметном стекле с набором агглютинирующих сывороток.
Для реакции агглютинации используют культуры, выращенные на среде Ресселя или на даусахарном или трехсахарном агарах. При этом для реакции агглютинации с О-сыворотками культуру следует брать из верхней части скошенного агара, а для агглютинации с Н-сыворотками — из самой нижней части (конденсационной воды), где микробы наиболее подвижны.
Исследование культуры начинают реакцией агглютинации с поливалентной адсорбированной О-сыворот-кой основных серологических групп А, В, С, D, Е.
На предметное стекло наносят каплю сыворотки и культуры, тщательно смешивают и в течение 2 мин. наблюдают склеивание (агглютинацию) частиц. Культуры, дающие положительную реакцию агглютинации с поливалентной сывороткой, также проверяют с монорецеп-торными агглютинирующими сыворотками. Сначала с помощью монорецепторных О-сывороток устанавливают принадлежность культур к той или иной серологической группе. Установив серологическую группу, к которой отнесена данная культура, последнюю проверяют монорецелторными Н-сыворотками сначала первой фазы, а потом второй, определяя таким образом серологический тип бактерий в соответствии со схемой Кауфмана-Уайта.
2.3. Метод «двойного центрифугирования»
2,3.1. Первый день исследования. К 100 г исследуемого корма, помещенного в стерильную колбу, добавляют 500 мл физиологического раствора, энергично взбалтывают в течение 5 мин и помещают в термостат при температуре 37°С. Через 6—8 ч колбу вынимают из термостата, встряхивают, затем содержимое отстаивают в течение 5—10 мин. Набирают 20—25 мл надосадочиой жидкости, вносят в 4 центрифужные пробирки и цент-трифугируют в течение 20 мин при 4000 оборотах в 1 мин.
Надосадочную жидкость из центрифужных пробирок удаляют и к осадку добавляют среды обогащения: Киллиана. Мюллера, жидкую среду Плоскирева (но не менее двух). После тщательного перемешивания пробирки помещают в термостат при температуре 37°С на 5—6 ч для подращивания микрофлоры осадка. После этого пробирки вновь центрифугируют при тех же режимах.
Из центрифужных пробирок производят посевы на плотные дифференциально-диагностические среды: висмут-сульфит агар и среду Плоскирева, для чего из каждой пробирки материал отбирают пастеровскими пипетками и вносят на 2—3 чашки по 1—-3 капли и равномерно распределяют его шпателем по всей поверхности среды. Засеянные чашки помещают в термостат.
К оставшемуся в центрифужных пробирках осадку добавляют ту же обогатительную среду, которая была удалена после центрифугирования, и продолжают ннку-
5
бацию до следующего дня. Колбы с кормом после отбора необходимого количества материала оставляют в термостате также до следующего дня.
2.3.2. Второй день исследования. Из верхнего слоя обогатительных сред центрифужных пробирок (без встряхивания) и колб после 18—24-часового выдерживания в термостате при 37еС производят посевы на плотные среды. Затем просматривают посевы, произведенные в первый день исследования. С выросшими на плотных средах колониями, подозрительными на сальмонеллы, проводят реакцию агглютинации на предметных стеклах с поливалентной сальмонеллсзной О-сывороткой. Культуры, давшие положительную реакцию агглютинации, проверяют с монорецспторными О-сывороткамн и устанавливают принадлежность культур к той или иной серологической группе.
Определение биохимических свойств культур проводят ускоренным методом, для чего применяют пастеровские пипетки, в которые насасывают каплю взвеси исследуемой культуры, а затем небольшое количество тех или иных углеводов. Результаты учитывают по ферментации углеводов после выдерживания пипеток в термостате при 37° С в течение 2—3 ч.
2.3.3. Третий день исследования. Производят просмотр чашек с твердыми средами, засеянными во второй день исследования, и проверяют биохимические и серологические свойства выделенных культур для определения серологического типа бактерий в соответствии со схемой Кауфмана-Уайта.
2.4. Люминесцентный метод обнаружения сальмонелл
2.4.1. Из средней пробы берут 100 г корма, разводят стерильным физиологическим раствором в соотношении 1:5 и выдерживают в термостате 6—8 ч при температуре 37° С. Из полученной смеси готовят 2 мазка на обезжиренных стеклах нанесением суспензии бактериологической петлей на площадь 1 смг, обозначенную восковым карандашом на обратной стороне. Мазки высушивают на воздухе при комнатной температуре или в термостате, фиксируют этиловым спиртом 15 мин и ополаскивают дистиллированной водой в течение 5—10 с.
2.4.2. На высушенные мазки, помещенные на мостик бактериологических чашек с влажным тампоном (для
предотвращения высыхания сыворотки), наносит 1—2 капли рабочего разпсдення люмннесцируюшей поливалентной сальмонеллезной сыворотки. При необходимости определения групповой принадлежности сальмонелл применяют групповые люминесцирующие сальмонеллез* ные сыворотки. Мазки выдерживают во влажной камере в течение 30 мин при комнатной температуре или 15 мин в термостате при 37*0. Затем мазки дважды по 10 мин промывают 0,15 М раствором хлористого натрия, ополаскивают дистиллированной водой и вновь высушивают.
2.4.3. Окрашенные мазки заключают в смесь, состоящую из 9 частей глицерина и 1 части 0,15 М раствора хлористого натрия, накрывают покровным стеклом, на которое наносят каплю не флюоресцирующего иммерсионного масла или диметилфталата, и просматривают под люминесцентным микроскопом.
2.4.4. За положительный результат обнаружения сальмонелл считается наличие клеток соответствующей морфологии, у которых отмечается сияющая или яркая флюоресценция зеленого цвета периферии клеток с четко контрастируемой зоной по центру.
В качестве контроля берут сальмонеллезную культуру. наносят ее на предметное стекло и к ней добавляют люминесцирующую сыворотку.
2.5. Исследования на энтеропатогенные типы кишечной палочки
2.5.1. 50 г корма помещают в колбу, содержащую 500 мл стерильного физиологического раствора, встряхивают на шуттель-аппарэте в течение 30 мин и из полученной взвеси стерильными пипетками готовят разведения 1 :100, 1:1000, 1:10000, 1 :100 000. 1 : 1 000 000. По 1 мл каждого разведения вносят в пробирки (по выбору) со средами: Эйкмана, Кесслера или Кода. Посевы помещают в термостат при температуре 43еС для первых двух сред и при 37* С для последней.
Через 24 ч учитывают рост — на среде Эйкмана по помутнению среды и образованию газа, на средах Кесслера и Кода по изменению цвета сред. Титр кишечной палочки устанавливают по наибольшему разведению, в котором еще наблюдался ее рост.
Из пробирок, где наблюдается рост микробов, производят посев на плотные дифференциально-диагности-
7
ческие среды: Эндо, Левина в бактериологических чашках, разделенных на секторы для каждого разведения.
Типичные колонии Е. coli характеризуются круглой формой, гладкой, выпуклой или слегка приподнятой в центре поверхностью, ровными краями, розового, красного или малинового цвета с металлическим блеском или без него на среде Эндо или черного цвета на среде Левина.
2.5.2. Выросшие изолированные колонии S-формы (не менее 4) пересевают на МПБ, выдерживают в термостате при температуре 37° С в течение 16—24 ч. После этого одну часть пробирок используют для приготовления мазков, посева на дифференциально-диагностические среды, заражения мышей; вторую — для приготовления автоклавированного антигена, еелн кипяченый антиген нс будет агглютинироваться поливалентными (комплексными) колисыворотками.
У выделенных культур определяют морфологические и культурально-биохимические свойства с целью проведения их родовой дифференциации, как указано в приложении I.
Морфологию бактерий изучают в мазках, окрашенных по Граму, подвижность определяют по характеру роста в 0,3%-ном полужидком МПА.
2.5.3. Для определения культурально-биохимических свойств бактерий используют набор питательных сред, куда входят среды с углеводами и индикатором Андраде (лактоза, глюкоза, сахароза, маннит, дульцит. адо-нит, инозит), среда Кларка, цитратно-аммонийная среда, МПЖ, среда с мочевиной. МПБ или бульон Хоттин-гера и агар с глюкозой и сернокислым железом.
2.5.4. Патогенные свойства кишечной палочки определяют путем постановки биологической пробы на белых мышах. С этой целью внутрибрюшинио заражают трех мышей весом 14—16 г смывом с суточных агаровых культур в дозе 500 млн. микробных тел. Концентрацию бактерий устанавливают по бактерийному стандарту. Культуру признают патогенной в случае гибели одной или более мышей в первые 4 суток после заражения.
2.5.5. Одновременно с определением морфологических, культурально-биохимических и патогенных свойств бактерий проводят серологическую типизацию культур ки-
8