Внутривидовое типирование дизентерийных бактерий Зонне по колициногенности и колициночувствительности
Купить бумажный документ с голограммой и синими печатями. подробнее
Цена на этот документ пока неизвестна. Нажмите кнопку "Купить" и сделайте заказ, и мы пришлем вам цену.
Распространяем нормативную документацию с 1999 года. Пробиваем чеки, платим налоги, принимаем к оплате все законные формы платежей без дополнительных процентов. Наши клиенты защищены Законом. ООО "ЦНТИ Нормоконтроль"
Наши цены ниже, чем в других местах, потому что мы работаем напрямую с поставщиками документов.
Способы доставки
- Срочная курьерская доставка (1-3 дня)
- Курьерская доставка (7 дней)
- Самовывоз из московского офиса
- Почта РФ
Метод основан на определении характера действия колицинов, продуцируемых исследуемыми штаммами бактерий Зонне, на 15 индикаторных культур, из которых 13 - шигеллы Зонне, I - Sh. Dysenteriae 2 (Штуцер-Шмитца) и I - вариант E. coli K-12 Row
Оглавление
Введение
Типирование шигелл Зонне по Абботу и Шеннону
1. Набор индикаторных и типовых штаммов и схема типирования
2. Среды, применяемые при типировании
3. Техника и ход исследования
4. Учет результатов
Колицинотипирование по Фредерику
Организация и материальное обеспечение работы
Условия хранения индикаторного набора Абботта и Шеннона
| Дата введения | 01.01.2021 |
|---|---|
| Добавлен в базу | 01.02.2017 |
| Актуализация | 01.01.2021 |
Этот документ находится в:
Организации:
Чтобы бесплатно скачать этот документ в формате PDF, поддержите наш сайт и нажмите кнопку:

стр. 1

стр. 2

стр. 3

стр. 4

стр. 5

стр. 6

стр. 7

стр. 8

стр. 9

стр. 10

стр. 11
стр. 12

стр. 13

стр. 14

стр. 15

стр. 16

стр. 17

стр. 18
МЕТОДИЧЕСКИЕ МАТЕРИАЛЫ
ВНУТРИВИДОВОЕ ТИПИРОВАНИЕ ДИЗЕНТЕРИЙНЫХ БАКТЕРИЙ ЗОННЕ ПО КОЛИЦИНОГЕННОСТИ И КОЛИЦИНОЧУВСТВИТЕЛЬНОСТИ
Для республиканских, областных и городских бактериологических лабораторий
Москва — 1971 г.
|
М3 СССР | |
|
Кандидат мед. наук |
Составители: Ю. П. Солодовников М. В. Турчинская Ю. В. Толмачева |
|
Кандидат мед. наук Кандидат мед. наук Кандидат мед. наук Кандидат мед. наук |
П. И. Емельянов М. А. Смирнова-Мутушева Б. А. Годованный С. Д. Татаринова |
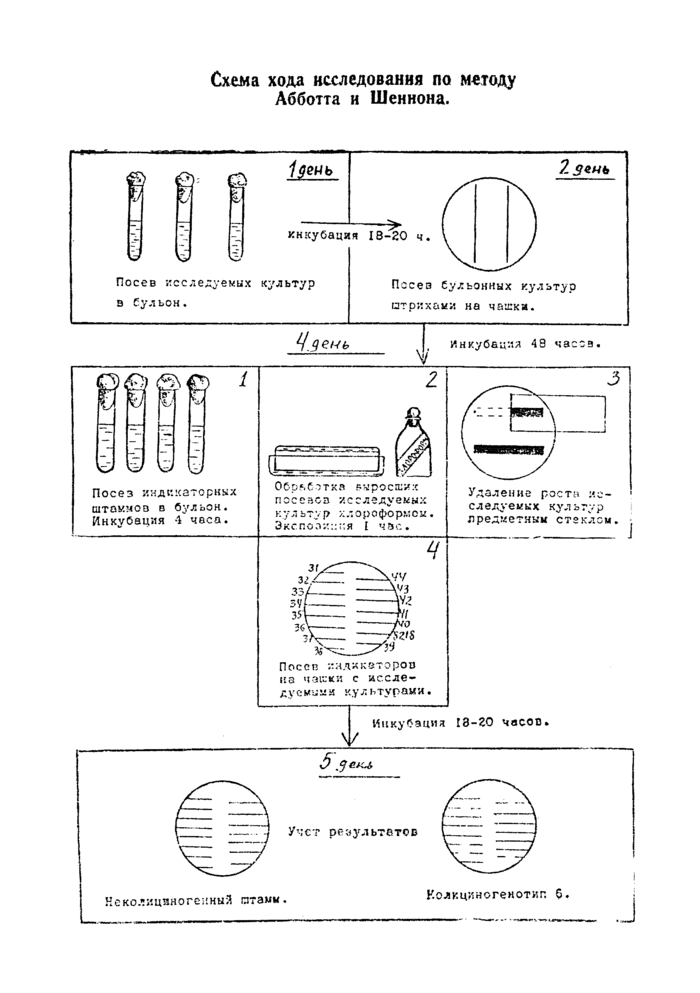
блюдают один и тот же порядок их размещения, что позволяет, при достаточном навыке, не производить нумерацию штаммов на чашке. При использовании всех 15 индикаторных культур, как показано на рисунке 2, на одной половине чашки сеют 8 штаммов (с 31 по 38), а па другой — остальные 7 штаммов (с 39 по 44). При применении 10 индикаторных штаммов сеют, соответственно, 6 и 4 культуры. Такое распределение также позволяет не нумеровать нанесенные штаммы.
После посева индикаторных штаммов чашки помещают в термостат еще на 18—20 часов при 37° С.
4. Учет результатов.
Если исследуемая культура является колициногенной, наблюдается торможение роста индикаторных штаммов, чувствительных к продуцируемым колицинам. При этом линия роста чувствительного штамма прерывается в том месте, где она пересекает зону диффузии колицина в питательную среду. Штаммы, устойчивые к определенному колицину, растут в виде сплошных непрерывных штрихов. Такими же штрихами растут все 15 индикаторных штаммов в том случае, когда исследуемая культура не продуцирует колицинов.
Штамм E.coliRow (№ 44) чувствителен к колицинам всех известных в настоящее время колицнногенотипов шигелл Зон-не, за исключением типа 7.
Величина зоны торможения роста зависит от концентрации и степени диффузии колицина в агар и выраженности чувствительности индикаторных штаммов.
Учет результатов производят по наличию или отсутствию зон торможения роста индикаторных .культур. Культура считается чувствительной, если зона торможения составляет более 4 мм. В некоторых случаях в зоне торможения роста чувствительного штамма наблюдается рост отдельных резистентных колоний или островков индикаторной культуры. При определении размеров зоны торможения эти колонии и островки не принимают во внимание, учитывают всю ширину зоны от одного ее края до другого.
Установленный спектр действия колицинов исследуемой культуры на индикаторные штаммы сопоставляют со схемой типировання (табл. 3 или 4) и определяют колициногенотип изученного штамма шигелл Зонне.
Схема хода исследования по методу Абботта и Шеннона.
В некоторых случаях установленный тип может не совпадать ни с одним из известных типов. Такие культуры обозначают как нетипируемые. Следует учитывать также возможность обнаружения новых колициногенотипов.
Регистрацию результатов типирования наиболее удобно производить по приведенной ниже форме (табл. 5).
Знаком « + » обозначают ннлнчне зоны торможения, знаком «—» обозначают отсутствие зоны торможения (сплошной рост индикаторного штамма).
|
Таблица 5 Форма рабочего журнала для регистрации результатов типирования шигелл Зонне по Абботту и Шеннону (пример регистрации) | ||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||
|
1545 — - — — — — + — - — + 2 | ||||||||||||||||||||||||||||||||||
КОЛИЦИНОТИПИРОВАНИЕ ПО ФРЕДЕРИКУ
Определение спектра чувствительности культур Зонне к колицинам целесообразно проводить при помощи следующих 11 эталонных (колициногенных) штаммов Фредерика1 2:
Е.соП СА — 18 продуцирует колицин В;
Е. соП СА —23 продуцирует колицин Д
Е.соП СА —38 продуцирует колицин Е 4* 1
Е.соП СА — 42 продуцирует колицин F
Е.соП СА — 53 продуцирует колицин I Е.соП К — 235 продуцирует колицин К
Е.соП СА — G2 продуцирует колицин J + I
Е.соП СА — 7 продуцирует колицин V Sh. boydii Р — 1 продуцирует колицин Si
Sfi. sonnei P — 9 продуцирует полиции S3-fI В. dispar P—>14 продуцирует полиции Ss
Перечисленные колицины дают четкие зоны угнетения роста бактерии Зонне и позволяют подразделять их на определенные колншшотипы.
Накануне опыта в чашки Петри разливают по 20—25 мл 1,5%. мясопептониого агара, подкрашенного ген циан виол етом до слегка синего цвета (2—4 капли 0,1% водного раствора на 100 мл среды). Слабые растворы генцианвиолета угнетают рост воздушной микрофлоры и способствуют повышению колицииопродукции эталонных штаммов.
Чашки со средой подсушивают в термостате. Затем дно чашек делят восковым карандашом (чернилами) на 11 квадратов (по числу эталонных культур). Квадраты обозначают номерами: 1, 2, 3, 4 и т. д. При известном навыке, если ко-лицнногенные штаммы постоянно употреблять в одном и том же порядке, можно вообше ограничиться обозначением только начала посева культур. Описанным способом для каждого штамма шигелл, который подлежит испытанию на чувствительность к колицииам, готовят две чашки со средой, т. е. число чашек со средой должно быть в два раза больше, чем число штаммов исследуемых шигелл Зонне.
Эталонные колишшогеиные штаммы суточной давности, выросшие на среде Ресселя, наносят уколом петли в соответствующий квадрат чашки. После посева каждой эталонной культуры петлю прожигают на пламени горелки.
В целях экономии времени целесообразно, без ущерба для результатов опыта, производить последовательный посев соответствующего эталонного штамма одновременно на 5— 7 чашек, размещенных в ряд, при однократном заборе материала со среды Ресселя.
Чашки, засеянные колнцнногеиными культурами, помещают в термостат на 22—24 часа при 37° С, после чего выросшие колонии бактерий стерилизуют парами хлороформа. С этой целью чашки помещают на столе вверх дном и на внутреннюю поверхность крышки наносят 8—12 капель хлороформа. Через 40—50 минут бактерии погибают, а хлороформ улетучивается из чашек.
Затем в пробирку с 2,5 мм расплавленного полужидкого 0,7 %\ агара, охлажденного до 46—48D (пробирка не должна обжигать тыльную сторону кисти .руки), вносят 2 капли 6-ти часовой бульонной культуры исследуемого штамма и после встряхивания смесь наслаивают равномерным слоем в чашку поверх агара с колониями нанесенных ранее колициноген-ных культур. Каждый штамм испытывают на двух чашках.
На крышке записывают номер исследуемого штамма. После 1G—20 часового роста при 37° вокруг колоний, к колицинам которых исследуемый штамм бактерий Зонне чувствителен, образуются зоны задержки роста,— подобно зонам задержки роста вокруг диска с антибиотиками. Культура считается чувствительной к колицину, если ширина зоны задержки роста бактерий составляет более 2 мм. Величину зоны подавления роста измеряют от края м а проколок и к эталонного коли-'циногенного штамма до наружного края зоны и оценивают в плюсах: ширина зоны до 2 мм + , 2—5 мм ++, 5—10 мм + + + и более 10 мм + + + + . Такое обозначение позволяет сравнивать степень чувствительности культур к колицинам. Однако необходимо иметь в виду, что ширина зоны угнетения роста бактерий зависит также от характера питательной среды, концентрации агара: чем плотнее среда, тем медленнее идет процесс диффузии колицнпа в агар вокруг колоний и тем уже зона торможения роста бактерий чувствительного штамма.
Необходимо подчеркнуть, что наслоение чрезмерно густой взвеси бактерий может исказить результаты исследования. В чашке должен быть равномерный, но не чрезмерно густой рост испытуемого штамма.
Результаты типнровання культур записывают в виде характеристики спектра их чувствительности к соответствующим колицинам. Например, штамм Sh. sonnei N2 1210 коли-цинотип: В, Д, F, К, V, S3 + 1; если на обеих чашках спектр чувствительности штамма однотипен, опыт можно считать законченным. При расхождении результатов чувствительности в чашках при изучении одного и того же штамма, исследование повторяют.
Необходимо также учитывать, что наиболее четкие и достоверные результаты колицинотипирования получаются при исследовании свежевыделенных культур и особенно при одновременном испытании культур, полученных из одного очага, т. к. при этом соблюдаются равные условия для всех испытываемых штаммов.
ОРГАНИЗАЦИЯ И МАТЕРИАЛЬНОЕ ОБЕСПЕЧЕНИЕ
РАБОТЫ
Целесообразно, чтобы постоянное выполнение работы было поручено определенным лицам (врачу и лаборанту), поскольку такая организация исследований способствует повышению их качества и обеспечивает определенную стандартизацию учета результатов исследования, снижая вероятность технических ошибок.
1*1
При проведении коЛициногенотнпирования и коЛициноТй-пнровання не требуется специального сложного оборудования.
Помимо термостата, который является обязательным для любых бактериологических исследований, лаборатория, в которой производится колициногенотипироваине, должна иметь холодильник с обычным режимом работы и свертыватель для приготовления среды Дорсэ (см. ниже).
В зависимости от расписания работы лаборатории (пятнили шестидневная рабочая неделя) постановку опытов можно производить один или два раза в неделю в соответствии го схемой типировання, приведенной выше.
Сокращение срока исследования может быть произведено за счет уменьшения времени инкубации бульонных культур исследуемых штаммов с 18—20 до 4—5 часов (посев утром в начале рабочего дня в бульон с последующим штриховым посевом культур на чашки к концу дня). Могут быть использованы также бульонные культуры, входящие в состав «пестрого» ряда при идентификации выделенных штаммов.
Ниже приведен примерный расчет материалов, необходимых для типировання шигелл Зонне (100 штаммов):
Количество материалов, необходимое для колицнногенотипирования 100 штаммов шигелл Зонне
Наименование Количество
1. Сухой питательный агар Д 100 г
2. Сухой питательный агар 120 г
3. Гидролизат Хоттингера для приготовления
питательного бульона 100 г
4. Хлороформ 100 мл
Условия хранения индикаторного набора Абботта и Шеннона
Индикаторные культуры следует хранить на плотной яичной среде Дорсэ или на столбиках 0,5% питательного агара на гидролизате Хоттингера с содержанием аминного азота 130—150 мг% под слоем стерильного вазелинового масла.
Среду Дорсэ готовят по следующей прописи:
3 части — цельные куриные яйца и 1 часть физиологического раствора поваренной соли смешивают до гомогенного состояния в стерильной посуде с бусами, разливают по 3—4 мл в стерильные пробирки с ватными пробками и стерилизуют в свертывателе в скошенном положении при 85° два дня
14
«УТВЕРЖДАЮ»
Заместитель начальника Главного санитарно-эпидемиологического Управления М3 СССР
В. ПОПОВ 10 марта 1971 г.
МЕТОДИЧЕСКИЕ МАТЕРИАЛЫ Внутривидовое типирование дизентерийных бактерий Зонне по колициногенности и колициночувствительности
ВВЕДЕНИЕ
В этнологической структуре бактериальной дизентерии на большей части территории Советского Союза преобладают в настоящее время заболевания, вызываемые шнгеллами Зонне. В связи с отсутствием методов серологического типи-ровання данных возбудителей весьма актуальным является внедрение других методов внутривидового подразделения дизентерийных бактерий Зонне.
Возможность дифференциации возбудителя на достаточное число четко характеризующихся стабильных типов, установление типового состава шигелл Зонне в масштабах страны или на отдельных территориях могут способствовать изучению закономерностей эпидемического процесса дизентерии, углубленному проведению эпидемиологического анализа заболеваемости, уточнению данных эпидемиологического обследования очагов инфекции с целью разработки эффективных противоэпидемических мероприятий.
Согласно литературным данным (Фредерик, 1953, 1960; Аббот и Шеннон, 1958; Папависсилиу с соавт., 1964; Д. Г. Куд-лай с соавт., 1964; Д. Г. Кудлай и В. Г. Лиходед, 1966 и др.), а также результатам собственных исследований составителей настоящих методических материалов, для тнпнрования патогенных энтеробактерий, в том числе шигелл Зонне, могут быть использованы методы, основанные на феномене коли-циногении.
Явление колнциногении было впервые обнаружено Грациа в 1925 г. Колниины — это вещества белковой природы, про*
1 Разработаны Центральным научно-исследовательским институтом эпидемиологии Л\ииистерстса здравоохранения СССР.
1
дуцируемые некоторыми видами бактерий семейства кишечных и тормозящие рост чувствительных к ним культур того же или филогенетически родственного вида бактерий. Колицнны различаются между собой как по спектру действия на чувствительные бактерии, так и по ряду физико-химических свойств. В настоящее время известно 24 типа колнцинов. обозначаемых буквами латинского алфавита А; В1; В2; С; Д; El; Е2; ЕЗ; Е4; G; Н; I; К; L; М; N; О; Р; X; VI; V2; V3; V4; V5.
Способность продуцировать колицнны («колнцнноген-иость») и тип продуцируемого колнцина являются стойкими наследственными признаками, которые определяются присутствием в бактериальных клетках особых генетических элементов, т. н. колициногенных факторов.
Чувствительность к колнцинам («колнцнночувствитель-ность») связана с наличием на поверхности бактерии рецепторов, на которых происходит адсорбция колнцинов. Это свойство высоко специфично, поскольку различные колицнны или группы колнцинов фиксируются на строго определенных рецепторах.
Бактериальная клетка, как правило, бывает резистентна (иммунна) к действию колицина того типа, который она сама вырабатывает.
Способностью к колицинопродукции обладают не все бактерии семейства кишечных: не все культуры являются также колициночувствительнымн. В связи с этим внутривидовое тн-пированне бактерий на основе феномена колициногенни целесообразно только для тех видов, у которых эти свойства выражены в достаточной степени. К таким видам относятся кишечные палочки, шнгеллы Зонне, Флекснера, Ньюкасл, Бойда •и др.
Колициногенность отмечается у 60—95% выделяемых штаммов шигелл Зонне; чувствительны к колнцинам— 90— 95% этих бактерий.
Подразделение бактерий на основе их колициногенных свойств обозначается как «колнциногенотипирование», дифференциация бактерий по чувствительности к определенным колнцинам носит название «колнцинотипирования».
В процессе роста колицнногенного штамма колицин диффундирует в окружающую питательную среду. Присутствие колнцина в среде может быть выявлено с помощью так называемых универсальных индикаторных штаммов, чувствительных ко всем или подавляющему большинству известных колнцинов. Наиболее часто с этой целью употребляют индикаторные штаммы Е. coli <? , В или К-12.
Типирование бактерий по колицинопродукции производят с помощью специально подобранных индикаторных культур, 2
заведомо устойчивых или чувствительных к определенным кд-лицинам.
Колициночувствительность определяют по отношению исследуемых культур к действию колициногенных штаммов, продуцирующих колицнны известных типов. Чаще всего при этом употребляют эталонные колициногенные культуры из коллекции проф. Фредерика.
В настоящих материалах приведены два метода типиро-вания шигелл Зонне на основе феномена колициногении:
1) модифицированный метод Абботта и Шеннона;
2) типирование по чувствительности к колицннам (по методу проф. Фредерика).
ТИПИРОВАНИЕ ШИГЕЛЛ ЗОННЕ ПО АББОТТУ н ШЕННОНУ
1. Набор индикаторных н типовых штаммов и схема типирования
Метод основан на определении характера действия колн-цннов, продуцируемых исследуемыми штаммами бактерий Зонне, на 15 индикаторных культур, из которых 13 — шигеллы Зонне, I — Sh. dysenteriae2 (Штуцер-Шмитца) и I — вариант Е. coli К-12 Row.
С помощью этих индикаторных культур в настоящее время удалось установить 17 колициногенотипов бактерий Зонне. Типы являются стабильными и редко меняются при хранении культур в лабораторных условиях. Штаммы, выделенные в эпидемических очагах дизентерии и происходящие от одного и того же источника инфекции, относятся, как правило, к одному колнциногенотипу. При выделении в одном очаге культур разных колициногенотипов можно предполагать наличие нескольких источников инфекции.
Помимо индикаторных культур, в набор входят 15 типовых колициногенных штаммов шигелл Зонне, каждый из которых принадлежит к определенному колнциногенотипу. Эти штаммы используются для контроля стабильности свойств индикаторных культур.
Перечень индикаторных и типовых штаммов, а также схема типирования шигелл Зонне по методу Абботта и Шеннона представлены, соответственно, в таблицах, 1, 2 и 3.
3
|
ИНДИКАТОРНЫЕ ШТАММЫ | ||||||||||||||||
|
|
Sh. sonnei |
2 |
100031 |
|
Sh. sonnei |
56 |
100032 |
|
Sh. sonnei |
17 |
100033 |
|
Sh. sonnei |
2M |
100034 |
|
Sh. sonnei |
38 |
100035 |
|
Sh. sonnei |
56/56 |
100036 |
|
Sh. sonnei |
56/98 |
100037 |
|
Sh. sonnei |
Rl |
100038 |
|
ТИПОВЫЕ КОЛИЦИНОГЕННЫЕ ШТАММЫ ДЛЯ ПЕРИОДИЧЕСКОГО КОНТРОЛЯ РАБОТЫ ИНДИКАТОРНЫХ КУЛЬТУР | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Регистрационные номера индикаторных штаммов указаны в соответствии с перечнем международного справочного центра по шигеллам в Лондоне, откуда получен данный набор. В повседневной работе удобно обозначать индикаторные штаммы последними цифрами соответствующих регистрационных номеров (31, 32, 33 и т. д.). Типовые колнциногениые штаммы обозначают номерами соответствующих типов.
| |||||||||||||||||||||
|
Таблица 2 | |||||||||||||||||||||
4
Схема колициногенотипирования шигелл Зонне по методу Абботта и Шеннона
|
Индикаторные |
культуры | ||||||||||||||
|
2 (И |
31 |
32 |
3 |
34 |
35 |
36 |
37 |
38 |
39 |
8218 |
40 |
41 |
42 |
43 |
44 |
|
1А |
4- |
4- |
4- |
_ |
_ |
4- |
4- |
_ |
_ |
4- |
_ |
_ |
_ |
— |
4- |
|
IB |
-f. |
+ |
4- |
— |
— |
4- |
+ |
— |
4- |
4- |
— |
— |
— |
— |
4- |
|
2 |
— |
+ |
+ |
— |
— |
— |
— |
— |
4- |
— |
— |
— |
— |
— |
4- |
|
3 |
4- |
4- |
4- |
— |
4- |
4- |
4- |
4" |
4- |
4- |
4- |
4 |
+ |
4- |
4- |
|
ЗА |
4- |
+ |
4- |
— |
4- |
+ |
4- |
4* |
4- |
— |
4- |
4 |
4- |
4- |
4- |
|
4 |
4- |
4- |
4- |
V |
4- |
— |
— |
+ |
4- |
— |
4- |
+ |
4- |
— |
4* |
|
• |
4- |
+ |
4- |
V |
4- |
+ |
4- |
4- |
4- |
4- |
4- |
4- |
4“ |
— |
4- |
|
6 |
— |
4- |
— |
— |
— |
4- |
4- |
— |
4 |
— |
— |
4- | |||
|
7 |
4- | ||||||||||||||
|
8 |
-ь |
— |
+ |
— |
4- |
— |
— |
4- |
— |
— |
— |
- |
4- |
— |
4- |
|
9 |
4- |
4- |
4- |
— |
V |
4- |
+ |
4- |
4- |
— |
— |
— |
4- |
— |
4- |
|
10 |
4- |
-1- |
+ |
— |
л. |
+ |
4" |
4- |
4- |
+ |
— |
— |
4- |
— |
4“ |
|
11 |
4- | ||||||||||||||
|
12 |
4- |
4- |
— |
— |
4- |
4- |
4- |
4- |
4- |
— |
— |
— |
4- |
— |
4- |
|
13 |
— |
4- |
4* |
— |
— |
4- |
4- |
— |
4- |
— |
— |
— |
— |
— |
4- |
|
14 |
4- |
4- |
4- |
4- |
+ |
4- |
4- |
4- |
4- |
— |
4- |
4- |
4- |
— |
4- |
|
15 4- — 4-Обозначения: |
+ |
4- |
4- |
4- |
4 |
4- |
4- |
4- | |||||||
4- наличие зоны торможения роста индикаторных штаммов;
— отсутствие зоны торможения;
V вариабельные результаты.
Как видно из приведенной схемы, некоторые индикаторные штаммы обладают идентичной чувствительностью к ко-лицннам эталонных культур (,N?№ 36 и 37; 35, 38 и 42; 40 и 41).
В связи с этим в практических условиях можно ограничиться использованием 10 индикаторных культур (№Я° 31, 32, 33, 37, 39, 8218, 41, 42, 43, 44). Сокращенная схема колициногенотипирования шигелл Зонне представлена в таблице 4.
5
|
Таблица 4 Сокращенная схема колициногенотипирования шигелл Зонне | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
2. Среды, применяемые при типированни |
Состав и плотность питательных сред оказывают существенное влияние на продукцию колицннов бактериями, а также на скорость и степень диффузии колицинов в агаре.
Наилучшие результаты типирования получаются при применении сухого питательного агара «Д» производства Дагестанского института питательных сред. Можно использовать также 1,5% питательный агар на гидролизате Хоттингера с конечным содержанием аминного азота в среде 130—150 мг% и pH = 7,4.
Для усиления колицинопродукшш исследуемых культур и подавления роста воздушной флоры к питательному агару добавляют раствор генцианвиолета (2—4 капли 0,1% водного раствора на 100 мл среды).
6
Среды заготавливают во флаконах небольшими партиями из расчета использования их максимум в течение 2-х недель. Флаконы должны быть плотно закупорены для предохранения агара от высыхания и, следовательно, изменения его плотности.
Накануне постановки опыта среду во флаконе растапливают на водяной бане и разливают в чашки Петри по 20 мл. В день опыта чашки помещают в термостат и оставляют их там слегка приоткрытыми на 30 минут для испарения конденсационной жидкости.
3. Техника и ход исследования
Исследование производят методом перекрестных посевов. Изучаемые культуры, предварительно выращенные в течение суток в пробирках с бульоном, сеют с помощью бактериологической петли двумя линейными штрихами параллельно диаметру чашки по обе стороны от него. Расстояние между штрихами — 3—4 см (рис. 1)
|
Рис. /. Посев исследуемой культуры. |
7
Посевы инкубируют в термостате при 36—37° в течение 48*ми часов. За этот срок в питательной среде накапливаются колицины в концентрации, достаточной для выявления их действия на индикаторные штаммы. По окончании инкубации выросшие культуры убивают парами хлороформа, для чего в крышку опрокинутой дном вверх чашки Петри с выросшей исследуемой культурой наливают около 0,5 мл хлороформа и, закрыв чашку, оставляют ее на столе на 40—60 минут.
Убитую культуру удаляют (соскребают) узким краем чистого шлифованного предметного стекла, стараясь при этом не повредить поверхности агара.
Затем на агар наносят 4-х часовые бульонные культуры индикаторных штаммов в виде линейных штрихов, пересекающих линии посева исследуемых культур в перпендикулярном к ним направлении (рис. 2).
|
Рис. 2. Посевы индикаторных штаммов. Видны зоны торможения роста некоторых культур. |
Посевы индикаторных штаммов располагают на равном расстоянии друг от друга таким образом, чтобы линии, находящиеся на одной половине чашки, приходились против промежутков между линиями на другой половине чашки и не сливались. При посеве индикаторных культур постоянно со-
1
При получении коллекции колициногенных эталонных культур нх отвивают в столбики 1,5% мясо-пептонного агара и хранят под вазелиновым маслом в рефрижераторе. Одновременно субкультуры испытывают на способность к продукции колнцинов по их действию на универсальные индикаторные штаммы Е. toli <?,К-12и В и определяют нх культуральные и биохимические свойства с тем, чтобы при случайном загрязнении можно было установить истинную принадлежность штаммов. Один раз в квартал желательно проверять рабочие эталонные штаммы и убеждаться в том, что они по своим свойствам соответствуют исходным культурам.
2