МУ 3.1.1029-01
Отлов, учет и прогноз численности мелких млекопитающих и птиц в природных очагах инфекций
Купить МУ 3.1.1029-01 — бумажный документ с голограммой и синими печатями. подробнее
Распространяем нормативную документацию с 1999 года. Пробиваем чеки, платим налоги, принимаем к оплате все законные формы платежей без дополнительных процентов. Наши клиенты защищены Законом. ООО "ЦНТИ Нормоконтроль"
Наши цены ниже, чем в других местах, потому что мы работаем напрямую с поставщиками документов.
Способы доставки
- Срочная курьерская доставка (1-3 дня)
- Курьерская доставка (7 дней)
- Самовывоз из московского офиса
- Почта РФ
Методические указания по отлову, учету и прогнозу численности мелких млекопитающих и птиц в природных очагах инфекций разработаны в помощь специалистам санитарно-эпидемиологических учреждений для оптимизации эпиднадзора в природных очагах зоонозных болезней в Российской Федерации. Методические указания обязательны для выполнения на всей территории Российской Федерации учреждениями санитарно-эпидемиологической службы и здравоохранения
Оглавление
1. Область применения
2. Нормативные ссылки
3. Обоснование
4. Роль мелких млекопитающих и птиц в носительстве возбудителей опасных болезней человека
5. Общие принципы организации зоологической работы в природных очагах зоонозных инфекций
6. Основные приемы и средства сбора полевого материала
6.1. Добыча теплокровных носителей
6.2. Сбор погадок хищных птиц
6.3. Сбор материала для вирусологических исследований (млекопитающие, птицы)
6.3.1. Общие положения
6.3.2. Взятие материала от мелких млекопитающих
6.3.3. Взятие материала от птиц
7. Рекогносцировочное обследование территории
8. Основные методы учета численности носителей в природных очагах
8.1. Общие положения
8.2. Учет численности носителей в природных биотопах
8.2.1. Мелкие млекопитающие
8.2.2. Серая крыса (экзоантропная форма)
8.2.3. Водяная полевка
8.2.4. Малые песчанки
8.2.5. Суслики
8.2.6. Сурки
8.2.7. Тушканчики
8.2.8. Пищухи
8.2.9. Хищные млекопитающие
8.2.10. Птицы
8.3. Учет численности мелких млекопитающих в скирдах, стогах, ометах и прессованном сене
8.4. Учет численности грызунов в населенных пунктах
8.4.1. Общие положения
8.4.2. Учет численности мелких грызунов
8.4.3. Учет численности крыс
9. Общие принципы организации работы на стационарных участках
10. Общие принципы картографирования поселений носителей
11. Составление прогноза изменений численности носителей
11.1. Общие положения
11.2. Критерии прогноза численности отдельных видов грызунов и зайцеобразных
11.2.1. Мелкие грызуны
11.2.2. Водяная полевка
11.2.3. Малые песчанки
11.2.4. Суслики
11.2.5. Пищухи (даурская, монгольская)
12. Схема составления обзора численности носителей
Приложение 1 (справочное). Участие на территории Российской Федерации отдельных видов грызунов и зайцеобразных в носительстве возбудителей ряда природно-очаговых инфекций, опасных для человека (по М.В. Шеханову, 1979 с изменениями)
Приложение 2 (справочное). Методы учета численности грызунов (по Е.В. Карасевой, А.Ю. Телицыной, 1996 с некоторыми изменениями)
Приложение 3 (рекомендуемое). Формы учета зоологической работы
| Дата введения | 06.04.2001 |
|---|---|
| Добавлен в базу | 01.01.2019 |
| Актуализация | 01.01.2021 |
Этот документ находится в:
- Раздел Экология
- Раздел 11 ЗДРАВООХРАНЕНИЕ
- Раздел 11.220 Ветеринария
- Раздел 11 ЗДРАВООХРАНЕНИЕ
Организации:
- Федеральный закон 52-ФЗ О санитарно-эпидемиологическом благополучии населения
- Р 1.1.001-96 Общие требования к организации разработки нормативных и методических документов системы государственного санитарно-эпидемиологического нормирования
- Р 1.1.002-96 Классификация нормативных и методических документов системы государственного санитарно-эпидемиологического нормирования
- Р 1.1.003-96 Общие требования к построению, изложению и оформлению нормативных и методических документов системы государственного санитарно-эпидемиологического нормирования
- Р 1.1.004-96 Порядок проведения научной экспертизы нормативных и методических документов
- Р 1.1.005-96 Порядок утверждения, регистрации, издания и распространения нормативных и методических документов системы государственного санитарно-эпидемиологического нормирования
- СП 1.3.1285-03 Безопасность работы с микроорганизмами I - II групп патогенности (опасности)
- МУ 3.1.700-98 Временные методические указания по организации и проведению эпидемиологического надзора в природных очагах чумы России в условиях ограниченных финансовых и материально-технических ресурсов
- Показать все
Чтобы бесплатно скачать этот документ в формате PDF, поддержите наш сайт и нажмите кнопку:

стр. 1

стр. 2

стр. 3

стр. 4

стр. 5

стр. 6

стр. 7

стр. 8

стр. 9

стр. 10

стр. 11

стр. 12

стр. 13

стр. 14
стр. 15

стр. 16

стр. 17

стр. 18

стр. 19

стр. 20

стр. 21
стр. 22
стр. 23

стр. 24

стр. 25

стр. 26

стр. 27

стр. 28

стр. 29

стр. 30
3.1. ЭПИДЕМИОЛОГИЯ. ПРОФИЛАКТИКА ИНФЕКЦИОННЫХ БОЛЕЗНЕЙ
Отлов, учет и прогноз численности мелких млекопитающих и птиц в природных очагах инфекций
Методические указания МУ 3.1.1029—01
ББК51.9
080
080 Отлов, учет и прогноз численности мелких млекопитающих и птиц в природных очагах инфекций: Методические указания.— М.: Федеральный центр госсанэпиднадзора Минздрава России, 2002.—72 с.
1. Методические указания разработали: Российский научно-исследовательский противочумный институт “Микроб” (Корнеев Г. А., Тарасов М. А., Кузнецов А. А, Матросов АН., Попов Н. В., СлудскийА. А., Ермаков Н. М., Князева Т. В., УдовиковА. И., Ефимов С. В., Шилов М. М., Шилова Л. Д, Попова Э. 3., Чекашов В. Н, Яковлев С. А.)., Противочумный центр М3 РФ (Новиков Н. Л., Степнов А П, СамуровМ. А.)., Иркутский научно-исследовательский противочумный институт Сибири и Дальнего Востока (ПопковА. Ф., Очиров Ю. Д.)., Ставропольский научно-исследовательский противочумный институт (ДягловА. И., ЧумаковаИ. В., ЕригорьевМ. П.)., Научно-исследовательский институт эпидемиологии и микробиологии им. Н. Ф. Еамалеи РАМН (Дубровский Ю. А.)., Астраханская противочумная станция М3 РФ (Козлова Т. А.).
2. Одобрены Межведомственным научным советом по санитарно-эпидемиологической охране территории Российской Федерации 7 октября 1999 г.
3. Утверждены и введены в действие Влавным государственным санитарным врачом Российской Федерации, Первым заместителем Министра здравоохранения, 6 апреля 2001г.
4. Введены впервые.
ББК51.9
© Минздрав России, 2002 © Федеральный центр госсанэпиднадзора Минздрава России, 2002
МУ 3.1.1029—01
стояниях между первыми. Края цилиндра должны вплотную соприкасаться с вертикальными стенками канавки, а верхний его обрез должен быть примерно на 1 см ниже дна канавки.
Вместо канавок можно устраивать заборчики такой же длины из полос фанеры, плотного картона, рубероида и даже полиэтиленовой пленки высотой 25—30 см, которые вставляют в бороздку глубиной 2—3 см и закрепляют колышками в вертикальном положении. Цилиндры (конуса) вкапывают в том же порядке, что и в канавки, или крайние располагают в 5 м от концов заборчика, а остальные - через 10 м друг от друга. Края заборчика должны заходить на 0,5—1 см внутрь цилиндра.
Канавки и заборчики обходят утром и собирают из цилиндров пойманных зверьков. При использовании этого метода для определения численности носителей единицей учета служит число особей, попавших в среднем в один цилиндр за 10 дней работы канавки или заборчика.
Во всех случаях добытых млекопитающих, если они не подлежат доставке в лабораторию в живом виде, умерщвляют корнцангами и помещают в индивидуальные бязевые мешочки, которые завязывают с двойным подворотом верхнего края (во избежание ухода эктопаразитов). Материал снабжают сопроводительной этикеткой, в которой указывают: вид материала, адрес сбора, биотоп (стацию), дату обследования, общее количество отловленных животных, в т. ч. по видам.
Если зверьки транспортируются в лабораторию живыми, то их содержат в металлических отсадниках или деревянных ящиках, обитых изнутри оцинкованным железом. Перед отправкой животных дустируют.
Во все периоды полевой работы необходимо проводить поиск и сбор трупов носителей (в основном грызунов). Для этого осматривают входы и провалы нор, углубления почвы, где вероятнее всего можно обнаружить погибшую особь. Труп зверька помещают в мешочек и снабжают этикеткой.
В весенне-летний период на участках обследования следует брать под наблюдение гнезда хищных птиц и организовывать сбор из них остатков теплокровных животных.
Птиц для исследований добывают отстрелом (что не всегда оправдано), ловчими сетями, используемыми при кольцевании, а также другими разнообразными способами, исходя из биологических и экологических особенностей интересующих видов. Объектами лабораторных анализов могут служить и подросшие птенцы перед вылетом из гнезда (“слетки”).
6.2. Сбор погадок хищных птиц
Погадки хищных птиц могут служить ценным материалом для серологических и молекулярно-биологического исследований по обнару-
11
МУ 3.1.1029—01
жению не только текущих эпизоотий, но и в целях ретроспективной оценки состояния как очаговых, так и потенциально очаговых территорий. В частности, исследование погадок, собранных в одних и тех же местах через определенные промежутки времени и в разные сезоны, позволяет в известной степени характеризовать различия в течении эпизоотий в разные годы и сезонные особенности их развития.
Исследованию погадок хищных птиц, как правило, должно предшествовать определение их видовой принадлежности, а также анализ содержимого по костным фрагментам. Это дает возможность выяснить, где и какие виды животных, остатки которых содержатся в погадках, перенесли то или иное заболевание.
Наиболее массовые сборы погадок осуществляют рядом с гнездами хищных птиц. Эффективен также сбор погадок в открытых ландшафтах у различных возвышающихся над местностью объектов - триангуляционных вышек и отдельных деревьев, на которые любят присаживаться разные виды канюков и орлов; у могил и развалин (филин, домовый сыч, болотная сова, степной орел и др.); по берегам дамб, ирригационных и других насыпей, где птицы отдыхают (орлы, канюки, луни, совы); в зарослях кустарников по балкам (филин, ушастая сова и др.); в нишах обрывов и чинков (филин, домовый сыч) и т. д.
В любых ландшафтах перспективен сбор погадок у телеграфных столбов и опор линий электропередач, особенно в тех случаях, когда эти линии проходят через безлесные пространства. При этом сборы свежих погадок под столбами бывают наиболее результативными осенью, во время пролета хищных птиц, особенно в годы с высокой численностью грызунов.
Кроме погадок птиц для лабораторных исследований используют также экскременты хищных млекопитающих, в отдельных случаях и экскременты фоновых видов носителей (грызунов, зайцеобразных), а также пробы субстрата из их нор (в первую очередь из гнездовых и кормовых камер).
6.3. Сбор материала для вирусологических исследований (млекопитающие, птицы)
6.3.1. Общие положения
В качестве источников выделения арбовирусов известны представители всех четырех классов наземных позвоночных - амфибий, рептилий, птиц и млекопитающих. Из них наиболее важную роль в носитель-стве вирусов и в прокормлении членистоногих переносчиков в природных очагах арбовирусных инфекций играют птицы и млекопитающие.
При определении роли позвоночных животных в циркуляции арбовирусов основное применение нашли серологические и вирусологиче-
12
МУ 3.1.1029—01
ские методы. Соответственно, в первом случае собирают сыворотки крови, во втором - сгустки крови, пробу головного мозга и кусочки печени, сердца, почки, селезенки, в которых отмечается высокая концентрация попавшего в организм арбовируса. В случае исследования материала на миксовирусы берут также кусочки легкого и трахеи в области бифуркации (место разделения трахеи на бронхи).
Особенности добычи и подготовки позвоночных для исследований на арбовирусы заключаются прелюде всего в том, что материал должен быть взят или прижизненно (взятие крови для серологических исследований), или тотчас после умерщвления особи (пробы внутренних органов) с максимальным соблюдением правил, обеспечивающих стерильность взятых проб. Поэтому наиболее распространенный способ добычи мелких млекопитающих - отлов плашками Геро - следует заменить отловом живоловками или канавками (заборчиками), а если это исключено, плашки необходимо проверять каждые 1—2 ч.
Отстрелом животных для получения вирусологического материала пользуются лишь в крайних случаях, при невозможности применения других методов. В этом плане уместно рекомендовать иммобилизацию (обез-дв иже ванне) особей с помощью мышечных релаксантов. Для обездвижева-ния млекопитающих средних и крупных размеров надежные результаты дает метод активной дистанционной иммобилизации, при которой в качестве действующего вещества весьма эффективен дитилин. Отлов некоторых видов стайных птиц (сизых голубей, грачей и др.) можно проводить с использованием оральных иммобилизирующих веществ, в частности эта-минал-натрия совместно с тазепамом, в смеси с приманкой1.
6.3.2. Взятие материала от мелких млекопитающих
Мелкие млекопитающие (преимущественно грызуны) часто бывают основным объектом исследований при эпизоотологическом мониторинге за природными очагами многих зоонозных инфекций, в т. ч.е и вирусной этиологии. Для проведения серологических анализов на ин-фицированность позвоночных животных арбовирусами требуется, как правило, 1,0—1,5 мл сыворотки, которую в таком объеме получают из 4—5 мл крови. Однако у мелких грызунов цельной крови обычно удается взять не более 1,5—2,0 мл. Поэтому, если нет задачи исследовать животных индивидуально, в пробу с одной точки отлова объединяют 2—3 особи одного вида, пола и желательно возраста.
Зверьков после умерщвления вскрывают в течение 5—7 мин. Для этого готовят 2 пары ножниц и пинцетов. Одной парой вскрывают кожу
МУ 3.1.1029—01
(фартуком), второй - грудную клетку, рассекая на несколько частей сердце, и стерильным шприцем забирают кровь. Ее сливают в пробирку по стеклу и, набрав 4,5—5,0 мл, ставят при температуре 20 °С на 30— 60 мин для образования сгустка. Затем сгусток обводят стерильной пастеровской пипеткой или прокаленной на огне стальной спицей, чтобы отделить его от стенок пробирки. После обведения сгустка пробирки закрывают резиновыми пробками и ставят в прохладное место (холодильник или на лед). Оптимальная температура - 0 °С. Если нет холодильника, пробирки можно сохранять, обернув их мокрым материалом и поместив в тень или на сквозняк. Через 4—6 ч сыворотку крови отсасывают стерильными пастеровскими пипетками и переносят в стерильные емкости (пенициллиновые или инсулиновые флаконы, виалки и др.). Сыворотку хранят в холодильнике (или замораживают в сосуде Дьюара). При длительном хранении в холодильнике в сыворотку добавляют консервант (мертиолят натрия 1: 10 000), чтобы ингибировать постороннюю микрофлору. Длительное хранение без холодильника недопустимо. Пробирки и флаконы заранее этикетируют. На этикетке указывают номер пробы, дату забора крови, вид животного, его пол и возраст (число особей, если от нескольких зверьков), адрес отлова. Эти данные должны совпадать с данными в жу рнале, где дополнительно записывают, были ли сняты с животного эктопаразиты (если да, то указывают их таксономическую принадлежность и количество).
После взятия крови в первую очередь берут головной мозг, затем сгустки крови и кусочки внутренних органов. При заборе пробы головного мозга первой парой инструментов снимают шкуру, разрезая колу затылочной области на уровне 1—2 шейных позвонков. Колу срезают по бокам до конца лба и откладывают ее вперед. Края разрезанной колеи и череп обрабатывают 70° спиртом или, в крайнем случае, 5 %-ным йодом. Второй парой инструментов срезают по шву верхнюю часть черепа и снимают ее, оголяя головной мозг. Брашнами ножниц (стерильных) забирают кусочки мозга и над пламенем спиртовки помещают в стерильный флакон, этикетируют, затем сразу же замораживают в сосуде Дьюара.
Для взятия проб внутренних органов также пользуются двумя парами инструментов. Кусочки органов доллены быть объемом 1—1,5 см3. Пробы калсдого органа складывают в отдельные стерильные флаконы, сопроволсдают соответствующими этикетками и помещают в сосуд Дьюара, где они хранятся до момента исследования.
От животных, добытых давилками или капканами, материал следует брать не позже 2 ч после их гибели (поимки), т. к. в более поздние сроки антигены арбовирусов (особенно в головном мозге) начинают распадаться.
МУ 3.1.1029—01
б. 3.3. Взятие материала от птиц
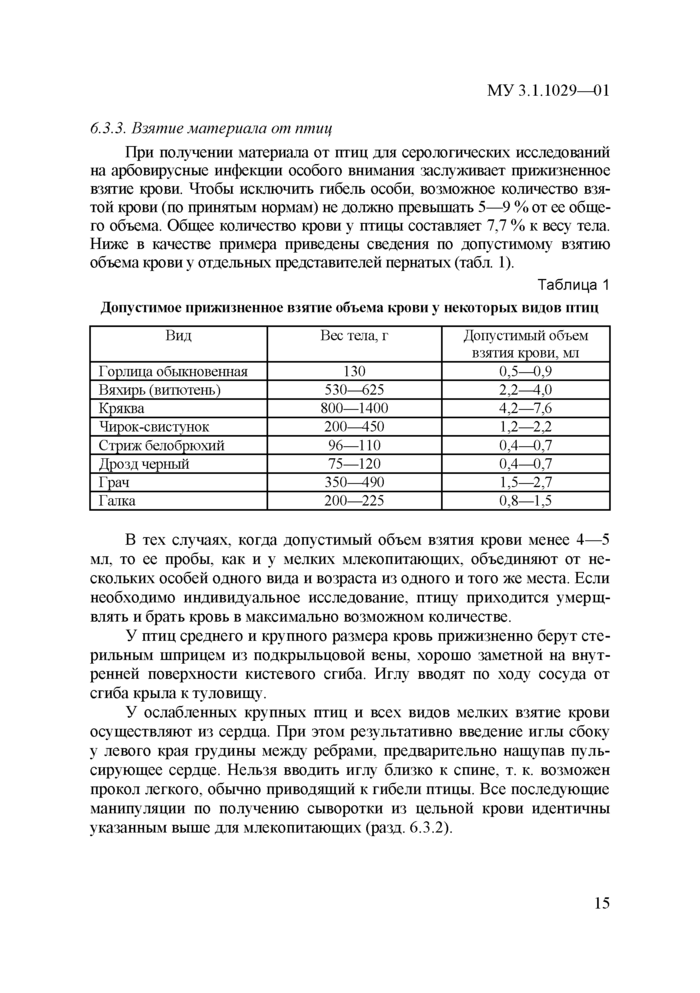
При получении материала от птиц для серологических исследований на арбовирусные инфекции особого внимания заслуживает прижизненное взятие крови. Чтобы исключить гибель особи, возможное количество взятой крови (по принятым нормам) не должно превышать 5—9 % от ее общего объема. Общее количество крови у птицы составляет 7,7 % к весу тела. Ниже в качестве примера приведены сведения по допустимому взятию объема крови у отдельных представителей пернатых (табл. 1).
Таблица 1
Допустимое прижизненное взятие объема крови у некоторых видов птиц
|
Вид |
Вес тела, г |
Допустимый объем взятия крови, мл |
|
Г орлица обыкновенная |
130 |
0,5—0,9 |
|
Вяхирь (витютень) |
530—625 |
2,2—4,0 |
|
Кряква |
800—1400 |
4,2—7,6 |
|
Чирок-свистунок |
200—450 |
1,2—2,2 |
|
Стриж белобрюхий |
96—110 |
0,4—0,7 |
|
Дрозд черный |
75—120 |
0,4—0,7 |
|
Грач |
350—490 |
1,5—2,7 |
|
Галка |
200—225 |
0,8—1,5 |
В тех случаях, когда допустимый объем взятия крови менее 4—5 мл, то ее пробы, как и у мелких млекопитающих, объединяют от нескольких особей одного вида и возраста из одного и того же места. Если необходимо индивидуальное исследование, птицу приходится умерщвлять и брать кровь в максимально возможном количестве.
У птиц среднего и крупного размера кровь прижизненно берут стерильным шприцем из подкрыльцовой вены, хорошо заметной на внутренней поверхности кистевого сгиба. Иглу вводят по ходу сосуда от сгиба крыла к туловищу.
У ослабленных крупных птиц и всех видов мелких взятие крови осуществляют из сердца. При этом результативно введение иглы сбоку у левого края грудины между ребрами, предварительно нащупав пульсирующее сердце. Нельзя вводить иглу близко к спине, т. к. возможен прокол легкого, обычно приводящий к гибели птицы. Все последующие манипуляции по получению сыворотки из цельной крови идентичны указанным выше для млекопитающих (разд. 6.3.2).
15
МУ 3.1.1029—01
От убитой птицы кровь для сыворотки можно взять только в первые 3—5 мин после отстрела. Поэтому необходима организация полевого рабочего места в непосредственной близости от пункта добычи. Для этого следует иметь походный “вирусологический чемодан” (укладку), где на одной стенке в штативах закреплено необходимое для работы, а откидывающаяся крышка служит столиком. После взятия крови птицу помещают в бязевый мешочек (для последующего сбора эктопаразитов) и в течение 2 ч доставляют к месту забора проб органов. Приемы взятия этого материала от птиц принципиально не отличаются от таковых при работе с млекопитающими.
7. Рекогносцировочное обследование территории
При оптимизации эпидемиологического надзора и дифференцированном подходе к эпизоотологическому обследованию энзоотичных территорий значительно возрастает роль ускоренного, но широкого обследования контролируемых районов. Такую рекогносцировку местности проводят, в основном, визуальными методами в первые дни работы зоологической бригады или до начала основных сезонных работ. Она дает возможность оперативного получения предварительной информации об общем состоянии главных факторов природной среды, влияющих на эпизоотическую активность очагов; ориентировочного выделения участков наиболее вероятного проявления эпизоотий или, напротив, ставить вопрос об исключении отдельных территорий на определенный срок из эпизоотологического обследования. Все это используется для корректировки календарно-территориального плана работ.
Перед проведением рекогносцировочных наблюдений, особенно на неизученных или слабо изученных в эпизоотологическом отношении территориях целесообразно предпринять предварительное детальное ознакомление с имеющимися картографическими материалами на конкретную местность (топографическими и тематическими картами, аэрокосмическими снимками и т. и.).
В целом рекогносцировочное обследование энзоотичных территорий включает:
• общую визуальную оценку абиотических и биотических факторов, обуславливающих природную очаговость в данном регионе (погодные условия, особенно аномальные явления и их последствия; состояние растительного покрова, определяющего кормовые и защитные условия жизни носителей; обилие и биотопическое распределение животных, имеющих медицинское значение; характер изменений в био-
МУ 3.1.1029—01
геоценозах, в частности происходящих под воздействием хозяйственной деятельности человека);
• предварительную (ориентировочную) оценку общего состояния популяций и численности фоновых (основных) видов носителей по следам их жизнедеятельности или непосредственным встречам с широким применением визуальных методов учета;
• выявление по соответствующим признакам для разных инфекций участков вероятного проявления эпизоотий (попутно собирают первичный материал, снабжая его по возможности точными координатами места взятия проб);
• уточнение мест стоянок работников отгонного животноводства и промысловых бригад, дислокации экспедиционных отрядов и других временных контингентов населения с проведением соответствующих санитарно-информационных мероприятий.
Сведения по численности носителей, полученные во время рекогносцировки, отражают на картосхеме, которая дополняется и уточняется в процессе последующих обследований, что дает возможность дифференцированно подходить к эпизоотологической оценке территории природного очага.
Потенциально очаговые территории обследуют лишь путем рекогносцировочных выездов со сбором первичного материала для серологических и молекулярно-биологических исследований с периодичностью примерно один раз в 5 лет.
Во всех случаях при рекогносцировках первостепенное внимание должно быть уделено эпидемиологически опасным участкам территории.
8. Основные методы учета численности носителей в природных очагах
8.1. Общие положения
Одним из важнейших элементов полевого раздела зоологической работы по эпизоотологическому мониторингу за природными очагами болезней является регулярное проведение в соответствующие фенологические сроки учетов численности грызунов и других носителей, в первую очередь фоновых видов. При этом в зависимости от конкретных задач и практических возможностей учреждений используют разные формы организации таких учетов: визуальную (глазомерно-балльную) оценку обилия животных на обширных площадях; разовые учеты в отдельных пунктах территории; учеты на ключевых участках (пунктах многолетних или долговременных наблюдений), а также на стационарах (принципы работы
17
МУ 3.1.1029—01
на последних см. разд. 9). Сочетание стационарных форм наблюдений с разовыми обследованиями территории позволяет надежнее выявлять как общий характер динамики численности носителей, так и ее локальные изменения, вызванные местными причинами.
Глазомерно-балльная оценка численности интересующих видов дает возможность получить общее представление об уровне плотности поселений носителей, а также оценить их пространственное распределение и определить места скоплений.
Путем разовых учетов, проводимых соответствующими методами выборочно на отдельных (необязательно на одних и тех же) участках района обследования, получают сведения главным образом о текущем состоянии численности носителей. Такой формой учетов следует по возможности охватывать все основные типы биотопов, пригодные для обитания вида (видов). В первую очередь, это касается территорий наиболее частого контакта человека с природным очагом, а также мест вероятного проявления эпизоотических ситуаций. Все пункты учетов численности носителей и сбора материала для лабораторных исследований отмечаются (отуривают-ся) на местности и наносятся на картосхему. В районах с редким возникновением эпизоотий разовые учеты, как и эпизоотологическое обследование, проводят с периодичностью один раз в 2—3 года. Так, кратность обследования и учетов в очагах чумы определяется дифференцированным подходом к разным территориям, различающимся по индексу эпизоотичности (ИЭ)2 и уровню эпидемического потенциала.
В связи с тем, что выраженная периодичность и разобщенность разовых учетов не позволяет получать адекватных данных о многолетней динамике численности носителей на обширных пространствах, в каждом ландшафтно-экологическом районе контролируемой территории выделяют ключевые участки - пункты многолетних (долговременных) наблюдений. Такие участки (число их регламентируется возможностями учреждений) целесообразно закладывать в местах относительно частого проявления эпизоотий, а тем более в сочетании с условиями, способствующими эпидемическим осложнениям. Площадь ключевых участков должна охватывать все основные типы биотопов, характерных для данного района. На участках проводят крупномасштабное картографирование местности с последующим нанесением на планшет (картосхему) результатов учета численности животных и лабораторных исследований
МУ 3.1.1029—01
материала. Обследуют ключевые участки ежегодно в 2—3 срока: весной перед началом размножения грызунов; в конце весны - начале лета при расселении молодых (преимущественно для сусликов); осенью - по окончании размножения (для незимоспящих). Общая продолжительность наблюдений на конкретном ключевом участке должна составлять не менее 3—5 лет, а по возможности, и более.
Среди существующих методов оценки численности животных выделяют учеты прямые (относительные и абсолютные) и косвенные (относительные). Прямые учеты связаны непосредственно с выловом или подсчетом самих зверьков; косвенные - с ориентировочной оценкой обилия особей по следам их жизнедеятельности или другим косвенным показателям (прилож. 2). В практике зоологической работы в природных очагах преимущественно используют относительные (прямые и косвенные) методы учета численности носителей. Особенно привлекательны те из них, которые отличаются достаточной простотой и информативностью, сравнимостью результатов и меньшей трудоемкостью по сравнению с абсолютными учетами, которые целесообразны лишь на стационарах.
Все результаты учета, какими бы методами они ни были достигнуты, являются сугубо выборочными оценками, основанными на анализе ничтожно малой части от всей совокупности населения вида (видов) на контролируемой территории. Это обязывает к очень внимательному проведению экстраполяции полученных данных на окружающую местность с детальной дифференциацией последней по сходным условиям существования животных. При обсуждении результатов учета численности конкретных видов указывают соответствующие методы или их модификации, использованные для получения этих материалов.
8.2. Учет численности носителей в природных биотопах
8.2.1. Мелкие млекопитающие
Основным приемом при учетах (как и при отловах) различных видов мелких млекопитающих (мышей, полевок, хомячков, землероек и т. п.) служит универсальный метод ловушко-линий в разных его вариантах. Наиболее простой из них заключается в использовании плашек (давилок) Геро малого размера с трапом или без него со стандартной приманкой из кусочков хлеба, сдобренных растительным маслом (для серых полевок дополнительно насаживают кусочки моркови). Ловушки выставляют в линию (прямую или ломаную) с интервалом 5 м. Выбор подходящего места для постановки орудия лова допускает отклонения
19
МУ 3.1.1029—01
от пятиметровой отметки в радиусе 1 м. Давилки настораживают, как правило, во второй половине дня и проверяют на следующее утро. Минимальной учетной единицей для каждой стации обитания видов считают 100 ловушко-ночей (ловушко-суток). Показателем численности служит число зверьков (общее и по видам), попавших в такое количество ловушек ( процент попадания). Исходя из условий местности, орудия лова могут быть расставлены в 2 или 4 линии (не ближе 50 м одна от другой) соответственно по 50 и 25 плашек.
Леммингов учитывают дуговыми капканами (№ 0 или 1), а также плашками (малого или большого размера) с трапом без приманки, т. к. эти грызуны берут ее плохо. Орудия лова ставят по возможности на выходах из нор, на тропках поперек движения зверьков так, чтобы ловчая часть ловушек находилась на пути движения животных. Учетная единица - процент попадания.
Численность леммингов определяют и на площадках размером 0,25 га в однотипных биотопах с подсчетом заселенных нор и отловом зверьков. Такую работу проводят преимущественно на стационарных участках.
При рекогносцировочных обследованиях приемлем маршрутно-визуальный метод учета леммингов. На пеших маршрутах, протяженностью не менее 5 км с шириной полосы 5—10 м (в зависимости от густоты растительного покрова) учитывают всех выбегающих зверьков (наиболее точные показатели получают с использованием лайки). По ходу движения глазомерно оценивают местность и отмечают границы основных стаций обитания этих грызунов. Пересчет числа особей осуществляют на 1 км маршрута в однотипных биотопах.
Серых полевок (обыкновенную, общественную, узкочерепную, полевку Брандта) и степную пеструшку, имеющих хорошо заметные с поверхности сложные норы-колонии, дополнительно к ловушко-линиям (или вместо них) учитывают маршрутным методом с выборочной раскопкой нор. Во всех случаях при учетах мелких грызунов этим методом площадь маршрутной полосы должна быть не менее 1 га (например, ширина полосы -5 м, длина - 2 км). Ширина маршрутной полосы для учета численности полевок в высокотравных степях и лугах не должна превышать 2 м; в низкотравных может составлять до 10 м и более. На этом пространстве подсчитывают все жилые колонии зверьков. Колонии, попавшие в учетную полосу не полностью, подсчитывают только на одной стороне маршрута. Число зверьков в одной сложной норе определяют путем ее полной раскопки с выловом и подсчетом всех обитающих в ней особей. На каждом биотопически однородном марш-
МУ 3.1.1029—01
Содержание
1. Область применения...............................................................................................................4
2. Нормативные ссылки..............................................................................................................4
3. Обоснование............................................................................................................................5
4. Роль мелких млекопитающих и птиц в носительстве
возбудителей опасных болезней человека................................................................................6
5. Общие принципы организации зоологической работы
в природных очагах зоонозных инфекций................................................................................8
6. Основные приемы и средства сбора полевого материала..................................................10
6.1. Добыча теплокровных носителей..................................................................................10
6.2. Сбор погадок хищных птиц...........................................................................................11
6.3. Сбор материала для вирусологических исследований
(млекопитающие, птицы).........................................................................................................12
6.3.1. Общие положения.................................................................................................12
6.3.2. Взятие материала от мелких млекопитающих....................................................13
6.3.3. Взятие материала от птиц.....................................................................................15
7. Рекогносцировочное обследование территории.................................................................16
8. Основные методы учета численности носителей в природных очагах.............................17
8.1. Общие положения...........................................................................................................17
8.2. Учет численности носителей в природных биотопах..................................................19
8.2.1. Мелкие млекопитающие......................................................................................19
8.2.2. Серая крыса (экзоантропная форма)...................................................................21
8.2.3. Водяная полевка....................................................................................................22
8.2.4. Малые песчанки....................................................................................................23
8.2.5. Суслики.................................................................................................................25
8.2.6. Сурки.....................................................................................................................26
8.2.7. Тушканчики...........................................................................................................27
8.2.8. Пищухи..................................................................................................................28
8.2.9. Хищные млекопитающие.....................................................................................28
8.2.10. Птицы...................................................................................................................29
8.3. Учет численности мелких млекопитающих
в скирдах, стогах, ометах и прессованном сене......................................................................30
8.4. Учет численности грызунов в населенных пунктах.....................................................31
8.4.1. Общие положения.............................................................................................31
8.4.2. Учет численности мелких грызунов................................................................32
8.4.3. Учет численности крыс.....................................................................................33
9. Общие принципы организации работы на стационарных участках..................................34
10. Общие принципы картографирования поселений носителей..........................................38
11. Составление прогноза изменений численности носителей..............................................41
11.1. Общие положения.........................................................................................................41
11.2. Критерии прогноза численности отдельных видов грызунов
и зайцеобразных........................................................................................................................42
11.2.1. Мелкие грызуны..................................................................................................42
11.2.2. Водяная полевка..................................................................................................45
11.2.3. Малые песчанки..................................................................................................46
11.2.4. Суслики................................................................................................................48
11.2.5. Пищухи (даурская, монгольская)......................................................................50
12. Схема составления обзора численности носителей..........................................................50
Приложения..............................................................................................................................52
3
МУ 3.1.1029—01
руте раскапывают 10 колоний. Численность полевок на 1 га устанавливают путем умножения среднего числа особей в одной сложной норе на количество таких нор, подсчитанных на одногектарном маршруте.
8.2.2. Серая крыса (экзоантропная форма)
Экзоантропная форма серой крысы в пределах России населяет дельту Волги и Ахтубы. поймы Кубани, Терека, Кумы, встречается в Приморье и Южном Сахалине, а также по берегам искусственных каналов, водохранилищ, рисовым чекам и т. п. Эти дикие популяции обычно не связаны с синантропными крысами населенных пунктов.
Для учета численности экзоантропных крыс применяют капканнолинейный метод с приманкой. Дуговые капканы (№ 0 или 1) в количестве 25 штук выставляют в линию вдоль берега (чаще всего по урезу воды) через 10 м один от другого. В качестве приманки используют кусочки рыбы, помещенные под капкан. Показателем численности служит количество особей, отловленных в среднем на 100 м учетной линии.
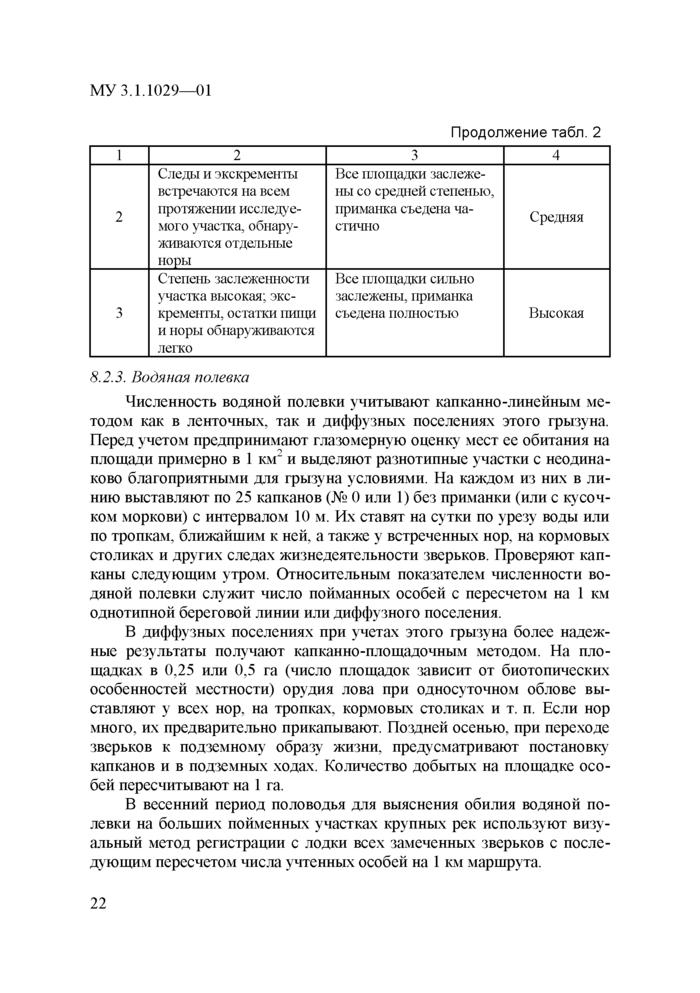
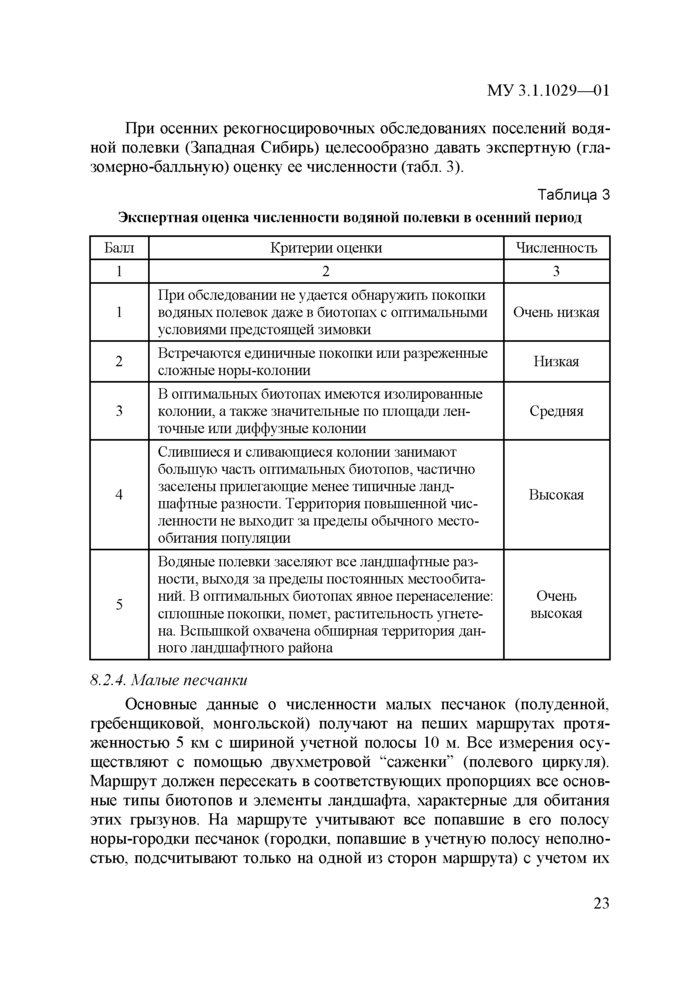
При учетах серых крыс, обитающих в природных биотопах, используют также экспертную оценку их обилия по 4-балльной шкале. Ее проводят путем визуальной регистрации следов жизнедеятельности зверьков или с помощью иловых площадок (табл. 2).
Иловые площадки закладывают равномерно по 3—4 на 1 км береговой линии. Для этого лопатой снимают верхний слой почвы на площади примерно 1 м2. Затем поверхность площадки смачивают водой, разравнивают и в центр помещают рыбную приманку. Следующим утром площадки осматривают и оценивают на посещаемость крысами. С помощью таких площадок можно обнаружить наличие крыс, когда другие внешние следы их жизнедеятельности отсутствуют.
Таблица 2
|
Экспертная оценка численности серых крыс в природных местообитаниях | ||||||||||||||||||
| ||||||||||||||||||
МУ 3.1.1029—01
УТВЕРЖДАЮ Главный государственный санитарный врач Российской Федерации - Первый заместитель Министра здра-воохранения Российской Федерации
Г. Г. Онищенко
МУ 3.1.1029—01 06 апреля 2001 г.
Дата введения: с момента утверждения
3.1. ЭПИДЕМИОЛОГИЯ. ПРОФИЛАКТИКА ИНФЕКЦИОННЫХ БОЛЕЗНЕЙ
Отлов, учет и прогноз численности мелких млекопитающих и птиц в природных очагах инфекцийМетодические указания 3 4
МУ 3.1.1029—01
2.2. Руководство по профилактике чумы.—Саратов, 1992.
2.3. Временные методические указания по организации и проведению эпидемиологического надзора в природных очагах чумы России в условиях ограниченных финансовых и материально-технических ресурсов.—М., 1998.
2.4. “Об усилении мероприятий по профилактике туляремии”. Приказ М3 РФ № 125 от 14.04.99.
2.5. Инструкция по эпидемиологическому надзору в природных очагах чумы Советского Союза.—Саратов, 1979.
2.6. Инструкция по учету численности грызунов для противочумных учреждений Советского Союза.—Саратов, 1978.1
2.7. Методические указания по зоологической и паразитологической работе отделов особо опасных инфекций областных санитарно-эпидемиологических станций Средней полосы Европейской части СССР,—М., 1963.4
2.8. Арбовирусы (методы лабораторных и полевых исследований).—М., 1986
2.9. Методические указания по прогнозу и учету численности серых полевок: Изд-во “Колос”.—М., 1970.
2.10. Методические указания по картографированию поселений грызунов в природных очагах чумы.—Саратов, 1979.
2.11. Программа работы эпизоотологических стационаров в природных очагах туляремии, иерсиниозов, лептоспирозов и арбовирусных инфекций Сибири и Дальнего Востока.—Иркутск, 1990.
2.12. Порядок разработки, экспертизы, утверждения, издания и распространения нормативных и методических документов системы государственного санитарно-эпидемиологического нормирования. Руководство. Р 1.1.001—1.1.005—96.
3. Обоснование
Настоящие методические указания основаны на многолетнем опыте практической работы противочумных учреждений и отделов особо опасных инфекций санитарно-эпидемиологической службы. Главным объектом внимания являются позвоночные животные, имеющие важное медицинское значение в качестве носителей (резервуаров) возбудителей природно-очаговых болезней, опасных для человека. Контроль за динамикой численности и пространственным распределением таких видов 5 6
МУ 3.1.1029—01
животных - один из основных разделов работы медицинских зоологов в общем комплексе противоэпидемических мероприятий.
Действовавшие на территории бывшего СССР основные руководства и рекомендации по зоологической работе к настоящему времени устарели. К тому же объединение всех санитарно-эпидемиологических служб при Департаменте госсанэпиднадзора Минздрава России требует единого подхода к организации и проведению зоологических исследований в общем комплексе мероприятий, обеспечивающих эффективность мониторинга за природными очагами и профилактику инфекций. В силу указанных причин назрела необходимость унифицирования основных методических приемов, регламентирующих содержание и объем зоологической работы в учреждениях санитарно-эпидемиологического профиля.
Настоящие методические указания входят в ряд основополагающих информационно-методических документов при осуществлении эпидемиологического надзора в природных очагах зоонозов на территории Российской Федерации.
4. Роль мелких млекопитающих и птиц в носительстве возбудителей опасных болезней человека
Во всех природно-климатических зонах Российской Федерации со своеобразными типами ландшафтов и их азональными компонентами птицы и мелкие млекопитающие, в первую очередь грызуны (местами и зайцеобразные), занимают ведущее положение в циркуляции возбудителей многих зоонозов. Особо важную роль в существовании природных очагов таких заболеваний играют, как правило, фоновые виды (обычно выступающие основными носителями возбудителя), которые с наибольшим постоянством принимают участие в развитии эпизоотий и поддержании очаговости. Грызуньг служат и главными прокормителями разнообразных кровососущих членистоногих - переносчиков (а порой и длительных хранителей) возбудителя.
Так, в отдельных природных очагах чумы северных регионов При-каспия и на Кавказе в качестве основных носителей выступают малый суслик, горный суслик, полуденная и гребенщиковая песчанки, обыкновенная полевка, а в условиях Сибири и Дальнего Востока - длиннохвостый и даурский суслики, монгольская пигцуха. В очагах туляремии в соответствии с их ландшафтными типами первостепенное значение имеют водяная и другие виды полевок, лесная и домовая мыши, степная пеструшка, зайцы, хомяки, лемминги и остальные мелкие млекопитающие (в т. ч. насекомоядные), относящиеся к 1 группе по восприимчиво- 7
МУ 3.1.1029—01
сти и чувствительности к возбудителю этого заболевания. В очагах клещевого энцефалита важную роль как прокормители клещей играют зайцы (беляк и русак), белка, бурундук, различные виды мелких грызунов, а также птицы (тетеревиные, дроздовые, некоторые мелкие лесные виды и др.). Роль птиц в этих природных очагах становится особенно заметной в годы депрессии численности грызунов. На энзоотичных по разным инфекциям территориях отдельные виды носителей могут иметь важное эпидемиологическое значение как объекты промысла или других форм контакта с человеком, независимо от степени их участия в эпизоотическом процессе.
Во многих случаях наблюдается сопряженность (сочетанность) природных очагов разнообразных болезней не только в результате их территориального совмещения, но и вследствие наличия общих носителей и переносчиков. К примеру, с очагами чумы могут быть сопряжены природные очаги многих заболеваний (псевдотуберкулез, кишечный иерсиниоз, пастереллез, туляремия, лептоспироз и др.). Очаги туляремии в разных регионах России проявляют сочетанность с очагами леп-тоспироза и листериоза. В Средней полосе и Поволжье они зачастую сопряжены с очагами геморрагической лихорадки с почечным синдромом, а в районах Западной Сибири - с очагами омской геморрагической лихорадки. Тесную связь с очагами клещевого энцефалита имеют обычно природные очаги болезни Лайма и т. д.
Оценка роли птиц в существовании природной очаговости болезней в последние десятилетия значительно возросла в связи с направленным выявлением нозоареалов обширной группы арбовирусньгх инфекций и необходимостью организации постоянного санитарно-эпидемиологического надзора за активностью таких очагов. Особую значимость в данном случае приобретают перелетные представители орнитофауны, способные к трансконтинентальным заносам возбудителей. К тому же арбовирусы, как правило, образуют сочетанные очаги с возбудителями многих других трансмиссивных заболеваний (бактериями, риккетсиями, простейшими и т. д.).
Все это вызывает необходимость проведения комплексных исследований полевого материала на наиболее значимые для конкретных территорий нозологические формы приро дно-очаговых болезней. В прилож. 1 содержится информация об участии некоторых видов грызунов и зайцеобразных в носительстве возбудителей ряда зоонозных инфекций. Хотя эти сведения далеко не исчерпывающие, они в основном отражают картину возможных сочетаний разных природных очагов
МУ 3.1.1029—01
опасных заболеваний человека в одной и той же местности, в которой обитает комплекс соответствующих видов носителей.
5. Общие принципы организации зоологической работы в природных очагах зоонозных инфекций
Общая организация зоологической работы в природных очагах болезней (чума, туляремия, клещевой энцефалит и т. д.) подчинена современным требованиям оптимизации эпидемиологического надзора и органически связана с основными целями эпизоотологического мониторинга за такими очагами. Эти цели предполагают:
• осуществление контроля за состоянием природных очагов на основе дифференциации их территорий по приоритетности и кратности обследования отдельных участков, исходя из их эпизоотической активности и эпидемиологической значимости;
• использование для полевых и лабораторных исследований наиболее экономичных и эффективных тактических и методических приемов, которые дают необходимый объем эпизоотологической информации с целью своевременного выявления разлитых эпизоотий, имеющих наибольшее эпидемиологическое значение;
• определение интенсивности выявленных эпизоотий, границ их распространения, тенденции дальнейшего развития и степени эпидемической опасности;
• сбор данных, характеризующих особенности механизма циркуляции возбудителя в периоды его активной фазы и сохранения в межэпизоотические периоды;
• фиксирование изменений, происходящих в очагах при антропогенном воздействии и трансформации природных комплексов;
• выявление новых природных очагов и определение функциональной роли отдельных видов носителей и переносчиков в таких очагах;
• прогнозирование эпизоотических ситуаций и угрозы эпидемических осложнений;
• обоснование необходимых мер профилактики в очагах;
• проведение информационно-разъяснительной работы среди населения.
Исходя из указанных общих целей, основу полевого раздела работы медицинских зоологов составляет получение в оптимальные сроки и с минимальными затратами первичных информативных материалов по эпизоотической активности природных очагов и определение тенденций в изменениях ее уровня. Это достигается путем использования соответствующих тактических и методических приемов, связанных со специ-
МУ 3.1.1029—01
фикой природной очаговости конкретных нозологических форм, а также с особенностями жизнедеятельности носителей и состояния их популяций. Эффективность сбора первичного материала базируется на детальном знании обслуживаемой территории при наличии средне- или крупномасштабной карты (картосхемы), ее ландшафтно-экологического (эпизоотологического) районирования.
В частные задачи полевого раздела работы входят:
• общая оценка состояния биотических и абиотических факторов в природных очагах болезней с учетом меры антропогенного воздействия на их биогеоценозы;
• получение первичного полевого материала для лабораторных исследований путем добычи носителей, сбора их трупов, костных останков, а также остатков стола пернатых и наземных хищников, продуктов их метаболизма (погадки, экскременты); в отдельных случаях - взятие субстрата из нор грызунов и сбор экскрементов основных видов носителей;
• проведение в оптимальные фенологические сроки учетов численности носителей (в первую очередь, фоновых видов), оценка ее текущего состояния и прогноз ожидаемых изменений;
• определение биотопической приуроченности и пространственной (по возможности и популяционной) структуры поселений носителей, хода размножения и эколого-физиологического состояния особей, возрастного и полового состава популяций, подвижности животных и других особенностей экологии, которые определяют развитие эпизоотий и условия заражения человека;
• выявление мест сохранения поселений носителей (“станций переживания”) в периоды депрессий их численности;
• уточнение видового состава, пространственного распределения и численности животных на потенциально очаговых территориях, выявление на них мест возможного возникновения эпизоотий;
• проведение плановых наблюдений на стационарных участках.
Получение материала для лабораторных исследований обычно сочетают с учетом численности носителей и изучением отдельных особенностей их экологии. Сбор этих сведений осуществляется путем регулярного, скоординированного по срокам обследования обслуживаемой территории в минимально необходимом, но достаточном для их объективной оценки объеме работ.
Помимо полевого раздела работы зоологи принимают участие в подготовке собранного материала к лабораторным исследованиям и его камеральной обработке. При этом предусматривается:
9
МУ 3.1.1029—01
• разбор погадок хищных птиц, экскрементов плотоядных млекопитающих и костных останков носителей для серологических исследований и генодиагностики; определение животных по возможности с точностью до вида по содержащимся костным фрагментам;
• при вскрытиях животных контроль за правильностью определения возрастного и полового состава добытых особей, их репродуктивной активности по состоянию генеративных органов, уточнение при необходимости видовой принадлежности;
• оформление коллекционных материалов, экспонатов и т. и.;
• анализ результатов полевых наблюдений и лабораторных исследований, а также уточнение существующих схем ландшафтно-экологического и эпизоотологического районирования очаговых территорий;
• составление обзора и прогноза численности носителей, участие в составлении эпизоотологического прогноза по состоянию природных очагов;
• определение в случае необходимости характера и объемов профилактических мероприятий в природных очагах.
Все полевые и лабораторные разделы работы выполняются в соответствии с санитарными правилами “Безопасность работы с микроорганизмами I—II групп патогенности” (М., 1994).
6. Основные приемы и средства сбора полевого материала
6.1. Добыча теплокровных носителей
Для отлова мелких млекопитающих (грызунов, насекомоядных) чаще всего применяют плашки (давилки Геро) с трапом или без него. В качестве стандартной приманки служат кусочки хлебных корок (примерный объем - 1 см3), сдобренные растительным маслом (для серых полевок желательно использовать кусочки моркови).
Млекопитающих средней величины (сусликов, крыс, пищух, мелких куньих и др.) отлавливают дуговыми капканами № 0 или 1, более крупных (сурков) - капканами № 2 или 3, а также добывают путем отстрела.
В целях вылова мелких млекопитающих живыми применяют разного рода живоловки (сетчатые или ящичного типа), либо сооружают ловчие канавки или заборчики с вкопанными цилиндрами или конусами (последние менее трудоемки в установке). Канавки роют длиной от 20 до 50 м (в зависимости от плотности грунта и рельефа местности), глубиной и шириной - 25 см. В канавки вкапывают от 3 до 5 ловчих цилиндров (диаметром 25 см), изготовленных из жести или рубероида. Высота цилиндров должна быть 50 см (при отлове полевок может составлять 30 см). Два из них вкапывают по одному в торцевых частях канавки, остальные - на равных рас-
1
Оптимальная доза для сизых голубей - 0,25 г этаминала-натрия и 0,05 тазепама на 100 г прикорма.
13
2
ИЭ определяется отношением числа лет (сезонов) с эпизоотиями к общему числу лет (сезонов) обследования конкретной территории.
3
Область применения
1.1. Методические указания по отлову, учету и прогнозу численности мелких млекопитающих и птиц в природных очагах инфекций разработаны в помощь специалистам санитарно-эпидемиологических учреждений для оптимизации эпиднадзора в природных очагах зоонозных болезней в Российской Федерации.
1.2. Настоящие методические указания обязательны для выполнения на всей территории Российской Федерации учреждениями санитарно-эпидемиологической служсбы и здравоохранения.
1.3. Методические указания разработаны на основании закона Российской Федерации “О санитарно-эпидемиологическом благополучии населения” №52-ФЗ от 30 марта 1999 г. и “Положения о государственном санитарно-эпидемиологическом нормировании”.
4
Нормативные ссылки
2.1. “Безопасность работы с микроорганизмами I и II групп патогенности”. СП 1.2.011—94.—М., 1994.
4
5
Отменяется после утверждения настоящих методических указаний.
6
Отменяется в части зоологической работы после утверждения настоящих МУ.
5
7