Методические указания по выделению и идентификации штаммов вируса ящура
Купить бумажный документ с голограммой и синими печатями. подробнее
Цена на этот документ пока неизвестна. Нажмите кнопку "Купить" и сделайте заказ, и мы пришлем вам цену.
Распространяем нормативную документацию с 1999 года. Пробиваем чеки, платим налоги, принимаем к оплате все законные формы платежей без дополнительных процентов. Наши клиенты защищены Законом. ООО "ЦНТИ Нормоконтроль"
Наши цены ниже, чем в других местах, потому что мы работаем напрямую с поставщиками документов.
Способы доставки
- Срочная курьерская доставка (1-3 дня)
- Курьерская доставка (7 дней)
- Самовывоз из московского офиса
- Почта РФ
Учебное издание содержит действующие методические указания, наставления и инструкции по лабораторной диагностике вирусных болезней животных, утвержденные Министерством сельского хозяйства СССР, РФ и Россельхознадзором РФ. Документы систематизированы по видам животных, в большинстве прошли многолетнюю аппробацию в Алтайской краевой ветеринарной лаборатории и включены в «Перечень нормативной документации, разрешенной для использования в государственных ветеринарных лабораториях при диагностике болезней животных, рыб, пчел, а также контроля безопасности сырья животного и растительного происхождения (по состоянию на июль 2011 г.). Приводятся предметный указатель и библиографический список.
Предназначено для студентов, обучающихся по специальности «Ветеринария» и направлению «Ветеринарно-санитарная экспертиза», ветеринарных врачей и лаборантов ветеринарных лабораторий.
Оглавление
I. Выделение вируса ящура
1. Правила отбора патологического материала
2. Подготовка материала к исследованию
3. Выделение вируса
II. Методы идентификации вируса
1. Серологические методы
Определение типов вируса ящура
Определение подтипов (вариантов) вируса ящура
Постановка РСК по 50% -ному гемолизу при определении степени антигенного родства штаммов вируса ящура
Приготовление агаровой среды для реакции диффузионной преципитации
Приготовление агаровых пластинок
Определение в РДП типа вируса ящура по сывороткам крови переболевших животных
Определение в РДП типа вируса ящура в патологическом материале
Сравнительное изучение антигенных свойств эпизоотических штаммов вируса ящура в реакции диффузионной преципитации
Определение типов вируса ящура
2. Биологические методы
А. Определение типа и варианта вируса ящура методом перекрестного иммунитета на переболевших и вакцинированных животных
Б. Реакция серозащиты на мышатах-сосунах
Компоненты реакции
Постановка реакции
Определение типа вируса ящура по сывороткам крови переболевших животных
Определение типа вируса ящура в патологическом материале
Определение вариантной принадлежности вируса ящура и соответствия эпизоотических штаммов вируса производственным
В. Реакция нейтрализации вируса в культуре ткани
Определение типа вируса ящура по сывороткам крови переболевших животных
Определение типа вируса ящура в патологическом материале
Краткий словарь использованных ветеринарных терминов
Библиографический список
Предметный указатель
| Дата введения | 01.01.2021 |
|---|---|
| Добавлен в базу | 01.01.2019 |
| Актуализация | 01.01.2021 |
Этот документ находится в:
- Раздел Экология
- Раздел 11 ЗДРАВООХРАНЕНИЕ
- Раздел 11.220 Ветеринария
- Раздел 11 ЗДРАВООХРАНЕНИЕ
Организации:
| 15.10.1973 | Утвержден | Минсельхоз СССР | |
|---|---|---|---|
| Разработан | Всесоюзный научно-исследовательский ящурный институт МСХ СССР | ||
| Издан | Издательство Лань | 2015 г. |
Чтобы бесплатно скачать этот документ в формате PDF, поддержите наш сайт и нажмите кнопку:

стр. 1

стр. 2

стр. 3

стр. 4

стр. 5

стр. 6

стр. 7

стр. 8

стр. 9

стр. 10

стр. 11
стр. 12

стр. 13

стр. 14
стр. 15

стр. 16

стр. 17
стр. 18

стр. 19

стр. 20

стр. 21

стр. 22

стр. 23

стр. 24
стр. 25

стр. 26

стр. 27

стр. 28
стр. 29

стр. 30
ЛАБОРАТОРНАЯ ДИАГНОСТИКА ВИРУСНЫХ БОЛЕЗНЕЙ ЖИВОТНЫХ
|
П. И. Барышников, В. В. Разумовская |
- САНКТ-ПЕТЕРБУРГ • •МОСКВА-• КРАСНОДАР -•2015-
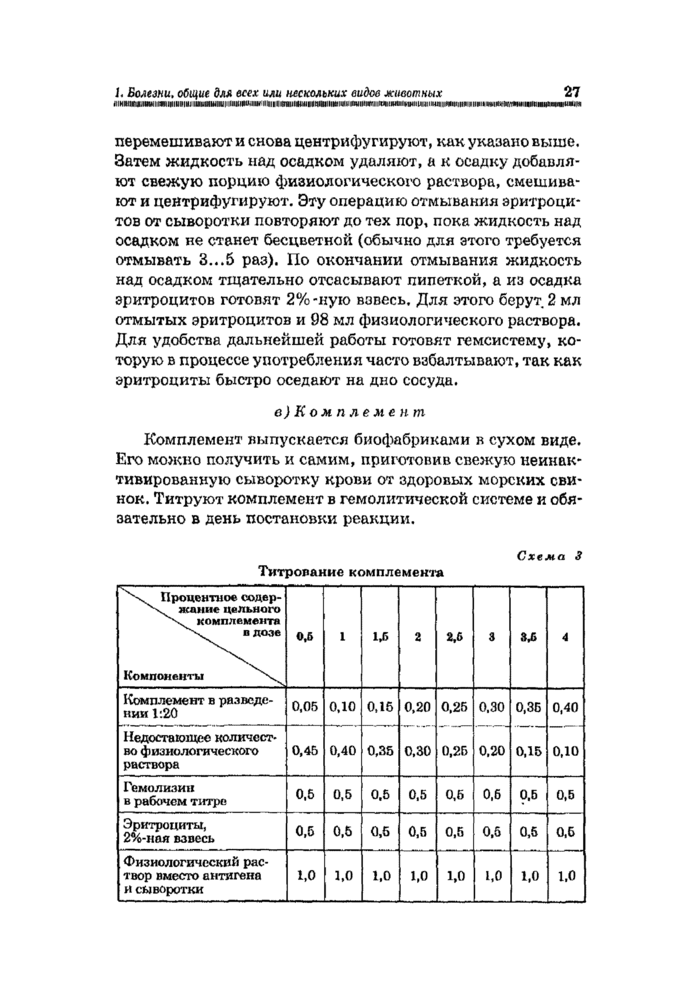
Рабочим разведением гемолизина считается четырех-кратная концентрация от его предельного титра.
|
Схема £ Титрование гемолизина | |||||||||||||||||||||||||||||||||||
|
В дальнейшем перед постановкой реакции гемолизин обычно не титруют, а рабочее разведение готовят, исходя из предельного титра, установленного при его выпуске био-фабрикой и указанного на этикетке. Например, если предельный титр гемолизина 1:3000, рабочее разведение будет 1:750. Поскольку гемолизин, выпускаемый биофабрикой, консервирован глицерином (1 часть глицерина на 1 часть гемолизина), для приготовления рабочего разведения гемолизина берут вдвое больше, т, е. 2:750, или 0,2 мл гемолизина и 74,8 мл физиологического раствора.
Для дальнейшей работы гемолизин в рабочем разведении смешивают с равным количеством 2% -ной взвеси эритроцитов. Полученная смесь называется гемолитической системой (гемсистемой).
б)Эритроциты
Полученную кровь барана дефибринируют, фильтруют через марлю в центрифужные пробирки, затем центрифугируют 10 мин при 2000...3000 об/мин. Сыворотку отсасывают, а к осадку эритроцитов добавляют примерно 8.. .10-кратное количество физиологического раствора, все тщательно
1, Болезни, общие для всех или нескольких видов животных
27
11И1!1ШМ!,11№.111||||||Н!ШШ. lilllilillHillll: шивмпи................ 'in i mill:
перемешивают и снова центрифугируют» как указано выше. Затем жидкость над осадком удаляют» а к осадку добавляют свежую порцию физиологического раствора» смешивают и центрифугируют. Эту операцию отмывания эритроцитов от сыворотки повторяют до тех нор» пока жидкость над осадком не станет бесцветной (обычно для этого требуется отмывать 3...5 раз). По окончании отмывания жидкость над осадком тщательно отсасывают пипеткой» а из осадка эритроцитов готовят 2%-ную взвесь. Для этого берут 2 мл отмытых эритроцитов и 98 мл физиологического раствора. Для удобства дальнейшей работы готовят гемсистему» которую в процессе употребления часто взбалтывают» так как эритроциты быстро оседают на дно сосуда.
в) К о м п л е м е н т
Комплемент выпускается биофабриками в сухом виде. Его можно получить и самим, приготовив свежую неинак-тивированную сыворотку крови от здоровых морских свинок. Титруют комплемент в гемолитической системе и обязательно в день постановки реакции.
|
Схема 3 Титрование комплемента | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
28 Лабораторная диагностика вирусных болезней животных
................................................................................................11111..... 1111.......«ИНН
Комплемент исследуют в разведении 1:20 в следующих дозах: 0,05; 0,10; 0,15 и т. д, с интервалами 0,05 до 0,40 мл. В каждую пробирку недостающее количество до объема 0,5 мл доливают физиологическим раствором (в первую пробирку 0,45 мл физиологического раствора, во вторую — 0,40, в третью — 0,35 и т, д.). Это будет соответствовать 0,5; 1,0; 1,5; 2; 2,5; 3; 3,5 и 4% цельного комплемента, содержащегося в дозе 0,5 мл разведения с физиологическим раствором.
Водяная баня 15 мин при температуре 37...38°С, после чего проводят учет реакции.
Титром комплемента считается наименьшее его коли* честно, дающее полный гемолиз эритроцитов. Для работы по определению типов вируса ящура пригоден комплемент, дающий при этих условиях титр не ниже 2*5%.
В дальнейшем для постановки главного опыта комплемент берут с постоянным излишком в 2 условные единицы от титра в его гемолитической системе. Например, если титр комплемента в гемолитической системе 1,5% (см. схему титрования комплемента), для получения рабочего разведения комплемента следует взять 2,5%, что составляет 2 единицы, Разведение комплемента делают из нативного цельного комплемента.
г) С ы воротки
Типоспецифические и вариантные гипериммунные ящурные сыворотки готовят на биофабриках (в институтах) и используют для определения типов и подтипов (вариантов) вируса ящура.
д) Антигены
Типоспецифические и вариантные ящурные антигены готовят из тканей больных ящуром крольчат на биофабриках и в институтах.
Испытуемый антиген (стенки афт с языка крупного рогатого скота, с «пятачка» или вымени свиней, с венчика, межкопытной щели или беззубого края верхней челюсти мелкого рогатого скота и т. д.) готовят по методике, описанной выше (см, п. 2). Присланный на исследование пато-
29
нмпнмги
логический материал в виде стенок афт или других тканей берут в количестве, необходимом для постановки РСК. Ос* таток патологического материала хранят в холодильнике при температуре -6...-20°С в консерванте и используют для дальнейшего изучения. В случае отрицательных результатов РСК допускается расплодка испытуемого материала на 4...6-дневных мышатах, морских свинках или культуре ткани.
Определение типов вируса ящура
При определении типов вируса ящура перед проведением главного опыта позитивные ящурные сыворотки и антигены не титруют, а используют их в удвоенных титрах. Например, если предельный титр сыворотки, указанный на этикетке, 1:40, то ее удвоенным титром будет раз-ведение 1:20. Если предельный титр антигена, указанный на этикетке, 1:6, то его удвоенным титром будет разведение 1:8,
Испытуемый антиген в реакции исследуют цельным (33%-ная взвесь) и в разведениях 1:2; 1:4, 1:8.
|
Схема 4 Определение типа вируса (главный опыт) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
30 Лабораторная диагностика вирусных болезней животных
«iiiiMiiiitHiiiHttiiiiitaiiiiniiiiiiiiiiiuiiiiiHuiHiiiiiiikMiiMMiHiiuiiiiiiiiiiiiiiMiimiiifiiiiiiiiiiiiiiiiMiMWiHiHiHmnmiiiriimiimmiffniimmWHnmrHiinnitimnitrimm
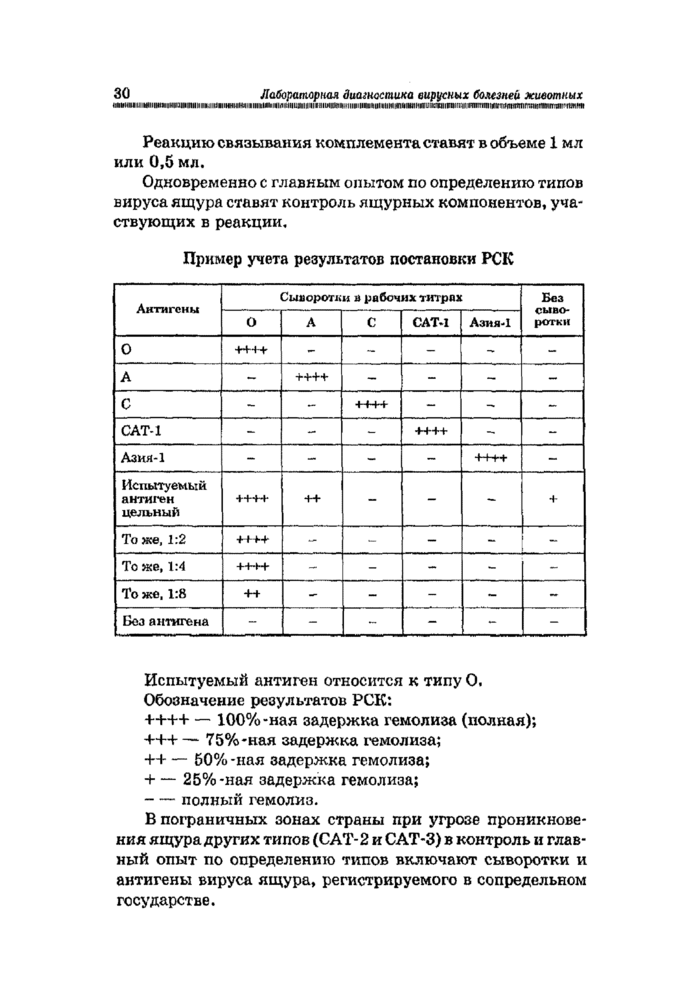
Реакцию связывания комплемента ставят в объеме 1 мл или 0,5 мл.
Одновременно с главным опытом по определению типов вируса ящура ставят контроль ящурных компонентов, участвующих в реакции.
|
Пример учета результатов постановки РСК | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Испытуемый антиген относится к типу О.
Обозначение результатов РСК:
++++ — 100%-ная задержка гемолиза (полная);
+++ — 75%-ная задержка гемолиза;
++ — 50% -ная задержка гемолиза;
+ — 25%-ная задержка гемолиза;
- — полный гемолиз.
В пограничных зонах страны при угрозе проникновения ящура других типов (CAT-2 и САТ-3) в контроль и главный опыт по определению типов включают сыворотки и антигены вируса ящура, регистрируемого в сопредельном государстве.
Определение подтипов (вариантов) вируса ящура
Для определения подтипов (вариантов) вируса ящура или соответствия эпизоотического штамма производственному необходимы те же компоненты, что и при постановке РСК для определения типов, и, кроме того, антигены и сыворотки производственных (вариантных) штаммов ви-руса ящура.
Перед постановкой РСК с целью определения вариантной принадлежности эпизоотических штаммов вируса ящура определяют активность и вариантную специфичность антигенов и сывороток* используемых в реакции.
Первый учет реакции проводят сразу после водяной бани, а окончательный — через 18 ч после выдерживания пробирок при температуре 12...18°С.
Предельным титром сыворотки считают наивысшее раз-ведение ее, дающее с антигеном гомологичного штамма полную задержку гемолиза эритроцитов (++++), в данном случае разведение 1:40.
|
Схема 5 Проверка активности вариантной сыворотки Ач | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Титром антигена считается наивысшее разведение его, дающее с гомологичной сывороткой полную задержку гемолиза эритроцитов, в данном случае разведение 1:6.
По аналогичным схемам проверяют на активность и специфичность сыворотки и антигены других вариантов.
32 Лабораторная диагностика вирусных бом»тй животных
irieiii<iiiiin)iiiiiiiiHiiiHijii№Hiiiiiiiaiiiiiunmiiiin!iiiaiuiiiiiimi]i|iiiiiiiiiiiiii(iiiMiiiiiiifiiiiiiiiirMHiiiiMiiiiiMiiiiiiiiiiiii|iMii!4iil)|Hi«Manm)iiuiiiiiiiii|itjj)Hiirtiini'iMifii^ri^HUiJiii<
|
Схема € Проверка вариантной специфичности сыворотки А? | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Заключение: сыворотка варианта А7 специфична.
|
Схема 7 Проверка активности антигена варианта А? | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Схем a S | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Проверка вариантной специфичности антигена Ат | ||||||||||||||||||||
|
|
Продолжение схемы S | ||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||
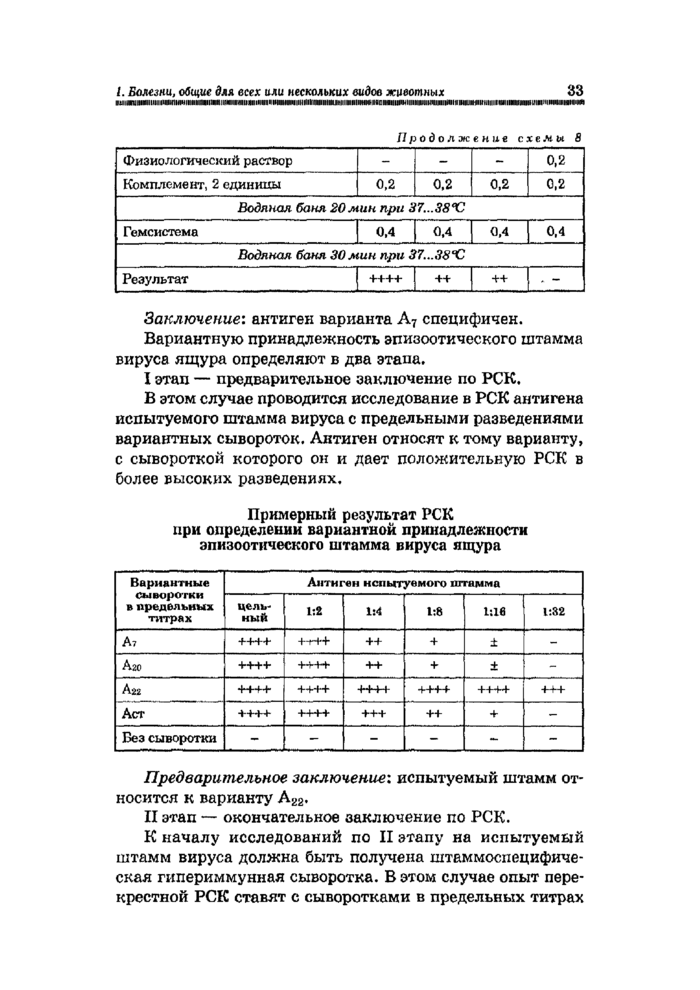
Заключение: антиген варианта А7 специфичен. Вариантную принадлежность эпизоотического штамма вируса ящура определяют в два этапа.
I этап — предварительное заключение по РСК,
В этом случае проводится исследование в РСК антигена испытуемого штамма вируса с предельными разведениями вариантных сывороток. Антиген относят к тому варианту, с сывороткой которого он и дает положительную РСК в более высоких разведениях.
Примерный результат РСК при определении вариантной принадлежности эпизоотического штамма вируса ящура
|
Вариантные сыворотки в предельных титрах |
Антиген испытуемого штамма | |||||
|
цель ный |
1:2 |
1:4 |
1:8 |
1:18 |
1:32 | |
|
Ат |
++++ |
+-Г++ |
++ |
+ |
± |
- |
|
Аго |
++++■ |
t 1 » -1 Т'“ГТМТ |
++ |
+ |
± |
- |
|
Ай2 |
++++ |
++++ |
++++ |
++++ |
++++ |
+++ |
|
Act |
++++ |
++++ |
+++ |
++ |
- | |
|
Без сыворотки |
- |
- |
- |
- |
- |
- |
Предварительное заключение: испытуемый штамм относится к варианту А22.
II этап — окончательное заключение по РСК.
К началу исследований по II этапу на испытуемый штамм вируса должна быть получена штаммоспецифическая гипериммунная сыворотка. В этом случае опыт перекрестной РСК ставят с сыворотками в предельных титрах
34 Лабораторная диагностика вирусных болезней животных
iMiiuiHiiMwiiiiHiiuttiuiiiiiiuiNMiriiiiiMiiiHu«iiiwiiwiiMiiiniiiMuniuiiiiiHiniiiiiiii!iiirNHiiiiiiitiMm(iii|iiiiiMiiMiiMimiiMiiiuiiiiniiMiMiiiimiiiiuiKiiiiiinMi
и с антигенами в удвоенных титрах, Испытуемый антиген относится к тому варианту, с сывороткой которого он будет давать наибольшее (++++) связывание.
Окончательное заключение: испытуемый штамм вируса ящура относится к варианту А22.
* * *
В последнее время при определении антигенного соответствия эпизоотического штамма производственному используют схему постановки РСК, » которой предусматривают перекрестное титрование штаммоспецифических сывороток с гомологичным и гетерологичным антигеном1, В этом случае антигенное родство между штаммами вируса рассчитывают по формуле Архетти и Хорсфала (1950):
В~ 100ф\ч%%
где
средний % задержки гемолиза на каждое
_ разведение сыворотки I к вирусу П_#
Гг средний % задержки гемолиза на каждое* разведение сыворотки I к вирусу I
средний % задержки гемолиза на каждое
_ разведение сыворотки II к вирусу I_
Г% средний % задержки гемолиза на каждое* разведение сыворотки II к вирусу II
Задержку гемолиза в один крест принимают за 25%, в два креста — 50%, в три креста — 75%, в четыре креста — 100%. Антигенное родство (R) более 70% свидетельствует о том, что штаммы по антигенным свойствам идентичны друг другу и относятся к одному и тому же варианту, от 10 до 70% — к различным вариантам (подтипам) и менее 10% — к различным типам.
При постановке РСК по этой схеме используют гипериммунные сыворотки одинаковой активности с титром не ниже 1:40.
Для идентификации вируса с низкой комплементсвязы-вающей активностью, например антигенов из культурального вируса, применяют модифицированную РСК. Сущность
ее в том, что, не изменяя объемов других компонентов, дозу испытуемого антигена увеличивают до 0,4 мл. Сыворотку применяют в удвоенном титре, комплемент — 2 единицы.
Б. Реакция связывания комплемента по 50% -ному гемолизу2
Компоненты реакции.
В реакции используют гемолизин и комплемент био* фабричного производства» эритроциты барана» консервированные в консерванте Мигулиной, гипериммунные сыворотки морских свинок и антигены (афтозный, лапикиэи-рованный или культуральный). В качестве разбавителя используют веронадовый буфер pH 7,3...7,4.
а)Верон а лов ый буфер
Концентрированный раствор вероналового буфера готовят по прописи:
Раствор А
NaCi 83,00 г
Na-б, 5-диэтилбарбитурат 10,19 г
вода дистиллированная 500,0 мл
1 н. HCI 34,58 мл
Раствор Б
MgClr6H20 20,3 г
СаС1г-2Н20 4,4 г
вода дистиллированная 100 мл
К раствору А добавляют 5 мл раствора Б и при тщательном перемешивании доводят дистиллированной водой до 2000 мл.
ЛАБОРАТОРНАЯДИАГНОСТИКА ВИРУСНЫХ БОЛЕЗНЕЙ ЖИВОТНЫХСоставители:
Составители:
П. И. Барышников,
В. В» Разумовская
Издание второе, исправленное
ДОПУЩЕНО
Министерством сельского хозяйства РФ в качестве учебного пособия для студентов вузов, обучающихся по направлению подготовки (специальности) «Ветеринария»
ДОПУЩЕНО
УМО вузов РФ по образованию в области зоотехнии и ветеринарии в качестве учебного пособия для студентов вузов, обучающихся по направлению подготовки (специальности) 3 Ветеринария»
(квалификация (степень) «Ветеринарный врач»)
Лабораторная диагностика вирусных болезней животных
№Ш .......... Ии .................................. ........................
Концентрированный раствор разливают во флаконы» стерилизуют автоклавированием и хранят в холодильнике при температуре +4°С.
Рабочий раствор вероналового буфера готовят по мере надобности перед постановкой реакции путем разбавления одной части концентрированного раствора четырьмя частями дистиллированной воды.
Примерная схема и результат постановки перекрестной РСК для определения вариантной принадлежности эпизоотического штамма вируса ящура
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
б) Эритроциты барана | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Рекомендуется использовать консервированные эритроциты барана не ранее чем через 5 дней после консервирования.
Для приготовления рабочей суспензии смешивают X объем осажденных, отмытых эритроцитов барана и 32,2 объема охлажденного рабочего раствора вероналового буфера; 1 мл полученной суспензии лизируют в 9 мл дистиллированной воды и определяют оптическую плотность (ОП) полученного образца.
При отклонении ОП от желаемой более чем на ±0,02 проводят коррекцию по формуле
ББК 48.7я73 Л 12
Л12 Лабораторная диагностика вирусных болезней животных / Сост, IL И. Барышников, В. В. Разумовская: Учебное пособие. — 2-е изд., испр. — СПб,: Издательство «Лань», 2015,— 672с,: ил, — (Учебники для вузов. Специальная литература).
ISBN 978-5-8114-1882-4
Учебное издание содержит действующие методические указания, наставления и инструкции по лабораторной диагностике ви-русных болезней животных, утвержденные Министерством сельского хозяйства СССР, РФ и Россельхознадзором РФ. Документы систематизированы по видам животных, В большинстве прошли многолетнюю аппробацию в Алтайской краевой ветеринарной лаборатории и включены в «Перечень нормативной документации, разрешенной для использования в государственных ветеринарных лабораториях при диагностике болезней животных, рыб, пчел, а также контроля безопасности сырья животного и растительного происхождения» (по состоянию на июль 2011 г.). Приводятся предметный указатель и библиографический список.
Предназначено для студентов, обучающихся по специальности «Ветеринария» и направлению «Ветеринарно-санитарная экспертиза», ветеринарных врачей и лаборантов ветеринарных лабораторий.
ББК 48.7я73
Рецензенты:
Я, Я. ГУСЛАВСКИЙ — доктор ветеринарных наук, профессор кафедры микробиологии, эпизоотологии, паразитологии и ВСЭ Алтайского государственного аграрного университета;
В. Я. ПЛЕШАКОВА — доктор ветеринарных наук, профессор, зав. кафедрой ветеринарной микробиологии, вирусологии и иммунологии Омского государственного аграрного университета им. П. А. Столыпина;
В. А. СИНИЦЫН — доктор ветеринарных наук, зав. отделом ФГБУ «Новосибирская межрегиональная ветеринарная лаборатория».
Обложка © Издательство «Лань», 2015 Е. А. ВЛАСОВА © Коллектив авторов, 2015 © Издательство «Лань»,
художественное оформление, 2015
Лабораторная диагностика вирусных болезней животных
1.2.
МЕТОДИЧЕСКИЕ УКАЗАНИЯ ПО ВЫДЕЛЕНИЮ И ИДЕНТИФИКАЦИИ ШТАММОВ ВИРУСА ЯЩУРА
(одобрены и рекомендованы 15 октября 1973 гб/н)
I. ВЫДЕЛЕНИЕ ВИРУСА ЯЩУРА
Для выделения вируса из патологического материала необходимо располагать достаточным количеством такого материала, иметь восприимчивых к вирусу ящура сельскохозяйственных или лабораторных животных, а также чувствительные к вирусу культуры клеток; располагать условиями, исключающими возможность выноса вируса за пределы диагностической лаборатории. 4
тозные органы. Для прижизненного обнаружения вируса ящура можно использовать слюну и кровь больных животных. Для исследования на вирусоносительство у животных специальным зондом берут соскоб слизистой оболочки глотки и пищевода.
При отборе патологического материала пользуются стерильным инструментом или посудой. Патологический материал помещают в стерильные флаконы или банки с навинчивающимися колпачками с плотной резиновой прокладкой, в которые до 1/3 объема наливают консервирующую жидкость, состоящую из смеси равных частей химически чистого глицерина и фосфатно-буферного раствора pH 7,4...7,6. На флаконы наклеивают этикетку с наименованием вида патологического материала, даты отбора и адреса хозяйства.
Флаконы или банки с отобранным материалом ставят в металлический непроницаемый контейнер, опечатывают и помещают в термос со льдом. К материалу прилагают сопроводительную записку, в которой указывают дату взятия материала, от какого вида животных и какой материал взят, сообщают подробную эпизоотическую обстановку по ящуру в хозяйстве.
2. Подготовка материала к исследованию.
При доставке в лабораторию стенок афт от больных животных для определения типа и варианта вируса ящура необходимо в максимально короткий срок провести исследование в РСК. С этой целью из афтозного материала готовят антиген по следующей методике. Стенки афт отмывают физиологическим раствором pH 7,4...7,6, высушивают фильтровальной бумагой* взвешивают, измельчают и растирают в фарфоровой ступке с битым нейтральным стеклом до получения однородном массы.
Антигены для РСК готовят в виде 33%-ной суспензии (1:3) путем добавления к полученному весу афтозного материала двойного количества физиологического раствора. Полученную взвесь экстрагируют при комнатной температуре в течение 2 ч и промораживают при температуре -6...-20°С в течение 5... 18ч,
22 Лабораторная диагностика вирусных болезней животных
lilllMIUIIII;lllnillllllllltllllllllNllllllllllilllllllllUilllltllllUIIII(flllMflUIIIJII!llllllHllltllllllllIIIIIIUllllNllllltNllltnill|llillllllIllHVIItUIIHi||IIIUIIIIIIIIII|lllllrtll|illl|IIIII<IIIIUI|lll|itl|l|JI|llIIIIII
После размораживания антиген центрифугируют 10.,. 15 мин при 5000 об/мин. Затем надосадочную жидкость сливают и инактивируют при 58°С в течение 40 мин. После инактивации надосадочную жидкость повторно центрифу-гируют и используют в РСК.
Эффективность выделения вируса из патологического материала повышается при очистке и концентрировании вируссодержащих суспензий. Для этой цели в суспензию используемого материала добавляют фреон-113 в равном количестве к ее объему или хлороформ (10% к объему суспензии). После гомогенизации в течение 15...20 мин и центрифугирования в течение 20 мин проводят концентрирование надосадочной жидкости полиэтиленгликолем с молекулярным весом 6000. К надосадочной жидкости добавляют 7,5% полиэтиленгликоля, встряхивают до растворения и оставляют в холодильнике при температуре 4°С на 2 ч. Затем центрифугируют при 4000...6000 об/мин в течение 20 мин. Надосадочную жидкость удаляют, а образовавшийся осадок разбавляют фосфатным буфером или физиологическим раствором в объеме, в 10...20 раз меньшем, чем исходное количество взятой суспензии. Подготовленный материал используют для испытания на наличие вируса,
3. Выделение вируса.
На основании опыта отечественных и зарубежных исследователей для выделения вируса ящура может быть предложена следующая схема (рис. 1).
Лучшим, хотя и дорогостоящим, методом обнаружения вируса ящура в патологическом материале является биопроба на крупном рогатом скоте. 10%-ную суспензию полученного материала вводят телятам в возрасте 3 мес. и старше, по 0,1 мл в слизистую оболочку языка в нескольких точках. Появление афт на месте введения материала с последующим подтверждением специфичности материала в РСК свидетельствует о наличии вируса ящура. Этот метод применяется в диагностической практике очень редко. Чаще всего для постановки биопроб используют мышат-сосунов 4,,.6-дневного возраста и морских свинок весом не
|
WIK* |
|
Рис. 1 Схема выделения вируса |
менее 500 г. Мышатам-сосунам 10%-ную суспензию испытуемого материала вводят под кожу в дозе 0,2 мл или внут-рибрюшинно в дозе 0,1 мл. Появление парезов и параличей конечностей, а затем гибель мышат с подтверждением специфичности в РСК свидетельствует о наличии вируса ящура в испытуемом материале. Морским свинкам 10%-ную суспензию испытуемого материала вводят методом туннелирования внутрикожно в плантарную поверхность лапок. Появление афт на месте введения материала с последующим подтверждением их специфичности в РСК свидетельствует о наличии вируса ящура.
Высокочувствительным методом выделения вируса является инокуляция культур клеток. В этих целях чаще всего используют однослойную культуру первично-трипсини-зированных клеток почек свиней (СП). 10%-ную суспензию испытуемого материала вносят в 4...6 пробирок с культу-
Лабораторная диагностика вирусных болезней животных
рой клеток. Для этого удаляют питательную среду и добавляют ОД.-.0,2 мл испытуемого материала. Лучше испытуемый материал инокулировать в увеличенных дозах (20 мл) в большие сосуды типа матрасов Повитской емкостью до 5 л. Пробирки или матрасы оставляют в горизонтальном положении около часа для контакта клеток с испытуемым материалом. После этого добавляют питательную среду. Наблюдение за инфицированными культурами клеток ве-дут в течение трех дней. При появлении выраженного ци-топатического действия (++++) культуральную жидкость собирают и сохраняют в замороженном состоянии. Специфическая дегенерация клеток при подтверждении ее специфичности в РСК свидетельствует о наличии вируса ящура в испытуемом материале.
И. МЕТОДЫ ИДЕНТИФИКАЦИИ ВИРУСА
1. Серологические методы
А. Реакция связывания комплемента по 100%-му гемолизу5
Реакция связывания комплемента применяется для определения типов и подтипов (вариантов) вируса ящура, вызвавших заболевание животных, а также для проверки производственных штаммов вируса ящура при изготовлении вакцин и лабораторных штаммов в научно-исследовательской работе.
Компоненты реакции:
а) гемолизин — сыворотка кроликов, гипериммунизи-рованных эритроцитами барана;
б) эритроциты барана — в виде 2% -ной взвеси (из осадка отмытых эритроцитов) на физиологическом растворе;
в) комплемент — свежая или сухая нормальная сыворотка морских свинок;
I. Болезни* общие to всех или нескольких видов животных 2S
rmmiiwmiMMiflimiwuniMMieMiiHiiiiimMiiiMHitiiniqmmttiwiHttniijinfflmminiiiMiinniMiiiniiiiiiiiMiiiiiwiiiiHitiiiiiitiiiii'iHiiiiiiiniiiiWNinwiuii
г) сыворотки морских свинок, гипериммунизированных
стандартными типовыми производственными или эпизоотическими штаммами вируса ящура;
д) антигены контрольные — из эталонов типовых и производственных штаммов вируса ящура, испытуемые — из эпизоотических, производственных или лабораторных штаммов вируса от крупного рогатого скота, овец, свиней, крольчат и животных других видов;
е) физиологический раствор — 0,85%-ный раствор химически чистой поваренной соли на дистиллированной воде,
а) Гемолизин
Для определения титра гемолизина из него готовят серию разведений на физиологическом растворе и затем испытывают его активность в этих разведениях.
Выпускаемый биофабрикой гемолизин консервирован глицерином (1:1), поэтому для приготовления первого разведения 1:100 берут 0,2 мл гемолизина и 9,8 мл физиологического раствора. Затем в отдельной пробирке готовят следующее разведение — 1:1000, для чего к 1 мл гемолизина в разведении 1:100 добавляют 9 мл физиологического раствора. Разведение 1:1000 является основным, из которого готовят все последующие: 1:1600,1:2000,1:3000, 1:4000 и т. д.
|
Схема 1 Приготовление разведений гемолизина | |||||||||||||||||||||
|
Водяная баня 10 мин при температуре 37...38°С, после чего проводят учет реакции.
Титром гемолизина считается наивысшее разведение, дающее полный гемолиз эритроцитов.
1
Указанный метод апробирован в лаборатории ВНЙЯИ и рекомендуется для практического использования в диагностических лабораториях.
2
Методика постановки РСК по 50% -ному гемолизу освоена сотрудниками ВНИЯЙ в Международной справочной лаборатории Пирбрайте, апробирована в лаборатории ВНИЯЙ и рекомендуется для использования в работе научно-исследовательским учреждениям.
3
САНКТ-ПЕТЕРБУРГ • МОСКВА 3 КРАСНОДАР -• 2015•
4
Правила отбора патологического материала.
Для исследования отбирают патологический материал в виде стенок афт от 2...3 больных животных в количестве не менее 5 г. У крупного рогатого скота берут стенки созревших непрорвавшихся афт с языка, у свиней — с «пятачка» или вымени, у мелкого рогатого скота — с беззубого края верхней челюсти, с кожи межкопытной щели или венчика. Афты должны быть свежими, плотной консистенции, не издавать гнилостного запаха.
Материалом для исследования могут служить и лимфатические узлы или костный мозг, реже другие паренхима-
5
Наставление по определению типов и подтипов (вариантов) вируса ящура утверждено Главным управлением ветеринарии МСХ СССР 27 августа 1968 г.